HIBRIDISASI INTERPOPULASI
IKAN LELE AFRIKA
Clarias gariepinus
YANG DIINTRODUKSI DI INDONESIA
ADE SUNARMA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul Hibridisasi Interpopulasi Ikan Lele Afrika yang Diintroduksi di Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2016
Ade Sunarma
RINGKASAN
ADE SUNARMA. Hibridisasi Interpopulasi Ikan Lele Afrika Clarias gariepinus
yang Diintroduksi di Indonesia. Dibimbing oleh ODANG CARMAN, MUHAMMAD ZAIRIN JUNIOR dan ALIMUDDIN.
Indonesia adalah produsen terbesar ikan genus Clarias di dunia dengan produksi hingga 678 000 ton pada tahun 2014. Seluruh produksi ikan Clarias adalah ikan lele Afrika yang diintroduksi ke Indonesia. Saat ini, terdapat lima populasi ikan lele Afrika introduksi, yaitu populasi Taiwan yang diintroduksi tahun 1985 (selanjutnya disebut populasi Sangkuriang), populasi Thailand tahun 2002 dan 2008, populasi Mesir tahun 2005, populasi Kenya tahun 2011 dan populasi Belanda tahun 2011. Tiga tahapan penelitian dirancang untuk mengevaluasi performa genotipe dan fenotipe kelima populasi ikan lele tersebut.
Penelitian pertama bertujuan untuk menentukan status ikan lele Afrika yang diintroduksi ke Indonesia. Karakter genotipe dan fenotipe kelima populasi ikan diuji dengan menggunakan analisis PCR-RFLP DNA mitokondria lokus ND5/6, analisis truss-morfometri pada 10 karakter morfometri dan analisis performa reproduksi pada induk jantan dan betina dan persilangan antar populasi. Hasil penelitian menunjukkan keragaman haplotipe dan jarak genetik pada ikan lele Afrika yang diintroduksi ke Indonesia relatif tinggi, yaitu masing-masing 0.611-0.695 dan 0.118-0.582. Analisis morfometri tidak menunjukkan adanya karakter morfometri yang yang dapat menjadi indikasi adanya persilangan antar populasi ikan lele sebelumnya. Analisis performa reproduksi menunjukkan bahwa karakter reproduksi pada jantan dan betina relatif sebanding dengan populasi ikan lele Afrika di alam. Persilangan antar populasi ikan lele introduksi juga berhasil dilakukan dan mendapatkan tingkat pembuahan dan penetasan telur yang tinggi. Berdasarkan hasil-hasil tersebut, kelima populasi yang digunakan pada penelitian ini dapat dipastikan merupakan spesies ikan lele Afrika C. gariepinus.
Penelitian tahap kedua dilakukan untuk melakukan evaluasi performa ikan hasil persilangan interpopulasi hingga umur 81 hari (tahap pembenihan). Lima populasi ikan lele digunakan untuk membentuk lima populasi galur murni dan 20 populasi persilangan. Hasil penelitian menunjukkan persilangan Mesir betina x Belanda jantan (MB) menunjukkan performa terbaik yaitu laju pertumbuhan (SGR), kelangsungan hidup (SR) dan jumlah ikan over-size (OS) masing-masing 9.69±0.03%, 83.49±6.72% and 0.22±0.04%. Hasil penelitian juga menunjukkan bahwa terdapat korelasi antara OS dengan SR, makin tinggi OS, makin rendah SR. Korelasi ini cenderung makin menurun pada pemeliharaan ikan yang semakin besar. Namun demikian, secara umum, performa SGR, SR dan OS antar silangan relatif rendah atau tidak berbeda.
heterosis positif pada semua karakter yang diamat. Dibandingkan dengan menggunakan populasi galur murni yang terbaik, populasi BT dapat meningkatkan produksi biomassa hingga 36% dan menurunkan konversi pakan hingga 10% dan 202% dan 5.5% bila dibandingkan dengan menggunakan ikan lele populasi Sangkuriang. Dari hasil ini menunjukkan potensi pemanfaatan populasi BT dalam produksi akuakultur
SUMMARY
ADE SUNARMA. Interpopulation Crossbreeding of Introduced African Catfish
Clarias gariepinus in Indonesia. Supervised by ODANG CARMAN,
MUHAMMAD ZAIRIN JUNIOR dan ALIMUDDIN.
Indonesia is the biggest producer of Clarias in the world by production up to 678 000 ton in 2014. Mostly, Clarias production was African catfish that introduced to Indonesia. African catfish was introduced since 1985 from Taiwan (hereinafter as Sangkuriang population) and subsequently in 2002 and 2008 from Thailand, in 2005 from Egypt and 2011 from Kenya and the Netherlands. Three phases of the study was designed to evaluate the performance of genotypic and phenotypic of five populations of introduced African catfish in Indonesia.
The first study was conducted to examine of species status introduced African catfish using PCR−RFLP analysis of mitochondrial DNA ND 5/6 locus, truss-morphometry of 10 morphometric traits, and reproductive performance analysis of both parents and its crosses. The results showed high haplotipe diversity and genetic distance among introduced African catfish. Morphometric analysis showed that there were no differences characters among five populations that can be separated as a distinct species. Reciprocal crosses also resulted high fertilization and hatching rate. Based on the genotype and phenotype, introduced African catfish in Indonesia can be ascertained is the species C. gariepinus.
The second study evaluated growth and survival performances up to 81 days post hatching (nursing stage) of reciprocally interpopulation crossbreeding. Five populations was used to form five purebred and 20 crossbreed population. The results showed the Egypt female x Dutch male (ED) crossbreed showed the best performance with SGR, SR, and OS of 9.69±0.03%, 83.49±6.72% and 0.22±0.04%, respectively. The result also revealed a correlation evidence between the OS and the SR; the higher OS, the lower SR. This correlation tended to be weak at the sequentially nursing stages. However, generally, the performance of SGR, SR and OS among crossbreeds relatively low or no different.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Akuakultur
HIBRIDISASI INTERPOPULASI
IKAN LELE AFRIKA
Clarias gariepinus
YANG DIINTRODUKSI DI INDONESIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji pada Ujian Tertutup: Dr Ir Nurbambang Priyo Utomo, MSi Dr Ir Ratu Siti Aliah, MSc
Judul Disertasi : Hibridisasi Interpopulasi Ikan Lele Afrika Clarias gariepinus
yang Diintroduksi di Indonesia
Nama : Ade Sunarma
NIM : C161110131
Disetujui oleh Komisi Pembimbing
Dr Ir Odang Carman, MSc Ketua
Prof Dr Ir Muhammad Zairin Jr, MSc Anggota
Dr Alimuddin, SPi MSc Anggota
Diketahui oleh
Ketua Program Studi Budidaya Perairan
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian :
Tertutup : 20 Juli 2016 Promosi : 12 Agustus 2016
PRAKATA
Alhamdulillah, penulisan disertasi ini akhirnya selesai. Disertasi ini telah ditulis sebaik yang dapat dilakukan berdasarkan hasil riset yang telah dikerjakan dan didukung dengan literatur yang berhasil dikumpulkan. Mudah-mudahan isi disertasi ini dapat berguna bagi siapapun yang membutuhkan dan bagi pengembangan akuakultur Indonesia.
Banyak orang yang memberikan kontribusi selama studi hingga penulisan disertasi ini yang cukup sulit untuk penulis menyebut setiap peran mereka, namun pasti peran mereka adalah sangat besar. Untuk itu, penulis sangat menghargai dan menyampaikan terima kasih kepada siapapun yang telah memberikan dukungan dan bantuan apapun selama studi dan penelitian. Beberapa pihak memberikan peran yang sangat penting sehingga penulis merasa perlu menyampaikan terima kasih secara khusus, yaitu kepada Bapak Dr Ir Odang Carman MSc, Bapak Prof Dr Ir Muhammad Zairin Junior MSc dan Bapak Dr Alimuddin SPi MSc selaku komisi pembimbing; Bapak Dr Ir Nurbambang Priyo Utomo MSi dan Ibu Dr Ir Ratu Siti Aliah MSc selaku penguji luar komisi; Direktur Jenderal Perikanan Budidaya KKP, Kepala Badan Pengembangan Sumber Daya Manusia KKP dan Kepala BBPBAT Sukabumi yang telah memberikan kesempatan penulis mengambil pendidikan S3 dan segala bantuan fasilitas selama penelitian; Kementerian Riset dan Teknologi yang telah memberikan biaya bagi sebagian penelitian melalui Insentif Riset Sistem Inovasi Nasional; Kedutaan Besar Republik Indonesia di Nairobi, Kenya, yang telah membantu dalam pengadaan ikan lele Afrika populasi Kenya dan Belanda; Mahasiswa S3 Program Studi Akuakultur angkatan 2011 yang telah bersama-sama dengan penulis menempuh pendidikan; Bapak M. Abduh Nurhidajat, Dikdik Koswara, Adi Sucipto, Cucu Muktiana, Gemi Triastutik dan Putri Zulfania atas beragam bantuan yang telah diberikan; dan staf BBPBAT Sukabumi yang telah memberikan bantuan yang sangat memuaskan selama penulis melakukan penelitian. Kelancaran studi dan penelitian juga tidak lepas atas dukungan dan doa dari Ema dan (alm) Abah Haji, istri dan anak-anak, keluarga dan masyarakat di kampung penulis.
Sejak awal, penulis sudah berniat menempuh program doktor sebagai ibadah, belajar dan contoh. Ibadah sebagai seorang mahluk, belajar agar dapat memberi manfaat yang lebih baik bagi manusia, dan sebagai contoh untuk anak-anak penulis. Semoga semua itu dapat tercapai. Aamiin.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL vii
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN viii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 5
Tujuan Penelitian 5
Manfaat Penelitian 6
Hipotesis 6
Kebaruan 6
2 TINJAUAN PUSTAKA 8
Budidaya Ikan Lele Afrika di Indonesia 8
Persilangan Ikan 10
Basis Genetik pada Persilangan 11
3 MENELUSURI STATUS SPESIES IKAN LELE AFRIKA YANG
DIINTRODUKSI DI INDONESIA 13
Abstrak 13
Pendahuluan 13
Bahan dan Metode 15
Hasil 17
Pembahasan 19
Simpulan 24
4 PERSILANGAN INTERPOPULASI BUDIDAYA DAN LIAR IKAN
LELE AFRIKA PADA TAHAP PEMBENIHAN 25
Abstrak 25
Pendahuluan 26
Bahan dan Metode 27
Hasil 28
Pembahasan 30
Simpulan 32
5 PERFORMA DAN HETEROSIS PADA PERSILANGAN
INTERPOPULASI IKAN LELE PADA TAHAP PEMBESARAN 33
Abstrak 33
Pendahuluan 34
Bahan dan Metode 35
Hasil 36
Simpulan 42
6 PEMBAHASAN UMUM 43
Hasil Penelitian 43
Implikasi terhadap Akuakultur Indonesia 45
7 KESIMPULAN UMUM 48
DAFTAR PUSTAKA 49
LAMPIRAN 59
DAFTAR TABEL
1. Perbedaan sejarah introduksi ikan lele Afrika ke Indonesia yang
digunakan pada penelitian 3
2. Produksi budidaya ikan genus Clarias di dunia pada tahun 2014 (FAO
2016) 8
3. Program PCR pada amplifikasi DNA Mitokondria ikan lele 15
4. Prosedur restriksi hasil amplifikasi PCR 15
5. Induk betina dan jantan ikan lele Afrika yang digunakan 16 6. Haplotipe pada ikan lele Afrika dan ikan lele lokal 18 7. Jarak genetik antar lima populasi ikan lele Afrika dan ikan lele lokal
(Nei’s Genetic Distance 1972) berdasarkan marka DNA mitokondria
lokus ND5/6 18
8. Karakter reproduksi induk betina dan jantan serta hasil pemijahannya
pada setiap populasi ikan lele Afrika 20
9. Tingkat pembuahan dan penetasan telur pada persilangan interpopulasi
ikan lele Afrika 21
10. Laju pertumbuhan (SGR), kelangsungan hidup akumulatif (SR), koefisien variasi (CV) dan jumlah ikan over-size (OS) pada persilangan interpopulasi ikan lele Afrika pada tahap pembenihan 29 11. Performa karakter pada persilangan interpopulasi ikan lele Afrika tahap
pembesaran 37
12. Mid-parent heterosis pada hibridisasi interpopulasi ikan lele Afrika tahap
pembesaran 38
13. Best-parent heterosis pada hibridisasi interpopulasi ikan lele Afrika tahap
Pembesaran 39
DAFTAR GAMBAR
1. Alur penelitian hibridisasi interpopulasi ikan lele 6 2. Produksi ikan (di luar rumput laut) nasional dan produksi ikan lele di
Indonesia (diolah dari FAO 2016) 9
3. Pengukuran morfometrik ikan lele 16
4. UPGMA dendrogram berdasarkan jarak genetik lima populasi ikan lele Afrika dan ikan lele lokal berdasarkan marka DNA mitokondria lokus
ND5/6 19
5. Plot komponen utama pada analisis truss-morfometri lima populasi ikan
lele Afrika dan ikan lele lokal 19
6. Program seleksi individu pada pemuliaan genetik ikan lele Afrika yang
DAFTAR LAMPIRAN
1. Elektroforegram hasil amplifikasi produk PCR DNA mitokondria lokus
ND5/6 pada ikan lele 59
2. Elektroforegram produk PCR DNA mitokondria lokus ND5/6, profil penjajaran, haplotipe dan ukuran fragmen berdasarkan hasil restriksi
dengan enzim AluIpada ikan lele 60
3. Elektroforegram produk PCR DNA mitokondria lokus ND5/6, profil penjajaran, haplotipe dan ukuran fragmen berdasarkan hasil restriksi
dengan enzim HaeIIIpada ikan lele 61
4. Elektroforegram produk PCR DNA mitokondria lokus ND5/6, profil penjajaran, haplotipe dan ukuran fragmen berdasarkan hasil restriksi
dengan enzim HhaIpada ikan lele 62
5. Elektroforegram produk PCR DNA mitokondria lokus ND5/6, profil penjajaran, haplotipe dan ukuran fragmen berdasarkan hasil restriksi
dengan enzim HinfIpada ikan lele 63
6. Elektroforegram produk PCR DNA mitokondria lokus ND5/6, profil penjajaran, haplotipe dan ukuran fragmen berdasarkan hasil restriksi
dengan enzim HpaIIpada ikan lele 64
7. Elektroforegram produk PCR DNA mitokondria lokus ND5/6, profil penjajaran, haplotipe dan ukuran fragmen berdasarkan hasil restriksi
dengan enzim PstIpada ikan lele 65
8. Elektroforegram produk PCR DNA mitokondria lokus ND5/6, profil penjajaran, haplotipe dan ukuran fragmen berdasarkan hasil restriksi
1
PENDAHULUAN
Latar Belakang
Akuakultur mempunyai peran penting bagi penyediaan sumber protein hewani. Secara global, produksi akuakultur meningkat hampir dua kali lipat dalam dekade terakhir dengan rata-rata peningkatan 6.1% per tahun, dari 36.8 juta ton pada tahun 2002 menjadi 66.6 juta ton pada tahun 2012 (FAO 2014). Secara nasional, produksi akuakultur Indonesia juga meningkat empat kali lipat, yaitu dari 1.05 juta ton pada tahun 2004 menjadi 4.29 juta ton pada tahun 2014 (FAO 2016). Salah satu komoditas ikan yang memberikan kontribusi tinggi terhadap peningkatan produksi akuakultur Indonesia adalah ikan lele. Produksi ikan lele meningkat dari 56 ribu ton pada tahun 2004 menjadi 678 ribu ton pada tahun 2014 atau setara dengan peningkatan 29% per tahun (FAO 2016).
Namun demikian, perkembangan produksi akuakultur tersebut masih jarang memanfaatkan ikan dari hasil program pemuliaan yang efisien dan sistematik (Gjedrem 2005). Secara global, kontribusi ikan hasil pemuliaan hanya sekitar 1% pada tahun 1993, 5% pada tahun 2002, 8.2% pada tahun 2010 dan 10% pada tahun 2012 (Gjedrem 2012; Gjedrem et al. 2012). Rendahnya kontribusi ikan hasil pemuliaan berkaitan dengan masih terbatasnya jenis ikan yang telah diperbaiki secara genetik. Secara global, hanya sekitar 25 spesies yang sudah/sedang dilakukan upaya perbaikan mutu genetik (Neira 2010; Rye et al. 2010) dari sekitar 540 jenis ikan akuakultur yang diproduksi (FAO 2016). Pada sisi lain, perkembangan produksi yang cepat dapat mengakibatkan terjadinya penurunan mutu genetik ikan yang dibudidayakan akibat penggunaan induk dan benih yang tidak terkontrol, seperti diindikasikan terjadi pada ikan lele di Indonesia. Nurhidayat et al. (2003) telah melaporkan adanya indikasi penurunan pertumbuhan ikan lele akibat tekanan inbreeding. Berdasakan marka mikrosatelit DNA (Deoxyribo Nucleic Acid), Imron et al. (2011) melaporkan adanya penurunan keragaman genetik dan akumulasi inbreeding pada ikan lele.
Dengan kondisi tersebut, perbaikan mutu genetik pada ikan lele telah mendesak untuk dilakukan. Pemanfaatan ikan hasil perbaikan mutu genetik sudah terbukti dapat meningkatkan efisiensi produksi pada ikan salmon, yaitu meningkatkan pertumbuhan hingga 113% dan menurunkan konversi pakan hingga 20% (Gjedrem et al. 2012). Salah satu faktor yang menentukan keberhasilan program perbaikan mutu genetik adalah penggunaan ikan yang memiliki tingkat keragaman genotipe dan fenotipe yang tinggi. Program pemuliaan ikan nila menggunakan delapan populasi dari hasil budidaya di Asia dan populasi alami dari Afrika (Eknath et al. 2007) sedangkan ikan salmon di Norwegia menggunakan empat populasi dasar yang menggunakan material genetik masing-masing berasal dari 8, 13, 18 dan 24 sungai selama empat tahun pengumpulan (Holtsmark et al. 2008). Pemanfaatan populasi campuran budidaya dan alami diharapkan dapat meningkatkan variasi genetik pada populasi dasar yang akan dibentuk karena populasi budidaya biasanya sudah mengalami penurunan mutu genetik (Wachirachaikarn et al. 2009; McKinna et al. 2010).
2
didatangkan pada tahun 1985, terdapat banyak nama lokal untuk ikan lele Afrika, diantaranya: ikan lele Dumbo, Sangkuriang, Sangkuriang2, Paiton, Mesir, Thailand, Masamo, Mutiara, Mandalika dan Burma. Diantara beragam nama tersebut, sebagian merupakan hasil introduksi langsung dan sebagian lainnya merupakan hasil perbaikan genetik yang telah dirilis oleh Pemerintah. Secara umum, introduksi ikan lele Afrika di Indonesia dapat diklasifikasikan berdasarkan asal negara, yaitu populasi Taiwan (selanjutnya disebut populasi Sangkuriang), Thailand, Mesir, Kenya dan Belanda (Tabel 1).
Populasi Sangkuriang merupakan hasil perbaikan mutu genetik yang telah dilakukan di Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi tahun 2000-2004 yang telah dirilis oleh Menteri Kelautan dan Perikanan Republik Indonesia. Perbaikan mutu tersebut menggunakan teknik silang-balik ikan lele Afrika populasi Taiwan yang diintroduksi tahun 1985, secara lokal dikenal dengan nama lele dumbo, antara keturunan kedua (F2) dengan keturunan di atas generasi keenam (>F6) (Sunarma et al. 2005). Populasi Thailand merupakan hasil introduksi dari Thailand oleh perusahaan swasta sekitar tahun 2002 dan 2008, populasi Mesir diintroduksi sekitar tahun 2007 oleh Dinas Kelautan dan Perikanan, Pemerintah Provinsi Jawa Barat, populasi Belanda diintroduksi dan dikembangkan di Universitas Brawijaya pada tahun 1985 dan introduksi oleh BBPBAT Sukabumi pada tahun 2011, dan populasi Kenya merupakan populasi yang diintroduksi tahun 2011 oleh BBPBAT Sukabumi atas hasil pertukaran dengan ikan lele Sangkuriang dari Pemerintah Kenya. Populasi Sangkuriang, Thailand dan Belanda merupakan tipe budidaya, yaitu populasi yang sudah lama berkembang biak pada kegiatan budidaya. Populasi Mesir dan Kenya merupakan tipe liar, yaitu populasi yang berasal dari tangkapan langsung dari alam atau populasi yang belum dibudidayakan secara intensif.
Salah satu program pemuliaan yang dapat dilakukan dengan ketersediaan beragam jenis populasi ikan lele tersebut adalah hibridisasi. Program pemuliaan ikan dengan metode hibridisasi berpotensi dapat menghasilkan benih hibrida unggul dalam waktu yang relatif lebih singkat, yaitu satu generasi, dibandingkan dengan metode lain, misalnya seleksi yang memerlukan lebih dari tiga generasi. Secara umum, hibridisasi dilakukan untuk mendapatkan keturunan yang memiliki performa yang lebih baik dibandingkan dengan tetuanya (hybrid vigor atau heterosis) (Tave 1986; Bartley et al. 2001). Hibridisasi juga dilakukan untuk penggabungan karakter yang dikehendaki dari populasi/spesies berbeda ke dalam suatu populasi/spesies tunggal, produksi ikan steril, produksi ikan kelamin tunggal dan peningkatan kemampuan adaptasi terhadap lingkungan budidaya (Bartley et al. 2001; Chen 2010). Hibridisasi dapat terjadi baik di dalam satu jenis ikan yang sama tetapi berbeda populasi (interpopulation crossbreeding) atau antar genus/famili yang berbeda (interspecific hybridization) (Hulata, 2001). Baik secara alamiah ataupun akibat campur tangan manusia, hibridisasi diperkirakan terjadi pada sekitar 25% spesies tanaman dan 10% spesies hewan (Mallet 2005).
3
et al. 2010), silver perch Bidyanus bidyanus (Guy et al. 2009), brook trout Salvelinus fontinalis (Granier et al. 2011), rasio bobot daging terhadap bobot tubuh pada hibrida antara ikan channel catfish Ictalurus punctatus dengan ikan blue catfish I. furcatus (Argue et al. 2003), dan kelangsungan hidup larva ikan gupi
Poecilia reticulata (Shikano & Taniguchi 2002). Namun demikian, heterosis tidak selalu didapatkan pada proses hibridisasi, misalnya pada pertumbuhan, kelangsungan hidup dan indeks fagositosis hibridisasi antar populasi ikan lele Afrika di Thailand (Wachirachaikarn et al. 2009). Munculnya heterosis pada hibridisasi, diantaranya bergantung pada variasi genetik di dalam populasi tetuanya atau heterosigositas dan jarak genetik antar tetua yang digunakan (Fjalestad 2005; Goyard et al. 2008).
Upaya peningkatan heterosigositas dan jarak genetik antar populasi dapat dilakukan dengan introduksi kembali ikan lele dari habitat alaminya ke sistem budidaya (Schönhuth et al. 2003; Wachirachaikarn et al. 2009). Meskipun variasi genetik pada level molekuler belum menjamin adanya variasi pada karakter fenotipe kuantitatif (Reed & Frankham 2001; Overturf et al. 2003; Borrel et al. 2004; Wachirachaikarn et al. 2009), tetapi variasi genetik yang tinggi dapat menjadi basis bagi program pemuliaan dalam jangka panjang. Pada ikan rainbow trout
Tabel 1 Perbedaan sejarah introduksi ikan lele Afrika ke Indonesia yang digunakan pada penelitian
Populasi Asal Negara dan Waktu Introduksi
Sejarah Domestikasi
Sangkuriang Taiwan, 1985 Populasi ini diintroduksi dan dibudidayakan di Taiwan sejak tahun 1975 (Huang et al. 2005). Di Indonesia, produksi massal telah dimulai sejak 30 tahun lalu dan sudah dilakukan silang-balik inter-generasi pada tahun 2000
Mesir Mesir, 2005 Sejarah domestikasi populasi ini di Mesir tidak ditemukan. Produksi ikan lele di Mesir telah dilaporkan sejak tahun 1996 dan baru meningkat secara nyata pada tahun 2005 (El-Naggar 2008).
Kenya Kenya, 2011 Ditangkap secara langsung dari habitat alaminya dan dikarakterisasi sebagai populasi liar
Belanda Belanda, 2011 Populasi ini diintroduksi ke Belanda dari Afrika Selatan tahun 1974 (Holcik 1991) dan sudah dilakukan seleksi massal untuk pertumbuhan (Fleuren 2008).
Thailand Thailand, 2002 Populasi ini berasal dari populasi yang diintroduksi ke Vietnam dari Afrika Tengah pada tahun 1974 (Na-Nakorn & Brummett 2009). Diintroduksi ke Thailand pada tahun 1987 dan sudah memberikan kontribusi nyata terhadap produksi akuakultur (Wachirachaikarn
4
Onchorhynchus mykiss, heterosigositas pada lokus alozim berhubungan dengan karakter fenotipe yang terkait dengan ketahanan tubuh (Thelen & Allendorf 2001). Persilangan pada ikan/udang yang memiliki jarak genetik yang tinggi dapat menghasilkan perbaikan performa, baik ketahanan tubuh atau kebugaran (fitness) seperti pada ikan gupi (Shikano & Taniguchi 2002) maupun pertumbuhan seperti pada udang biru Pasifik (Goyard et al. 2008).
Pada ikan lele Afrika di Indonesia, informasi variasi genotipe setiap populasi belum tersedia. Selain itu, masih terdapat perbedaan pendapat mengenai status spesies ikan lele Afrika. Ada pendapat yang menyatakan sebagai ikan hibrida interspesies, tapi sebagian lainnya menyatakan sebagai spesies Clarias gariepinus. Perbedaan tersebut diakibatkan tidak adanya dokumentasi yang memadai ketika ikan ini diintroduksi. Analisis variasi genotipe dan penelusuran asal-usul ikan lele dapat dilakukan dengan memanfaatkan marka DNA mitokondria. Selain itu, penelusuran status spesies/hibrida juga dapat dilakukan dengan analisis truss-morfometri dan analisis performa reproduksi.
DNA mitokondria diturunkan secara maternal sehingga bersifat non-mendelian (Liu 2009). Marka DNA mitokondria banyak digunakan pada analisis genetika populasi karena genom mitokondria berubah lebih cepat dibandingkan dengan genom inti sehingga menyebabkan polimorfik yang tinggi (Liu 2009). Berdasarkan analisis lokus ND5/6 (NADH (nicotinamide adenine dinucleotide)
dehydrogenase 5/6) DNA mitokondria dengan menggunakan PCR-RPLP
(polymerase chain reaction - restriction fragment length polymorphism), struktur populasi ikan lele C. gariepinus di Afrika dapat dipisahkan menjadi tiga grup filogenetik, yaitu grup Afrika bagian Timur, bagian Utara dan bagian zona kontak antara Timur dengan Tengah-Selatan, meskipun ketiga populasi tersebut memiliki kesamaan morfologi (Giddelo et al. 2002). Dengan analisis DNA mitokondria juga dapat dibedakan antara ikan lele yang dibudidayakan di Afrika Selatan yang berasal dari Belanda dengan ikan lele yang secara asli terdapat di perairan negara tersebut (Roodt-Wilding et al. 2010). Lokus ND 5/6 berhasil memisahkan populasi ikan salmon (Cronin et al. 1993), ikan nila (Rognon & Guyomard 1997; Li et al. 2002), ikan mas (Gross et al. 2002; Zhou et al. 2003), dan ikan lele (Giddelo et al. 2002; Mohindra et al. 2007). Analisis truss-morfometri sudah berhasil memisahkan beragam ikan lele di Afrika (Teugel 1986; Agnese et al. 1997) dan Asia (Ng 1999; Sudarto 2002). Performa reproduksi dapat digunakan untuk identifikasi ikan hibrida karena persilangan antar spesies bisa menghasilkan ikan hibrida yang fertil atau yang steril (Wu et al. 1990; Lenormand et al. 1998; Senanan et al. 2004).
Selain informasi karakter genotipe, Nguyen & Ponzoni (2008) menyarankan perlu didapatkannya karakter fenotipe unggul dari setiap stok yang ada pada tahap awal program pemuliaan ikan. Pada banyak spesies, karakter fenotipe yang dipilih adalah pertumbuhan, misalnya pada ikan nila (Eknath et al. 2007), ikan salmon (Gjedrem 2010) dan Cherax destructor (Jerry et al. 2005). Pada ikan lele Afrika di Indonesia, karakter pertumbuhan juga menjadi pilihan utama pada perbaikan mutu genetik.
5 menginformasikan persilangan terbaik di antara kelima populasi yang dapat dimanfaatkan untuk usaha budidaya ikan lele Afrika.
Perumusan Masalah
Data FAO (2016) menunjukkan bahwa Indonesia merupakan produsen terbesar ikan lele di dunia dengan kontribusi sekitar 58%. Dalam lima tahun terakhir, peningkatan rata-rata produksi ikan lele hampir mencapai 40% per tahun (KKP 2013). Laju peningkatan produksi yang tinggi tersebut telah menyebabkan terjadi penurunan mutu genetik akibat adanya akumulasi inbreeding dan penurunan keragaman genetik (Nurhidayat et al. 2003; Imron et al. 2011). Namun demikian, sejauh ini, perbaikan mutu genetik ikan lele, baik di tingkat nasional maupun internasional, belum menghasilkan populasi yang unggul seperti halnya pada ikan nila dan udang vaname. Secara global, riset yang terkait dengan program pemuliaan ikan lele dilakukan melalui teknik ginogenesis dan androgenesis (Bongers et al. 1995; Galbusera et al. 2000), hibridisasi inter-generik (Senanan et al. 2004), seleksi (Rezk 2008), dan persilangan intra-spesies (Wachirachaikarn et al. 2009). Di Indonesia, berdasarkan Surat Keputusan Menteri Kelautan dan Perikanan, telah dilepas sebanyak empat populasi ikan lele hasil pemuliaan, yaitu ikan lele Sangkuriang, benih hibrida ikan lele Sangkuriang2, ikan lele Mutiara dan benih hibrida ikan lele Mandalika.
Upaya lebih lanjut perbaikan mutu genetik pada ikan lele Afrika di Indonesia dapat dilakukan dengan memanfaatkan beragam populasi yang ada dengan memanfaatkan populasi yang sudah dibudidayakan dan populasi yang baru didomestikasi dari alam. Saat ini, koleksi ikan lele Afrika di BBPBAT Sukabumi meliputi lima populasi, yaitu: populasi Sangkuriang, populasi Thailand, populasi Belanda, populasi Mesir dan populasi Kenya. Tiga populasi pertama berasal dari sistem budidaya (tipe kultur) sedangkan dua populasi yang terakhir merupakan tipe liar yang berasal dari habitat alaminya. Semua populasi tipe kultur diduga berasal dari populasi yang terpisah yang sudah mengalami adaptasi pada lingkungan yang berbeda sedangkan populasi Mesir dan Kenya masih pada proses adaptasi terhadap lingkungan budidaya.
Untuk kepentingan tersebut, karakterisasi genotipe, baik untuk kepentingan penelusuran status spesies maupun untuk mendapatkan variabilitas genetik pada kelima populasi yang ada perlu dilakukan. Potensi budidaya pada kelima populasi diperlukan dengan melakukan hibridisasi di antara populasi tersebut. Dengan pendekatan secara genotipe maupun fenotipe tersebut diharapkan dapat dihasilkan hibrida unggul yang dapat dimanfaatkan pada proses produksi budidaya ikan lele sehingga produksi perikanan budidaya dapat meningkat (Gambar 1).
Tujuan Penelitian
6
1. Menentukan kekerabatan dan status spesies ikan lele yang diintroduksi di Indonesia,
2. Menghasilkan ikan hibrida yang memiliki karakter unggul,
3. Menghasilkan informasi dan material dasar untuk proses seleksi selanjutnya.
Manfaat Penelitian
Hibrida unggul ikan lele yang berasal dari hasil persilangan pada penelitian ini akan memberikan manfaat bagi peningkatan produksi ikan lele secara nasional. Kejelasan status spesies dan material dasar ikan lele akan memberikan manfaat bagi penentuan teknik pemuliaan yang akan diterapkan.
Hipotesis
Hipotesis pada penelitian ini adalah:
1. Ikan lele Afrika yang diintroduksi ke Indonesia merupakan spesies C. gariepinus dan bukan merupakan ikan hibrida hasil persilangan interspesies, 2. Persilangan interpopulasi ikan lele Afrika akan menghasilkan hibrida unggul yang dicirikan dengan pertumbuhan, kelangsungan hidup, biomassa dan konversi pakan yang lebih baik dibandingkan ikan lele yang saat ini digunakan di masyarakat.
Kebaruan
Berdasarkan penelusuran literatur, penelitian mengenai persilangan ikan lele Afrika dengan memanfaatkan sumber genetik yang beragam belum pernah dilakukan/dipublikasikan sehingga penelitian ini merupakan yang pertama
7 dilakukan di Indonesia. Kebaruan yang berhasil diperoleh pada penelitian ini adalah:
1. Pendekatan fenotipe dan genotipe berhasil membuktikan bahwa ikan lele yang diintroduksi di Indonesia adalah spesies Clarias gariepinus
2. Persilangan interpopulasi ikan lele introduksi telah menghasilkan populasi hibrida unggul yang dapat meningkatkan biomassa hingga 200% dibandingkan dengan penggunaan ikan lele yang banyak beredar di masyarakat saat ini,
3. Persilangan interpopulasi pada ikan lele merupakan metode yang dapat memperbaiki mutu genetik secara cepat (1 generasi).
2
TINJAUAN PUSTAKA
Budidaya Ikan Lele Afrika di Indonesia
Genus Clarias tersebar secara luas di benua Asia dan Afrika. Genus ini terdiri atas 61 spesies (Fishbase 2016), beberapa sudah dibudidayakan, diantaranya: C. anguillaris (Sanda et al. 2015), C. batrachus (Senanan et al. 2004), C. fuscus
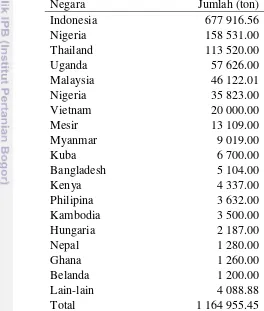
(Huang et al. 2005), C. gariepinus (Ponzoni & Nguyen 2008) dan C. macrocephalus (Senanan et al. 2004). Hingga tahun 2014, budidaya genus Clarias, termasuk hibrida interspesies, sudah dilakukan di 54 negara dengan produksi mencapai 1.16 juta ton dengan nilai $ 2327 juta (FAO 2016) (Tabel 2). Di antara genus Clarias, lele Afrika merupakan spesies yang paling banyak disebarkan ke luar Afrika dan sudah mengalami domestikasi yang sangat panjang. Ikan lele Afrika,
diantaranya diintroduksi ke Belanda dari Afrika Selatan pada tahun 1974 (Holcik 1991), ke Vietnam dari Afrika Tengah pada tahun 1974 (Na-Nakorn & Brummett 2009) dan ke Taiwan pada tahun 1975 (Huang et al. 2005).
Ikan lele Afrika diintroduksi ke Indonesia pertama kali pada tahun 1985 dari Taiwan. Seiring dengan perkembangan budidayanya, introduksi kemudian dilakukan kembali, baik untuk digunakan pada kegiatan produksi budidaya secara langsung maupun untuk tujuan perbaikan mutu genetik, yaitu berturut-turut pada
Tabel 2 Produksi budidaya ikan genus Clarias di dunia pada tahun 2014 (FAO 2016)
Negara Jumlah (ton)
Indonesia 677 916.56
Nigeria 158 531.00
Thailand 113 520.00
Uganda 57 626.00
Malaysia 46 122.01
Nigeria 35 823.00
Vietnam 20 000.00
Mesir 13 109.00
Myanmar 9 019.00
Kuba 6 700.00
Bangladesh 5 104.00
Kenya 4 337.00
Philipina 3 632.00
Kambodia 3 500.00
Hungaria 2 187.00
Nepal 1 280.00
Ghana 1 260.00
Belanda 1 200.00
Lain-lain 4 088.88
9 tahun 2002 dan tahun 2008 dari Thailand, tahun 2005 dari Mesir dan tahun 2011 dari Kenya dan Belanda.
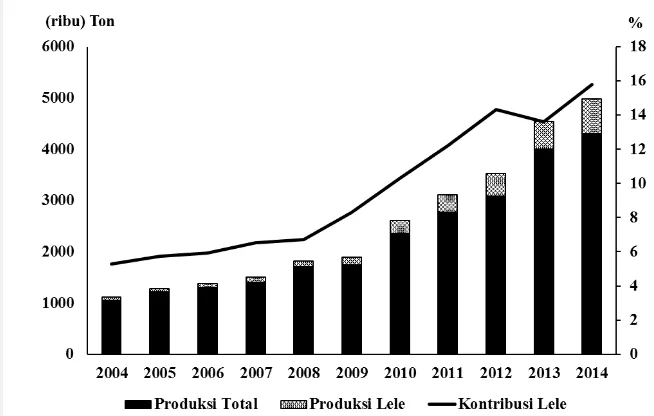
Budidaya ikan lele Afrika di Indonesia mengalami perkembangan pesat terutama sejak tahun 2000-an. Produksi ikan lele meningkat dari 56000 ton pada tahun 2004 menjadi 678000 ton pada tahun 2014 dengan peningkatan rata-rata 29% per tahun dibanding dengan produksi ikan total (di luar rumput laut) sebesar 15% per tahun. Kontribusi produksi ikan lele terhadap produksi ikan nasional (di luar rumput laut) meningkat dari 5.3% pada tahun 2004 menjadi 15.8% pada tahun 2014 (FAO 2016) (Gambar 2).
Peningkatan produksi ikan lele Afrika ini didukung oleh perkembangan sistem budidaya yang digunakan di Indonesia. Berbeda dengan kebanyakan budidaya ikan lele di negara lain yang menggunakan sistem budidaya berteknologi tinggi, misalnya di Belanda yang menggunakan teknik pemijahan dengan cara
buatan dan pemeliharaan ikan di dalam sistem resirkulasi di dalam ruangan tertutup (Fleuren 2008), budidaya lele di Indonesia kebanyakan menggunakan teknik pemijahan alami dan produksi benih dan ikan konsumsi menggunakan wadah plastik di luar ruangan (Sunarma et al. 2013). Dengan teknik budidaya seperti itu, biaya investasi untuk produksi ikan lele menjadi jauh lebih murah sehingga dapat diterapkan pada skala rumah tangga.
Sejalan dengan peningkatan produksi tersebut, upaya perbaikan mutu induk ikan lele juga sudah dilakukan. Pada tahun 2004, Balai Besar Perikanan Budidaya Air Tawar Sukabumi, sebuah lembaga pemerintah di bawah Kementerian Kelautan dan Perikanan, telah mengeluarkan dan menyebarkan induk ikan lele Sangkuriang. Ikan lele Sangkuriang merupakan hasil perbaikan mutu genetik melalui penerapan teknik silang-balik ikan lele Afrika yang diintroduksi tahun 1985 antara generasi kedua dengan generasi keenam (Sunarma et al. 2005). Perbaikan mutu genetik kemudian dilanjutkan dengan mengeluarkan ikan lele Sangkuriang2 pada tahun 2013. Penggunaan ikan lele Sangkuriang di masyarakat sudah turut memberikan peningkatan produksi ikan lele nasional. Kontribusi lele Sangkuriang terhadap
10
produksi ikan lele nasional meningkat dari 2.5% pada tahun 2006 menjadi sekitar 30% pada tahun 2014. Selain ikan lele Sangkuriang, di masyarakat sudah pula beredar ikan lele hasil perbaikan mutu genetik, diantaranya adalah ikan lele Mutiara yang dikeluarkan oleh Balai Penelitian dan Pemuliaan Ikan Sukamandi pada tahun 2015.
Persilangan Ikan
Persilangan (crossbreeding/hybridization) dapat terjadi antar populasi/subpopulasi dalam satu spesies yang sama (interpopulation crossbreeding) atau antar genus/famili yang berbeda (interspecific hybridization). Hibridisasi dapat terjadi baik akibat campur tangan manusia ataupun secara alamiah. Mallet (2005) memperkirakan hibridisasi telah terjadi setidaknya pada sekitar 25% spesies tanaman dan 10% spesies hewan. Hibridisasi ikan, baik untuk kepentingan akuakultur ataupun hanya untuk menguji performa persilangan, telah dilakukan setidaknya pada 35 persilangan spesies dalam 17 famili (Bartley et al. 2001). Untuk kepentingan akuakultur, hibridisasi merupakan salah satu cara perbaikan mutu genetik yang dapat menghasilkan ikan unggul dalam waktu yang singkat melalui peningkatan heterosigositas dan eksploitasi variasi genetik dominan (Guy et al.
2009). Hibridisasi dilakukan untuk penggabungan karakter yang dikehendaki dari populasi/spesies berbeda ke dalam suatu populasi/spesies tunggal dengan tujuan untuk mendapatkan keturunan yang memiliki performa yang lebih baik dibandingkan dengan tetuanya (hybrid vigor atau heterosis), baik laju pertumbuhan, ketahanan terhadap penyakit, produksi ikan steril, produksi ikan kelamin tunggal dan peningkatan kemampuan adaptasi terhadap lingkungan budidaya (Bartley et al.
2001; Hulata 2001; Vandeputte et al. 2014). Menurut Falconer & Mackay (1996), ekspresi heterosis pada persilangan dua populasi, sebagian, akan bergantung pada perbedaan frekuensi gen dan interaksi gen di antara populasi tersebut, termasuk pengaruh dominan dan epistasis. Namun demikian, munculnya heterosis pada persilangan sulit diprediksi dan dapat bergantung pada tahap perkembangan ikan (Granier et al. 2011).
Pemanfaatan heterosis dari hasil hibridisasi yang dilakukan secara sengaja untuk kepentingan akuakultur telah banyak dilakukan. Heterosis dilaporkan didapatkan pada beberapa jenis ikan, di antaranya: pertumbuhan ikan nila
Oreochromis niloticus (Bentsen et al. 1998; Nguyen et al. 2009), rohu Labeo rohita
(Gjerde et al. 2002), ikan mas Cyprinus carpio (Vandeputte 2003; Nielsen et al. 2010), udang biru Pasifik Penaeus stylirostris (Goyard et al. 2008), udang galah
Macrobrachium rosenbergii (Thanh et al. 2010), silver perch Bidyanus bidyanus
(Guy et al. 2009), brook troutSalvelinus fontinalis (Granier et al. 2011), rasio bobot daging terhadap bobot tubuh pada hibrida antara ikan channel catfish Ictalurus punctatus dengan ikan blue catfish I. furcatus (Argue et al. 2003), dan kelangsungan hidup larva ikan gupi Poecilia reticulata (Shikano & Taniguchi 2002). Namun demikian, heterosis tidak selalu didapatkan pada proses hibridisasi, misalnya pada pertumbuhan, kelangsungan hidup dan indeks fagositosis hibridisasi antar populasi ikan lele Afrika di Thailand (Wachirachaikarn et al. 2009).
11 jantan atau sebaliknya (Granier et al. 2011), asal induk yang digunakan dengan introduksi material genetik baru/liar (Bryden et al. 2004) atau variasi genetik di dalam populasi tetuanya atau heterosigositas dan jarak genetik antar tetua yang digunakan (Goyard et al. 2008).
Pada beberapa persilangan ikan, perbedaan skema pemijahan, yaitu satu populasi berperan sebagai jantan atau sebagai betina (efek resiprok), dapat menghasilkan performa yang berbeda, seperti yang ditemukan pada persilangan ikan Chinook salmon (Bryden et al. 2004), ikan nila (Bentsen et al. 1998; Lutz et al. 2010), brook trout (Granier et al. 2011; Crespel et al. 2012) dan persilangan blunt snout bream (Luo et al. 2014). Efek resiprok ini mungkin berkaitan dengan pengaruh maternal atau paternal, penurunan sitoplasmik dan keterkaitan genetik antara gen seks dengan gen performa (Bentsen et al. 1998; Crespel et al. 2012).
Persilangan antar populasi liar dengan populasi budidaya tidak selalu menghasilkan performa yang lebih baik. Pada ikan tilapia, persilangan antar populasi liar (betina Kenya x jantan Mesir) telah menghasilkan bobot tubuh lebih tinggi dibandingkan dengan populasi murninya dan persilangan antar populasi liar dengan populasi budidaya (Bentsen et al. 1998), sedangkan pada udang galah M. rosenbergii, persilangan populasi budidaya dengan populasi liar menghasilkan bobot tubuh yang lebih tinggi dibandingkan dengan kedua tetuanya (Thanh et al.
2009). Hasil berbeda ditunjukkan pada ikan brook trout S. fontinalis yang menunjukkan populasi budidaya menghasilkan bobot yang lebih tinggi dibandingkan persilangan populasi budidaya dengan populasi liar (Granier et al.
2011) dan pada ikan Atlantik salmon Salmo salar yang menunjukkan bahwa performa ikan hasil persilangan berada di antara performa ikan populasi budidaya dan populasi liar (Glover et al. 2009).
Dengan beragam fakta tersebut di atas, dapat diketahui bahwa persilangan, baik antar populasi dalam satu spesies ataupun antar spesies, belum tentu menghasilkan performa hibrida yang diinginkan. Karena itu, Hulata (2001) menyebutkan bahwa identifikasi secara eksperimental penting dilakukan untuk menentukan kombinasi persilangan spesifik.
Basis Genetik pada Persilangan
Heterosis pada tingkat populasi muncul karena adanya hubungan antara fitness populasi dengan heterosigositas pada populasi tersebut secara keseluruhan (Lippman & Zamir 2006). Interaksi gen antara dua populasi homozigot membentuk suatu hibrida heterosigot yang memiliki performa lebih baik dari kedua tetuanya. Secara umum, hipotesis interaksi gen pada suatu persilangan dapat berupa dominan atau overdominan (Hochholdinger & Hoecker 2007; Chen 2010). Interaksi dominan terjadi ketika terdapat aksi saling melengkapi (complementary) alel dominan superior dari kedua populasi inbreed induknya pada multi-lokus yang melebihi alel yang tidak dikehendaki sehingga memunculkan perbaikan performa pada hibridanya (AAaa x bbBB menghasilkan AABB). Interaksi overdominan terjadi ketika interaksi alel pada satu atau multi-lokus sehingga menghasilkan
hibrida yang superior dibanding kedua induknya (A’A’BB x AAB’B’
menghasilkan AA’BB’). Teori heterosis berdasarkan interaksi gen memberikan
12
sehingga heterosis muncul. Interaksi gen juga menyebabkan terjadinya peningkatan keragaman genetik yang akan menyebabkan meningkatnya fitness pada hibridanya. Bagaimanapun, interaksi gen pada hibridisasi melibatkan banyak gen yang memberikan kontribusi dan banyak gen yang belum dapat diidentifikasi hubungannya dengan sifat fenotipe yang muncul pada hibridanya. Dengan dasar itu, sebagian ahli ada yang berpendapat bahwa kemunculan heterosis lebih karena adanya peningkatan keragaman genetik semata (Lippman & Zamir 2006). Pada sisi lain, selain bisa memunculkan heterosis (yang bersifat positif), interaksi gen juga bisa menimbulkan tekanan outbreeding yang menyebabkan hibrida kehilangan fitness. Karena itu, sulit untuk memformulasikan dasar genetik pada kemunculan heterosis (Birchler et al. 2006).
Beberapa studi menunjukkan bahwa variasi genetik pada level molekuler belum menjamin adanya variasi pada karakter fenotipe quantitatif (review oleh Reed & Frankham 2001; Overturf et al. 2003; Borrel et al. 2004; Wachirachaikarn
3
MENELUSURI STATUS SPESIES IKAN LELE AFRIKA
YANG DIINTRODUKSI DI INDONESIA
Abstrak
Hingga saat ini, status spesies ikan lele Afrika yang diintroduksi ke Indonesia masih diperdebatkan, yaitu sebagai ikan hibrida antar spesies atau spesies C. gariepinus. Penelitian ini bertujuan untuk menguji keragaman genetik dan status spesies dua populasi liar dan tiga populasi budidaya ikan lele Afrika dengan menggunakan analisis marka DNA mitokondria, analisis truss-morfometri dan analisis performa reproduksi. Hasil penelitian menunjukkan bahwa keragaman dan jarak genetik pada ikan lele Afrika yang diintroduksi ke Indonesia, relatif tinggi dan sebanding dengan lele Afrika di habitat aslinya. Hasil penelitian juga menunjukkan tidak terdapat perbedaan karakter di antara lima populasi tersebut yang dapat dipisahkan sebagai spesies berbeda. Persilangan antar lima populasi tersebut juga menghasilkan tingkat pembuahan dan penetasan telur yang tinggi. Dari hasil penelitian ini dapat disimpulkan bahwa kelima populasi ikan lele Afrika yang diintroduksi ke Indonesia merupakan spesies C. gariepinus.
Kata Kunci: Lele Afrika, DNA mitokondria, truss-morfometri, performa reproduksi
Tracing of Species Status of Introduced African Catfish in Indonesia.
Abstract – There are two arguments about species status of introduced African catfish in Indonesia, i.e. as interspecific hybrid or as purebreed C. gariepinus. Our research was conducted to examine of genetic diversity and species status of two wild populations and three farm populations of introduced African catfish using mitochondria DNA marker, truss-morphometry and reproductive performance analysis. Our current research showed the genetic diversity and distance of African catfish were introduced to Indonesia, is relatively high and comparable to African catfish in their natural habitat. Our result also showed no different characters among five populations that can be used to separate as different species. All reciprocal crosses among populations obtained high fertilization and hatching rate. Our research proven that five introduced African catfish populations, as representatively
Clarias production in Indonesia, as C. gariepinus.
Keywords: African catfish, mitochondrial DNA, truss-morphometry, reproductive performance
Pendahuluan
14
menjual atau penamaan oleh masyarakat. Mengingat wilayah perairan tawar Indonesia merupakan habitat ikan lele liar (setidaknya terdapat 15 spesies ikan lele (Fishbase 2016), dengan merujuk tempat asalnya dari Afrika, maka ikan lele introduksi ini untuk selanjutnya disini disebut sebagai ikan lele Afrika.
Di dalam negeri, masih terdapat dua pendapat mengenai klasifikasi ikan lele Afrika tersebut, yaitu: pendapat pertama meyakini bahwa ikan tersebut merupakan hasil hibrida antara C. gariepinus dengan C. fuscus (atau sebaliknya), sementara pendapat lainnya menyebutkan bahwa ikan lele Afrika adalah spesies C. gariepinus
(Iswanto 2013). Perbedaan ini terutama akibat tidak adanya bukti tertulis ketika ikan tersebut diintroduksi pada tahun 1985 dari Taiwan (beberapa sumber menyatakan introduksi pada tahun 1984 dan 1985 (Iswanto 2013)). Diantara alasan ikan ini diyakini sebagai ikan lele hibrid karena memiliki kesesuaian ciri-ciri yang termasuk kepada C. gariepinus dan C. fuscus (Prof. Komar Sumantadinata, 2012, komunikasi pribadi).
Selain dari Taiwan, ikan lele Afrika juga telah diintroduksi dari Belanda pada tahun 1985 (Na-Nakorn & Brummett 2009). Setelah itu, beberapa introduksi juga telah dilakukan secara berturut-turut, yaitu dari Thailand pada tahun 2002 dan 2008, dari Mesir tahun 2007, dari Kenya tahun 2011 dan dari Belanda tahun 2011 (untuk selanjutnya, introduksi ikan lele Afrika tersebut disebut sebagai populasi menurut asal introduksinya). Populasi Belanda 1985 dan 2011 diyakini sebagai ikan lele C. gariepinus berdasarkan sejarah domestikasi lele di Belanda (Holcik 1991). Populasi Thailand dimungkinkan merupakan species C. gariepinus atau hasil persilangan C. macrocephalus dengan C. gariepinus (Senanan et al. 2004). Populasi Mesir dan Kenya diidentifikasi sebagai populasi C. gariepinus karena merupakan populasi liar yang diintroduksi dari habitat alaminya.
Kejelasan status spesies ikan lele Afrika yang diintroduksi ke Indonesia diperlukan karena akan terkait dengan strategi upaya perbaikan mutu genetik ikan lele Afrika. Strategi perbaikan mutu genetik ikan hibrid akan berbeda dengan ikan yang murni. Pada ikan hibrid, perbaikan mutu genetik harus dilakukan pada kedua populasi indukan. Hal ini karena ikan hibrid yang fertil yang kemudian anakannya digunakan sebagai indukan dapat menyebabkan hilangnya hibrid vigour untuk pertumbuhan dan ketahanan penyakit (Senanan et al. 2004). Sementara itu, pada ikan yang murni, perbaikan mutu genetik hanya dilakukan pada satu populasi tersebut dan anakan yang dihasilkan dapat digunakan kembali sebagai indukan.
15 Penelitian ini dilakukan untuk menentukan status ikan lele Afrika yang diintroduksi ke Indonesia. Hasil penelitian ini dapat digunakan sebagai dasar untuk upaya perbaikan mutu genetik ikan lele Afrika di Indonesia.
Bahan dan Metode
Ikan lele Afrika yang digunakan merupakan koleksi BBPBAT Sukabumi, sedangkan ikan lele lokal (C. batrachus) merupakan ikan liar hasil tangkapan dari daerah Sukabumi bagian Selatan. Ikan lele Afrika terdiri atas lima populasi, yaitu: populasi Sangkuriang, populasi Belanda, populasi Thailand, populasi Mesir dan populasi Kenya. Populasi Sangkuriang merupakan generasi ke-2 dari hasil silang-balik ikan lele Afrika yang diintroduksi dari Taiwan tahun 1985 antara F2 betina dan F6 jantan.
Analisis marka DNA mitokondria dilakukan pada ikan lele Afrika dan ikan lele lokal. Setiap populasi diwakili oleh 10 sampel. Genom DNA dari sampel sirip diekstraksi dan dipurifikasi menggunakan Puregene kit (Qiagen Inc., USA). Lokus ND5/6 pada DNA-mitokondria diamplifikasi dengan PCR menggunakan primer
forward 5’-AATAGTTTATCC(A/G)TTGGTCTTAGG-3’ dan reverse 5’
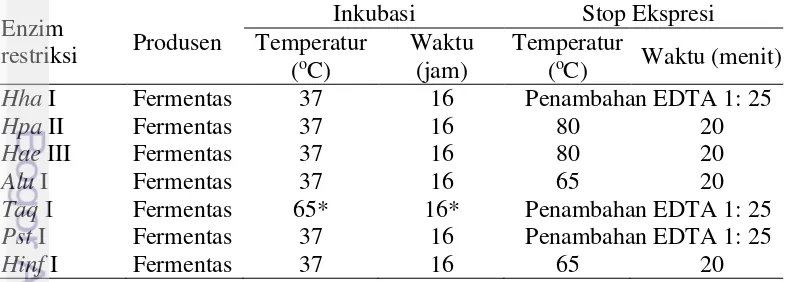
-TTACAACGATGGTTTTTCAT(G/A)TCA-3’ (Cronin et al., 1993) dengan tahapan seperti pada Tabel 3. Hasil amplifikasi dipotong menggunakan enzim restriksi Alu I, Hae III, Hha I, Hinf I, Hpa II, Pst I dan Taq I dengan prosedur mengikuti petunjuk produsen seperti pada Tabel 4. Produk PCR yang telah dipotong kemudian dielektroforesis pada 1,5% gel agarosa dan DNA divisualisasi
Tabel 3 Program PCR pada amplifikasi DNA Mitokondria ikan lele Tahapan Temperatur (oC) Waktu Siklus
Pradenaturasi 95 5 menit
Denaturasi
Pascaekstensi 72 3 menit
16
menggunakan GelRed (Biotium Inc., California, USA) dengan alat bantu Gel Doc XR+ dan program Quantity One (Biorad Inc., California, USA).
Analisis truss-morfometri dilakukan pada ikan lele afrika populasi Sangkuriang, Mesir, Thailand, Belanda dan Kenya masing-masing diwakili 30, 20, 49, 36 dan 12 sampel dengan bobot 200-500 gram/ekor dan ikan lele lokal (C. batrachus) sebanyak 15 sampel dengan bobot 100-150 gram/ekor. Pengukuran karakter morfometri mengikuti Teugels (1986), meliputi: panjang standar (SL), panjang antara ujung mulut sampai pangkal sirip punggung (PDL), panjang antara ujung mulut sampai pangkal sirip anal (PAL), panjang antara ujung mulut sampai pangkal sirip perut (PPL), panjang antara ujung mulut sampai pangkal sirip dada (PPEL), panjang sirip punggung (DFL), panjang sirip anal (AFL), panjang kepala (HL), jarak antara dua bola mata (IOW), panjang antara lekukan dan ujung tonjolan di tulang kepala (OPL) dan lebar antar lekukan di tulang kepala (OPW) (Agnese et al. 1997) (Gambar 3).
Analisis reproduksi dilakukan hanya pada ikan lele Afrika. Setiap populasi diwakili tiga jantan dan tiga betina (Tabel 5). Kantung sperma dari induk jantan ikan lele diambil dengan cara pembedahan kemudian dibelah untuk mengeluarkan cairan spermanya. Pengenceran cairan sperma dilakukan dengan menambahkan larutan garam 0.9% dengan pengenceran 1000x. Kepadatan sel spermatozoa dihitung dibawah mikroskop dengan menggunakan sedgwick rafter counting chamber. Motilitas sel spermatozoa dianalisis dibawah mikroskop dengan melakukan aktifasi pergerakan sel dengan menggunakan air pada perbandingan 1:99.
Untuk pengukuran diameter, telur diambil dari induk betina matang gonad dengan teknik intra-ovarian biopsy menggunakan kanulator. Diameter telur diukur dibawah mikroskop yang dilengkapi dengan mikrometer. Untuk perhitungan fekunditas relatif, telur dikeluarkan dari induk betina dengan cara diurut setelah
Keterangan singkatan lihat teks
Gambar 3 Pengukuran morfometrik ikan lele Tabel 5 Induk betina dan jantan ikan lele Afrika yang digunakan
Populasi Betina (kg) Jantan (kg)
Sangkuriang 5.41 ± 1.96 2.03 ± 0.45
Belanda 1.33 ± 0.22 1.68 ± 0.62
Thailand 3.70 ± 0.43 2.78 ± 0.09
Mesir 3.10 ± 0.67 2.59 ± 0.12
17 mencapai tahap ovulasi 10-12 jam setelah dilakukan penyuntikan dengan Ovaprim 0.2 mL/kg induk.
Cairan sperma sekitar 20 mL dicampurkan dengan telur sekitar 10 mg untuk proses pembuahan buatan. Pembuahan buatan dilakukan inter dan intra populasi sehingga terbentuk 25 populasi baru masing-masing dengan tiga ulangan. Campuran telur dan sperma kemudian diberi 15-20 mL air untuk proses aktifasi sperma sehingga merangsang terjadinya pembuahan. Campuran kemudian disebar ke dalam akuarium untuk proses penetasan telur.
Pola pemotongan enzim restriksi pada DNA mitokondria dikumpulkan pada setiap enzim restriksi sehingga dapat ditentukan tipe digesti, ukuran fragmen dan tipe komposit haplotipe pada setiap ikan sampel. Keragaman haplotipe dalam satu populasi dihitung dengan menggunakan persamaan Nei & Tajima (1981). Jarak genetik dan dendrogram UPGMA dihitung dan dibuat dengan software TFPGA (Miller 1997). Data trus-morfometri ditransformasi log kemudian diolah menggunakan pendekatan principal component analysis (PCA) dengan software PAST versi 2.17 (University of Oslo, Oslo, NO; Geological Museum, Copenhagen, DK). Normalitas data performa reproduksi diuji dengan menggunakan uji Shapiro-Wilk. Data yang berupa persentase dan data kepadatan sel spermatozoa dilakukan transformasi log. Pengaruh populasi terhadap performa reproduksi diuji menggunakan ANOVA. Bila terdapat perbedaan (p<0.05), dilakukan uji lanjut menggunakan uji Tukey.
Hasil
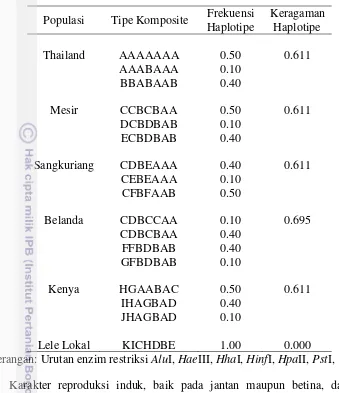
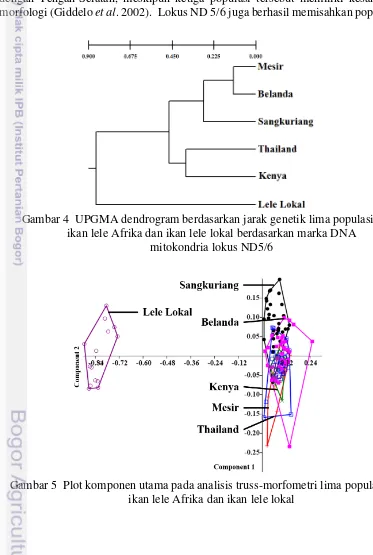
Keragaman genetik populasi ikan lele yang diintroduksi ke Indonesia relatif tinggi seperti ditunjukkan pada variasi restriksi lokus ND5/6 DNA mitokondria pada penelitian ini. Secara keseluruhan, amplifikasi DNA mitokondria lokus ND5/6 dihasilkan pada ukuran sekitar 2.4 kb (Lampiran 1). Semua enzim berhasil melakukan pemotongan (Lampiran 2 - Lampiran 8). Hasil analisis menunjukkan terdapat 17 haplotipe dengan rata-rata tiga haplotipe per populasi. Keragaman haplotipe pada populasi Sangkuriang, Mesir, Kenya, Belanda dan Thailand masing-masing adalah 0.611, 0.611, 0.611, 0.695 dan 0.611 sedangkan pada ikan lele lokal tidak didapatkan keragamannya (Tabel 6). Antar populasi lele Afrika, jarak genetik tertinggi diperoleh antara populasi Sangkuriang dengan populasi Kenya (0.582) dan terendah antara populasi Belanda dengan populasi Mesir (0.118) sedangkan dibandingkan dengan ikan lele lokal, jarak terjauh adalah dengan populasi Sangkuriang dan Mesir (0.881) dan terendah dengan populasi Belanda (0.830) (Tabel 7) (Gambar 4).
18
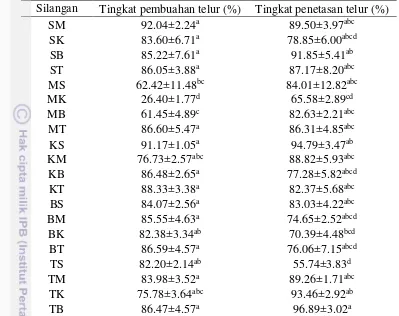
Karakter reproduksi induk, baik pada jantan maupun betina, dan hasil pemijahan tidak berbeda di antara lima populasi yang digunakan, kecuali diameter telur dan indeks gonado-somatik jantan (Tabel 8). Persilangan berhasil dilakukan antar populasi meskipun variasi tingkat pembuahan dan penetasan telur cukup tinggi, yaitu masing-masing pada kisaran 26.40% – 92.04% dan 55.74% – 96.89% (Tabel 9). Tingkat pembuahan telur tidak berbeda nyata pada 17 persilangan dan hanya berbeda pada persilangan MS (62.42%), MB (61.45%) dan MK (26.40%).
Tabel 6 Haplotipe pada ikan lele Afrika dan ikan lele lokal Populasi Tipe Komposite Frekuensi
Haplotipe
Keragaman Haplotipe
Thailand AAAAAAA 0.50 0.611
AAABAAA 0.10
BBABAAB 0.40
Mesir CCBCBAA 0.50 0.611
DCBDBAB 0.10
ECBDBAB 0.40
Sangkuriang CDBEAAA 0.40 0.611
CEBEAAA 0.10
CFBFAAB 0.50
Belanda CDBCCAA 0.10 0.695
CDBCBAA 0.40
FFBDBAB 0.40
GFBDBAB 0.10
Kenya HGAABAC 0.50 0.611
IHAGBAD 0.40
JHAGBAD 0.10
Lele Lokal KICHDBE 1.00 0.000
Keterangan: Urutan enzim restriksi AluI, HaeIII, HhaI, HinfI, HpaII, PstI, TaqI
Tabel 7 Jarak genetik antar lima populasi ikan lele Afrika dan ikan lele lokal (Nei’s Genetic Distance 1972) berdasarkan marka DNA mitokondria lokus ND5/6
Populasi Thailand Mesir Sangkuriang Belanda Kenya Lele Lokal Thailand X
Mesir 0.519 X
Sangkuriang 0.377 0.333 X
Belanda 0.468 0.118 0.218 X
Kenya 0.375 0.439 0.582 0.402 X
19 Pada umumnya, tingkat penetasan telur adalah tinggi (>74%), kecuali pada BK (70.39%), MK (65.58%) dan TS (55.74%)
Pembahasan
Analisis PCR-RFLP DNA mitokondria dapat digunakan baik untuk identifikasi/pemisahan spesies dalam satu genus maupun populasi dalam satu spesies. Berdasarkan analisis lokus ND5/6 DNA mitokondria, struktur populasi ikan lele C. gariepinus di Afrika dapat dipisahkan menjadi tiga grup filogenetik, yaitu grup Afrika bagian Timur, bagian Utara dan bagian zona kontak antara Timur dengan Tengah-Selatan, meskipun ketiga populasi tersebut memiliki kesamaan morfologi (Giddelo et al. 2002). Lokus ND 5/6 juga berhasil memisahkan populasi
Gambar 4 UPGMA dendrogram berdasarkan jarak genetik lima populasi ikan lele Afrika dan ikan lele lokal berdasarkan marka DNA
mitokondria lokus ND5/6
20
ikan salmon (Cronin et al. 1993), ikan nila (Rognon & Guyomard 1997; Li et al. 2002), ikan mas (Gross et al. 2002; Zhou et al. 2003), dan ikan lele (Agnese et al. 1997; Mohindra et al. 2007). Analisis PCR-RFLP juga dapat digunakan untuk identifikasi populasi hibrida seperti dilaporkan pada ikan Salmo trutta (Hansen et al. 2000), ikan Salvelinus (Wilson & Bernatchez 1998), ikan Pseudoplatystoma
(Prado et al. 2011; Hashimoto et al. 2013; Porto-Foresti et al. 2013), ikan-ikan Serrasalmid (Hashimoto et al. 2011) dan ikan-ikan Atherinid (Strussmann et al. 1997).
Keragaman haplotipe pada penelitian ini (0.611-0.695) lebih rendah dibandingkan dengan ikan lele C. gariepinus di Danau Victoria, Kenya, yaitu pada kisaran 0.741-0.754 (Barasa et al. 2014) dan Afrika Selatan, yaitu 0.852 (Roodt-Wilding et al. 2010) namun jumlah haplotipe yang ditemukan (tiga haplotipe per populasi) masih relatif sebanding dengan yang ditemukan di Afrika bagian timur yaitu kisaran 0 – 5 haplotipe per populasi (Giddelo et al. 2002), di Senegal yaitu enam haplotipe per populasi (Agnese et al. 1997) dan di India, yaitu tiga haplotipe per populasi (Mohindra et al. 2007). Jumlah haplotipe pada populasi Belanda lebih banyak dibandingkan dengan empat populasi lainnya. Hal ini diduga berkaitan dengan keragaman sumber genetik yang tinggi pada ikan lele yang diintroduksi ke Tabel 8 Karakter reproduksi induk betina dan jantan serta hasil pemijahannya pada
setiap populasi ikan lele Afrika
Karakter Sangkuriang Belanda Thailand Mesir Kenya Betina
a 11.47±0.81a 14.62±0.52a 11.27±2.09a 15.27±4.26a
Fekunditas
74.74±7.11a 62.89±14.26a 80.70±7.38a 87.63±5.18a 89.73±8.59a
Keterangan:
21
Belanda dan proses seleksi yang sudah dilakukan dapat tetap mempertahankan keragaman tersebut.
Dari hasil keragaman haplotipe yang ditemukan pada ke lima populasi yang diamati, setiap populasi memiliki haplotipe yang tidak dimiliki oleh populasi lainnya. Adanya perbedaan haplotipe ini dapat diduga berkaitan dengan asal wilayah/habitat alami dan tidak adanya aliran gen antar populasi. Mengacu pada penelitian Giddelo et al. (2002) yang berhasil memisahkan populasi ikan lele di Afrika, kemungkinan wilayah alami ikan lele yang diintroduksi ke Indonesia berasal dari wilayah yang berbeda. Hal ini didukung dengan jarak genetik antar populasi ikan lele yang diperoleh pada penelitian ini.
Jarak genetik antar populasi (kisaran 0.118-0.582) lebih tinggi dibandingkan dengan antar populasi ikan lele Afrika yang diintroduksi ke India, 0.028 (Mohindra
et al. 2007) dan Thailand, 0.036-0.144 (Wachirachaikarn et al. 2009) namun masih sebanding dengan di Nigeria (Anene & Tianxiang 2007). Berdasarkan jarak genetik ini, semakin memperkuat bukti bahwa tidak ada aliran genetik antar populasi. Ikan yang digunakan pada penelitian ini masih dipelihara secara terpisah dan belum dilakukan pemijahan persilangan antar populasi sebelumnya. Jarak genetik antar populasi yang relatif tinggi juga menunjukkan adanya potensi untuk dilakukan Tabel 9 Tingkat pembuahan dan penetasan telur pada persilangan interpopulasi ikan
lele Afrika
Silangan Tingkat pembuahan telur (%) Tingkat penetasan telur (%)
SM 92.04±2.24a 89.50±3.97abc
22
persilangan antar populasi. Dengan jarak genetik yang tinggi diharapkan persilangan antar populasi dapat memberikan hasil heterosis yang tinggi pula.
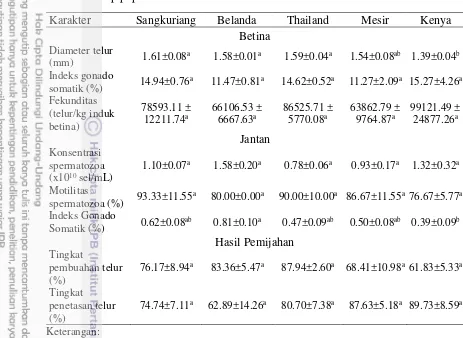
Karakteristik morfometri antar populasi ikan lele introduksi tidak dapat dibedakan berdasarkan sepuluh parameter yang diamati namun dapat dibedakan dengan ikan lele lokal. Hal ini sejalan dengan penelitian Agnese et al. (1997) yang melaporkan tidak adanya pemisahan antar populasi ikan lele Afrika C. gariepinus
namun secara jelas dapat dipisahkan dengan spesies C. Anguillaris yang dikumpulkan dari habitat aslinya di Senegal. Perbedaan morfometri banyak digunakan untuk melakukan klasifikasi spesies ikan, termasuk ikan lele (Teugel 1986; Agnese et al. 1997; Ng 1999; Sudarto 2002). Hasil penelitian ini menunjukkan tidak ditemukan adanya penanda morfometri yang dapat dijadikan indikasi adanya persilangan antar spesies ikan lele sebelumnya.
Berdasarkan karakter reproduksi, baik pada betina maupun jantan, tidak terdapat perbedaan antar populasi ikan lele Afrika, kecuali pada diameter telur dan indeks gonado-somatik jantan. Pada induk betina, diameter telur (kisaran 1.39-1.75 mm) sebanding dengan diameter telur yang ditemukan di habitat alaminya, yaitu 1.0-1.7 mm (Clay 1979). Diameter telur populasi budidaya, yaitu populasi Sangkuriang, Belanda dan Thailand, relatif lebih tinggi dibandingkan dengan populasi liar, yaitu populasi Mesir dan Kenya. Populasi Belanda memiliki diameter telur yang lebih besar sedangkan populasi Kenya memiliki diameter yang paling kecil dibandingkan dengan populasi lainnya. Hal ini diduga berkaitan dengan sejarah domestikasi dan budidaya yang telah dilakukan. Semakin lama proses domestikasi, semakin teradaptasi dalam pemanfaatan nutrisi untuk pembentukan telur sehingga memiliki diameter telur yang lebih besar.
Populasi Kenya memiliki diameter telur yang kecil namun indeks gonado somatik relatif lebih tinggi sehingga menghasilkan fekunditas yang lebih tinggi dibandingkan populasi lainnya. Indeks gonado-somatik (kisaran 11-15%) tidak berbeda antara populasi liar dengan populasi budidaya. Pada habitat alaminya di Danau Victoria, Kenya, indeks gonado-somatik ikan lele hanya mencapai <5% di luar musim pijah dan 5-10% pada musim pijah (de Graff & Janseen, 1996) dan di Afrika Selatan mencapai 4.53-5.53% (Barnhoorn et al. 2004), sedangkan pada populasi budidaya di Nigeria dapat mencapai 7-17% (Aiyelari et al. 2007; Sule 2010) dan di Belanda pada kisaran 5-12% (Fleuren 2008).
23 populasi budidaya di Belanda, 0.37-0.75% (Viveiros et al. 2002) dan Thailand, 0.6-0.9 (Wachirachaikarn et al. 2009).
Persilangan dapat dilakukan antar populasi dalam satu spesies, antar spesies atau antar genus. Pada penelitian ini, persilangan antar lima populasi ikan lele dapat dilakukan dan menghasilkan tingkat pembuahan dan penetasan telur yang tinggi, kecuali masing-masing pada silangan populasi Mesir x Kenya dan populasi Thailand x Sangkuriang. Persilangan antar populasi budidaya ikan lele Afrika sudah dilaporkan oleh Wachirachaikarn et al. (2009). Persilangan antar spesies ikan lele Afrika telah berhasil dilakukan dengan C. fuscus (Wu et al. 1990), C. meladerma
(Lenormand et al. 1998) dan C. macrocephalus (Na-Nakorn et al. 2004; Senanan
et al. 2004). Sedangkan persilangan antar genus sudah berhasil dilakukan dengan lele Heterobranchus longifilis (Legendre et al. 1992). Persilangan ikan lele Afrika tidak berhasil dilakukan dengan C. batrachus, C. nieuhofii dan C. teijsmanni
(Lenormand et al. 1998). Persilangan dengan betina C. fuscus menghasilkan hibrida dengan karakter morfologi yang mendekati bentuk C. fuscus dan jantan steril (Wu
et al. 1990) dan warna tubuh yang dapat secara jelas dibedakan dengan C. gariepinus (Huang et al. 2005). Persilangan dengan betina C. macrocephalus
menghasilkan hibrida betina fertil dan jantan yang tidak dapat menghasilkan keturunan (Abol-Munafi et al. 2006) sedangkan morfologi hampir sama dengan C. macrocephalus (Senanan et al. 2004). Persilangan dengan betina C. meladerma
menghasilkan hibrida steril sedangkan pada resiproknya tidak berhasil hidup (Lenormand et al. 1998).
Pada silangan populasi Mesir x Kenya dan populasi Thailand x Sangkuriang masing-masing diperoleh tingkat pembuahan dan penetasan telur yang lebih rendah secara signifikan dibandingkan dengan populasi silangan lainnya. Keberhasilan tingkat pembuahan dan penetasan telur sangat dipengaruhi oleh kualitas telur dan sperma (Bobe & Labbe 2010). Selain itu, tingkat pembuahan yang rendah dapat berkaitan dengan interaksi antara sel spermatozoa dengan sel telur. Interaksi kedua sel yang menyebabkan kegagalan pembuahan diantaranya akibat ketidak-sesuaian ukuran sel spermatozoa dengan lubang mikrofil telur betina atau gagalnya penggabungan pronukleus jantan dan betina setelah spermatozoa berhasil memasuki telur (Lyman-Gingerich & Pelegri 2007; Kinsey et al. 2007). Sedangkan kegagalan penetasan telur dapat diakibatkan oleh temperatur (Thepot & Jerry 2015), pH (Gao et al. 2011), kandungan oksigen terlarut (Oyelese 2006), terlalu cepat atau terlalu lambat proses pengeluaran telur (stripping) setelah waktu ovulasi (Agbebi
24
Simpulan
4
PERSILANGAN INTERPOPULASI BUDIDAYA DAN LIAR
IKAN LELE AFRIKA PADA TAHAP PEMBENIHAN
Abstrak
Ikan lele Afrika Clarias gariepinus telah diintroduksi dan dibudidayakan di Indonesia sejak tahun 1985 dan memberikan kontribusi yang signifikan terhadap produksi akuakultur. Namun demikian, perkembangan cepat budidaya ikan lele tidak selaras dengan upaya perbaikan mutu induk sehingga menyebabkan terjadinya penurunan performa ikan. Salah satu metode perbaikan mutu genetik adalah teknik persilangan. Penelitian ini mengevaluasi performa pertumbuhan dan kelangsungan hidup hingga umur 81 hari (tahap pembenihan) ikan hasil persilangan interpopulasi dari lima populasi ikan lele, yaitu populasi Sangkuriang, Mesir, Kenya, Belanda dan Thailand. Pemijahan buatan antar populasi dilakukan untuk membentuk lima populasi galur murni dan 20 populasi persilangan. Terdapat perbedaan yang nyata pada laju pertumbuhan panjang (SGR), kelangsungan hidup (SR) dan jumlah ikan
over-size (OS). Persilangan betina Mesir x jantan Belanda (MB) menunjukkan performa terbaik yaitu SGR, SR dan OS masing-masing 9.69±0.03%, 83.49±6.72% and 0.22±0.04%. Hasil penelitian juga menunjukkan bahwa terdapat korelasi antara OS dengan SR, makin tinggi OS, makin rendah SR. Korelasi ini cenderung makin menurun pada pemeliharaan ikan yang semakin besar. Dari hasil penelitian ini kami menyimpulkan bahwa persilangan MB berpotensi tinggi untuk dimanfaatkan pada upaya perbaikan kualitas benih ikan lele Afrika.
Kata Kunci: Lele Afrika, persilangan interpopulasi, variasi pertumbuhan, kelangsungan hidup, over-size