PENGEMBANGAN MINUMAN FUNGSIONAL BERBASIS DAUN PEGAGAN (Centella asiatica) DENGAN AKTIVITAS
ANTI-HIPERURISEMIA :OPTIMASI PROSES EKSTRAKSI BAHAN BAKU MINUMAN FUNGSIONAL
SARAH LUBNA
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengembangan Minuman Fungsional Berbasis Daun Pegagan (Centella asiatica) dengan Aktivitas Anti-Hiperurisemia : Optimasi Proses Ekstraksi Bahan Baku Minuman Fungsional adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
SARAH LUBNA. Pengembangan Minuman Fungsional Berbasis Daun Pegagan (Centella asiatica) dengan Aktivitas Anti-Hiperurisemia: Optimasi Proses Ekstraksi Bahan Baku Minuman Fungsional.Dibimbing oleh C. HANNY WIJAYA and BUDI NURTAMA.
Penelitian ini bertujuan untuk mengoptimasi proses ekstraksi bahan bakuyang digunakan dalam pembuatan minuman fungsional berbasis pegagan. Ekstrak kering dari tanaman pegagan (Centella asiatica), kumis kucing (Orthosiphon aristatus), jahe (Zingiber oficinale) and kayu manis (Cinnamomum sp.) dikeringkan dengan metode pengeringan semprot (sray dryer). Response surface methodology (RSM) digunakan sebagai metode rancangan percobaan dan proses optimasi dalam perangkat lunak Design Expert 7. Hasil optimasi untuk keempat sampel adalah: pegagan menggunakan suhu eksstraksi A oC selama B jam dalam waterbathshaker, jumlah maltodekstrin C % dan suhu inlet pengeringan D oC; kayu manis memerlukan waktu ekstraksi E menit dalam air mendidih, jumlah maltodekstrin F% dan suhu inlet pengeringan GoC; ekstrak cair kumis kucing dan jahe dicampurkan maltodekstrin H % dan dikeringkan dengan suhu inlet pengeringan IoC. Respon untuk keempat sampel menunjukkan pegagan mengandung 36867 ppm AEAC dan total fenol 10028 ppm GAE; kumis kucing memiliki aktivitas antioksidan 81450 ppm AEAC dan total fenol 22272 ppm GAE; kayu manis memiliki aktivitas antioksidan 65200 ppm AEAC dan total fenol 22941 ppm GAE; dan jahe memiliki aktivitas antioksidan 42572 ppm AEAC dan total fenol 9808 ppm GAE. Daya inhibisi enzim xantin oksidase untuk sampel yang teroptimasi adalah : pegagan 30%, kumis kucing 60%, kayu manis 45%, dan jahe 26%.
ABSTRACT
SARAH LUBNA. Development of Pegagan (Centella asiatica) Functional Beverage with Anti-Hyperuricemia Activity: Optimization of Extraction Process on Functional Beverage Main Ingredients. Supervised by C. HANNY WIJAYA dan BUDI NURTAMA.
The aim of this research is to optimize the extraction process of the ingredients pegagan functional beverage.The plant extract of Centella asiatica (pegagan), Orthosiphon aristatus (kumis kucing), Zingiber oficinale (ginger) and Cinnamomum sp. (cinnamon)are dried using spray dryer. Response surface methodology (RSM) is used for the experimental design and optimization with Design Expert 7 software.The optimization results of the four samples are as follow: pegagan is using A oC temperature of extraction in B hours extraction process inside the waterbathshaker, C% amounts of maltodextrin and DoC inlet temperature on spray dryer; cinnamon needs E minutes extraction time on boiling water (approx. 95oC), F% amounts of maltodextrin and GoC inlet temperature on spray dryer; kumis kucing and ginger are best mixed with the lowest amounts of maltodextrin, which is H% and the inlet temperature for spray dryer is IoC. The response results show the antioxidant activity for pegagan is 36867 ppm AEAC, the phenolic compound is 10028 ppm GAE; kumis kucing has antioxidant activity 81450 ppm AEAC andphenolic compounds 22272 ppm GAE; cinnamon hasantioxidant activity 65200 ppm AEAC and the phenolic compound is 22941 ppm GAE; and ginger has 42572 ppm AEAC antioxidant activity and phenolic compounds 9808 ppm GAE. The xanthine oxidase enzyme inhibition for optimized samples are: pegagan 30%, kumis kucing 60%, cinnamon 45%, and ginger 26%.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
PENGEMBANGAN MINUMAN FUNGSIONAL
BERBASIS DAUN PEGAGAN (
Centella asiatica
) DENGAN
AKTIVITAS ANTI-HIPERURISEMIA : OPTIMASI PROSES
EKSTRAKSI BAHAN BAKU MINUMAN FUNGSIONAL
SARAH LUBNA
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi :Pengembangan Minuman Fungsional Berbasis Daun Pegagan (Centella asiatica) dengan Aktivitas Anti-Hiperurisemia : Optimasi Proses Ekstraksi Bahan Baku Minuman Fungsional
Nama : Sarah Lubna NIM : F24090104
Disetujui oleh
Prof. Dr.Ir. C Hanny Wijaya Pembimbing I
Dr.Ir.Budi Nurtama, M.Agr Pembimbing II
Diketahui oleh
Dr.Ir.Feri Kusnandar, M.Sc. Ketua Departemen
PRAKATA
Puji dan syukur penulis ucapkan kehadirat Allah Subhanahu wa ta’ala atas segala karunia-Nya sehingga skripsi yang berjudul Pengembangan Minuman Fungsional Berbasis Daun Pegagan (Centella asiatica) dengan Aktivitas Anti-Hiperurisemia : Optimasi Proses Ekstraksi Bahan Baku Minuman Fungsional dapat diselesaikan dengan baik.
Terima kasih penulis menyampaikan ucapan kepada Ibu Prof Dr Ir C. Hanny Wijaya selaku pembimbing I yang telah banyak memberikan waktu, saran, dan bimbingannya kepada penulis dalam penyelesaian penelitian dan penulisan skripsi ini. Ucapan terima kasih juga penulis sampaikan pada Bapak Dr Ir Budi Nurtama, M.Agr selaku pembimbing II yang juga memberikan waktu, saran, dan bimbingan kepada penulis. Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Sukarno, M.Sc selaku dosen penguji yang telah banyak memberi saran.
Rasa hormat penulis sampaikan kepada ibu, ayah, dan keluarga tercinta yang telah membimbing dan memberikan doa, semangat, kasih sayang, dukungan moril dan materiil dengan tulus selama ini. Terima kasih juga Penulis sampaikan kepada teman-teman tercinta, Nurul, Astro, Beber, Ririd dan Suci atas semangat,- doa, dan dukungan yang telah diberikan. Teman-teman ITP 46 atas kebersamaan yang telah dibangun selama ini, para peneliti di Pusat Studi Biofarmaka Bu Susi dan Mbak Laila. Terima kasih pula kepada teknisi laboratorium ITP, Pak Nur, Pak Yahya, Pak Rozak, dan Pak Gatot yang banyak membantu selama penelitian.
Penulis berharap skripsi ini dapat memberikan manfaat bagi pembaca. Bogor, Mei 2014
DAFTAR ISI
DAFTAR ISI ... xiii
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xiv
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 4
Manfaat Penelitian ... 4
METODE ... 5
Bahan ... 5
Alat ... 5
Prosedur ... 5
HASIL DAN PEMBAHASAN ... 12
Persiapan Bahan Baku ... 12
Proses ekstraksi ... 14
Optimasi Proses ... 15
Analisis Daya Inhibisi Enzim Xantin Oksidase ... 20
SIMPULAN DAN SARAN ... 23
Simpulan ... 23
Saran ... 23
DAFTAR PUSTAKA ... 24
DAFTAR TABEL
1 Pengukuran Total Fenol Berdasarkan Perbedaan Waktu Ekstraksi dan
Sampel yang Digunakan 13
2 Pengukuran Fenol pada Pengamatan dan Pengukuran Respon 14
DAFTAR GAMBAR
1 Diagram Alir Pembuatan Ekstrak Kering Pegagan 7 2 Diagram Alir Pembuatan Ekstrak Kering Kumis Kucing 8 3 Diagram Alir Pembuatan Ekstrak Kering Kayu Manis 9 4 Diagram Alir Pembuatan Ekstrak Kering Jahe 10 5 Pengukuran aktivitas antioksidan metode DPPH (Molyneux 2004) 11 6 Permodelan Aktivitas Antioksidan dan Total Fenol Pegagan 17 7 Permodelan Aktivitas antioksidan dan total fenol Kayu manis 18 8 Permodelan aktivitas antioksidan dan total fenol jahe 19 9 Permodelan aktivitas antioksidan dan total fenol kumis kucing 20 10 Kurva Inhibisi Xantin Oksidase pada Allupurinol 21 11 Kurva Daya Inhibisi Sampel terhadap Enzim XOD 22
DAFTAR LAMPIRAN
1 Rancangan Percobaan RSM Kayu Manis 28
2 RancanganPercobaan RSM Kumis Kucing dan Jahe 28
3 Rancangan Percobaan RSM Pegagan 29
4 Kurva Standar Asam Galat (Total Fenol) 29
5 Kurva Standar Asam Askorbat (Antioksidan) 30
6 Hasil Optimasi Pegagan 30
7 Hasil Optimasi Kumis Kucing 31
8 Hasil Optimasi Kayu Manis 31
9 Hasil Optimasi Jahe 32
10 Tabel Kontrol Positif Allupurinol 32
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara dengan biodiversitas tinggi. Menurut Syukur dan Hernani (2002), 30.000 dari 40.000 jenis flora di dunia ada di Indonesia. Sebagian telah banyak dibudidayakan, tetapi masih lebih banyak lagi yang tumbuh liar. Tanaman hasil budidaya yang memiliki khasiat atau untuk menjaga kesehatan disebut tanaman obat. Pada skala industri, tanaman obat dapat dikembangkan dan diformulasikan menjadi jamu atau obat tradisional, makanan maupun minuman. Pengembangan agroindustri tanaman obat memiliki prospek yang baik karena Indonesia memiliki kekayaan alam yang melimpah sebagai sumber bahan baku.
Adanya tren back to nature akhir-akhir ini, berpengaruh terhadap maraknya pengembangan dan produksi produk pangan dari bahan lokal. Saat ini semakin banyak dikembangkan produk pangan yang di klaim memiliki manfaat untuk menjaga kesehatan maupun mengurangi resiko penyakit tertentu, yang dikenal dengan pangan fungsional. Pangan fungsional merujuk ke makanan atau minuman yang memiliki manfaat bagi tubuh dan dikonsumsi dalam bentuk makanan sehari-hari. Perkembangan pangan fungsional saat ini cukup pesat karena dikenal tidak memiliki efek samping jika dibandingkan dengan obat-obatan kimia. Pangan fungsional umumnya terbuat dari bahan alami seperti tanaman obat. Beberapa penelitian membuktikan bahwa tanaman obat selain aman juga berkhasiat untuk mencegah dan menyembuhkan berbagai penyakit. Salah satu yang umum digunakan untuk mencegah dan mengatasi gangguan kesehatan adalah teh, pegagan, dan jeruk purut (Heyne 1987). Di Indonesia, penggunaan tanaman obat umumnya untuk menyembuhkan hipertensi, hiperurisemia, demam, antiradang, dan lain sebagainya (Dalimartha 2000).
2
dapat dikeluarkan dari dalam tubuh. Allupurinol adalah satu-satunya penghambat enzim xantin oksidase yang diaplikasikan secara klinis pada tiga dekade terakhir ini. Tetapi obat ini memiliki efek samping yang merugikan seperti hepatitis, nephropathy, reaksi alergi, dan 6-mercaptopurine toxicity (Kong et al.). Hal tersebut menjadi salah satu penyebab perlunya ditemukan penghambat enzim xantin oksidase yang baru.
Hasil penelitian Iswantini dan Darusman (2003) menunjukkan peran ekstrak kasar flavonoid (salah satu senyawa fenol) herba memiliki daya inhibisi terkuat bila dibandingkan dengan produk jamu komersial yang beredar di pasaran. Hal ini sesuai dengan referensi dari Schemeda-Hirschmann et al.(1996); Cos et al. (1998); Milian(2004) yang menyatakan bahwa ekstrak kasar herba yang mengandung komponen flavonoid salah satunya, dapat menghambat enzim xantin oksidase.
Tanaman pegagan telah lama dikenal di Indonesia. Pegagan memiliki rasa yang manis, bersifat mendinginkan, memiliki fungsi sebagai antioksidan, membersihkan darah, melancarkan peredaran darah, peluruh kencing (diuretika), penurun panas (antipiretika), menghentikan pendarahan (haemostatika), meningkatkan syaraf memori, anti bakteri, tonik, antispasma, antiinflamasi, hipotensif, insektisida, antialergi, dan stimulan. Tanaman pegagan mengandung zat kimia yang bermanfaat bagi manusia yang dapat digolongkan menjadi asam amino, flavonoid, terpenoid, dan minyak atsiri (Barnes et al. 2002). Pegagan mengandung asam amino alanin dan serine, amino butirat, aspartat, glutamate, histidin, lisin, dan threonin. Selain itu, pegagan juga mengandung flavonoid quercetin, kaempferol, dan berbagai glikosida. Kandungan utama pegagan adalah golongan terpenoid, yaitu asiatikosida, sentelosida, madekasosida, brahmosida dan brahminosida (glikosa saponin), asam asiaticentoic, asam centellic, asam centoic, dan asam madekasat. Kandungan komponen bioaktif dalam tanaman dipengaruhi oleh habitat, pemupukan, dan umur tanaman (Sjamsuhidajat dan Nurendah 1992). Selain itu, Darusman et al. (2003) menyatakan bahwa komponen bioaktif tanaman dikendalikan oleh kemampuan metabolisme tanaman yang dipengaruhi oleh lingkungan. Pegagan dijadikan sebagai bahan baku utama minuman fungsional karena memiliki kandungan komponen aktif yang beragam.
Jahe memiliki aroma khas yang umum digunakan dalam berbagai olahan pangan. Jahe mengandung air, protein, pati, selulosa, pentosan, minyak atsiri, oleoresin, dan mineral. Kandungan serat kasar, minyak volatil, dan komponen pungent pada jahe merupakan kriteria penting dalam menentukan penggunaannya (Purseglove et al. 1981). Minyak atsiri merupakan komponen volatil yang terdiri dari monoterpen, seskuiterpen dan monoterpen teroksidasi, sedangkan bau khas nya disebabkan oleh zingiberen yang merupakan seskuiterpen hidrokarbon (C12H24) dan zingiberol yang merupakan seskuiterpen alkohol (C15H25O)
3
Jahe mengandung senyawa oleoresin atau gingerol yang merupakan antioksidan. Komponen bioaktif jahe berfungsi melindungi membran dari oksidasi radikal bebas, menghambat oksidasi kolesterol dan meningkatkan kekebalan tubuh.
Kumis kucing telah lama digunakan sebagai tanaman obat di Indonesia. Komponen bioaktif dalam kumis kucing adalah orthosiphonin glikosida, polifenol, minyak atsiri, minyak lemak, saponin, sapofonin, garam kalium, mioinositol, dan sinensetin (Dalimartha 2000). Kumis kucing termasuk tanaman yang memiliki kandungan antioksidan. Selain komponen polifenol yang dapat menjadi antioksidan, Indariani (2011) menyatakan bahwa kumis kucing mengandung senyawa fitokimia lain berupa alkaloid, flavonoid, tannin, saponin, triterpenoid, dan hidroquinon. Pemanfaatan tanaman kumis kucing dilakukan pada semua bagian tanamannya, namun penggunaan daunnya lebih umum digunakan (Mardhiyyah 2012). Daun kumis kucing sering dimanfaatkan sebagai obat antiradang (anti-inflamasi), peluruh kencing (diuretik), dan menghancurkan batu kemih. Van deer Veen et al. (1979) menyatakan bahwa senyawa kalium, inositol, danlipophilic flavones yang terdapat pada daun kumis kucing mempunyai sifat diuretik dan bakteriostatik. Kemampuan kumis kucing untuk meningkatkan kemampuan diuretik tubuh dapat bermanfaat untuk menurunkan kadar asam urat dalam tubuh.
Kayu manis umumnya digunakan dalam pengolahan pangan karena dapat memperkuat rasa dan aroma, serta meningkatkan umur simpan karena dapat berperan sebagai antimikroba dan antioksidan (Ho et al. 1992). Bagian yang umumnya dimanfaatkan dari kayu manis adalah kulit pohon kayu manis yang telah dikeringkan dan berbentuk gulungan. Kulit kayu manis kering yang bermutu baik pada umumnya mengandung minyak atsiri, pati, getah, resin, fixed oil, tannin, selulosa, zat warna, kalium oksalat, dan mineral (Rismunandar dan Paimin 2001). Komponen flavor utama pada kayu manis adalah sinamaldehida. Selain itu, pada kayu manis dapat ditemukan komponen flavor utama pada cengkeh yaitu, eugenol. Kayu manis dapat berperan sebagai antioksidan karena mengandung tannin dan eugenol (King 2000).
4
kecepatan penguapan dipengaruhi oleh komposisi bahan terutama kandungan total padatan. Semakin tinggi total padatan bahan makan akan mempercepat proses penguapan. Pengeringan semprot cocok digunakan untuk bahan-bahan yang sensitif terhadap panas karena tidak merusak bahan. Ekstrak yang dikeringkan dengan pengeringan semprot diharapkan memiliki stabilitas dan umur simpan yang lebih baik dibandingkan bentuk ekstrak cair karena memiliki kadar air yang relatif rendah. Metode pengeringan semprot memerlukan bahan pengisi untuk meningkatkan total padatan. Maltodekstrin digunakan sebagai bahan pengisi karena dapat menurunkan tekanan osmotik yang berdampak pada peningkatan total padatan (Hidayat 2002).
Secara umum optimasi berarti pencarian nilai terbaik (minimum atau maksimum) dari beberapa fungsi yang diberikan pada suatu konteks.Optimasi juga dapat berarti upaya untuk meningkatkan kinerja sehingga mempunyai kualitas yang baik dan hasil kerja yang tinggi (Depdikbud 1996). Pada penelitian ini optimasi proses dilakukan untuk mencari proses yang optimal berdasarkan respon dan karakteristik yang diinginkan. Optimasi dilakukan karena salah satu kendala pembuatan pangan fungsional adalah ketidakseragaman komponen fungsional. Penggunaan bahan baku alami umumnya tidak dapat ditetapkan kandungannya selalu sama seperti bahan kimia. Proses yang teroptimasi dapat dijadikan acuan untuk melakukan ekstraksi dengan hasil yang serupa. Optimasi proses menggunakan metode Response Surface (RSM) yang ada dalam perangkat lunak Design Expert 7 (DX 7). RSM adalah metode ekstensif yang digunakan untuk situasi dimana beberapa variable input berpotensi mempengaruhi respon atau kualitas dari sebuah proses (Carley et al. 2004). Ide dasar metode ini adalah memanfaatkan desain eksperimen berbantuan statistika untuk mencari nilai optimal dari suatu respon.
Tujuan Penelitian
Tujuan penelitian ini adalah mendapatkan proses ekstraksi dan pengeringan bahan baku minuman, yaitu daun pegagan, daun kumis kucing, jahe, dan kayu manis berdasarkan aktivitas komponen fungsional ekstrak sehingga diperoleh ekstrak kering dengan aktivitas antioksidan, total komponen fenolik yang optimum dan memiliki daya inhibisi xantin oksidase.
Manfaat Penelitian
5
METODE
Bahan
Bahan baku yang dibutuhkan dalam penelitian ini adalah daun pegagan, daun kumis kucing, rimpang jahe, dan kayu manis. Semua bahan baku didapatkan dari Unit Kebun dan Budidaya Biofarmaka PSB LPPM IPB. Pelarut yang digunakan untuk mengekstrak bahan baku adalah air. Bahan-bahan yang digunakan untuk analisis yaitu, pereaksi Folin-Ciocalteau, methanol, larutan penyangga asam asetat, akuades, asam askorbat. Bahan yang digunakan untuk analisis daya inhibisi Xantin Oksidase (XOD) adalah buffer fosfat, xantin, enzim xantin oksidase, HCl, dan NaOH. Bahan pengisi dalam proses pengeringan adalah maltodekstrin.
Alat
Alat untuk mengekstrak daun pegagan adalah gelas piala dan waterbathshaker. Alat-alat yang digunakan untuk mendapatkan ekstrak jahe adalah parutan manual dan kain saring. Alat untuk mendapatkan ekstrak kumis kucing adalah pemanas, kain saring, dan rotary evaporator (rotavapor) untuk pemekatan ekstrak. Alat untuk mengekstrak kayu manis adalah gelas piala bertutup dan pemanas. Untuk mempersiapkan bahan baku diperlukan baskom, pisau, talenan, dan panci. Alat-alat yang digunakan untuk analisis adalah pH meter, mikropipet, spektrofotometri, neraca analitik, desikator, water bath, alat vorteks, dan alat-alat gelas. Homogenizer dan pengering semprot diperlukan sebagai alat pengeringan.
Prosedur
6
Persiapan Bahan Baku
Daun pegagan segar dikeringkan dalam oven pada suhu 50 oC selama 24 jam. Daun pegagan yang telah dikeringkan kemudian dihancurkan dengan blender. Bahan baku kulit kayu manis segar dibersihkan dan dipotong-potong. Kulit kayu manis segar juga dikeringkan dalam oven pada suhu 50 oC selama 24 jam. Bahan baku kumis kucing dan jahe digunakan dalam keadaan segar. Daun kumis kucing dibersihkan, kemudian dipilih daun yang tidak berlubang. Persiapan rimpang jahe melalui tahap pencucian dan blansir selama 3 menit sebelum diekstraksi.
Ekstraksi bahan baku
Pegagan diekstrak dengan menggunakan metode modifikasi maserasi dan pemanasan menggunakan pelarut air. Daun pegagan kering sebanyak 10 g dimasukkan ke dalam 200 mL akuades dan dimasukkan dalam waterbath-shaker selama rentang waktu tertentu sebagai perlakuan (Chalid dan Zulfakar 2009). Setelah itu campuran disaring hingga didapatkan ekstrak cair.
Ekstraksi kumis kucing dan jahe merujuk pada penelitian yang dilakukan Mardhiyyah (2012). Daun kumis kucing segar dimasukan ke dalam kantong berpori, yang kemudian dimasukan ke dalam air mendidih dan dipertahankan pada suhu 90-95oC. Ekstraksi jahe melalui beberapa tahap yaitu, pembersihan, pemblansiran, pengecilan ukuran, ekstraksi (pemerasan), pengendapan, dan pasteurisasi. Pemisahan cairan dan pengendapan ekstrak jahe dilakukan dengan menuang ke wadah lainnya, kemudian dipasteurisasi pada suhu 75oC selama 30 menit. Pada ekstraksi kulit kayu manis, sampel kering ditimbang sebanyak 20 g, dan ditambahkan akuades sebanyak 200 mL (1:10), lalu direbus dengan air dalam keadaan tertutup sampai mendidih, dan dibiarkan mendidih selama beberapa variable waktu sebagai perlakukan. Kemudian disaring dan didapatkan larutan stok kayu manis (Safithri dan Fahma 2008).
Pengeringan
7
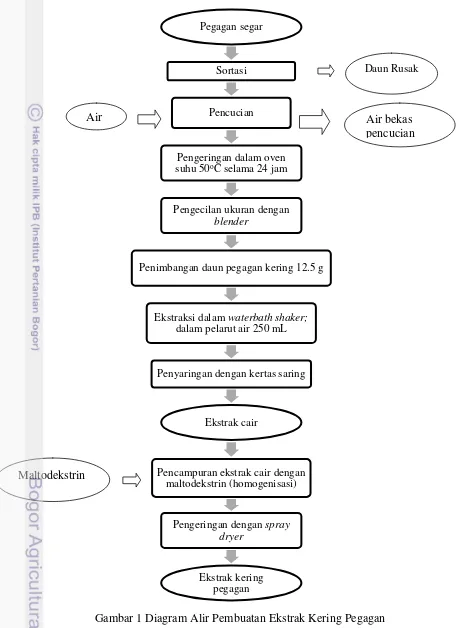
Gambar 1 Diagram Alir Pembuatan Ekstrak Kering Pegagan
Pegagan segar
Sortasi
Pencucian
Pengeringan dalam oven
suhu 50oC selama 24 jam
Pengecilan ukuran dengan
blender
Penimbangan daun pegagan kering 12.5 g
Ekstraksi dalam waterbath shaker;
dalam pelarut air 250 mL
Penyaringan dengan kertas saring
Ekstrak cair
Pencampuran ekstrak cair dengan maltodekstrin (homogenisasi)
Pengeringan dengan spray
dryer
Ekstrak kering pegagan
Air bekas pencucian Air
Maltodekstrin
8
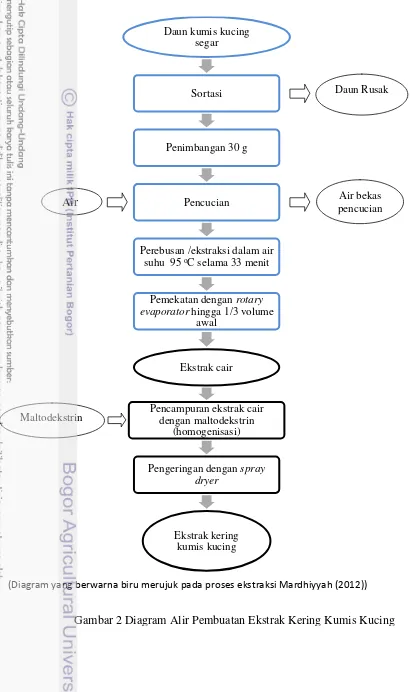
Gambar 2 Diagram Alir Pembuatan Ekstrak Kering Kumis Kucing
Daun kumis kucing segar
Sortasi
Penimbangan 30 g
Pencucian
Perebusan /ekstraksi dalam air
suhu 95 oC selama 33 menit
Pemekatan dengan rotary
evaporator hingga 1/3 volume awal
Ekstrak cair
Pencampuran ekstrak cair dengan maltodekstrin
(homogenisasi)
Pengeringan dengan spray
dryer
Ekstrak kering kumis kucing
(Diagram yang berwarna biru merujuk pada proses ekstraksi Mardhiyyah (2012)) Maltodekstrin
Air Air bekas
9
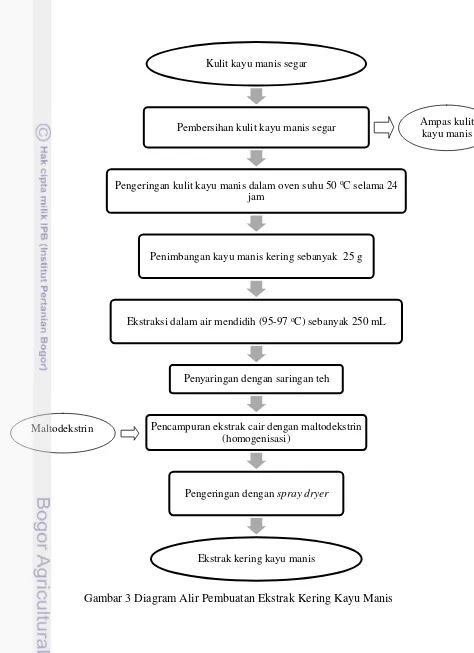
Gambar 3 Diagram Alir Pembuatan Ekstrak Kering Kayu Manis
Kulit kayu manis segar
Pembersihan kulit kayu manis segar
Pengeringan kulit kayu manis dalam oven suhu 50 oC selama 24
jam
Penimbangan kayu manis kering sebanyak 25 g
Ekstraksi dalam air mendidih (95-97 oC) sebanyak 250 mL
Penyaringan dengan saringan teh
Pencampuran ekstrak cair dengan maltodekstrin (homogenisasi)
Pengeringan dengan spray dryer
Ekstrak kering kayu manis
Ampas kulit kayu manis
10
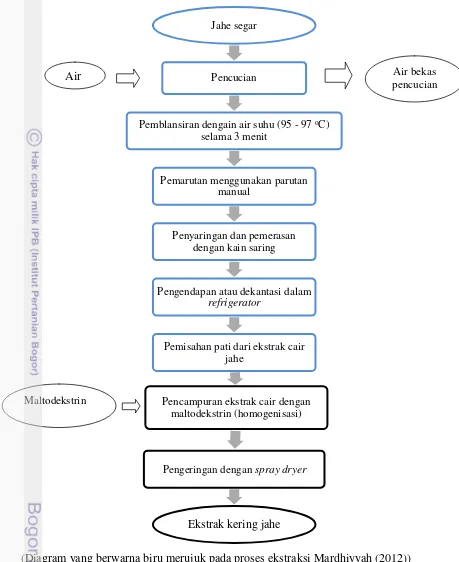
Air bekas pencucian
Air
Jahe segar
Pencucian
Pemblansiran dengain air suhu (95 - 97 oC)
selama 3 menit
Pemarutan menggunakan parutan manual
Penyaringan dan pemerasan dengan kain saring
Pengendapan atau dekantasi dalam
refrigerator
Pemisahan pati dari ekstrak cair jahe
Pencampuran ekstrak cair dengan maltodekstrin (homogenisasi)
Pengeringan dengan spray dryer
Ekstrak kering jahe
Gambar 4 Diagram Alir Pembuatan Ekstrak Kering Jahe
(Diagram yang berwarna biru merujuk pada proses ekstraksi Mardhiyyah (2012))
11
Optimasi Proses Ekstraksi
Tahap awal optimasi diawali dengan pengamatan dan pengukuran respon untuk menentukan batas atas dan bawah dari variable yang akan diuji. Setelah didapatkan batas atas dan bawah yang sesuai, dilakukan pembuatan rancangan percobaan dengan software Design Expert 7 (DX7). Desain yang digunakan adalah D-Optimal. Faktor yang diujikan pada sampel pegagan adalah waktu ekstraksi (A –B jam), suhu ekstraksi (C – DoC), jumlah maltodekstrin (E -F %) dan suhu inlet pegeringan semprot (G - HoC). Waktu ekstraksi pada kayu manis (I
– J menit) menjadi salah satu faktor, selain jumlah maltodekstrin dan suhu inlet pengeringan semprot. Pada kumis kucing dan jahe, optimasi yang dilakukan hanya pada faktor jumlah maltodekstrin dan suhu inlet pengeringan semprot. Hal tersebut dikarenakan proses ekstraksi kumis kucing dan jahe yang diacu sudah mengalami optimasi proses untuk menghasilkan aktivitas antioksidan dan total fenol terbaik. Respon yang diukur dari keempat sampel adalah aktivitas antioksidan dan total fenol. Hasil dari pengolahan data dengan metode RSM akan menentukan perlakukan yang harus dilakukan untuk mendapatkan titik kendali proses optimum.
Uji Aktivitas Antioksidan (Molyneux 2004)
DPPH adalah radikal bebas yang stabil dalam larutan berair atau larutan methanol serta memiliki serapan yang kuat pada panjang gelombang 515 nm dalam bentuk teroksidasi. Uji aktivitas antioksidan dilakukan pada bahan baku yang diduga mempunyai aktivitas sebagai antioksidan. Prinsip metode ini adalah berdasarkan pada reaksi penangkapan hidrogen oleh DPPH dari senyawa antioksidan.DPPH berperan sebagai radikal bebas yang diredam oleh antioksidan dari sampel.
2 mL larutan buffer asetan (pH 5.5), 3.75 mL methanol dan 200 µl larutan DPPH 3mM dalam methanol
Larutan campuran divorteks
Ditambah 50 µl larutan sampel atau larutan standar antioksidan
Diinkubasi pada suhu 37oC selama 30 menit
Dibaca absorbansi sampel dengan spektrofotometer pada λ = 517 nm
12
Total Fenol (Strycharz dan Shetty 2002)
Larutan standar dibuat dengan melarutkan 10, 25, 50, 75, 100, 125, dan 150 ppm asam galat dalam air suling. Larutan reagen dibuat dengan mencampurkan reagen folin-ciocalteau 50 mL dengan air suling 50 mL. Larutan Na2CO3 dibuat dengan melarutkan 5 g Na2CO3 dalam 100 mL air suling. Larutan
standar atau sampel sebanyak 1 mL dilarutkan dalam 5 mL air suling dan 0.5 mL larutan reagen. Selain itu, larutan didiamkan selama 5 menit dalam ruang gelap kemudian ditambahkan 1 mL larutan Na2CO3 dan diinkubasi kembali dalam ruang
gelap selama 1 jam. Setelah inkubasi, larutan divorteks dan diukur absorbansinya pada 725 nm.
Uji Daya Inhibisi Xantin oksidase
Uji daya inhibisi ekstrak kering pegagan, jahe, kumis kucing, dan kayu manis pada xantin oksidase mengacu pada penelitian Owen and Johns (1999) dengan modifikasi. Uji dilakukan dengan mengukur aktivitas enzim xantin oksidase dengan xantin sebagai substrat pada spektrofotometri. Larutan xantin (0.15 mM) dilarutkan pada buffer fosfat pH 7.8. Enzim xantin oksidase dipersiapkan dengan melarutkan ke dalam larutan buffer fosfat hingga didapat konsentrasi 0.1 unit/mL. Reaksi diawali dengan memasukkan sampel, buffer dan substrat xantin pada tabung reaksi. Dilakukan pra-inkubasi selama 10 menit. Setelah itu ditambahkan enzim xantin oksidase sebelum diinkubasi pada suhu 30oC selama 30 menit. Reaksi dihentikan menggunakan 1 mL larutan HCl 1N. Kontrol untuk masing-masing sampel juga dibuat seperti pembuatan sampel tetapi tanpa menggunakan enzim. Pengukuran aktivitas xantin menggunakan spektrofotometri pada panjang gelombang 281.5 nm. Daya hambat enzim xantin oksidase dihitung menggunakan (1 – B/A) x 100, dengan A adalah perubahan absorbansi blanko dan B adalah perubahan absorbansi sampel. Pada setiap analisis dibuat kontrol positif allupurinol sebagai pembanding.
HASIL DAN PEMBAHASAN
Persiapan Bahan Baku
13
fenolnya. Proses ekstraksi pegagan mengalami modifikasi karena rentang faktor yang ditentukan terlalu sempit. Kemudian dilakukanekstraksi menggunakan shaker yang berada dalam waterbath. Bahan baku pegagan dengan perbandingan dan pelarut yang sama diekstrak dalam waterbathshaker selama F dan G jam pada suhu HoC. Diuji pula ekstraksi dengan menggunakan pegagan kering dan segar. Salah satu kelebihan menggunakan bahan kering adalah mengurangi aktivitas air sehingga menekan pertumbuhan mikroba (Gupta et al. 2011). Selain itu, pengeringan daun juga dapat mengurangi volume penyimpanan dan mengurangi reaksi-reaksi yang dapat merusak bahan seperti hidrolisis maupun oksidasi lemak (Winarno 2008). Hasil pengukuran komponen fenol untuk pegagan segar dan kering ditunjukkan pada tabel berikut:
Terjadi penurunan jumlah komponen fenol pada pegagan kering yang diekstrak selama J jam. Hal ini diasumsikan karena faktor suhu berpengaruh terhadap total fenol, sehingga dilakukan percobaan ekstraksi selama J jam pada suhu H oC. Hasilnya menunjukkan kandungan fenol yang lebih rendah daripada hasil ekstraksi pada suhu L oC. Untuk melihat pengaruh suhu terhadap proses ekstraksi, maka dilakukan lagi ekstraksi selama J jam pada suhu M oC. Hal tersebut dilakukan untuk melihat apakah kandungan fenol menurun pada suhu tersebut. Jika total fenol menurun, maka faktor suhu dapat dijadikan variabel terkontrol pada suhu L oC dan jika total fenol lebih tinggi pada suhu M oC maka faktor suhu dijadikan perlakuan. Tabel 2 menunjukkan hasil analisis total fenol berdasarkan perlakuan suhu.
Tabel 2 Pengukuran Total Fenol Berdasarkan Perbedaan Suhu
Hasil analisis total fenol pada ekstrak percobaan suhu M oC menunjukkan kenaikan, sehingga suhu ekstraksi diujikan sebagai faktor optimasi proses.
Sampel
Tabel 1 Pengukuran Total Fenol Berdasarkan PerbedaanWaktu Ekstraksi dan Sampel yang Digunakan
Keterangan: data disamarkan
14
Analisis yang digunakan pada pengamatan dan pengukuran respon ini adalah kandungan senyawa fenolik. Meenakshi et al. (2009) dan Lim et al. (2002) menyatakan bahwa adanya hubungan antara total fenol dan aktivitas antioksidan. Umumnya di dalam suatu bahan konsentrasi senyawa fenol yang tinggi maka aktivitas antioksidan dalam bahan tersebut juga tinggi. Menurut Andayani et al. (2008), senyawa fenol yang memiliki aktivitas antioksidan biasanya memiliki gugus -OH dan -OR seperti flavonoid dan asam fenolat. Oktaviana (2010) juga menyatakan bahwa senyawa fenol bisa berfungsi sebagai antioksidan karena kemampuannya meniadakan radikal-radikal bebas dan radikal peroksida sehingga efektif dalam menghambat oksidasi lipida. Diharapkan dengan didapatkannya jumlah kandungan komponen fenolik menggambarkan aktivitas antioksidan dan inhibisi xantin oksidase secara kualitatif.
Ekstraksi menggunakan pelarut air dipilih karena lebih mudah didapat dan lebih aman jika mempertimbangkan ekstrak sebagai langkah awal pembuatan minuman fungsional. Perlu juga diperhatikan kehalalan ekstrak untuk konsumsi, sehingga dihindari penggunaan pelarut alkohol. Selain itu, menurut Suradikusumah (1989) senyawa fenol lebih mudah terekstrak dengan air karena sering terdapat bergabung dengan gula dan biasanya terdapat pada rongga sel.
Ekstraksi kayu manis menggunakan kayu manis kering dengan pelarut air. Perbandingan kayu manis dan air adalah 1:10. Kayu manis kering dimasukkan ke dalam air mendidih selama P dan Q menit sebagai perlakuan batas bawah dan batas atas. Setelah itu ekstrak disaring dan disimpan untuk dianalisis komponen fenolnya. Bahan baku jahe dan kumis kucing juga dilakukan percobaan ekstraksi. Kedua bahan baku ini diekstrak untuk mengidentifikasi karakteristik bahan baku dan kendala teknis di laboratorium.
Proses ekstraksi
Ekstraksi pegagan dan kayu manis menggunakan bahan baku yang telah dikeringkan. Pengeringan bahan baku dilakukan menggunakan oven pengering suhu 50oC selama 24 jam. Waktu yang relatif lama dan suhu rendah dipilih agar panas dari pengeringan tidak sampai merusak komponen bioaktif bahan baku.
Bahan baku pegagan kering dihaluskan dengan menggunakan blender. Ukuran dapat dipertimbangkan berdasarkan hasil daun pegagan kering, karena semakin kecil partikel semakin banyak daun kering yang menempel pada alat sehingga mengurangi hasil daun kering. Alat blender yang digunakan adalah blender rumah tangga biasa, sehingga dibutuhkan usaha untuk menyamakan ukuran, yaitu dilakukannya proses blender dengan waktu dan kecepatan yang sama. Rendemen yang dihasilkan untuk pengeringan daun pegagan sekitar 12%. Pada kayu manis kering batangan yang telah dikeringkan memiliki rendemen 66%.
15
lilin (Sudjadi 1986). Hasil ekstraksi kemudian disaring dan dipasteurisasi apabila tidak langsung dikeringkan dengan spraydryer.
Ekstraksi kayu manis menggunakan metode pemanasan dalam pelarut air. Suhu yang digunakan 95-97oC cukup tinggi sehingga waktu ekstraksi menjadi penentu hasil ekstrak. Ekstraksi kumis kucing menggunakan metode dekok yaitu merendam dalam air mendidih (95-97oC) selama A menit. Ekstraksi jahe tidak menggunakan bahan pelarut, melainkan dengan mengeluarkan cairan dari dalam jahe. Setelah semua ekstrak cair didapatkan, kemudian dilakukan persiapan proses pengeringan. Langkah pertama adalah homogenisasi ekstrak cair dengan bahan pengisi. Maltodekstrin adalah bahan pengisi yang dipilih karena dapat mengikat air yang akan membantu proses penguapan air dari ekstrak berlangsung lebih cepat. Proses pengeringan yang cepat sangat dibutuhkan untuk mencegah rusaknya komponen aktif karena kontak dengan suhu tinggi. Ekstrak kering yang telah disalut maltodekstin umumnya tidak cepat higroskopis, partikel lebih halus dan seragam serta komponen aktifnya terjaga. Penggunaan maltodekstrin dipilih karena mengalami proses disperse yang cepat, memiliki daya larut yang tinggi, mampu membentuk film, memiliki sifat higroskopis yang rendah, sifat browning rendah, mampu menghambat kristalisasi dan memiliki daya ikat yang kuat (Hui 1992).
Ekstrak kering yang didapatkan kemudian dilakukan analisis aktivitas antioksidan dan total fenol. Analisis daya inhibisi XOD dilakukan setelah didapatkan hasil optimasi berdasarkan respon antioksidan dan total fenol. Komponen fenol dan antioksidan yang tinggi mengarah kepada daya inhibisi XOD yang semakin besar.Kebanyakan senyawa penghambat enzim XOD adalah senyawa fenolik. Sementara peran aktivitas antioksidan dapat memperbaiki kondisi di dalam tubuh ketika terjadi hiperurisemia karena ketika pembentukan asam urat, terbentuk pula oksigen reaktif saat enzim berada dalam bentuk teroksidasi. Banyak faktor yang menyebabkan enzim berada dalam bentuk teroksidasi, salah satunya adalah sitokinesis dan berlebihnya jumlah substrat (xantin). Hiperurisemia dapat dicirikan dengan peningkatan oksigen reaktif dan menurunnya jumlah antioksidan (Many et al. 1996).
Optimasi Proses
Optimasi proses dengan RSM memilihkan nilai faktor terbaik sesuai dengan respon yang optimal. Kriteria yang diutamakan adalah kandungan total fenol yang maksimal. Paixa˜o et al. (2007) menyatakan bahwa kandungan total senyawa fenolik memiliki korelasi yang tinggi dengan aktivitas antioksidan.Selain itu, zat yang berperan sebagai inhibitor enzim xantin oksidase umumnya adalah komponen fenolik seperti kampferol, myricetin dan kuarsetin (Selloum et al. 2001).
16
mengoptimasi proses ekstraksi tersebut. Pada penelitian Mardhiyyah (2012) optimasi proses memiliki tujuan yang sama, yaitu untuk mendapatkan total fenol dan aktivitas antioksidan yang tinggi, sehingga proses optimasinya dapat dijadikan acuan dalam penelitian ini. Optimasi yang dilakukan untuk kumis kucing dan jahe pada penelitian ini adalah pada kondisi pengeringan. Rancangan percobaan dibuat menggunakan metode response surfacedengan bantuan software Design Expert7. Response Surface Methodology (RSM) adalah metode ekstensif yang digunakan untuk situasi dimana beberapa variable input berpotensi mempengaruhi respon atau kualitas dari sebuah proses (Carley et al. 2004). Cakupan RSM terdiri dari strategi eksperimental untuk mejelajah ruang-ruang proses atau variable bebas, statistika empiris modeling untuk mengembangkan perkiraan hubungan yang tepat antara hasil dan proses. Mengidentifikasi dan menyocokkan eksperimental data untuk menjadi model yang tepat diperlukan data statistika eksperimen, teknik permodelan regresi dan optimasi metode.Ketiga topik tersebut umumnya digabungkan dalam RSM. Desain yang digunakan dapat berupa D-optimal, Box-Behnken, ataupun Central Composite Design (CCD). Penentuan desain akan menentukan jumlah perlakuan yang dilakukan. Umumnya desain CCD memiliki perlakuan yang paling banyak karena desain ini juga menguji titik di luar batas yang disebut alfa. Nilai alfa tergantung pada karaktertistik yang diinginkan dan pada jumlah faktor yang diujikan.Desain box-Behnken adalah desain kuadratik independen yang tidak mengandung faktor yang terikat atau fraksi faktorial. Pada desain ini kombinasi perlakuan berada pada titik tengah dari ruang proses dan pada pertengahan. Desain ini memerlukan 3 level dari setiap faktor. Keterbatasan desain terletak pada orthogonal blocking jika dibandingkan dengan central composite design. Desain yang digunakan dalam penelitian ini adalah D-Optimal. Desain D-Optimal biasanya digunakan untuk meminimalkan rancangan faktorial. Desain D-Optimal yang akan menentukan poin atau perlakuan yang dilakukan. Desain D-Optimal dirancang untuk meminimalkan perlakuan umum dari koefisien regresi yang diramalkan. Desain ini langsung menuju optimasi berdasarkan criteria yang dipilih serta permodelan yang cocok. Rancangan percobaan untuk bahan baku pegagan berjumlah 25 perlakuan (Lampiran 2), untuk kayu manis 20 perlakuan (Lampiran 1), untuk kumis kucing dan jahe masing-masing 16 perlakuan (Lampiran 3). Jumlah ekstrak kering untuk dianalisis aktivitas antioksidan dan total fenolnya adalah 77 ekstrak kering.
17
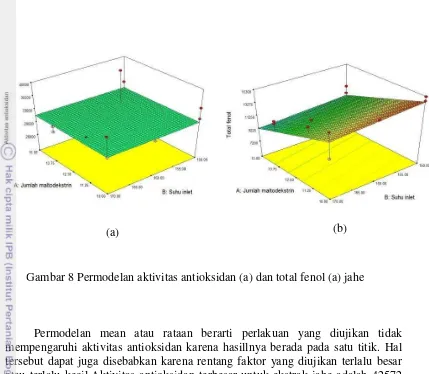
Hasil dari analisis respon antioksidan dan total fenol menunjukkan model data dari masing-masing bahan baku. Bahan baku pegagan memiliki model mean (rata-rata) untuk aktivitas antioksidan dan permodelan kuadratik dengan modifikasi untuk total fenol.
Gambar 6 Permodelan aktivitas antioksidan (a) dan total fenol (b) pegagan
Permodelan mean atau rataan berarti perlakuan yang diujikan tidak mempengaruhi aktivitas antioksidan karena hasillnya berada pada satu titik. Hal tersebut dapat juga disebabkan karena rentang faktor yang diujikan terlalu besar atau terlalu kecil. Sampel pegagan mengandung rata-rata aktivitas antioksidan sebesar 36866.67 ppm AEAC. Diduga komponen fenolik yang terekstrak pada pelarut air memiliki gugus hidroksil (-OH) yang jauh lebih sedikit dan lebih sulit untuk mendonorkan atom hidrogen (energi aktifasinya lebih tinggi). Gugus hidroksil (-OH) pada komponen antioksidan merupakan gugus yang berperan pada proses transfer elektron untuk menstabilkan radikal bebas. Semakin banyak gugus hidroksil yang dimiliki oleh komponen antioksidan maka semakin banyak elektron yang dapat didonorkan untuk menstabilkan radikal bebas. Hal tersebut mungkin menjadi penyebab nilai aktivitas antioksidan yang stagnan pada titik tertentu. Persamaan aktivitas antioksidan pegagan dari permodelan: Aktivitas antioksidan = +48662.5 Total komponen fenolik pada pegagan menunjukkan permodelan kuadratik dengan modifikasi. Hasil analisis ragam menunjukkan bahwa suhu ekstraksi dan jumlah maltodekstrin yang mempengaruhi total fenol. Suhu optimal untuk menghasilkan total fenol tertinggi sebesar 10027.72 ppm GAE adalah pada A oC. Pada suhu perlakuan dibawah B oC dan di atas C oC total fenol yang dihasilkan relatif rendah. Persamaan dari permodelan total fenol pegagan adalah :
Persamaan di atas menunjukkan bahwa peningkatan suhu ekstraksi dapat meningkatkan kandungan total fenol. Pada jumlah maltodekstrin yang semakin tinggi dapat menurunkan kandungan total fenol. Randhir R. et al. (2008) dalam penelitiannya menyebutkan bahwa proses pemanasan dapat membebaskan senyawa asam fenolik yang terdapat di dalam konstituen sel dan yang terlindungi oleh dinding sel tanaman. Pada suhu yang relatif rendah, energi panas yang
18
diberikan belum cukup untuk dapat mendenaturasi dinding sel tanaman dan membebaskan senyawa fenolik yang terperangkap di dalamnya. Energi panas tersebut dapat mempercepat terjadinya reaksi oksidasi senyawa fenolik yang ada sehingga mengakibatkan kerusakan senyawa fenolik. Energi panas yang diberikan tidak bisa terlalu rendah atau terlalu panas karena keduanya dapat menyebabkan rendahnya komponen fenolik yang terekstrak.
Kayu manis memiliki permodelan mean (rata-rata) untuk aktivitas antioksidan. Sementara untuk total fenol kayu manis, data menunjukkan permodelan kuadratik, seperti pada gambar berikut:
Gambar 7 Permodelan aktivitas antioksidan (a) dan total fenol (b) kayu manis Permodelan mean atau rataan berarti perlakuan yang diujikan tidak mempengaruhi aktivitas antioksidan karena hasillnya berada pada satu titik. Hal tersebut dapat juga disebabkan karena rentang faktor yang diujikan terlalu besar atau terlalu kecil. Persamaan dari permodelan total fenol kayu manis:
Dengan a=waktu ekstraksi, b=jumlah maltodekstin, dan c=suhu inlet.
Semakin lama waktu ekstraksi dan semakin rendah kandungan maltodekstrin akan menghasilkan total komponen fenol yang paling tinggi. Hal ini sesuai dengan literatur yang menyatakan bahwa panas dapat membantu melepaskan komponen fenolik yang berada dalam sel tanaman (Randhir et al. 2008). Berdasarkan hasil optimasi didapatkan nilai tertinggi untuk total fenol adalah sebesar 22940.59 ppm GAE. Aktivitas antioksidan terbaik yang didapatkan adalah sebesar 65200 ppm AEAC.
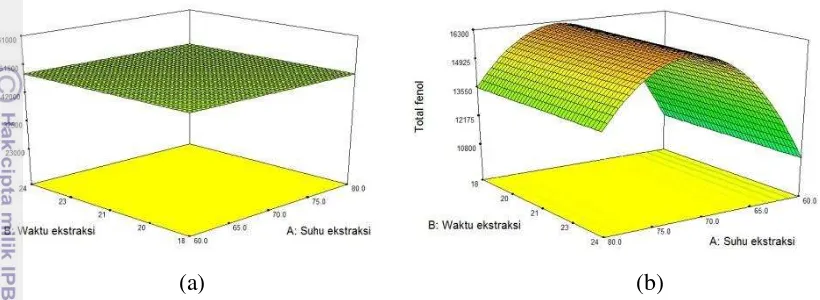
Ekstrak jahe menunjukkan permodelan rataan untuk aktivitas antioksidan dan permodelan linear untuk total fenol. Gambar permodelan 3 dimensi dapat dilihat di bawah ini:
19
Permodelan mean atau rataan berarti perlakuan yang diujikan tidak mempengaruhi aktivitas antioksidan karena hasillnya berada pada satu titik. Hal tersebut dapat juga disebabkan karena rentang faktor yang diujikan terlalu besar atau terlalu kecil.Aktivitas antioksidan terbesar untuk ekstrak jahe adalah 42572 ppm AEAC. Total fenol pada jahe dapat ditunjukkan melalui persamaan linear berikut :
Dengan a= jumlah maltodekstrin dan b=suhu inlet.
Persamaan permodelan total fenol di atas menunjukkan bahwa semakin tinggi jumlah maltodekstrin maupun suhu inlet maka akan semakin rendah total komponen fenolik. Banyaknya kandungan maltodekstrin akan mengurangi jumlah ekstrak bahan baku sehingga kandungan total fenol ekstrak tersebut menurun. Suhu inlet yang terlalu tinggi dapat merusak komponen aktif yang berada dalam ekstrak. Hasil tertinggi untuk kandungan total fenol jahe adalah sebesar 9807.92 ppm GAE.
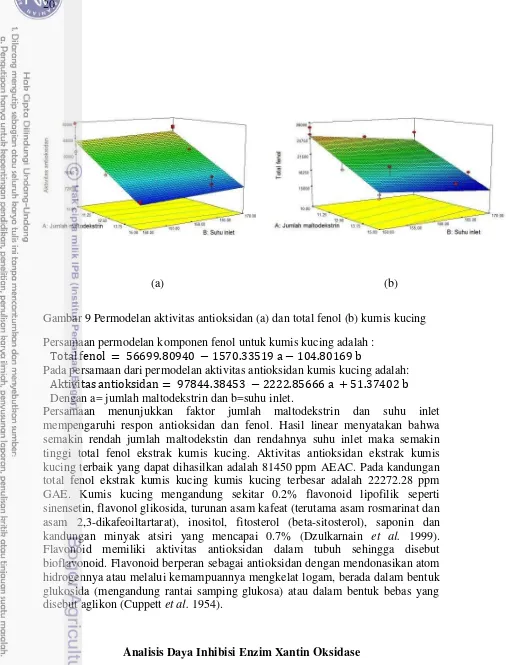
Ekstrak kumis kucing menunjukkan hasil permodelan linear untuk aktivitas antioksidan dan total fenol. Permodelan 3 Dimensi dapat dilihat di bawah ini:
Gambar 8 Permodelan aktivitas antioksidan (a) dan total fenol (a) jahe
20
Gambar 9 Permodelan aktivitas antioksidan (a) dan total fenol (b) kumis kucing Persamaan permodelan komponen fenol untuk kumis kucing adalah :
Pada persamaan dari permodelan aktivitas antioksidan kumis kucing adalah:
Dengan a= jumlah maltodekstrin dan b=suhu inlet.
Persamaan menunjukkan faktor jumlah maltodekstrin dan suhu inlet mempengaruhi respon antioksidan dan fenol. Hasil linear menyatakan bahwa semakin rendah jumlah maltodekstin dan rendahnya suhu inlet maka semakin tinggi total fenol ekstrak kumis kucing. Aktivitas antioksidan ekstrak kumis kucing terbaik yang dapat dihasilkan adalah 81450 ppm AEAC. Pada kandungan total fenol ekstrak kumis kucing kumis kucing terbesar adalah 22272.28 ppm GAE. Kumis kucing mengandung sekitar 0.2% flavonoid lipofilik seperti sinensetin, flavonol glikosida, turunan asam kafeat (terutama asam rosmarinat dan asam 2,3-dikafeoiltartarat), inositol, fitosterol (beta-sitosterol), saponin dan kandungan minyak atsiri yang mencapai 0.7% (Dzulkarnain et al. 1999). Flavonoid memiliki aktivitas antioksidan dalam tubuh sehingga disebut bioflavonoid. Flavonoid berperan sebagai antioksidan dengan mendonasikan atom hidrogennya atau melalui kemampuannya mengkelat logam, berada dalam bentuk glukosida (mengandung rantai samping glukosa) atau dalam bentuk bebas yang disebut aglikon (Cuppett et al. 1954).
Analisis Daya Inhibisi Enzim Xantin Oksidase
Metode analisis xantin yang umum digunakan adalah dengan mengukur kandungan xantin yang tersisa dan mengukur jumlah asam urat yang terbentuk. Perbedaan dari kedua metode tersebut yang paling mendasar adalah panjang
21
gelombang pada pengukuran spektrofotometri. Merujuk pada penelitian Owen dan Johns (1999), analisis inhibisi mengukur jumlah asam urat yang dihasilkan dari reaksi substrat dengan enzim. Adanya sampel diasumsikan akan menghambat kerja enzim sehingga asam urat yang dihasilkan semakin sedikit, begitu pula dengan nilai absorbansi yang semakin kecil. Kontrol sampel dibuat sebagai koreksi serapan, apabila dari kandungan sampel itu sendiri dapat mengganggu serapan di spektrofotometri. Nilai absorbansi yang dimasukkan ke dalam perhitungan adalah nilai aktivitas enzim yang sesungguhnya, yaitu dengan menghitung selisih sampel dan kontrol sampel serta blanko dan kontrol blanko.
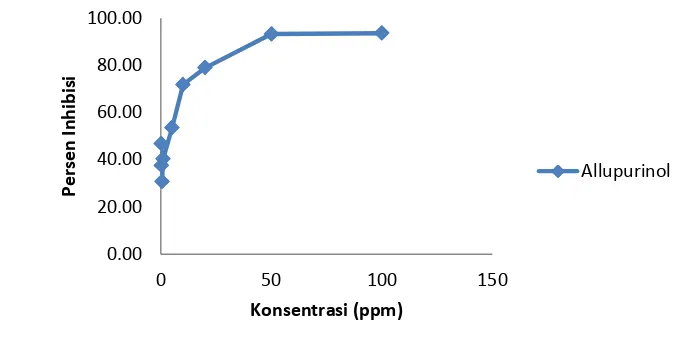
Pada penelitian awal menentukan metode analisis inhibisi XOD dilakukan pengujian pada allupurinol di beberapa konsentrasi. Tujuan dari hal tersebut adalah untuk mengetahui kerja enzim XOD dengan melihat tren data yang terbentuk. Tabel data analisis inhibisi xantin oksidase pada allupurinol dapat dilihat pada Lampiran 10.
Gambar 10 Kurva Inhibisi Xantin Oksidase pada Allupurinol
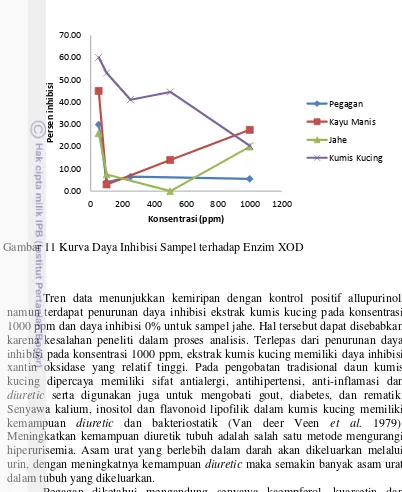
Bahan baku yang telah teroptimasi dianalisis daya inhibisi xantin oksidasenya. Metode yang digunakan sama seperti analisis yang dilakukan pada allupurinol. Masing-masing bahan baku diuji pada konsentrasi 50 – 1000 ppm. Sampel dilarutkan ke dalam buffer pH 7.8.Setiap analisis dibuat kontrol positif sebagai acuan. Hasil analisis (Gambar 11) menunjukkan keempat bahan baku memiliki daya inhibisi xantin oksidase terbaik pada konsentrasi 50 ppm. Inhibisi tertinggi oleh ekstrak kumis kucing sebesar 60%, kemudian ekstrak kayu manis (45%), ekstrak pegagan (30%) dan terakhir jahe (26%). Hasil yang didapat sesuai dengan penelitian Owen dan Johns (1999) yang menyatakan bahwa frekuensi penghambatan enzim xantin oksidase oleh tanaman yang diuji relatif tinggi, tetapi kebanyakan memiliki efek yang relatif rendah pada enzim. Rata-rata daya inhibisi dari ekstrak tanaman adalah 24.89% pada konsentrasi 100mg/mL.
22
Tren data menunjukkan kemiripan dengan kontrol positif allupurinol, namun terdapat penurunan daya inhibisi ekstrak kumis kucing pada konsentrasi 1000 ppm dan daya inhibisi 0% untuk sampel jahe. Hal tersebut dapat disebabkan karena kesalahan peneliti dalam proses analisis. Terlepas dari penurunan daya inhibisi pada konsentrasi 1000 ppm, ekstrak kumis kucing memiliki daya inhibisi xantin oksidase yang relatif tinggi. Pada pengobatan tradisional daun kumis kucing dipercaya memiliki sifat antialergi, antihipertensi, anti-inflamasi dan diuretic serta digunakan juga untuk mengobati gout, diabetes, dan rematik. Senyawa kalium, inositol dan flavonoid lipofilik dalam kumis kucing memiliki kemampuan diuretic dan bakteriostatik (Van deer Veen et al. 1979). Meningkatkan kemampuan diuretik tubuh adalah salah satu metode mengurangi hiperurisemia. Asam urat yang berlebih dalam darah akan dikeluarkan melalui urin, dengan meningkatnya kemampuan diuretic maka semakin banyak asam urat dalam tubuh yang dikeluarkan.
Pegagan diketahui mengandung senyawa kaempferol, kuarsetin dan glikosida lainnya (Barnes 2002). Kaempferol dan kuarsetin memiliki kemampuan menghambat kerja enzim xantin oksidase (Selloum et al. 2001). Pada penelitian Lio et al. (1984) kaempferol dan kuarsetin memiliki daya inhibisi xantin oksidase sebesar 85 dan 90% pada konsentrasi 50 mg/mL. Kulit batang kayu manis mengandung minyak atsiri, saponin dan flavonoida. Selain itu terdapat juga tannin, dan daunnya mengandung alkaloid dan polifenol (Anonim 2005). Flavonoid, fenol, tannin, serta kumarin telah diteliti berpotensi menjadi penghambat enzim xantin oksidase (Chang dan Chiang 1995). Kandungan tannin tersebut yang diduga menyebabkan besarnya daya hambat ekstrak kayu manis terhadap enzim xantin oksidase. Kandungan flavonoid pada jahe diduga menjadi penghambat kerja enzim xantin oksidase. Rimpang jahe diketahui mengandung minyak atsiri 0.25-3.3% yang terdiri dari zingiberene, curcumene, philandren. Selain itu Gambar 11 Kurva Daya Inhibisi Sampel terhadap Enzim XOD
0.00
0 200 400 600 800 1000 1200
23
terdapat pula oleoresin sebanyak 4.3-6.0% yang terdiri dari gingerols dan shogaols (Sutarno et al. 1999).
Terdapat korelasi positif antara total fenol dan tannin terhadap inhibisi XOD (Owen dan Johns 1999), tetapi tidak semua tanaman menunjukkan korelasi positif. Inhibisi XOD ditentukan oleh berbagai faktor. Meskipun terdapat ragam korelasi antara total fenol dan inhibisi XOD, secara umum Owen dan Johns (1999) menyatakan bahwa total fenol dan tannin pada ekstrak tanaman berperan penting dalam kontribusi penghambatan enzim XOD. Beberapa komponen fenolik, kebanyakan flavonoid, dilaporkan sebagai inhibitor enzim XOD (Noro et al. 1983; Iio et al. 1985; Hatano et al. 1989; Chang et al. 1993).
SIMPULAN DAN SARAN
Simpulan
Proses ekstraksi yang optimal untuk pegagan adalah diesktrak dalam waterbath shaker selama A jam pada suhu B oC dengan C % maltodekstrin sebagai bahan pengisi dan suhu inlet pengeringan semprot D oC. Aktivitas antioksidan terbesar untuk pegagan adalah sebesar 36866.67 ppm AEAC dan untuk total fenol sebesar 10027.72 ppm GAE. Proses ekstraksi yang optimal untuk kayu manis adalah dididihkan selama E menit kemudian dikeringkan dengan campuran F % maltodekstrin pada suhu inlet G oC. Aktivitas antioksidan terbesar untuk kayu manis adalah sebesar 65200 ppm AEAC dan untuk total fenol sebesar 22940.59 ppm GAE. Kondisi pengeringan optimal untuk bahan baku kumis kucing dan jahe adalah dengan campuran maltodekstrin H % dan suhu inlet pengeringan semprot I oC. Aktivitas antioksidan terbesar untuk kumis kucing adalah sebesar 81450 ppm AEAC dan untuk total fenol sebesar 22272.28 ppm GAE. Aktivitas antioksidan terbesar untuk jahe adalah sebesar 42572 ppm AEAC dan untuk total fenol sebesar 9807.92 ppm GAE. Daya inhibisi enzim xantin oksidase untuk ekstrak pegagan teroptimasi adalah 30 %, ekstrak kumis kucing teroptimasi 60 %, ekstrak kayu manis teroptimasi 45 %, dan ekstrak jahe teroptimasi 26 %.
Catatan :
Informasi data yang disamarkan bisa diperoleh melalui: Prof. C. Hanny Wijaya, M. Agr (hazemi@indo.net.id)
Saran
24
DAFTAR PUSTAKA
Andayani R, Lisawati Y, Maimunah. 2008. Penentuan aktivitas antioksidan, kadar fenolat total dan likopen pada buah tomat (Solanum lycopersicum L). Jurnal Sains dan Teknologi Farmasi.13(1): 1-9.
Anonim. 2005. Kayu Manis (padang). http : //www.PortalIPTEK.net.
BarnesJ,Andereson LA, danPhillipson JD. 2002. Herbal Medicines. London (UK): Second Edition. Pharmaceutical Press.
Benjelalai. 1984. Pengantar ilmu pangan; Nutrisi dan Mikrobiologi. Yogyakarta (ID): Gadjahmada University Press.
Cahyono DT. 1995. Aktivitas Antioksidan dari Daun Sirih (Piper betle L.) [skripsi]. Bogor (ID) : Institut PertanianBogor.
Carley KM, Kamneva NY, Reminga J. 2004.Response surface methodology.CASOS Technical Report.CMU-ISRI-04-136.
Chang WS, Chiang HC. 1995. AnticancerResearch. 15, 5B: 1969-1974.
Chang WS, Lee YJ, Lu FJ, Chiang HC. 1993. Inhibitory effects of flavonoids on xanthine oxidase. Anti-cancer Research 13, 2165-2170.
Cos P, Ying L, Calomme M, Hu JP, Cimanga K, Van Poel B, Pieters L, Vietinck AJ, Vanden Berghe D. 1998. Structure-activity relationship and classification of flavonoids as inhibitors of xanthine oxidase and superoxide scavengers.Journal of Natural Product. 61: 71-76.
Cuppett S, Schrepf M, Hall C. 1954. Natural Antioxidant – Are They Reality. Di dalam Foreidoon Shahidi: Natural Antioxidants, Chemistry, Health Effect and Applications, AOCS Press. Illinois: 12-24.
Dalimartha S. 2000. Atlas Tumbuhan Obat Indonesia.Volume ke-2. Jakarta (ID): Trubus Agriwidya.
[Depdikbud] Departemen Pendidikan dan Kebudayaan. 1996. Kamus Besar Bahasa Indonesia. Jakarta (ID): Balai Pustaka.
Darusman LK,Purwakusumah ED,Kumalaputri EI, Gulamahdi M, Siswoyo, dan Iswantini D. 2003. Pola Pengembangan biofarmaka dalam konsep regional.Buku panduan seminar nasional tumbuhan obat Indonesia XXIV.Kelompok Kerja Nasional Tumbuhan Obat Nasional dan Pusat Studi Biofarmaka Lembaga Penelitian IPB. Bogor. 47hal.
Dzulkarnain BL, Widowati A, Isnawati, Thijssen HJC. 1999. Orthosiphon aristatus (blume)Miq. Di dalam: LS de Padua, Bunyapraphatsara N, Lemmens RHMJ (Ed). Medicinal and Poisonous Plants 1.Plant Resources of South-East Asia (PROSEA) Foundation.
Gupta S, Cox S, Ghannam NA. 2011. Effect of different drying temperatures on the moisture and phytochemical constituents of edible Irish brown seaweed. Journal of Food Science and Technology.44: 1266-1272.
25
glisoflavone, and inhibitory effects of licorice phenolics on xanthine oxidase.Chemical and Pharmaceutical Bulletin 37, 3005-3009.
Heyne, 1987.Tumbuhan Berguna Indonesia.Badan Penelitian dan Pengembangan Kehutanan. Departemen Kehutanan. Yayasan Sarana Wana Jaya, Jakarta. Hidayat B, Adil B, Sugiono. 2002. Karakterisasi maltodekstrin DP 3-9 serta
kajian potensi penggunaannya sebagai sumber karbohidrat pada minuman olahraga. Jurnal Teknologi Industri Pangan Vol XIV(1): 51-58.
Ho CT, Lee CY, dan Huang MT. 1992, Phenolic Compounds in Food and Their Effects on Health I : Analysis, Occurrence, and Chemistry. Washington DC (US): American Chemical Society.
Hui YH. 1992. Dextrin. Encyclopedia of Food Science and Technology Vol. I.New York (US): John Wiley and Sons, Inc.
Iio M, Moriyama A, Matsumoto Y, Takaki N, Fukumoto M. 1985. Inhibition of xanthine oxidase by flavonoids by folate compounds and amethopterin.Journal of Biological Chemistry 259, 12-15.
Indariani S. 2011. Aktivitas Antihiperglikemik Minuman Fungsional berbasis Ekstrak Daun Kumis Kucing (Orthosiphon aristatus BI.Miq) pada Mencit Hiperglikemik yang Diindukasi dengan Streptozotocin [Tesis]. Bogor (ID): : Program Studi Ilmu Pangan Sekolah Pascasarjana, Institut Pertanian Bogor. Iswantini D, Darusman LK. 2003. Effect of Sidaguri Extract as an Uric Acid
Lowering Agent on the Activity of Xanthine Oxidase Enzyme. Proceeding of International Symposium on Biomedicines. Biopharmaca Research, Bogor Agricultural University.
King RA. 2000. The Role of Poluphenol in Human Health. Di dalam Brooker JD (ed). Tannins in Livestock and Human Nutrition.ACIAR Proceedings No. 92. Kong LD, Cai Y, Huang WW, Cheng CH dan Tan RX. 2000. Inhibition of
xanthine oxidase by some Chinese medicinal plants used to treat gout. Journal of Ethnopharmacology. 73: 192-207.
Koswara, S. 1995. Jahe dan Hasil Olahannya.Jakarta (ID): Pustaka Sinar Harapan. Krisnatuti, Diah. 2008.Perencana Menu untuk Penderita Gangguan Asam Urat.
Jakarta (ID): Penebar Swadaya.
Lim SN, Cheung PK, Ooi VEC, Ang PO. 2002. Evaluation of antioxidative activity of extracts from a brown seaweed, Sargassum siliquastrum.Journal of Tropical Medicine.3:898-901.
Many A, Hubel CA, Roberts JM. 1996. The pathophysiologic mechanisms of preeclampsia as a source of increased uric acid production. American Journal of Obstetrics and Gynecology.Vol. 174: 288-291.
26
Meenakshi S, Gnanambigai DM, Mozhi ST, Arumugam M, Balasubramanian T. 2009. Total Flavonoid and in vitro antioxidant activity of two seaweeds of Rameshwaram Coast. Global Journal of Pharmacology.3(2): 59-62.
Milian. 2004. Reactive Oxygen Species (ROS) Generation Inhibited by Aporphine and Phenanthrene Alkaloids Semi-Synthesized from Natural Boldine. Chemistry Pharmaceutical Bulletin.(6): 696-699.
Molyneux, P. 2004. The use of the stable free radical diphenylpicryl-hydrazyl (DPPH) for estimating antioxidant activity.SongklanakarinJournal of Science Technology Vol. 26 (2): 211-219.
Noro T, Oda Y, Miyase T, Ueno A, Fukushima S. 1983.Inhibitors of xanthine oxidase from the flowers and buds of Daphne genkwa.Chemical and Pharmaceutical Bulletin 31: 3984-3987.
Oktaviana PR. 2010. Kajian kadar kurkuminoid, total fenol dan aktivitas antioksidan ekstrak temulawak (Curcuma xanthorriza) pada berbagai teknik pengeringan dan proporsi pelarutan [skripsi]. Surakarta (ID): Fakultas Pertanian, Universitas Sebelas Maret.
Owen PL, Johns Timothy. 1999. Xanthine oxidase inhibitory activity of Northeastern North American plant remedies used for gout. Elsevier Journal of Ethnopharmacology. 64 (1999) 149-160.
Paixa~o N, Perestrelo R, Marques, Jose’ C, Camara, Jose’ S. 2007. Relationship Between Antioxidant Capacity and Total Phenolic Content of Red Rose and White Wines. Journal of Food Chemistry. 105: 204-214.
Purseglove JW. Brow EG. Green CL. Dan Robbins SRJ. 1981. Spices Vol. II.London (UK): Longman.
Randhir R, Kwon Y, Shetty K. 2008. Effect of Thermal Processing on Phenolics, Antioxidant Activity and Health-Relevant Functionality of Select Grain Sprouts and Seedlings.Journal of Innovative Food Science and Emerging Technology. 9: 355-364.
Rismunandar dan Paimin FB. 2001. Kayu Manis : Budidaya dan Pengolahan. Jakarta (ID): Penebar Swadaya.
Safithri M, Fahma F. 2008. Potency of Piper crocatum decoction as an antihiperglycemia in rat strain Sprague dawley.Hayati Journal ofBioscience 15(1):45-48.
Schmeda-Hirschmann G, Zuniga J, Duta-Behrens M, Habermehl G. 1996. Xanthine Oxidase Inhibitory Activity of Flavonoids and Tannins from Hexachlamys edulis(Myrtaceae).Phytoteraphy Research. Vol. 10.260-262. Selloum L, Reichl S, Müller M, Sebihi L, Arnhold J. 2001. Effects of flavonols on
the generation of superoxide anion radicals by xanthine oxidase and stimulated neutrophils.Archives of Biochemistry and Biophysics 395 (1): 49– 56.doi:10.1006/abbi.2001.2562.
27
Budidaya Tanaman Obat.Badan Penelitian dan Pengembangan Pertanian Pusat Penelitian dan Pengembangan Tanaman Industri. Bogor. 204hal.
Sudjadi. 1986. Metode Pemisahan.Yogyakarta (ID): UGM Press.
Suradikusumah E. 1989. Kimia Tumbuhan. Bogor (ID): Pusat Antar Universitas Ilmu Hayat IPB.
Sutarno H, Hadad EA, Brink M. 1999.Zingiber officinale Roscoe. Di dalam: CC de Guzman, Siemonsma JS (Eds.). Spices. Plant Resources of South-East Asia (PROSEA) Foundation No. 13: 238-244.
Strycharz S dan Shetty K. 2002.Effect of Agrobacterium rhizogenes on phenolic content of Menthapulegium alite clonal line for phytomedition applications.Journal of Process Biochemistry 38:287-293.
Syukur, C dan Hernani. 2002. Budidaya Tanaman Obat Komersial. Jakarta (ID): Penebar Swadaya
Taekuchi TM, Pereira CG, Braga MEM, Marostica MR, Leal PF, Meireles MAA. 2009. Low-Pressure Solvent Extraction (Solid-liquid extraction, Microwaved Assisted and Ultrasound Assisted) from Condimentary Plants. In:Meireles MAA (ed). Extracting Bioactive Compounds for Food Products: Theory and Applications.New York (US): CRC Press.
Utami, Prapti. (2004).Terapi Jus untuk Rematik dan Asam Urat.Jakarta (ID): AgromediaPustaka
Van deer Veen X, Makubard Th M, Zwazing JH. 1979. Pharmaceutisch Weekblad. Voigt R. 1994. Buku Pelajaran Teknologi Farmasiedisi V. Yogyakarta (ID):
Gajah Mada University Press.
28
LAMPIRAN
Lampiran 1 RancanganPercobaan RSM Kumis Kucing dan Jahe Lampiran 2 Rancangan Percobaan RSM Kayu Manis
29
Lampiran 4 Kurva Standar Asam Galat (Total Fenol)
0 0.075
Lampiran 3 Rancangan Percobaan RSM Pegagan
30
Lampiran 5 Kurva Standar Asam Askorbat (Antioksidan)
Lampiran 6 Hasil Optimasi Pegagan
31
Lampiran 7 Hasil Optimasi Kumis Kucing
Lampiran 8 Hasil Optimasi Kayu Manis *
*
* *
* * * * * * * *
* * * * * * * *
* * * * * * * * *
* *
* * *
* *
32
Lampiran 9 Hasil Optimasi Jahe
Lampiran 10 Tabel Kontrol Positif Allupurinol
Allu (0.1) 0,243 0,228 0,161 41,43 52,14 46,79
Allu (0.2) 0,220 0,225 0,135 39,29 35,71 37,50
Allu (0.5) 0,233 0,235 0,137 31,43 30,00 30,71
Allu (1) 0,232 0,223 0,144 37,14 43,57 40,36
Allu (5) 0,218 0,218 0,153 53,57 53,57 53,57
Allu (10) 0,195 0,194 0,155 71,43 72,14 71,79
Allu (20) 0,194 0,199 0,167 80,71 77,14 78,93
Allu (50) 0,192 0,183 0,178 90,00 96,43 93,21
Allu (100) 0,222 0,230 0,217 96,43 90,71 93,57
Blanko 0,275 0,135
Kontrol Sampel Sampel
(ppm) Abs 1 Abs 2
% inhibisi 1
% inhibisi 2
Rata-rata % inhibisi *
* * *
* *
* *
* *
33
Lampiran 11 Tabel Hasil Analisi Daya Inhibisi Xantin Oksidase Sampel
Sampel Konsentrasi Abs 1 Abs 2 Kontrol sampel
% inhibisi
1
% inhibisi
2
Rata2 % inhibisi
Pegagan 50 0.257 0.234 0.165 28.75 31.00 29.88
100 0.253 0.253 0.157 4.00 4.00 4.00
250 0.262 0.269 0.172 10.00 3.00 6.50
1000 0.332 0.327 0.235 3.00 8.00 5.50
Kayu manis
50 0.226 0.222 0.169 43.00 47.00 45.00
100 0.256 0.25 0.156 0.00 6.00 3.00
500 0.273 0.293 0.197 24.00 4.00 14.00
1000 0.321 0.316 0.246 25.00 30.00 27.50
Jahe 50 0.232 0.222 0.153 21.00 31.00 26.00
100 0.287 0.21 0.156 -31.00 46.00 7.50
500 0.291 0.293 0.19 -1.00 -3.00 0.00
1000 0.351 0.323 0.257 6.00 34.00 20.00
Kumis kucing
50 0.194 0.228 0.171 77.00 43.00 60.00
100 0.231 0.231 0.184 53.00 53.00 53.00
250 0.249 0.259 0.195 46.00 36.00 41.00
500 0.275 0.276 0.22 45.00 44.00 44.50
1000 0.383 0.33 0.256 20.31
Allupurinol 50 0.204 0.191 87.00
34
Lampiran 12 Hasil Verifikasi Antioksidan dan Total Fenol Keempat Bahan Baku (Pegagan, jahe, kumis kucing, dan kayu manis)
Pegagan
Jahe
Kumis Kucing
Kayu Manis
Response Prediction SE Mean 95% CI low 95% CI high SE Pred 95% PI low 95% PI high Verifikasi
Total fenol 13922.12 848.00 12158.61 15685.64 2290.29 9159.21 18685.03 10027.72
Aktivitas antioksidan 48662.50 1851.98 44840.20 52484.80 9443.29 29172.52 68152.48 36866.67
Response Prediction SE Mean 95% CI low 95% CI high SE Pred 95% PI low 95% PI high Verifikasi
Total fenol 12741.84 422.34 11829.42 13654.26 1478.22 9548.34 15935.33 9807.92
Aktivitas antioksidan 31447.40 881.67 29568.15 33326.64 3635.24 23699.07 39195.72 42575.00
Response Prediction SE Mean 95% CI low 95% CI high SE Pred 95% PI low 95% PI high Verifikasi Total fenol 21960.30 433.89 21022.94 22897.66 1518.62 18679.52 25241.08 22272.28 Aktivitas antioksidan 79959.65 707.94 78430.25 81489.06 2477.80 74606.69 85312.61 81450.00
Response Prediction SE Mean 95% CI low 95% CI high SE Pred 95% PI low 95% PI high Verifikasi aktivitas antioksidan 57256.25 5057.64 46670.49 67842.01 23177.00 8746.22 105766.28 65200.00 total fenol 9797.05 1512.54 6426.90 13167.20 2948.33 3227.75 16366.35 22940.59
35
RIWAYAT HIDUP
Penulis bernama lengkap Sarah Lubna, lahir di Jakarta 20 Agustus 1991 dari ayah Salim dan ibu Vera Farhana, sebagai putri pertama dari tiga bersaudara. Penulis mengawali jenjang pendidikannya di TK Islam Al-Kahfi pada tahun 1995-1997, kemudian melanjutkan pendidikan ke SDS Kartika XII-2 pada tahun 1997-2003, SMPN 20 Jakarta pada tahun 2003-2006, dan SMAN 14 Jakarta pada tahun 2006-2009. Penulis masuk sebagai mahasiswa IPB melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) pada mayor Ilmu dan Teknologi Pangan (ITP). Penulis dapat dihubungi melalui email sarah.lubna@yahoo.com.
Selama mengikuti perkuliahan, penulis aktif pula dalam Himitepa dan Forum Bina Islami Fateta (FBI Fateta) sebagai staf Informasi dan Komunikasi (IVO). Penulis melakukan penelitian yang berjudul PengembanganMinuman Fungsional Berbasis Daun Pegagan (Centella asiatica) dengan Aktivitas Anti-Hiperurisemia : Optimasi Proses Ekstraksi Bahan Baku Minuman Fungsional sebagai tugas akhir, dibawah bimbingan Prof. C. Hanny Wijaya, M. Agr dan Dr. Ir. Budi Nurtama, M. Agr.