ISOLASI DAN SELEKSI BAKTERI PENAMBAT NITROGEN
DAN PENGHASIL
INDOLE-3-ACETIC ACID
ASAL SAMPEL
TANAH DARI JAMBI INDONESIA
ISMI ISTI’ANAH
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi dan Seleksi Bakteri Penambat Nitrogen dan Penghasil Indole-3-Acetic Acid Asal Sampel Tanah dari Jambi Indonesia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
ISMI ISTI’ANAH. Isolasi dan Seleksi Bakteri Penambat Nitrogen dan Penghasil
Indole-3-Acetic Acid Asal Sampel Tanah dari Jambi Indonesia. Dibimbing oleh NISA RACHMANIA MUBARIK dan ARIS TJAHJOLEKSONO.
Mikrob yang terdapat di dalam tanah memainkan peranan penting dalam produktivitas tanaman, terutama dalam proses penambatan nitrogen bebas di alam dan menghasilkan substansi zat pemacu tumbuh seperti Indole-3-Acetic Acid (IAA) eksogen. Kedua ciri tersebut diperlukan untuk memacu pertumbuhan tanaman. Penelitian ini bertujuan mengisolasi dan menyeleksi bakteri penambat nitrogen dan penghasil IAA asal sampel tanah di Taman Nasional Bukit Dua Belas (TNBD) Jambi. Isolasi dilakukan pada 17 sampel tanah yang diambil dari daerah rhizosfer tanaman kelapa sawit. Media yang digunakan untuk isolasi ialah media semisolid Nitrogen Free Bromthymol Blue (NfB). Isolat yang dipilih merupakan isolat yang dapat membentuk pelikel berwarna putih pada permukaan media semisolid tersebut dan mampu mengubah warna media dari hijau menjadi biru karena terjadi peningkatan pH. Isolasi menghasilkan sepuluh isolat terpilih yang kemudian diidentifikasi morfologinya. Identifikasi morfologi koloni dan sel menghasilkan lima isolat. Isolat yang menunjukkan pertumbuhan yang baik yaitu isolat A13.1 yang diidentifikasi sebagai Pseudomonas luteola dengan menggunakan KIT API 20 NE. Isolat A13.1 menghasilkan IAA eksogen tertinggi pada waktu inkubasi hari ke-5 di media NfB. Konsentrasi IAA yang terukur sebesar 33,88 ppm.
Kata kunci: IAA (Indole-3-Acetic Acid), mikrob, nitrogen, Nitrogen Free Bromthymol Blue (NfB), rhizosfer
ABSTRACT
ISMI ISTI’ANAH. Isolation and Selection of Nitrogen-Fixing and Producing Indole-3-Acetic Acid Bacteria from Soil Samples of Jambi Indonesia. Supervised by NISA RACHMANIA MUBARIK and ARIS TJAHJOLEKSONO.
luteola using KIT API 20 NE. The.isolate produced maximum exogenous IAA at 5 days incubation at medium NfB. The amount of IAA was 33.88 ppm.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
ISOLASI DAN SELEKSI BAKTERI PENAMBAT NITROGEN
DAN PENGHASIL
INDOLE-3-ACETIC ACID
ASAL SAMPEL
TANAH DARI JAMBI INDONESIA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi dan Seleksi Bakteri Penambat Nitrogen dan Penghasil Indole-3-Acetic Acid Asal Sampel Tanah dari Jambi Indonesia Nama : Ismi Isti’anah
NIM : G34100036
Disetujui oleh
Dr Nisa Rachmania Mubarik, MSi Pembimbing I
Dr Ir Aris Tjahjoleksono, DEA Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
PRAKATA
Alhamdulillahirabbil’alamiin. Puji syukur kehadirat Allah SWT atas limpahan rahmat dan karunia-Nya, sehingga saya dapat menyelesaikan karya ilmiah yang berjudul Isolasi dan Seleksi Bakteri Penambat Nitrogen dan Penghasil Indole-3-Acetic Acid Asal Sampel Tanah dari Jambi Indonesia. Terhitung dari bulan Oktober 2013-Juni 2014 di Laboratorium Mikrobiologi, Departemen Biologi IPB.
Terima kasih penulis ucapkan kepada Ibu Dr Nisa Rachmania Mubarik, MSi dan Bapak Dr. Aris Tjahjoleksono, DEA selaku pembimbing yang telah memberikan pengarahan dan dukungan materi selama penelitian dan penyusunan skripsi. Ucapan terima kasih disampaikan pula kepada Ibu Dra Hilda Akmal, M.Si selaku penguji, atas saran dan diskusi yang diberikan. Tak lupa juga penulis ucapkan terima kasih kepada Mba Eja, Kak Asril, Syifa, Suri, Rastya, Yuli, Ledy, Della, Yunita, Sumayyah, Olip, Mita, Nisa, Epi, teman-teman asrama serta teman-teman Laboratorium Mikrobiologi IPB yang tidak dapat disebutkan satu-persatu. Ungkapan terima kasih juga penulis sampaikan kepada keluarga tercinta, terutama kedua orang tua (Ibu & Bapak), kakak-kakak (Mas Anifuddin, Mas Sofian, Mas Iwan), kakak ipar (Mba Ika, Mba Mardha, Mba Ayu), dan keponakan-keponakan (Yahya, Balqis, Sakhia, Salwa, Syahma, Arkaan) yang senantiasa memberikan doa, dukungan, dan limpahan kasih sayang. Tak lupa penulis ucapkan terima kasih kepada teman-teman Biologi 47 atas kerjasama, dukungan, dan semangatnya.
Semoga karya ilmiah ini dapat menambah wawasan dan pengetahuan bagi kita semua.
Bogor, Agustus 2014
DAFTAR ISI
DAFTAR TABEL ix
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
METODE 2
Waktu dan Tempat 2
Prosedur Penelitian 2
HASIL 3
Isolasi dan Seleksi Bakteri Penambat Nitrogen Bebas 3
Penapisan Isolat Bakteri untuk Produksi IAA 5
Identifikasi Bakteri Penambat Nitrogen Bebas 6
PEMBAHASAN 7
SIMPULAN DAN SARAN 9
Simpulan 9
Saran 9
DAFTAR PUSTAKA 10
LAMPIRAN 12
DAFTAR TABEL
1 Hasil seleksi bakteri penambat nitrogen bebas pada media
Congo Red Agar (CRA) 4
2 Hasil pertumbuhan lima isolat bakteri terpilih pada media NfB 5 3 Hasil uji biokimia/fisiologi isolat A13.1 7
DAFTAR GAMBAR
1 Warna media semisolid Nitrogen Free Bromthymol Blue (NfB) sebelum
dan setelah dilakukan isolasi 4
2 Isolat A13.1 pada media seleksi CRA dan hasil pewarnaan Gram 5 3 Pertumbuhan isolat A13.1 dan produksi IAA yang dihasilkannya 6
DAFTAR LAMPIRAN
1 Sampel tanah asal perkebunan kelapa sawit kawasan Hutan Taman Nasional Bukit Dua Belas Jambi yang berhasil diseleksi pada media
CRA 12
PENDAHULUAN
Latar Belakang
Nitrogen merupakan kebutuhan pokok bagi seluruh organisme sebab unsur nitrogen diperlukan dalam sintesis molekul-molekul protein yang kompleks dan berpengaruh terhadap pertumbuhan dan reproduksi organisme. Oleh karena itu, nitrogen juga merupakan unsur hara yang penting bagi tanaman karena merupakan salah satu unsur pupuk yang diperlukan dalam jumlah paling banyak, sehingga bila kekurangan atau jumlah unsur tersebut tidak cukup maka tanaman tidak dapat tumbuh dengan normal (Sanchez 1993). Penggunaan pupuk kimia yang berlebihan dapat menyebabkan terjadinya penurunan kualitas di lahan pertanian (Las et al. 2006). Salah satu solusi yang dapat diterapkan, yakni dengan menggunakan pupuk hayati.
Indole-3-acetic acid (IAA) yang dikenal dengan nama hormon auksin berfungsi mengendalikan beberapa mekanisme fisiologi tumbuhan, seperti proses pembelahan sel dan diferensiasi jaringan tumbuhan. Hormon auksin yang dihasilkan oleh tumbuhan disebut IAA endogen, sedangkan IAA eksogen merupakan hormon yang dihasilkan oleh organisme selain tumbuhan (Haq dan Dahot 2007). IAA eksogen yang dihasilkan oleh jenis mikrob tertentu merupakan salah satu faktor untuk meningkatkan pertumbuhan tanaman (Alexander 1977).
Mikrob yang terdapat di dalam tanah memainkan peranan penting dalam produktivitas tanaman, terutama dalam proses penambatan nitrogen bebas di alam dan sintesis zat pemacu tumbuh seperti IAA (Tilak et al. 2005). Beberapa bakteri yang diketahui mampu menambat nitrogen dan mensintesis Indole-3-acetic acid (IAA) yaitu Azotobacter, Azospirillum, dan Pseudomonas. Produksi IAA antarspesies sangat bervariasi serta dipengaruhi oleh kondisi lingkungan, tingkat pertumbuhan, dan ketersediaan substrat seperti asam amino (Frankenberger dan Arshad 1995).
2
Tujuan Penelitian
Penelitian ini bertujuan mengisolasi dan menyeleksi bakteri penambat nitrogen yang hidup bebas dan penghasil Indole-3-acetic acid (IAA) asal sampel tanah dari Jambi Indonesia.
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Oktober 2013-Juni 2014 bertempat di rumah kaca dan Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB.
Prosedur Penelitian
Isolasi dan Seleksi Bakteri Penambat Nitrogen Bebas
Sebanyak 17 sampel tanah asal rhizosfer kelapa sawit masing-masing diencerkan dari 10-1 hingga 10-4 menggunakan larutan garam fisiologis 0,85%. Sebanyak 0,1 mL suspensi tanah tersebut diletakkan pada media semisolid NfB (Nitrogen Free Bromthymol Blue) dan diinkubasi selama 7 hari. Komposisi media NfB (dalam 1 liter) adalah sebagai berikut: asam malat 5,0 g, K2HPO4 0,5 g, MgSO4.7H2O 0,2 g, NaCl 0,1 g, CaCl2.2H2O 0,02 g, indikator bromthymol blue 0,5% dalam KOH 0,2 M 2 mL, larutan vitamin B 1 mL, dan larutan hara mikro 2 mL dengan komposisi sebagai berikut CuSO4.5H2O 40 mg, ZnSO4.7H2O 0,12 g, H2BO3 1,4 g, Na2MO4.2H2O 1,0 g, MnSO4.H2O 1,175 g, FeEDTA 1,64% 4 mL, KOH 4,5 g. pH disesuaikan menjadi 6,8 dan ditambahkan 1,75 g agar-agar (Okon et al.1977). Isolat yang didapatkan dari hasil isolasi kemudian diseleksi menggunakan media CRA (Congo Red Agar).
Media CRA (dalam 1 liter), terdiri atas: asam malat 5,0 g, K2HPO4 0,5 g, MgSO4.7H2O 0,2 g, NaCl 0,1 g, CaCl2.2H2O 0,02 g, indikator merah kongo 0,25% dalam akuades 10 mL, ekstrak khamir 0,05 g, dan larutan hara mikro 2 mL dengan komposisi sebagai berikut CuSO4.5H2O 40 mg, ZnSO4.7H2O 0,12 g, H2BO3 1,4 g, Na2MO4.2H2O 1,0 g, dan MnSO4.H2O 1,175 g, FeEDTA 1,64% 4 mL, KOH 4,5 g. pH disesuaikan menjadi 6,8 dan ditambahkan 15 g agar-agar (Caceres 1982).
Karakter morfologi diidentifikasi dengan mengacu pada Holt et al. (1994). Karakter morfologi yang diamati meliputi bentuk koloni, warna koloni, elevasi, tepian, bentuk sel bakteri, dan pewarnaan Gram.
Penapisan Isolat Bakteri untuk Produksi IAA
3 Analisis IAA dilakukan dengan metode kolorimetri menggunakan reagen Salkowski (Gordon dan Weber 1950). Sebanyak 50 mL media cair NfB ditambah dengan 1,0 mM triptofan (Trp). Media tersebut diinokulasi dengan 1 mL kultur bakteri dalam media cair NfB yang telah berumur 24 jam. Kemudian diinkubasi selama 7 hari pada inkubator bergoyang dengan kecepatan 120 rpm. Kandungan IAA di dalam media dihitung setiap 24 jam selama 7 hari berdasarkan kurva standar IAA dengan perlakuan berupa media ditambah dengan Trp dan yang tidak ditambah dengan Trp.
Kandungan IAA pada media kultur diuji dengan mengambil 1,5 mL kultur ke dalam tabung mikro, kemudian kultur tersebut disentrifugasi selama 10 menit dengan kecepatan 10.000 g. Sebanyak 1 ml supernatan direaksikan dengan 4 mL reagen Salkowski (150 mL H2SO4 pekat; 7,5 mL FeCl3.6H2O 0,5 M; dan 250 mL akuades steril), diinkubasi selama 15 menit tanpa paparan cahaya, kemudian diukur absorbansinya pada panjang gelombang 520 nm menggunakan spektrofotometer Genesys. Kandungan IAA di dalam media dapat diketahui dengan menggunakan kurva standar pengukuran IAA dengan konsentrasi 0-50 ppm.
Identifikasi Bakteri Penambat Nitrogen Bebas
Ciri fisiologi diamati menggunakan KIT API 20 NE bioMérieux®sa yang merupakan sebuah sistem yang terstandarisasi untuk mengidentifikasi bakteri gram negatif yang bersifat nonenterik. Bakteri yang akan diuji menggunakan alat KIT API 20 NE bioMérieux®sa ini akan melalui 8 uji konvensional, 12 uji asimilasi, serta sebuah basis data sehingga dapat diidentifikasi jenis bakteri yang diujikan.
HASIL DAN PEMBAHASAN
Hasil
Isolasi dan Seleksi Bakteri Penambat Nitrogen Bebas
4
Gambar 1 Warna media semisolid Nitrogen Free Bromthymol Blue (NfB) sebelum dilakukan isolasi (a) dan warna media semisolid setelah dilakukan isolasi pada hari ke-7 serta pelikel putih yang terbentuk pada permukaan media (tanda panah) (b)
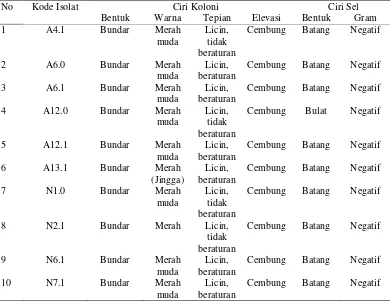
Sepuluh isolat terpilih dari hasil seleksi pada media CRA diidentifikasi secara morfologi. Bentuk kesepuluh isolat tersebut ialah bundar dengan warna merah muda hingga merah, memiliki tepian licin beraturan atau tidak beraturan, serta elevasi yang cembung (Tabel 1).
Tabel 1 Hasil seleksi bakteri penambat nitrogen bebas pada media Congo Red
5 perlakuan pewarnaan Gram. Morfologi salah satu isolat terpilih, yaitu isolat A13.1 dapat dilihat pada gambar 2.
Gambar 2 Isolat A13.1 pada media CRA (a) dan hasil pewarnaan Gram isolat A13.1 pada perbesaran 1000x (b)
Penapisan Isolat Bakteri untuk Produksi IAA
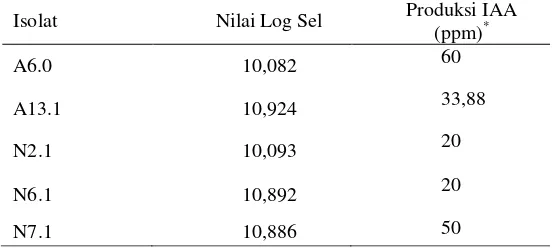
Sebanyak 5 dari 10 isolat terpilih, yaitu A6.0, A12.1, A13.1, N2.1, dan N7.1 diuji kemampuan pertumbuhannya dalam media NfB selama masa inkubasi 24 jam. Pemilihan 5 isolat tersebut berdasarkan kemiripan morfologi dengan kelompok bakteri penambat nitrogen dari genus Azospirillum. Isolat A13.1 memiliki nilai log sel tertinggi sebesar 10,924 pada waktu inkubasi 24 jam (Tabel 2).
Tabel 2 Hasil pertumbuhan lima isolat bakteri terpilih pada media NfB
*Keterangan : Produksi IAA dihitung setelah masa inkubasi 5 hari
6
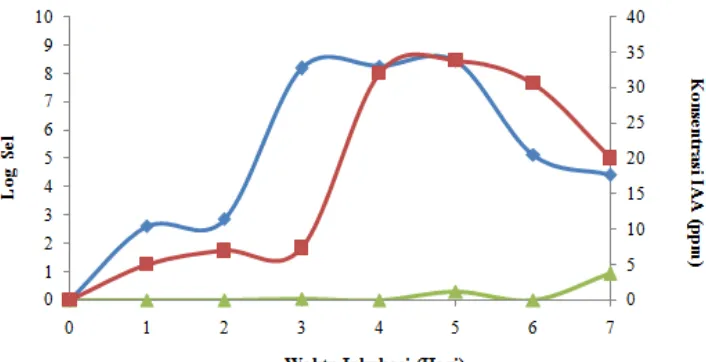
Gambar 3 Pertumbuhan isolat A13.1 ( ) , produksi IAA pada media dengan penambahan Trp ( ), dan tanpa penambahan Trp ( )
Proses seleksi selanjutnya yaitu menentukan kurva produksi sintesis IAA eksogen oleh isolat A13.1. Pengukuran IAA dilakukan selama 7 hari dengan menggunakan reagen Salkowski dengan pengukuran kurva standar IAA setiap harinya. Nilai absorbansi tersebut diinterpolasikan pada persamaan garis dari kurva standar IAA sehingga diperoleh konsentrasi antara 5 hingga 33,88 ppm pada media dengan penambahan Trp. Sedangkan konsentrasi 0,041 hingga 0,93 ppm diperoleh pada perlakuan media tanpa penambahan Trp. Perlakuan dengan menggunakan penambahan Trp menunjukkan sintesis IAA meningkat dari hari pertama dan optimum pada hari ke-5 (Gambar 3).
Identifikasi Bakteri Penambat Nitrogen Bebas
Identifikasi secara fisiologi dilakukan menggunakan alat KIT API 20 NE bioMérieux®sa. Kit API 20 NE terdiri atas 20 microtubes mengandung substrat yang diinokulasi dengan larutan saline bacterial suspension. Selama masa inkubasi 24 dan 48 jam, hasil reaksi metabolisme menghasilkan perubahan warna. Reaksi yang berlangsung dibaca sesuai dengan Reading Table dan identifikasi diperoleh dengan mengacu pada Indeks Analytical Profile pada perangkat lunak.
7 Tabel 3 Hasil uji biokimia/fisiologi isolat A13.1
Reaksi pada KIT API 20 NE Hasil reaksi
Reduksi nitrat ke nitrit (NO3) -
Produksi indol (TRP) -
Kemampuan fermentasi (GLU) -
Arginine dihydrolase (ADH) +
Urease (URE) +
Hidrolisis β-glucosidase (ESC) +
Hidrolisis protease (GEL) +
Asimilasi potassium glukonat (GNT) +
Asimilasi capric acid (CAP) -
Asimilasi adipic acid (ADI) -
Asimilasi malat (MLT) +
Asimilasi trisodium sitrat (CIT) + Asimilasi phenylacetic acid (PAC) -
Cytochrome oxidase (OX) -
Pembahasan
Isolasi bakteri yang dilakukan pada 17 sampel tanah rhizosfer di Jambi di dalam media NfB bertujuan mengetahui kemampuan bakteri dalam proses penambatan nitrogen bebas. Media NfB tidak mengandung unsur nitrogen pada komposisi bahannya sehingga isolat yang dapat ditumbuhkan dalam media tersebut ialah isolat yang mampu memfiksasi nitrogen bebas. Sebanyak 17 sampel tanah yang diinokulasi ke dalam media semisolid NfB menghasilkan isolat-isolat terpilih. Pemilihan isolat berdasarkan pada kemampuan dalam penambatan nitrogen bebas. Adanya pelikel putih yang tumbuh di permukaan media menunjukkan keberhasilan dari isolat yang memiliki kemampuan dapat menambat nitrogen bebas (Kumar dan Pannerselvam 2013). Selain itu, bakteri yang diduga dapat menambat nitrogen bebas juga memiliki kemampuan untuk mengubah pH media menjadi lebih basa. Hal ini ditandai dengan perubahan warna media yang semula berwarna hijau menjadi berwana kebiruan.
Isolat-isolat bakteri yang terpilih selanjutnya diseleksi menggunakan media CRA (Congo Red Agar). Media CRA merupakan media modifikasi dari NfB sehingga komposisi bahan yang menyusun media CRA sama dengan NfB. Namun media CRA menggunakan indikator berupa merah kongo dan terdapat ekstrak khamir. Penggunaan merah kongo sebagai indikator berperan dalam membedakan serta memisahkan genus Rhizobium dari bakteri penambat nitrogen bebas, seperti genus Azospirillum (Caceres 1982). Ekstrak khamir berfungsi sebagai pemacu tumbuh sel di fase awal karena ekstrak khamir memiliki
Keterangan:
8
kemampuan menyediakan faktor pertumbuhan, seperti asam malat yang digunakan oleh bakteri dalam proses metabolisme serta menjaga pH media agar tetap netral, yaitu 6,8-7,0 (Kung et al. 1996).
Hasil identifikasi secara fisiologi menggunakan alat KIT API 20 NE bioMérieux®sa menunjukkan bahwa isolat A13.1 memilliki 99% kesamaan dengan spesies Pseudomonas luteola. Isolat P. luteola memiliki karakteristik sebagai PGPR (Planth Growth Promoting Bacteria), yaitu meningkatkan pertumbuhan tanaman karena memproduksi fitohormon seperti auksin (Deshwal et al. 2013). Ali dan Sabri (2010) menyatakan bahwa anggota dari genus Pseudomonas sp. merupakan salah satu contoh dari bakteri tanah (rhizobakteria) yang mampu menghasilkan IAA. Selain itu, Stieglmeier et al. (2009) melaporkan bahwa P. luteola berhasil diisolasi dalam medium tanpa N sehingga diketahui bahwa P. luteola merupakan bakteri penambat nitrogen bebas. Isolat ini termasuk ke dalam kelompok Proteobacteria, yaitu kelompok dari Bacteria yang anggotanya terdiri atas bakteri Gram negatif. Berdasarkan identifikasi 16S rRNA, secara filogenetik filum Proteobacteria dibagi ke dalam 5 kelas, yaitu Alphaproteobacteria, Betaproteobacteria, Gammaproteobacteria, Deltaproteobacteria, dan Epsilonproteobacteria. Isolat A13.1 termasuk ke dalam kelas Gammaproteobacteria. Isolat ini termasuk ke dalam kelas yang sama dengan bakteri penambat nitrogen dari genus Azotobacter (Madigan et al. 2006). Kurva tumbuh isolat A13.1 (Gambar 3) menunjukkan bahwa isolat A13.1 tersebut digolongkan sebagai bakteri yang tumbuh lambat karena pencapaian fase log dari bakteri tersebut baru terjadi pada hari ke-3. Hal ini sesuai dengan pernyataan bahwa bakteri yang hidup di rhizosfer umumnya merupakan bakteri yang tumbuh lambat karena ketersediaan nutrisi yang terbatas (Rao 1994). Kurva pertumbuhan bakteri juga berhubungan dengan kurva konsentrasi IAA yang dihasilkan oleh isolat A13.1 (Gambar 3). IAA disintesis optimum sejak akhir fase log dan mencapai konsentrasi tertinggi di akhir fase stasioner.
Produksi IAA pada media pertumbuhan isolat A13.1 didukung oleh triptofan sebagai prekusor. Berdasarkan penelitian yang dilakukan oleh Zakharova et al. (1999), Trp merupakan prekursor yang paling efisien digunakan bakteri. IAA dapat disintesis dengan berbagai lintasan dan senyawa intermediet yang berbeda. Menurut berbagai jalur sintesis IAA digunakan oleh prokariot, suatu galur bakteri dapat menggunakan lebih dari satu jalur sintesis IAA. Jalur-jalur ini dikelompokkan berdasarkan jenis senyawa antaranya, yaitu jalur indol asetamida (IAM), asam indol-3-piruvat (IPA), triptamin (TAM), dan indol-3-asetonitril (IAN) (Patten dan Glick 1996).
Jalur indol asetamida (IAM) merupakan jalur yang umum digunakan bakteri dalam mensintesis IAA. Triptofan diubah menjadi indol asetamida oleh enzim triptofan-2-monooksigenase. Gen yang terkait IAM telah terdeteksi pada berbagai spesies Pseudomonas. Bakteri Pseudomonas luteola menggunakan triptofan sebagai prekusor dalam proses produksi IAA melalui jalur indol asetamida (IAM). Selain Pseudomonas luteola, bakteri-bakteri rhizosfer seperti Agrobacterium tumefaciens, Rhizobium, dan Bradyrhizobium juga menggunakan jalur indol asetamida (IAM) (Spaepen et al. 2007).
9 direaksikan dengan reagen Salkowski. Salkowski merupakan reagen pewarna yang dapat digunakan untuk menguji senyawa indol dan turunannya. Reagen Salkowski akan mengoksidasi senyawa indol dan turunannya. Indol ialah senyawa organik golongan aromatik yang memiliki struktur bisiklik yang terdiri atas cincin benzena (Joule dan Mills 2000). IAA merupakan salah satu contoh senyawa yang memiliki gugus indol sehingga akan memberikan konsentrasi warna merah muda. Kepekatan warna berbanding lurus dengan peningkatan jumlah IAA yang dihasilkan (Ehmann 1977).
Data mengenai kurva tumbuh serta konsentrasi IAA yang diperoleh dalam penelitian dapat digunakan sebagai data awal sebelum isolat digunakan sebagai formulasi pupuk hayati. Oleh karena itu, diperlukan pengujian lebih lanjut dari isolat A13.1 dalam kemampuannya menambat nitrogen bebas. Kemampuan penambatan jumlah nitrogen bebas dapat dilihat dari kemampuan isolat A13.1 dalam mereduksi asetilen dengan menggunakan metode Asetilene Reduction Assay sehingga dapat diketahui keefektifan penggunaan isolat A13.1 dalam pembuatan formulasi pupuk hayati. Proses identifikasi lebih lanjut dengan teknik molekuler juga diperlukan agar isolat A13.1 dapat diidentifikasi sampai tingkat spesies.
SIMPULAN DAN SARAN
Simpulan
Bakteri penambat nitrogen yang hidup bebas dan dapat menghasilkan Indole-3-Acetic Acid (IAA) dari Taman Nasional Bukit Dua Belas (TNBD) Jambi berhasil diisolasi. Isolat terpilih yaitu isolat A13.1 yang merupakan bakteri Gram negatif serta menunjukkan kemiripan dengan Pseudomonas luteola sebesar 99%. Isolat A13.1 optimum mensintesis IAA pada hari ke-5, yaitu pada fase pertumbuhan stasioner.
Saran
10
DAFTAR PUSTAKA
Alexander M. 1977. Introduction to Soil Microbiology. Ed ke-2. New York (US): J Willey.
Ali B, Sabri AN. 2010. Rhizobacterial potential to alter auxin content and growth of Vignata radiata (L.). World J Microbiol Biotech. 26(8):1397-1384. Caceres EAR. 1982. Improved medium for isolation of Azospirillum spp. Appl
Environ Microbiol. 44(4):990-991.
Deshwal VK, Singh SB, Kumar P, Chubey A. 2013. Rhizobia unique plant growth promoting rhizobacteria. Int J Life Sci. 2(2):53-55.
Ehmann A. 1977. The van urk-salkowski reagent- a sensitive and specific chromogenic reagent for silica gel thin-layer chromatographic detection and identification on indole derivatives. J Chrom. 132(1977):267-276.
Frankenberger M, Arshad WT. 1995. Phytohormones in Soils: Microbial Production and Function. New York (US): Marcel Dekker Inc.
Gordon SA, Weber RP. 1950. Colorimetric estimation of indolacetic acid. Plant Physiol. 26(1):192-195.
Haq I, Dahot MU. 2007. Micropropagation efficiency in banana (Musa spp.) under different immersion systems. Pak J Biol Sci. 10(5):726-733.
Holt JG, Krig NR, Sneath P, Staley J, William S. 1994. Bergeys Manual of Determinative Bacteriology. Ed ke-9. Pennsylvania (US): Lipincott Williams and Wilkins Company.
Joule JA, Mills K. 2000. Heterocyclic Chemistry. Oxford(UK): Blackwell Science Kumar S, Pannerselvam A. 2013. Studies on Azospirillum isolated from the soils
of Thiruvarur Dt., Tamilnadu, India. Adv Appl Sci Res. 4(1):86-93.
Kung LJR, Kreck RST, Tung AO, Hession. 1996. Effect of a life yeast culture and enzymes on in vitro ruminal fermentation and milk production of dairy cow. J Dairy Sci. 80(5):2045-2051.
Las I, Setiyanto AP, Subagyono K. 2006. Isu dan pengelolaan lingkungan dalam revitalisasi pertanian. J Litbang Pertan. 25(3): 1-8.
Lindow SE, Desurmont C, Elkins R, McGourty G, Clark E, Brandl MT. 1998. Occurrence of indole-3-acetic acid producing bacteria on pear trees and their association with fruit russet. Bacteriology 88(11):1151-1157.
Madigan MT, Martinko JM, Dunlap PV, Clark DP. 2006. Brock: Biology of Microorganisms. 12th Ed. San Fransisco (US): Pearson Education Inc. Okon Y, Albrecht SL, Burris RH. 1977. Methods for growing Spirillum lipoferum
and for counting it in pure culture and in association with plants. Appl Environ Microbiol. 33 (1):85-88.
Patten CL, Glick BR. 1996. Bacterial biosynthesis of indole-3-acetic acid. Can J Microbiol. 42(2):207-220.
Purnamasari D. 2013. Isolasi dan seleksi bakteri selulolitik penghambat pertumbuhan cendawan pada tanaman kelapa sawit [skripsi]. Bogor (ID): Institut Pertanian Bogor.
11 Riyadi I. 2008. Potensi pengelolaan bioprospeksi terhadap pertumbuhan ekonomi
Indonesia. J Litbang Pertan. 27(2):69-73.
Sanchez PA. 1993. Sifat dan Pengelolaan Tanah Tropika. Bandung (ID) : ITB Press.
Spaepen S, Jos V, Roseline R. 2007. Indole-3-acetic acid in microbial and microorganism plant signaling. FEMS Microbiol Rev. 31:425–448
Stieglmeier M, Wirth R, Kminek G, Moisl-Eichinger C. 2009. Cultivation of anaerobic and facultatively anaerobic bacteria from spacecraft-assosiated clean rooms. Appl Environ Microbiol. 75(11): 3484-3491.
Tilak KVBR, Ranganayaki N, Pal KK, Saxena AK, Nautiyal CS. 2005. Diversity of plant growth and soil health supporting bacteria. Curr Sci. 89(1):136-150.
12
LAMPIRAN
Lampiran 1 Sampel tanah asal perkebunan kelapa sawit kawasan Hutan Taman Nasional Bukit Dua Belas, Jambi yang berhasil diseleksi pada media CRA
Lampiran 2 Nilai absorbansi dan nilai log sel selama 7 hari inkubasi Waktu Inkubasi
13 Lampiran 4 Produksi IAA (ppm) selama 7 hari inkubasi
Waktu Inkubasi (Hari ke-)
(+) Trp (-) Trp
0 0 0
1 5 0
2 6,93 0
3 7,36 0,041
4 32 0
5 33,88 0,29
6 30,63 0
14
RIWAYAT HIDUP
Penulis dilahirkan di Purbalingga pada tanggal 17 Mei 1992 dari ayah Abdul Azis dan ibu Tumidjah. Penulis merupakan anak keempat dari empat bersaudara. Tahun 2010 penulis lulus dari SMA Negeri 1 Purwokerto. Pada tahun yang sama, penulis lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB (USMI) di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Penulis mendapatkan beasiswa Peningkatan Prestasi Akademik (PPA) dari DIKTI pada tahun 2011-2014. Pada tahun 2013 penulis diterima sebagai mahasiswa program sinergi S1-S2 fast-track untuk program studi S2 Mikrobiologi.
Penulis aktif mengikuti beberapa kegiatan dalam masa studi seperti menjadi peserta kompetisi olimpiade biologi pada OSN Pertamina (2011-2012) dan ON-MIPA DIKTI tingkat regional III (2012-2013) serta kegiatan Organisasi Mahasiswa Daerah (OMDA) Banyumas. Penulis juga aktif mengikuti lomba baca puisi SPIRIT FMIPA IPB (2012-2013) dan IAC (IPB Art Contest). Penulis juga menjadi anggota divisi Tatib (Tata Tertib) dalam acara Masa Perkenalan Departemen
Biologi “MORFOLOGI” tahun 2012-2013, divisi Tim Khusus Lomba Cepat Tepat Biologi (LCTB) Pesta Sains Nasional IPB tahun 2012, serta beberapa kepanitiaan lainnya.