PEMANFAATAN EKSTRAK BUAH Rhizophora sp.
SEBAGAI ANTI BAKTERI TERHAVAP BAKTERI PATOGEN
IKAN AIR TAWAR
Oleh
HERMAN APRIYANTO
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERIKANAN
pada
Jurusan Budidaya Perairan
Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN
UNIVERSITAS LAMPUNG
ABSTRAK
PEMANFAATAN EKSTRAK BUAH Rhizophora sp. SEBAGAI ANTI BAKTERI TERHADAP BAKTERI PATOGEN IKAN AIR TAWAR
Oleh
HERMAN APRIYANTO
Buah Rhizophora sp. mengandung berbagai macam senyawa anti bakteri dan berpotensi sebagai antibiotik alami. Penelitian ini dilakukan untuk mempelajari potensi anti bakteri dari ekstrak buah Rhizophora sp. terhadap beberapa bakteri patogen pada ikan air tawar. Buah Rhizophora sp. diekstraksi dengan menggunakan tiga pelarut yaitu metanol, etil asetat, dan heksana. Ekstrak diuji aktivitas antibakterinya terhadap empat spesies bakteri air tawar Aeromonas hydrophila, Edwardsiella tarda, Pseudomonas stutzeri dan Streptococcus iniae dengan beberapa jenis pengujian yaitu sensitifitas, zona penghambatan, MIC (Konsentrasi Penghambatan Minimum), MBC (Konsentrasi Bakterisidal Minimum), toksisitas dan ITC (Inhibition Time Course). Hasil pengujian menunjukkan bahwa ekstrak buah Rhizophora sp. yang diekstraksi dengan etil asetat, memiliki kemampuan paling besar untuk menghambat pertumbuhan bakteri S. Iniae pada MIC dengan konsentrasi ekstrak 500 mg/L dan MBC pada konsentrasi ekstrak 600 mg/L. Pengujian toksisitas dengan BSLT (Brine Shrimp Lethality Test) ekstrak buah Rhizophora sp. dengan etil asetat bersifat toksik dengan nilai LC50 610,9 mg/L (< 1000 mg/L). Dan pengujian ITC selama 24 jam tidak menghasilkan penghambatan terhadap pertumbuhan S. iniae.
xiii
DAFTAR RIWAYAT HIDUP ... vii
xiv
D. Edwardsiella tarda . ... 9
E. Pseudomonas stutzeri ... 10
F. Streptococcus iniae ... 11
G. Senyawa Antibakteri . ... 12
H. Penggunaan Rhizophora sp. Sebagai Antibakteri ... 14
III. METOVE PENELITIAN A. Waktu dan Tempat Penelitian ... 17
B. Alat dan Bahan ... 17
c. Uji MIC (Minimum Inhibitory Concentration) ... 20
d. Uji MBC (Minimum Bactericidal Concentration) ... 21
e. Uji Toksisitas (Brine Shrimp Lethality Test) ... 22
f. Uji Inbibition time course... 23
IV. HASIL VAN PEMBAHASAN A .Hasil Penelitian Dan Pembahasan ... 24
1. EkstraksiSenyawa Aktif ... 24
2. Uji Sensitivitas ... 25
3. Uji Zona Hambat ... 28
4. Uji MIC (Minimum Inhibitory Concentration) ... 30
5. Uji MBC (Minimum Bactericidal Concentration) ... 32
6. Uji Toksisitas (Brine Shrimp Lethality Test) ... 33
xv ✁SIMPULAN VAN SARAN
A. Kesimpulan ... 38 B. Saran ... 38
xvi VAFTAR GAMBAR
Gambar Halaman
1. Zonasi Mangrove ... 5
2. Daun, Bunga, dan Buah Rhizophora mucronata ... 6
3. Daun, Bunga, dan Buah Rhizophora apiculata ... 6
4. Daun, Bunga, dan Buah Rhizophora stylosa ... 7
5. Hasil Uji Sensitivitas ... 26
6. Hasil Uji Zona Hambat ... 29
7. Hasil Uji MIC Bakteri S. iniae ... 31
8. Hasil Uji MBC Bakteri S. iniae ... 33
xvii VAFTAR TABEL
Tabel Halaman
1. Hasil Uji Zona Hambat Mangrove Terhadap Vibrio sp. ... 15
2. Hasil Uji Zona Hambat Daun Rhizophora mucronata Terhadap Bakteri A. salmonicida Dan V. harveyi ... 16
3. Hasil Uji Zona Hambat Ekstrak Daun Rhizophora apiculata Terhadap V. parahemolyticus ... 16
4. Hasil Akhir Ekstraksi Buah Rhizophora sp. ... 24
5. Hasil Uji Sensitivitas Ekstrak Buah Rhizophora sp. Konsentrasi 100% ... 25
6. Hasil Uji Zona Hambat Terhadap Bakteri S. iniae ... 28
7. Hasil Uji MIC Bakteri S. iniae Dengan Konsentrasi Ekstrak 200 – 600mg/L ... 31
8. Hasil Uji MBC Bakteri S. iniae Dengan Konsentrasi Ekstrak 500 dan 600mg/L ... 32
xviii VAFTAR LAMPIRAN
Lampiran Halaman
1. Perhitungan Uji Toksisitas (Brine Shrimp Lethality Test) ... 42
2. Sterilisasi Alat dan Bahan ... 44
3. Ekstraksi Buah Mangrove Rhizophora sp. ... 45
4. Proses Uji MIC (Minimum Inhibitory Concentration)... 46
5. Proses Uji MBC (Minimum Bactericidal Concentration) ... 47
6. Proses Uji Toksisitas (Brine Shrimp Lethality Test) ... 48
7. Proses Uji Inhibition Time Course ... 49
1 I. PENDAHULUAN
A. Latar Belakang
Sektor kelautan dan perikanan merupakan salah satu sumber andalan dalam
pembangunan perikanan di Indonesia. Namun berbagai permasalahan
menghambat upaya peningkatan produksi tersebut, antara lain kegagalan produksi
akibat serangan wabah penyakit ikan yang bersifat patogenik baik dari golongan
parasit, jamur, bakteri, dan virus. Timbulnya serangan wabah penyakit tersebut
pada dasarnya sebagai akibat terjadinya gangguan keseimbangan dan interaksi
antara ikan, lingkungan yang tidak menguntungkan ikan dan berkembangnya
patogen penyebab penyakit. Masalah ini akan semakin serius apabila sistem
budidaya ikan sudah mencapai tahapan budidaya intensif dan kualitas lingkungan
yang kurang memadai sehingga kondisi tersebut akan melahirkan tekanan atau
stress terhadap komoditas yang dibudidayakan, sehingga rentan terhadap
munculnya penyakit (Purwaningsih dan Taukhid, 2010).
Penyakit bakterial merupakan masalah yang cukup serius. Penyakit yang
disebabkan oleh bakteri umumnya bersifat oportunis artinya akan menyerang saat
ikan berada dalam kondisi stress atau terluka. Ikan yang sakit karena serangan
bakteri pada umumnya diobati dengan menggunakan antibiotik dan bahan kimia
2 dapat menghambat bahkan membunuh mikroorganisme patogen, tetapi pemakaian
antibiotik ternyata menimbulkan masalah baru karena sifatnya yang tidak ramah
lingkungan. Zat-zat antibiotik tersebut dapat meningkatkan resistensi hama yang
ingin ditanggulangi sehingga semakin tidak mempan atau dosis yang digunakan
akan terus meningkat (Trianto dkk, 2004). Oleh karena itu perlu dilakukan
pencarian metode lain yang aman bagi biota dan lingkungannya, seperti
memanfaatkan bahan-bahan alami dari tanaman.
Beberapa keuntungan menggunakan bahan-bahan alami dari tanaman antara lain
relatif lebih aman, mudah diperoleh, murah, tidak menimbulkan resistensi, dan
relatif tidak berbahaya terhadap lingkungan sekitarnya. Salah satu bahan alami
yang dapat dimanfaatkan adalah dari tanaman mangrove jenis Rhizophora sp.
Hampir semua bagian tanaman Rhizophora sp. mengandung senyawa alkaloid,
saponin, flavonoid dan tannin dimana senyawa ini merupakan antibakteri (Rohaeti
dkk, 2010). Oleh karena itu Rhizophora sp. memiliki potensi yang sangat baik
untuk dikelola dan dikembangkan, terutama sebagai antibiotik alami.
B. Tujuan Penelitian
Tujuan dari dilakukan penelitian ini adalah untuk:
1. mengetahui respon hambat dan nilai ketoksikan ekstrak buah Rhizophora sp.
terhadap bakteri patogen ikan air tawar.
2. mengetahui waktu hambat ekstrak buah Rhizophora sp. terhadap bakteri
3 C. Manfaat
Hasil penelitian ini diharapkan mampu memberikan informasi bagi masyarakat
tentang potensi ekstrak buah mangrove Rhizophora sp. sebagai antibakteri alami
terhadap beberapa bakteripenyebab penyakit pada ikan air tawar.
D. Kerangka Pemikiran
Penyakit merupakan salah satu pembatas keberhasilan dalam usaha budidaya
perikanan yang bisa diakibatkan oleh virus, jamur, parasit, dan juga bakteri.
Penyakit yang disebabkan oleh bakteri yang sering menyerang ikan beberapa
diantaranya antara lain bakteri jenis Aeromonas sp. yang menyebabkan penyakit
aeromoniasis pada ikan air tawar seperti ikan lele, ikan mas, dan gurame; bakteri
dari jenis Streptococcus sp. yang menyebabkan penyakit streptococcosis pada
ikan nila; serta bakteri jenis Edwarsiella sp. yang menyebabkan penyakit
edwardsiellosis.
Selama ini pencegahan dan pengobatan terhadap serangan bakteri dilakukan
dengan pemberian antibiotik sintesis dan bahan kimia. Akan tetapi obat-obatan
kimiawi memiliki dampak negatif apabila diberikan secara terus menerus karena
selain dapat menyebabkan organisme patogen menjadi resisten, juga residu dari
antibiotik dapat mencemari lingkungan perairan yang mengakibatkan penurunan
kualitas air. Hingga saat ini pencarian bahan-bahan alami sebagai alternatif
antibiotik kimiawi terus dilakukan dengan harapan dapat ditemukannya bahan
yang ampuh digunakan sebagai antibakteri, sekaligus tidak memiliki dampak
negatif yang tidak diinginkan. Salah satu tumbuhan yang memiliki potensi sebagai
4 bagian Rhizophora sp. mengandung senyawa antibakteri seperti alkaloid, saponin,
flavonoid dan tannin (Rohaeti dkk, 2010)
Bagian-bagian Rhizophora sp. seperti pada bagian kulit kayu, bunga, dan daunnya
telah banyak dimanfaatkan oleh masyarakat pesisir untuk pengobatan alami
(Purnobasuki, 2004). Bagian lain Rhizophora sp. yang perlu diteliti potensinya
dalam pengobatan adalah bagian buahnya. Bagian ini diduga mengandung
senyawa-senyawa antibakteri yang berguna bagi pengobatan infeksi yang
disebabkan oleh bakteri. Penelitian terhadap buah Rhizophora sp. belum banyak
dilakukan, oleh karena itu perlu adanya penelitian lebih lanjut terhadap buah
Rhizophora sp. akan potensinya sebagai bahan alami yang bisa digunakan sebagai
antibakteri alternatif yang ampuh dalam pengobatan penyakit bakterial dan juga
bersifat aman, baik terhadap ikan budidaya, lingkungan, dan manusia, apabila
5
II. TINJAUAN PUSTAKA
A. Rhizophorasp.
Rhizophora sp. merupakan salah satu jenis tanaman mangrove, yaitu kelompok
tanaman tropis yang bersifat halophytic atau toleran terhadap garam (Irwanto,
2006). Mangrove memiliki kemampuan khusus untuk beradaptasi dengan kondisi
lingkungan yang ekstrim, seperti kondisi tanah yang tergenang, kadar garam yang
tinggi serta kondisi tanah yang kurang stabil. Kondisi lingkungan seperti itu
menyebabkan beberapa jenis mangrove mengembangkan mekanisme yang
memungkinkan secara aktif mengeluarkan garam dari jaringan, sementara yang
lainnya mengembangkan sistem akar napas untuk membantu memperoleh oksigen
bagi sistem perakarannya (Setyawan dkk, 2002).
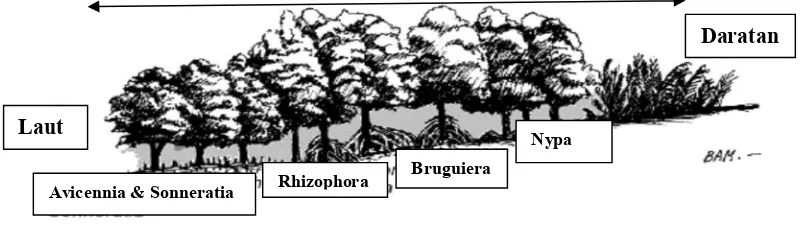
Gambar 1. Zonasi Mangrove
Rhizophora sp. termasuk dalam famili Rhizophorazceae. Ada tiga jenis yang
tergolong dalam Rhizophora sp., yaitu R. mucronata, R. apiculata dan R. stylosa.
Laut
Daratan
Avicennia & Sonneratia Rhizophora Bruguiera
6
Jenis-jenis ini dikenal dengan nama bakau, dan merupakan jenis yang umum dan
selalu tumbuh di hutan mangrove (Sukardjo, 1984). Noor (2006) mengemukakan
taksonomi jenis Rhizophora sp.adalah sebagai berikut:
Divisi : Spermatophyta
Sub divisi : Angiospermae
Kelas : Dicotiledonae
Sub kelas : Dialypetalae
Ordo : Myrtales
Famili : Rhizophoraceae
Genus : Rhizophora
Spesies : Rhizophora sp.
(A) (B) (C)
Gambar 2. daun (A) bunga (B) dan buah (C) Rhizophora mucronata
(A) (B) (C)
7
(A) (B)
Gambar 4. Daun dan bunga (A) serta buah (B) Rhizophora stylosa
Hampir semua bagian tanaman Rhizophora sp. mengandung senyawa alkaloid,
saponin, flavonoid dan tannin (Rohaeti dkk, 2010). Alkaloid bersifat toksik
terhadap mikroba, sehingga efektif membunuh bakteri dan virus (Sari, 2008).
Senyawa saponin dapat bekerja sebagai antimikroba karena akan merusak
membran sitoplasma dan membunuh sel (Rahayu, 2007). Senyawa flavonoid
mekanisme kerjanya mendenaturasi protein sel bakteri dan merusak membran sel
tanpa dapat diperbaiki lagi (Rinawati, 2011). Tanin merupakan senyawa fenolik
komplek yang dapat menghambat aktivitas bakteri sehingga tumbuhan yang
mengandung tanin sering digunakan dalam bidang farmasi karena tanin
mengandung asam tanik yang telah digunakan sebagai antiseptik (Trianto dkk,
2004).
B. Bakteri
Bakteri adalah sel prokariota yang khas dan bersifat uniseluler. Bakteri umumnya
memiliki dinding sel, seperti sel hewan dan jamur, tetapi dengan komposisi yang
8
beragam bentuk seperti berbentuk bulat, batang, atau spiral dan berdiameter antara
0,5 sampai dengan 1,0 μm dan panjang antara 1,5 sampai dengan 2,5 μm
(Underwood, 2006).
Bakteri dapat dibedakan menjadi bakteri Gram positif dan bakteri Gram negatif
berdasarkan perbedaan pada komposisi dan struktur dinding selnya. Bakteri Gram
positif mempunyai struktur dinding sel yang tebal antara 15-80 nm dan berlapis
tunggal. Bakteri gram positif lebih rentan terhadap penisilin (Juliantina dkk,
2009). Bakteri Gram negatif mempunyai struktur dinding sel berlapis tiga dengan
ketebalan yang tipis berkisar antara 10-15 nm. Komposisi dinding sel bakteri
Gram negatif pada lapisan luar terdiri dari 5-10% peptidoglikan, sedangkan pada
lapisan lainnya terdiri dari protein, lipopolisakarida, dan lipoprotein. Lapisan ini
merupakan lapisan lipid kedua yang disebut lapisan lipopolisakarida (LPS)
(Underwood, 2006). Bakteri gram negatif umumnya kurang rentan terhadap
penisilin, dan kurang resisten terhadap gangguan fisik (Juliantina dkk, 2006).
C. Aeromonas hydrophila
Klasifikasi A. hydrophila menurut Janda & Sharon (2010):
Kingdom : Bacteria
9
Kelompok bakteri dari genus Aeromonas merupakan bakteri yang dapat
ditemukan di daerah perairan tawar, bersifat Gram Negatif dan berbentuk batang
(Gardenia dkk, 2010). A. hydrophila mempunyai morfologi batang pendek
dengan ukuran bervariasi antara lebar 0,8 sampai 1,0 mikron dengan panjang 1,0
sampai 3,5 mikron, tidak memiliki spora, bakteri bersifat motil karena mempunyai
flagela monotrichous. Morfologi koloni permukaannya agak menonjol, berbentuk
bulat, dan mengkilat (Herupradoto dan Gandul, 2010).
Bakteri A. hydrophila merupakan penyebab penyakit hemoragic septicaemia yang
juga disebut sebagai MAS (Motile Aeromonas Septicaemia), dan bakteri ini
dikenal bersifat oportunis karena akan menyerang saat ikan mengalami stress.
Gejala ikan yang terinfeksi MAS bervariasi tetapi umumnya ditandai oleh adanya
pendarahan (hemoragik) pada kulit, insang, rongga mulut, borok pada kulit, dan
bola mata menonjol (exopthalmia) dan perut kembung serta ikan lemas dan sering
di permukaan atau dasar kolam (Jayavignesh dkk, 2011).
D. Edwardsiella tarda
Park (2012) menjelaskan klasifikasi ilmiah dari bakteri Edwardsiella tarda :
Kingdom : Bacteria
Filum : Proteobacteria
Kelas : Gamma Proteobacteria
Ordo : Enterobacteriales
Famili : Enterobacteriaceae
Genus : Edwardsiella
10 E. tarda merupakan bakteri Gram-negatif yang berbentuk batang bengkok, dengan
ukuran 1 x 2-3 µm, bersifat gram negatif bergerak dengan bantuan flagella, tidak
membentuk spora atau kapsul dan bersifat fakultatif anaerob. Bakteri ini dapat
dijumpai di lingkungan air tawar dan air laut, dengan suhu optimal bagi
pertumbuhannya sekitar 35oC, sedangkan pada suhu di bawah 10oC atau di atas
45oC tidak dapat tumbuh (Park dkk, 2012).
E. tarda merupakan bakteri penyebab penyakit edwardsiellosis. Bakteri ini
menyerang spesies-spesies ikan di daerah tropis dan bisa menjadi patogen
oportunistik pada manusia, menyebabkan meningitis dan diare (Wyatt dkk, 1979).
Penularannya secara horizontal yaitu kontak antara inang satu dengan inang
lainnya atau melalui air (Tan dkk, 2002). Nadirah (2012) menjelaskan ikan yang
terjangkit edwardsiellosis akan memperlihatkan gejala sebagai berikut:
1. Terjadi luka pada kulit yang kemudian akan meluas ke bagian daging,
sehingga dengan segera akan mengakibatkan perdarahan. Luka semacam ini
sering dijumpai pada hati ikan.
2. Jika tidak segera diobati, luka-luka ini akan berkembang menjadi bisul dan
mengeluarkan nanah (abses).
3. Pada jaringan daging, hati dan ginjal sering terjadi nekrosa.
E. Pseudomonas stutzeri
Klasifikasi Pseudomonas stutzeri menurut Sijderius (1946)
Kingdom : Bacteria
Filum : Proteobacteria
11
Ordo : Pseudomonadales
Famili : Pseudomonadaceae
Genus : Pseudomonas
Spesies : Pseudomonas stutzeri
P. stutzeri adalah anggota dari genus Pseudomonas. Ciri Genus Pseudomonas
antara lain memiliki sel berbentuk lurus atau sedikit berlekuk. Bersifat motil oleh
satu atau beberapa flagella. Bersifat aerob, tipe metabolisme respirasi
menggunakan oksigen sebagai akseptor elektron, pada beberapa kasus nitrat dapat
digunakan sebagai alternatif akseptor elektron. dan termasuk bakteri Gram negatif
(Bryan, 1999). P. stutzeri banyak ditemukan di tanah, dan juga sering menyerang
ikan air tawar. Bakteri P. stutzeri disebut juga sebagai dinitrifiers karena bakteri
ini mampu merubah nitrat menjadi gas nitrogen (Hardhianto, 2010).
P. stutzeri mempunyai tiga tahap infeksi, yang pertama dimulai dengan bakteri
yang berkolonisasi, kemudian infeksi lokal, dan yang ketiga adalah penyebaran ke
dalam aliran darah (Bisharat, 2012). P. stutzeri umumnya bersifat oportunistik
ketika mekanisme pertahanan ikan mulai melemah. P. stutzeri dapat
menghasilkan eksotoksin, yang menyebabkan nekrosis jaringan dan dapat
mematikan ikan (Guasp dkk, 2000).
F. Streptococcus iniae
Klasifikasi bakteri Streptococcus iniae menurut Pier (1976):
Kingdom : Bacteria
Filum : Firmicutes
12
Ordo : Lactobacillales
Famili : Streptococcaceae
Genus : Streptococcus
Spesies : Streptococcus iniae
S. iniae adalah bakteri Gram-Positif yang berbentuk bulat dengan karakteristik
membentuk pasangan atau rantai selama pertumbuhannya (Locke dkk, 2007).
Buchanan (2008) menjelaskan morfologi bakteri S. iniae adalah koloni tumbuh
pada suhu 25 - 45°C (suhu optimum 37°C) selama 24 - 48 jam, dan berdiameter
0,5 mm.
Bakteri S. iniae menyebabkan penyakit streptococcosis. Penyakit ini biasa
menyerang pada ikan nila dan merupakan golongan HPIK (Hama Penyakit lkan
Karantina) golongan bakteri. Ikan yang terserang streptococosis menunjukkan
gejala seperti sisiknya hilang, gerakan berenang yang tidak menentu (erratic),
sirip gripis (Purwaningsih dan Taukhid, 2010), pigmen kulit lebih gelap
(melanosis), bola mata menonjol (exopthalmia), pendarahan (haemorhagic), perut
kembung (dropsy), pada infeksi yang akut terdapat infeksi pada hati menjadi
pucat, limpa membesar (bengkak), dan terjadi kerusakan pada otak (Purwaningsih
dan Taukhid, 2010).
G. Senyawa Antibakteri
Senyawa antibakteri adalah zat yang dapat menghambat pertumbuhan bakteri dan
dapat digunakan untuk pengobatan infeksi pada manusia, hewan dan tumbuhan.
Senyawa antibakteri dalam bidang farmakologi digunakan untuk membasmi
13
digunakan dengan baik, adalah antibiotik yang memiliki sifat toksisitas selektif
setinggi mungkin. Sifat toksisitas selektif artinya zat antibakteri tersebut harus
toksik untuk bakteri tetapi tidak toksik untuk inang (host). Bila ada zat antibakteri
yang sangat toksik untuk bakteri tetapi membahayakan untuk inang bukan kriteria
antibakteri yang baik, bahkan dianggap beracun. Karena dasar pengobatan
terhadap suatu penyakit adalah usaha untuk menyembuhkan penyakit tersebut
tanpa mengakibatkan adanya bahaya ataupun adanya efek samping yang
merugikan pengguna suatu obat-obatan (Budyanto dan Joni, 2012).
Berdasarkan cara kerjanya antibakteri dibedakan menjadi bakteriostatik dan
bakterisida. Antibakteri bakteriostatik dengan cara menghambat perbanyakan
populasi bakteri dan tidak mematikan, sedangkan bakterisida bekerja membunuh
bakteri. Bakteriostatik dapat bertindak sebagai bakterisida pada konsentrasi tinggi.
(Sari, 2008). Mekanisme kerja senyawa yang bersifat antimikroba ada beberapa
cara, yaitu penghambatan sintesis dinding sel yang menyebabkan kerusakan
dinding sel sehingga terjadi lisis, perubahan permeabilitas membran sel atau
transpor aktif melalui membran sel yang dapat menyebabkan kebocoran dan
kematian sel, penghambatan sintesis protein, dan penghambatan sintesis asam
nukleat (Ramachandran dkk, 2004). Suada (2012) memaparkan, ketentuan kekuatan
antibiotik-antibakteri antara lain:
1. Daerah hambatan 20 mm atau lebih berarti sangat kuat
2. Daerah hambatan 10-20 mm (kuat)
3. Daerah hambatan 5-10 mm (sedang)
14
Penghambatan aktivitas mikroba oleh komponen bioaktif tanaman dapat
disebabkan oleh beberapa faktor, antara lain: (1) gangguan pada senyawa
penyusun dinding sel, (2) peningkatan permeabilitas membran sel yang
menyebabkan kehilangan komponen penyusun sel, (3) menginaktifkan enzim
metabolik, dan (4) dekstruksi atau kerusakan 13 material genetik (Sari, 2008).
Ciri-ciri antibakteri yang baik menurut Pelczar dan Chan (2005) adalah:
1) Mampu membunuh atau menghambat pertumbuhan bakteri.
2) Substansi itu harus dapat larut dalam air atau pelarut-pelarut lain sampai pada
taraf yang diperlukan.
3) Perubahan yang terjadi pada substansi itu bila dibiarkan beberapa lama harus
seminimal mungkin dan tidak boleh mengakibatkan kehilangan sifat
antimikrobialnya dengan nyata.
4) Tidak bersifat racun bagi manusia maupun hewan lain.
5) Komposisinya harus seragam sehingga bahan aktifnya selalu terdapat pada
setiap aplikasi.
6) Tidak bergabung dengan bahan organik.
7) Aktivitas antimikrobial pada suhu kamar atau pada suhu tubuh.
8) Kemampuan untuk menembus dinding sel.
9) Tidak menimbulkan karat dan warna.
10) Kemampuan menghilangkan bau yang kurang sedap.
H. Penggunaan Rhizophora sp. sebagai Antibakteri
Hampir semua bagian tanaman Rhizophora sp. mengandung senyawa alkaloid,
15
bersifat bakterisidal. Oleh karena itu beberapa bagian Rhizophora sp. telah
digunakan sebagai bahan penelitian untuk melihat potensinya sebagai antibakteri.
Penelitian yang dilakukan oleh Feliatra (2000) terhadap beberapa spesies
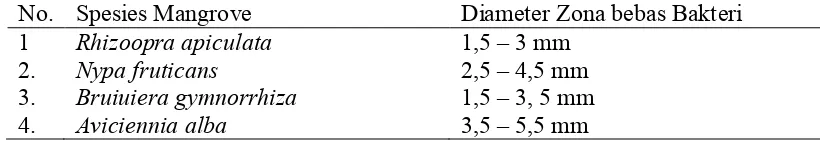
mangrove terhadap bakteri vibrio sp. menunjukkan adanya zona antibakteri (Tabel
1). Zona hambat terbesar dihasilkan oleh Avicennia alba, sementara untuk
Rhizophoraapiculata memiliki zona hambat terkecil.
Tabel 1. Hasil Uji Zona Hambat Mangrove terhadap Vibrio sp. (Feliatra, 2000)
No. Spesies Mangrove Diameter Zona bebas Bakteri
1 Rhizoopra apiculata 1,5 – 3 mm
2. Nypa fruticans 2,5 – 4,5 mm
3. Bruiuiera gymnorrhiza 1,5 – 3, 5 mm
4. Aviciennia alba 3,5 – 5,5 mm
Penelitian lain yang memanfaatkan mangrove Rhizophora adalah Suciati (2012),
dan Setyaningrum (2011). Pada penelitian oleh Suciati, menggunakan 3 jenis daun
dari Rhizophora mucronata sebagai antibakteri terhadap bakteri Aeromonas
salmonicida dan Vibrio harveyi dengan 3 pelarut yang berbeda kepolaran melalui
metode cakram (Tabel 2). Hasil zona hambat terbesar terdapat pada daun pucuk
dengan pelarut methanol. Sedangkan pada A. salmonicida zona hambat bakteri
16 Tabel 2. Hasil Uji Zona Hambat Daun Rhizophora mucronata terhadap
Bakteri A. salmonicida dan V. harveyi (Suciati, 2012)
No. Daun/Pelarut Jenis Sampel Jenis Bakteri & Diameter Zona Hambat A. salmonicida V. harveyi
1. Daun Pucuk/Methanol - 14,8 mm
Pada penelitian oleh Setyaningrum (2011), menggunakan daun Rhizophora
apiculata sebagai antibakteri terhadap bakteri Vibrio parahemolyticus dengan
menggunakan metode cakram menunjukkan kisaran zona bebas bakteri yang
cukup besar (Tabel 3).
Tabel 3. Hasil Uji Zona Hambat ekstrak daun Rhizophora apiculata terhadap V.
parahemolyticus (Setyaningrum, 2011)
No. Konsentrasi Diameter zona bebas bakteri
1. 100 ppm 6,73 mm
2. 200 ppm 7,17 mm
3. 300 ppm 8,53 mm
Pada hasil penelitiannya menunjukkan makin besar konsentrasi ekstrak daun
Rhizophora apiculata maka diameter zona bebas bakteri yang ditimbulkan juga
17
III. METODE PENELITIAN
A. Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan Juli sampai September 2012 bertempat di
Laboratorium Stasiun Karantina Ikan Pengendalian Mutu dan Keamanan Hasil
Perikanan Kelas I Lampung dan Laboratorium Jurusan Budidaya Perairan
Fakultas Pertanian Universitas Lampung.
B. Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah: timbangan digital, gelas ukur,
blender, vortex (BOECO, GermanyTM), mikropipette (Nesco®), autoklaf, vacum
evaporator (Heidolph), lemari es, jangka sorong 0,05 mm, lampu bunsen,
inkubator, cawan petri 150 x 15 mm (Normax®), tabung reaksi 5 ml (Iwaki
glassTM), erlenmeyer 500 ml dan 250 ml (Pyrex®), spreader, pipet tetes, jarum
ose, magnetic stirer, hot plate (Stuart CB162TM), aluminium foil, plastik tahan
panas, kertas kopi, kapas steril, kertas label, masker, karet gelang, sarung tangan,
pisau, korek api, kertas saring, kertas cakram, saringan, tisu, corong, mikroskop,
wadah penetasan Artemia salina, lampu, spektrofotometer (Genesys-20,
Thermospectronic), kamera digital, dan alat tulis.
18
Sedangkan bahan yang digunakan dalam penelitian ini adalah inokulum
murni bakteri A. hydrophila, E. tarda, S. iniae, dan P. stutzeri, ekstrak buah
Rhizophora sp., kista Artemia salina, media TSA (Trypticase Soy Agar)
(OXOID®), media TSB (Trypticase Soy Broth) (OXOID®), media MHB
(Mueller-Hilton Broth) (OXOID®), alkohol 70%, metanol, heksan, etil asetat dan
aquades steril.
C. Metode Penelitian
Pelaksanaan penelitian terbagi menjadi 2 tahap, yaitu:
1. Tahap Persiapan
a. Sterilisasi Alat
Sterilisasi merupakan usaha yang dilakukan untuk membebaskan alat dan
bahan dari mikroorganisme kontaminan. Sterilisasi dapat dilakukan dengan
cara mencuci alat dan bahan yang akan digunakan sampai bersih. Setelah
kering, alat-alat dibungkus menggunakan kertas kopi, hal ini bertujuan untuk
mencegah alat-alat tersebut terkena air, selanjutnya masukan alat-alat tersebut
ke dalam autoklaf dengan suhu 1210C, tekanan 1 atm selama 15-20 menit.
b. Pembuatan Ekstrak
Pembuatan ekstrak dilakukan dengan menggunakan metode maserasi.
Buah dicuci sampai bersih kemudian dikeringkan pada suhu ruangan sampai
kering, selanjutnya buah dihaluskan dengan blender dan diayak dengan
saringan sampai didapatkan bubuk halus.
Proses ekstraksi dilakukan dengan melarutkan 500 gram bubuk buah
19
masing-masing sebanyak 2500 ml. Kemudian hasil maserasi disaring
dengan menggunakan kertas saring dan dievaporasi menggunakan vacum
evaporator dan didapatkan ekstrak buah Rhizophora sp.
c. Penyiapan Bakteri Uji
Bakteri uji yang akan digunakan pada penelitian ini adalah E. tarda, S.
iniae, dan A. hydrophila yang berasal dari Laboratorium Hama dan
Penyakit Ikan, Strasiun Karantina Ikan Pengendalian Mutu dan Keamanan
Hasil Perikanan Kelas I Lampung.
2. Tahap Pelaksanaan
a. Uji Sensitivitas
Uji sensitivitas bertujuan untuk mengetahui potensi antibakteri yang terkandung
di dalam ekstrak buah Rhizophora sp. dengan konsentrasi 100 % yang dilarutkan
menggunakan 3 pelarut berbeda terhadap bakteri A. hydrophilla, E. tarda, P.
stutzeri, dan S. iniae. Uji sensitivitas dilakukan dengan menggunakan metode
difusi (Diffusion Test) menggunakan kertas cakram. Hasil uji aktivitas antibakteri
dengan metode kertas cakram ditunjukkan dengan adanya zona bening di sekitar
kertas cakram. Sebanyak 20 isolat cair bakteri uji masing – masing dengan
kepadatan 107 cfu/ml diinokulasikan pada media TSA dan diratakan dengan
spreader. Kertas cakram dengan diameter 6 mm yang telah direndam di dalam
ekstrak buah Rhizophora sp yang dilarutkan dengan 3 jenis pelarut berbeda
(heksana, etil asetat dan methanol) selama 15 menit, kemudian diletakkan pada
permukaan media TSA, lalu media TSA diinkubasi selama 18-24 jam.
20
Rhizophora sp. yang terbentuk terhadap bakteri A. hydrophilla, E. tarda, P.
stutzeri, dan S. iniae. Hasil dari uji sensitivitas yang menunjukkan diameter
terbesar dari 1 pelarut ke 1 bakteri yang akan dipakai di dalam uji zona hambat.
b. Uji Zona Hambat
Uji zona hambat dilakukan dengan menggunakan metode difusi (Diffusion Test)
menggunakan kertas cakram. Uji zona hambat dilakukan berdasarkan hasil dari uji
sensitivitas ekstrak buah Rhizophora sp. yang menunjukan potensi antibakteri.
Sebanyak 20 isolat cair bakteri yg ditentukan dari uji sensitivitas dengan hasil
diameter zona hambat terbesar dengan kepadatan 107 cfu/ml diteteskan pada
media TSA lalu diratakan dengan spreader. Kertas cakram dengan diameter 6
mm yang telah direndam di dalam ekstrak buah Rhizophora sp. pada konsentrasi
100, 200, 300, 400, 500 dan 600 mg/l selama 15 menit, kemudian diletakkan
pada permukaan media TSA. Kontrol positif dilakukan dengan memberikan
kertas cakram berisi antibiotik oxytetracycline, sedangkan kontrol negatif berupa
kertas cakram netral (hanya diberi akuades). Setelah masa inkubasi, kemudian
diamati dan diukur diameter zona hambat yang terbentuk di sekitar kertas cakram
tersebut dengan jangka sorong.
c. Uji MIC (Minimum Inhibitory Concentration)
Uji MIC dilakukan berdasarkan hasil uji zona hambat. Uji MIC bertujuan untuk
mencari konsentrasi terendah bahan anti bakteri yang dapat menghambat
pertumbuhan bakteri. Metode Penentuan MIC langkah awal yang dilakukan yaitu
disiapkan tabung reaksi steril dan dimasukkan 4,5 ml media MHB ke dalam
21
100, 200, 300, 400, 500, 600 mg/l dan kontrol, kontrol positif berupa antibiotik
oxytetracyline, sedangkan kontrol negatif hanya diberi bakteri, dimasukkan
sebanyak 0,5 ml ke dalam masing-masing tabung reaksi. Kemudian suspensi
bakteri uji dengan kepadatan 107 cfu/ml sebanyak 0,1 ml ditambahkan kedalam
masing-masing tabung reaksi dan divortek hingga homogen. Media MHB
diinkubasi pada suhu ruang selama 24 jam. Hasil pengamatan dibandingkan
dengan larutan pembanding (larutan MHB dicampur ekstrak buah Rhizophora
tanpa ditambah bakteri) sehingga dapat diketahui adanya media yang mulai
bening/jernih yang menunjukkan nilai MIC. Nilai-nilai MIC ditafsirkan sebagai
pengenceran tertinggi dan konsentrasi terendah (Wilson, 2005).
Pengamatan uji MIC dilakukan dengan melihat kekeruhan media MHB yang
telah diberi ekstak buah Rhizophora sp.
d. Uji MBC (Minimum Bactericidal Concentration)
Penentuan MBC dapat dilakukan setelah menginokulasikan larutan dari tabung
MIC terjernih pada media. Diambil 0,1 ml suspensi bakteri dari tabung pada
perlakuan yang menunjukkan nilai MIC sampai konsentrasi sebesar 100%,
kemudian ditumbuhkan dalam medium TSA. Diinkubasi pada suhu ruang selama
24 jam. Setelah diinkubasi, dihitung jumlah koloni yang tumbuh pada medium
TSA. Nilai MBC ditentukan dari konsentrasi terendah ekstrak yang menunjukkan
tidak adanya pertumbuhan koloni pada cawan petri. Pengamatan uji MBC
dilakukan dengan melihat konsentrasi terendah ekstrak yang menunjukkan tidak
22
e. Uji Toksisitas (Brine Shrimp Lethality Test)
Brine Shrimp Lethality Test (BSLT) merupakan salah satu metode uji toksisitas
yang banyak digunakan dalam penelusuran senyawa bioaktif yang bersifat toksik
dari bahan alam. Uji Toksisitas dengan Metode BSLT digunakan untuk
mempelajari toksisitas sampel secara umum dengan menggunakan Artemia salina.
Penetasan Kista A. salina.
Wadah berbentuk kerucut disiapkan untuk penetasan kista A. salina. Lampu
diletakkan di atas wadah untuk menghangatkan suhu dalam penetasan. Wadah
diisi air laut dan diberi aerasi, kemudian dimasukan kista A. salina sebanyak 1 gr.
Lampu dinyalakan selama 48 jam untuk menetaskan kista. Setelah menetas larva
A. salina diambil dengan pipet.
Persiapan Larutan Sampel yang akan diuji.
Larutan sampel yang akan diuji dibuat dengan perbandingn 0,5 : 1 : 1,5 : 2 : 2,5 :
3 kali dari konsentrasi hasil terbaik uji MIC.
Prosedur Uji Toksisitas dengan Metode BSLT.
Larutan sampel yang akan diuji masing-masing perbandingan konsentrasi 0,5 : 1 :
1,5 : 2 : 2,5 : 3. Setiap konsentrasi dilakukan 3 kali pengulangan. Kontrol
dilakukan tanpa penambahan sampel. Penambahan larutan ekstrak dan air laut
sampai volume 2 ml. Larva A. salina dimasukkan masing-masing 20 ekor dengan
menggunakan pipet ke dalam wadah uji. Larutan dibiarkan selama 24 jam,
kemudian dihitung jumlah larva yang hidup dan mati dari tiap perlakuan.
Selanjutnya dihitung mortalitas A. salina. Grafik dibuat dengan log konsentrasi
sebagai sumbu x terhadap mortalitas sebagai sumbu y. Nilai LC50 merupakan
23
memakai persamaan regresi linier y = a + bx. Suatu zat dikatakan aktif atau toksik
bila nilai LC50 < 1000 ppm untuk ektrak (Juniarti, 2011).
= ℎ 100%
f. Uji Inhibition Time Course
Uji inhibition time course bertujuan untuk melihat waktu ekstrak Rhizopora sp.
dapat menghambat bakteri. Langkah awal dalam uji inhibition time course
pertama membuat media TSB dengan aquades steril, dimasukan kedalam tabung
erlemayer masing – masing sebanyak 50 ml, kemudian ekstrak dimasukan
kedalam masing – masing tabung erlenmayer sehingga dosis ekstrak menjadi 1
MIC, 2 MIC, dan 3 MIC, dengan kontrol positif menggunakan oxytetracyline, dan
kontrol negatif tanpa pemberian antibiotik. Kemudian, sebanyak 50 µl dengan
kepadatan 105 sel/ml inokulasi bakteri yang telah disiapkan 1 hari sebelumnya
dimasukan kedalam erlenmayer. Pengamatan dilakukan setiap 3 jam selama 24
jam, pengamatan dilakukan dengan menggunakan spektrofotometer. Pengamatan
Uji Inhibition Time Course dilakukan dengan menghitung kepadatan bakteri
✂ ✄☎ESIMPULAN DAN SARAN
A. Kesimpulan
Dari hasil penelitian maka dapat disimpulkan bahwa:
1. ekstrak buah Rhizophora sp. memiliki respon hambat yang lemah dalam
menghambat pertumbuhan bakteri S. iniae, dan melalui uji toksisitas
menunjukkan ekstrak buah Rhizophora sp. bersifat toksik sehingga tidak
dapat digunakan pada uji In vivo.
2. uji Inhibition Time Course selama 24 jam belum menunjukan waktu ekstrak
buah Rhizophora sp. dalam menghambat pertumbuhan bakteri S. iniae
B. Saran
1. Perlu dilakukan uji fitokimia untuk mengetahui kandungan bahan alami yang
terdapat pada buah Rhizophora sp. sehingga dapat dieksplorasi potensinya
lebih jauh.
2. Perlu dilakukan perbaikan pada proses pengeringan bahan dan metode
ekstraksi, seperti bahan sediaan untuk ekstraksi, dan tingkat kehalusan
sediaan ekstraksi.
3. Perlu penambahan waktu dalam uji Inhibition Time Course ekstrak buah
DAFTAR PUSTAKA
Aryanti, 2004. Isolasi Senyawa Antikanker Dari Tanaman Keladi Tikus (Typhonium divaricatum L. Decne). Jurnal Bahan Alam Indonesia ISSN 1412-2855 Vol.3(2): 188-190.
Baiano, Justice C.F. and Andrew C. Barnes. 2009. Towards Control Of Streptococcus iniae. Emerging Infectious Diseases. Vol. 15(12): 1891-1896 p.
Bisharat, Naiel, Tatiana Gorlachev and Yoram Keness. 2012. 10-Years Hospital Experience In Pseudomonas stutzeri and Literature Review. The Open Infectious Disease Journal, 6: 21-24 p.
Bromage, E.S, A. Thomas, and L. Owens. 1999. Streptococcus iniae, A Bacterial Infection In Barramundi Lates calcalifer. Disease Of Aquatic Organisms. Vol. 36: 177-181p.
Bryan, Sheri-Ann J. 1999. Starvation Responses of Pseudomonas Stutzeri. Thesis. Seton Hall University.
Buchanan, John T., Kelly M. Colvin, Mike R. Vicknair, Silpa K. Patel, Anjuli M. Timmer, and Victor Nizet. 2008. Strain-Associated Virulence Factors Of Streptococcus iniae In Hybrid-Striped Bass. Veterinary Microbiology 131: 145-153p.
Budyanto, Ponco, dan Joni Kusnadi. 2012. Formulasi Edible Film Antibacterial Active Packaging Dengan Penambahan Ekstrak Antibakteri Daun Jati. Jurnal. Universitas Brawijaya, Malang.
Damayanti, Ema., dan T.B. Supardjana. 2007. Efek Penghambatan Beberapa Fraksi Ekstrak Buah Mengkudu Terhadap Shigella dysenteriae. Prosiding Semnas Teknik Kimia. Universitas Jendral Soedirman. Purwokerto
Gardenia, Lila, Isti Koesharyani, Hambali Supriyadi, dan Tatik Mufidah. 2010. Aplikasi Deteksi Aeromonas hydrophila Penghasil Aerolysin Dengan Menggunakan Polymerase Chain Reaction (PCR). Jurnal Prosiding Forum Inovasi Teknologi Akuakultur. Hal: 877-883.
Guasp, Caterina, Edward R.B. Moore, Jorge Lalucat, and Antonio Bennasar.
40
The Definition of Pseudomonas stutzeri Genomovars and Other
Pseudomonas Species. International Journal of Systematic and Evolutionary
Microbiology. Great Britain. 50: 1629–1639p.
Hardhianto, Mochammad Dwi, Boedi S. Rahardja, dan Gunanti Mahasri. 2010. Efektivitas Bakteri Pseudomonas Sebagai Pengurai Bahan Organik (Protein Karbohidrat, Lemak) Pada air Limbah Pembenihan Ikan Lele Dumbo (Clarias sp.) Sistem Sirkulasi Tertutup. Abstrak Tesis.
Herupradoto, B. A, dan Gandul Atik Yuliani. 2010. Karakterisasi Protein Spesifik Aeromonas hydrophila Penyebab Penyakit Ulser Pada Ikan Mas. Jurnal
Veteriner Vol. 11 No. 3: 158–162.
Irwanto. 2008. Hutan Mangrove dan Manfaatnya. Ambon.
Irwanto. 2006. Keanekaragaman Fauna pada Habitat Mangrove. Yogyakarta.
Janda, J. Michael and Sharon L. Abbott. 2010. The Genus Aeromonas: Taxonomy, Pathogenicity, and Infection. Clinical Microbiology Review Vol.23 (1): 35-73.
Jayavignesh, V., K. Sendesh Kannan, and Abhijith D. Bath. 2011. Biochemical Characterization and Cytotoxicity of The Aeromonas hydrophila Isolated From Catfish. Archives of Applied Science Research Vol 3 (3): 85-93.
Juliantina, F., Dewa Ayu C.M., Bunga Nirwani, Titis Nurmasitoh, dan Endrawati Tri Bowo. 2009. Manfaat Sirih Merah (Piper crocatum) Sebagai Agen Antibakterial Terhadap Bakteri Gram Positif dan Gram Negatif. Jurnal Kedokteraan dan Kesehatan Indonesia.
Juniarti, Delvi Osmeli, dan Yuhernita. 2009. Kandungan Kimia, Uji Toksisitas
(Brine Shrimp Lathalitytest) Dan Antioksidan
(1,1-diphenyl-2-pikrilhydrazyl) Dari Ekstrak Daun Saga (Abrus precatorius L.). Makara Sains Vol.13(1): 50-54.
Locke, J.B., Kelly M. Colvin, Nissi Varki, Mike R. Vicknair, Victor Nizet, and John T. Buchanan. 2007. Streptococcus iniae B-Hemolysin Streptolysin S Is A Virulence Factor In Fish Infection. Disease of Aquatic Organisms. Vol.76: 17-26.
Masibo, M. and He, Q. 2009. In Vitro Antimicrobial Activity and The Major Polyphenol In Leaf Extract of Mangifera indica L. Malaysian Journal of Microbiology. Vol.5(2): 73-80.
41
Noor, Y.R., M. Khazali, dan I N.N. Suryadiputra. 2006. Panduan Pengenalan Mangrove di Indonesia. PHKA/WI-IP. Bogor
Park, Seong Bin, Takashi Aoki, and Tae Sung Jung. 2012. Pathogenesis of and Strategies for Preventing Edwardsiella tarda Infections In Fish. Veterinary Research, 43:67
Pelczar MJ, and Chan ECS. 2005. Dasar-Dasar Mikrobiologi 2. Hadioetomo RSi Imas T, Tjitrosomo SS, Angka SL. Penerjemah. Jakarta: UI Press. Terjemahan dari : Elements of Microbiology.
Pier GB, Madin SH. 1976. Streptococcus iniae sp. nov., a betahemolytic
streptococcus isolated from an Amazon freshwater Dolphin, Inia
geoffrensis. International Journal of Systematic bacteriology 26 (4): 545-53.
Purnobasuki, Hery. 2004. Potensi Mangrove Sebagai Tanaman Obat. Biota IX (2): 125-126.
Purwaningsih, Uni dan Taukhid. 2010. Vaksin Anti Streptococcus spp. Inaktivasi Melalui Heatkilled Untuk Pencegahan Penyakit Streptococcosis Pada Ikan
Nila (Oreochromis niloticus). Prosiding Forum Inovasi Teknologi
Akuakultur. Hal.: 901-904
Rahayu, I.D. 2008. Produksi Antibiotik Alami Hasil Isolasi Aloe barbadensis
Miller :Penanggulangan Mastitis pada Sapi Perah. Laporan Penelitian
Hibah
Ramachandran, T., Rajendrakumar K., dan Rajendran R., 2004. Antimicrobial
Textiles–an Overview. IE (I) Journal. Vol.84: 42-47.
Rinawati. N. D., 2011. Daya Antibakteri Tumbuhan Majapahit (Cresentia cujete L.) Terhadap Bakteri Vibrio Alginolyticus. Tugas Akhir Program Studi Biologi ITS. Surabaya.
Rohaeti, E., Batubara, I., Lieke, A., dan Darusman, LK. 2010. Potensi Ekstrak Rhizophora sp. Sebagai Inhibitor Tirosinase. Prosiding Semnas Sains III. IPB. Bogor.
Sari, D.K. 2008. Penapisan Antibakteri dan Inhibitor Topoisomerase I dari Xylocarpus granatum. Tesis. ITB. Bogor
42
Soeroyo dan Suyarso. 2000. Kondisi Dan Inventarisasi Hutan Mangrove Di Kawasan Teluk Lampung. Puslitbang Oseanografi. LIPI. Hal. 95-102
Suada, I Ketut. 2012. Keragaman Aktivitas Antifungi Biota Laut Terhadap Fusarium oxysporum f.sp. vanillae Penyebab Busuk Batang Vanili. Jurnal Bumi Lestari, Vol. 12 (1): 66-70.
Sukardjo, Sukristijono. 1984. Ekosistem Mangrove. Oseana. Volume IX (4): 102-115.
Tan, Y.P., Q. Lin, X.H. Wang, S. Joshi, C.L. Hew, and K.Y. Leung. 2002. Comparative Proteomic Analysis of Extracellular Proteins of Edwardsiella tarda. Infections and Immunity Vol.70(11): 6475-6480.
Trianto A. Wibowo, E. Suryono, dan Sapta R. 2004. Ekstrak daun mangrove Aegiceras corbiculatum sebagai antibakteri Vibrio harveyi dan vibrio parahaemolyticus. Ilmu kelautan 9(4):186-189.
Underwood, J.C.E. 2006. Patologi Umum dan Sistematik. Penerjemah: Prof. Dr. Sarjadi, dr., SpPA. Penerbit Buku Kedokteran EGC.
Weinstein, M.R., Margaret Litt, Daniel A. Kertesz, Phyllis Wyper, David Rose, Mark Coulter, Allison McGeer, Richard Facklam, Carola Ostach, Barbara M. Willey, Al Borczyk, and Donald E. Low. 1997. Invasive Infections Due To A Fish Pathogen, Streptococcus iniae. The New England Journal of Medicine Vol.337(9): 589-594.