SINTESIS TURUNAN ARILAMIDA-2 DAN UJI AKTIVITAS IN VITRO TERHADAP MATRIX METALLOPROTEINASE-9 (MMP-9) SEBAGAI
KANDIDAT ANTI-KANKER PAYUDARA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Benedictus Wisnu Putra Jati NIM: 158114102
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
SINTESIS TURUNAN ARILAMIDA-2 DAN UJI AKTIVITAS IN VITRO TERHADAP MATRIX METALLOPROTEINASE-9 (MMP-9) SEBAGAI
KANDIDAT ANTI-KANKER PAYUDARA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Benedictus Wisnu Putra Jati NIM: 158114102
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“Barangsiapa Ingin Mutiara Harus Berani Terjun
di Lautan yang Dalam”
(Ir. Soekarno)
“Sesungguhnya aku ini adalah
Hamba Tuhan,
terjadilah padaku menurut perkataanM
u itu” (St.
Perawan Maria) (Lukas 1:38)
vii PRAKATA
Puji Syukur penulis panjatkan kepada Tuhan Yang Maha Esa, karena atas berkat dan rahmat-Nya, skripsi yang berjudul Sintesis Turunan Arilamida-2 dan Uji Aktivitas In Vitro Terhadap Matrix Metalloproteinase-9 (MMP-9) Sebagai Kandidat Anti-Kanker Payudara dapat diselesaikan dengan baik. Skripsi ini disusun sebagai syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm.) di Universitas Sanata Dharma Yogyakarta.
Skripsi ini merupakan bagian dari penelitian Maywan Hariono, Ph.D., Apt. yang didanai oleh Indonesian Toray Science Foundation (ITSF) 2017-2018 dengan judul “Synthesis, enzymatic assay, and molecular modelling of purine derivatives targeting hemopexin domain of matrix metalloproteinase-9 (PEX-9) in the
discovery of novel anti-breast cancer”.
Penulis juga ingin memberikan apresiasi yang besar kepada berbagai pihak yang telah memberikan dukungan, bimbingan, dan bantuan dalam penyelesaian naskah skripsi ini, tanpa mereka penulis tidak akan bisasampai pada tahap ini. Oleh karena itu, peneliti ingin mengucapkan terimakasih yang besar kepada:
1. Ibu Dr. Yustina Sri Hartini, Apt. selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ibu Dr. Christine Patramurti, Apt. selaku Ketua Program Studi Farmasi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
3. Bapak Maywan Hariono, Ph.D., Apt. selaku dosen pembimbing skripsi yang telah membimbing tim penelitian dengan sabar, selalu memberikan perhatian, semangat, dukungan, motivasi, kritik, dan saran dari awal hingga akhir penyusunan skripsi ini.
4. Ibu Phebe Hendra, M.Si., Ph.D., Apt. dan Ibu Dr. Erna Tri Wulandari, M.Si., Apt. selaku dosen penguji yang selalu memberikan semangat, kritik, dan saran yang membangun untuk penulis menyelesaikan skripsi ini.
viii
6. Bapak Matius Abdullah Chaidir dan Ibu Gertruda Tri Teguh Rahayu, S.Pd. yang selalu memberikan dukungan, motivasi, semangat, dan doa untuk mendampingi penulis menyelesaikan skripsi ini.
7. Teman-teman seperjuangan penelitian “Skripsi Kok Analog” Kevin, Krisna, Ervan, Aldo, dan Sangga yang telah berjuang dan bekerja sama dengan penulis melewati suka dan duka dalam menyelesaikan penelitian ini.
8. Sahabat tercinta “Dolan Squad” dan “Quebec” Aldo, Krisna, Retha, Bulin, Inge, dan Masrud yang telah menjalani bersama masa suka dan duka dalam dunia perkuliahan dalam tiga setengah tahun ini.
9. Teman dan keluarga Drug Discovery Research Group terutama para senior Tito, Diana, dan Eko serta divisi penelitian dan pengembangan BEMF Farmasi 2017-2018 yang telah membantu penulis dalam penelitian ini.
10. Sahabat tercinta Almarhum Andreas Ardi Marwanto yang juga menjadi salah satu motivasi penulis untuk masuk dalam dunia penemuan obat khususnya kanker ini.
11. Aurel, Wanda, Laras, Rio, Echa, Dodo, Gilang, Ega, dan Vidan selaku sahabat terbaik sejak kecil yang juga selalu hadir dalam jalinan persahabatan bersama penulis.
12. Pak Parlan, Mas Kunto, Pak Wagiran, dan Mas Bimo selaku laboran yang selalu membantu penulis dalam pelaksanaan penelitian.
13. Teman-teman kelas FSM C 2015 dan Angkatan 2015 yang memberikan dinamika dan kenangan yang indah selama masa perkuliahan di farmasi. 14. Semua pihak yang tidak bisa penulis sebutkan satu persatu telah mendukung
penyelesaian naskah skrripsi ini.
Penulis menyadari masih terdapat banyak kekurangan dalam skripsi ini. Oleh karena itu penulis sangat mengharapkan kritik, saran, dan masukan yang membangun untuk perbaikan skripsi ini. Penulis berharap skripsi ini dapat bermanfaat untuk pengembangan ilmu pengetahuan dan penelitian khususnya dalam bidang farmasi penemuan obat. Terimakasih.
ix
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN PERSETUJUAN PUBLIKASI ... v
PERNYATAAN KEASLIAN KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
ABSTRAK ... xiii
ABSTRACT ... xiv
PENDAHULUAN ... 1
METODE PENELITIAN ... 4
HASIL DAN PEMBAHASAN ... 7
KESIMPULAN ... 18
SARAN ... 18
UCAPAN TERIMAKASIH ... 19
DAFTAR PUSTAKA ... 20
LAMPIRAN ... 23
x
DAFTAR TABEL
Tabel I. Hasil uji kelarutan senyawa turunan arilamida-2 ... 10
Tabel II. Hasil spektrum 1H-NMR senyawa arilamida-2 ... 11
Tabel III. Hasil spektrum 13C-NMR senyawa arilamida-2 ... 14
xi
DAFTAR GAMBAR
Gambar 1. Struktur senyawa dan farmakofor penting (a) senyawa 2 (Dufour
et al. 2011), (b) senyawa 3c (Alford et al. 2017), (c) senyawa arilamida-2 ... 3
Gambar 2. Reaksi substitusi asil nukleofilik antara benzokain dan 3-bromopropionil klorida dengan menggunakan piridin sebagai katalis nukleofil. ... 8
Gambar 3. Hasil spektrum 1H-NMR senyawa turunan arilamida-2 ... 10
Gambar 4. Hasil spektrum 13C-NMR senyawa turunan arilamida-2 ... 13 Gambar 5. Hasil spektrum inframerah (a) senyawa arilamida-2 (b)
xii
DAFTAR LAMPIRAN
Lampiran 1. Dokumentasi hasil sintesis, dan profil KLT senyawa turunan arilamida-2 ... 23 Lampiran 2. Uji DAB-HCl ... 25 Lampiran 3. Perhitungan bahan sintesis dan hasil rendemen senyawa
arilamida-2 ... 26 Lampiran 4. Perbesaran puncak pada spektrum 1H-NMR ... 27 Lampiran 5. Usulan mekanisme fragmentasi molekul utuh dan base peak
xiii ABSTRAK
Enzim MMP-9 diekspresikan secara tinggi pada kanker payudara dengan permasalahan, inhibitor yang telah dirancang untuk enzim tersebut bersifat tidak selektif sehingga menyebabkan efek samping yang merugikan. Pada penelitian ini telah disintesis senyawa arilamida-2 sebagai penghambat MMP-9 yang dirancang lebih selektif dengan menghambat hemopexin domain MMP-9 (PEX-9). Senyawa arilamida-2 berhasil disintesis dengan mereaksikan benzokain dan 3-bromopropionil klorida dengan katalisator piridin melalui mekanisme reaksi substitusi nukleofilik asil. Senyawa hasil sintesis dilakukan uji organoleptis, kelarutan, titik lebur, dan warna dengan DAB-HCl. Produk yang terbentuk berupa serbuk berwarna putih, larut dalam etil asetat, kloroform, dan DMSO. Titik lebur senyawa hasil sintesis adalah 116-124oC yang bereaksi negatif terhadap DAB-HCl mengindikasikan gugus amina primer dari benzokain sudah tersubstitusi. Senyawa hasil sintesis dipastikan strukturnya dengan menggunakan 1H-NMR, 13C-NMR, FTIR, dan GC-MS. Spektrum 1H-NMR menunjukan proton etilen pada geseran kimia 2-4 ppm dan karbon etilen pada 20-40 ppm untuk 13C-NMR. Gugus karbonil amida dideteksi dengan FTIR muncul pada 1535 cm-1 sementara bobot molekul senyawa hasil sintesis dideteksi dengan MS sebesar m/z 299. Hasil uji aktivitas in vitro terhadap enzim 9 menunjukan persentase penghambatan enzim MMP-9 sebesar 36% yang berasosiasi dengan aktivitas rendah-sedang senyawa arilamida-2 sebagai inhibitor MMP-9.
xiv
ABSTRACT
MMP-9 is highly expressed in breast cancer with the major issue, the inhibitor which has been designed for the corresponding enzyme having non-selective properties, therefore this causes some adverse drug reactions. In this study, it has been synthesized arylamide-2 as MMP-9 inhibitor which is designed to be more selective by inhibiting hemopexin domain of MMP-9 (PEX-9). Arylamide-2 was successfully synthesized by reacting benzocaine and 3-bromopropionyl chloride using pyridine as the catalyst through the mechanism of acyl nucleophilic substitution reactions. Synthesized compound was carried out by an organoleptic, solubility, melting point, and color with DAB-HCl test. The product was formed as a white powder which is soluble in ethyl acetate, chloroform, and DMSO. The melting point of the synthetic product was measured at 116-124oC, while negatively reacting with DAB-HCl indicating that primary amine has been substituted. The synthesized compound structure was confirmed using 1H-NMR by showing ethylene proton at 2-4 ppm whereas the ethylene-carbon appears at 20-40 ppm as confirmed by 13C-NMR. The amide carbonyl group was indicated at 1535 cm-1 as confirmed by FTIR while the molecular weight was detected using GC-MS by showing m/z 299. The result showed that arylamide-2 was able to inhibit MMP-9 with percentage inhibition of 36% at 200 µg/ml concentration associating with its potency as weak to moderate inhibitor of MMP-9 in searching of anti-breast cancer candidate.
1 PENDAHULUAN
Kanker merupakan penyakit kedua penyebab utama kematian di dunia. Pada tahun 2018, terdapat 18,1 juta kasus kanker baru di dunia. Kanker payudara merupakan kasus yang paling sering terjadi pada wanita (World Health Organization, 2018). Pada tahun 2013, kanker payudara merupakan salah satu kanker dengan prevalensi tertinggi di Indonesia yaitu sebesar 0,5%. Daerah Istimewa Yogyakarta merupakan provinsi dengan prevalensi kanker payudara tertinggi yaitu sebesar 2,4% (Kementrian Kesehatan RI, 2016). Menurut World Health Organization (2014), kematian akibat kanker payudara pada wanita di Indonesia cukup tinggi yaitu sebesar 21,4%.
Kanker adalah penyakit yang ditandai dengan pertumbuhan sel yang tidak normal dan tidak teratur yang disebabkan oleh mutasi genetik serta dapat mengalami invasi dan penyebaran sel dari satu bagian tubuh ke bagian tubuh yang lain. Metastasis menjadi penyebab utama kematian pada penderita kanker (Pecorino, 2012). Menurut American Cancer Society (2018) metastasis sel kanker ke organ-organ viseral seperti pankreas, kolon, dan paru-paru merupakan hal yang paling membahayakan nyawa dengan memperpendek harapan hidup kurang dari 5 tahun pada 20% penderita kanker secara umum. Lebih daripada itu, metastasis menyebabkan kematian pada 90% penderita kanker (Alford, 2017).
Pada tahun 2014, menurut penelitian yang dilakukan Yousef et al. (2014) enzim Matrix Metalloproteinase 9 (MMP-9) diekspresikan tinggi pada sel kanker payudara dibandingkan dengan sel payudara normal. Selain itu, ditemukan
overexpression MMP-9 pada kanker payudara jenis triple-negative dan Human Epidermal ReceptorGrowth Factor Receptor 2 positive (HER 2-positive). Merdad
et al., (2014) juga mengemukakan bahwa MMP-9 diekspresikan tinggi pada 97,5 % penderita kanker payudara Infiltrating Ductal Carcinoma (IDC), serta pada 52-62% penderita kanker payudara Human Epidermal Receptor (HER).
Enzim MMP-9 merupakan salah satu peptidase yang termasuk dalam subfamilia dari enzim matrix metalloproteinase (MMP). MMP merupakan enzim jenis zinc-dependent endopeptidase yang bekerja dengan mendegradasi protein
2
yang diklasifikasikan kedalam 6 jenis subfamilia MMP berdasarkan spesifitasnya terhadap substrat (collagenases, gelatinases, stromelysins, matrilysins, enamelysin,
membrane type MMPs) (Benson et al., 2013). MMP-9 tergolong ke dalam subfamilia MMP gelatinase B karena substratnya adalah gelatin. Degradasi ECM
oleh MMP-9 sangat penting pada proses kanker untuk memicu proses angiogenesis dan metastasis sel kanker yang dapat bermigrasi ke daerah tubuh yang lain (Stankovic et al., 2010).
Melihat pentingnya peran enzim MMP pada kanker, beberapa industri farmasi telah merancang beberapa obat yang memiliki sifat penghambatan pada MMP (MMP inhibitors) yang diharapkan mampu menjadi salah satu terapi kanker. Namun, sebagian besar obat tersebut gagal melewati uji klinis karena kurang selektif sehingga menimbulkan efek samping yang besar. Sebagai contoh, marimastat menimbulkan efek samping berupa nyeri muskoskeletal dan inflamasi (Cathcart et al., 2015). Sebagian besar MMP memiliki struktur genomik yang sama yaitu propeptide region, catalytic domain, linker peptide (hinge region), dan
hemopexin domain (Nagase et al., 2006). Kegagalan MMP inhibitors tersebut karena sebagian besar obat yang telah dirancang sebagai MMP inhibitor memiliki spesifisitas yang rendah (Vandenbroucke dan Libert, 2014). Hal ini disebabkan obat-obat tersebut mentargetkan catalytic domain yang memiliki persamaan sekuens asam-asam amino (homologi) yang tinggi pada sebagian besar MMP (43-65%) (Dufour et al., 2011).
3
melakukan penelitian tentang PEX-9 dan menemukan 5 senyawa aktif berdasarkan penapisan virtual dengan metode in silico, uji in vitro, dan uji in vivo pada tikus yang telah diinduksi dengan sel kanker MDA-MDB 435 sehingga mengalami karsinogenesis. Senyawa yang paling aktif adalah CID135415473
www.pubchem.ncbi.nlm.nih.gov yang dinamakan senyawa 2 dengan Kd = 2,2 μM. Senyawa tersebut memiliki struktur relatif sederhana untuk disintesis sehingga berpotensi untuk dikembangkan lebih lanjut. Gugus yang berperan dalam aktivitas penghambatan PEX-9 adalah cincin planar yang memiliki interaksi dengan pocket blade PEX-9 dan juga memiliki arilamida yang terhubung oleh rantai alkil untuk berinteraksi di daerah permukaan pocket. Gambar 1(a) dan 1(b) menunjukkan struktur senyawa 2 yang ditemukan oleh Dufour et al. (2011) dan Alford et al. (2011).
(a)
(b)
(c)
Gambar 1. Struktur senyawa dan farmakofor penting (a) senyawa 2 (Dufour et al. 2011), (b) senyawa 3c (Alford et al. 2017), (c) senyawa arilamida-2.
Gugus difluorometoksi
Rantai alkil Cincin planar
Gugus Fluoro
Gugus arilamida Rantai alkil
Cincin planar Gugus arilamida
Rantai alkil
4
Pada penelitian kali ini telah disintesis senyawa fragmen dari senyawa 2 dengan mengambil sebagian farmakofor yang penting, yang akan diberi nama turunan arilamida-2. Farmakofor yang diadaptasi untuk disintesis ialah gugus arilamida dan rantai alkil. Selain itu juga dilakukan modifikasi pada posisi para dari cincin arilamida yaitu berupa ester etil benzoat. Struktur senyawa turunan arilamida-2 dapat dilihat pada gambar 1(c). Senyawa akan disintesis dengan mereaksikan benzokain dan 3-bromopropionil klorida dengan katalis piridin melalui mekanisme reaksi substitusi nukleofilik asil (SNA). Kemudian senyawa
turunan arilamda-2 tersebut akan diuji aktivitasnya terhadap enzim MMP-9 secara
in vitro. Penelitian ini diharapkan dapat menambah jumlah senyawa penghambat PEX-9 yang diharapkan aktif dan selektif sebagai kandidat anti-kanker payudara.
METODE PENELITIAN Bahan
Bahan kimia yang digunakan dalam penelitian kecuali dinyatakan lain bermutu analisis yang disuplai dari Sigma Aldrich dan Merck. Bahan-bahan untuk sintesis meliputi: benzokain mutu farmasetis (ethyl 4-aminobenzoate), 3-bromopropionil klorida mutu pro analisis, piridin mutu pro analisis, natrium karbonat mutu teknis (Na2CO3), plat kromatografi lapis tipis (KLT) silika gel GF254, pelarut organik sebagai fase gerak (n-heksana dan etil asetat) mutu pro analisis, dan 4-dimetilano benzaldehid HCl (DAB-HCl) mutu pro analisis. Bahan-bahan untuk elusidasi struktur meliputi: pellet kalium bromide mutu pro analisis untuk FTIR dan pelarut kloroform-D (CDCl3) pro analisis untuk NMR. Bahan-bahan untuk uji aktivitas in vitro bermutu pro analisismeliputi: Kit enzim MMP-9 terdiri dari enzim MMP-9 terliofilisasi, substrat peptide, dapar, peptida NNGH sebagai kontrol positif, gliserol untuk rekonstitusi enzim, dan dimetilsulfoksida (DMSO) sebagai pelarut sampel.
Alat
5
GmbH + Co.KG), labu alas bulat (pyrex), pengaduk magnetik, lempeng panas, drupple plate, seperangkat alat uji titik lebur (Mettler Toledo®), lampu UV254, dan alat gelas pada umumnya. Ala-alat yang digunakan pada elusidasi struktur meliputi: kromatografi gas-spektrofotometer inframerah (GC-MS-QP2010S SHIMADZU), spektrometer nuclear magnetic resonance (Bruker 700 MHz dan 176 MHz), dan spektrometer massa. Alat-alat untuk uji in vitro meliputi: pipet mikro (Eppendorf),
micro well plate96, pipet tips, inkubator, vortex, ELISA Tecan Infinite 200 PRO microplate reader fluorescence.
Prosedur Penelitian
Sintesis Senyawa Arilamida-2 (Diadaptasi dari Arifiyanto, 2001)
Dalam labu alas bulat dimasukkan benzokain sebanyak 3,59 mmol (0,59 g) kemudian ditambahkan piridin sebagai katalisator sebanyak 3,59 mmol (0,28 g ; 0,29 mL). Campuran diaduk selama 10 menit pada suhu kamar. 3-bromopropionil klorida ditambahkan tetes demi tetes sebanyak sebanyak 4,00 mmol (0,41 mL). Campuran diaduk kembali selama 30 menit hingga tebentuk padatan. Padatan disaring kemudian dinetralkan dengan Na2CO3 10% dan dicuci dengan akuades untuk menghilangkan sisa piridin, NaCl, dan CO2 sebagai produk samping. Serbuk hasil sintesis kemudian dihitung rendemennya.
Uji Organoleptis
Senyawa hasil sintesis dideterminasi bentuk dan warnanya. Uji Kelarutan
Senyawa hasil sintesis diletakkan pada tabung reaksi kemudian ditetesi perlahan-lahan dengan kloroform, etil asetat, DMSO, etanol, air, n-heksana, dan aseton hingga larut dan ditentukan kategori kelarutannya berdasarkan Farmakope Indonesia V.
Rekristalisasi
6 Uji Warna dengan DAB-HCl
Senyawa hasil sintesis diletakan di drupple plate kemudian ditetesi DAB-HCl. Perubahan warna dilihat dan dibandingkan dengan benzokain.
Kromatografi Lapis Tipis (KLT)
Serbuk hasil sintesis diuji kemurniannya dengan KLT menggunakan tiga sistem fase gerak hasil orientasi yaitu n-heksana: etil asetat 1:3; 2:2; 3:1 (diadaptasi dari metode Adhipandito, 2017) dan didapat fase gerak dengan pemisahan terbaik yaitu n-heksana: etil asetat 3:1. Serbuk hasil sintesis dilarutkan dalam etil asetat dan ditotolkan pada fase diam plat silika gel GF254 kemudian dieluasi dengan fase gerak terpilih. Bercak dideteksi dibawah lampu UV254.
Uji Titik Lebur
Senyawa hasil sintesis dimasukan kedalam pipa kapiler kemudian dimasukan ke dalam alat pengukur titik lebur. Suhu diatur 85-150oC kemudian senyawa diamati suhu saat pertama kali melebur hingga semua habis. Jarak lebur didokumentasikan.
Elusidasi Struktur
Senyawa hasil sintesis dielusidasi strukturnya menggunakan NMR, FTIR, dan GC-MS yang dilakukan di Fakultas MIPA UGM, Sleman, DIY dan Institut Farmasetikal dan Nutrasetikal, Malaysia dengan metode standar yang sudah dilakukan di masing-masing tempat tersebut.
Uji aktivitas in vitro
Kit enzim MMP-9 terdiri dari enzim MMP-9 yang terliofilisasi, substrat
fluorescence resonance energy transfer (FRET)-based MMP-9, dapar uji MMP-9,
dan NNGH inhibitor sebagai kontrol positif yang didapatkan dari Biovision. Enzim yang terliofilisasi direkonstitusi dengan 110 µ L gliserol 30% dalam deionised
water. Enzim yang sudah terekonstitusi dilarutkan dalam 550 µL dapar dan siap
7
µL senyawa hasil sintesis, 5 µL enzim, dan 50 µL substrat, desain well plate untuk
uji in vitro dapat dilihat pada lampiran 6. Sampel dicampurkan dengan buffer dan
enzim dan diinkubasi pada suhu 37ºC selama 30 menit. Substrat (40 µM) sebanyak 50 µL ditambahkan ke dalam campuran tersebut dan diinkubasi kembali pada suhu 37ºC selama 60 menit. Fluorosensi dibaca menggunakan ELISA Tecan Infinite 200 PRO microplate reader fluorescence dengan panjang gelombang eksitasi 325 nm
dan emisi 393 nm dan dihitung persentase penghambatan enzim MMP-9 dengan rumus:
1 −𝐵𝑎𝑐𝑎𝑎𝑛 𝑓𝑙𝑢𝑜𝑟𝑒𝑠𝑒𝑛𝑠𝑖 𝑠𝑒𝑛𝑦𝑎𝑤𝑎 ℎ𝑎𝑠𝑖𝑙 𝑠𝑖𝑛𝑡𝑒𝑠𝑖𝑠 − 𝑏𝑙𝑎𝑛𝑘𝑜𝐵𝑎𝑐𝑎𝑎𝑛 𝑓𝑙𝑢𝑜𝑟𝑒𝑠𝑒𝑛𝑠𝑖 𝑘𝑜𝑛𝑡𝑟𝑜𝑙 𝑛𝑒𝑔𝑎𝑡𝑖𝑓 − 𝑏𝑙𝑎𝑛𝑘𝑜 𝑥 100%
HASIL DAN PEMBAHASAN
Senyawa arilamida-2 disintesis dengan farmakofor cincin arilamida yang dihubungkan oleh rantai alkil. Penelitian ini akan mengeksplorasi gugus para cincin arilamida yaitu OCF2 pada senyawa 2 yang memiliki karakteristik electron
donating group (EDG) pada gugus OC-R dan electron withdrawing group (EWG)
pada gugus difluoro dengan penambahan gugus ester etil benzoat. Gugus ester etil bezoat mewakili karakter gugus electron withdrawing group (EWG).
Sintesis Senyawa Arilamida-2
8
Gambar 2. Reaksi substitusi asil nukleofilik antara benzokain dan 3-bromopropionil klorida dengan menggunakan piridin sebagai katalis nukleofil.
9
kloroform memiliki titik didih yang rendah yaitu sebesar 62oC (Pubchem, 2019) sehingga mudah menguap sempurna (volatile).
Uji warna dengan reagen DAB-HCl pada hasil sintesis ditujukan untuk memastikan senyawa arilamida-2 telah terbentuk. Senyawa dengan gugus amina primer akan bereaksi dengan DAB-HCl membentuk basa Schiff yang berwarna jingga, sedangkan yang tidak memiliki gugus amina primer tidak akan bereaksi (Adegoke, 2011). Senyawa arilamida-2 tidak bereaksi dengan DAB-HCl membentuk warna jingga karena gugus amina primernya sudah tersubstitusi menjadi amida. Mekanisme reaksi DAB-HCl dengan benzokain disajikan pada Lampiran 2a, sedangkan hasil uji warna berupa produk warna jingga disajikan pada Lampiran 2b.
10
Tabel I. Hasil uji kelarutan senyawa turunan arilamida-2
Pelarut Senyawa Arilamida-2 Perbandingan Kategori Kelarutan FI V n-heksana sangat sukar larut 1: 1000
Kloroform larut 1:30
Etil asetat larut 1:20
Aseton agak sukar larut 1:60
Etanol agak sukar larut 1:100
Air sangat sukar larut 1:1000
DMSO larut 1:30
Elusidasi Struktur
Spektrometri Resonansi Magnetik Inti
Elusidasi struktur dilakukan dengan pelarut kloroform berdasarkan hasil uji kelarutan yang dilakukan terhadap senyawa hasil sintesis. Selain itu, kloroform juga tidak akan mengganggu pada pembacaan sinyal karena sinyal senyawa diprediksi berbeda dengan sinyal kloroform. Spektrum 1H-NMR disajikan pada Gambar 3.
Gambar 3. Hasil spektrum 1H-NMR senyawa arilamida-2 X
11
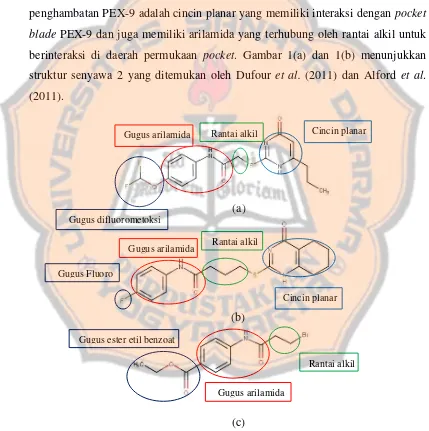
Tabel II. Hasil spektrum 1H-NMR senyawa arilamida-2
Proton Geseran
kimia (ppm)
Integrasi Splitting J Coupling Constant
Sinyal pada geseran kimia 1,39 ppm (integrasi 3) (J = 7,7 Hz) merupakan sinyal dari proton HA. Integrasi menunjukkan jumlah proton pada atom yang dikenai gelombang radio. Integrasi yang muncul sudah sesuai dengan teori karena jumlah proton pada HA berjumlah 3. Sinyal yang muncul sudah sesuai berdasarkan teori hukum pencacahan proton yaitu n+1 dengan n adalah jumlah proton tetangga yang tidak ekivalen secara kimia, sehingga sinyal yang muncul berupa triplet karena memiliki dua proton tetangga pada lingkungan kimia yang berbeda. Perbesaran sinyal HA disajikan pada Lampiran 4a.
12
terluarnya) daripada gugus karbonil amida yang berdekatan dengan HB sehingga membuat HC kurang terlindungi dari medan magnet luar (de-shielded) (Anderson, 2004). Perbesaran sinyal HB dan HC disajikan pada Lampiran 4b dan 4c.
Sinyal pada geseran kimia sekitar 4,30 ppm (integrasi 2) (J= 7,7 Hz) merupakan sinyal dari proton HD. Sinyal yang muncul sudah sesuai berdasarkan teori yaitu muncul berupa quartet karena memiliki tiga proton tetangga pada lingkungan kimia yang berbeda. Geseran kimia proton HD bergeser pada ppm yang lebih jauh daripada proton HA yang merupakan proton tetangganya karena proton HD berikatan langsung dengan atom O yang elektronegatif sehingga cenderung menarik elektron atom C pada HD dan membuat HD kurang terlindungi dari medan magnet luar (de-shielded) serta mengubah orientasi spin-nya untuk bergeser pada ppm yang lebih jauh. Perbesaran sinyal HD disajikan pada Lampiran 4d.
Sinyal pada geseran kimia 7,00 – 9,00 ppm merupakan daerah proton aromatik (Silverstein et al., 2005). Sinyal yang muncul pada geseran kimia tersebut adalah dua sinyal berbeda, yaitu pada geseran kimia sekitar 7,61 ppm dan 8,02 ppm. Perbesaran pada geseran kimia tersebut ditunjukkan pada Lampiran 4e dan 4f. Sinyal pada geseran kimia 7,61 ppm (integrasi 2) (J= 7,7 Hz) merupakan proton HE, sedangkan sinyal 8,02 ppm, (integrasi 2) (J= 7 Hz) merupakan proton HF. Proton HE lebih terlindungi (shielded) daripada proton HF karena berada di lingkungan kimia dekat dengan gugus NH yang memiliki elektronegativitas lebih rendah daripada gugus C=O karbonil yang dekat dengan proton HF (Anderson, 2004). Sinyal yang muncul pada kedua proton tersebut sudah sesuai dengan teori yaitu berupa sinyal doublet karena hanya memiliki satu proton tetangga pada lingkungan kimia berbeda. Pada geseran 7,26 pm merupakan sinyal X yaitu sinyal dari pelarut kloroform sedangkan sinyal Y geseran kimia 1,60 ppm yang merupakan sinyal H2O (Fulmer et al., 2010).
13
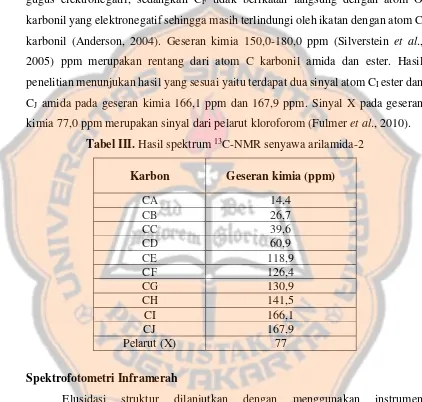
dengan hasil penelitian yaitu pada daerah tersebut terdapat 1 sinyal pada geseran kimia 39,6 ppm menunjukkan atom CC pada rantai alkil (gugus etilen). Sementara atom CB pada geseran kimia 26,7 ppm merupakan C etilen (alkil sekunder) yang sesuai dengan hasil empiris terletak pada daerah geseran kimia 20,0-30,0 ppm (Vollhardt dan Schore, 2014). Atom CB lebih terlindungi daripada CC karena atom CC berikatan dengan atom Br yang merupakan penarik elektron yang lebih kuat daripada gugus karbonil (C=O) amida yang berikatan dengan atom CB. Geseran kimia pada 5,0-20,0 ppm (Vollhardt dan Schore, 2014) menunjukan sinyal dari atom C metil (alkil primer), hal ini sudah sesuai dengan hasil penelitian bahwa pada geseran kima tersebut muncul 1 sinyal yang menunjukan atom CA dari rantai etil ester pada 14,4 ppm. Sementara CD pada sinyal 60,9 ppm merupakan atom C yang berikatan langsung dengan atom O ester yang sesuai berdasarkan hasil empiris muncul pada geseran kimia 50,0-90,0 ppm (Vollhardt dan Schore, 2014). Atom CA lebih terlindungi daripada atom CD karena atom CD berikatan langsung dengan atom O ester yang merupakan gugus penarik elektron.
Gambar 4. Hasil spektrum 13C-NMR senyawa arilamida-2
Geseran kimia 110,0-160,0 ppm (Vollhardt dan Schore, 2014) adalah rentang atom-atom C pada cincin benzena. Hal ini sudah sesuai dengan hasil penelitian yang menunjukan geseran kimia pada rentang tersebut dengan munculnya 4 sinyal yaitu 118,9 ppm, 126,4 ppm, 130,9 ppm, dan 141,5 ppm yang berkorespondensi dengan atom CE, CF, CG, dan CH pada cincin arilamida. Atom CE
14
lebih terlindungi daripada atom CG karena posisi CE lebih dekat pada gugus NH yang memiliki elektronegativitas lebih rendah daripada C=O ester yang dekat dengan atom CE (Anderson, 2004). Atom CH lebih tidak terlindung daripada CF diduga akibat CH berikatan langsung dengan NH dan C=O amida yang merupakan gugus elektronegatif, sedangkan CF tidak berikatan langsung dengan atom O karbonil yang elektronegatif sehingga masih terlindungi oleh ikatan dengan atom C karbonil (Anderson, 2004). Geseran kimia 150,0-180,0 ppm (Silverstein et al., 2005) ppm merupakan rentang dari atom C karbonil amida dan ester. Hasil penelitian menunjukan hasil yang sesuai yaitu terdapat dua sinyal atom CI ester dan CJ amida pada geseran kimia 166,1 ppm dan 167,9 ppm. Sinyal X pada geseran kimia 77,0 ppm merupakan sinyal dari pelarut kloroforom (Fulmer et al., 2010).
Tabel III. Hasil spektrum 13C-NMR senyawa arilamida-2
Karbon Geseran kimia (ppm)
CA 14,4
15
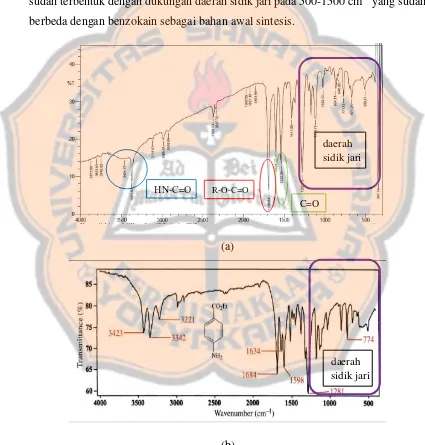
pada gambar 5. Berdasarkan spektrum inframerah yang dihasilkan, terdapat pita pada bilangan gelombang (ῡ) 1500 cm-1 yang menunjukan gugus C karbonil (C=O). C=O tersebut merupakan C=O amida pada 1535 cm-1, sedangkan pada 1689 cm-1 menunjukan C=O ester. Keberadaan gugus C=O amida tersebut diperkuat dengan adanya pita kembar yang satu ujungnya melebar pada daerah 3371 cm-1 dan 3464 cm-1 yang diduga merupakan gugus NH amida. Senyawa hasil sintesis diprediksi sudah terbentuk dengan dukungan daerah sidik jari pada 500-1500 cm-1 yang sudah berbeda dengan benzokain sebagai bahan awal sintesis.
(a)
(b)
Gambar 5. Hasil spektrum inframerah (a) senyawa arilamida-2 (b) benzokain (diadaptasi dari Anderson et al., 2004)
HN-C=O R-O-C=O
C=O
daerah sidik jari
16 Kromatografi Gas-Spektrometri Massa
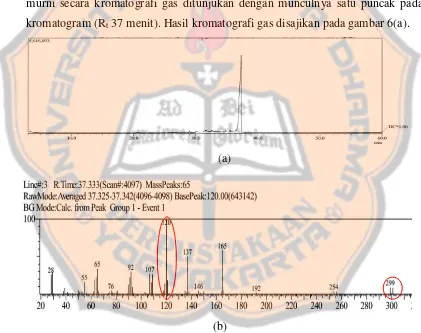
Senyawa dielusidasi struktur dengan menggunakan kromatografi gas-spektrometer massa yang bertujuan untuk menentukan bobot molekul dari senyawa baru hasil sintesis (Anderson, 2004). Kromatografi gas bertujuan untuk memastikan kemurnian senyawa hasil sintesis, ditandai dengan hasil kromatogram satu puncak. Kromatografi gas dilakukan pada senyawa hasil sintesis karena berdasarkan sifat fisika kimia senyawa dari hasil uji titik lebur menunjukkan titik lebur senyawa hasil sintesis <200oC sehingga dapat diaplikasikan pada kromatografi gas dengan suhu detektor 300oC. Hasil percobaan menunjukan bahwa senyawa hasil sintesis sudah murni secara kromatografi gas ditunjukan dengan munculnya satu puncak pada kromatogram (Rt 37 menit). Hasil kromatografi gas disajikan pada gambar 6(a).
(a)
(b)
Gambar 6.Kromatogram (a) dan spektrum massa (b) turunan arilamida-2 Pada gambar hasil spektrum massa (gambar 6(b)) terjadi perekaman
17
dan stabil) pada spektrum tersebut memiliki massa relatif per ion sebesar m/z 120. Mekanisme fragmentasi tersebut dapat dilihat pada lampiran 5a dan 5b.
Uji Aktivitas In Vitro
Pada uji aktivitas in vitro, MMP-9 direaksikan dengan substrat peptida untuk memutus ikatan peptidanya. Substrat merupakan peptida yang dihubungkan gugus fluorofor (Aminometil kumarin) (Niccoloti, 2012) yang akan diputus ikatan peptidanya oleh MMP-9 sehingga gugus fluorofornya terlepas dan terbaca fluoresensinya sebagai aktivitas enzim. Kontrol positif pada pengujian ini adalah peptida NNGH (Arg-Arg-Gly-His) (Biovision, 2019).
Pengujian in vitro pada arilamida-2 menunjukan persentase penghambatan aktivitas enzim sebesar 36% pada konsentrasi 200 µg/mL. Pada konsentrasi ini, senyawa arilamida-2 termasuk dalam kategori aktivitas rendah-sedang (Aderogba
et al., 2013) sehingga masih dapat dioptimasi konsentrasinya untuk mengetahui
18
Tabel IV. Hasil uji aktivitas in vitro
Aktivitas enzim = rata-rata/32332 x 100%, Penghambatan enzim = 100 – aktivitas enzim
KESIMPULAN
Senyawa turunan arilamida-2 dapat disintesis dari benzokain dan 3-bromopropionil klorida melalui reaksi substitusi nukleofilik asil (SNA) dengan katalisator piridin berupa serbuk putih, larut dalam etil asetat, kloroform, dan DMSO, memiliki jarak lebur 116-124oC serta memiliki aktivitas penghambatan kategori rendah-sedang terhadap MMP-9 secara in vitro sebesar 36 % pada konsentrasi 200 µg/mL.
SARAN
Penelitian ini merupakan skrining awal untuk uji aktivitas in vitro sehingga konsentrasi sampel masih dapat dioptimasi lagi untuk mendapatkan nilai persentase penghambatan enzim yang lebih representatif. Optimasi konsentrasi sampel tidak lebih dari 500 µM. Jika lebih dari itu, untuk meningkatkan aktivitasnya struktur senyawa perlu dioptimasi dan didesain ulang dengan mempertimbangkan hubungan struktur dan aktivitas.
Sampel Fluoresensi
19
UCAPAN TERIMA KASIH
20
DAFTAR PUSTAKA
Adegoke, O.A. 2011. Analytical, Biochemical, and Synthetic Application of para-dimethylaminobenzaldedid. International Journal of Pharmaceutical
Sciences Review and Research. 11(2):17-29.
Aderogba, M.A., Ndhlala, A.R., Rengasamy, K.R.R., dan Staden J.V.S. 2013. Antimicrobial and Selected In Vitro Enzyme Inhibitory Effectsof Leaf Extracts, Flavonols and Indole Alkaloids Isolated from Croton menyharthii. Molecules.18:12633-12644.
Adhipandito, C. F. 2017. Sintesis Analog Purin (FFUSD-001) dan Studi In Silico Terhadap Matrix Metalloproteinase-9 (MMP-9) Hemopexin Domain sebagai Kandidat Anti-Kanker Payudara. Skripsi. Universitas Sanata Dharma.
Anderson, R.J., Bendell, D.J., dan Groundwater P.W., 2004. Organic Spectoscopic
Analysis. Royal Society of Chemistry. London. United Kingdom.
Arifiyanto, A. 2001. Pengaruh Penambahan Basa Natrium Hidroksida dan Piridin dalam Sintesis Benzoilanilida. Skripsi. Universitas Sanata Dharma. Alford, V.M., Kamath, A., Ren, X., Kumar, K., Gan, Q., Awwa, M. et al. 2017.
Targeting the Hemopexin-like Domain of Latent Matrix Metalloproteinase-9 (proMMP-9) with a Small Molecule Inhibitor Prevents the Formation of Focal Adhesion Junctions. ACS Chemical Biology.12: 1 - 44.
American Cancer Society. 2018. Global Cancer: Facts & Figures 2018. American Cancer Society Inc., Atlanta.
Bamane, V., Rakholiya, V.K., Chitre, T.S. 2011. Application of schotten-baumann reaction: synthesis of sometetrahydroquinoline-3-carbohydrazide derivatives. Heterocyclic Letters. 1(3): 263-268.
Benson, C.S., Babu, S.D., dan Radhakrishna, S. 2013. Expression of matrix metalloproteinases in human breast cancer tissues. Disease Markers. 34: 395 – 405.
Biovision. 2019. MMP-1 Inhibitor Screening Kit (Fluorometric).
https://www.biovision.com/mmp-1-inhibitor-screening-kit-fluorometric.html. Diakses tanggal 12 Februari 2019.
Dirjen POM. 2014. Farmakope Indonesia Edisi V. Jakarta, Kementrian Kesehatan Republik Indonesia.
21
Fulmer, G.R., Miller, A.J.M., Sherden, N.H. Gottlieb, H.E., Nudelman, A., Stoltz B. M., Bercaw J.E., dan Goldberg K.I. 2010. NMR Chemical Shifts of Trace Impurities: Common Laboratory Solvents, Organics, and Gases in Deuterated Solvents Relevant to the Organometallic Chemist.
Organometallics. 29: 2176–2179.
Kementerian Kesehatan RI. 2016. Infodatin (Pusat Data dan Informasi Kementerian Kesehatan RI): Stop Kanker. Jakarta, Kementerian Kesehatan RI.
McMurry, J., 2016. Organic Chemistry, 9th Edition. Cengage Learning. Massachusetts. USA.
Merdad, A., Karim, S., Schulten, H.J., Dallol, A., Buhmeida, A., Al-Thubaity, F. et al. 2014. Expression of Matrix Metalloproteinases (MMPs) in Primary Human Breast Cancer: MMP-9 as a Potential Biomarker for Cancer Invasion and Metastasis. Anticancer Research. 34: 1355 – 1366. Mohrig, J.R., Alberg, D.G., Hofmeister, G.E., Schatz, P.F., dan Hammond, C.N.
2014. Laboratory Techniques in Organic Chemistry: Supporting Inquiry-Driven Experiments, 4th Edition. W. H. Freeman and Company. New York. USA.
Montalbetti, C.A.G.N., dan Falque, V., 2005. Amide bond formation and peptide coupling. Tetrahedron. 61: 10827 - 10852.
Nagase, H., Visse, R., dan Murphy, G. 2006. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69: 562 - 573.
Nicolotti, O., Catto, M., Giangreco, I., Barletta, M., Leonetti, F., Stefanachi, A. et al. 2012. Design, synthesis and biological evaluation of hydroxy, 5-substituted pyrimidine-2,4,6-triones as potent inhibitors of gelatinases MMP-2 and MMP-9. European Journal of Medicinal Chemistry. 58: 368-376.
Pecorino, L. 2012. Molecular Biology of Cancer: Mechanisms, Targets, and Therapeutics. 3rd Edition. Oxford University Press. Oxford. United Kingdom.
Piccard, H., Van den Steen, P.E., dan Opdenakker, G., 2007. Hemopexin domains as multifunctional liganding modules in matrix metalloproteinases and other proteins. Journal of Leukocyte Biology. 81: 870 - 892.
Pubchem.2019. Chloroform. https://pubchem.ncbi.nlm.nih.gov. Diakses tanggal 12 Februari 2019.
22
Sigma Aldrich. 2019. Benzocaine.https://www.sigmaaldrich.com. Diakses tanggal 20 Januari 2019.
Silverstein, R.M., Webster, F.X., dan Kiemle, D.J. 2005. Spectrometric Identification of Organic Compound. 7th Edition. John Wiley & Sons, Inc. Hoboken. USA.
Stankovic, S., Konjevic, G., Gopcevic, K., Jovic, V., Inic, M., dan Jurisic, V., 2010. Activity of MMP-2 and MMP-9 in sera of breast cancer patients.
Pathology - Research and Practice. 206 (4): 241 - 247.
Supratman, U. 2010. Elusidasi Struktur Senyawa Organik. Widya Padjajaran. Bandung. Indonesia.
Vandenbroucke, R.E., danLibert, C., 2014. Is there new hope for therapeutic matrix metalloproteinase inhibition?. Nature Reviews Drug Discovery. AOP. Publikasi online 7 November 2014. Diakses tanggal 15 November 2018.
Vollhardt, P., dan Schore, N. 2014. Organic Chemistry: Structure and Function. 7th Edition. W.H. Freeman and Company. New York. USA.
White, T.D., Berglund, K.D., Groh, J.M., Johnson, M.D., Miller, R.D., dan Yates, M.H. 2012. Development of a Continuous Schotten−Baumann Route to an Acyl Sulfonamide. Org. Process Res. Dev.16: 939−957.
World Health Organization. 2014. Cancer Country Profiles: Indonesia. Geneva, WHO Press.
World Health Organization. 2018. Latest global cancer data: Cancer burden rises to 18.1 million new cases and 9.6 million cancer deaths in 2018.
Geneva, WHO Press.
Yousef, E.M., Tahir, M.R., St-Pierre, Y., dan Gaboury, L.A. 2014. MMP-9 expression varies according to molecular subtypes of breast cancer.
BMC Cancer. 14 (609): 1 – 12.
Zhang, L., Wang, X.J., Wang, J., Grinberg, N., Krishnamurthy, D.K., dan Senanayake, C.H. 2009. An improved method of amide synthesis using acyl chlorides. Tetrahedron Letters. 50 (24): 2964 - 2966.
23
LAMPIRAN
Lampiran 1. Dokumentasi hasil sintesis, dan profil KLT senyawa turunan arilamida-2
Lampiran 1a. Hasil KLT sintesis senyawa turunan arilamida-2 yang menunjukkan 2 noda yang berbeda, yaitu benzokain (A) dengan nilai Rf 1 0,62 dan senyawa arilamida-2 (B) dengan nilai Rf 2 0,36 . Fase gerak yang digunakan adalah n-heksana : etil asetat (3:1). Deteksi di lampu UV254.
Lampiran 1b. Foto dari tahap sintesis senyawa arilamida-2 setelah dilakukan proses pengadukan selama 30 menit.
2 1
A
B Rf 1 = 0,62
24
25 Lampiran 2. Uji DAB-HCl
Lampiran 2a. Mekanisme reaksi antara benzokain dengan DAB-HCl yang membentuk basa Schiff yang berwarna jingga.
Lampiran 2b. Hasil uji DAB-HCl dengan benzokain (A) dan senyawa turunan arilamida-2 (B). Pembentukan basa Schiff ditandai dengan warna jingga.
26
Lampiran 3. Perhitungan bahan sintesis dan hasil rendemen senyawa arilamida-2 Perhitungan bahan:
1. Benzokain digunakan 3,59 mmol = 0,00359 mol Berat molekul = 165 g/mol
0,00359 mol x 165 g/mol = 0,59 g
2. Piridin digunakan 3,59 mmol = 0,00359 mol Berat molekul = 79,1 g/mol
Massa jenis = 0,982 g/mL
0,00359 mol x 79,1 g/mol = 0,284 g : 0,982 g/mL = 0,29 mL 3. 3-bromopropionil klorida digunakan 4 mmol = 0,004 mol
Berat molekul = 171,418 g/mol Massa jenis = 1,701 g/mL
0,004 mol x 171,418 g/mol = 0,686 g : 1,701 g/mL = 0,41 mL Reaksi Stoikiometri:
Benzokain + 3-bromopropionil klorida Arilamida-2 + HCl 3,59 mmol 4,00 mmol
3,59 mmol 3,59 mmol 3,59 mmol 3,59 mmol 0,41 mmol 3,59 mmol 3,59 mmol Massa teoritis arilamida-2 = 3,59 mmol x 300 mmol/mg
= 1077 mg =1,08 g Hasil rendemen:
Senyawa arilamida-2 = 0,88 g
27
Lampiran 4. Perbesaran puncak pada spektrum 1H-NMR
Lampiran 4a. Perbesaran sinyal HA pada geseran kimia 1,39 ppm menunjukan
splitting triplet dengan integrasi 3 dan nilai J coupling constant yaitu 7,7 Hz.
Lampiran 4b. Perbesaran sinyal HB pada geseran kimia 2,85 ppm dan 2,98 ppm menunjukan splitting triplet of triplet dengan integrasi 2 dan nilai J coupling
28
Lampiran 4c. Perbesaran sinyal HC pada geseran kimia 3,71 ppm dan 3,89 ppm menunjukan splitting triplet of triplet integrasi 2 dan nilai J coupling constant yaitu 6,3 Hz.
Lampiran 4d. Perbesaran sinyal HD pada geseran kimia 4,36 ppm menunjukan
29
Lampiran 4e. Perbesaran sinyal HE pada geseran kimia 7,61 ppm menunjukan
splitting doublet integrasi 2 dan nilai J coupling constant yaitu 7,7 Hz.
Lampiran 4f. Perbesaran sinyal HF pada geseran kimia 8,02 ppm menunjukan
30
Lampiran 5. Usulan mekanisme fragmentasi molekul utuh dan base peak turunan arilamida-2 pada spektrometri massa
Lampiran 5a. Usulan pola fragmentasi molekul utuh m/z 299
Lampiran 5b. Usulan pola fragmentasi base peak m/z 120
31
Lampiran 6. Desain well plate untuk uji aktivitas in vitro
Keterangan: B : dapar
KP : senyawa kontrol positif (peptida NNGH) TA2 : turunan arilamida-2
C : senyawa lain E : enzim MMP-9
S : substrat enzim MMP-9 Angka : volume (mikroliter/µl)
32
BIOGRAFI PENULIS
Penulis skripsi dengan judul “Sintesis Turunan Arilamida-2 dan Uji Aktivitas In Vitro terhadap Matrix
Metalloproteinase-9 (MMP-9) Sebagai Kandidat
Anti-Kanker Payudara” bernama lengkap Benedictus Wisnu Putra Jati. Penulis merupakan anak sulung dari pasangan Matius Abdullah Chaidir dan Gertruda Tri Teguh Rahayu. Penulis lahir di Sleman, 13 Nopember 1996. Pendidikan formal penulis diawali di TK Kanisius Sorowajan (2002-2003), SD Kanisius Sorowajan (2003-2009), SMP Pangudi Luhur 1 Yogyakarta (2009-2012), dan SMA Kolese De Britto (2012-2015). Pendidikan dilanjutkan hingga perguruan tinggi di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta. Penulis terlibat dalam beberapa kegiatan organisasi dan kepanitiaaan, antara lain Bendahara Drug Discovery Research Group tahun 2017-2019, koordinator divisi Perlengkapan dan Ketua kegiatan DESA MITRA 2016 dan 2017, anggota dan koordinator divisi Konsumsi kegiatan TITRASI 2016 dan 2017, serta menjadi asisten praktikum mata kuliah Kimia Organik (2018) dan Kimia Dasar (2018). Penulis juga terlibat dalam beberapa perlombaan tingkat nasional antara lain sebagai peserta PICS 2017 di Institut Teknologi Bandung dan peserta
Poster Competition CADD 2018 di Bali. Penulis juga aktif mengikuti kegiatan
Drug Discovery Research Group yang bergerak memfasilitasi mahasiswa/i Farmasi