4.1. Isolasi Bakteri Pelarut Fosfat
Sampel tanah rizosfer yang digunakan sebagai sumber isolat bakteri pelarut fosfat (BPF) diperoleh dari areal Kebun Percobaan IPB Cikabayan (Bogor, Jawa Barat), Citeureup (Bogor, Jawa Barat), Nusa Tenggara Barat (NTB), dan Nusa Tenggara Timur (NTT). Sampel tanah tersebut diambil di dekat areal sungai, perkebunan, dan persawahan warga. Sampel tanah diambil di sekitar perakaran (rizosfer) pada beberapa tanaman.
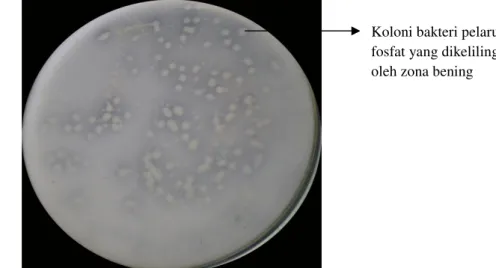
Mikroba pada sampel tanah yang diinokulasikan ke dalam medium Pikovskaya cair kemudian diukur kemampuannya dalam melarutkan P pada medium Pikovskaya padat. Tidak semua mikroba tersebut menghasilkan zona berwarna terang jernih atau zona bening. BPF yang tumbuh pada medium Pikovskaya padat akan melarutkan P ditandai dengan adanya zona berwarna terang jernih atau zona bening yang mengelilingi koloni bakteri tersebut. Hal ini disebabkan adanya pelarutan fosfat dari Ca3(PO4)2 yang terdapat dalam medium.
Sebanyak 29 isolat BPF yang menghasilkan zona bening kemudian dimurnikan pada medium Pikovskaya padat dan disimpan dalam medium agar miring (stock culture) untuk digunakan dalam pengujian selanjutnya.
Gambar 3. Hasil isolasi bakteri pelarut fosfat dari rizosfer
Koloni bakteri pelarut fosfat yang dikelilingi oleh zona bening
Gambar 4. Pemurnian bakteri pelarut fosfat pada medium Pikovskaya padat
4.2. Karakteristik dan Kemampuan Bakteri Pelarut Fosfat dalam Melarutkan P
Sebanyak 29 isolat bakteri pelarut fosfat (BPF) yang telah diperoleh selanjutnya dilakukan pengamatan karakteristik morfologi koloni meliputi bentuk, tepian, elevasi, dan warna koloni bakteri sesuai prosedur Hadioetomo (1993), serta pengukuran indeks pelarutan fosfat (IP). Hasil pengamatan dan pengukuran tersebut dapat dilihat pada Tabel 1.
Tabel 1. Karakteristik Morfologi Koloni dan Kemampuan Bakteri Pelarut Fosfat dalam Melarutkan P pada Medium Pikovskaya Padat Selama 7 Hari Inkubasi
No. Isolat Ciri Koloni IP
Kode Asal Warna Elevasi Tepian Bentuk
1. P 1.1 NTT Putih Timbul Licin Bundar dengan
tepian timbul 1.20 2. P 1.2 NTT Kuning Timbul Licin Keriput 1.50
3. P 1.3 NTT Putih Seperti
kawah Licin
Bundar dengan
tepian timbul 1.10 4. P 1.4 NTT Putih Timbul Licin Bundar 1.70
5. P 1.5 NTT Putih Seperti
kawah Licin
Bundar dengan
tepian timbul 1.08 6. P 2.1 NTT Putih Timbul Berombak Kompleks 1.10
Lanjutan Tabel 1...
No. Isolat Ciri Koloni IP
Kode Asal Warna Elevasi Tepian Bentuk
7. P 2.2 NTT Putih kekuningan Seperti
kawah Licin Bundar dengan tepian timbul 1.09 8. P 2.3 NTT Putih Seperti kawah Licin Bundar dengan tepian kerang 1.11 9. P 2.4 NTT Putih Seperti kawah Berombak Bundar dengan tepian kerang 1.22 10. P 3.1 NTT Kuning kecoklatan Timbul Tak beraturan Bundar dengan tepian kerang 1.27 11. P 3.2 NTT Kuning
kecoklatan Timbul Berombak
Bundar dengan tepian menyebar 1.50 12. P 3.3 NTT Kuning kecoklatan Timbul Tak beraturan Bundar dengan tepian menyebar 1.56 13. P 3.4 NTT Kuning kecoklatan Timbul Tak beraturan
Tak beraturan dan menyebar 1.25
14. P 3.5 NTT Coklat Timbul Tak beraturan Bundar dengan tepian kerang 1.78 15. P 3.6 NTT Kuning Seperti kawah Berombak Bundar dengan tepian kerang 1.50
16. P 4.1 NTT Putih kekuningan Seperti
tetesan Licin Bundar 1.08
17. P 4.2 NTT Putih Seperti
kawah Licin
Bundar dengan
tepian timbul 1.08
18. P 4.3 NTT Putih kekuningan Seperti
kawah Licin
Bundar dengan
tepian timbul 1.09
19. P 4.4 NTT Putih Seperti
tetesan Licin Bundar 1.08
20. P 5.1 NTB Putih Seperti
kawah Berombak
Bundar dengan
tepian timbul 1.10
21. P 5.2 NTB Putih Timbul Berombak Bundar dengan
tepian timbul 1.42 22. P 5.3 NTB Putih Timbul Licin Bundar 1.57
23. P 6.1 NTB Putih kekuningan Seperti
Lanjutan Tabel 1...
No. Isolat Ciri Koloni IP
Kode Asal Warna Elevasi Tepian Bentuk
24. P 6.2 NTB Putih Seperti
kawah Licin
Bundar dengan tepian kerang 1.22
25. P 7.1 CK Kuning Timbul Berombak Bundar dengan tepian menyebar 1.11
26. P 8.1 CK Putih Timbul Licin Bundar dengan tepian kerang 1.67 27. P 8.2 CK Putih Datar Licin Bundar 1.10
28. P 9.1 CT Kuning
kecoklatan Timbul Licin Bundar 1.62
29. P 10.1 CT Kuning
kecoklatan Datar Licin Bundar 1.80 Keterangan :
IP = Indeks Pelarutan Fosfat NTB = Provinsi Nusa Tenggara Barat NTT = Provinsi Nusa Tenggara Timur CK = Cikabayan (Kebun Percobaan IPB)
CT = Citeureup (Bogor, Jawa Barat)
Berdasarkan Indeks Pelarutan (IP) yang dihasilkan dapat diketahui bahwa BPF memiliki kemampuan melarutkan P yang bervariasi. Menurut Rachmiati (1995) luas zona bening secara kualitatif diduga menunjukkan besar kecilnya kemampuan bakteri melarutkan P dari fosfat tak larut. Pada pengamatan bentuk koloni yang mengacu kepada Hadioetomo (1993) menujukkan ke-29 isolat rata-rata berbentuk bundar, bundar dengan tepian timbul, bundar dengan tepian menyebar, dan bundar dengan tepian kerang. Sebagian besar isolat berwarna putih, putih kekuningan, dan kuning kecoklatan dengan tepian licin, berombak, tak beraturan serta elevasi timbul, datar, seperti kawah (cekung), dan seperti tetesan (cembung). loni diameterko zonabening loni diameterko IP= +
4.3. Kemampuan Bakteri Pelarut Fosfat dalam Menghasilkan Enzim Fosfatase dan Zat Pengatur Tumbuh Indole Acetic Acid (IAA) serta Karakterisasi Pewarnaan Gram
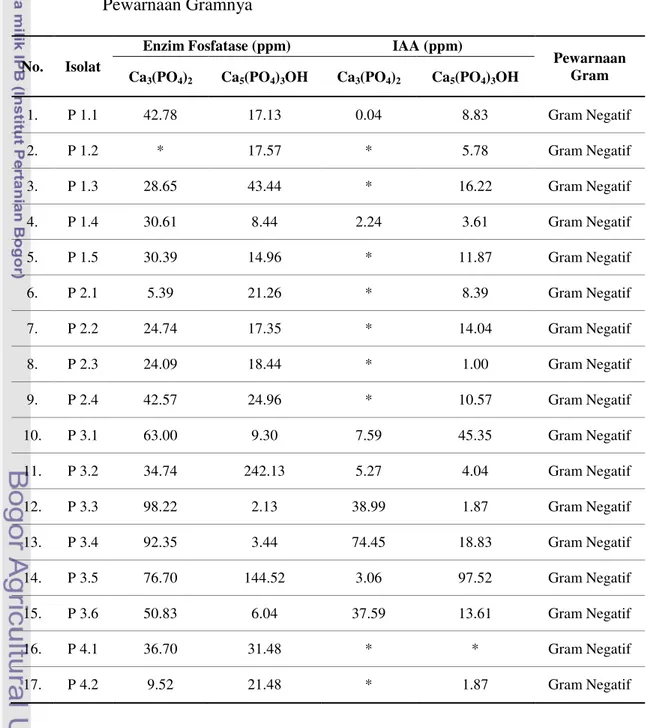
Setelah dilakukan pengujian karakteristik dan kemampuan bakteri pelarut fosfat (BPF) dalam melarutkan P pada medium Pikovskaya padat, kemudian dilakukan pengujian kemampuan BPF dalam menghasilkan enzim fosfatase dan IAA serta pewarnaan Gram yang hasilnya dapat dilihat pada Tabel 2.
Tabel 2. Kemampuan Bakteri Pelarut Fosfat dalam Menghasilkan Enzim Fosfatase dan Indole Acetic Acid (IAA) Selama 3 Hari Inkubasi serta Pewarnaan Gramnya
No. Isolat
Enzim Fosfatase (ppm) IAA (ppm)
Pewarnaan Gram Ca3(PO4)2 Ca5(PO4)3OH Ca3(PO4)2 Ca5(PO4)3OH
1. P 1.1 42.78 17.13 0.04 8.83 Gram Negatif 2. P 1.2 * 17.57 * 5.78 Gram Negatif 3. P 1.3 28.65 43.44 * 16.22 Gram Negatif 4. P 1.4 30.61 8.44 2.24 3.61 Gram Negatif 5. P 1.5 30.39 14.96 * 11.87 Gram Negatif 6. P 2.1 5.39 21.26 * 8.39 Gram Negatif 7. P 2.2 24.74 17.35 * 14.04 Gram Negatif 8. P 2.3 24.09 18.44 * 1.00 Gram Negatif 9. P 2.4 42.57 24.96 * 10.57 Gram Negatif 10. P 3.1 63.00 9.30 7.59 45.35 Gram Negatif 11. P 3.2 34.74 242.13 5.27 4.04 Gram Negatif 12. P 3.3 98.22 2.13 38.99 1.87 Gram Negatif 13. P 3.4 92.35 3.44 74.45 18.83 Gram Negatif 14. P 3.5 76.70 144.52 3.06 97.52 Gram Negatif 15. P 3.6 50.83 6.04 37.59 13.61 Gram Negatif 16. P 4.1 36.70 31.48 * * Gram Negatif 17. P 4.2 9.52 21.48 * 1.87 Gram Negatif
Lanjutan Tabel 2… No. Isolat
Enzim Fosfatase (ppm) IAA (ppm)
Pewarnaan Gram Ca3(PO4)2 Ca5(PO4)3OH Ca3(PO4)2 Ca5(PO4)3OH
18. P 4.3 39.30 18.44 * 12.30 Gram Negatif 19. P 4.4 41.48 16.26 * 2.30 Gram Negatif 20. P 5.1 21.70 47.13 * 2.74 Gram Negatif 21. P 5.2 41.70 17.78 * * Gram Negatif 22. P 5.3 28.44 20.61 * 17.09 Gram Negatif 23. P 6.1 31.26 10.61 * 3.61 Gram Negatif 24. P 6.2 66.70 43.44 * 15.35 Gram Positif 25. P 7.1 0.17 14.09 * 1.44 Gram Negatif 26. P 8.1 21.70 14.52 * 8.39 Gram Negatif 27. P 8.2 29.52 21.48 * 2.74 Gram Negatif 28. P 9.1 31.26 70.39 7.96 1.44 Gram Negatif 29. P 10.1 30.17 100.17 20.13 94.04 Gram Negatif Keterangan * : Tidak Terdeteksi
Enzim fosfatase merupakan kompleks enzim penting di dalam tanah yang berfungsi memutuskan ikatan fosfat yang terikat oleh senyawa-senyawa organik menjadi bentuk yang tersedia bagi tanaman. Pada Tabel 2 terlihat bahwa isolat BPF yang menghasilkan enzim fosfatase tertinggi pada sumber fosfat Ca3(PO4)2
adalah isolat P 3.3 dengan kandungan enzim fosfatase sebesar 98.22 ppm. Sedangkan isolat yang menghasilkan enzim fosfatase terendah adalah isolat P 7.1, yaitu sebesar 0.17 ppm. Isolat P 3.3 dan P 7.1 masing-masing diisolasi dari sampel pasir Sungai Pinti, Nusa Tenggara Timur (NTT) dan sampel tanah rizosfer tanaman kedelai di Kebun Percobaan IPB Cikabayan (Bogor, Jawa Barat).
Pada sumber fosfat Ca5(PO4)3OH, isolat yang menghasilkan enzim
fosfatase tertinggi adalah P 3.2 dengan kandungan enzim fosfatase sebesar 242.13 ppm. Sedangkan isolat yang menghasilkan enzim fosfatase terendah adalah isolat P 3.3, yaitu sebesar 2.13 ppm. Kedua isolat tersebut diisolasi dari sampel pasir Sungai Pinti, Nusa Tenggara Timur (NTT). Sebagian besar sampel tanah yang
berasal dari Sungai Pinti, Nusa Tenggara Timur (NTT) memiliki kandungan enzim fosfatase yang tinggi.
Pada pengujian kemampuan BPF dalam menghasilkan IAA diketahui bahwa tidak semua isolat BPF mampu menghasilkan IAA (Tabel 2). Beberapa isolat diketahui tidak terdeteksi dalam menghasilkan IAA. Berdasarkan pengujian tersebut, diperoleh 10 isolat yang diketahui mampu menghasilkan IAA pada medium Pikovskaya cair dengan sumber fosfat Ca3(PO4)2, dan 27 isolat diketahui
dapat menghasilkan IAA pada medium Pikovskaya cair dengan sumber fosfat Ca5(PO4)3OH. Produksi IAA ditandai dengan adanya warna merah muda pada
larutan, hal ini karena adanya penambahan pereaksi Salkowski. Semakin pekat warna merah mudanya, maka konsentrasi IAA yang dihasilkan akan semakin tinggi.
Berdasarkan data pada Tabel 2 juga diketahui bahwa isolat BPF yang menghasilkan IAA tertinggi pada sumber fosfat Ca3(PO4)2 adalah isolat P 3.4,
yaitu sebesar 74.45 ppm. Sedangkan isolat yang menghasilkan IAA terendah adalah isolat P 1.1 dengan kandungan IAA sebesar 0.04 ppm. Isolat P 3.4 dan P 1.1 masing-masing diisolasi dari sampel pasir Sungai Pinti, Nusa Tenggara Timur (NTT) dan sampel tanah rizosfer pohon mahoni, Nusa Tenggara Timur (NTT). Pada sumber fosfat Ca5(PO4)3OH, isolat yang menghasilkan IAA tertinggi adalah
isolat P 3.5, dengan kandungan IAA sebesar 97.52 ppm. Sedangkan isolat yang menghasilkan IAA terendah adalah isolat P 2.3, yaitu sebesar 1.00 ppm. Isolat P 3.5 dan P 2.3 masing-masing diisolasi dari sampel pasir Sungai Pinti, Nusa Tenggara Timur (NTT) dan sampel tanah rizosfer tanaman padi sawah, Nusa Tenggara Timur (NTT).
Dari data pada Tabel 2, diseleksi tiga isolat BPF berdasarkan kandungan enzim fosfatase dan zat pengatur tumbuh IAA tertinggi pada masing-masing daerah asal sampel tanah (Bogor, NTB, dan NTT) yang hasilnya dapat dilihat pada Tabel 3. Isolat BPF terpilih tersebut selanjutnya dilakukan pengujian lanjut, yaitu pengukuran pertumbuhan populasi, perubahan pH pada medium Pikovskaya cair, dan pengukuran kandungan enzim fosfatase selama 7 hari inkubasi.
Tabel 3. Isolat Bakteri Pelarut Fosfat Terpilih Berdasarkan Kandungan Enzim Fosfatase dan IAA Tertinggi pada Masing-masing Daerah Asal Sampel Tanah
Isolat Enzim Fosfatase (ppm) IAA (ppm)
Kode Asal Ca3(PO4)2 Ca5(PO4)3OH Ca3(PO4)2 Ca5(PO4)3OH
P 3.5 NTT 76.70 144.52 3.06 97.52
P 6.2 NTB 66.70 43.44 * 15.35
P 10.1 Citeureup, Bogor 30.17 100.17 20.13 94.04 Keterangan * : Tidak Terdeteksi
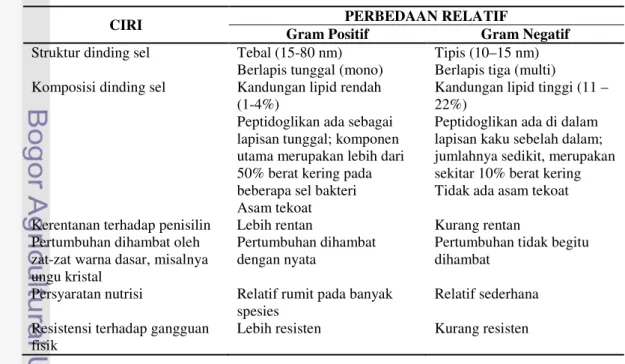
Berdasarkan hasil pewarnaan Gram yang telah dilakukan, diketahui bahwa semua isolat BPF merupakan bakteri Gram negatif. Isolat P 3.5 dan isolat P 10.1 merupakan bakteri Gram negatif berbentuk kokus atau bulat, sedangkan isolat P 6.2 merupakan bakteri Gram negatif berbentuk basilus atau batang (Gambar 5). Pewarnaan Gram dapat membedakan sel bakteri yang termasuk Gram negatif atau Gram positif. Bakteri Gram positif akan tampak berwarna ungu, sedangkan bakteri Gram negatif akan tampak berwarna merah muda. Perbedaan antara bakteri Gram positif dengan Gram negatif disajikan pada Tabel 4.
Tabel 4. Beberapa Ciri Bakteri Gram Positif dan Gram Negatif (Pelczar, 1986)
CIRI PERBEDAAN RELATIF
Gram Positif Gram Negatif
Struktur dinding sel Tebal (15-80 nm) Berlapis tunggal (mono)
Tipis (10–15 nm) Berlapis tiga (multi) Komposisi dinding sel Kandungan lipid rendah
(1-4%)
Peptidoglikan ada sebagai lapisan tunggal; komponen utama merupakan lebih dari 50% berat kering pada beberapa sel bakteri Asam tekoat
Kandungan lipid tinggi (11 – 22%)
Peptidoglikan ada di dalam lapisan kaku sebelah dalam; jumlahnya sedikit, merupakan sekitar 10% berat kering Tidak ada asam tekoat Kerentanan terhadap penisilin Lebih rentan Kurang rentan Pertumbuhan dihambat oleh
zat-zat warna dasar, misalnya ungu kristal
Pertumbuhan dihambat dengan nyata
Pertumbuhan tidak begitu dihambat
Persyaratan nutrisi Relatif rumit pada banyak spesies
Relatif sederhana Resistensi terhadap gangguan
fisik
10 µm (a) 10 µm (b) 10 µm (c)
Gambar 5. Hasil pewarnaan Gram dari sel bakteri pelarut fosfat; (a) isolat P 3.5, (b) isolat P 6.2, (c) isolat P 10.1 yang dilihat di bawah mikroskop (perbesaran 100 x 10)
4.4. Pertumbuhan Populasi, pH, dan Kandungan Enzim Fosfatase Bakteri Pelarut Fosfat Terpilih
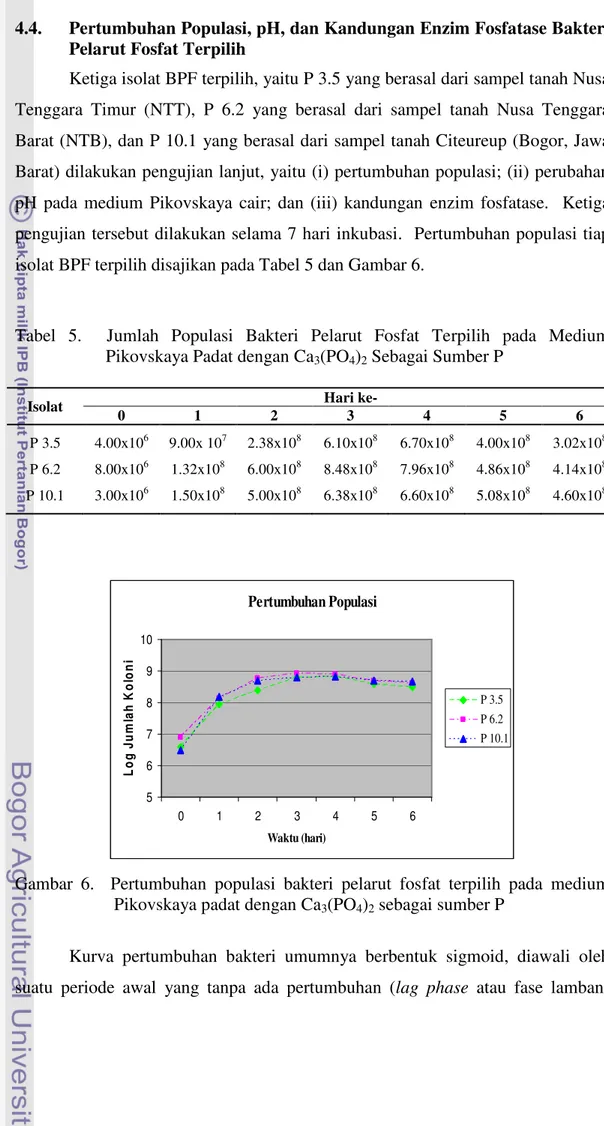
Ketiga isolat BPF terpilih, yaitu P 3.5 yang berasal dari sampel tanah Nusa Tenggara Timur (NTT), P 6.2 yang berasal dari sampel tanah Nusa Tenggara Barat (NTB), dan P 10.1 yang berasal dari sampel tanah Citeureup (Bogor, Jawa Barat) dilakukan pengujian lanjut, yaitu (i) pertumbuhan populasi; (ii) perubahan pH pada medium Pikovskaya cair; dan (iii) kandungan enzim fosfatase. Ketiga pengujian tersebut dilakukan selama 7 hari inkubasi. Pertumbuhan populasi tiap isolat BPF terpilih disajikan pada Tabel 5 dan Gambar 6.
Tabel 5. Jumlah Populasi Bakteri Pelarut Fosfat Terpilih pada Medium Pikovskaya Padat dengan Ca3(PO4)2 Sebagai Sumber P
Isolat Hari ke-
0 1 2 3 4 5 6 P 3.5 4.00x106 9.00x 107 2.38x108 6.10x108 6.70x108 4.00x108 3.02x108 P 6.2 8.00x106 1.32x108 6.00x108 8.48x108 7.96x108 4.86x108 4.14x108 P 10.1 3.00x106 1.50x108 5.00x108 6.38x108 6.60x108 5.08x108 4.60x108 Pertumbuhan Populasi 5 6 7 8 9 10 0 1 2 3 4 5 6 Waktu (hari) L o g J u m la h K o lo n i P 3.5 P 6.2 P 10.1
Gambar 6. Pertumbuhan populasi bakteri pelarut fosfat terpilih pada medium Pikovskaya padat dengan Ca3(PO4)2 sebagai sumber P
Kurva pertumbuhan bakteri umumnya berbentuk sigmoid, diawali oleh suatu periode awal yang tanpa ada pertumbuhan (lag phase atau fase lamban)
diikuti oleh suatu periode pertumbuhan yang cepat (log phase), kemudian mendatar (stationary phase atau fase statis), dan akhirnya diikuti oleh suatu penurunan populasi sel-sel hidup (death phase atau fase kematian) (Pelczar, 1986). Beberapa ciri pertumbuhan bakteri disajikan pada Tabel 6.
Tabel 6. Beberapa Ciri Pertumbuhan Bakteri pada Setiap Fase Pertumbuhan (Pelczar, 1986)
FASE PERTUMBUHAN CIRI
Lamban (lag) Tidak ada pertambahan populasi
Sel mengalami perubahan dalam komposisi kimiawi dan bertambah ukurannya; substansi intraseluler bertambah Logaritma atau eksponensial Sel membelah dengan laju yang konstan
Massa menjadi dua kali lipat dengan laju yang sama Aktivitas metabolik konstan
Keadaan pertumbuhan seimbang
Statis Penumpukan produk beracun dan/atau kehabisan nutrien Beberapa sel mati sedangkan yang lain tumbuh dan membelah Jumlah sel hidup menjadi tetap
Penurunan atau kematian Sel menjadi mati lebih cepat daripada terbentuknya sel-sel baru
Laju kematian mengalami percepatan menjadi eksponensial Bergantung kepada spesiesnya, semua sel mati dalam waktu beberapa hari atau beberapa bulan
Pada Gambar 6 terlihat bahwa ketiga isolat mengalami fase lag atau fase permulaan pada hari ke-0 sampai hari ke-1. Pada fase ini bakteri baru menyesuaikan diri dengan lingkungan yang baru, sehingga sel belum membelah diri. Sel mikroba mulai membelah diri pada fase pertumbuhan yang dipercepat, tetapi waktu generasinya masih panjang. Fase logaritma terjadi pada hari ke-1 sampai hari ke-3. Pada fase ini terjadi kecepatan sel membelah diri paling cepat, dengan waktu generasi pendek dan konstan. Selama fase logaritma, metabolisme sel paling aktif, sintesis bahan sel sangat cepat dengan jumlah konstan sampai nutrien habis atau terjadinya penimbunan hasil metabolisme yang menyebabkan terhambatnya pertumbuhan (Sumarsih, 2003).
Pada hari ke-3 sampai hari ke-4 terjadi fase stasioner. Pada fase pertumbuhan yang mulai terhambat, kecepatan pembelahan sel berkurang dan jumlah sel yang mati mulai bertambah. Pada fase stasioner maksimum jumlah sel yang mati semakin meningkat sampai terjadi jumlah sel hidup hasil pembelahan
sama dengan jumlah sel yang mati, sehingga jumlah sel hidup konstan, seolah-olah tidak terjadi pertumbuhan (pertumbuhan nol). Sedangkan fase kematian terjadi mulai dari hari ke-5 sampai ke-6. Pada fase kematian, kecepatan kematian sel terus meningkat sedang kecepatan pembelahan sel nol, sampai pada fase kematian logaritma maka kecepatan kematian sel mencapai maksimal, sehingga jumlah sel hidup menurun dengan cepat seperti deret ukur. Walaupun demikian penurunan jumlah sel hidup tidak mencapai nol, dalam jumlah minimum tertentu sel mikroba akan tetap bertahan sangat lama dalam medium tersebut (Sumarsih, 2003).
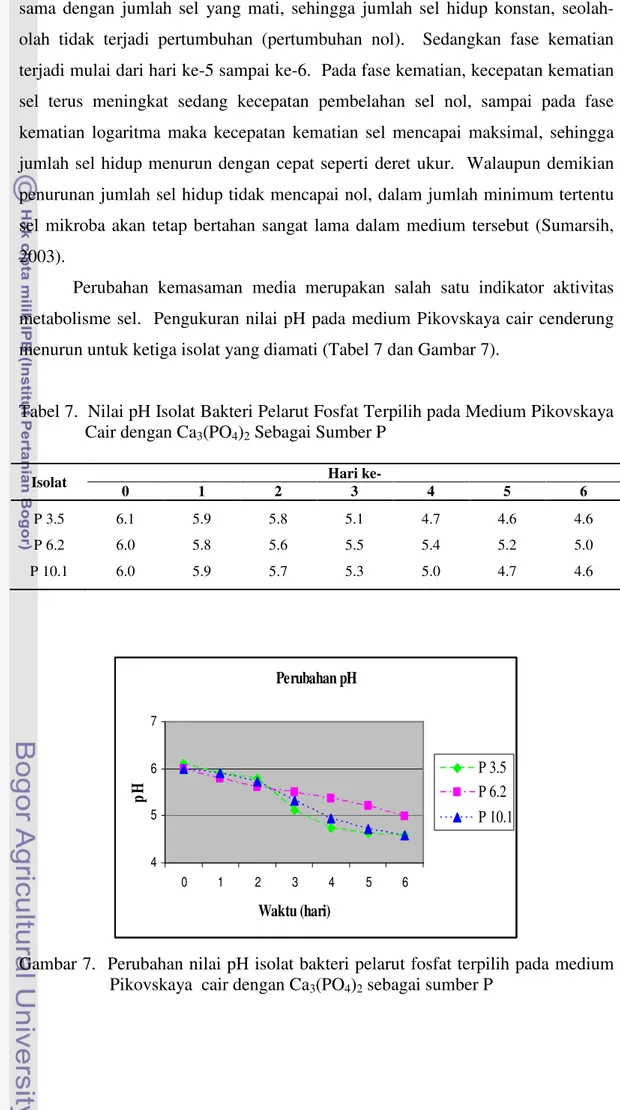
Perubahan kemasaman media merupakan salah satu indikator aktivitas metabolisme sel. Pengukuran nilai pH pada medium Pikovskaya cair cenderung menurun untuk ketiga isolat yang diamati (Tabel 7 dan Gambar 7).
Tabel 7. Nilai pH Isolat Bakteri Pelarut Fosfat Terpilih pada Medium Pikovskaya Cair dengan Ca3(PO4)2 Sebagai Sumber P
Isolat Hari ke-
0 1 2 3 4 5 6 P 3.5 6.1 5.9 5.8 5.1 4.7 4.6 4.6 P 6.2 6.0 5.8 5.6 5.5 5.4 5.2 5.0 P 10.1 6.0 5.9 5.7 5.3 5.0 4.7 4.6 Perubahan pH 4 5 6 7 0 1 2 3 4 5 6 Waktu (hari) p H P 3.5 P 6.2 P 10.1
Gambar 7. Perubahan nilai pH isolat bakteri pelarut fosfat terpilih pada medium Pikovskaya cair dengan Ca3(PO4)2 sebagai sumber P
Penurunan pH pada medium disebabkan oleh disekresikannya asam-asam organik yang dibebaskan oleh sejumlah BPF dalam aktivitasnya. BPF akan membebaskan sejumlah asam-asam organik antara lain asam sitrat, glutamat, suksinat, laktat, oksalat, glikooksalat, malat, fumarat, tartarat, asam α-ketobutirat. Meningkatnya asam-asam organik tersebut biasanya diikuti pula dengan penurunan pH yang tajam, sehingga berakibat terjadinya pelarutan Ca-P (Subba-Rao, 1982). Rachmiati (1995) berpendapat bahwa setiap jenis BPF mempunyai kemampuan berbeda secara genetik dalam menghasilkan jumlah jenis asam-asam organik yang berperan dalam menentukan tinggi rendahnya pelarutan P.
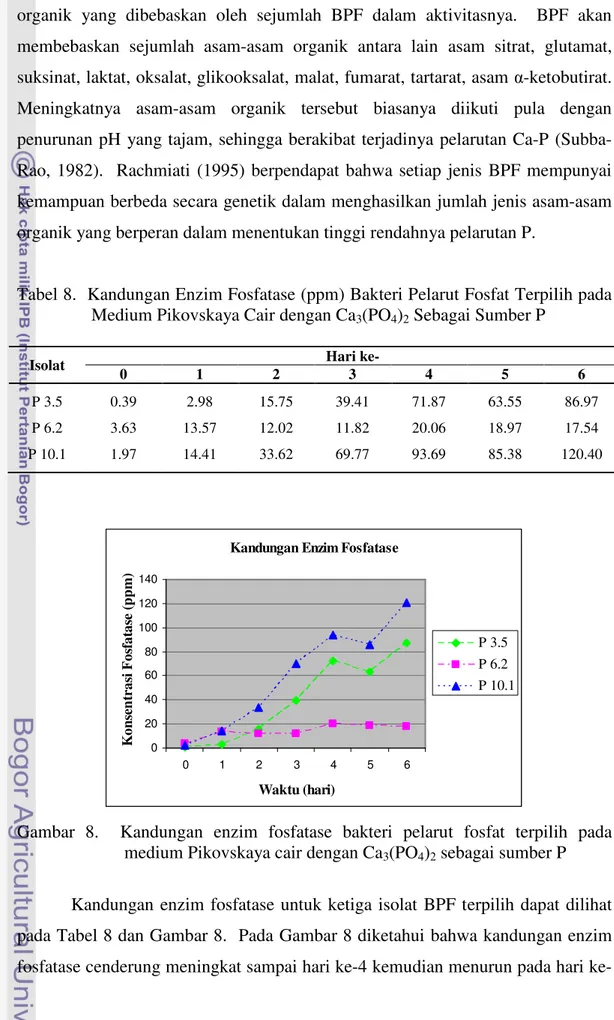
Tabel 8. Kandungan Enzim Fosfatase (ppm) Bakteri Pelarut Fosfat Terpilih pada Medium Pikovskaya Cair dengan Ca3(PO4)2 Sebagai Sumber P
Isolat Hari ke-
0 1 2 3 4 5 6
P 3.5 0.39 2.98 15.75 39.41 71.87 63.55 86.97 P 6.2 3.63 13.57 12.02 11.82 20.06 18.97 17.54 P 10.1 1.97 14.41 33.62 69.77 93.69 85.38 120.40
Kandungan Enzim Fosfatase
0 20 40 60 80 100 120 140 0 1 2 3 4 5 6 Waktu (hari) K o n se n tr a si F o sf a ta se ( p p m ) P 3.5 P 6.2 P 10.1
Gambar 8. Kandungan enzim fosfatase bakteri pelarut fosfat terpilih pada medium Pikovskaya cair dengan Ca3(PO4)2 sebagai sumber P
Kandungan enzim fosfatase untuk ketiga isolat BPF terpilih dapat dilihat pada Tabel 8 dan Gambar 8. Pada Gambar 8 diketahui bahwa kandungan enzim fosfatase cenderung meningkat sampai hari 4 kemudian menurun pada hari
ke-5 tetapi meningkat kembali pada hari ke-6 (untuk isolat P 3.ke-5 dan P 10.1). Sedangkan untuk isolat P 6.2 peningkatan kandungan enzim fosfatase tidak begitu tajam dibandingkan dengan isolat P 3.5 dan P 10.1. Isolat P 10.1 memiliki kandungan enzim fosfatase tertinggi diikuti dengan isolat P 3.5 kemudian isolat P 6.2.
Hasil pengukuran dari kandungan enzim fosfatase yang diukur pada setiap pengamatan untuk ketiga isolat BPF terpilih tersebut didapatkan hasil absorbansi yang meningkat pada setiap pengukuran, tetapi setelah absorbansi dihitung dalam hasil kurva standar p-nitrophenol terjadi penurunan hasil kandungan enzim fosfatase pada hari ke-5, hal ini disebabkan adanya perbedaan dari hasil kurva standar p-nitrophenol, karena pada setiap pengamatan diukur pula kurva standar p-nitrophenol yang hasilnya berbeda-beda pada setiap pengamatan. Selain itu, kandungan enzim fosfatase pada inkubasi hari ke-3 diperoleh hasil yang berbeda dengan hasil kandungan enzim fosfatase pada masa inkubasi yang sama pada pengujian sebelumnya (Tabel 2). Hal ini disebabkan pula karena adanya perbedaan waktu pengukuran dan perbedaan kurva standar p-nitrophenol.
4.5. Identifikasi Molekuler Bakteri Pelarut Fosfat 4.5.1. Isolasi DNA
Isolasi DNA bakteri pelarut fosfat (BPF) menggunakan metode Lazo et al. (1987) sebagai awal untuk mendapatkan informasi genetik bakteri tersebut. BPF yang diidentifikasi secara molekuler merupakan isolat terpilih yang memiliki kandungan enzim fosfatase dan IAA yang tinggi pada masing-masing daerah asal sampel tanah (Bogor, NTB, dan NTT). Ketiga isolat tersebut adalah P 3.5 (NTT), P 6.2 (NTB), dan P 10.1 (Citeureup, Bogor). Sel BPF yang diinokulasikan ke dalam medium Luria Bertani (LB) dishaker dengan kecepatan 120 rpm dan diinkubasi selama 2-3 hari pada suhu ruang.
Pada metode Lazo et al. (1987) isolasi DNA secara keseluruhan banyak dilakukan secara kimiawi. Sel BPF yang telah ditumbuhkan kemudian disentrifugasi dan diresuspensi menggunakan bufer STE. Bufer STE mengandung NaCl yang akan menghilangkan interaksi ionik antara DNA dan kation sehingga DNA akan larut lebih baik dan lebih stabil pada garam. Selain itu, bufer STE juga
mengandung etilen diamin tetra asetat (EDTA) yang berfungsi sebagai perusak sel dengan cara mengikat ion magnesium. Ion ini berfungsi untuk mempertahankan integritas sel maupun mempertahankan aktivitas enzim nuklease yang merusak asam nukleat (Muladno, 2002).
Sodium dodesil sulfat (SDS) 10% yang digunakan dalam isolasi DNA merupakan sejenis deterjen yang dapat digunakan untuk merusak membran sel, hal ini mengakibatkan sel mengalami lisis. Isolasi DNA juga menggunakan proteinase-K. Enzim tersebut yang mengkatalisis degradasi polipeptida menjadi unit-unit yang lebih kecil. Kotoran (debris) sel yang disebabkan oleh pengrusakan sel oleh EDTA dan SDS dibersihkan dengan cara disentrifugasi sehingga yang tertinggal hanya molekul nukleotida (DNA dan RNA). Untuk menghilangkan protein dari larutan digunakan larutan fenol (mengikat protein dan sebagian kecil RNA) dan kloroform (membersihkan protein dan polisakarida dari larutan) (Muladno, 2002). Pemberian larutan fenol dan kloroform dapat dilakukan berulang agar protein dan pengotor pada proses isolasi DNA dapat terbuang lebih maksimal. Pengambilan fase yang mengandung DNA pada bagian atas dilakukan dengan sangat hati-hati. Selanjutnya DNA dipresipitasi menggunakan etanol absolut 95%. DNA terlihat berwarna bening dan kental saat dililit menggunakan ujung tip mikro (Gambar 9).
4.5.2. Elektroforesis Gel Agarosa
DNA yang telah berhasil diisolasi kemudian dilakukan pengujian untuk mendeteksi keberadaan DNA tersebut menggunakan elektroforesis pada gel agarosa (Gambar 10).
1 2 3 4
Gambar 10. Hasil elektroforesis DNA genom bakteri pelarut fosfat
4.5.3. Amplifikasi Gen 16S rRNA
Isolasi DNA dilakukan sebagai tahap awal untuk melakukan proses PCR. Konsentrasi DNA yang terlalu tinggi akan menghambat tahapan denaturasi PCR, karena dapat memacu terjadinya snapback, yaitu kembalinya DNA utas tunggal menjadi DNA utas ganda, hal ini akan menyebabkan DNA cetakan untuk reaksi PCR berkurang.
Hasil amplifikasi PCR isolat BPF menggunakan primer 16S rRNA (Gambar 11) menghasilkan satu amplikon atau produk PCR berukuran sekitar 1300 bp. Primer yang digunakan dalam proses PCR ini, yaitu primer F-63
(5’-CAGGCCTAACACATGCAAGTC) dan primer R-1387
(5’-GGGCGGCGTGTACAAGGC) (Marchesi et al., 1998). Selanjutnya amplikon ini disekuen untuk mengetahui urutan nukleotida pada gen 16S rRNA masing-masing isolat.
Keterangan :
1 = 1 kb DNA ladder marker 2 = isolat P 3.5
3 = isolat P 6.2 4 = isolat P 10.1
1 2 3 4
Gambar 11. Hasil amplifikasi gen 16S rRNA bakteri pelarut fosfat
4.5.4. Sekuensing DNA Bakteri Pelarut Fosfat
Berdasarkan hasil analisis sekuen gen 16S rRNA pada program WU-BLASTN 2.0 diketahui homologi spesies dari tiga isolat bakteri pelarut fosfat yang diuji. Isolat P 3.5 (NTT) dan isolat P 10.1 (Citeureup, Bogor) memiliki kemiripan sebesar 98% dengan Gluconacetobacter sp. strain Rh1-MS-CO, sedangkan isolat P 6.2 (NTB) memiliki kemiripan sebesar 97% dengan Enterobacter sp. strain pp9c.
Hasil analisis sekuen gen 16S rRNA dari tiga isolat BPF pada data GenBank sebagai berikut :
Isolat 3.5
> Gluconacetobacter sp. Rh1-MS-CO 16S ribosomal RNA gene, partial sequence Length=1394
Score = 708 bits (784), Expect = 0.0
Identities = 401/406 (98%), Gaps = 1/406 (0%) Query 40 GGATCTGTCNTNCCGGTGGGGGATAACACTGGGAAACTGGTGCTAATACCGCATGACACC 99 ||||||||| |||||||||||||||||||||||||||||||||||||||||||||| Sbjct 60 GGATCTGTCCATG-GGTGGGGGATAACACTGGGAAACTGGTGCTAATACCGCATGACACC 118 Query 100 TGAGGGTCAAAGGCGAGAGTCGCCTGTGGAGGAACCTGCGTTCGATTAGCTAGTTGGTGG 159 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 119 TGAGGGTCAAAGGCGAGAGTCGCCTGTGGAGGAACCTGCGTTCGATTAGCTAGTTGGTGG 178 Query 160 GGTAACTGCCTACCAAGGCGATGATCGATAGCTGGTCTGAGAGGATGATCAGCCACACTG 219 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 179 GGTAACTGCCTACCAAGGCGATGATCGATAGCTGGTCTGAGAGGATGATCAGCCACACTG 238 Query 220 GGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGGACAATGGG 279 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 239 GGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGGACAATGGG 298 1650 bp 1000 bp Amplikon ~1300 bp Keterangan :
1 = 1 kb DNA ladder marker 2 = isolat P 3.5
3 = isolat P 6.2 4 = isolat P 10.1
Query 280 GGCAACCCTGATCCAGCAATGCCGCGTGTGTGAAGAAGGTCTTCGGATTGTAAAGCACTT 339 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 299 GGCAACCCTGATCCAGCAATGCCGCGTGTGTGAAGAAGGTCTTCGGATTGTAAAGCACTT 358 Query 340 TCGACGGGGACGATGATGACGGTACCCGTAGAAGAAGCCCCGGCTAACTTCGTGCCAGCA 399 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 359 TCGACGGGGACGATGATGACGGTACCCGTAGAAGAAGCCCCGGCTAACTTCGTGCCAGCA 418 Query 400 GCCGCGGTAATACGAAGGGGGCTAGCGTTGCTCGGAATGACTGGGC 445 |||||||||||||||||||||||||||||||||||||||||||||| Sbjct 419 GCCGCGGTAATACGAAGGGGGCTAGCGTTGCTCGGAATGACTGGGC 464 Isolat 10.1
> Gluconacetobacter sp. Rh1-MS-CO 16S ribosomal RNA gene, partial sequence Length=1394
Score = 719 bits (796), Expect = 0.0
Identities = 407/412 (98%), Gaps = 1/412 (0%) Query 42 GGATCTGTCNTTCCNGTGGGGGATAACACTGGGAAACTGGTGCTAATACCGCATGACACC 101 ||||||||| | ||||||||||||||||||||||||||||||||||||||||||||| Sbjct 60 GGATCTGTCCATG-GGTGGGGGATAACACTGGGAAACTGGTGCTAATACCGCATGACACC 118 Query 102 TGAGGGTCAAAGGCGAGAGTCGCCTGTGGAGGAACCTGCGTTCGATTAGCTAGTTGGTGG 161 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 119 TGAGGGTCAAAGGCGAGAGTCGCCTGTGGAGGAACCTGCGTTCGATTAGCTAGTTGGTGG 178 Query 162 GGTAACTGCCTACCAAGGCGATGATCGATAGCTGGTCTGAGAGGATGATCAGCCACACTG 221 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 179 GGTAACTGCCTACCAAGGCGATGATCGATAGCTGGTCTGAGAGGATGATCAGCCACACTG 238 Query 222 GGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGGACAATGGG 281 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 239 GGACTGAGACACGGCCCAGACTCCTACGGGAGGCAGCAGTGGGGAATATTGGACAATGGG 298 Query 282 GGCAACCCTGATCCAGCAATGCCGCGTGTGTGAAGAAGGTCTTCGGATTGTAAAGCACTT 341 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 299 GGCAACCCTGATCCAGCAATGCCGCGTGTGTGAAGAAGGTCTTCGGATTGTAAAGCACTT 358 Query 342 TCGACGGGGACGATGATGACGGTACCCGTAGAAGAAGCCCCGGCTAACTTCGTGCCAGCA 401 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 359 TCGACGGGGACGATGATGACGGTACCCGTAGAAGAAGCCCCGGCTAACTTCGTGCCAGCA 418 Query 402 GCCGCGGTAATACGAAGGGGGCTAGCGTTGCTCGGAATGACTGGGCGTAAAG 453 |||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 419 GCCGCGGTAATACGAAGGGGGCTAGCGTTGCTCGGAATGACTGGGCGTAAAG 470 Isolat 6.2
> Enterobacter sp. pp9c 16S ribosomal RNA gene, partial sequence Length=1535
Score = 708 bits (784), Expect = 0.0
Identities = 408/419 (97%), Gaps = 1/419 (0%) Query 29 CGAGAGGANNANGGGTGAGTTTTCTTCTGGGAAACTGCCTGATGGAGGGGGATAACTACT 88 |||| || | |||||||| | | |||||||||||||||||||||||||||||||||| Sbjct 92 CGAGCGGCGGACGGGTGAGTAATGT-CTGGGAAACTGCCTGATGGAGGGGGATAACTACT 150 Query 89 GGAAACGGTAGCTAATACCGCATAACGTCGCAAGACCAAAGAGGGGGACCTTCGGGCCTC 148 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 151 GGAAACGGTAGCTAATACCGCATAACGTCGCAAGACCAAAGAGGGGGACCTTCGGGCCTC 210 Query 149 TTGCCATCAGATGTGCCCAGATGGGATTAGCTAGTAGGTGGGGTAACGGCTCACCTAGGC 208 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 211 TTGCCATCAGATGTGCCCAGATGGGATTAGCTAGTAGGTGGGGTAACGGCTCACCTAGGC 270
Query 209 GACGATCCCTAGCTGGTCTGAGAGGATGACCAGCCACACTGGAACTGAGACACGGTCCAG 268 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 271 GACGATCCCTAGCTGGTCTGAGAGGATGACCAGCCACACTGGAACTGAGACACGGTCCAG 330 Query 269 ACTCCTACGGGAGGCAGCAGTGGGGAATATTGCACAATGGGCGCAAGCCTGATGCAGCCA 328 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 331 ACTCCTACGGGAGGCAGCAGTGGGGAATATTGCACAATGGGCGCAAGCCTGATGCAGCCA 390 Query 329 TGCCGCGTGTATGAAGAAGGCCTTCGGGTTGTAAAGTACTTTCAGCGGGGAGGAAGGCGT 388 |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||| Sbjct 391 TGCCGCGTGTATGAAGAAGGCCTTCGGGTTGTAAAGTACTTTCAGCGGGGAGGAAGGCGT 450 Query 389 TGNGGTTAATAACCNCAGCGATTGACGTTACCCGCAGAAGAAGCACCGGCTAACTCCGT 447 || ||||||||||| |||||||||||||||||||||||||||||||||||||||||||| Sbjct 451 TGAGGTTAATAACCTCAGCGATTGACGTTACCCGCAGAAGAAGCACCGGCTAACTCCGT 509
Hasil sekuen isolat P 3.5 dan P 10.1 termasuk ke dalam taksonomi sebagai berikut : Kingdom : Bacteria Phylum : Proteobacteria Class : Alphaproteobacteria Order : Rhodospirillales Family : Acetobacteraceae Genus : Gluconacetobacter Spesies : Gluconacetobacter sp.
Sedangkan hasil sekuen isolat P 6.2 termasuk ke dalam taksonomi sebagai berikut : Kingdom : Bacteria Phylum : Proteobacteria Class : Gammaproteobacteria Order : Enterobacteriales Family : Enterobacteriaceae Genus : Enterobacter Spesies : Enterobacter sp.
Proteobacteria merupakan filum terbesar dalam Kingdom/Domain Eubacteria. Semua Proteobacteria merupakan bakteri Gram negatif, tetapi memiliki bentuk bermacam-macam (batang, bulat, dan spiral). Kebanyakan bergerak dengan flagela, tetapi ada yang bergerak meluncur atau tidak dapat bergerak. Sebagian besar anggotanya termasuk mikroorganisme anaerob
fakultatif atau obligat. Anggota Proteobacteria ada yang hidup bebas, bersimbiosis ataupun sebagai patogen pada manusia, hewan, dan tumbuhan. Berdasarkan rangkaian rRNA-nya, Proteobacteria dibagi menjadi lima kelompok, yaitu Alphaproteobacteria, Betaproteobacteria, Gammaproteobacteria, Deltaproteobacteria, dan Epsilonproteobacteria. Alphaproteobacteria meliputi bakteri fototrof dan bakteri yang menggunakan senyawa C1. Anggota kelompok ini ada yang bersimbiosis dengan tanaman (contohnya, Rhizobium sp) dan hewan. Ada pula yang merupakan patogen pada hewan dan manusia, contohnya Rickettsia prowazek. Bakteri ini menyebabkan demam pada penyakit tifus jika berpindah dari kutu ke manusia. Contoh lainnya adalah Agrobacterium tumefaciens dan Magnetospirilum magnerotuctlicum (Siregar, 2008).
Betaproteobacteria terdiri atas kelompok bakteri aerob fakultatif, bakteri kemolitotrof (misalnya, Nitrosomonas), serta bakteri fototrof (misalnya, Rhodocyclus). Contoh spesies patogen dalam kelompok ini adalah Neisseria gonorrhoea. Gammaproteobacteria terdiri atas kelompok-kelompok bakteri yang banyak digunakan untuk keperluan medis dan penelitian, contohnya Enterobacteri, Vibrio, dan Pseudomonas. Namun ada pula yang merupakan patogen, misalnya Salmonella (tifus), Vibrio (kolera), dan Yersinia. Kelompok Deltaproteobacteria terdiri atas bakteri pembentuk badan buah, yaitu Myxobacteria. Bakteri tersebut ditemukan di tanah dan bahan-bahan organik yang membusuk. Kelompok Epsilonproteobacteria diantaranya dua anggota kelompok kecil ini merupakan patogen pada manusia. Contohnya, Helicobacter pylori yang menyebabkan tukak lambung dan Campylobacter jejuni yang menyebabkan gangguan gastrointestinal (Siregar, 2008).