UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. ASTRAZENECA INDONESIA
JABABEKA PHASE III TECHNOPARK
Jl. TEKNO RAYA BLOK B1A – B1B CIKARANG, BEKASI
PERIODE 4 MARET – 30 APRIL 2013
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
NISA YULIANTI SUPRAHMAN
1206313412
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI PT. ASTRAZENECA INDONESIA
JABABEKA PHASE III TECHNOPARK
Jl. TEKNO RAYA BLOK B1A – B1B CIKARANG, BEKASI
PERIODE 4 MARET – 30 APRIL 2013
Diajukan sebagai salah satu syarat untuk memperoleh gelar
Apoteker
NISA YULIANTI SUPRAHMAN
1206313412
ANGKATAN LXXVI
FAKULTAS FARMASI
PROGRAM PROFESI APOTEKER
DEPOK
JULI 2013
Laporan Praktik Kerja Profesi Apoteker ini diajukan oleh:
iv
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Tuhan Yang Maha Esa karena atas berkat dan rahmat-Nya, penulis dapat menyelesaikan Laporan Praktek Kerja Profesi Apoteker (PKPA) di PT. Astra Zeneca Indonesia. Penulisan laporan ini dilakukan dalam rangka memenuhi salah satu syarat untuk mencapai gelar Apoteker pada Program Profesi Apoteker Fakultas Farmasi Universitas Indonesia.
Penulis menyadari bahwa tanpa bantuan dan bimbingan dari berbagai pihak, sangatlah sulit bagi penulis untuk menyelesaikan laporan praktek kerja ini. Oleh karena itu, penulis menyampaikan terima kasih kepada:
1. Ibu Dewi Ikha Sokasari S.Farm., Apt selaku pembimbing di PT.Astra Zeneca Indonesia yang telah memberikan kesempatan, bimbingan, dan pengetahuan kepada penulis selama pelaksanaan dan penyusunan laporan PKPA ini. 2. Bapak Dr. Hayun M.Si selaku pembimbing di Program Profesi Apoteker
Fakultas Farmasi UI yang telah memberikan kesempatan, arahan, dan bimbingan kepada penulis selama pelaksanaan dan penyusunan laporan PKPA di PT. Astra Zeneca Indonesia
3. Bapak Dr. Harmita, Apt. selaku Ketua Program Profesi Apoteker, Fakultas Farmasi UI yang telah memberikan bimbingan dan arahan kepada penulis selama penulisan laporan PKPA.
4. Ibu Prof. Dr. Yahdiana Harahap, M.S. selaku Dekan Fakultas Farmasi UI. 5. Bapak Risman Abudaeri selaku Site Director PT. Astra Zeneca Indonesia
yang telah memberikan kesempatan kepada penulis untuk melaksanakan PKPA di PT. Astra Zeneca Indonesia
6. Ibu Haryanti Diah Astuti S.Farm., Apt yang telah banyak memberikan bimbingan, arahan dan dukungan kepada penulis selama melaksanakan PKPA di PT. Astra Zeneca Indonesia
7. Seluruh karyawan di PT. Astra Zeneca Indonesia yang telah memberi bimbingan dan dukungan kepada penulis selama melaksanakan PKPA di PT. Astra Zeneca Indonesia
Apoteker.
9. Keluarga tercinta yang telah memberikan doa dan dukungan moral serta materi sehingga program PKPA dan penyusunan laporan ini dapat dilaksanakan dengan lancar.
10. Rekan-rekan PKPA di PT. Astra Zeneca Indonesia yang telah berbagi ilmu, pengalaman dan suka duka selama pelaksanaan PKPA.
11. Seluruh sahabat dan teman Program Profesi Apoteker, Fakultas Farmasi UI selaku teman seperjuangan yang telah memberikan dukungan dan semangat.
Penulis menyadari bahwa penyusunan laporan PKPA ini masih jauh dari sempurna. Oleh karena itu, penulis dengan senang hati menerima segala kritik dan saran demi perbaikan di masa yang akan datang. Penulis berharap agar laporan PKPA ini dapat bermanfaat bagi pengembangan ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya.
Penulis
vi
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Indonesia, saya yang bertanda tangan di bawah ini:
Nama : Nisa Yulianti Suprahman
NPM : 1206313412
Program Studi : Profesi Apoteker
Departemen : Farmasi
Fakultas : MIPA
Jenis karya : Laporan Praktek Kerja Profesi
demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada Universitas Indonesia Hak Bebas Royalti Noneksklusif (Non-exclusive
Royalty Free Right) atas karya ilmiah saya yang berjudul :
Laporan Praktek Kerja Profesi Apoteker di PT. Astrazeneca Indonesia Jababeka Phase III Technopark Jl. Tekno Raya Blok B1A-B1B Cikarang, Bekasi Period March, 4th – April, 30th 2013
beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalti Noneksklusif ini Universitas Indonesia berhak menyimpan,
mengalihmedia/format-kan, mengelola dalam bentuk pangkalan data (database), merawat, dan memublikasikan tugas akhir saya selama tetap mencantumkan nama saya sebagai penulis/pencipta dan sebagai pemilik Hak Cipta.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di : Depok Pada tanggal : 1 Juli 2013
Yang menyatakan
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERSETUJUAN PUBLIKASI ... vi
DAFTAR ISI ... vii
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
BAB 1 PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
BAB 2 TINJAUAN PUSTAKA ... 3
2.1 Industri Farmasi ... 3
2.2 Cara Pembuatan Obat yang Baik (CPOB) ... 5
BAB 3 TINJAUAN KHUSUS PT. ASTRAZENECA INDONESIA ... 15
3.1 Sejarah dan Perkembangan ... 15
3.2 Visi dan Misi ... 16
3.3 Struktur dan Organisasi ... 16
3.4 Lokasi dan Sarana ... 24
3.5 Bangunan dan Fasilitas serta Sarana Penunjang ... 25
BAB 4PEMBAHASAN ... 26
4.1 Sistem Manajemen Mutu ... 26
4.2 Personalia ... 26
4.3 Bangunan dan Fasilitas ... 27
4.4 Peralatan ... 31
4.5 Sanitasi dan Higiene ... 32
4.6 Produksi ... 34
4.7 Pengawasan Mutu ... 36
4.8 Inspeksi Diri, Audit Mutu dan Audit & Persetujuan Pemasok .... 38
4.9 Penanganan Keluhan terhadap Produk dan Penarikan Kembali Produk ... 39
4.10 Dokumentasi ... 42
4.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 43
4.12 Kualifikasi dan Validasi ... 44
BAB 5 KESIMPULAN DAN SARAN ... 49
5.1 Kesimpulan ... 49
viii
x
DAFTAR TABEL
Tabel 4.1 Persyaratan aliran tekanan ... 36
Tabel 4.2 Daftar dari inspeksi GMP pada PT. AstraZeneca Indonesia selama 5 tahun terakhir ... 38
Lampiran 1 Struktur Organisasi PT.AstraZeneca Indonesia – Cikarang Site 51
Lampiran 2 Struktur Organisasi QA and SHE Department ... 52
Lampiran 3 Struktur Organisasi Supply Chain Department ... 52
1 Universitas Indonesia
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Kesehatan merupakan parameter untuk menentukan kualitas hidup manusia. Oleh karena itu penyelenggaraan upaya kesehatan harus didukung oleh seluruh sumber daya kesehatan meliputi tenaga kesehatan, biaya kesehatan, pengelolaan, penelitian dan pengembangan kesehatan termasuk obat-obatan. Obat merupakan suatu produk industri farmasi yang berhubungan dengan jiwa pemakainya, oleh karena itu industri farmasi menjadi salah satu industri yang dikontrol dan diawasi ketat oleh pemerintah dan Badan Pengawasan Obat dan Makanan.
Industri farmasi dituntut menghasilkan obat sesuai dengan tujuan penggunaannya, yaitu memenuhi persyaratan seperti yang telah ditentukan sehingga menghasilkan produk obat yang aman, berkhasiat, dan berkualitas. Pemerintah mengatur bagaimana suatu industri farmasi dapat menjalankan fungsinya sebagai tempat pembuatan obat agar tujuan pengobatan tersebut dapat tercapai. Salah satu upaya pemerintah dalam menjamin ketersediaan obat sesuai dengan tujuan tersebut adalah dengan membuat pedoman yang harus dipenuhi oleh setiap industri farmasi, yaitu Cara Pembuatan Obat yang Baik (CPOB).
CPOB merupakan pedoman yang bertujuan untuk menjamin obat dibuat secara konsisten, agar tercapai standar mutu yang sesuai dengan tujuan penggunaan dan memenuhi persyaratan yang telah ditentukan. Pedoman ini juga dimaksudkan untuk digunakan oleh industri farmasi sebagai dasar pengembangan aturan internal sesuai kebutuhan (Badan POM RI, 2006).
Penerapan CPOB di dalam industri farmasi dapat terlaksana dengan baik jika para personil telah memiliki pemahaman yang baik mengenai CPOB. Berdasarkan Peraturan Pemerintah Republik Indonesia No. 51 Tahun 2009 tentang pekerjaan kefarmasian, salah satu tempat pengabdian profesi apoteker adalah industri farmasi. Tanggung jawab apoteker dalam industri farmasi tersebut berada pada bidang pemastian mutu, produksi, serta pengawasan mutu. Dengan bekal pengetahuan dan keahlian yang dimiliki mengenai produksi obat,
seorang apoteker harus benar-benar menjalankan tanggung jawab profesi tersebut dengan profesional. Untuk mencapai peran dan tanggung jawab tersebut, apoteker dituntut memiliki pengetahuan, wawasan, keterampilan yang memadai, dan kemampuan dalam mengaplikasikan ilmunya secara profesional terutama dalam memahami kenyataan di lapangan industri. Calon apoteker perlu dibekali dengan pengetahuan dan pemahaman yang komprehensif antara teori dengan prakteknya secara langsung.
Berdasarkan hal tersebut, maka seorang calon Apoteker harus memahami tanggung jawab profesinya secara nyata. Melalui teori yang dibekali sebelumnya, calon Apoteker diharapkan memiliki pemahaman mengenai penerapannya di dunia nyata. Pemahaman tersebut dapat diperoleh melalui sebuah praktek kerja profesi di industri farmasi. Oleh karena itu, Program Profesi Apoteker Fakultas Farmasi UI mengadakan kerjasama dengan PT AstraZeneca Indonesia dalam menyelenggarakan Praktek Kerja Profesi Apoteker (PKPA) agar dapat menjadi sarana pembelajaran di industri farmasi bagi para calon Apotekernya. Praktek kerja profesi ini dijalankan dari periode 4 Maret-30 April 2013.
1.2 Tujuan
1. Memahami aspek penerapan CPOB di PT AstraZeneca Indonesia 2. Memahami peran dan tanggung jawab Apoteker dalam Industri
3 Universitas Indonesia
BAB 2
TINJAUAN PUSTAKA
2.1 Industri Farmasi
Industri farmasi dapat didefinisikan sebagai Industri Obat Jadi dan Industri Bahan Baku Obat, hal ini didasarkan atas Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 tentang Ketentuan dan Tata Cara Pelaksanaan Pemberian Izin Usaha Industri Farmasi Bab I pasal 1. Industri obat jadi adalah industri yang menghasilkan suatu produk yang telah melalui seluruh tahap proses pembuatan. Proses pembuatan adalah seluruh rangkaian kegiatan yang menghasilkan suatu obat yang meliputi produksi dan pengawasan mutu mulai dari pengadaan bahan awal, proses pengolahan, pengemasan sampai obat jadi dan siap untuk didistribusikan.
Obat jadi adalah sediaan atau paduan bahan-bahan yang siap digunakan untuk mempengaruhi atau menyelidiki sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosa, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan, dan kontrasepsi. Adapun yang dimaksud dengan bahan baku obat adalah bahan, baik yang berkhasiat maupun tidak berkhasiat yang digunakan dalam pengelolaan obat dengan standar mutu sebagai bahan farmasi.
Industri farmasi wajib memiliki Izin Usaha Industri Farmasi sebelum memulai proses produksinya. Izin Usaha Industri Farmasi diberikan kepada pemohon yang telah siap berproduksi sesuai persyaratan Cara Pembuatan Obat yang Baik (CPOB). Sebelum memperoleh Izin Usaha Industri Farmasi, suatu perusahaan harus melewati tahap persetujuan prinsip. Persetujuan prinsip diberikan kepada industri farmasi untuk dapat langsung melakukan persiapan-persiapan dan usaha pembangunan, pengadaan, pemasangan instalasi peralatan, dan lain-lain yang diperlukan termasuk produksi percobaan dengan memperhatikan ketentuan perundang-undangan di bidang obat. Persetujuan prinsip tersebut berlaku selama jangka waktu 3 tahun dan setiap tahun perusahaan yang bersangkutan wajib meyampaikan informasi kemajuan pembangunan proyeknya kepada Kepala Badan Pengawas Obat dan Makanan (Badan POM).
Perluasan atau pengembangan pabrik diperbolehkan dengan syarat harus mengajukan izin dan disetujui oleh Badan POM.
Izin usaha industri farmasi yang diberikan dapat berlaku untuk seterusnya selama perusahaan industri farmasi yang bersangkutan berproduksi dan tidak melanggar ketentuan yang telah ditetapkan dalam surat keputusan Menteri Kesehatan Republik Indonesia No. 245/MENKES/SK/V/1990.
Beberapa persyaratan yang diperlukan industri farmasi dalam mendapatkan Izin Usaha adalah :
a. Dilakukan oleh Perusahaan Umum, Badan Hukum berbentuk Perseroan Terbatas, atau Koperasi.
b. Memiliki Rencana Investasi.
c. Memiliki Nomor Pokok Wajib Pajak (NPWP).
d. Memenuhi persyaratan Cara Pembuatan Obat yang Baik (CPOB) sesuai ketentuan Pedoman CPOB 2008 (current GMP).
e. Memperkerjakan secara tetap sekurang-kurangnya tiga Apoteker warga Negara Indonesia, masing-masing sebagai penanggung jawab produksi dan pengawasan mutu, sesuai persyaratan CPOB.
f. Obat jadi yang diproduksi oleh perusahaan farmasi hanya dapat diedarkan setelah memperoleh persetujuan, sesuai dengan ketentuan perundang-undangan yang berlaku.
Kewajiban lain yang harus dilakukan oleh perusahaan yang telah memperoleh Izin Usaha Industri Farmasi, yaitu :
a. Membuat laporan jumlah dan nilai produksinya sekali dalam enam bulan, sedangkan untuk laporan lengkap wajib disampaikan sekali dalam setahun. b. Menyalurkan produksinya sesuai dengan ketentuan perundang-undangan yang
berlaku.
c. Melaksanakan keamanan dan keselamatan alat, bahan baku, proses, hasil produksi, pengangkutan, dan keselamatan kerja.
d. Melaksanakan upaya keseimbangan dan kelestarian serta mencegah pencemaran lingkunga.
e. Melakukan Analisa Mengenai Dampak Lingkungan (AMDAL) berupa Upaya Pengelolaan Lingkungan (UKL) dan Upaya Pemantauan Lingkungan (UPL).
5
Universitas Indonesia
Pencabutan Izin Usaha Industri Farmasi dilakukan bila Perusahaan Industri Farmasi yang telah mendapat Izin Usaha Industri Farmasi :
a. Melakukan pindah tangan hak milik izin usaha industri farmasi dan perluasan tanpa izin.
b. Tidak menyampaikan informasi industri tiga kali berturut-turut atau dengan sengaja menyampaikan informasi yang tidak benar.
c. Melakukan pemindahan lokasi industri tanpa persetujuan tertulis terlebih dahulu dari Menteri Kesehatan Republik Indonesia.
d. Dengan sengaja memproduksi obat atau bahan baku obat yang tidak memenuhi persyaratan dan ketentuan yang berlaku (obat palsu).
e. Tidak memenuhi ketentuan dalam izin usaha industri farmasi.
2.2 Cara Pembuatan Obat yang Baik (CPOB) (Badan Pengawas Obat dan Makanan, 2012)
Cara Pembuatan Obat yang Baik (CPOB) berujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan yang ditetapkan dan sesuai dengan tujuan penggunaannya. CPOB mencakup seluruh aspek produksi dan pengendalian mutu. Pada pembuatan obat, pengendalian menyeluruh adalah sangat esensial untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi. Pembuatan secara sembarangan tidak dibenarkan bagi produk yang digunakan untuk menyelamatkan jiwa, atau memulihkan atau memelihara kesehatan.
Tidaklah cukup bila produk jadi hanya sekedar lulus dari serangkaian pengujian, tetapi yang lebih penting adalah bahwa mutu harus dibentuk ke dalam produk tersebut. Mutu obat tergantung pada bahan awal, bahan pengemas, proses produksi dan pengendalian mutu, bangunan, peralatan yang dipakai dan personil yang terlibat. Pemastian mutu suatu obat tidak hanya mengandalkan pada pelaksanaan pengujian tertentu saja, namun obat hendaklah dibuat dalam kondisi yang dikendalikan dan dipantau secara cermat.
Aspek CPOB berdasarkan Pedoman CPOB 2012 meliputi manajemen mutu; personalia; bangunan dan fasilitas; peralatan; hygiene dan sanitasi; produksi; pengawasan mutu; inspeksi diri, audit mutu dan audit & persetujuan
terhadap pemasok ; penanganan keluhan terhadap produk dan penarikan kembali produk, dokumentasi; pembuatan dan analisis berdasarkan kontrak; serta kualifikasi dan validasi.
2.2.1 Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan risiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen bertanggung jawab untuk pancapaian tujuan ini melalui suatu “Kebijakan Mutu”, yang memerlukan partisipasi dan komitmen jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor.
Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan sistem Pemastian Mutu yang didesain secara menyeluruh dan diterapkan secara benar serta menginkorporasi Cara Pembuatan Obat yang Baik termasuk Pengawasan Mutu dan Manajemen Risiko Mutu.
Unsur dasar manajemen mutu adalah suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya dan tindakan sistematis yang diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan.
2.2.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Oleh sebab itu industri farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah memahami tanggung jawab masing-masing dan dicatat. Seluruh personil hendaklah memahami prinsip CPOB serta memperoleh pelatihan awal dan berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan pekerjaannya.
7
Universitas Indonesia
Industri farmasi hendaklah memiliki personil yang terkualifikasi dan berpengalaman praktis dalam jumlah yang memadai. Tiap personil hendaklah tidak dibebani tanggung jawab yang berlebihan untuk menghindarkan risiko terhadap mutu obat. Industri farmasi harus memiliki struktur organisasi. Tugas spesifik dan kewenangan dari personil pada posisi penanggung jawab hendaklah dicantum-kan dalam uraian tugas tertulis.
Struktur organisasi industri farmasi hendaklah sedemikian rupa sehingga bagian produksi, pengawasan mutu, manajemen mutu (pemastian mutu) dipimpin oleh orang yang berbeda serta tidak saling bertanggung jawab satu terhadap yang lain. Masing-masing personil hendaklah diberi wewenang penuh dan sarana yang memadaai yang diperlukan untuk dapat melaksanakan tugasnya secara efektif. Hendaklah personil tersebut tidak mempunyai kepentingan lain diluar organisasi yang dapat menghambat atau membatasi kewajibannya dalam melaksanakan tanggung jawab atau yang dapat menimbulkan konflik kepentingan pribadi atau finansial.
Didalam industri farmasi terdapat tiga Personil Kunci. Personil kunci mencakup kepala bagian Produksi, kepala bagian Pengawasan Mutu dan kepala bagian Manajemen Mutu (Pemastian Mutu). Posisi utama tersebut dijabat oleh personil purnawaktu. Kepala bagian Produksi dan kepala bagian Manajemen Mutu (Pemastian Mutu)/kepala bagian Pengawasan Mutu harus independen satu terhadap yang lain.
Kepala bagian produksi dan kepala bagian pengawasan mutu harus seorang apoteker yang cakap, terlatih dan memiliki pengalaman praktis yang memadai di bidang industri farmasi dan keterampilan dalam kepemimpinan sehingga memungkinkan melaksanakan tugas secara professional. Kepala bagian produksi hendaklah memiliki wewenang serta tanggung jawab penuh untuk mengelola produksi obat. Kepala bagian pengawasan mutu adalah satu-satunya yang memiliki wewenang untuk meluluskan bahan, produk antara, produk ruahan, dan obat jadi bila produk tersebut sesuai dengan spesifikasinya, atau menolaknya bila tidak cocok dengan spesifikasinya, atau bila tidak dibuat sesuai dengan prosedur yang disetujui dan kondisi yang ditentukan.
Industri farmasi hendaklah memberikan pelatihan bagi seluruh personil yang karena tugasnya harus berada di dalam area produksi, gudang penyimpanan atau labolatorium (termasuk personil teknik, perawatan dan petugas kebersihan), dan bagi personil lain yang kegiatannya dapat berdampak pada mutu produk. Disamping pelatihan dasar dalam teori dan praktik CPOB, personil baru hendaklah mendapat pelatihan sesuai degan tugas yang diberikan. Pelatihan berkesinambungan hendaklah juga diberikan, dan efektifitas penerapannya hendaklah dinilai secara berkala. Hendaklah tersedia program pelatihan yang disetujui kepala bagian masing-masing. Pelatihan hendaklah diberikan oleh orang yang terkualifikasi.
2.2.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat harus memiliki desain, konstruksi dan letak yang memadai, serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadi kekeliruan, pencemaran silang dan kesalahan lain, serta memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindarkan pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Letak bangunan hendaklah sedemikian rupa untuk menghindarkan pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara, tanah dan air serta dari kegiatan industri lain yang berdekatan. Apabila letak bangunan tidak sesuai, hendaklah diambil tindakan pencegahan yang efektif terhadap pencemaran tersebut. Bangunan dan fasilitas hendaklah didesain, dikonstruksi, dilengkapi dan dirawat sedemikian agar memperoleh perlindungan maksimal terhadap pangaruh cuaca, banjir, rembesan dari tanah serta masuk dan bersarang serangga, burung, binatang pengerat, kutu atau hewan lain. Hendaklah tersedia prosedur untuk pengendalian binatang pengerat dan hama. Bangunan dan fasilitas hendaklah dirawat dengan cermat, dibersihkan dan bila perlu, didisinfeksi sesuai prosedur tertulis rinci.
9
Universitas Indonesia
2.2.4 Peralatan
Peralatan untuk pembuatan obat hendaklah memiliki desian dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, ukuran yang memadai serta ditempatkan dan dikualifikasi dengan tepat, agar mutu obat terjamin sesuai desain serta seragam dari bets ke bets dan untuk memudahkan pembersihan serta perawatan agar dapat mencegah kontaminasi silang, penumpukan debu atau kotoran dan hal-hal yang umumnya berdampak buruk pada mutu produk.
Peralatan manufaktur hendaklah didesain, ditempatkan dan dirawat sesuai dengan tujuannya. Permukaan peralatan yang bersentuhan dengan bahan awal, produk antara atau produk jadi tidak boleh menimbulkan reaksi, adisi atau absorbsi yang dapat yang dapat mempengaruhi identitas, mutu atau kemurnian di luar batas yang ditentukan.
Peralatan hendaklah dipasang sedemikian rupa untuk mencegah risiko kesalahan atau kontaminasi. Peralatan satu sama lain hendaklah ditempatkan pada jarak yang cukup untuk menghindarkan kesesakan serta memastikan tidak terjadi kekeliruan dan kecampurbauran produk.
Peralatan hendaklah dirawat sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat mempengaruhi identitas, mutu atau kemurnian produk. Kegiatan perbaikan dan perawatan hendaklah tidak menimbulkan risiko terhadap mutu produk.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan hygiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan hygiene meliputi personil, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya, bahan pembersih dan desinfeksi, dan segala sesuatu yang dapat merupakan sumber pencemaran produk. Sumber pencemaran potensial hendaklah dihilangkan melalui suatu program sanitasi dan hygiene yang menyeluruh dan terpadu. Selain itu, prosedur sanitasi dan hygiene hendaklah di validasi dan di evaluasi secara berkala untuk memastikan bahwa prosedur yang diterapkan cukup efektif dan memenuhi persyaratan.
Untuk menjamin perlindungan prouk dari pencemaran dan untuk keamanan personel, hendaklah personel mengenakan pakaian pelindung yang bersih dan sesuai dengan tugasnya termasuk penutup rambut. Hendaklah dihindarkan bersentuhan langsung antara tangang operator dengan bahan awal, produk antara dan produk ruahan yang terbuka dan juga dengan bagian peralatan yang bersentuhan dengan produk.
2.2.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan, dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar. Produksi hendaklah dilakukan dan diawasi oleh personil yang kompeten. Penanganan bahan dan produk jadi, seperti penerimaan dan karantina, pengambilan sampel, penyimpanan, penandaan, penimbangan, pengolahan, pengemasan dan distribusi hendaklah dilakukan sesuai dengan prosedur atau instruksi tertulis dan bila perlu dicatat.
Seluruh bahan yang diterima hendaklah diperiksa untuk memastikan kesesuaiannya dengan pesanan. Wadah hendaklah dibersihkan dimana perlu dan diberi penandaan dengan data yang diperlukan. Kerusakan wadah dan masalah lain yang dapat berdampak merugikan terhadap mutu bahan hendaklah diselidiki, dicatat dan dilaporkan kepada Bagian Pengawasan Mutu. Bahan yang diterima dan produk jadi hendaklah dikarantina secara fisik atau administratif segera setelah diterima atau diolah, sampai dinyatakan lulus untuk pemakaian atau distribusi.
Produk antara dan produk ruahan yang diterima hendaklah ditangani seperti penerimaan bahan awal. Semua bahan dan produk jadi hendaklah disimpan pada kondisi seperti yang ditetapkan pabrik pembuat dan disimpan secara teratur untuk memudahkan segregasi antar bets dan rotasi stok. Pemeriksaan hasil nyata dan rekonsiliasi jumlah hendaklah dilakukan sedemikian untuk memastikan tidak ada penyimpangan dari batas yang telah ditetapkan.
Pengolahan produk yang berbeda tidak boleh dilakukan secara bersamaan atau bergantian dalam ruang kerja yang sama kecuali tidak ada risiko
11
Universitas Indonesia
terjadi kecampurbauran ataupun kontaminasi silang. Produk dan bahan hendaklah dilindungi terhadap pencemaran mikroba atau pencemaran lain pada tiap tahap pengolahan.
Semua prosedur produksi hendaknya di validasi dengan tepat, sesuai dengan prosedur yang telah ditentukan dan catatan hasilnya hendaknya didokumentasikan. Perubahan yang penting dalam proses, baik itu penggantian alat maupun penggantian asal bahan baku, hendaklah dilakukan validasi ulang. Hal ini untuk menjamin bahwa perubahan tersebut akan tetap menghasilkan produk yang memenuhi spesifikasi yang telah ditentukan.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian esensial dari Cara Pembuatan Obat yang Baik untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu sesuai dengan tujuan pemakaiannya. Keterlibatan dan komitmen semua pihak yang berkepentingan pada semua tahap merupakan keharusan untuk mencapai sasaran mutu mulai dari awal pembuatan sampai kepada distribusi produk jadi.
Pengawasan mutu mencakup pengambilan sampel, spesifikasi, pengujian serta termasuk pengaturan, dokumentasi dan prosedur pelulusan yang memastikan bahwa semua pengujian yang relevan telah dilakukan, dan bahan tidak diluluskan untuk dipakai atau produk diluluskan untuk dijual, sampai mutunya telah dibuktikan memenuhi persyaratan. Pengawasan mutu tidak terbatas pada kegiatan labolatorium, tapi juga harus terlibat dalam semua keputusan yang terkait dengan mutu produk.
2.2.8 Inspeksi Diri, Audit Mutu dan Audit & Persetujuan Pemasok
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB. Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri hendaklah dilakukan secara independen dan rinci oleh petugas yang
kompeten dari perusahaan yang dapat mengevaluasi penerapan CPOB secara obyektif.
Inspeksi diri hendaklah dilakukan secara rutin dan di samping itu, pada situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi penolakan yang berulang. Semua saran untuk tindakan perbaikan supaya dilaksanakan.
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkannya. Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau suatu tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
2.2.9 Penanganan Keluhan Terhadap Produk dan Penarikan Kembali Produk Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat harus dikaji dengan teliti sesuai dengan prosedur tertulis. Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga cacat dari peredaran secara cepat dan efektif.
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari peredaran. Tindakan penarikan kembali produk hendaklah dilakukan segera setelah diketahui ada produk yang cacat mutu atau diterima laporan mengenai reaksi yang merugikan. Pemakaian produk yang berisiko tinggi terhadap kesehatan, hendaklah dihentikan dengan cara embargo yang dilanjutkan dengan penarikan kembali dengan segera. Penarikan kembali hendaklah menjangkau hingga tingkat konsumen.
2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu. Dokumentasi yang jelas adalah fundamental untuk memastikan bahwa tiap personil menerima uraian tugas yang relevan secara jelas dan rinci sehingga
13
Universitas Indonesia
memperkecil resiko terjadi salah tafsir dan kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan. Spesifikasi, Dokumen Produksi Induk/Formula Pembuatan, prosedur, metode dan instruksi, laporan dan catatan harus bebas dari kekeliruan dan tersedia secara tertulis. Keterbacaan dokumen adalah sangat penting.
Spesifikasi menguraikan secara rinci persyaratan yang harus dipenuhi produk atau bahan yang digunakan atau diperoleh selama pembuatan. Dokumen ini merupakan dasar untuk mengevaluasi mutu.
Dokumentasi Produksi Induk, Prosedur Pengolahan Induk dan Prosedur Pengemasan Induk (Formula Pembuatan, Instruksi Pengolahan dan Instruksi Pengemasan) menyatakan seluruh bahan awal dan bahan pengemas yang digunakan serta menguraikan semua operasi pengolahan dan pengemasan. Prosedur berisi cara untuk melaksanakan operasi tertentu, misalnya pembersihan, berpakaian, pengendalian lingkungan, pengambilan sampel, pengujian, dan pengoperasian peralatan. Catatan menyajikan riwayat tiap bets produk, termasuk distribusinya dan semua keadaan yang relevan yang berpengaruh pada mutu produk akhir.
Dokumen hendaklah didesain, disiapkan, dikaji dan didistribusikan dengan cermat. Bagian dokumen pembuatan dan hendaklah sesuai dengan dokumen persetujuan izin edar yang relevan. Dokumen hendaklah dikaji ulang secara berkala dan dijaga agar selalu mutakhir. Bila suatu dokumen direvisi, hendaklah dijalankan suatu sistem untuk menghindarkan penggunaan dokumen yang sudah tidak berlaku secara tidak sengaja.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar, disetujui dan dikendalikan untuk menghindarkan kesalahpahaman yang dapat menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan. Kontrak tertulis antara Pemberi Kontrak dan Penerima Kontrak harus dibuat secara jelas yang menentukan tanggung jawab dan kewajiban masing-masing pihak.
Hendaklah dibuat kontrak tertulis yang meliputi pembuatan dan/atau analisis obat yang dikontrakkan dan semua pengaturan teknis terkait. Semua pegaturan untuk pembuatan dan analisis berdasarkan kontrak termasuk usul perubahan dalam pengaturan teknis atau pengaturan lain hendaklah sesuai dengan izin edar untuk produk bersangkutan. Dalam hal analsis berdasarkan kontrak, pelulusan akhir harus diberikan oleh kepala bagian Manajemen Mutu (Pemastian Mutu) Pemberi Kontrak.
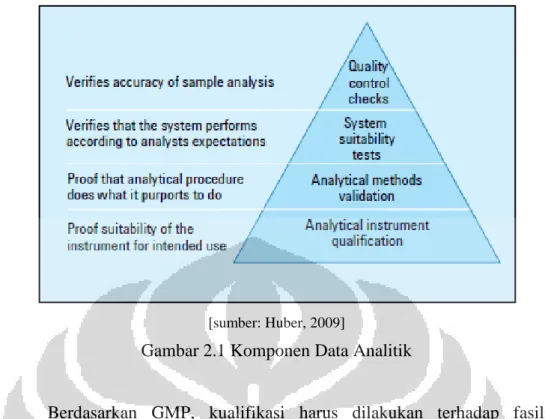
2.2.12 Kualifikasi dan Validasi
CPOB menguraikan prinsip kualifikasi dan validasi yan dilakukan di indusri farmasi. CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan. Perubahan signifikan teradap fasilitas, peralatan dan proses yang dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan kajian risiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan validasi.
Seluruh kegiatan validasi hendaklah direncanakan Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi atau dokumen setara.
Seluruh kegiatan validasi harus direncanakan terlebih dahulu. Unsur utama program validasi dirinci dengan jelas dan dikomentasikan dalam Rencana Induk Validasi (Validation Master Plan). Protokol validasi tertulis hendaklah merinci kualifikasi dan validasi yang akan dilakukan. Hendaklah dibuat laporan yang mengacu pada protocol kualifikasi/validasi yang memuat ringkasan hasil yang diperoleh, tanggapan terhadap penyimpangan yang terjadi, kesimpulan dan rekomendasi perbaikan. Setelah kualifikasi selesai dilakukan, maka diberikan persetujuan tertulis untuk dapat melakukan tahap kualifikasi dan validasi selanjutnya.
15 Universitas Indonesia
BAB 3
TINJAUAN KHUSUS
PT. ASTRAZENECA INDONESIA
3.1 Sejarah dan Perkembangan
AstraZeneca merupakan suatu perusahaan biofarmasetika yang memiliki kegiatan dengan tujuan meningkatkan derajat hidup seseorang. Bagi pasien dan dokter, AstraZeneca menyediakan obat untuk beberapa penyakit serius di dunia (AstraZeneca Global, 2012).
Terbentuknya AstraZeneca berawal dari berdirinya Astra AB dan Imperial Chemical Industries Ltd. (ICI). Astra AB merupakan sebuah perusahaan Swedia yang didirikan pada tahun 1913 di Soldertatje, Stockholm bagian selatan. Pada tahun 1987, dibentuk Divisi Astra Indonesia yang berada dibawah PT. Merck Indonesia.
ICI merupakan salah satu pabrik di Inggris yang didirikan pada tahun 1926. Bertahun-tahun kemudian, yaitu dibentuk PT. ICI Farmasi Indonesia pada tahun 1970 dan dua tahun setelahnya dibangun pabrik Pandaan di daerah Pandaan-Pasuruan, Jawa Timur.
Namun, pada tahun 1993 kegiatan bahan kimia ICI dari bisnis
biosciences (termasuk obat-obatan) memisahkan diri sehingga terbentuk Zeneca Pharma di Inggris. Setahun setelahnya, Zeneca Pharma memperluas jaringannya ke Indonesia sehingga terbentuk Zeneca Pharma Indonesia.
AstraZeneca sendiri dibentuk pada tanggal 6 April 1999 melalui penggabungan Astra AB dari Swedia dan Zeneca Group PLC dari Inggris - dua perusahaan yang memiliki budaya science-based yang serupa dan bersama-sama memiliki visi untuk industri farmasi. Penggabungan tersebut bertujuan untuk meningkatkan kemampuan perusahaan untuk memberikan pertumbuhan jangka panjang dan meningkatkan nilai pemegang saham.
Akibat penggabungan tersebut, Zeneca Pharma Indonesia berubah menjadi PT. AstraZeneca Indonesia. Pada tahun 2007, Pabrik Pandaan ditutup dan diputuskan untuk mendirikan pabrik baru di Cikarang, Bekasi.
Pabrik AstraZeneca Indonesia (AZI)-Cikarang Site berdiri pada tanggal 5 Oktober 2010 dan diresmikan oleh Menteri Kesehatan RI, Endang Rahayu Sedyaningsih. Pabrik ini mulai produktif sejak November 2010. Pabrik tersebut merupakan pabrik pengemasan tablet dengan target ekspor ke beberapa negara Asia dan Australia. Fasilitas yang dibangun di pabrik PT. AstraZeneca Indonesia bertujuan untuk mengakomodasi kegiatan pengemasan primer dan sekunder untuk mengemas sediaan solid oral (Fase I) dan fasilitas produksi (Fase II) yang masih dalam tahap pengembangan.
Pabrik PT. AstraZeneca Indonesia tidak memproduksi atau mengemas berbagai substansi obat yang toksik atau berbahaya atau produk obat seperti antibiotik beta laktam dan sefalosporin, hormon dan sitostatik. Pabrik ini juga tidak mengemas atau mengemas ulang (repack) obat hewan.
3.2 Visi dan Misi PT. AstraZeneca Indonesia
3.2.1 Visi PT. AstraZeneca Indonesia
Visi PT. AstraZeneca Indonesia adalah menjadi mitra terpercaya dan layak untuk profesional kesehatan, berkomitmen untuk meningkatkan kesehatan pasien dan menyediakan akses yang lebih luas untuk obat-obatan yang inovatif.
3.2.2 Misi PT. AstraZeneca Indonesia
Misi PT. AstraZeneca Indonesia yaitu sebagai perusahaan farmasi global yang memiliki tekad untuk membuat perbedaan berarti bagi kesehatan pasien melalui obat-obatan yang membawa manfaat bagi pasien
3.3 Struktur Organisasi PT. AstraZeneca Indonesia
PT. AstraZeneca Indonesia dipimpin oleh seorang Site Director yang membawahi 4 kepala departemen secara langsung, yaitu:
a. Plant Manager
b. QA and SHE Manager
c. Supply Chain Manager
d. Plant Accountant
Plant Manager secara langsung akan membawahi Engineering Asc Manager,Production Supervisor, Assc Purchasing Manager dan GA&P
17
Universitas Indonesia Supervisor. QA and SHE Manager akan membawahi QC Supervisor dan QA and SHE Supervisor. Sedangkan Supply Chain Manager akan membawahi Logistic Supervisor dan Supply Chain Supervisor. Bagan struktur organisasi PT. AstraZeneca Indonesia dapat dilihat pada Lampiran 1.
3.3.1 Departemen QA and SHE (Quality Assurance and Safety, Healthy, Environment)
PT. AstraZeneca Indonesia - Cikarang Site memiliki departemen QA and SHE yang bertanggungjawab terhadap aktivitas QA dan QC untuk memastikan bahwa produk sesuai dengan kebijakan marketing atau spesifikasi yang diinginkan, GMP dan syarat dari AstraZeneca internal. Adapun Departemen QA and SHE ini berada di bawah naungan Global Quality Operations. Wakil direktur dari Global Quality Operations membawahi, secara tidak langsung, kepala Departemen QA dari berbagai negara pelaksana Operations dan juga kepala departemen QA dalam bidang Pharmaceutical Development, R&D.
Fungsi QA dalam Operations yaitu bertanggung jawab untuk memastikan pelaksanaan kerja dan produksi produk dan penyediaan untuk komersial sesuai dengan persyaratan internal, regulatori dan standar.
3.3.1.1 QA and SHE Department
QA and SHE Department dipimpin oleh seorang apoteker dengan jabatan QA and SHE Manager yang memiliki tanggung jawab:
a. membuat desain sistem kualitas dan perencanaan untuk memenuhi kaidah GMP yang digunakan
b. melaksanakan dan memimpin dalam implementasi quality system sesuai yang direncanakan
c. menjaga sistem manajemen mutu (Quality Management System) selalu update untuk diaplikasikan dan menjaga Licence to Operate
d. menanamkan, mengimplementasikan, memonitor dan meninjau SHE
Management system sesuai standar AZ dan regulasi lokal untuk mencapai tujuan dan Global SHE objective
e. mengelola kontraktor atau pihak ketiga dalam mendukung kepentingan AZ untuk mencapai kualitas
f. bertanggung jawab terhadap GMP yang diperintahkan dan pelatihan SHE g. mengelola sistem dokumentasi
h. menetapkan peraturan, hak dan tanggung jawab dari Quality Unit
i. memastikan GMP diimpelementasikan dengan baik di area pabrik
j. memastikan seluruh perizinan dan pelatihan dilaksanakan pada tempatnya k. berpartisipasi aktif dalam Regional External Supply Network
QA and SHE Supervisor di PT. AstraZeneca Indonesia dijabat oleh seorang apoteker yang memiliki tanggung jawab:
a. bersama-sama dengan QA and SHE Manager menyiapkan dan menyediakan produk berkualitas tinggi, serta mengimplementasikan, memonitor dan memperbarui sistem manajemen mutu sesuai dengan standar PT. AstraZeneca Indonesia dan regulasi lokal
b. melaksanakan GMP dan pelatihan SHE sesuai yang direncanakan c. mengatur sistem dokumen di pabrik
d. meninjau ulang AstraZeneca Quality Manual secara berkala
e. memberikan izin untuk bekerja dan mengimplementasikan sistem keselamatan dalam bekerja
f. mendukung aktivitas kualifikasi
g. menyediakan protokol validasi dan laporan validasi
h. mengatur dan mengawasi prosedur change control, deviasi dan OOS i. mengelola keluhan, menginvestigasi, dan menanggapi keluhan j. menyediakan kualifikasi personil untuk pekerja
k. meninjau ulang batch record sebelum disetujui l. mengawasi Corrective and Preventive Action (CAPA) m. menyediakan dan melaksanakan program audit internal
n. menyediakan Validation Master Plan dan Validation Master Report
o. menyediakan review product bersamaan dengan QC supervisor
19
Universitas Indonesia
q. merelease material yang baru masuk dan finished product (tidak ditemukan deviasi/OOS)
r. menyediakan batch packaging record sesuai yang diminta
s. Assign Batch Number dan Expired Date dari finished product berdasarkan PON
t. menyediakan dan memperbarui Site Master File
u. mengatur distribusi SOP ke departemen yang terkait
v. menyediakan sertifikat analisis (Certificate of Analysis) dari finished product
w. mengatur dan mengevaluasi pelatihan secara efektif
3.3.1.2 Quality Control
Quality Control (QC) adalah subfungsi dari QA Operations dan bertanggung jawab terhadap pengujian kimia dan fisika serta mikrobiologi yang berhubungan dengan komponen pengemasan dan formulasi produk untuk memastikan sesuai dengan spesifikasi yang ditentukan. Di dalam Quality Control
terdapat fungsi analyst dan inspector, dimana kedua fungsi ini dikepalai oleh seorang QC supervisor.
Adapun beberapa tanggung jawab dari fungsi QC mencakup:
a. mengambil contoh (sampling), menganalisis dan mereleasekan pengemasan dan produk
b. membuat spesifikasi dari bahan awal, in-process material dan produk jadi c. menyimpan contoh pertinggal dari bahan awal dan produk jadi
d. menganalisis validasi metode
e. mengevaluasi data stabilitas dan data temperatur yang menyimpang dari produk selama pengiriman
f. melakukan pengujian mikrobiologi dari purified water dan steam systems. g. melakukan monitoring mikrobiologi di Area Bersih
h. menyimpan hasil uji laboratorium dan data di dalam sistem Manajemen Informasi Laboratorium (Laboratory Information Management System)
i. melakukan pengembangan dari sampling dan rencana inspeksi yang sesuai dengan prosedur dan spesifikasi
j. melakukan pengujian fisika/kimia/mikrobiologi terhadap produk dan material sesuai dengan prosedur dan spesifikasi
k. melakukan pengembangan, mengeluarkan dan menyetujui metode uji analisis dan spesifikasi
l. melakukan pengujian mikrobiologi untuk monitoring lingkungan dari fasilitas, media, peralatan dan personil
m. mengimplementasikan, memonitor dan memperbarui Quality and SHE Management System dalam cakupan laboratorium QC
3.3.2 Departemen Plant
Depatemen ini dikepalai oleh seorang Plant Manager yang memiliki tanggung jawab untuk mengembangkan dan menjaga kapasitas, pelaksanaan, produktivitas produksi mencapai produksi yang sesuai dengan permintaan secara efektif dan efisien; memastikan bahwa area produksi, peralatan dan fasilitas yang digunakan sesuai dengan GMP dengan peralatan dan mesin yang terkualifikasi dan secara rutin dikalibrasi; memelihara fasilitas produksi dan peralatan, bersih dan rapi dalam penyelenggaraan yang optimum untuk memastikan fasilitas layak digunakan untuk produksi; melakukan SHE di tempat untuk memastikan tanggung jawabnya terhadap pengurangan akan penggunaan energi, kecelakaan dan alarm; serta menjaga lisensi dan izin untuk beroperasi.
Plant manager membawahi beberapa bagian, yaitu Production,
Engineering (teknik), Purchasing (pembelian) dan General Affair & Personnel
(GA & P).
3.3.2.1 Produksi
Bagian produksi dikepalai oleh seorang supervisor (pengawas) yang merupakan seorang apoteker. Supervisor produksi mengepalai 2 orang operator dan 5 orang packer.
Proses produksi yang berlangsung di PT. AstraZeneca Indonesia - Cikarang Site saat ini mencakup pengemasan primer dan sekunder terhadap sediaan solid oral non-steril (tablet), yaitu Inderal (propranolol hidroklorida). Selain itu di bagian ini juga berlangsung proses pengemasan ulang (repacking)
21
Universitas Indonesia
produk yang diimpor dari beberapa negara ke dalam kemasan baru yang berbeda dari kemasan sebelumnya, dimana pada kemasan baru ini telah didesain sedemikian rupa sehingga memenuhi spesifikasi dan standar lokal pada negara yang dituju tempat nantinya produk tersebut akan dijual. Pada kemasan yang baru ini juga dicantumkan batch number, expired date dan pharmacode dari masing-masing produk.
Peran bagian produksi di PT. AstraZeneca Indonesia - Cikarang Site yaitu bertanggung jawab terhadap pengemasan produk farmasetikal; menyelesaikan produksi tepat waktu sesuai jadwal; bertanggung jawab mematuhi peraturan cGMP Global Quality Policy terkait pelaksanaan pengemasan; mengimplementasikan SHE dan DEPNAKER’s UKK (Industrial Hygiene and Safety) dalam area produksi; melakukan line clearance atau pembersihan lini; membantu QC dalam proses pengambilan sampel dalam rangka Performance Qualification, Validation Process dan apabila terjadi cacat (defect) pada penampilan tablet.
3.3.2.2 Teknik (Engineering)
Bagian Teknik (Engineering) dikepalai oleh seorang Engineering Asc Manager yang bertanggung jawab dalam mengatur semua kegiatan Teknik yang terkait dengan produk, serta memastikan penerapan GMP dalam setiap peralatan, bangunan dan fasilitas yang digunakan, termasuk pelaksanaan kalibrasi dan kualifikasi.
Engineering Asc Manager membawahi tiga personel, yaitu: a. Engineering Leader
Engineering Leader melakukan pengembangan kontrol, meninjau hasil dari perawatan mesin, kalibrasi dan status; membuat perencanaan mingguan untuk perawatan mesin; menjalankan fasilitas yang terdapat dalam pabrik (sistem BAS,
access control, sistem pengolahan air, sistem HVAC, dsb); menyelenggarakan CAPA yang berhubungan dengan analisis resiko, audit internal dan mendukung program kualifikasi.
b. Engineering Administrator
Bagian ini melakukan berbagai tugas administrasi dan dokumentasi di bagian Engineering, seperti memperbaharui status dari Work Orders, perawatan mesin dan kalibrasi; menyiapkan jadwal pelaksanaan perawatan mesin dan kalibrasi; menyiapkan acceptance sheet untuk kalibrasi dan label kalibrasi pada mesin.
c. Engineering Techincian
Posisi ini bertujuan untuk melakukan monitoring sistem BAS, tekanan, temperatur dan filter pada AHU; melakukan perawatan mesin sesuai jadwal; menjaga level klorin dalam domestic water pump; melakukan Job Orders sesuai jadwal dan melaksanakan kalibrasi sesuai permintaan.
3.3.2.3 Pembelian (Purchasing)
Bagian ini terdiri dari seorang Assc Purchasing Manager yang bertanggung jawab dalam pengadaan pembelian barang atau jasa dari user. Bagian ini di AstraZeneca Indonesia berperan penting mulai dari proses penawaran harga (quotation) hingga pembelian barang. Proses tersebut dilakukan secara PTP (Purchase to Pay). Vendor yang melakukan penawaran harga senantiasa dinilai terlebih dahulu mengenai risikonya terhadap produk yang dibuat (Risk Assesment Vendor) oleh QA. Purchasing juga menilai vendor tersebut dari segi bisnis, yaitu terkait kesesuaian harga dan kualitas dari produk yang ditawarkan vendor. Terkadang purchasing juga dapat melakukan perbandingan harga (bidding) dari beberapa vendor yang berbeda karena nilai yang dikeluarkan dianggap bermakna sehingga dapat terhindar dari conflict of interest.
3.3.2.4 General Affair & Personnel (GA&P)
GA&P di AstraZeneca Indonesia membawahi Manajemen kebersihan (Cleaning), hama (IPM), keamanan (Security) dan transportasi (Driver). Bagian ini juga berhubungan langsung dengan kantor pusat di Jakarta. GA&P dikepalai oleh seorang supervisor yang bertanggung jawab untuk mengontrol dan memonitor administrasi dan operasional umum, termasuk resepsionis, kebersihan, keamanan dan pelayanan di kantor sehingga sesuai dengan standar.
23
Universitas Indonesia GA&P Supervisor mengepalai GA officer yang berperan dalam melakukan perjanjian terhadap hal-hal yang berhubungan dengan tiket, akomodasi, logistik, vendor, pembayaran, perizinan, penyediaan makan (catering), serta mengurus faktur (invoice), inventaris dan barang non inventaris.
3.3.3 Departemen Supply Chain
Departemen ini dikepalai oleh seorang Supply Chain and Logistic Manager yang bertanggung jawab untuk memastikan penyediaan (supply) kepada pelanggan dengan persediaan yang minimum dan efisiensi yang optimum; memberikan dukungan kepada perusahaan agar tujuan komersialnya dapat tercapai; melakukan pengembangan dan menjaga kapasitas gudang, kinerja, produktivitas dan kinerja supply mencapai efisien dengan biaya optimal; serta memastikan area gudang, peralatan, fasilitas dan sistem memenuhi peraturan.
Supply Chain and Logistic Manager mengepalai bagian Supply Chain
dan Logistic.
3.3.3.1 Supply Chain
Bagian ini dikepalai oleh seorang supervisor yang memiliki tanggung jawab mengoptimalkan persediaan; menjaga penyaluran dengan kinerja yang optimal kepada pelanggan; memastikan kapasitas produksi baik dan memenuhi permintaan seperti yang direncanakan; mengidentifikasi sumber daya yang diperlukan secara optimal; mengkoordinasi dan follow-up Toll (kerjasama kontrak); mempersiapkan dan memeriksa pembayaran untuk vendor/kontraktor; bertanggung jawab mengimplementasikan AstraZeneca SHE dan DEPNAKER’s Upaya Kesehatan Kerja-UKK (Industrial Hygiene and Safety); serta memelihara dokumentasi pendukung yang diperlukan secara akurat sesuai standar GMP dan perusahaan dalam sistem Supply Chain.
3.3.3.2 Logistic
Bagian ini dikepalai oleh seorang supervisor yang mengepalai dua orang
warehouse operator. Peran Logistic supervisor antara lain bertanggung jawab atas keadaan bahan baku, kemasan, produk bulk dan penyimpanan produk jadi;
bertanggung jawab untuk mengadakan distribusi material ke produksi dan produk jadi ke distributor tepat waktu; melakukan koordinasi dengan bagian produksi, QC dan Purchasing; menganalisis dan mengusulkan perbaikan gudang; memelihara dokumen penyimpanan dan sistem pencarian supaya tetap menjamin pelaksanaan FEFO (first expired-first out); memelihara daerah yang sudah ditentukan sebagai tempat penyimpanan bahan awal, kemasan, produk bulk dan produk jadi; memastikan pengendalian internal yang baik untuk meminimalkan dampak kerugian finansial; bertanggung jawab mengimplementasikan AstraZeneca SHE dan DEPNAKER’s Upaya Kesehatan Kerja-UKK (Industrial Hygiene and Safety); serta menjaga lisensi dan izin yang berhubungan dengan gudang.
3.3.4 Plant Accountant
Bagian ini saat ini berperan dalam pengadaan kerja sama dengan area bisnis yang relevan untuk memastikan ketepatan waktu dalam pengiriman; memastikan laporan manajemen dan anggaran sesuai dengan pedoman dan kebutuhan manajemen; bekerjasama dengan plant management, bagian produksi, QA, GA&A untuk menyokong anggaran dan analisis laporan bulanan, mengelola kerjasama kontrak antara Indonesia dan UK; serta terlibat dalam kontrol pembangunan, proses, pelaporan manajemen yang sedang berlangsung, transaksi keuangan dan masalah pajak.
3.4 Lokasi dan Sarana
Pabrik ini berlokasi di Jababeka Phase III TechnoPark Jl. Tekno Raya Blok B1A- B1B Cikarang, Bekasi, Jawa Barat yang merupakan kawasan industri dan berdekatan dengan daerah pemukiman penduduk serta beberapa industri lainnya. Sedangkan kantor pusatnya berlokasi di Perkantoran Hijau Arkadia Tower F, 3rd F1, Jl TB Simatupang Kav 88 Jakarta, 12520.
25
Universitas Indonesia
3.5 Bangunan dan Fasilitas serta Sarana Penunjang
Pabrik AZI-Cikarang Site menerapkan principle of minimum distance, yaitu prinsip penempatan ruangan untuk proses yang berurutan didesain secara berdekatan sehingga efisiensi dalam proses produksi dapat tercapai. Bangunan dan fasilitas serta sarana penunjang yang ada didesain sedemikian rupa untuk dapat menjamin kualitas produk dan memenuhi spesifikasi CPOB.
Gambar 3.1. PT. AstraZeneca Indonesia - Cikarang Site
Konstruksi pabrik dibangun menggunakan tiang pondasi. Secara arsitektur, desain bangunan bagian luar mencerminkan kegiatan pembuatan produk jadi yang mendukung citra kegiatan sebagai industri farmasi yang bersih dan modern dan menempatkan perawatan sebagai prioritas.
Prioritas pertama adalah sesuai dengan aturan GMP dan kebersihan. Semua ruang memiliki standar kenyamanan kerja, seperti suhu yang sesuai dan pengaturan cahaya, khususnya pada siang hari.
4.1 Sistem Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen registrasi dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen bertanggung jawab untuk pencapaian tujuan ini melalui suatu kebijakan mutu yang merupakan partisipasi dan komitmen jajaran di semua departemen dalam perusahaan. PT. AstraZeneca Indonesia telah menerapkan aspek manajemen mutu ini sesuai dengan konsep yang sebenarnya sesuai CPOB.
PT. AstraZeneca Indonesia memiliki Departemen Pemastian Mutu yang bertanggung jawab terhadap kegiatan QA/QC untuk memastikan produk yang dihasilkan sesuai dengan kebijakan marketing/spesifikasi produk, GMP dan peraturan internal. Departemen Pemastian Mutu di PT. AstraZeneca Indonesia dipimpin oleh seorang Manajer QA & SHE, yang membawahi unit QA & SHE dan QC yang masing-masing independen terhadap bagian yang lain. Aktivitas unit pemastian mutu tersebut sudah mencakup basis CPOB ditambah dengan faktor lain diluar pedoman ini, seperti The Global Policy for Quality and Regulatory Compliance. Departemen Pemastian Mutu bertanggung jawab terhadap pengendalian mutu menyeluruh, yaitu pengendalian mutu terhadap produk yang dihasilkan termasuk didalamnya penilaian terhadap pemasok dan distributor.
4.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Personalia PT. AstraZeneca Indonesia telah memenuhi persyaratan CPOB yaitu personil yang terkualifikasi untuk melaksanakan tugas. Personalia PT. AstraZeneca Indonesia memiliki tingkat pendidikan yang sesuai dengan bidang pekerjaanya, pengetahuan dan keterampilan yang dibutuhkan, serta sehat fisik dan mental. Dalam menjalankan kegiatannya, PT. AstraZeneca Indonesia memiliki
27
Universitas Indonesia
struktur organisasi dan deskripsi tugas yang jelas dengan pembagian tanggung jawab yang sesuai dengan kapasitasnya.
Personil kunci PT. AstraZeneca Indonesia mencakup Kepala Bagian Produksi, Kepala Bagian Pengawasan Mutu dan kepala bagian Manajemen Mutu (Pemastian Mutu) yang masing-masing dijabat oleh seorang Apoteker yang terdaftar, terkualifikasi dan independen satu terhadap yang lain. Personil kunci tersebut memiliki wewenang penuh dan sarana memadai untuk melaksanakan tugasnya secara efektif dan tidak mempunyai kepentingan lain diluar organisasi yang dapat menghambat atau membatasi kewajibannya.
Setiap karyawan baru yang akan memulai pekerjaannya di PT. AstraZeneca Indonesia wajib mengikuti training, yaitu dapat berupa Induction Training yang terdiri dari GMP Training dan SHE Induction Training serta On The Job Training. Training ini dilaksanakan dengan beberapa cara, yaitu training
oleh trainee yang kompeten dan self study. Hal ini juga berlaku bagi mahasiswa PKPA (Praktek Kerja Profesi Apoteker) agar segala kegiatan yang dilakukan sesuai dengan basis GMP. Pelatihan ini tidak hanya dilakukan oleh karyawan baru saja, tetapi karyawan lain juga akan mengikuti pelatihan sesuai dengan tugasnya ataupun pelatihan yang berbasis GMP. Pelatihan tersebut dilakukan secara berkesinambungan dengan frekuensi yang cukup untuk menjamin agar personalia tidak melakukan penyimpangan terhadap basis GMP terkait dengan tugasnya. Setiap pelatihan yang dilakukan akan didokumentasikan pada sebuah catatan yang kemudian akan disimpan. Setelah dilakukan pelatiha, maka dilakukan penilaian yang akan menggambarkan apakah personalia tersebut memiliki kualifikasi yang memadai untuk melaksanakan tugas yang diberikan kepadanya.
4.3 Bangunan dan Fasilitas
Berdasarkan CPOB 2012, bangunan dan fasilitas untuk pembuatan obat harus memiliki desain, konstruksi dan letak yang memadai serta disesuaikan kondisinya dan dirawat dengan baik untuk memudahkan pelaksanaan operasi yang benar. Tata letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil risiko terjadi kekeliruan, pencemaran silang dan kesalahan lain, serta
memudahkan pembersihan, sanitasi dan perawatan yang efektif untuk menghindarkan pencemaran silang, penumpukan debu atau kotoran, dan dampak lain yang dapat menurunkan mutu obat.
Letak bangunan PT. AstraZeneca Indonesia berada pada lokasi yang cukup strategis untuk kawasan industri karena posisi bangunan ini sedemikian rupa untuk menghindari pencemaran dari lingkungan seperti pencemaran dari udara, tanah dan air. Bangunan dan fasilitas di PT. AstraZeneca Indonesia didesain, dikonstruksi, dilengkapi, dan dirawat sedemikian rupa sehingga memperoleh perlindungan maksimal terhadap cuaca, banjir, rembesan air tanah, dll. Setiap bangunan dan fasilitas di PT. AstraZeneca Indonesia dirawat secara berkala sehingga berada dalam kondisi bersih dan rapi untuk mempermudah pelaksanaan operasi yang benar sesuai dengan CPOB.
PT. AstraZeneca Indonesia memiliki sarana penunjang seperti kantin, ruang ganti pakaian dan kelengkapannya. Pada bangunan dan fasilitas dilakukan pengaturan tenaga listrik, lampu penerangan, suhu, kelembaban dan ventilasi agar tidak mengakibatkan dampak yang merugikan baik secara langsung maupun tidak langsung terhadap produk. Suhu, kelembaban, kondisi udara, dan tekanan pada setiap ruangan dan fasilitas di ruang produksi diatur oleh sistem AHU (Air handling Unit) sehingga memenuhi persyaratan sesuai dengan yang diinginkan.
Ruangan produksi di PT. AstraZeneca Indonesia dikelompokkan menjadi beberapa ruangan yang aktif, dimana setiap satu ruangan diperuntukkan untuk satu kegiatan produksi, seperti ruangan dispensing, bulk staging, washing room, serta ruang pengemasan primer dan sekunder. Selain itu terdapat pula ruangan non aktif di produksi yang belum berfungsi, seperti ruangan granulating, milling, tablet press, spare room, cleaned equipment storage, intermediate product storage dan in process control room. Ruang pengemasan primer, ruang
dispensing, bulk staging dan washing room serta ruang produksi inaktif berada pada area kelas E, sedangkan ruang pengemasan sekunder berada di area kelas F.
Permukaan dinding, lantai dan langit-langit bagian dalam ruangan produksi dilapisi oleh epoksi yang bersifat kedap air, licin dan tahan goresan logam sehingga mudah dibersihkan dan untuk mencegah terjadinya perembesan air. Konstruksi lantai di area produksi juga dibuat dari bahan kedap air,
29
Universitas Indonesia
permukaannya rata dan memungkinkan pembersihan yang cepat dan efisien apabila terjadi tumpahan bahan. Tiap sudut ruangan produksi dibuat melengkung sehingga mudah untuk pembersihan, sanitasi dan perawatan. Celah antara rangka jendela dengan kaca celah pada pemasangan lampu serta pipa didesain sedemikian rupa atau menggunakan sealant untuk mengurangi kontaminasi. Pintu di dalam area produksi yang berfungsi sebagai barier terhadap pencemaran silang selalu ditutup apabila sedang tidak digunakan. Langit-langit di area produksi dibangun dengan menggunakan panel sandwich yang mendukung berat tambahan untuk memungkinkan akses personil sehingga dapat berjalan di atasnya untuk GMP dan tujuan pemeliharaan.
Bangunan produksi dibuat bersebelahan dengan gudang menggunakan akses pintu yang berbeda. Antara gudang dan area produksi terdapat ruang untuk transfer material dari gudang ke produksi atau sebaliknya. Hal ini bertujuan untuk menghindari penyebaran debu dari gudang ke area produksi atau sebaliknya. Ruang antara untuk transfer material dari ruang primary packing dan secondary packing dipisahkan untuk mencegah terjadinya kontaminasi silang antara produk dan material. Pada ruang produksi terdapat gowning area yang bersifat airlock
untuk meminimalkan kontaminasi silang oleh personil.
Berdasarkan suhu penyimpanannya, gudang terbagi menjadi dua ruangan , yaitu cool warehouse dan ambient warehouse. Cool warehouse digunakan untuk menyimpan produk ruahan dan produk jadi, dimana area ini merupakan area penyimpanan yang dikondisikan suhu (≤25oC) dan kelembabannya dengan kondisi penyimpanan produk. Ambient warehouse digunakan untuk menyimpan bahan pengemas (botol, tutup, boks, karton) dan label, dimana pada area ini tidak memerlukan pengaturan suhu. Pada kenyataannya saat ini, ambient warehouse di PT. AstraZeneca Indonesia belum digunakan sesuai fungsinya. Bahan pengemas dan label ditempatkan di area cool warehouse. Hal ini dilakukan karena cool warehouse mempunyai area yang cukup luas dan mampu menampung bahan pengemas dan label sehingga dapat memudahlan dalam pengangkutan ke area pengemasan. Selain itu, adanya bahan pengemas dan label di area cool warehouse
disimpan di cool warehouse ataupun kualitas bahan pengemas dan label itu sendiri.
Sampling room, rejected area dan hazardous waste room terdapat disebelah ambient warehouse. Keseluruhan area tersebut dan gudang merupakan kelas G, kecuali sampling room yang merupakan area kelas E. sampling room
digunakan untuk mengamati kondisi visual botol dan tutup yang digunakan dalam pengemasan primer. Ruangan ini juga digunakan untuk mengambil contoh botol dan tutup tersebut, yang selanjutnya akan dibawa ke laboratorium bahan pengemas untuk dianalisa. Rejected area digunakan untuk menyimpan barang-barang hasil reject oleh personil QA. Sedangkan hazardous waste room
digunakan untuk menyimpan limbah-limbah berbahaya (limbah B3). Limbah yang berasal dari rejected area akan dikelompokkan terlebih dahulu menjadi limbah domestic dan limbah B3. Limbah B3 dari rejected area dan yang berasal dari hazardous waste room akan dikelola oleh pihak ketiga, yaitu PPLI (Pusat Pengolahan Limbah Industri), sedangkan untuk limbah domestic akan dikelola oleh Jababeka Infrastructure.
Laboratorium pengawasan mutu terdiri dari laboratorium bahan pengemas, laboratorium preparasi, laboratorium mikrobiologi, serta laboratorium kimia dan fisika. Laboratorium ini termasuk ke dalam kelas G, kecuali laboratorium mikrobiologi yang merupakan area kelas E. laboratorium pengawasan mutu terpisah dari area produksi dan dibuat area tersendiri untuk laboratorium mikrobiologi. Di dalam laboratorium mikrobiologi terdapat gowning area untuk berganti pakaian.
Sarana pendukung yang terdapat di PT. AstraZeneca Indonesia yaitu kantin, ruang untuk mengganti pakaian kerja, toilet, office, dan ruangan lainnya yang terpisah dari area produksi. Ruang untuk mengganti pakaian kerja, membersihkan diri dan toilet tersedia dengan jumlah yang cukup dengan personil dan mudah diakses. Ruang ganti pakaian berhubungan dengan area produksi namun letaknya terpisah.
31
Universitas Indonesia
4.4 Peralatan
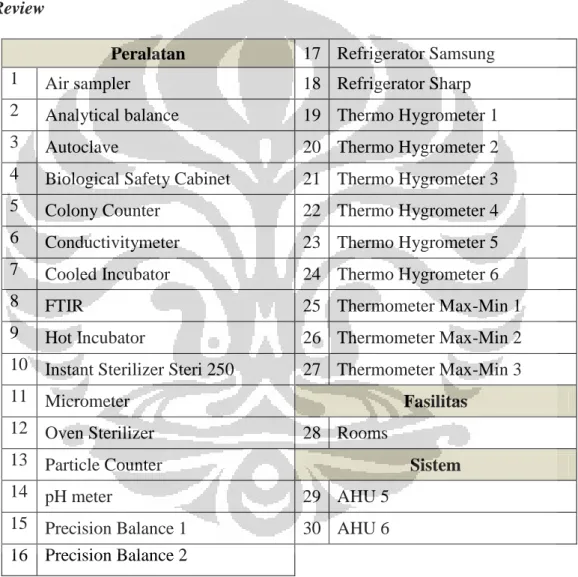
Sesuai dengan CPOB 2012, seluruh peralatan yang tersedia untuk proses manufaktur dan berpengaruh terhadap kualitas produk dikualifikasi sebelum penggunaannya. Melalui proses kualifikasi, setiap peralatan tersebut dipastikan dapat menjamin dihasilkannya produk obat dengan mutu yang terjamin sesuai desain, baik melalui desain dan konstruksinya yang tepat, ukuran nya yang memadai, fungsi yang berjalan baik, instalasi yang tepat, kinerja yang baik, maupun pembersihan dan perawatan yang menjamin kesesuaian alat dan tidak terjadinya kontaminasi terhadap produk. Proses kualifikasi ini dilakukan berdasarkan validation master plan dan dikaji ulang secara periodik setiap 3 tahun untuk mengkonfirmasi bahwa status tersebut masih valid.
Kalibrasi dilakukan pada peralatan untuk mengukur, menimbang, mencatat dan mengendalikan. Kalibrasi ini dilakukan berdasarkan jadwal dan SOP spesifik. Setiap peralatan diberi label yang menunjukkan status kalibrasi. Sebelum penggunaannya, peralatan harus dipastikan status kalibrasinya berdasarkan label tersebut. Perawatan dilakukan pada peralatan sesuai jadwal untuk mencegah malfungsi atau pencemaran yang dapat memengaruhi identitas, mutu atau kemurnian produk. Perawatan setiap peralatan dilakukan dengan merujuk pada setiap buku petunjuk. Peralatan tersebut mengenai kegiatan pemantauan rutin yang disarankan pembuat alat berdasarkan interval waktunya. Jadwal perawatan disesuaikan juga dengan rekomendasi manual book dan informasi pendukung lainnya kemudian disusun ke dalam form Maintenance Master Schedule, Equipment Calibration Master Schedule, Test Equipment Master Schedule. Jadwal preventive maintenance setiap bulan didistribusikan ke departemen yang berkaitan minimal 1 minggu sebelumnya jadwal bulanan yang berjalan berakhir. Pelaksanaan preventive maintenance dapat dilakukan secara internal maupun dengan bantuan pihak ketiga untuk mesin yang dalam pemeliharaanya membutuhkan keahlian khusus dengan mengacu pada contact service yang disetujui. Pelaksanaan preventive maintenance ini memperhatikan aspek keamanan, kesehatan dan lingkungan (alat-alat pengaman, lock out dan tag out yang memadai dan sebagainya), aspek GMP (kebersihan, pakaian kerja dan sebagainya) serta suku cadang yang diperlukan (sebelum pelaksanaan). Seluruh