INTISARI
Kanker payudara merupakan salah satu jenis kanker dengan tingkat prevalensi yang cukup tinggi di Indonesia setelah kanker leher rahim. Selama ini penatalaksanaan kanker payudara dilakukan dengan serangkaian pengobatan meliputi pembedahan, kemoterapi, radiasi, hormonal dan terapi imunologik. Terdapat beberapa kelemahan dari pengobatan tersebut antara lain menimbulkan rasa mual dan muntah, pendarahan serta dapat meningkatkan resiko kanker endometrium (pada wanita menopause). Oleh karena itu, penting untuk dilakukan penemuan obat antikanker yang selektif.
Penelitian ini mengeksplorasi efek antikanker ekstrak etanol daun lavender (Lavandula officinalis Chaix.) terhadap sel kanker payudara T47D. Model sel kanker payudara yang digunakan adalah sel T47D yang mampu mengekspresikan reseptor estrogen alfa (ERα). Uji sitotoksisitas dianalisis menggunakan metode 3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide (MTT), dilanjutkan dengan uji induksi apoptosis dengan metode Annexin V Fluos. Mekanisme molekuler terhadap ERα dianalisis secara semi-kuantitatif menggunakan metode imunositokimia.
Ekstrak etanol daun lavender (L. officinalis Chaix) menunjukkan efek sitotosik pada nilai IC50 232 µg/mL yang dihitung secara statistik menggunakan program R serta mampu menginduksi sel kanker payudara T47D melalui mekanisme apoptosis dengan menekan ekspresi protein ERα.
ABSTRACT
Breast cancer is the second highest incidence after cervical cancer in Indonesia. Management of breast cancer is conducted by a series of treatment include surgery, chemotherapy, radiation, hormonal, and immunological therapy. But, there are several side effects caused by the treatment, for example, nausea and vomiting, bleeding, and may increase the risk of endometrial cancer (for menopausal woman). Furthermore, it is important to discover a selective anticancer drug.
This study explored the effect of ethanol extract of Lavandula officinalis
Chaix leaves against T47D breast cancer cell line. Breast cancer cell model used T47D, an overexpressing estrogen receptor alpha (ERα). Cytotoxicity assay were analyzed using 3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide
(MTT) then induction of apoptosis using Annexin V Fluos method. Molecular mechanism on ERα was analyzed using a semi-quantitative methode, immunocytochemistry.
Ethanol extract of Lavandula officinalis Chaix leaves showed cytotoxic effect with IC50 value 232 µg/mL which calculated using statistical R program and was able to induce T47D breast cancer cells through mechanism of apoptosis by inhibition the expression of ERα.
Keyword: Ethanolic extract, Lavandula officinalis Chaix, breast cancer, T47D.
EFEK ANTIKANKER EKSTRAK ETANOLIK DAUN LAVENDER
(Lavandula officinalis Chaix) TERHADAP SEL KANKER PAYUDARA
T47D MELALUI PENEKANAN EKSPRESI RESEPTOR ESTROGEN-α
Skripsi
!Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Disusun Oleh :
Winda Sekarjati
NIM : 118114126
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
i
EFEK ANTIKANKER EKSTRAK ETANOLIK DAUN LAVENDER
(Lavandula officinalis Chaix) TERHADAP SEL KANKER PAYUDARA
T47D MELALUI PENEKANAN EKSPRESI RESEPTOR ESTROGEN-α
Skripsi
!Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Disusun Oleh :
Winda Sekarjati
NIM : 118114126
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
2014
iv
HALAMAN PERSEMBAHAN
“Sebab Aku ini mengetahui rancangan – rancangan apa yang ada pada-Ku mengenai
kamu demikianlah firman TUHAN, yaitu rancangan damai sejahtera dan bukan rancangan kecelakaan, untuk memberi kepdamu hari depan yang pebuh harapan.”
(Yeremia 29:11)
“Diberkatilah orang yang mengandalkan TUHAN, yang menaruh harapannya pada TUHAN”
(Yeremia 17:7)
!
vii PRAKATA
Puji syukur kepada Tuhan Yesus Kristus atas kasih dan berkat-Nya yang
begitu melimpah, sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Efek Antikanker Ekstrak Etanolik Daun Lavender (Lavandula Officinalis Chaix)
terhadap Sel Kanker Payudara T47D melalui Penekanan Ekspresi Reseptor
Estrogen-α” dengan baik. Skripsi ini disusun untuk memenuhi salah satu
persyaratan untuk memperoleh gelar Sarjana Farmasi (S.Farm.) program studi
Farmasi Universitas Sanata Dharma Yogyakarta.
Penulis menyadari bahwa dalam pelaksanaan dan penyusunan skripsi ini
tidak lepas dari bantuan dan campur tangan dari berbagai pihak. Oleh karena itu,
pada kesempatan yang indah ini penulis hendak mengucapkan terima kasih
kepada:
1. Ibu Aris Widayati, M.Si., Ph.D., Apt. selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma
2. Ibu Agustina Setiawati, M.Sc., Apt. selaku dosen pembimbing dan dosen
penguji skripsi ini serta selaku Kepala Laboratorium Fakultas Farmasi,
atas segala bimbingan, bantuan, dukungan, kesabaran, dan motivasi
selama penyusunan skripsi tidak lupa atas segala izin yang telah diberikan
untuk dapat menggunakan semua fasilitas laboratorium untuk kepentingan
skripsi ini.
3. Bapak Enade Perdana Istyastono, Ph.D., Apt. selaku dosen penguji skripsi
dan telah memberikan saran kepada penulis.
viii
4. Ibu Damiana Sapta Candrasari, S.Si., M.Sc. selaku Dosen penguji skripsi
dan telah memberikan saran kepada penulis.
5. Seluruh Dosen dan Karyawan Fakultas Farmasi Universitas Sanata
Dharma atas ilmu , arahan, dan bimbingan yang telah dibagikan.
6. Ibu Rumbi dan Ibu Juju selaku teknisi Laboratorium Parasitologi, Fakultas
Kedokteran Umum UGM atas bimbingan dan bantuan selama melakukan
berbagai perlakuan sel kanker di laboratorium tersebut.
7. Keluarga tercinta, Bapak Sudarto, Ibu Tatik Retnowulan, Pandu
Yogaswara dan Datia Kurnia Witri atas segala doa yang tak henti
diucapkan, dukungan, semangat, dan bantuan agar penulis dapat
menyelesaikan studi dengan tepat waktu dan menjadi kebanggan keluarga.
8. Teman- teman tim skripsi “Pasti Sukses!” : Clara Dewi Anggraeni dan
Andung Panjalu Vidityo yang telah memberikan bantuan, semangat dan
tekad untuk dapat mengenakan toga bersama di hari wisuda nanti.
9. Sahabat-sahabat tercinta Vincentius Henry, Albertus Juannino, Theresia
Dian, Skolastika Ferranda, dan Gregoria Novalia atas segala dukungan dan
semangat yang telah diberikan.
10.Teman-teman FST B 2011, FSM C 2011, dan seluruh teman- teman
Fakultas Farmasi Universitas Sanata Dharma Yogyakarta angkatan 2011
atas kebersamaannya.
11.Rekan-rekan kerja part time di PT. Aseli Dagadu Djokdja terkhusus
ix
serta dukungan, doa dan motivasi untuk setiap anggotanya agar dapat
menyelesaikan studi dengan tepat waktu.
12. Teman-teman Pemuda GKJ Brayat Kinasih Yogyakarta atas motivasi
yang selalu diberikan.
13.Sahabat tercinta Thorifah Zatu Sabila dan Karisa Indraswari atas
persahabatan yang telah terjalin sejak duduk di bangku Taman Kanak-
kanak hingga saat ini.
14.Semua pihak yang tidak dapat disebutkan satu per satu oleh penulis yang
telah membantu selama proses penyusunan skripsi ini berlangsung.
Penulis menyadari masih banyak kekurangan dalam penyusunan skripsi
ini, sehingga membutuhkan saran dan kritik yang membangun untuk perubahan
yang lebih baik. Semoga skripsi ini dapat bermanfaat bagi pembaca.
Yogyakarta, 23 Februari 2015
x DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
xi
BAB II. PENELAAHAN PUSTAKA ... 6
A. Lavender (Lavandula officinalis Chaix) ... 6
1. Taksonomi ... 6
E. Uji Sitotoksik dengan Metode MTT ... 14
F. Uji Apoptosis menggunakan Annexin V Fluos ... 15
G. Uji Ekspresi Sel dengan Metode Imunositokimia ... 16
H. Landasan Teori ... 17
I. Hipotesis ... 18
BAB III. METODE PENELITIAN... 19
A. Jenis dan Rancangan Penelitian ... 19
B. Variabel dan Definisi Operasional ... 19
1. Variabel Penelitian ... 19
2. Definisi Operasional ... 20
C. Bahan Penelitian ... 21
D. Alat Penelitian ... 22
E. Tata Cara Penelitian ... 22
xii
2. Determinasi Tanaman ... 22
3. Sortasi Basah ... 22
4. Pencucian ... 23
5. Pembuatan serbuk daun lavender kering ... 23
6. Pembuatan ekstrak etanol daun L. officinalis Chaix ... 23
7. Pembuatan larutan uji ... 23
8. Uji sitotoksik ekstrak etanol daun L. officinalis Chaix... 24
9. Uji apoptosis Annexin V Fluos... 26
10.Imunositokimia ... 38
BAB IV HASIL DAN PEMBAHASAN ... 31
A. Penyiapan ekstrak ... 31
B. Uji sitotoksik ekstrak dengan metode MTT ... 32
C. Uji apoptosis ekstrak dengan metode Annexin V Fluos ... 38
D. Uji ekspresi ERα menggunakan metode imunositokimia ... 41
BAB V KESIMPULAN DAN SARAN ... 47
A. Kesimpulan ... 47
B. Saran ... 47
DAFTAR PUSTAKA ... 48
LAMPIRAN ... 53
xiii DAFTAR TABEL
Halaman
Tabel I Viabilitas sel T47D dengan perlakuan ekstrak ... 35
Tabel II Viabilitas sel T47D dengan perlakuan tamoxifen ... 36
Tabel III Persentase sel T47D pada uji Annexin V Fluos ... 39
Tabel IV Perhitungan ekspresi ERα pada kontrol sel ... 43
Tabel V Perhitungan ekspresi ERα ekstrak ... 44
!
! !
xiv
DAFTAR GAMBAR
. Halaman
Gambar 1. Lavandula officinalis Chaix... 7
Gambar 2. Struktur senyawa dalam lavender... 8
Gambar 3. Anatomi kelenjar payudara manusia... 9
Gambar 4. Jalur signaling ERα... 11
Gambar 5. Sel T47D... 12
Gambar 6. Anatomi sel nekrosis dan apoptosis... 13
Gambar 7. Struktur MTT... 15
Gambar 8. Bentuk kristal formazanpada metode MTT... 33
Gambar 9. Morfologi sel T47D... 37
Gambar 10. Hasil pembacaan flowcytometer ... 39
Gambar 11. Morfologi ekspresi sel T47D pada uji imunositokimia ... 42
!
!
!
!
!
xv
DAFTAR LAMPIRAN
. Halaman
Lampiran 1. Surat keterangan hasil determinasi daun lavender ... 54
Lampiran 2. Perhitungan seri kadar ekstrak dan tamoxifen ... 55
Lampiran 3. Viabilitas sel T47D dengan pemberian ekstrak ... 56
Lampiran 4. Viabilitas sel T47D dengan pemberian tamoxifen ... 57
Lampiran 5. Analisis IC50 ekstrak menggunakan program R ... 58
Lampiran 6. Analisis IC50 tamoxifen menggunakan program R ... 59
xvi INTISARI
Kanker payudara merupakan salah satu jenis kanker dengan tingkat prevalensi yang cukup tinggi di Indonesia setelah kanker leher rahim. Selama ini penatalaksanaan kanker payudara dilakukan dengan serangkaian pengobatan meliputi pembedahan, kemoterapi, radiasi, hormonal dan terapi imunologik. Terdapat beberapa kelemahan dari pengobatan tersebut antara lain menimbulkan rasa mual dan muntah, pendarahan serta dapat meningkatkan resiko kanker endometrium (pada wanita menopause). Oleh karena itu, penting untuk dilakukan penemuan obat antikanker yang selektif.
Penelitian ini mengeksplorasi efek antikanker ekstrak etanol daun lavender
(Lavandula officinalis Chaix.) terhadap sel kanker payudara T47D. Model sel
kanker payudara yang digunakan adalah sel T47D yang mampu mengekspresikan reseptor estrogen alfa (ERα). Uji sitotoksisitas dianalisis menggunakan metode
3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide (MTT), dilanjutkan
dengan uji induksi apoptosis dengan metode Annexin V Fluos. Mekanisme molekuler terhadap ERα dianalisis secara semi-kuantitatif menggunakan metode imunositokimia.
Ekstrak etanol daun lavender (L. officinalis Chaix) menunjukkan efek sitotosik pada nilai IC50 232 µg/mL yang dihitung secara statistik menggunakan
program R serta mampu menginduksi sel kanker payudara T47D melalui mekanisme apoptosis dengan menekan ekspresi protein ERα.
xvii ABSTRACT
Breast cancer is the second highest incidence after cervical cancer in Indonesia. Management of breast cancer is conducted by a series of treatment include surgery, chemotherapy, radiation, hormonal, and immunological therapy. But, there are several side effects caused by the treatment, for example, nausea and vomiting, bleeding, and may increase the risk of endometrial cancer (for menopausal woman). Furthermore, it is important to discover a selective anticancer drug.
This study explored the effect of ethanol extract of Lavandula officinalis
Chaix leaves against T47D breast cancer cell line. Breast cancer cell model used T47D, an overexpressing estrogen receptor alpha (ERα). Cytotoxicity assay were analyzed using 3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide
(MTT) then induction of apoptosis using Annexin V Fluos method. Molecular mechanism on ERα was analyzed using a semi-quantitative methode, immunocytochemistry.
Ethanol extract of Lavandula officinalis Chaix leaves showed cytotoxic effect with IC50 value 232 µg/mL which calculated using statistical R program and
was able to induce T47D breast cancer cells through mechanism of apoptosis by inhibition the expression of ERα.
1 BAB I
PENDAHULUAN
A. Latar Belakang
Kanker merupakan salah satu penyakit tidak menular yang menjadi
masalah kesehatan utama baik di dunia maupun di Indonesia. Menurut data WHO
tahun 2013, angka kejadian kanker meningkat dari 12,7 juta kasus pada tahun
2008 menjadi 14,1 juta kasus pada tahun 2012. Di Indonesia, prevalensi penyakit
kanker juga cukup tinggi, berdasarkan data Riset Kesehatan Dasar (RISKESDAS)
tahun 2013, prevalensi kanker di Indonesia adalah 1,4 per 1000 penduduk atau
sekitar 330.000 orang. Jenis kanker yang menduduki posisi dengan angka
kejadian tertinggi pada wanita adalah kanker leher rahim (serviks) dan kanker
payudara. Menurut estimasi Globocan, International Agency for Reasearch on
Cancer (IARC) tahun 2012, angka kejadian kanker payudara sebesar 40 per
100.000 wanita, sedangkan kanker leher rahim sebesar 17 per 100.000 wanita
(Kementrian Kesehatan Republik Indonesia, 2014). Berdasarkan data di atas,
maka penelitian terkait kanker payudara sangat menarik untuk dikembangkan.
Kanker payudara sendiri memiliki berbagai macam sub tipe secara
molekuler, Karolina dkk. (2010) menggolongkan menjadi empat macam yaitu:
luminal (luminal A dan luminal B), HER2, basal-like, dan normal breast.
Mengacu pada penelitian yang telah dilakukan oleh Pilar dkk. (2010), kanker
payudara luminal A merupakan sub tipe yang paling umum terjadi, yaitu sekitar
!
2
dari kanker payudara luminal A adalah adanya ekspresi gen yang diaktifkan oleh
faktor transkripsi estrogen. Over ekspresi produksi reseptor akibat stimulasi
estrogen dapat mengakibatkan proliferasi sel yang tidak terkontrol. Salah satu
jenis reseptor yang bertanggung jawab atas kejadian kanker payudara adalah
reseptor estrogen alfa (ERα). Informasi terkait regulasi ekspresi reseptor ERα
memberikan kontribusi positif terhadap penelitian mengenai kanker payudara
(Hayashi, dkk., 2003).
Mekanisme terjadinya kanker payudara yang cukup kompleks juga
berpengaruh pada berbagai macam pengobatan yang diberikan bagi para penderita
kanker payudara, beberapa diantaranya melalui operasi pengangkatan payudara,
terapi radiasi, dan terapi hormonal (National Cancer Institute, 2013). Tidak sedikit
pula efek samping yang ditimbulkan dari berbagai jalur pengobatan tersebut,
kelemahan dari pengobatan kanker payudara adalah munculnya efek samping
yang secara umum dapat berupa mual dan muntah, timbulnya rasa nyeri dan sakit,
pendarahan, dan lain sebagainya. Berdasarkan keterangan diatas, maka perlu
adanya penelitian untuk menemukan suatu senyawa yang memiliki target aksi
lebih spesifik pada sel kanker payudara sehingga tidak menimbulkan berbagai
efek samping.
Daun Lavandula officinalis Chaix (Sinonim Lavandula angustifolia
Mill.; Lavandula vera DC) dipilih karena mengandung berbagai komponen
senyawa kimia, antara lain adalah linalil asetat, linalol, kampor, limone, dan lain
sebagainya, namun yang terbesar diantara semua adalah kandungan monoterpen
!
(2001) melaporkan bahwa salah satu hasil metabolit monoterpen memiliki
aktivitas dalam melawan sel kanker payudara pada uji klinik fase I yang pernah
dilakukan. Berdasarkan penelitian diatas, maka dapat disimpulkan bahwa ekstrak
daun L.officinalis Chaix potensial untuk dikembangkan sebagai agen
kemopreventif pada kanker payudara.
Penelitian ini didesain untuk eksplorasi aktivitas antikanker dan
kemampuan ekstrak etanol daun L.officinalis Chaix dalam menginduksi apoptosis
sel kanker payudara T47D. Mekanisme molekuler antikanker dianalisis melalui
!
4
1. Rumusan Masalah
Apakah ekstrak etanol daun lavender mempunyai kemampuan sitotoksik,
induksi apoptosis, dan menekan ekspresi ERα terhadap sel kanker payudara T47D
serta berapa nilai IC50 ekstrak tersebut?
2. Keaslian Penelitian
Penelitian dengan menggunakan ekstrak etanol Lavandula officinalis
Chaix yang pernah dilakukan adalah Neuroprotective effect of pretreatment with
Lavandula officinalis ethanolic extract on blood-brain barrier permeability in a
rat stroke model (Rabiei dan Rafieian, 2014), dalam penelitian tersebut ekstrak
etanol digunakan untuk pengobatan stroke. Terdapat pula penelitian lain
menggunakan ekstrak lavender sebagai anti-mikroba yang dikombinasikan
dengan minyak aroma terapi lain, judul penelitian tersebut adalah The In Vitro
Antimicrobial Activity of Lavandula angustifolia Essential Oil in Combination
with Other Aroma Therapeutic Oils (Rapper, dkk.,2013).
Sejauh studi pustaka yang dilakukan oleh peneliti, penelitian tentang uji
efektifitas antikanker ekstrak etanol daun lavender (Lavandula officinalis Chaix)
dengan metode MTT dan imunositokimia pada sel kanker payudara T47D belum
pernah dilakukan.
3. Manfaat Penelitian
a. Manfaat Teoretis.
Penelitian ini dapat bermanfaat bagi pengembangan ilmu pengetahuan
!
lavender (Lavandula officinalis Chaix) sehingga dapat pula menjadi sumber acuan
yang dapat digunakan untuk penelitian selanjutnya.
b. Manfaat Praktis.
Penelitian ini diharapkan dapat membuktikan secara ilmiah khasiat dari
ekstrak etanol daun lavender (Lavandula officinalis Chaix) yang berpengaruh
pada apoptosis sel kanker payudara T47D dan mendeteksi ekspresi sel protein
kanker payudara.
B. Tujuan Penelitian
1. Tujuan Umum
Mengetahui aktivitas antikanker ekstrak etanol daun lavender terhadap
sel kanker payudara T47D.
2. Tujuan Khusus
Mengetahui efek ekstrak etanol daun lavender terkait kemampuan
sitotoksik, induksi apoptosis pada sel kanker payudara T47D serta penekanan
!
Berdasarkan sistem taksonomi, tanaman lavender dikenal dengan nama
ilmiah Lavandula officinalis Chaix. Adapun klasifikasi tanaman tersebut adalah
sebagai berikut :
Species : Lavandula officinalis Chaix
(United States Departement of Agriculture)
Lavender merupakan tanaman yang dapat tumbuh dengan baik di tempat
kering dengan sinar matahari penuh disertai perlindungan angin (Prusinowska,
2014). Tanaman ini berasal dari wilayah Mediterania Utara, kemudian
!
Serikat dan bekas Yugoslavia. Lavender berasal dari bahasa latin yang diambil
dari kata “Lavo” atau “Lavare” yang berarti sarana untuk mencuci atau
membersihkan (Prusinowska, 2014). Lavender merupakan nama dalam bahasa
Indonesia maupun bahasa Inggris (WHO, 2007).
2. Morfologi
Gambar 1. Lavandula officinalis Chaix (United States Departement of Agriculture)
Lavandula officinalis Chaix merupakan sinonim dari Lavandula
angustifolia Mill. Pada sebagian besar buku referensi lama menyebutkan bahwa
Lavandula officinalis Chaix sebagai nama spesies, namun menurut peraturan
internasional nomenklatur botani, Lavandula angustifolia Mill. Merupakan nama
spesies yang resmi. Lavender merupakan tanaman yang termasuk dalam anggota
keluarga Lamiaceae serta memiliki genus yang terdiri dari 25-35 sub-spesies dan
memberikan morfologi yang beragam. Tanaman ini ditemukan dalam bentuk
semak aromatik setinggi 1-2 meter, memiliki cabang berwarna abu sampai coklat
tua. Bunga lavender berwarna ungu tua hingga biru tua dengan tinggi 25-35 cm.
Jumlah bunga dalam satu batang mencapai 6-10 buah. Daun mengelompok pada
!
8
tangkai daun sangat pendek, bentuk tangkai daun linier-lanset higga linier dengan
panjang 17 mm, lebar 2 mm (WHO, 2007).
3. Kandungan kimia
(A) (B) (C) (D)
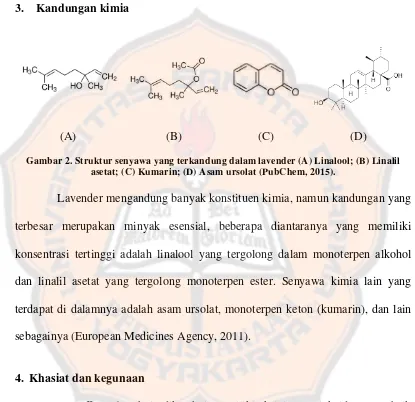
Gambar 2. Struktur senyawa yang terkandung dalam lavender (A) Linalool; (B) Linalil asetat; (C) Kumarin; (D) Asam ursolat (PubChem, 2015).
Lavender mengandung banyak konstituen kimia, namun kandungan yang
terbesar merupakan minyak esensial, beberapa diantaranya yang memiliki
konsentrasi tertinggi adalah linalool yang tergolong dalam monoterpen alkohol
dan linalil asetat yang tergolong monoterpen ester. Senyawa kimia lain yang
terdapat di dalamnya adalah asam ursolat, monoterpen keton (kumarin), dan lain
sebagainya (European Medicines Agency, 2011).
4. Khasiat dan kegunaan
L. officinalis Chaix diketahui memiliki aktivitas antioksidan yang baik
dan komponen kimia yang berperan adalah komponen fenolik, kandungan minyak
esensial didalamnya juga memiliki aktivitas antioksidan yang kuat dalam
melawan lipid peroksidasi sistem model asam linoleat. Senyawa perilil alkohol
(POH) golongan monoterpen didalam L. officinalis Chaix dapat digunakan
!
(Bardon, dkk.,2002). Pada penelitian Lim (2014), menyebutkan bahwa tikus yang
diberi makan p-limonene (salah satu golongan monoterpen) sebanyak 10.000 ppm
dapat mereduksi 72% tumor payudara dibandingkan dengan kontrol pada 18
minggu perlakuan
.
Khasiat lain yang terkandung dalam L. officinalis Chaix adalah sebagai
antimikrobia, antikonvulsan dan memiliki efek sedatif, serta berperan sebagai
senyawa anti-inflamasi. Pada uji klinik diketahui bahwa minyak esensial L.
officinalis Chaix dapat digunakan untuk aromaterapi pada penderita insomnia
(WHO, 2007).
B. Kanker Payudara dan Reseptor Estrogen- α (ERα)
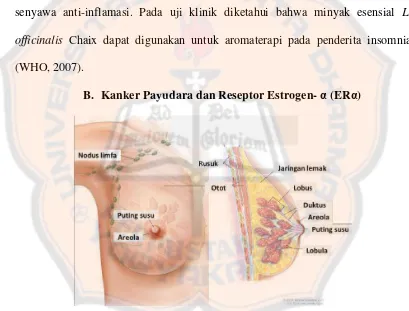
Gambar 3. Anatomi kelenjar payudara manusia (PubMed Health, 2014).
Kelenjar payudara manusia terdiri dari duktus dan lobus, dibentuk dari
sel-sel epitel yang dikekelingi sel-sel mioepitel serta sel lain yang tergolong dalam
jaringan ikat seperti fibroblast, sel endotel, serabut saraf dan adiposa. Kanker
payudara adalah tumor ganas yang berasal dari kelenjar payudara, termasuk
!
10
bermula dari sel epitelial, sehingga sebagian besar kanker payudara dikelompokan
sebagai karsinoma (keganasan tumor epitelial) (Hondermarck, 2003).
Terjadinya kanker payudara dibagi kedalam 4 tahapan utama didasarkan
pada hasil pengujian tumor dan benjolan kelenjar getah bening selama operasi dan
tes lain, tahapan tersebut adalah :
a) Tahap 0 (karsinoma in situ) : Merupakan tahapan non-invasif yaitu
dimana sel abnormal ditemukan di dalam kelenjar payudara. Sel abnormal ini
cenderung tidak menyebar menuju jaringan lain didalam payudara.
b) Tahap 1 : Tahap 1 terdiri dari 1A dan 1B. Pada tahap 1A
ditemukan tumor yang berukuran 2 cm atau lebih kecil dan tidak menyebar di
jaringan yang lain. Pada tahap 1B terdapat sekelompok kecil sel kanker dengan
ukuran 0,2 mm namun tidak lebih dari 2 mm ditemukan di kelenjar getah bening.
c) Tahap 2 : Ukuran tumor menjadi lebih besar, yaitu sekitar 2–5 cm,
sel kanker ditemukan pada kelenjar getah bening aksilaris atau didekat tulang
dada.
d) Tahap 3 : Ukuran tumor lebih besar dari 5 cm, sel kanker sudah
mulai menyebar pada kelenjar getah bening aksilaris. Sekelompok kecil sel
kanker berukan lebih besar dari 0,2 mm.
e) Tahap 4 : Kanker sudah mulai menyebar pada bagian tubuh lain,
terutama pada bagian tulang, paru- paru, hati atau otak.
(National Cancer Institue, 2013).
Faktor yang dapat meningkatkan resiko kanker payudara pada individu
!
memiliki anak, kehamilan pertama pada usia di atas 30 tahun, periode menstruasi
yang lebih lama (menstruasi pertama lebih awal atau menopause lebih lambat),
faktor hormonal (baik estrogen maupun androgen) (Hondermarck, 2003).
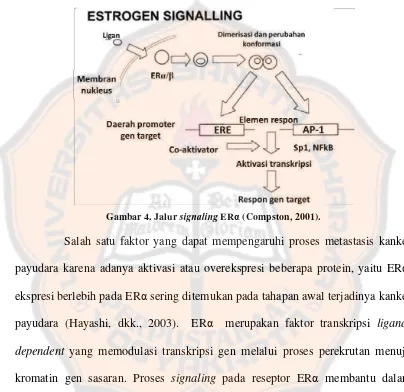
Gambar 4. Jalur signaling ERα (Compston, 2001).
Salah satu faktor yang dapat mempengaruhi proses metastasis kanker
payudara karena adanya aktivasi atau overekspresi beberapa protein, yaitu ERα,
ekspresi berlebih pada ERα sering ditemukan pada tahapan awal terjadinya kanker
payudara (Hayashi, dkk., 2003). ERα merupakan faktor transkripsi ligand-
dependent yang memodulasi transkripsi gen melalui proses perekrutan menuju
kromatin gen sasaran. Proses signaling pada reseptor ERα membantu dalam
memahami terjadinya kanker payudara, tahapan signaling ERα memberikan
kontribusi pada perubahan epigenik, epigenik merupakan modifikasi DNA yang
tidak merubah urutan gen, namun dapat berdampak pada ekspresi gen dan dapat
diwariskan. Sinyal ERα berpotensi untuk mengaktifkan sinyal ekstranuklear yang
berfungsi untuk mengaktifkan beberapa kaskade kinase yang secara langsung
!
12
fungsi dari histon yang memodifikasi enzim. Deregulasi ERα melalui sinyal
epigenik memiliki implikasi pada perkembangan kanker payudara (Mann, dkk.,
2011).
C. Sel Kanker T47D
Gambar 5. Sel T47D (Koleksi pribadi).
T47D merupakan sel kanker payudara yang aktivitasnya bergantung dari
jumlah hormon dalam tubuh manusia, sel ini secara luas digunakan sebagai model
eksperimental studi kanker payudara. T47D dapat dipakai pada uji in vitro (dalam
sel kultur) maupun in vivo (tumor xenograf pada tikus), fungsi protein dan tingkat
efikasi daya hambat sel. Sel ini awalnya berasal dari sisi metastasis efikasi pleura
dan memberikan ekspresi pada reseptor estrogen (Adjo dan Lin, 2012).
Sel kanker payudara T47D mengekpresikan reseptor estrogen nukleus,
yang diperlukan bagi sel untuk mengaktifkan gen penting tertentu dalam
pertumbuhan dan replikasi. Estrogen termasuk dalam hormon seks yang terdiri
dari estradiol, estriol, dan estrone. Hormon-hormon ini mampu menembus
membran sel sehingga dapat berdifusi langsung ke nukleus. Sekali estrogen dapat
masuk ke dalam nukleus, maka dapat terjadi ikatan antara substrat dan reseptor
!
dengan sisi spesifik pada DNA yang dapat menaikkan atau menurunkan ekspresi
gen tergantung pada peran faktor transkripsi sisi aktif (Neumann dan Rossi,
2012).
D. Apoptosis
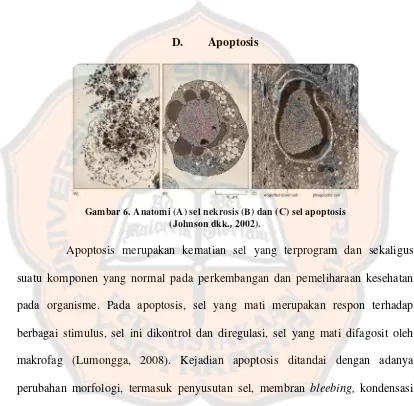
Gambar 6. Anatomi (A) sel nekrosis (B) dan (C) sel apoptosis (Johnson dkk., 2002).
Apoptosis merupakan kematian sel yang terprogram dan sekaligus
suatu komponen yang normal pada perkembangan dan pemeliharaan kesehatan
pada organisme. Pada apoptosis, sel yang mati merupakan respon terhadap
berbagai stimulus, sel ini dikontrol dan diregulasi, sel yang mati difagosit oleh
makrofag (Lumongga, 2008). Kejadian apoptosis ditandai dengan adanya
perubahan morfologi, termasuk penyusutan sel, membran bleebing, kondensasi
kromatin, fragmentasi DNA, dan pembentukan badan apoptosis (Handayani,
2012).
Apoptosis berbeda dengan nekrosis, pada nekrosis terjadi kematian sel
tidak terkontrol, sel yang mati pada nekrosis dapat membesar dan kemudian
hancur serta lisis pada satu daerah yang merupakan respon terhadap inflamasi.
!
14
penyakit, termasuk kanker, autoimun dan penyakit degeneratif. Sinyal apoptosis
terjadi melalui berbagai jalur independen yang dimulai dengan memicu peristiwa
dalam sel maupun dari luar sel, misalnya dengan ligasi kematian reseptor. Seluruh
jalur signaling apoptosis bertemu pada suatu mesin kerusakan sel yang diaktifkan
oleh famili protease sistein (caspase) yang membelah pada residu aspartat.
Pembongkaran sel dicapai dengan cara proteolisis dari konstituen vital sel,
degradasi DNA, dan fagositosis oleh sel tetangga (Strasser, dkk., 2000).
E. Uji Sitotoksik dengan Metode 3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide (MTT)
Uji 3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium bromide
(MTT) merupakan uji viabilitas sel yang dikembangkan untuk format 96 sumuran.
Metode ini diawali dengan mempersiapkan substrat MTT dalam larutan fisiologis
kemudian ditambahkan pada sel yang telah dikulturkan dan diinkubasi selama 1-
4 jam. Jumlah formazan (berbanding lurus dengan jumlah sel yang hidup) diukur
pada panjang gelombang 570 nm dengan menggunakan spektrofotometer. Sel
yang hidup dan memetabolisme aktif mengkonversi MTT menjadi formazan yang
berwarna ungu pada absorbansi maksimum 570 nm. Ketika sel tersebut mati,
maka sel itu kehilangan kemampuan dalam mengkonversi MTT menjadi sebuah
formasan, sehingga adanya perubahan warna berfungsi hanya sebagai penanda
jumlah sel yang masih hidup. Jumlah sinyal yang dihasilkan bergantung dari
konsentrasi MTT, masa inkubasi, jumlah sel yang hidup dan aktivitas
metabolisme (Terry, dkk., 2013).
!
Gambar 7. Struktur MTT dan formasan yang terbentuk (Terry, dkk., 2013).
F. Uji Apoptosis menggunakan Annexin V Fluos
Annexin V Fluos merupakan suatu metode uji yang digunakan untuk
menghitung jumlah sel yang telah mengalami apoptosis. Hal ini didasarkan pada
sel-sel normal di alam bersifat hidrofobik dan memiliki membran fosfolipid yang
terdistribusi di dalam dan di bagian luar lapisan membran. Pada bagian luar lipid
bilayer mengandung fosfatidilkolin dan sfingomielin sedangkan pada bagian
dalam terdapat fosfatidilserin, ketika terjadi apoptosis pada sel tersebut, bagian
membran menjadi terganggu atau rusak, sehingga mengakibatkan fosfatidilserin
keluar menuju bagian luar. Annexin V Fluos yang memiliki afinitas kuat terhadap
fosfatidilserin sehingga dapat terdeteksi jumlah sel yang mengalami apoptosis.
Sedangkan untuk sel- sel yang mengalami kerusakan DNA berikatan dengan
reagen propidium iodin dan dapat memberikan data jumlah sel yang mengalami
nekrosis (Istvan, dkk., 1995).
Alat yang digunakan untuk mendeteksi hasil Annexin V Fluos adalah
flow cytometer. Flow cytometer merupakan alat yang canggih untuk mendeteksi
!
16
diapancarkan oleh sel itu sendiri. Adanya fluroresensi ini kemungkinan berkaitan
dengan pewarnaan atau adanya konjugasi pada antibodi spesifik pada permukaan
sel atau pada komponen intraseluler. Flow cytometer dapat mengidentifikasi
berbagai macam jenis sel pada populasi sel yang heterogen, hal ini dapat dicapai
dengan adanya Fluorescence Activated Cell Sorting (FACS) didalam flow
cytometer, perangkat ini mampu mengidentifikasi lebih dari dua warna floresensi
(Macey, 2007).
G. Uji Ekspresi Sel dengan Imunositokimia
Metode imunositokimia memanfaatkan suatu antibodi spesifik yang
dapat berikatan dengan protein atau antigen didalam sel dan membran di bawah
mikroskop (Richard, 2010). Ada dua jenis metode imunositokimia, yaitu metode
langsung dan metode tidak langsung. Pada metode langsung, antibodi yang
mengikat fluoresen atau zat warna langsung berikatan dengan antigen pada sel.
Sedangkan pada metode tidak langsung, antigen diikatkan pada antibodi primer
secara langsung, kemudian ditambahkan antibodi sekunder yang mengikat enzim
seperti peroksidase, alkali fosfatase, atau glukosa oksidase. Antibodi sekunder
akan berikatan dengan antibodi primer. Selanjutnya ditambahkan substrat
kromogen yang diubah oleh enzim sehingga terjadi pembentukan warna (pigmen)
yang mampu memberikan warna pada sel (Richard, 2011).
Pada metode imunositokimia dibutuhkan suatu kontrol yang terdiri dari
antibodi primer, antibodi sekunder, dan kontrol label. Antibodi primer digunakan
untuk mengetahui spesifisitas ikatan antibodi primer tehadap antigen, antibodi
!
primer, sedangkan kontrol label merupakan hasil dari proses pelabelan selama
proses imunositokimia dan menunjukkan bahwa label yang digunakan tidak
bersifat endogen/bereaksi dengan produk (Richard, 2011).
H. Landasan Teori
Kanker payudara memiliki hubungan erat dengan hormon estrogen yang
terdapat pada wanita. Salah satu penyebab terjadinya kanker payudara adalah
aktivasi atau overekspresi protein, yaitu reseptor estrogen alfa (ERα). ERα
berikatan dengan estrogen membentuk kompleks reseptor aktif dan dapat
mempengaruhi transkripsi gen yang mengatur proliferasi sel, adanya overekspresi
pada ERα menimbulkan terjadinya proliferasi sel yang abnormal dan memicu
terjadinya kanker.
Beberapa macam jenis terapi yang pernah diberikan bagi penderita
kanker payudara antara lain adalah terapi hormonal, terapi radiasi, operasi
pengangkatan payudara, dan kemoterapi. Kekurangan dari berbagai terapi tersebut
yaitu munculnya iritasi pada kulit payudara, lymphedema, rasa mual, muntah,
diare dan sakit kepala, sehingga diperlukan adanya penelitian suatu senyawa yang
mampu membunuh sel kanker payudara secara selektif dan meminimalkan
munculnya efek samping. Selama ini telah dilakukan berbagai macam penelitian
terkait senyawa alam yang memiliki aktivitas antikanker pada kelenjar payudara.
Menurut Lim (2014), L. officinalis Chaix merupakan tanaman yang
memiliki kandungan monoterpen cukup tinggi dan senyawa ini mempunyai
!
18
menghambat viabilitas sel diujikan pada sel kanker payudara T47D yang mampu
mengekspresikan ERα. Kemampuan senyawa dalam menginduksi apoptosis diuji
menggunakan Annexin V Fluos. Jalur kematian apoptosis dipilih karena tidak
membawa pengaruh pada sel sekitarnya dan memberikan terapi yang lebih
selektif. Pengamatan molekuler sel dalam menekan ekspresi ERα dilakukan
dengan metode semi-kuantitatif melalui imunositokimia. Tamoxifen dapat
digunakan sebagai obat pembanding dalam penelitian ini karena obat ini tergolong
dalam terapi hormonal yang telah terbukti mampu menghambat ikatan antara
estrogen dengan sel-sel kanker ER-positif
I. Hipotesis
Adanya pengaruh ekstrak etanol daun lavender (Lavandula officinalis
Chaix) terhadap viabilitas sel T47D yang diuji menggunakan metode
3-[4,5-dimethylthiazol-2-yl]-2,5 diphenyl tetrazolium (MTT) dan mampu menginduksi
19 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian yang berjudul “Efek Antikanker Ekstrak Etanolik Daun
Lavender (Lavandula Officinalis Chaix) terhadap Sel Kanker Payudara T47D
melalui Penekanan Ekspresi Reseptor Estrogen-α” termasuk penelitian
eksperimental murni dengan menggunakan rancangan penelitian acak lengkap
pola searah. Penelitian ini termasuk jenis ekperimental karena terdapat perlakuan
terhadap subyek uji. Rancangan penelitian acak lengkap pola searah karena
penelitian ini memiliki satu faktor dengan banyak level.
B. Variabel dan Definisi Operasional
1. Variabel Penelitian
a. Variabel utama
1) Variabel bebas : tujuh peringkat konsentrasi ekstrak etanol daun
lavender yaitu (1585, 1150, 1000, 300, 178, 100, 10) µg/mL.
2) Variabel tergantung : viabilitas sel, persentase sel apoptosis, level
ekspresi protein ERα.
b. Variabel Pengacau
1) Variabel pengacau terkendali
Variabel pengacau terkendali dalam penelitian ini adalah kondisi sel uji, yaitu sel
!
20
Chaix yang didistribusikan oleh Dipokusumo Farm (Rasamala A4, Semarang Kota
50189, Jawa Tengah, Indonesia) berasal dari kebun di Malang, Jawa Timur dipanen
pada bulan Juni 2014, serta lama pengeringan daun L. Officinalis Chaix.
2) Variabel pengacau tak terkendali
Usia tanaman, cuaca, kontaminasi lingkungan, kondisi lingkungan, dan waktu
inkubasi.
2. Definisi Operasional
a. Ekstrak etanol daun Lavandula officinalis Chaix adalah larutan kental hasil
ekstraksi total daun lavender yang diperoleh dengan cara mengekstraksi.
b. Uji MTT adalah metode yang digunakan untuk mengetahui jumlah sel yang
masih hidup setelah pemberian ekstrak etanol daun Lavandula officinalis
Chaix.
c. Konsentrasi IC50 adalah konsentrasi sampel yang mampu mematikan sel
sebanyak 50% dari total sel.
d. Apoptosis sel yang teramati adalah sel hidup berfluoresensi hijau terang, sel
yang mengalami nekrosis berwarna oranye merata seperti sel normal, sel yang
mengandung ERα berwarna coklat dan sel yang tidak mengandung ERα
berwarna biru.
e. Imunositokimia adalah metode yang digunakan untuk mengetahui adanya
ekspresi suatu protein spesifik di dalam sel.
f. Level ekspresi ERα populasi atau persentase sel yang berwarna coklat baik
pada sitoplasma dan atau nukleus dalam tiga lapang pandang.
!
C. Bahan Penelitian
1. Bahan utama
a. Daun lavender (Lavandula officinalis Chaix) diperoleh dari distributor
Dipokusumo Farm (Rasmala A4, Semarang Kota) yang dipanen pada bulan
Juni 2014
b. Breast Cancer Cell Line T47D diperoleh dari Laboratorium Parasitologi
Universitas Gadjah Mada Yogyakarta.
2. Bahan kimia
Bahan kimia yang digunakan adalah etanol 70% (CV. Labora), PBS
(Phospate Buffer Saline), MK (Media Kultur) yang berisi Dulbeco’s Modified
Eagle Media (DMEM) dan Roswell Park Memorial Institute (RPMI), Dimethyl
Sulfoxide (DMSO), Reagen MTT 5mg/mL (50 mg MTT dan 10 mL PBS), Sodium
Dodecyl Sulfate (SDS) 10% dalam 0,1N HCl (larutan stopper), Fetal Bovine
Serum (FBS) 10% (v/v) (Gibco), penisilin- streptomisin 1% (v/v) (Gibco), tripsin
EDTA 0,25%, fungizone 0,5% (Gibco), reagen Annexin V Fluos (Roche),
Propidium Iodine (Pi), reagen Imunositokimia yang terdiri dari metanol, larutan
hidrogen peroksida, Novostain universal detection kit, antibodi monoklonal
primer ERα (Thermo Fisher Scientific Pierce), biotinylated universal secondary
antibodi(Lab Vision), etilen, xylol, dan hematoxylin (Dako). Bahan untuk kontrol
positif adalah tablet tamoxifen 10 mg (Nolvadex), akuades, Streptavidin berupa
!
22
D. Alat Penelitian
Treated tissue culture dish diameter 10 cm, 96 well-plate, 24 well-plate,
6 well-plate, cover slip, sentrifuge tube, object-glass, conical tube, eppendorf,
inkubator CO2, Laminar air flow cabinet, mikropipet, yellow-tip, blue-tip, pinset,
autoklaf, hemositometer, ELISA reader, kamera digital, mikroskop cahaya, rotary
evaporator, mikroskop inverter, neraca digital.
E. Tata Cara Penelitian
1. Pengumpulan tanaman
Tanaman Lavender officinalis Chaix dibeli dari perkebunan Dipokusumo
Farm (Rasamala A4, Semarang Kota 50189, Jawa Tengah, Indonesia) dipanen
pada bulan Juni 2014. Bagian tanaman yang digunakan hanya bagian daun dan
dipilih daun segar dengan ciri berwarna hijau, mengeluarkan aroma lavender,
bentuk masih utuh dan sedikit lengket karena kandungan minyak atsiri.
2. Determinasi tanaman
Daun lavender yang telah diperoleh dari perkebunan Dipokusumo Farm
dilakukan determinasi atau identifikasi tanaman sesuai dengan Lampiran 1.
3. Sortasi basah
Daun lavender dipisahkan dari bunga, batang dan akarnya serta
pengotor lain seperti tanah yang menempel pada permukaan daun.
!
4. Pencucian
Pencucian daun lavender dilakukan dengan menggunakan air mengalir
sebanyak tiga kali, pencucian dilakukan dengan hati–hati supaya daun lavender
tetap dalam kondisi utuh.
5. Pembuatan serbuk daun lavender kering
Daun lavender yang telah dicuci bersih dilakukan pengeringan suhu
rendah dengan cara dimasukkan ke dalam lemari pendingin pada suhu 5-100C
selama 14 hari, daun yang telah kering tersebut kemudian dibuat dalam bentuk
serbuk dengan cara diblender hingga hancur dan diperoleh serbuk halus simplisia.
6. Pembuatan ekstrak etanol daun Lavandula officinalis Chaix
Sebanyak 10 gram serbuk simplisia dilarutkan dengan 50 mL etanol
70% dalam erlenmeyer, kemudian dilakukan pengadukan dan dilanjutkan dengan
maserasi selama 48 jam dengan kecepatan 150 rpm. Hasil maserasi yang
diperoleh selanjutnya disaring dan diambil bagian cairan, kemudian dilakukan
rotary evaporator pada suhu 800C selama 5 menit dilanjutkan dengan pemekatan
dengan menggunakan waterbath selama 4,5 jam pada suhu yang sama, yaitu 800C
hingga diperoleh hasil ektraksi dengan konsistensi kental berwarna hijau pekat.
Hasil ekstraksi yang diperoleh ditimbang, ditempatkan dalam flakon, dan
disimpan pada suhu ruang (Hajhashemi, dkk., 2003).
7. Pembuatan larutan uji
a. Sampel ( ekstrak etanol daun L. officinalis Chaix)
Ekstrak kental ditimbang sebanyak 10 mg kemudian dilarutkan kedalam
!
Larutan kontrol positif menggunakan tamoxifen dari 20 tablet Nolvadex
yang tiap tabletnya mengandung 20 mg tamoxifen, ditimbang kemudian digerus
hingga homogen. Sebanyak 10 mg dilarutkan dalam DMSO 100 µL, didapatkan
larutan stok kontrol dengan konsentrasi 100.000 µg/ mL. Selanjutnya dibuat tujuh
seri kadar pengenceran yaitu 1585 µg/mL; 1150 µg/mL; 1000 µg/mL; 300 µg/mL;
178 µg/mL; 100 µg/mL; dan 10 µg/mL (Setiawati, dkk., 2009).
8. Uji Sitotoksik ekstrak etanol daun Lavender pada sel T47D
a. Perlakuan sel T47D
Sel T47D yang telah diinkubasi selama 24 jam dikeluarkan dari
inkubator dan dipindahkan menuju LAF (Laminar Air Flow), seluruh kegiatan uji
sitotoksik dilakukan didalam LAF yang sebelumnya telah diberi penyinaran UV
(Ultra Violet). Selanjutnya, seluruh media didalam well-plate dibuang dan
ditiriskan, lalu segera dipipet 100 µL sampel dari setiap seri kadar dan
dimasukkan kedalam lubang well-plate, dilakukan replikasi sebanyak tiga kali.
Didalam satu well-plate yang berisi 96 lubang diisi oleh sampel, kontrol sel,
kontrol positif (tablet tamoxifen). Selanjutnya, sel diinkubasi selama 24 jam
didalam inkubator dan setelah inkubasi dilakukan pengamatan pada sel yang telah
diberi perlakuan sampel dibawah mikroskop inverter, tidak semua lubang diamati,
!
terendah, bentuk sel diamati dan diambil gambar dengan menggunakan kamera
digital.
b. Metode MTT
Seluruh reagen MTT dipersiapkan dengan cara mencampur 1 mL MTT
dengan 10 mL MK kedalam conical tube, digojog secara perlahan karena sangat
mudah berbuih. Selanjutnya, media yang terdapat pada sel T47D perlakuan
dibuang dengan membalikan plate 1800 diatas tempat pembuangan dengan jarak
10 cm kemudian tekan plate secara perlahan diatas tisu untuk meniriskan sisa
cairan. Larutan PBS dimasukkan sebanyak 100 µL kedalam semua sumuran yang
telah berisi sel untuk mencuci sisa media yang masih bercampur dengan sel,
kemudian buang PBS dengan cara membalik plate seperti perlakuan diatas.
Ditambahkan reagen MTT yang telah dipersiapkan sebelumnya sebanyak 100 µL
ke setiap sumuran, termasuk kontrol media, dilakukan inkubasi selama empat jam
didalam inkubator CO2. Setelah itu, diamti kondisi sel dan formazan yang
terbentuk dibawah mikroskop inverted, jika formasan telah terbentuk,
ditambahkan 100 µL SDS 10% dalam 0,1N HCl. Plate dibungkus menggunakan
alumunium foil dan diinkubasi pada tempat gelap selama semalam pada suhu
kamar.
(American Type Culture Collection, 2011).
c. ELISA Reader
ELISA reader dihidupkan dan ditunggu hingga proses regressing selesai.
Pembungkus plate dan tutup plate dibuka kemudian plate dimasukkan kedalam
!
26
start. ELISA reader dimatikan, kertas hasil pembacaan menggunakan ELISA
reader di fotocopy dan ditempel pada logbook. Data yang diperoleh diolah untuk
mendapatkan nilai IC50 dengan membuat grafik absorbansi versus konsentrasi
menggunakan program Microsoft Excell serta dilanjutkan dengan program R.
Persentase sel yang hidup dihitung dengan rumus:
Persentase sel hidup = (!"#$%&'"#(!!"#$%&'%(!!!"#$!%&"'!!"#$%"&!!"#$%)
(!"#$%"&'#(!!"#$%"&!!"#!!"#$%"&'#(!!"#$%"&!!"#$%) X 100%
(Doyle dan Griffiths, 2000).
9. Uji apoptosis Annexin V Fluos
a. Perlakuan sel
Penanaman sel T47D dilakukan pada 6 well-plate, tiap sumuran diisi
dengan 2 mL. Jumlah sel sekitar lima ratus ribu hingga satu juta sel. Diinkubasi
selama 24 jam didalam inkubator CO2. Selanjutnya, plate sel yang telah
diinkubasi diambil dan dimasukkan dalam LAF, seluruh media dalam sumuran
disedot menggunakan micropipet dan dibuang. Selanjutnya dicuci PBS sebanyak
satu kali, PBS disedot kembali menggunakan micropipet. Sampel pada
konsentrasi IC50 dimasukkan dalam well-plate sebanyak 2 mL. Kemudian
diinkubasi selama 24 jam.
b. Pra Perlakuan Annexin V Fluos
Well-plate yang telah diinkubasi dengan sampel diambil dan disiapkan
conical tube untuk memindahkan media yang ada pada well-plate kedalam
conical tube.sesuai dengan jenis masing- masing sampel yang ada, termasuk
kontrol sel. Well-plate yang telah kosong dicuci menggunakan PBS sebanyak 1
!
ke dalam conical tube yang sesuai dengan tiap sampel. Selanjutnya, dimasukkan
tripsin kedalam well-plate sebanyak 200 µL, diinkubasi selama 3 menit, dan
diamati menggunakan mikroskop hingga terlihat bentuk bulat transparan yang
menunjukkan sel T47D. Ditambahkan MK sebanyak 1 mL kedalam plate, lalu
disedot kembali dan ditampung pada conical tube. Dilakukan sentrifuge pada
conical tube selama 4 menit dengan kecepatan 4000 rpm. Supernatan yang
terbentuk dibuang kemudian ditambahkan PBS dingin sebanyak 1 mL. Dilakukan
resuspensi dan 1 mL cairan di dalam conical tube dipindahkan kedalam eppendorf
1 mL. Eppendorf disentrifuge selama 5 menit dengan kecepatan 5000 rpm.
c. Pembuatan reagen Annexin V Fluos
Eppendorf dibungkus dengan alumunium foil, diambil 550 mL buffer
dan dimasukkan dalam eppendorf, ditambahkan reagen Annexin V Fluos 10 µL
lalu di vortex dan ditambahkan reagen Pi 10 µL, di vortex kembali. (Setiap 100
µL larutan uji digunakan 2 µL reagen Annexin V Fluos dan 2 µL reagen Pi).
d. Perlakuan sampel dengan reagen Annexin V Fluos
Supernatan pada sampel dibuang dan disisakan endapan yang terbentuk,
ditambahkan 100 µL reagen Annexin V Fluos yang telah dibuat kedalam endapan
sampel. Dilakukan inkubasi selama 10 menit dalam ruang gelap (laci).
Ditambahkan buffer 300 µL didalam eppendorf kemudian dilakukan analisis.
!
diambil sedikit dan dituang diatas kaca preparat untuk menghitung jumlah sel.
Kaca preparat diletakan diatas Haemositometer (alat penghitung sel), kemudian
diamati menggunakan mikroskop inverter perbesaran 10 kali dan dilakukan
penghitungan dengan bantuan counter. Sel sudah sesuai dengan kriteria apabila
jumLahnya antara minimal 50.000- 100.000 sel, jika hasil perhitungan sel sudah
sesuai maka dilanjutkan dengan preparasi sel tersebut. Dimasukka 5 mL MK
kedalam conical tube yang baru dan ditambahkan 1,25 mL sel dari conical tube
awal kedalam conical tube yang berisi 5 mL MK.
b. Subkultur sel
Cover slip dimasukkan ke dalam well plate sesuai dengan jumlah sampel
dan kontrol yang digunakan. Campuran MK dan sel yang ada di conical tube
dimasukkan pada 24 well-plate yang telah diisi coverslip sebanyak 1 mL. Inkubasi
dilakukan selama 24 jam didalam inkubator CO2.
c. Perlakuan
MK yang ada di dalam well plate disedot kemudian diisi dengan sampel
sebanyak 1 mL. Di dalam well plate juga diberi kontrol sel, kontrol positif, dan
kontrol negatif.
!
d. Perlakuan imunositokimia
Coverslip dipindahkan diatas kaca preparat dengan bantuan pinset dan
jarum agar tidak merusak sel dan peletakan coverslip juga harus tepat, tidak boleh
terbalik. Pada ujung kaca preparat diberi label yang dilapisi dengan selotip agar
tidak lepas atau sobek saat diberi perlakuan. Kaca preparat dipindahkan pada
tempat kayu untuk memudahkan memberi reagen imunositokimia. Mula–mula
dilakukan pencucian dengan PBS sebanyak dua kali dengan cara menggenangi
coverslip yang ada diatas kaca preparat dengan PBS yang diambil menggunakan
micropipet (asal tergenang). PBS ditarik atau disedot kembali dengan
menggunakan micropipet yang berbeda, hal ini dilakukan dengan hati- hati agar
coverslip tidak terjatuh. Lalu dilakukan fiksasi metanol selama 10 menit, fiksasi
metanol juga dilakukan dengan cara yang sama dengan pencucian PBS yaitu
dengan menggenangi coverslip dengan metanol dan menarik kembali setelah 10
menit. Selanjutnya, dilakukan pencucian PBS dua kali dan akuades dua kali, lalu
dibuat campuran H2O2 : H2O = 1:9, campuran diambil sebanyak 100 µL untuk
diteteskan diatas coverslip, didiamkan selama 10 menit kemudian ditarik/disedot
kembali menggunakan micropipet yang berbeda. Kemudian, preparat dicuci PBS
sebanyak dua kali. Larutan bloking ditambahkan 100 µL, didiamkan 10 menit dan
kembali disedot. Antibodi primer ditambahkan sebanyak 50 µL dan didiamkan
selama satu jam, antibodi primer dan diratakan dipermukaan coverslip, seluruh
coverslip diberi antibodi primer kecuali kontrol negatif. Cairan disedot kemudian
dibuang. PBS ditambahkan untuk pencucian. Antibodi sekunder universal
!
30
kemudian dibuang. Streptavidin (HRP) ditambahkan sebanyak 100 µL, didiamkan
selama 10 menit, cairan disedot kemudian dibuang. Proses pencucian PBS
dilakukan sebanyak dua kali. Sebanyak 100 µL DAB ditambahkan dan didiamkan
selama 2 menit. Akuades ditambahkan untuk mencuci sebanyak dua kali, disedot
kemudian dibuang. Perwarna hematoxilin ditambahkan sebanyak 100 µL dan
didiamkan selama 5 menit, kembali dicuci akuades dua kali hingga bersih dan
warna biru dari pewarna hilang. Etanol absolut ditambahkan dengan cara
menggenangi preparat dan langsung ditarik kembali kemudian digenangi xylol
dan kembali langsung ditarik. Coverslip yang ada di atas preparat dikeringkan
selama beberapa menit. Setelah kering, coverslip ditempel diatas object glass
dengan cara memberikan setetes etilen dan diaratakan di atas coverslip. Preparat
imunositokimia dapat diamati menggunakan mikroskop cahaya.
31 BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk mengetahui pengaruh ekstrak etanol daun
L. officinalis Chaix terhadap viabilitas sel kanker payudara T47D dengan melihat
aktivitas ekstrak etanol daun L. officinalis Chaix dalam menekan ekspresi ERα
serta untuk mengetahui IC50 ekstrak etanol daun L. officinalis Chaix yang
berpengaruh pada apoptosis sel kanker payudara T47D. Persentase viabilitas sel
diketahui dari uji in vitro menggunakan MTT assay, deteksi apoptosis dilakukan
dengan metode Annexin V Fluos dan dilanjutkan dengan uji imunositokimia
untuk melihat ekspresi antigen spesifik pada sel terhadap estrogen-α secara
molekuler. Tamoxifen digunakan sebagai kontrol positif karena tamoxifen telah
diketahui dapat dipergunakan sebagai obat dalam terapi hormonal bagi penderita
kanker payudara.
A. Penyiapan Ekstrak
Penelitian ini menggunakan sampel berupa tanaman yaitu daun L.
officinalis Chaix. Determinasi daun L. officinalis Chaix pada penelitian ini
bertujuan untuk membuktikan bahwa tanaman yang diguakan dalam penelitian ini
memang benar tanaman yang dimaksud, yaitu L. officinalis Chaix. Bagian
tanaman yang digunakan untuk determinasi merupakan bagian daun, hasil
determinasi dibuktikan dengan adanya surat keterangan yang dikeluarkan
!
32
determinasi menyatakan bahwa daun yang digunakan merupakan daun L.
officinalis Chaix (Lampiran 1).
Tahap selanjutnya dilakukan proses ekstraksi menggunakan metode
maserasi dengan pelarut etanol 70% dan diharapkan seluruh kandungan zat aktif
di dalam daun L. officinalis Chaix dapat tersari. Maserasi merupakan cara
ekstraksi yang sederhana, yaitu dengan merendam serbuk simplisia dalam cairan
penyari, pada percobaan ini dilakukan maserasi selama 48 jam agar diperoleh
rendemen ekstraksi dengan kadar yang tinggi. Prinsip maserasi adalah masuknya
cairan penyari kedalam rongga sel yang mengandung zat aktif, sehingga terjadi
perbedaan konsentrasi antara zat terlarut didalam sel dengan yang diluar sel maka
larutan didalam sel didesak keluar dan hal ini terjadi berulang kali hingga terjadi
keseimbangan konsentrasi antara larutan yang ada di dalam dan di luar sel. Hasil
maserasi disaring untuk memisahkan bagian padat yang mengendap dengan
bagian cairan, bagian cairan dilakukan pemekatan dengan bantuan rotary
evaporator untuk menguapkan larutan penyari (etanol 70%) sehingga diperoleh
hasil ekstraksi yang pekat, evaporasi dilakukan selama 5 menit karena jumlah
cairan hasil ekstraksi sedikit, sehingga hanya memerlukan waktu singkat untuk
menguapkan. Pemekatan dilanjutkan kembali menggunakan waterbath untuk
menguapkan sisa–sisa etanol 70% yang masih ada.
B. Uji sitotoksik ekstrak daun L.officinalis Chaix pada sel kanker
payudara T47D dengan metode MTT
Uji sitotoksik bertujuan untuk mengetahui potensi ketoksikan suatu
!
metode kolorimetrik berdasarkan pada perubahan garam tetrazolium [3-(4,5-dimet
iltiazol-2-yl)-2,5-difeniltetrazolium bromide] (MTT) menjadi formazan dalam
mitokondria yang aktif pada sel hidup. MTT diabsorbsi oleh sel hidup dan
dipecah oleh sistem reduktase suksinat tetrazolium yang termasuk dalam respirasi
mitokondria, sehingga aktif menjadi bentuk formazan (Doyle dan Griffiths, 2000).
Intensitas warna ungu dan jumlah kristal formazan yang terbentuk proporsional
dengan viabilitas sel. Kemudian absorbansi dapat diukur menggunakan ELISA
reader, hasil pembacaan ELISA terdapat pada Lampiran 3 dan 4.
!
Gambar 8. Kristal formazan (A) kontrol sel; (B) perlakuan ekstrak etanol daun L.officinalis Chaix
Ilustrasi gambar di atas merupakan contoh kristal formazan yang
terbentuk pada kontrol sel dan perlakuan ekstrak etanol daun L.officinalis Chaix.
Intensitas warna ungu dan jumlah kristal formazan yang terbentuk proporsional
dengan jumlah sel yang hidup, pada kontrol sel terbentuk kristal formazan lebih
banyak daripada perlakuan, hal ini menunjukkan bahwa ekstrak etanol daun
L.officinalis Chaix mampu menghambat sel kanker payudara T47D. Namun perlu
gambaran terkait sensitivitas ekstrak etanol daun L.officinalis Chaix terhadap sel
kanker payudara T47D sehingga dapat diperoleh suatu evaluasi mengenai
!
34
Sensitivitas ekstrak etanol daun L.officinalis Chaix terhadap sel kanker
payudara T47D diukur melalui nilai IC50, nilai IC50 menunjukkan konsentrasi
ekstrak etanol daun L. Officinalis Chaix yang mampu mematikan setengah dari
populasi sel T47D yang ada. Pada penelitian ini diperoleh nilai IC50 232,86 µg/mL
yang dihitung secara statistik menggunakan program R, program R merupakan
software statistik seperti halnya SPSS untuk analisis regresi namun memiliki
kemampuan yang lebih baik dalam mengolah dan menganalis data, hal ini seperti
yang dikemukakan oleh Darinus (2002). Hasil IC50 menunjukkan bahwa ekstrak
etanol daun L. Officinalis Chaix memiliki sifat sitotoksik yang cukup lemah
dibandingkan dengan nilai IC50 tamoxifen yaitu 13,98 µg/mL. Menurut
Kamuhabwa (2000), suatu ekstrak dikatakan memiliki efek sitotoksik terhadap sel
kanker payudara apabila memiliki nilai IC50 ≤ 100 µg/mL, namun ekstrak etanol
daun L. officinalis Chaix tetap memiliki potensi untuk dikembangkan sebagai
antikanker karena dalam penelitian Machana (2011) menyebutkan bahwa ekstrak
dikatakan tidak aktif sebagai antikanker apabila memiliki nilai IC50 > 500 µg/mL.
Nilai IC50 yang kurang sensitif diduga karena kompleksitas senyawa yang
terkandung didalam ekstrak etanol daun L. officinalis Chaix.
Pengaruh ekstrak etanol daun L.officinalis Chaix terhadap viabilitas sel
kanker payudara T47D dapat diketahui dari suatu kurva sigmoid yang
menunjukkan hubungan persentase viabilitas sel versus log konsentrasi ekstrak
etanol daun L.officinalis Chaix kemudian dibandingkan dengan kurva viabilitas
sel dari tamoxifen. Berikut merupakan hasil pengukuran viabilitas sel kanker
payudara T47D dengan perlakuan ekstrak etanol daun lavender.
!
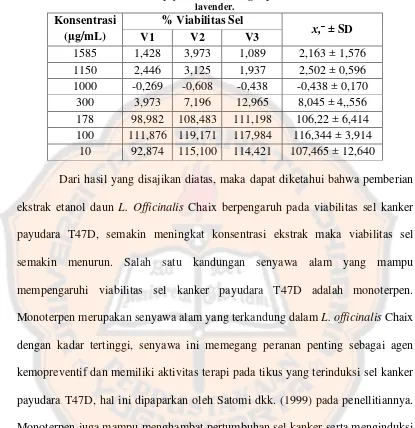
Tabel I. Viabilitas sel kanker payudara T47D dengan perlakuan ekstak etanol daun lavender.
Dari hasil yang disajikan diatas, maka dapat diketahui bahwa pemberian
ekstrak etanol daun L. Officinalis Chaix berpengaruh pada viabilitas sel kanker
payudara T47D, semakin meningkat konsentrasi ekstrak maka viabilitas sel
semakin menurun. Salah satu kandungan senyawa alam yang mampu
mempengaruhi viabilitas sel kanker payudara T47D adalah monoterpen.
Monoterpen merupakan senyawa alam yang terkandung dalam L. officinalis Chaix
dengan kadar tertinggi, senyawa ini memegang peranan penting sebagai agen
kemopreventif dan memiliki aktivitas terapi pada tikus yang terinduksi sel kanker
payudara T47D, hal ini dipaparkan oleh Satomi dkk. (1999) pada penellitiannya.
Monoterpen juga mampu menghambat pertumbuhan sel kanker serta menginduksi
!
36
Tabel II. Viabilitas sel kanker payudara T47D dengan perlakuan tamoxifen.
Konsentrasi
Data tamoxifen menunjukkan hasil yang sama, yaitu bahwa semakin
tinggi konsentrasi tamoxifen, persentase viabilitas sel kanker payudara T47D
mengalami penurunan. Tamoxifen tergolong dalam terapi hormonal yang
digunakan pada pasien penderita kanker payudara, mekanisme aksi tamoxifen
diketahui dapat melalui dua aksi, yaitu 1) melakukan kompetisi dengan 17β-
estradiol (E2) pada lokasi reseptor untuk memblok peran promosi E2 pada kanker
payudara; dan 2) dengan mengikat DNA setelah aktivasi metabolik (Yu dan
Bender, 2001). Tamoxifen merupakan senyawa yang memiliki aktivitas
antiestrogen dan menjadi inhibitor kompetitif bagi estrogen yang berikatan pada
reseptornya (Osborne, 1998). Apabila tamoxifen berikatan dengan ERα maka
ligand-activated transcription factor yang melakukan regulasi transkripsi pada
nukleus berikatan dengan Estrogen Response Element (ERE) dan mempengaruhi
aktivitas protein coregulator sehingga proliferasi dari estrogen dapat dihambat
(Deroo dan Korach, 2006)
!
Gambar 9. Morfologi sel T47D (A) kontrol sel ; (B) ekstrak etanol daun L. Officinalis Chaix 1585 µg/mL; (C) ekstrak lavender 300 µg/mL; (D) ekstrak lavender 10 µg/mL; (E) tamoxifen
(sel hidup: ;sel mati: )
Morfologi sel kanker payudara T47D diamati dibawah mikroskop
inverter dan memberikan gambaran bahwa sel yang mati memiliki warna lebih
gelap dan berbentuk bulat, hal ini terjadi karena sel kehilangan sitoplasma akibat
rusaknya membran sel, sehingga sel tidak dapat meneruskan cahaya dari
mikroskop. Sedangkan untuk sel yang masih hidup ditunjukkan dengan bentuk
yang lebih lonjong dan warna terang.
Perubahan morfologi sel perlu dianalisis lebih lanjut untuk mengetahui
kemampuan ekstrak etanol daun L. Officinalis Chaix dalam menginduksi
!
38
C. Uji Apoptosis Ekstrak Etanol Daun L. Officinalis Chaix dengan Metode Annexin V Fluos
Metode Annexin V Fluos digunakan dalam penelitian ini untuk
mengetahui jalur kematian sel akibat pemberian ekstrak etanol daun L. Officinalis
Chaix. Metode ini dipilih karena dapat memberikan hasil kuantitatif yang cepat
untuk mengetahui jumlah sel yang mengalami apoptosi melalui flow cytometer
dan dapat membedakan sel yang mengalami nekrosis maupun sel yang mengalami
apoptosis menggunakan reagen Annexin V Fluos dan Propidium Iodin (Pi).
Mekanisme kematian sel dapat dibagi menjadi dua yaitu melalui mekanisme
apoptosis dan nekrosis, proses kematian sel melalui mekanisme apoptosis penting
digunakan sebagai indikasi selektifitas ekstrak etanol daun L.officinalis Chaix
sebagai agen kemopreventif. Mekanisme kematian sel dapat dilihat dari
persentase total sel di setiap kuadran dengan menggunakan metode Annexin V
Fluos. Hasil Annexin V Fluos kemudian dianalisis menggunakan alat bernama
FACSCalibur (Gambar 10)
!
Gambar 10. Hasil pembacaan flow cytometer: (A) Kontrol sel; (B) Ekstrak etanol daun L.officinalis Chaix; (C) Tamoxifen
Tabel III. Persentase jumlah sel kanker payudara T47D pada setiap kuadran
Kontrol sel
Ekstrak etanol daun L.officinalis
Chaix
Tamoxifen
Kuadran I
(Sel hidup) 91,85% 5,51% 4,55%
Kuadran II (Early apoptosis)
6,24% 25,27% 65,61%
Kuadran III (Late apoptosis)
1,75% 52,83% 27,62%
Kuadran IV