AKTIVITAS SITOTOKSIK DAUN AFRIKA (Vernonia amygdalina Delile) YANG DIEKSTRAKSI SECARA REFLUKS
TERHADAP SEL KANKER PAYUDARA DAN KOLON SKRIPSI
OLEH:
SHINTIA LEONI PUTRI 171501129
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2022
AKTIVITAS SITOTOKSIK DAUN AFRIKA (Vernonia amygdalina Delile) YANG DIEKSTRAKSI SECARA REFLUKS
TERHADAP SEL KANKER PAYUDARA DAN KOLON SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
SHINTIA LEONI PUTRI 171501129
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2022
PENGESAHAN SKttPSI
AKTIVITAS SITOTOKSIK DAUN AFRIIい
L(ンセ″′Jθ′,f″″″●
=JJrFrlirrr Delile)ヽ
'ANG DIEKSTRAKSISECARA REFLliKS TERItIADAP SEL KANKER PAY■ iDARA DAN KOLON
OLEH:
SHINTIA LEONI PI:TRI
171501129
Dipertallalllkall di IIadapall Pcllgllli Sklipsi Fakllita=Farlllasi tI■ ivei sitas Stll■ atera IItala:nati〔lT,11lJg【ll: 14J31llitiri 2()22
Disetttui`漁漁:
rel.bi濃 蝿 :
袖
甕電
i聖.P,ptt A.詭si疑亀 M.Si.,rtttNIP 197鏑1020051012003
Pauitia Pcnguji,
Dttli韓饉ぬ奪,M.Si.,勇ド.
2(){)5012('04
凡
■o■ Df.PoppyプL目膿sibじ額、M,Si.,Apt.
Ketlla Program S無義 Sattalla Fal■lasl, ヽIP 1915(Xl()20()5(,12t)13
N ︲P 腑 ilr SurnarfEli ft st .+pt.
ヽIP 1977122620〔)ヽ122()1)2
SilonE,M=Si..Apt, 19531t,3()1980()311)()2
:.,M,PhaFrLt.,Ph.D_.Apt.
91802152t)1)ぶ 102(1()l
KATA PENGANTAR
Bismillahirrahmanirrahim,
Puji dan syukur kehadirat Allah SWT yang Maha Kuasa yang telah melimpahkan rahmat, taufik dan hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi ini yang berjudul “Aktivitas Sitotoksik Daun Afrika (Vernonia amygdalina Delile) yang diekstraksi Secara Refluks Terhadap Sel Kanker Payudara dan Kolon” sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan terima kasih kepada kepada Dekan Fakultas Farmasi Universitas Sumatera Utara, Ibu Khairunnisa, S.Si., M.Pharm., Ph.D., Apt. yang telah memberikan bantuan dan fasilitas selama masa pendidikan. Ibu Prof. Dr.
Poppy Anjelisa Zaitun Hasibuan, S.Si., M.Si., Apt. sebagai dosen pembimbing skripsi dan akademik yang telah membimbing dengan tulus, ikhlas serta penuh kesabaran dalam proses penelitian dan penulisan skripsi, Ibu Dr. Aminah Dalimunthe, S.Si., M.Si., Apt dan Bapak Dr. Drs. Panal Sitorus, M.Si., Apt.
selaku dosen penguji yang telah memberikan saran yang membangun dalam penulisan skripsi ini.
Pada kesempatan ini penulis secara tulus menyampaikan terima kasih sebesar-besarnya kepada orang tua tercinta Ayahanda Edimartalius dan Ibunda Nila Wati juga kepada adikku tersayang Shelbi Leoni Putri yang telah memberikan dukungan, doa, dan masukan selama proses pendidikan hingga penyelesaian skripsi ini. Penulis juga mengucapkan terima kasih kepada sahabat terdekat, Ririn, Gebri, Nanda, Dinda, Amirah, Ica, Nahda, Jasmine, Nari, Shania,
dan Nur Azizah juga Asisten Farmasi Komunitas serta teman-teman lainnya yang telah menjadi pendengar keluh kesah serta memberikan semangat, dukungan, bantuan, saran dan doa selama penyusunan skripsi ini. Penulis juga mengucapkan terima kasih kepada kucing-kucing penulis, Lulu, Wally, Ani, dan Ana yang menemani dan memotivasi penulis selama penyusunan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, sehingga penulis mengharapkan kritik dan saran yang bersifat membangun. Akhir kata, semoga tulisan ini bermanfaat bagi pembaca dan memberikan ilmu pengetahuan khususnya dalam bidang ilmu farmasi.
Medan, 14 Januari 2022 Penulis
Shintia Leoni Putri 171501129
AKTIVITAS SITOTOKSIK DAUN AFRIKA (Vernonia amygdalina Delile) YANG DIEKSTRAKSI SECARA REFLUKS
TERHADAP SEL KANKER PAYUDARA DAN KOLON ABSTRAK
Latar Belakang: Kanker payudara merupakan penyakit kanker yang banyak ditemui di Indonesia maupun negara lain. Begitupun kanker kolon, juga terus berkembang di dunia. Tumbuhan daun afrika (Vernonia amygdalina Delile) mengandung metabolit sekunder yaitu flavonoid, tannin, saponin, terpenoid, alkaloid, seskuiterpen lakton, triterpenoid, asam amino, dan kardiotonik.
Tumbuhan ini digunakan sebagai obat tradisional yang digunakan dalam pengobatan diabetes, malaria dan kanker.
Tujuan penelitian: Penelitian ini bertujuan untuk mengetahui aktivitas sitotoksik ekstrak etanol daun afrika (EEDA) yang diekstraksi dengan metode refluks terhadap sel kanker payudara (T47D) dan sel kanker kolon (WiDr).
Metode penelitian: Pembuatan ekstrak dilakukan dengan metode refluks menggunakan pelarut etanol serta dilakukan karakterisasi dan skrining fitokimia terhadap serbuk simplisia. Dilakukan pengujian antioksidan dengan metode DPPH dan penetapan total fenol dan flavonoid sebagai uji pendukung. Pengujian sitotoksik dilakukan dengan metode MTT assay.
Hasil Penelitian: Hasil uji antioksidan EEDA memberikan nilai IC50 sebesar 103 μg/mL dengan kekuatan antioksidan yang sedang. Hasil penetapan total fenol EEDA sebesar 48,918 mg GAE/g sampel dan penetapan total flavonoid sebesar 10,122 mg EQ/g sampel. Hasil uji sitotoksik EEDA terhadap sel T47D memberikan nilai IC50 sebesar 811,374 μg/mL dan pada sel WiDr nilai IC50
sebesar 870,971 μg/mL.
Kesimpulan: Berdasarkan hasil penelitian dapat disimpulkan bahwa EEDA yang diekstraksi dengan metode refluks memiliki aktivitas sitotoksik yang kurang kuat terhadap sel kanker payudara dan juga terhadap sel kanker kolon.
Kata kunci: daun afrika, sel T47D, sel WiDr, sitotoksik.
CYTOTOXIC ACTIVITY OF REFLUX EXTRACTED AFRICAN LEAVES (Vernonia amygdalina Delile) AGAINST
BREAST AND COLON CANCER CELLS ABSTRACT
Background: Breast cancer is a cancer that is often found in Indonesia or other countries. Even so colon cancer, also continues to grow in the worlds. African leaves (Vernonia amygdalina Delile) contains various bioactive compounds flavonoids, tannins, saponins, terpenes, alkaloids, sesquiterpene lactones, triterpenoids, amino acids, dan cardiotonic. This plant is used as traditional medicine used in the treatment of diabetes, malaria and cancer.
Objective: This study aims to determine citotoxic activity of ethanol african leaves (EEDA) extracted by reflux method against breasr cancer cells (T47D) and colon cancer cells (WiDr).
Method: Preparation of extracts was done by reflux using ethanol as a solvent and phytochemical characterization and screening of simplicia. Antioxidant testing using DPPH method and determination of total phenols and flavonoids as a supporting test. The cytotoxic test of extract againts T47D cells and WiDr cells using the MTT assay method.
Results: The test result of EEDA antioxidant giving IC50 values of 103 μg/mL with the less strong effect. And the result from determination of total phenol giving IC50 value 48,918 mg GAE/g sample and for total flavonoids test gave IC50
value 10,122 mg EQ/g sample. The result of cytotoxic test against T47S cells giving IC50 value 811,374 μg/mL and on WiDr cells giving IC50 value 870,971 μg/mL.
Conclussion: Base on the result of the study, it can be concluded that EEDA extracted by reflux method has less strong cytotoxic activity against breast cancer cells and colon cancer cells.
Keywords: african leaves, T47D cells, WiDr cells, cytotoxic.
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
HALAMAN PERNYATAAN ORISINALITAS ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I ... 1
PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis ... 4
1.4 Tujuan Penelitian ... 5
1.5 Manfaat Penelitian ... 5
1.6 Kerangka Pikir Penelitian ... 6
BAB II ... 7
TINJAUAN PUSTAKA... 7
2.1 Uraian Tumbuhan ... 7
2.1.1 Sistematika tumbuhan ... 7
2.1.2 Nama asing tumbuhan ... 7
2.1.3 Morfologi tumbuhan ... 7
2.1.4 Khasiat tumbuhan ... 8
2.1.5 Metabolit sekunder tumbuhan ... 8
2.2 Ekstraksi ... 8
2.2.1 Ekstraksi dingin ... 9
2.2.2 Ekstraksi panas... 10
2.3 Kanker ... 11
2.3.1 Karsinogenesis ... 13
2.3.2 Kanker payudara ... 15
2.3.2.1 Sel T47D ... 17
2.3.3 Kanker kolon... 18
2.3.3.1 Sel WiDr ... 21
2.4 Doksorubisin ... 21
2.5 Antioksidan ... 23
2.6 Uji Sitotoksik ... 24
2.6.1 Uji sitotoksik menggunakan metode MTT ... 25
BAB III... 27
METODE PENELITIAN ... 27
3.1 Jenis Penelitian ... 27
3.2 Alat ... 27
3.3 Bahan ... 28
3.4 Pengumpulan dan Pengolahan Sampel ... 28
3.4.1 Pengambilan sampel ... 28
3.4.2 Identifikasi tumbuhan ... 28
3.4.3 Pengolahan sampel ... 28
3.4.4 Pembuatan ekstrak daun afrika (Vernonia amygdalina Delile) ... 29
3.5 Karakterisasi Sampel ... 29
3.5.1 Pemeriksaan makroskopik ... 29
3.5.2 Pemeriksaan mikroskopik... 30
3.5.3 Penetapan kadar air ... 30
3.5.4 Penetapan kadar sari larut dalam air ... 30
3.5.5 Penetapan kadar sari larut etanol ... 31
3.5.6 Penetapan kadar abu total ... 31
3.5.7 Penetapan kadar abu tidak larut asam ... 31
3.6 Pemeriksaan Senyawa Metabolit Sekunder... 32
3.6.1 Pemeriksaan alkaloida ... 32
3.6.2 Pemeriksaan flavonoida... 32
3.6.3 Pemeriksaan glikosida ... 33
3.6.4 Pemeriksaan saponin ... 33
3.6.5 Pemeriksaan tanin ... 33
3.6.7 Pemeriksaan steroid/triterpenoid ... 34
3.7 Pengujian Kemampuan Antioksidan Dengan Spektrofotometri Visibel ... 34
3.7.1 Prinsip metode pemerangkapan radikal bebas 1,1-Diphenyl-2- Picrylhydrazyl ... 34
3.7.2 Pembuatan larutan 1,1-Diphenyl-2-Picrylhydrazyl 0,5 mM ... 34
3.7.3 Pembuatan larutan uji ekstrak etanol daun afrika ... 35
3.7.4 Pembuatan larutan kuersetin ... 35
3.7.5 Penentuan panjang gelombang serapan maksimum ... 36
3.7.6 Waktu pengukuran ... 36
3.7.7 Penentuan persen pemerangkapan radikal bebas ... 36
3.7.8 Penentuan nilai inhibitory concentration ... 36
3.8 Penetapan Kadar Total Fenol... 37
3.8.1 Pembuatan larutan induk baku asam galat ... 37
3.8.2 Penentuan panjang gelombang maksimum asam galat ... 37
3.8.3 Pembuatan kurva kalibrasi asam galat ... 37
3.8.4 Penetapan kandungan total fenol ekstrak etanol daun afrika ... 38
3.9 Penetapan Kadar Total Flavonoid ... 38
3.9.1 Pembuatan larutan induk baku kuersetin ... 38
3.9.2 Penentuan panjang gelombang maksimum kuersetin ... 38
3.9.3 Pembuatan kurva kalibrasi kuersetin... 39
3.9.4 Penetapan kadar total flavonoid ekstrak ... 39
3.10 Sterilisasi Alat dan Bahan ... 39
3.11 Pembuatan Media ... 40
3.11.1 Pembuatan media Roswell Park Memorial Institute (RPMI) ... 40
3.11.2 Pembuatan media kultur lengkap (MK-RPMI)... 40
3.11.3 Pembuatan media Dulbecco’s Modified Eagle’s Medium (DMEM) ... 41
3.11.4 Pembuatan media kultur (MK-DMEM) ... 42
3.12 Penumbuhan Sel ... 42
3.12.1 Penumbuhan sel kanker payudara (T47D) ... 42
3.12.2 Subkultur sel kanker payudara (T47D) ... 43
3.12.3 Panen sel kanker payudara (T47D) ... 43
3.12.4 Penumbuhan sel kanker kolon (WiDr) ... 43
3.12.5 Subkultur sel kanker kolon (WiDr) ... 44
3.12.6 Panen sel kanker kolon (WiDr) ... 44
3.12.7 Perhitungan sel kanker payudara (T47D) dan sel kanker kolon (WiDr) .... 45
3.13 Pembuatan Larutan Uji ... 46
3.13.1 Pembuaran sari konsentrasi larutan uji ... 46
3.14 Uji sitotoksik ... 46
3.15 Analisis Nilai IC50 ... 47
BAB IV ... 48
HASIL DAN PEMBAHASAN ... 48
4.1 Hasil Identifikasi Tumbuhan ... 48
4.2 Hasil Simplisia dan Ekstrak ... 48
4.3 Karakterisasi Sampel ... 48
4.3.1 Hasil pemeriksaan makroskopik ... 48
4.3.2 Hasil pemeriksaan mikroskopik ... 49
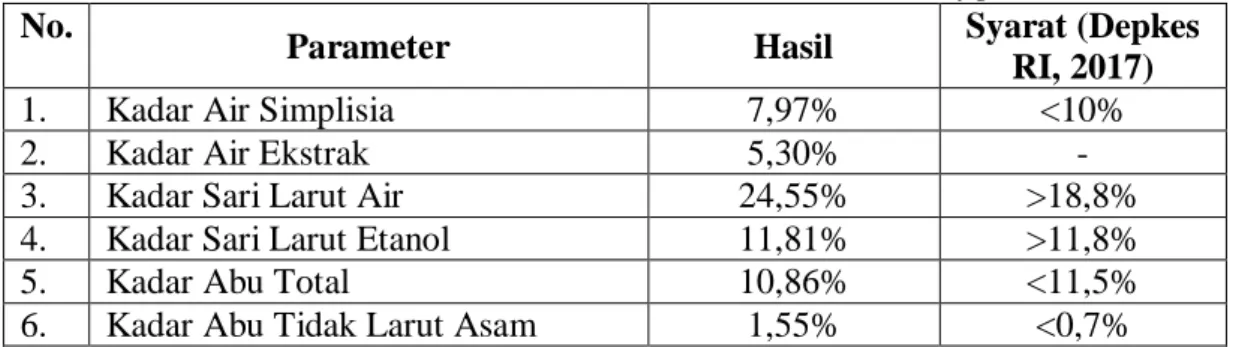
4.3.3 Hasil karakterisasi sampel ... 49
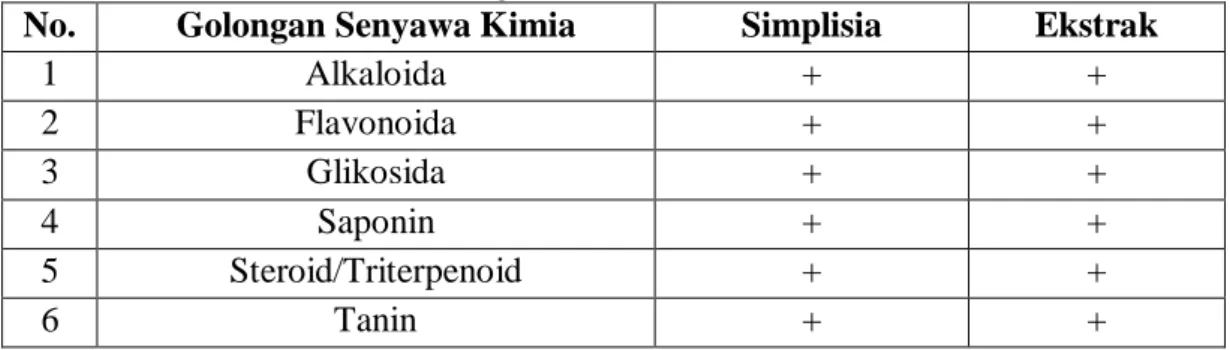
4.3.4 Hasil skrining fitokimia ... 51
4.4 Analisis Aktivitas Antioksidan ... 52
4.4.1 Hasil penentuan panjang gelombang serapan maksimum ... 52
4.4.2 Hasil analisis aktivitas antioksidan sampel uji ... 52
4.4.3 Hasil analisis nilai inhibitory concentration ... 53
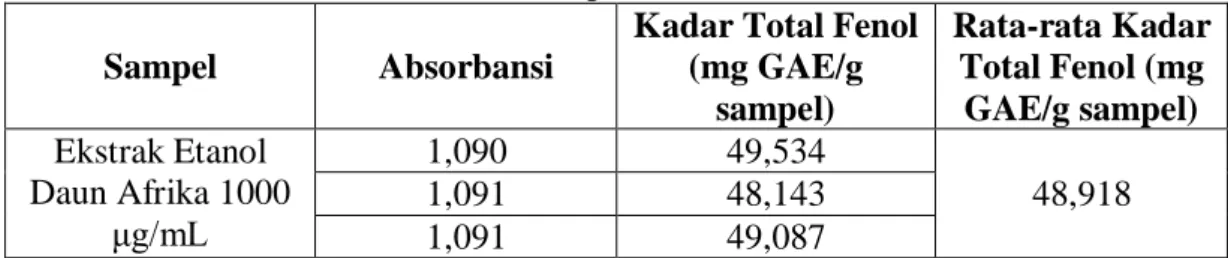
4.5 Penetapan Kadar Total Fenol... 54
4.5.1 Hasil penetapan kadar total fenol ... 54
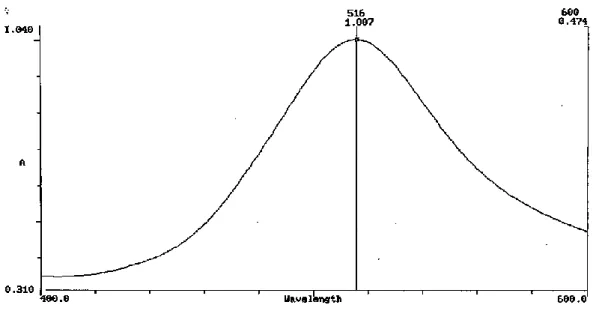
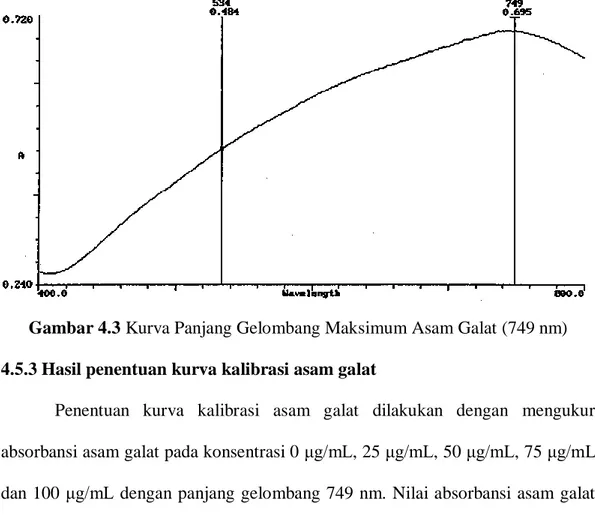
4.5.2 Hasil penentuan panjang gelombang serapan maksimum ... 55
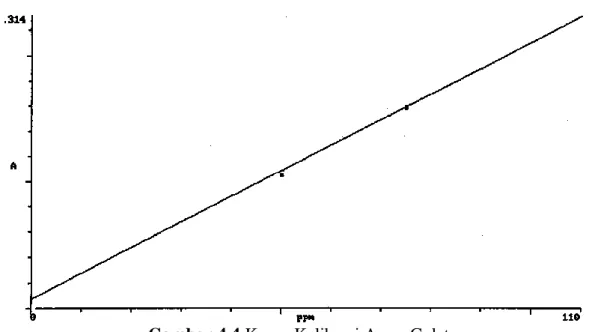
4.5.3 Hasil penentuan kurva kalibrasi asam galat ... 56
4.5.4 Hasil penentuan kadar total fenol pada ekstrak etanol daun afrika... 57
4.6 Penetapan Kadar Total Flavonoid ... 58
4.6.1 Hasil penetapan kadar total flavonoid ekstrak etanol daun afrika ... 58
4.6.2 Hasil penentuan panjang gelombang serapan maksimum ... 59
4.6.3 Hasil penentuan kurva kalibrasi kuersetin ... 59
4.6.4 Hasil penentuan kadar total flavonoid pada ekstrak etanol daun afrika ... 60
4.7 Uji Sitotoksik ... 61
BAB V ... 66
5.1 Kesimpulan ... 66
5.2 Saran ... 66
DAFTAR PUSTAKA ... 67
LAMPIRAN ... 71
DAFTAR TABEL
4.1 Hasil Karakterisasi Daun Afrika (Vernonia amygdalina Delile)... 49
4.2 Hasil Skrining Fitokimia Ekstrak Etanol Daun Afrika ... 51
4.3 Nilai Persen Peredaman DPPH dari Ekstrak Etanol Daun Afrika ... 53
4.4 Hasil Persamaan Regresi dan Nilai IC50 Sampel Uji dan Pembanding ... 53
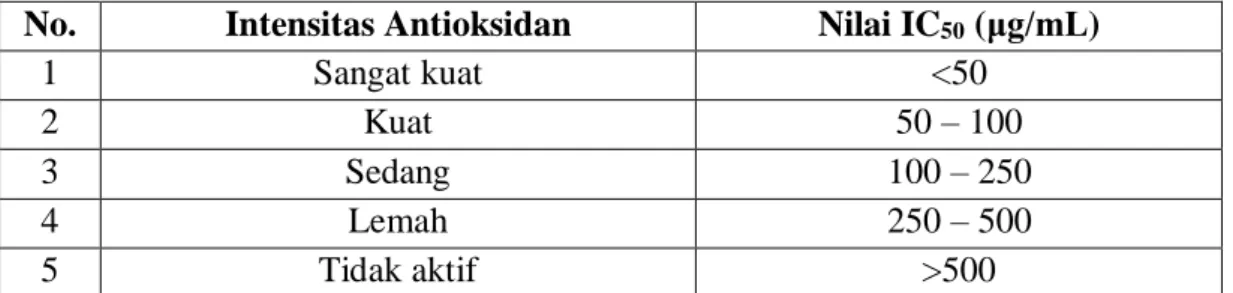
4.5 Kategori Nilai IC50 Sebagai Antioksidan ... 53
4.6 Nilai Absorbansi Asam Galat ... 56
4.7 Kadar Total Fenol pada Ekstrak Etanol Daun Afrika ... 58
4.8 Nilai Absorbansi Kuersetin ... 60
4.9 Kadar Total Flavonoid Ekstrak Etanol Daun Afrika ... 61
4.10 Nilai IC50 ... 62
DAFTAR GAMBAR
1.1 Kerangka Pikir Penelitian ... 6
3.1 Hemositometer, Alat yang digunakan untuk Menghitung Jumlah Sel ... 45
4.1 Panjang Gelombang Maksimum Larutan DPPH Konsentrasi 40 μg/mL dalam Metanol Menggunakan Spektrofotometri UV-Visibel ... 52
4.3 Kurva Panjang Gelombang Maksimum Asam Galat (749 nm) ... 56
4.4 Kurva Kalibrasi Asam Galat... 57
4.5 Kurva Panjang Gelombang Maksimum Kuersetin (433 nm) ... 59
4.6 Kurva Kalibrasi Kuersetin ... 60
4.7 Grafik Pengaruh Konsentrasi Terhadap Jumlah Kematian Sel T47D dan Sel WiDr. ... 64
DAFTAR LAMPIRAN
1. Hasil Identifikasi Daun Afrika... 71
2. Gambar Daun dan Simplisia Tumbuhan Daun Afrika ... 72
3. Gambar Alat ... 73
4. Bagan Kerja Pembuatan EEDA ... 74
5. Hasil Mikroskopik Serbuk Simplisia Daun Afrika ... 76
6. Perhitungan Rendemen Ekstrak dan Simplisia ... 77
7. Perhitungan Kadar Air ... 77
8. Perhitungan Kadar Sari Larut dalam Air Simplisia ... 78
9. Perhitungan Kadar Sari Larut dalam Etanol Simplisia ... 79
10. Perhitungan Kadar Abu Total Simplisia ... 79
11. Perhitungan Kadar Abu Tidak Larut dalam Asam Simplisia ... 80
12. Pengujian Aktivitas Antioksidan Ekstrak Etanol Daun Afrika ... 81
13. Perhitungan Nilai IC50 Ekstrak Etanol Daun Afrika ... 83
14. Pengujian Aktivitas Antioksidan Kuersetin sebagai Pembanding ... 83
15. Perhitungan Nilai IC50 Kuersetin ... 86
16. Perhitungan Persamaan Regresi dari Kurva Kalibrasi Asam Galat ... 87
17. Hasil Penetapan Kadar Total Fenol pada Ekstrak Etanol Daun Afrika ... 88
18. Perhitungan Kadar Total Fenol Estrak Etanol Daun Afrika ... 88
19. Perhitungan Persamaan Regresi Kurva Kalibrasi Kuersetin ... 89
20. Hasil Penetapan Kadar Total Flavonoid Ekstrak Etanol Daun Afrika... 90
21. Perhitungan Kadar Total Flavonoid Ekstrak Etanol Daun Afrika ... 90
22. Perhitungan Jumlah Sel T47D dan Sel WiDr yang digunakan ... 91
23. Perhitungan Konsentrasi Bahan Uji yang digunakan ... 92
24. Perhitungan Persen Viabilitas EEDA terhadap Sel T47D... 94
25. Perhitungan Persen Viabilitas Doksorubicin terhadap Sel T47D ... 94
26. Perhitungan Persen Viabilitas EEDA terhadap Sel WiDr ... 95
27. Perhitungan Persen Viabilitas Doksorubicin terhadap Sel WiDr ... 95
28. Hasil Perhitungan Nilai IC50 EEDA dan Doksorubicin terhadap Sel T47D dengan Analisa Probit SPSS 22 ... 96
29. Hasil Perhitungan Nilai IC50 EEDA dan Doksorubicin terhadap Sel WiDr dengan Analisa Probit SPSS 22 ... 98
BAB I PENDAHULUAN
1.1 Latar Belakang
Kanker merupakan salah satu penyakit mematikan yang terdapat pada setiap negara. Kanker bukan merupakan penyakit menular dan dapat terjadi di berbagai tempat di dalam tubuh. Proses terjadinya kanker disebabkan oleh pertumbuhan sel yang tidak beraturan yang berasal dari satu sel. Ketika sel–sel normal tidak berregulasi dengan semestinya, maka sel-sel tersebut akan berubah fungsi kerjanya sehingga dapat menyebabkan pertumbuhan jaringan abnormal (Ruddon, 2007).
Kanker payudara merupakan masalah besar di Indonesia maupun negara lain. Pada tahun 2003 di Amerika Serikat terdapat 211.300 orang dan 39.800 pasien meninggal akibat kanker payudara di tahun yang sama. Di Indonesia kanker payudara berada di urutan kedua sebagai kanker yang paling sering ditemukan pada perempuan, setelah kanker serviks. Jakarta Breast Cancer menyatakan bahwa pada April 2001 sampai April 2003 terdapat 2.834 orang yang memeriksakan benjolan di payudaranya, 2.229 diantaranya (78%) merupakan tumor jinak, 368 orang (13%) terdiagnosis kanker payudara dan sisanya merupakan infeksi dan kelainan bawaan payudara (Anggorowati, 2013).
Begitupun pada kanker kolon, di Indonesia tingkat kejadian kanker kolon per 100.000 orang ditemukan 17,2% dan pada kasus kematian 12,9%. Kanker kolon merupakan penyakit yang ditandai dengan perkembangan sel yang tidak terkendali pada lapisan epitel usus besar. Di Amerika Serikat kanker kolon menduduki peringkat ketiga dalam jumlah kasus kejadian dan kasus kematian.
Angka kejadian per tahun sekitar satu juta kasus dengan angka kematian lebih dari 500.000. Jumlah kasus tersebut diperkirakan meningkat selama dua dekade berikutnya sebagai akibat dari berkembangnya populasi, baik di negara maju maupun berkembang (Mustikasari dan Santoso, 2013; Susanty dkk., 2018).
Upaya yang dilakukan untuk menangani penyakit kanker dapat dilakukan dengan pembedahan, kemoterapi dan radioterapi. Pengobatan kanker dilakukan sesuai dengan tingkat keparahan penyakit kanker. Doksorubisin merupakan salah satu obat antikanker yang biasa digunakan pada kemoterapi. Mekanisme kerja doksorubisin melibatkan ikatan dengan lipid membran sel yang akan mengubah berbagai fungsi selular dan berinteraksi dengan topoisomerase II membentuk kompleks pemotong DNA sehingga terjadi penghambatan pertumbuhan sel (Tyagi dkk., 2004).
Kini pengobatan tradisional merupakan salah satu alternatif yang dapat dikembangkan sebagai obat antikanker. Tumbuhan yang memiliki kandungan metabolit sekunder seperti alkaloid, saponin, triterpenoid, glikosida diketahui memiliki aktivitas yang baik sebagai antikanker secara in vitro dan in vivo.
Tumbuhan afrika (Vernonia amygdalina Delile) mengandung metabolit sekunder yaitu flavonoid, tannin, saponin, terpenoid, alkaloid, seskuiterpen lakton, triterpenoid, asam amino, dan kardiotonik (Febrianti dkk., 2017; Pratiwi dan Gunawan, 2018).
Aktivitas daun afrika sebagai antikanker telah banyak diuji baik secara in vitro maupun in vivo. Ekstrak etanol daun afrika yang diekstraksi dengan metode
maserasi memiliki aktivitas sitotoksik yang cukup kuat pada sel WiDr. Aktivitas sitotoksiknya ditunjukkan dari nilai IC50 ekstrak etanol daun afrika sebesar 321,131 μg/mL (Bestari dkk., 2017). Dan pada sel T47D ekstrak etanol daun
afrika (EEDA) yang diekstraksi dengan metode maserasi memiliki aktivitas sitotoksik dengan nilai IC50 sebesar 311,72 μg/mL (Lifiani dkk., 2018).
Maserasi merupakan metode ekstraksi secara dingin. Metode ini memiliki beberapa kelemahan yaitu membutuhkan waktu ekstraksi yang lama dan menggunakan pelarut dengan jumlah yang banyak. Sedangkan refluks merupakan metode ekstraksi secara panas, dengan pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Metode refluks memiliki waktu ekstraksi yang singkat dan penggunaan pelarut yang sedikit (Depkes RI, 2000; Sarker dkk., 2006).
Uji sitotoksik merupakan uji toksisitas secara in vitro menggunakan kultur sel yang digunakan untuk mendeteksi adanya aktivitas antineoplastik dari suatu senyawa. Senyawa sitotoksik adalah senyawa yang bersifat toksik terhadap sel tumor secara in vitro dan jika toksisitas ini ditransfer menembus sel tumor (in vivo), senyawa tersebut mempunyai aktivitas antitumor (Freshney, 2000).
Berdasarkan uraian di atas, peneliti tertarik melakukan pengujian terhadap aktivitas sitotoksik daun afrika yang diekstraksi dengan metode refluks. Penelitian dilakukan dengan menilai aktivitas sitotoksik ekstrak etanol daun afrika yang diekstraksi dengan metode refluks. Uji ini dilakukan secara in vitro menggunakan sel kanker payudara dan sel kanker kolon yang sudah diisolasi, yaitu sel T47D sebagai sel kanker payudara dan sel WiDr sebagai sel kanker kolon.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, perumusan masalah dari penelitian ini adalah:
a. Apakah ekstrak etanol daun afrika yang diekstraksi secara refluks memiliki aktivitas antioksidan?
b. Berapakah kadar total fenol dan total flavonoid total pada ekstrak etanol daun afrika yang diekstraksi secara refluks?
c. Apakah ekstrak etanol daun afrika yang diekstraksi secara refluks memiliki aktivitas sitotoksik terhadap sel kanker payudara (T47D)?
d. Apakah ekstrak etanol daun afrika yang diekstraksi secara refluks memilliki aktivitas sitotoksik terhadap sel kanker kolon (WiDr)?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, hipotesis dari penelitian ini adalah:
a. Ekstrak etanol daun afrika yang diekstraksi secara refluks memiliki aktivitas antioksidan.
b. Ekstrak etanol daun afrika yang diekstraksi secara refluks memiliki kadar total fenol dan total flavonoid dalam jumlah tertentu.
c. Ekstrak etanol daun afrika yang diekstraksi secara refluks memiliki aktivitas sitotoksik terhadap sel kanker payudara (T47D).
d. Ekstrak etanol daun afrika yang diekstraksi secara refluks memiliki aktivitas sitotoksik terhadap sel kanker kolon (WiDr).
1.4 Tujuan Penelitian
Berdasarkan perumusan masalah dan hipotesis di atas, tujuan dari penelitian ini adalah:
a. Untuk menguji aktivitas antioksidan ekstrak etanol daun afrika yang diekstraksi secara refluks.
b. Untuk mengetahui kadar total fenol dan total flavonoid yang terkandung dalam ekstrak etanol daun afrika yang diekstraksi secara refluks.
c. Untuk menguji aktivitas sitotoksik ekstrak etanol daun afrika yang diekstraksi secara refluks pada sel kanker payudara (T47D).
d. Untuk menguji aktivitas sitotoksik ekstrak etanol daun afrika yang diekstraksi secara refluks pada sel kanker kolon (WiDr).
1.5 Manfaat Penelitian
Manfaat dari penelitian ini adalah memberikan informasi ilmiah kepada tenaga kesehatan khususnya farmasi, bahwa ekstrak etanol daun afrika yang diekstraksi secara refluks memiliki aktivitas sitotoksik yang dapat digunakan sebagai antikanker payudara dan kolon sehingga dapat dimanfaatkan sebagai obat tradisional yang bersifat antikanker.
1.6 Kerangka Pikir Penelitian
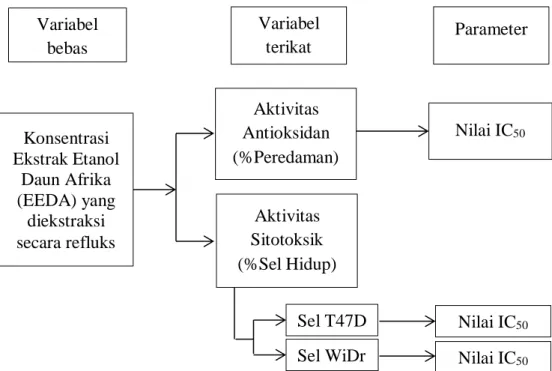
Berdasarkan uraian yang telah dijelaskan, maka tersusun kerangka pikir penelitian dengan subjek adalah sel kanker payudara (T47D) dan sel kanker kolon (WiDr), didukung variabel bebas ekstrak etanol daun afrika yang diekstraksi secara refluks dan variabel terikat uji aktivitas antioksidan dan sitotoksik.
Gambar 1.1 Kerangka pikir penelitian Variabel
bebas
Variabel terikat
Parameter
Konsentrasi Ekstrak Etanol
Daun Afrika (EEDA) yang
diekstraksi secara refluks
Aktivitas Sitotoksik (%Sel Hidup)
Nilai IC50
Aktivitas Antioksidan (%Peredaman)
Nilai IC50
Sel T47D
Sel WiDr Nilai IC50
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan 2.1.1 Sistematika tumbuhan
Klasifikasi dari tumbuhan afrika (Vernonia amygdalina) menurut Laboratorium Herbarium Medanense (2021) sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dicotyledoneae Ordo : Asterales Famili : Asteraceae Genus : Vernonia
Spesies : Vernonia amygdalina Delile Nama lokal : Daun Afrika
2.1.2 Nama asing tumbuhan
Di Indonesia tumbuhan ini dikenal sebagai Daun Afrika. Dalam bahasa Inggris tumbuhan ini biasa disebut bitter leaf (daun pahit), Onugbu dalam bahasa Igbo, Etidot di Efik, Ijaw, dan Ibibio, Ewuro dalam bahasa Yoruba, Oriwo di Edo dan Chusa-doki di Hausa (Johnson dkk., 2015).
2.1.3 Morfologi tumbuhan
Daun afrika (Vernonia amygdalina) merupakan tumbuhan semak atau pohon dengan ukuran kecil. Tumbuhan ini dapat tumbuh hingga ketinggian 2,5 m dengan diameter 6 m. Tumbuhan ini mempunyai daun dengan bentuk elips seperti telur memanjang sampai jorong, pangkal dan ujung daun runcing, tepi bergerigi,
menggulung ke permukaan atas, kedua permukaan sedikit kasar, pertulangan daun menyirip dengan ibu tulang daun pada permukaan bawah menonjol, kedua permukaan halus dengan panjang hingga 20 cm dan mempunyai rambut halus di bagian bawah tumbuhan. Daun dari tumbuhan ini berwarna hijau dan bau yang khas serta rasa yang pahit. Tumbuhan afrika mempunyai cabang–cabang yang rapuh dan mudah patah. Tumbuhan ini juga memiliki bunga–bunga kecil berwarna putih dan berkerumun (Depkes, 2017; Pratiwi dan Gunawan, 2018).
2.1.4 Khasiat tumbuhan
Bagian daun dari tumbuhan afrika digunakan sebagai obat antidiabetes, antimalaria, dan antikanker. Metabolit sekunder dari daun afrika juga diketahui dapat membunuh parasit penyebab schistosomiasis, malaria leishmaniasis, antiamoeba, antitumor, dan antimikroba. Selain itu, daun afrika juga dapat membantu menyembuhkan insomnia, membantu mencegah penyakit stroke, menstabilkan tekanan darah, dan mencegah penyakit jantung (Febrianti dkk., 2017; Pratiwi dan Gunawan, 2018).
2.1.5 Metabolit sekunder tumbuhan
Tumbuhan afrika mengandung metabolit sekunder yaitu flavonoid, tannin, saponin, terpenoid, alkaloid, seskueterpen lakton, dan triterpenoid (Febrianti dkk., 2017; Pratiwi dan Gunawan, 2018).
2.2 Ekstraksi
Ekstraksi adalah salah satu teknik pemisahan kimia yang digunakan untuk memisahkan atau menarik satu atau lebih komponen atau senyawa–senyawa (analit) dari suatu sampel dengan menggunakan pelarut yang sesuai (Leba, 2017).
Ekstrak tumbuhan obat yang dibuat dari simplisia nabati dapat dikatakan sebagai bahan awal, bahan antara atau bahan produk jadi. Ekstrak sebagai bahan awal dianalogkan dengan komoditi bahan baku obat yang dengan teknologi fitofarmasi diproses menjadi produk jadi. Ekstrak dikatakan sebagai bahan antara berarti masih menjadi bahan yang dapat diproses lagi menjadi fraksi-fraksi, isolat senyawa tunggal ataupun tetap sebagai campuran dengan ekstrak lainnya. Ekstrak yang dikatakan sebagai produk jadi berarti ekstrak yang berada dalam sediaan obat jadi siap digunakan (Depkes RI, 2000).
Dalam memperoleh suatu ekstrak proses yang dilalui cukup panjang dan melibatkan banyak faktor. Proses yang dilalui adalah pengeringan tanaman segar, lalu selanjutnya hasil olahan diserbukkan dan disari. Penyarian atau ekstraksi juga melibatkan larutan penyari. Ekstrak yang dihasilkan berupa ekstrak cair yang kemudian dipekatkan dengan cara menghilangkan atau mengurangi cairan penyari menjadi ekstrak kental atau bahkan menjadi ekstrak yang kering (Najib, 2018).
Pemilihan pelarut sangat penting dalam ekstraksi pelarut. Selektivitas, solubilitas, harga, dan keamanan harus menjadi pertimbangan dalam pemilihan pelarut. Berdasarkan kelarutannya, pelarut dengan kepolaran yang mendekati polaritas larutan bekerja dengan baik. Alkohol (EtOh dan MeOh) merupakan pelarut umum dalam ekstraksi untuk identifikasi fitokimia (Zhang dkk., 2018).
2.2.1 Ekstraksi dingin a. Maserasi
Maserasi merupakan metode ekstraksi dengan menggunakan pelarut diam atau dengan adanya pengadukan beberapa kali pada suhu ruangan. Metode ini dapat dilakukan dengan cara merendam bahan dengan sekali-sekali dilakukan pengadukan. Pada umumnya perendaman dilakukan selama 24 jam, kemudian
pelarut yang digunakan diganti dengan pelarut baru. Maserasi juga dapat dilakukan dengan pengadukan secara sinambung (maserasi kinetik). Kelebihan dari metode ini yaitu efektif untuk senyawa yang tidak tahan panas (terdegradasi karena panas). Namun metode ini juga memiliki beberapa kelemahan yaitu waktu untuk ekstraksi yang lama, membutuhkan pelarut dalam jumlah yang banyak, dan kemungkinan adanya senyawa tertentu yang tidak dapat diekstrak karena kelarutannya yang rendah pada suhu ruang (Sarker dkk., 2006).
b. Perkolasi
Perkolasi merupakan proses penyarian simplisia dengan cara melewatkan pelarut yang sesuai secara lambat pada simplisia dalam suatu percolator.
Perkolasi bertujuan supaya zat berkhasiat tertarik seluruhnya dan biasanya dilakukan untuk zat berkhasiat yang tahan ataupun tidak tahan pemanasan.
Prosedur metode ini yaitu bahan direndam dengan pelarut, kemudian pelarut baru dialirkan secara terus menerus sampai warna pelarut tidak lagi berwarna atau tetap bening yang berarti sudah tidak ada lagi senyawa yang terlarut. Kelebihan dari metode ini adalah tidak memerlukan proses tambahan untuk memisahkan padatan dengan ekstrak, sedangkan kelemahannya adalah jumlah pelarut yang dibutuhkan cukup banyak dan proses pengerjaan yang cukup lama, serta tidak meratanya kontak antara padatan dengan pelarut (Sarker dkk., 2006).
2.2.2 Ekstraksi panas a. Refluks
Refluks merupakan salah satu metode ekstraksi dengan cara panas.
Metode refluks dilakukan dengan ekstraksi pelarut pada temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna (Depkes RI, 2000).
Ekstraksi secara refluks diketahui lebih efisien daripada ekstraksi secara perkolasi dan maserasi karena membutuhkan waktu dan pelarut yang lebih sedikit (Zhang dkk., 2018).
b. Sokletasi
Ekstraksi dengan alat soklet merupakan ekstraksi dengan pelarut yang selalu baru, umumnya dilakukan menggunakan alat khusus sehingga terjadi ekstraksi konstan dengan adanya pendingin balik (kondensor). Pada metode ini, padatan disimpan dalam alat soklet dan tidak dipanaskan, sedangkan yang dipanaskan hanyalah pelarutnya. Pelarut terdinginkan dalam kondensor, kemudian mengekstraksi simplisia. Kelebihan metode ini adalah proses ekstraksi berlangsung secara kontinu, memerlukan waktu ekstraksi yang lebih sedikit dan jumlah pelarut yang lebih sedikit bila dibandingkan dengan metode maserasi dan perkolasi. Kelemahan metode ini adalah dapat menyebabkan rusaknya komponen lainnya yang tidak tahan panas karena pemanasan ekstrak yang dilakukan secara terus menerus (Sarker dkk., 2006).
2.3 Kanker
Kanker merupakan penyakit yang ditandai dengan pergeseran mekanisme kontrol yang mengatur kelangsungan hidup, proliferasi, dan diferensiasi sel. Sel yang telah mengalami transformasi neoplastik biasanya mengeskpresikan antigen permukaan sel yang dapat merupakan tipe fetal normal, dapat menunjukkan tanda–tanda nyata imaturitas lain, dan dapat menunjukkan kelainan kromosom kualitatif atau kuantitatif, termasuk berbagai translokasi dan munculnya sekuens
gen teramplifikasi. Sel tersebut berproliferasi secara berlebihan dan membentuk tumor lokal yang dapat menekan atau menginvasi struktur normal di sekitarnya.
Suatu subpopulasi sel kecil di dalam tumor disebut sebagai sel tunas tumor (tumor stem cell). Sel–sel ini mampu menjalani siklus proliferasi berulang kali serta
bermigrasi ke tempat terdalam di tubuh untuk mengkolonisasi berbagai organ dalam suatu proses yaitu metastatis. Dengan hal tersebut, tumor stem cell tersebut dapat mengekspresikan kemampuan klonogenik atau pembentukan-koloni. Sel tunas tumor (stem cell tumor) memiliki ciri yakni adanya kelainan kromosom yang menggambarkan ketidakstabilan genetiknya, ketidakstabilan ini menyebabkan terjadinya seleksi progresif subklon yang dapat bertahan hidup lebih baik dalam lingkungan multiseluler penerima. Kelainan kuantitatif di berbagai jalur metabolik serta di komponen sel menyertai perkembangan neoplastik ini. Proses invasif dan metastatik serta serangkaian kelainan metabolik yang terjadi akibat kanker menimbulkan penyakit yang berujung pada kematian, kecuali neoplasma jinak dapat dieradikasi dengan terapi (Katzung, 2007).
Kanker adalah pembentukan jaringan baru yang abnormal dan bersifat ganas yang memperbanyak diri terus–menerus (proliferasi). Sel yang terus berproliferasi akan menyebabkan pembengkakan atau benjolan yang disebut tumor atau neoplasma. Sel–sel kanker ini akan menginfiltrasi dan membunuh jaringan–jaringan disekitarnya. Sel yang berproliferasi pada satu tempat disebut tumor primer, dimana tumor primer ini sering kali menyebarkan sel–selnya melalui aliran darah dan limfe ke tempat lain di tubuh (metastase), dan selanjutnya akan berkembang menjadi tumor sekunder (Tjay dan Rahardja, 2007).
Proses pertumbuhan kanker dapat disebabkan oleh beberapa proses yang berlangsung keliru. Berikut merupakan proses–proses yang berlangsung keliru:
a. Terdapat gangguan dalam pembelahan sel dan pembentukan sel–sel baru yang terlalu aktif, sehingga proses pembentukan sel berlangsung terus- menerus.
b. Terdapat gangguan pada proses apoptosis. Pada kanker, sel–sel tua yang seharusnya mengalami apoptosis akan diperlambat prosesnya.
c. Terdapat gangguan pada proses perkembangan sel, dimana sel tetap muda.
Hal ini dapat menyebabkan gangguan pada perkembangan organ–organ tubuh.
d. Sel memiliki kemampuan untuk bermigrasi sehingga sel–sel kanker dapat tersebar ke organ tubuh lainnya. Proses penyebaran kanker ini disebut metastasis (Jong, 2002).
2.3.1 Karsinogenesis
Karsinogenesis adalah suatu proses yang bertahap, dengan setiap tahap disertai perubahan genetik yang spesifik. Hal ini didasarkan oleh hasil pengamatan epidemiologis, patologi, dan eksperimental. Pengamatan epidemiologis menyatakan adanya fenomena kanker yang meningkat dengan bertambahnya usia. Pengamatan patologis menyatakan adanya sel–sel yang berada pada berbagai macam tahap perkembangan maligna di spesimen kanker.
Sedangkan pengamatan eksperimental menyatakan dibutuhkannya beberapa perubahan genetik pada sel tikus yang dikultur sebelum sel memiliki sifat–sifat tumor (Haryono dkk., 2018).
Pada beberapa jenis kanker terdapat satu faktor yang dominan dalam menimbulkan kanker, seperti sinar ultraviolet yang dapat menimbulkan kanker kulit dan kelainan kromosom yang menimbulkan retinoblastoma (Kartawiguna, 2001).
Karsinogenesis yang diinduksi karsinogen kimia atau fisik maupun biologik memerlukan waktu yang disebut periode laten yaitu waktu dari pertama kali terpapar suatu karsinogen sampai terlihat kanker secara klinis. Periode laten pada setiap kanker berbeda–beda, namun seringkali pada kebanyakan kanker selama 20 tahun atau lebih. Efek karsinogen yang lemah dapat tidak terlihat, sebab periode latennya melampaui masa hidup seseorang (Kartawiguna, 2001).
Proses timbulnya kanker dapat terjadi melalui beberapa tingkat, yaitu:
a. Fase inisiasi: fase dimana DNA rusak akibat radiasi atau zat karsinogen (radikal bebas). Zat–zat ini mengganggu proses reparasi normal, sehingga terjadi mutasi DNA dengan kelainan pada kromosomnya. Lalu kerusakan DNA yang terjadi diteruskan pada anak–anak sel dan seterusnya.
b. Fase promosi: fase dimana zat karsinogen tambahan (co-carcinogens) diperlukan sebagai promotor untuk terjadinya proliferasi sel, sehingga sel–sel menjadi rusak dan ganas.
c. Fase progresi: gen–gen pertumbuhan yang diaktivasi oleh kerusakan DNA mengakibatkan proses mitose dipercepat dan pertumbuhan liar dari sel–sel ganas (Tjay dan Rahardja, 2007).
Berdasarkan penyelidikan epidemiologis, didapatkan bahwa asap rokok sebagai karsinogen dan debu asbes sebagai ko-karsinogen dapat menimbulkan kanker paru lebih cepat pada pekerja yang merokok dan menghirup debu asbes dibandingkan yang tidak mengisap asap rokok saja, karena ko-karsinogen dapat membantu karsinogen dalam menimbulkan kanker menjadi lebih efektif dan juga bahan yang menghambat mekanisme pertahanan tubuh membantu timbulnya kanker (Kartawiguna, 2001).
Penyebab terjadinya kanker dapat disebabkan oleh faktor eksternal yang berasal dari lingkungan dan faktor internal yang berasal dari tubuh, seperti predisposisi genetik dan ketidakteraturan metabolisme. Beberapa faktor eksternal penyebab kanker sebagian besar dapat di atasi dengan mencegah paparan dari faktor tersebut, seperti berhenti merokok dan menghindari kontak dengan perokok, memberikan terapi pada pasien yang terinfeksi kronis bakteri, menyediakan lingkungan yang bebas dari paparan asbes, dan menghindari zat–zat karsinogen. Zat karsinogen merupakan zat–zat yang dapat menyebabkan tumor melalui kontak dengan zat tersebut (lokal, inhalasi) atau secara oral (usus).
terdapat banyak zat kimiawi yang bersifat karsinogen, misalnya ter yang terbentuk dari pembakaran tembakau dan kertas (rokok), selain itu antara serat–
serat asbes dan nikel yang terdapat di udara juga merupakan zat karsinogen.
Selain itu terdapat juga obat-obat yang bekerja karsinogen yaitu zat alkilasi, azatioprin, doksorubisin, daunorubisin, dan prokarbazin. Selain obat, makanan juga ada yang mengandung zat karsinogen seperti nitromisin (pada lemak babi), nitrat (pada sayuran yang dibiakkan dengan pupuk buatan berlebihan). Benzpiren (terbentuk saat pemanasan daging dan ikan di atas api langsung pada bagian yang terbakar hitam atau hangus), dan lain–lain (Tjay dan Rahardja, 2007; Haryono dkk., 2018).
2.3.2 Kanker payudara
Kanker payudara merupakan masalah besar di Indonesia maupun negara lain. Pada tahun 2003 di Amerika Serikat terdapat 211.300 orang dan 39.800 pasien meninggal akibat kanker payudara di tahun yang sama. Di Indonesia kanker payudara berada di urutan kedua sebagai kanker yang paling sering ditemukan pada perempuan, setelah kanker serviks. Jakarta Breast Cancer
menyatakan bahwa pada April 2001 sampai April 2003 terdapat 2.834 orang yang memeriksakan benjolan di payudaranya, 2.229 diantaranya (78%) merupakan tumor jinak, 368 orang (13%) terdiagnosis kanker payudara dan sisanya merupakan infeksi dan kelainan bawaan payudara (Anggorowati, 2013).
Pada stadium awal kanker payudara, tidak ditemukan rasa sakit dan rasa ketidaknyamanan, dengan tidak adanya keluhan pada awal terjadinya kanker, hal tersebut menimbulkan gumpalan atau benjolan pada daerah sekitar payudara atau di area di bawah lengan, perubahan ukuran atau bentuk dari payudara, menonjolnya puting atau nyeri saat ditekan, pembengkakan, kemerahan, atau penskalaan pada kulit payudara, areola, dan puting (Panno, 2005)
Terdapat 3 faktor risiko utama yang terkait dengan kedua bentuk kanker payudara: mutasi pada 2 gen (BRCA1 dan BRCA2), paparan estrogen, dan terlambat melahirkan. Kode gen 1 dan 2 kanker payudara untuk protein–protein yang membutuhkan untuk memperbaiki kesalahan pada sintesis DNA selama siklus sel. Estrogen bertanggung jawab untuk menstimulasi payudara sebagai bagian fisiologi reproduktif normal namun dari waktu ke waktu dapat menyebabkan transformasi pada saluran sel. Hubungan antara terlambat melahirkan dan kanker payudara masih belum jelas (Panno, 2005).
Setiap payudara memiliki 15 hingga 20 bagian yang disebut lobus.
Dimana setiap lobus terdiri dari banyak lobulus. Lobulus berakhir dengan banyaknya bulbs yang dapat memproduksi susu. Saluran ini mengarah ke puting yang berapa di tengah area gelap dari kulit yang disebut areola. Pada payudara tidak terdapat otot, namun otot terdapat di bawah setiap payudara yang tertutupi oleh tulang rusuk. Payudara juga terdiri dari pembuluh darah dan pembuluh untuk sistem limpatik, yang dimana terdapat banyak kelenjar getah bening yang
ditemukan di seluruh tubuh. Banyak kelenjar getah bening ditemukan didaerah sekitar payudara, di bawah lengan, diantara tulang selangka, dan di dada. Jenis kanker payudara yang paling umum adalah karsinoma duktal, yang dimulai pada lapisan pembuluh. Jenis kedua yang sering muncul di lobus yang disebut lobulus karsinoma (lobular carcinoma) (Panno, 2005).
Kanker payudara dapat di diagnosa dengan pemeriksaan klinis payudara (clinical breast exam), mammography, ultrasonography, dan biopsi. Pemeriksaan klinis dilakukan mengetahui letak gumpalan atau benjolan pada payudara. Hal ini dapat memberitahukan apakah gumpalan atau benjolan tersebut jinak atau ganas berdasarkan rasanya, kemudahannya untuk berpindah, dan teksturnya.
Mammography menggunakan X-rays untuk memperoleh gambar dari payudara
dan benjolan lain yang mungkin timbul. Ultrasonography menggunakan gelombang suara frekuensi tinggi untuk menentukan apakah benjolan adalah kista berisi cairan (bukan kanker) atau massa padat. Pemeriksaan ini mungkin digunakan bersamaan dengan mammography. Pada beberapa kasus, sampel yang diduga tumor diperoleh maka sel–sel dapat diperiksa di bawah mikroskop.
Prosedur ini disebut biopsi, dan sampel jaringan biasanya didapatkan dengan jarum hipodermik (Panno, 2005).
2.3.2.1 Sel T47D
Sel T47D (Human ductal breast epithelial tumor cell line) merupakan sel yang mengekspresikan tumor yang telah termutasi pada protein p53. Sel ini dapat kehilangan estrogen reseptor (ER) apabila kekurangan estrogen pada jangka waktu lama selama percobaan in vitro. Sel ini berasal dari ductal carcinoma dan mengekspresikan caspase 3 (Mooney dkk., 2002).
Sel T47D adalah sel kanker yang mengekspresikan reseptor estrogen atau yang biasa disebut ER positif serta mengekspresikan p53 yang telah termutasi sehingga resisten terhadap mekanisme apoptosis. Pada sel T47D, p53 mengalami missense mutation pada residu 194 (dalam zinc-binding domain L2) sehingga p53
kehilangan fungsinya. Jika p53 tidak dapat mengikat response element pada DNA, maka akan mengurangi atau menghilangkan kemampuannya untuk meregulasi siklus sel dan memacu apoptosis. Sel ini dapat kehilangan estrogen reseptor (ER) apabila kekurangan estrogen pada jangka waktu yang lama selama percobaan in vitro. Oleh karena itu, sel ini digunakan pada model untuk penelitian resistensi
obat pada pasien dengan tumor payudara yang memiliki p53 termutasi (Abcam, 2007).
Sel T47D ini sering digunakan dalam penelitian kanker secara in vitro karena mudah penanganannya, memiliki kemampuan replikasi yang tidak terbatas atau cepat pertumbuhannya, memiliki homogenitas yang tinggi dan mudah diganti sel baru yang telah dibekukan jika terjadi kontaminasi (Abcam, 2007).
2.3.3 Kanker kolon
Kanker kolon merupakan penyakit yang ditandai dengan perkembangan sel yang tidak terkendali pada lapisan epitel usus besar. Di Amerika Serikat kanker kolon menduduki peringkat ketiga dalam jumlah kasus kejadian dan kasus kematian. Angka kejadian per tahun sekitar satu juta kasus dengan angka kematian lebih dari 500.000. Jumlah kasus tersebut diperkirakan meningkat selama dua dekade berikutnya sebagai akibat dari berkembangnya populasi, baik di negara maju maupun berkembang. Di Indonesia, tingkat kejadian kanker kolon per 100.000 orang ditemukan 17,2% dan pada kasus kematian 12,9%
(Mustikasari dan Santoso, 2013; Susanty dkk., 2018).
Berikut diduga merupakan faktor risiko terjadinya kanker kolon, yaitu:
a. Gender dan usia.
Kanker kolon menunjukkan bahwa pria lebih sedikit menderita kanker kolon dibandingkan wanita. Variasi rasio antara pria dan wanita adalah dari 1.0 hingga 1.4 berdasarkan pada pencatatan tumor yang sudah di data (Adrouny, 2002).
Risiko menderita kanker kolon meningkat berdasarkan usia. Umumnya kasus terjadi pada orang dengan usia di atas 60 tahun (Adrouny, 2002).
b. Pola makan, lingkungan, dan keturunan
Bukti menunjukkan bahwa faktor lingkungan utama dapat terbentuknya kanker kolon adalah pola makan. Paparan lingkungan lain, seperti merokok, biasanya juga turut serta dalam timbulnya kanker kolon namun belum pasti.
Memakan makanan dengan serat fiber yang tinggi, buah, dan sayur–sayuran diketahui dapat menurunkan risiko terkena kanker kolon, sedangkan mengonsumsi makanan tinggi lemak dan kurang mengonsumsi fiber dapat meningkatkan risiko kanker kolon (Adrouny, 2002).
c. Sosioekonomi, agama dan etnis
Jumlah kasus pada daerah perkotaan lebih tinggi daripada daerah pedesaan. Suatu penjelasan menyatakan bahwa pada daerah pedesaan orang–
orang lebih banyak terkena paparan matahari, yang kemudian dapat meningkatkan produksi vitamin D dan absorpsi kalsium (Adrouny, 2002).
d. Urutan dari polip ke kanker
Meskipun mekanisme biokimia dan genetik dari karsinogenesis kanker masih belum cukup dipahami, ini sudah membuktikan bahwa anatomi awal dari
kanker kolon adalah polip adenomatosa. Orang yang memiliki polip adenomatosa pada kolon dapat meningkatkan risiko berkembangnya kanker (Adrouny, 2002).
e. Sindrom poliposis
Beberapa sindrom bawaan yang ditandai dengan poliposis dan peningkatan risiko kanker colon. Familial adenomatous polyposis (FAP) merupakan sindrom yang sangat penting, namun jumlahnya kurang dari 1% dari kanker kolon di United States. Berdasarkan individu yang memiliki ratusan atau jutaan polip dari usia 10 tahun, salah satunya mungkin dapat berkembang menjadi kanker. 80% dari individu dengan FAP juga akan mengalami adenoma usus kecil, dan 50% akan mengalami polip di perut. Terdapat peningkatan risiko pada kanker pada bagian awal usus kecil (duodenum), dan pada orang Jepang terdapat peningkatan risiko kanker pada perut (Adrouny, 2002).
Diagnosis kanker kolon ditegakkan dengan melalui:
a. Pemeriksaan klinis yang didapat melalui data mengenai tumor, faktor risiko (genetik, lingkungan), penyakit komorbid (DM dan hipertensi), riwayat pengobatan sebelumnya, dan rectal toucher (RT).
b. Fecal occult blood test (FOBT). Pemeriksaan tumor marker yang digunakan sebagai data awal untuk menentukan respons pengobatan dan prognosis, namun bukan menegakkan diagnosis karena kurang spesifik.
c. Lower endoskopi. Berupa proktoskopi, sigmoidoskopi, dan kolonoskopi.
d. Radiologi. Berupa colon in loop (jika tidak ada fasilitas endoskopi ataupun karena kondisi darurat) dan Endorectal Ultrasonography (ERUS).
e. Patologi, yang didapatkan pra-operasi melalui proktoskopi atau kolonoskopi maupun pengambilan spesimen pada saat operasi (Ardhiansyah, 2018).
2.3.3.1 Sel WiDr
Sel WiDr adalah sel kanker kolon manusia yang diisolasi dari kolon seorang wanita berusia 78 tahun. Sel WiDr merupakan turunan dari sel kanker kolon yang lain yaitu sel HT-29. Sel ini sering digunakan dalam penelitian karena aman digunakan pada uji sitotoksik, mudah dalam pengkulturan dan perlakuan.
Sel WiDr memerlukan rentang waktu sekitar 15 jam untuk dapat menyebabkan satu daur sel (Chen dkk., 1987; Djajanegara, 2008).
Karakteristik dari sel WiDr adalah ekspresi siklooksigenase-2 (COX-2) yang memacu proliferasi sel itu sendiri. Sel WiDr memproduksi antigen karsinoembriotik dan memerlukan rentang waktu sekitar 15 jam untuk dapat menyelesaikan satu daur sel. A pada posisi 273 sehingga terjadi perubahan residu arginin menjadi histidin. Pada sel WiDr, terjadi mutasi p53 G. Namun, p21 pada sel WiDr yang masih normal memungkinkan untuk terjadinya penghentian daur sel. Apoptosis sel WiDr dapat terjadi melalui jalur independent p53, di antaranya melalui aktivasi p73 (Liu dkk., 2006; Levrero dkk., 2000).
2.4 Doksorubisin
Doksorubisin merupakan golongan antibiotik antrasiklin sitotoksik yang diisolasi dari Streptomyces peucetius var. caesius. Doksorubisin telah digunakan secara luas untuk mengobati kanker payudara. Senyawa ini menunjukkan kemampuan yang kuat dalam melawan kanker dan telah digunakan sebagai obat kemoterapi kanker sejak akhir tahun 1960-an (Singal dkk., 1998; Rock dkk., 2003).
Doksorubisin memiliki aktivitas antineoplastik dan spesifik untuk fase S dalam siklus sel. Mekanisme aktivitas antineoplastiknya belum diketahui dengan
pasti. Mekanisme aksi doksorubisin kemungkinan melibatkan ikatan dengan DNA melalui interkalasi di antara pasangan basa serta menghambat sinstesis DNA dan RNA. Kemungkinan mekanisme yang lain yaitu melibatkan ikatan dengan lipid membran sel yang akan mengubah berbagai fungsi selular dan berinteraksi dengan topoisomerase II membentuk kompleks pemotong DNA. Doksorubisin telah digunakan pada beberapa pengobatan jenis tumor seperti kanker payudara, esophagus, osteosarkoma, Kaposi’s sarkoma, sarkoma jaringan lunak, limfoma Hodgkin, dan non-Hodgkin baik dalam aplikasi tunggal maupun kombinasi dengan beberapa agen antitumor lainnya (Tyagi dkk., 2004).
Doksorubisin termasuk ke dalam golongan obat antrasiklin yang merupakan substrat Pgp. Doksorubisin akan dikenali oleh Pgp dan selanjutnya segera dikeluarkan dari dalam sel sehingga menurunkan konsentrasi efektif doksorubisin dalam sel kanker. Mekanisme pemompaan oleh Pgp sangat bergantung pada aktivasi protein tersebut dan penekanan ekspresi Pgp. Oleh karena itu, inaktivasi Pgp dan penekanan ekspresinya mampu mengatasi permasalahan resistensi sel kanker terhadap doksorubisin (Mechetner dkk., 1998;
Zhou dkk., 2006; Wong dkk., 2006).
Aplikasi doksorubisin yang telah digunakan secara klinis untuk berbagai jenis tumor ini dibatasi oleh timbulnya efek samping. Efek samping yang timbul segera setelah pengobatan dengan doksorubisin adalah mual, imunosupresi dan aritmia yang sifatnya reversibel serta dapat dikontrol dengan obat-obat lain. Efek samping yang paling serius akibat pengobatan dengan doksorubisin dalam jangka waktu yang lama adalah cardiomyopathy yang diikuti dengan gagal jantung (Tyagi dkk., 2004).
2.5 Antioksidan
Antioksidan merupakan agen yang dapat membatasi efek dari reaksi oksidasi dalam tubuh. Secara langsung efek yang diberikan oleh antioksidan dalam tubuh, yaitu dengan mereduksi radikal bebas dalam tubuh. Secara tidak langsung, yaitu dengan mencegah terjadinya pembentukan radikal (Sayuti dan Yenrina, 2015).
Secara kimia, senyawa antioksidan merupakan senyawa pemberi elektron (elektron donor). Secara biologis, antioksidan merupakan senyawa yang dapat menangkal atau meredam dampak negatif oksidan. Antioksidan dibutuhkan tubuh untuk melindungi tubuh dari serangan radikal bebas. Antioksidan adalah suatu senyawa atau komponen kimia yang dalam kadar atau jumlah tertentu mampu menghambat atau memperlambat kerusakan akibat proses oksidasi (Sayuti dan Yenrina, 2015).
Radikal bebas merupakan salah satu bentuk senyawa oksigen reaktif, yang secara umum diketahui sebagai senyawa yang memiliki elektron yang tidak berpasangan. Radikal bebas adalah atom, molekul atau senyawa yang tidak dapat berdiri sendiri yang mempunyai elektron tidak berpasangan, oleh karena itu bersifat sangat reaktif dan tidak stabil. Elektron yang tidak berpasangan selalu berusaha untuk mencari pasangan, sehingga dapat bereaksi dengan mudah dengan zat lain (protein, lemak maupun DNA) di dalam tubuh (Sayuti dan Yenrina, 2015).
Kerusakan oksidatif atau kerusakan akibat radikal bebas dalam tubuh pada dasarnya dapat diatasi oleh antioksidan endogen diantaranya yaitu enzim katalase yang berikatan dengan Fe, glutathione peroxide dan glutathione S-transferase yang berikatan dengn Se, superoxide dismutase yang berikatan dengan Cu, Zn,
dan Mn, akan tetapi jika senyawa radikal bebas yang terdapat dalam tubuh berlebih atau melebihi kapasitas kemampuan proteksi antioksidan seluler, maka dibutuhkan antioksidan tambahan dari luar (antioksidan eksogen) untuk menetralkan radikal bebas yang terbentuk. Antioksidan memiliki kemampuan mendonorkan elektron dan dapat berfungsi sebagai agen pereduksi sehingga dapat mengkhelat ion metal dan mengurangi potensi radikal dalam tubuh (Sayuti dan Yenrina, 2015).
Senyawa fenolik mempunyai berbagai efek biologis seperti aktivitas antioksidan melalui mekanisme sebagai pereduksi, penangkap radikal bebas, pengkhelat logam, serta pendonor elektron. Flavonoid merupakan salah satu dari kelompok senyawa fenolik yang ditemukan dalam buah dan sayur. Beberapa tahun ini, telah dibuktikan bahwa flavonoid memiliki potensi yang besar melawan penyakit yang disebabkan oleh penangkap radikal (Sayuti dan Yenrina, 2015).
2.6 Uji Sitotoksik
Uji sitotoksik merupakan uji toksisitas secara in vitro menggunakan kultur sel yang digunakan untuk mendeteksi adanya aktivitas antineoplastik dari suatu senyawa. Senyawa sitotoksik adalah senyawa yang bersifat toksik terhadap sel tumor secara in vitro dan jika toksisitas ini ditransfer menembus sel tumor (in vivo), senyawa tersebut mempunyai aktivitas antitumor (Freshney, 2000).
Pengujian dengan metode in vitro memiliki berbagai keuntungan, seperti:
membutuhkan sejumlah kecil bahan yang digunakan untuk kultur sel primer manusia dari berbagai organ target (ginjal, liver, dan kulit), memberikan informasi secara langsung efek potensial pada sel target manusia. Akhir dari uji sitotoksik
dapat memberikan informasi konsentrasi obat maksimal yang masih memungkinkan sel yang mampu bertahan hidup (Doyle dkk., 2000).
2.6.1 Uji sitotoksik menggunakan metode MTT
Evaluasi preklinik adalah salah satu hal penting untuk mengetahui potensi aktivitas neoplastik dalam pengembangan obat antikanker baru sebagai agen-agen kemoterapi kanker. Evaluasi yang sudah terstandarisasi untuk menentukan apakah suatu material mengandung bahan yang berbahaya (toksik) secara biologis disebut uji sitotoksisitas. Salah satu metode yang biasa digunakan untuk menetapkan jumlah sel adalah metode MTT (Microtetrazolium) (CCRC, 2012).
Prinsip dari metode MTT (Microtetrazolium) adalah terjadinya reduksi garam kuning tetrazolium MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazolium bromid) oleh sistem reduktase suksinat tetrazolium yang termasuk rantai respirasi dalam mitokondria, sel-sel yang hidup membentuk kristal formazan berwarna ungu tidak larut air, kemudian diukur absorbansinya menggunakan ELISA reader.
Intensitas warna ungu yang terbentuk proporsional dengan jumlah sel hidup, sehingga jika intensitas warna ungu semakin besar maka jumlah sel hidup juga semakin banyak (CCRC, 2012).
Formazan merupakan zat berwarna ungu yang tidak larut dalam air sehingga dilarutkan menggunakan HCl 0,04 N dalam isopropanol atau 10% SDS dalam HCl 0,01 N. Intensitas warna ungu terbentuk dapat ditetapkan dengan spektrofotometri dan berkorelasi langsung dengan jumlah sel yang aktif melakukan metabolisme, sehingga berkorelasi dengan viabilitas sel (Kepesik, 2011).
MTT assay menggunakan microplate 96-well, sehingga dapat diukur banyak sampel pada saat yang sama. Metode ini memiliki keuntungan yaitu:
waktu yang dibutuhkan singkat, memerlukan tenaga dan dana yang sedikit, dan metode ini tidak menggunakan isotop radioaktif dan tidak memerlukan transfer sel (Siregar, 2000).
Metode MTT assay didasarkan pada kemampuan sel hidup untuk mereduksi garam microtetrazolium yang berwarna kuning dan larut menjadi formazan yang berwarna biru-ungu dan tidak larut. Reduksi garam tetrazolium terjadi secara intraselular yang melibatkan enzim succinic dehidrigenase dari mitokondria. Reduksi ini melibatkan enzim retikulum endoplasma yang bergantung pada NADH, sedangkan enzim mitokondria hanya berperan kecil (Siregar, 2000).
Mekanisme kerja MTT assay yaitu setelah formazan dilarutkan dalam pelarutnya, intensitas warna diukur dengan spektrofotometer. Untuk mengukur intensitas warna digunakan microplate 96-well yang dapat digunakan untuk ELISA reader. Jumlah kristal formazan yang dihasilkan dan kemudian sudah diukur, berbanding secara proporsional dengan jumlah sel, walaupun absorbansi absolut berbeda antara berbagai sel. Makin pekat warnanya, maka makin tinggi nilai absorbansinya, dan makin banyak jumlah sel yang hidup (Siregar, 2000).
Metode in vitro memberikan berbagai keuntungan, yaitu hanya membutuhkan sejumlah kecil bahan yang digunakan untuk kultur sel primer manusia serta dapat memberikan informasi secara langsung efek potensial pada sel target manusia serta uji yang digunakan sangat sensitif dan dampak yang ditimbulkan dapat dilihat secara langsung (Doyle dkk., 2000).
BAB III
METODE PENELITIAN
3.1 Jenis Penelitian
Penelitian yang dilakukan merupakan penelitian eksperimental. Tahapan dalam penelitian meliputi pengumpulan dan pengolahan tumbuhan daun afrika (Vernonia amygdalina Delile), pembuatan simplisia, skrining fitokimia, karakterisasi simplisia,
pembuatan ekstrak etanol daun afrika (EEDA) yang dilakukan dengan metode ekstraksi refluks, pengujian aktivitas antioksidan EEDA, penetapan total fenol dan flavonoid EEDA, dan pengujian aktivitas sitotoksik EEDA dengan doksorubisin sebagai pembanding yang dilakukan terhadap sel kanker payudara (sel T47D) dan sel kanker kolon (sel WiDr). Lalu data hasil penelitian dianalisis menggunakan metode probit pada program SPSS versi 22.
3.2 Alat
Alat-alat yang digunakan dalam penelitian ini adalah aluminium foil, autoklaf, beaker glass (Iwaki), Biological Safety Cabinet (BSC), blender (Philips), cawan penguap, corong, gelas ukur (Pyrex), kertas perkamen, kertas saring, labu alas bulat (Iwaki), labu tentukur (Iwaki), Laminar Air Flow (LAF), lemari pengering, Microplate reader, micro tube, mikroskop cahaya (Olympus), neraca analitik (Mettler Toledo), object glass, spatula, oven listrik (Memmert), penangas air, pipet mikro, pipet tetes, spektrofotometer UV-Vis, tanur, vial, vortex, dan waterbath.
3.3 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah ekstrak etanol dari daun afrika (EEDA). Sel kanker kolon (WiDr) dan sel kanker payudara (T47D) yang merupakan koleksi Laboratorium Parasitologi Fakultas Kedokteran UGM. Media Dulbecco’s Modified Eagle Medium (DMEM), Roswell Park Memorial Institute (RPMI), aquabides steril, Hepes, HCl 1N, NaOH 1N,
NaHCO3, Fetal Bovine Serum (FBS), Penisilin-Streptomisin, Fungizone (Amphotericin B), Tripsin-EDTA 0,25%, Phosphate Buffer Saline (PBS). Selain bahan-bahan di atas digunakan juga DPPH 0,5 mM (1,1-Diphenyl-2- Picrylhydrazyl), kuersetin, asam galat, metanol, Folin-Ciocalteu 10%, Na2CO3
7,5%, AlCl3, dan CH2COONa.
3.4 Pengumpulan dan Pengolahan Sampel 3.4.1 Pengambilan sampel
Pengumpulan tumbuhan dilakukan secara purposif yaitu tanpa membandingkan dengan tumbuhan yang sama dari daerah lain. Tumbuhan yang digunakan adalah daun afrika (Vernonia amygdalina Delile) diambil di Kebun Tanaman Obat, Fakultas Farmasi, Universitas Sumatera Utara.
3.4.2 Identifikasi tumbuhan
Identifikasi daun afrika (Vernonia amygdalina Delile) dilakukan di Herbarium Medanense (MEDA), Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
3.4.3 Pengolahan sampel
Pengolahan daun afrika (Vernonia amygdalina Delile) dilakukan dengan membersihkan daun dengan air bersih, lalu ditiriskan dan ditimbang berat
keseluruhannya sebagai berat basah. Kemudian daun dikeringkan di lemari pengering hingga kering. Daun yang sudah kering dapat dilihat dengan kemudahannya untuk hancur ketika sampel diremas. Setelah sampel kering, ditimbang daun sebagai berat kering, lalu sampel dihaluskan dengan menggunakan blender dan disimpan ditempat kering dan tertutup rapat.
3.4.4 Pembuatan ekstrak daun afrika (Vernonia amygdalina Delile)
Simplisia ditimbang 50 gram dimasukkan ke dalam wadah. Dimasukkan simplisia ke dalam labu alas bulat, lalu ditambahkan pelarut (etanol). Dipasang kondensor, lalu dihidupkan heater sesuai suhu yang dibutuhkan. Dibiarkan selama 3 jam, lalu setelah 3 jam diamkan hingga dingin kemudian saring. Setelah filtrat dan residu terpisah, residu direfluks kembali sebanyak 3 kali. Setelah filtrat terkumpul dilakukan pengentalan ekstrak dengan rotary evaporator hingga terbentuk ekstrak kental.
3.5 Karakterisasi Sampel
Karakterisasi sampel yang dilakukan dalam penelitian ini adalah pemeriksaan makroskopik, pemeriksaan mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut dalan asam.
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik yang dilakukan pada simplisia daun afrika meliputi: pemeriksaan bentuk, warna, diameter, dan ketebalan (Dirjen POM, 2000).
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik terhadap serbuk simplisia dilakukan dengan cara meneteskan larutan kloralhidrat di atas kaca objek, ditaburkan serbuk simplisia, kemudian ditutup dengan kaca penutup dan dilihat di bawah mikroskop (Ditjen POM, 2000; WHO, 1998).
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan menurut metode Azeotrop (destilasi toluen) (Ditjen POM, 2000; WHO, 1998).
Cara kerja:
Toluena 200 mL dan 2 mL air suling dimasukkan ke dalam labu alas bulat, lalu didestilasi selama 2 jam. Setelah itu, toluena dibiarkan mendingin selama 30 menit dan dibaca volume air pada tabung penerima dengan ketelitian 0,05 mL.
Kemudian ke dalam labu tersebut dimasukkan masing–masing 5 g sampel, labu dipanaskan hati–hati selama 15 menit. Setelah toluene mendidih, kecepatan tetesan diatur lebih kurang 2 tetes tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan tetesan dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluene. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air dan toluene memisah sempurna, volume air dibaca dengan ketelitian 0.05 mL. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen.
3.5.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia yang telah dikeringkan, dimaserasi selama 24 jam dalam 100 mL air-kloroform (2,5 mL kloroform dalam air suling sampai 1
L) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 mL filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah ditara dan sisa dipanaskan pada suhu 105 0C sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 2000; Depkes RI, 1995).
3.5.5 Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk simplisia yang telah dikeringkan, dimaserasi selama 24 jam dalam 100 mL etanol 96% dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 mL filtrat diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105 0C sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 2000; Depkes RI, 1995).
3.5.6 Penetapan kadar abu total
Sebanyak 5 g serbuk simplisia ditimbang seksama dimasukkan dalam kurs porselin yang telah dipijar dan ditara, kemudian diratakan. Kurs dipijar perlahan- lahan sampai arang habis, pijaran dilakukan pada suhu 6000C selama 3 jam kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Ditjen POM, 2000; Depkes RI, 1995).
3.5.7 Penetapan kadar abu tidak larut asam
Abu yang diperoleh dalam penetapan kadar abu total dididihkan dalam 25 mL HCL encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan,