UJI SITOTOKSISITAS EKSTRAK ETANOLIK DAUN SIRIH MER AH (Piper crocatum Ruiz & Pav) TERHADAP
KULTUR SEL KANKER PAYUDARA T47D
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh :
Kartina Neritika
NIM : 048114112
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2008
Demi masa.
Sesungguhnya manusia pasti akan rugi.
Kecuali orang-orang yang beriman dan beramal shaleh, serta
saling berwasiat untuk berlaku sabar.
(Al ‘Ashr)
Ku persembahkan karyaku ini kepada:
Bapak dan ibu yang telah mendidik, mendukung dan mengiring
setiap langkahku dengan doa tulus ikhlasnya,
serta Mas Tigor dan Nanda yang terkasih,
untuk seseorang yang telah mengisi hatiku dan
untuk almamaterku.
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Kartina Neritika
Nomor Mahasiswa : 048114112
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
“Uji Sitotoksisitas Ekstrak Etanolik Daun Sirih Merah (Piper crocatum Ruiz & Pav) terhadap Kultur Sel Kanker Payudara T47D”
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, me-ngalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di Internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 18 Juli 2008
Yang menyatakan,
( Kartina Neritika )
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak
memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam
kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, 18 Juli 2008
Penulis,
Kartina Neritika
INTISARI
UJI SITOTOKSISITAS EKSTRAK ETANOLIK DAUN SIRIH MERAH (Piper crocatum Ruiz & Pav) TERHADAP
KULTUR SEL KANKER PAYUDARA T47D
Banyak studi dilakukan untuk memperoleh senyawa-senyawa baru yang memiliki aktivitas antikanker, termasuk dari bahan-bahan alam. Satu diantaranya adalah tanaman sirih merah (Piper crocatum Ruiz & Pav). Daun sirih merah secara empiris telah digunakan untuk mengobati penyakit kanker, tetapi belum ada data ilmiah yang mendukung. Penelitian ini bertujuan untuk mengetahui apakah ekstrak etanolik daun sirih merah dapat dikembangkan sebagai antikanker.
Uji aktivitas sitotoksik ekstrak etanolik daun sirih merah terhadap kultur sel kanker payudara T47D dilakukan dengan metode direct counting
menggunakan triphan blue dan diamati secara visual setelah diinkubasi selama 24 jam. Data yang diperoleh berupa persen kematian sel dan jumlah sel hidup setelah perlakuan yang kemudian diolah dengan menggunakan analisis probit dan uji
one-way ANOVA.
Hasil penelitian menunjukkan bahwa ekstrak etanolik daun sirih merah bersifat sitotoksik terhadap kultur sel T47D, dengan harga LC
50 sebesar 587,7
μg/ml, dengan demikian ekstrak etanolik daun Sirih merah dimungkinkan mengandung senyawa yang mempunyai aktivitas antikanker.
Kata kunci : sitotoksisitas, daun sirih merah, sel T47D, LC
50
ABSTRACT
THE CYTOTOXICITY ASSAY OF ETHANOLIC EXTRACT OF CELEBES PEPPER LEAVES (Piper crocatum Ruiz & Pav)
AGAINST BREAST CANCER CELL LINE T47D CULTURE
Many studies has been done to gain new active compound having anticancer activity, including from natural resources. One of them is celebes pepper plant (Piper crocatum Ruiz & Pav). The celebes pepper leaves empirically has been used for cancer treatment. There is no scientific evidence yet to support it. Therefore the objective of this research is to determine whether celebes pepper leaves ethanolic extract can be developed to be anticancer medicine.
The cytotoxic activity of ethanolic extract of the celebes pepper leaves was tested on breast cancer cell line T47D culture used direct counting method and was visually investigated after 24 hours of incubation by triphan blue. The obtained data (percentage of the death cells and lived cells after treatment) are analyzed with probit test and one-way ANOVA test.
The result of the research showed that ethanolic extract of celebes pepper’s leaf has cytotoxic activity on breast cancer cell line T47D, with LC50 value was 587.7 μg/ml. That is indicate that ethanolic extract of Celebes pepper’s leaf probably to be developed as anticancer.
Key word: cytotoxicity, celebes pepper leaves, T47D cells, LC
50
PRAKATA
Puji syukur kepada Allah SWT atas berkat rahmat dan anugerahnya,
sehingga penulis bisa menyelesaikan skripsinya yang berjudul “Uji Sitotoksisitas
Ekstrak Etanolik Daun Sirih Merah (Piper crocatum Ruiz & Pav) terhadap Sel
Kanker Payudara T47D”.
Terselesaikannya skripsi ini tidak lepas dari bantuan banyak pihak. Oleh
karena itu itu penulis ingin sekali mengucapkan terima kasih kepada:
1. Drs. A. Yuswanto S.U., Ph.D., Apt., selaku dosen pembimbing yang telah
banyak meluangkan waktu, tenaga, dan atas segala masukan serta sarannya
dalam penyusunan skripsi ini.
2. Drs. Mulyono, Apt.,selaku dosen penguji atas segala arahan, kritik, saran dan
waktunya.
3. Yohanes Dwiatmaka, M.Si., selaku dosen penguji atas segala arahan, kritik,
saran dan waktunya.
4. Rita Suhadi, MSi, Apt selaku dekan Fakultas Farmasi Universitas Sanata
Dharma.
5. Mbak Yuli dan segenap teknisi Laboratorium Penelitian dan Pengujian
Terpadu (LPPT), Universitas Gadjah Mada yang telah membantu jalannya
penelitian sehingga dapat terselesaikan dengan baik.
6. Ign. Y Kristyo B, M.Si. dan Romo Sunu, yang telah memberikan banyak
masukan dalam identifikasi dan determinasi tumbuhan serta dalam analisis
statistik.
7. Bapak, Ibu, Kakak, dan Adikku tercinta atas doa dan dukungannya selama ini.
8. Aa’ Inzi Almuntadzar atas perhatian, bantuan, dukungan dan kebersamaan
selama ini.
9. Mas Irfad dan Fadrian atas semua pelajaran, perhatian, semangat dan
dukungan yang diberikan.
10.Semua neritikcats atas kebahagiaan yang kalian berikan.
11.Caca Lemek atas semua kebersamaan dan persahabatan yang indah.
12.Eva, Meri, Nur, dan Sisca atas bantuan dan kerjasamanya selama penelitian.
13.Mba Echa, Resti, Brian, mba Mimi, Septi, Iyast, Meri, dan teman-teman kost
buat kebersamaannya selama ini.
14.Dona, Dipta, Probo, Rike, Cendani, Evie, Selvi, Robby, Ine, Budiaji, Finza,
Maria, Sisca, Robert, Resti, Chandy, teman- teman kelas C, dan teman-teman
FST angkatan 2004 atas persahabatan yang indah.
15.Semua pihak yang telah banyak membantu penyusunan skripsi ini.
Harapan penulis karya ini bermanfaat dan dapat mendorong mahasiswa
angkatan berikutnya untuk berkarya lebih baik bagi kemajuan dunia farmasi di
Indonesia. Oleh karena itu penulis menerima saran dan kritik yang membangun
guna tercapainya kesempurnaan tulisan ini.
DAFTAR ISI
Halaman
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING... ... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN... ... iv
HALAMAN PERSETUJUAN PUBLIKASI...v
PERNYATAAN KEASLIAN KARYA... ... vi
INTISARI... vii
ABSTRACT... . viii
PRAKATA... ix
DAFTAR ISI...x
DAFTAR TABEL...xv
DAFTAR GAMBAR... ... .xvi
DAFTAR LAMPIRAN... xvii
BAB I PENGANTAR... ...1
A. Latar Belakang... ... 1
1. Rumusan Masalah... 2
2. Keaslian karya... ...3
3. Manfaat penelitian... ...3
B. Tujuan Penelitian…... ... 3
1. Tujuan umum……... 3
2. Tujuan khusus………...3
BAB II PENELAAHAN PUSTAKA...4
A. Kanker dan Karsinogenesis... 4
B. Kanker Payudara…………...8
C. Kultur Sel…... ... 8
D. Sel kanker T47D. ………... 9
E. Sirih Merah... ...10
1. Keterangan Botani...10
2. Morfologi tanaman...10
3. Khasiat dan kegunaan ...11
4. Penelitian tentang sirih merah...11
5. Kandungan kimia ... 11
F. Flavonoid ...11
G. Teknik penyarian...12
1. Ekstrak ...12
2. Pelarut ...12
3. Maserasi ...13
H. Uji Sitotoksisitas ... ... 14
I. Landasan Teori... 18
J. Hipotesis...18
BAB III METODOLOGI PENELITIAN...19
A. Jenis dan Rancangan Penelitian... ... 19
B. Variabel Penelitian dan Definisi Operasional... ...19
1. Variabel bebas... ... 19
2. Variabel tergantung... ...19
3. Variabel pengacau terkendali... ...19
4. Definisi operasional... ...19
C. Alat dan Bahan...20
1. Alat ... ... 20
2. Bahan... ...20
D. Tata Cara Penelitian... ... 22
1. Determinasi tanaman... ... 22
2. Pengumpulan daun sirih merah... . 22
3. Pembuatan ekstrak etanolik daun sirih merah... ....22
4. Sterilisasi alat dan bahan ... ... 23
5. Pembuatan medium pencuci dan medium penumbuh ... ... 23
6. Pengaktifan dan panen sel T47D... ... 24
7. Pembuatan larutan uji ...……….25
8. Uji sitotoksisitas ekstrak etanolik daun sirih merah pada sel T47D... 25
E. Analisis Hasil... ...27
BAB IV HASIL DAN PEMBAHASAN... ...28
A. Determinasi Tanaman... ... 28
B. Pengumpulan daun sirih merah...28
C. Sterilisasi alat dan bahan... 29
D. Maserasi... ... 30
E. Uji Sitotoksisitas ekstrak etanolik daun sirih merah pada sel T47D...31
F. Analisis Hasil ...35
BAB V. KESIMPULAN DAN SARAN...41
A. Kesimpulan... ...41
B. Saran...41
DAFTAR PUSTAKA... ...42
LAMPIRAN...46
BIOGRAFI PENULIS... ...63
DAFTAR TABEL
Halaman
Tabel I. Hasil uji sitotoksisitas ekstrak etanolik daun sirih merah terhadap
kultur sel T47D ... ...36
Tabel II. Data log konsentrasi dan harga probit………....38
Tabel III. Nilai r (koefisien korelasi) pada level signifikansi 5% dan 1% ....56
Tabel IV. Harga probit sesuai dengan presentasenya……….58
DAFTAR GAMBAR
Halaman
Gambar 1. Morfologi sel T47D …………..…... ...31
Gambar 2. Reaksi pembentukan kristal formazan...……… 32
Gambar 3. Kristal Formazan...33
Gambar 4. Foto sel T47D pada haemocytometer... 34
Gambar 5. Konsentrasi ekstrak etanolik daun sirih merah vs persentase kematian sel T47D... ...36
Gambar 6. Grafik hubungan log kadar ekstrak sirih merah vs probit pada sel T47D pada replikasi 1...……… 37
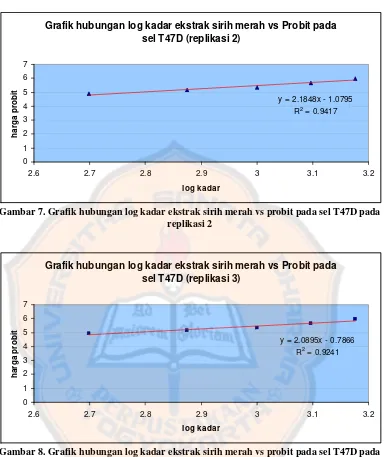
Gambar 7. Grafik hubungan log kadar ekstrak sirih merah vs probit pada sel T47D pada replikasi 2...……… 38
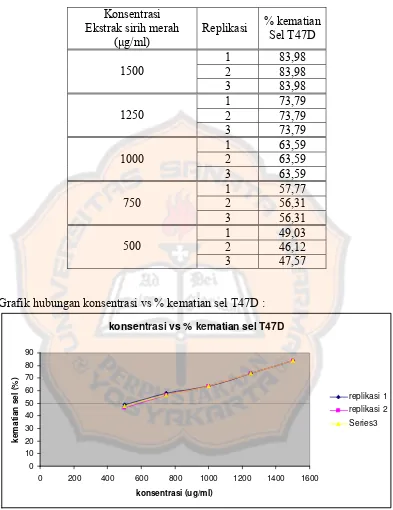
Gambar 8. Grafik hubungan log kadar ekstrak sirih merah vs probit pada sel T47D pada replikasi 3...38
Gambar 9. Foto tanaman sirih merah …………...59
Gambar 10. Foto ELISA reader …………... ...….60
Gambar 11. Foto Sentrifuge …………...60
Gambar 12. Foto 96 well-plate dan conical steril …………... ..60
Gambar 13. Laminar Air Flow...61
Gambar 14. Haemocytometer dan cell counter...61
Gambar 15. Microscope inverted...61
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data absorbansi sel dengan metode MTT... ....46
Lampiran 2. Perhitungan jumlah sel dengan menggunakan metode
direct counting... ...46
Lampiran 3. Perhitungan % Kematian Sel T47D ...49
Lampiran 4. Perhitungan LC50 ekstrak etanolik daun sirih merah terhadap sel
T47D dengan menggunakan analisis probit ...52
Lampiran 5. Perhitungan nilai korelasi LC50 ekstrak etanolik daun sirih merah
terhadap sel T47D pada taraf kepercayaan 95% ...56
Lampiran 6. Tes distribusi normal dengan menggunakan metode
Kolmogorov-Smirnov………....…… ...57
Lampiran 7. Perhitungan perbedaan mean pada kontrol dan perlakuan
dengan menggunalan analisis statistik one-way ANOVA ...57
Lampiran 8. Harga Probit Sesuai dengan Prosentasenya ……… ...58
Lampiran 9. Foto tanaman sirih merah………….………...59
Lampiran 10. Peralatan dan Bahan yang Digunakan dalam
Penelitian... ...60
BAB I PENGANTAR
A. Latar Belakang
Di AS dan beberapa negara berkembang lainnya, kanker sekarang ini
bertanggung jawab untuk sekitar 25% dari seluruh kematian (Anonim, 2005).
Salah satu jenis penyakit kanker yang paling ditakuti kaum wanita adalah kanker
payudara. Di Indonesia jumlah penderita kanker payudara menduduki tingkat
kedua setelah kanker mulut rahim (Anonim, 2008a).
Pengobatan kanker payudara dapat dilakukan dengan jalan operasi,
kemoterapi, radiasi (penyinaran), dan haemopati (Yuliani, 2000). Obat-obat yang
termasuk obat-obat sintetik memiliki toksisitas tinggi, selain itu obat sintetik juga
memiliki efek samping yang tinggi pula. Oleh karena itu perlu dikembangkan obat
antikanker dari bahan alami yang memiliki efek samping yang relatif kecil
daripada obat antikanker sintetik (Mulyadi, 1996).
Salah satu tanaman yang diyakini memiliki kegunaan sebagai obat
antikanker adalah daun sirih merah. Sirih merah selain bersifat antiseptik seperti
halnya sirih hijau, sirih merah juga bisa dipakai mengobati diabetes, kanker,
peradangan, hipertensi, hepatitis, dan ambeien. Jika dibuat teh herbal bisa
mengobati asam urat, darah tinggi, kencing manis, maag, atau kelelahan (Waldan
dan Sulistyati, 2001)
Saat ini belum banyak publikasi penelitian tentang kemampuan daun sirih
banyak digunakan sebagai obat tradisional, selain itu daun sirih merah telah
diyakini dapat bermanfaat sebagai obat antikanker, terbukti dari cukup banyaknya
penderita kanker yang sembuh setelah mengkonsumsi daun sirih merah dalam
bentuk rebusan atau pun bentuk lainnya. Hal tersebutlah yang mendasari
dilakukannya penelitian dengan cara melakukan ekstraksi daun sirih merah
terhadap kultur sel T47D untuk mengetahui apakah daun sirih merah mempunyai
efek sitotoksik dan dapat berpotensi untuk dikembangkan sebagai senyawa
antikanker.
Hasil yang didapatkan dari penelitian ini diharapkan dapat menambah
pengetahuan tentang khasiat dan kegunaan daun sirih merah, juga untuk
memberikan informasi sitotoksik dari daun sirih merah terhadap sel kanker.
1. Rumusan masalah
Berdasarkan latar belakang dari penelitian timbul berbagai permasalahan,
yaitu :
a. Apakah ekstrak etanolik daun sirih merah memiliki efek sitotoksisitas
terhadap kultur sel T47D?
b. Seberapa besar nilai LC50 dari ekstrak etanolik daun sirih merah terhadap
kultur sel T47D?
2. Keaslian Karya
Sejauh ini penulis belum menemukan adanya penelitian mengenai uji
sitotoksisitas ekstrak etanolik daun sirih merah terhadap kultur sel T47D di
3. Manfaat Penelitian
a. Manfaat teoritis
Penelitian ini diharapkan dapat melengkapi dan memperkaya
informasi yang telah ada mengenai khasiat, penggunaan dan efek sitotoksisitas
ekstrak etanolik daun sirih merah terhadap kultur sel T47D.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan alternatif untuk pengobatan
kanker dengan menggunakan bahan dari alam.
B. Tujuan Penelitian 1. Tujuan Umum
Penelitian ini bertujuan untuk mengetahui apakah ekstrak etanolik daun
sirih merah memiliki efek sitotoksik.
2. Tujuan khusus
a. Untuk mengetahui apakah ekstrak etanolik daun sirih merah memiliki efek
sitotoksisitas terhadap kultur sel T47D.
b. Untuk mengetahu nilai LC50 dari ekstrak etanolik daun sirih merah terhadap
BAB II
PENELAAHAN PUSTAKA
A. Kanker dan Karsinogenesis
Kanker merupakan suatu penyakit sel yang ditandai dengan hilangnya
fungsi kontrol sel terhadap regulasi daur sel maupun fungsi homeostatis sel pada
organisme multiseluler. Kegagalan tersebut menyebabkan sel tidak dapat
berproliferasi secara normal. Akibatnya, sel akan berproliferasi terus-menerus
sehingga menimbulkan pertumbuhan jaringan yang abnormal (Lodish et al.,
2000). Kanker dianggap suatu kelompok penyakit seluler dan genetik karena
dimulai dari satu sel yang telah mengalami mutasi DNA sebagai komponen dasar
gen. Sel-sel yang mengalami kerusakan genetik tidak peka lagi terhadap
mekanisme regulasi siklus sel normal sehingga akan terus melakukan proliferasi
tanpa kontrol. Mutasi yang terjadi pada DNA di dalam gen yang meregulasi siklus
sel (pertumbuhan, kematian dan pemeliharaan sel) akan menyebabkan
penyimpangan siklus sel, dan salah satu akibatnya adalah pembentukan kanker
atau karsinogenesis (Silalahi, 2006).
Seiring dengan berkembangnya ilmu biologi molekuler, pengetahuan
tentang mekanisme molekuler yang dapat mencetuskan terjadinya kanker dapat
berkembang pula. Oleh karenanya dapat diketahui berbagai alternatif jalur yang
dapat ditempuh untuk pengembangan obat untuk terapi kanker (Hanahan dan
Sel kanker memiliki karakteristik sebagai berikut :
a. Sel kanker mampu mencukupi kebutuhan sinyal pertumbuhannya sendiri.
Sinyal pertumbuhan diperlukan agar sel dapat terus membelah. Berbeda dari
sel normal, sel kanker dapat tetap dan terus tumbuh.
b. Tidak sensitif terhadap sinyal anti-pertumbuhan. Sel kanker tidak merespon
adanya sinyal yang dapat menghentikan terjadinya pertumbuhan dan
pembelahan sel, dengan demikian, sel kanker dapat terus membelah.
c. Sel kanker mampu menghindar dari mekanisme apoptosis. Apoptosis
merupakan program bunuh diri sel ketika sel tersebut mengalami kerusakan,
baik struktural maupun fungsional, yang tidak dapat ditolerir lagi. Namun sel
kanker dapat menghindar dari kematian dengan mengeblok jalur terjadinya
apoptosis di dalam sel.
d. Sel kanker memiliki potensi tak terbatas untuk mengadakan replikasi.
e. Sel kanker mampu menginduksi angiogenesis untuk mencukupi kebutuhannya
akan oksigen dan nutrisi. Akan terbentuk cabang baru pada pembuluh darah
yang menuju sel kanker yang kemudian akan mensuplai kebutuhan nutrisi dan
oksigen dari sel kanker.
f. Sel kanker mampu menginvasi jaringan di sekitarnya dan membentuk anak
sebar. (Hanahan dan Weinberg, 2000)
Pertumbuhan kanker merupakan sebuah proses mikroevolusioner yang
dapat berlangsung selama beberapa bulan atau beberapa tahun. Proses
pertumbuhan ini dinamakan karsinogenesis. Usaha penyembuhan penyakit kanker
(Albert et al., 1994). Proses karsinogenesis melalui beberapa fase, yang meliputi
fase inisiasi, fase promosi, fase progresi, dan metastasis. Inisiasi merupakan fase
pertama dan merupakan hasil dari adanya perubahan genetik yang menyebabkan
terjadinya proliferasi abnormal dari satu sel. Pada fase inisiasi terjadi interaksi
kovalen antara spesies reaktif (metabolit dari senyawa karsinogen dengan molekul
DNA sebagai sel target selanjutnya merusak struktural DNA). Promosi
merupakan kelanjutan inisiasi di mana sel mendapatkan pacuan dari tumor
promoting factor yang menyebabkan pertumbuhan yang cepat dan pembentukan
tumor benign. Pada fase progresi, perubahan genetik semakin bertambah banyak
sehingga akan menambah koloni sel tumor dengan peningkatan kemampuan
tumbuh dan munculnya keistimewaan-keistimewaan yag lain, seperti peningkatan
mobilitas dan angiogenesis. Fase berikutnya adalah metastasis, yaitu
perkembangan tumor yang bersifat malignant dan terjadinya pelepasan sel-sel
tumor ganas dari koloni primernya. Sel-sel tumor ganas ini dapat merusak saluran
limfatik sehingga dapat menyebar ke seluruh tubuh dan berkembang di tempat
yang jauh (Schneider, 1997)
Ada tiga cara atau faktor penting dalam proses terjadinya mutasi gen
yaitu : (1) faktor lingkungan yang meliputi nutrisi, agen infektor, gaya hidup; (2)
faktor kebetulan, dan (3) faktor keturunan atau bawaan. Faktor lingkungan seperti
gaya hidup dan pola makan berkorelasi dengan insiden kanker; misalnya paparan
sinar ultraviolet dengan kanker kulit, merokok dengan kanker paru-paru. Tetapi
menderita kanker kulit; berarti ada faktor lain di luar faktor lingkungan yakni
kesalahan replikasi DNA dan bawaan (Silalahi, 2006).
Kanker dapat terjadi akibat akumulasi DNA termutasi dalam gen
terutama yang mengatur proses siklus dan pertumbuhan sel. Mekanisme ketiga
cara terjadinya mutasi DNA adalah melalui faktor keturunan atau bawaan, yang
menyebabkan 5-10% kanker. Mutasi yang terjadi pada DNA di dalam gen yang
meregulasi siklus sel akan mengakibatkan penyimpangan, dan salah satu dampak
negatifnya adalah pembentukan kanker atau karsinogenesis. Ada tiga kelompok
utama gen yang terlibat dalam regulasi pertumbuhan sel, yaitu proto-onkogen, gen
penekan tumor (tumor suppresor gene = TSG) dan gen gatekeeper.
Proto-onkogen menstimulasi dan meregulasi pertumbuhan dan pembelahan sel. Gen
penekan tumor biasanya menghambat pertumbuhan sel atau menginduksi
apoptosis (kematian sel terprogram). Kelompok gen ini dikenal sebagai
anti-onkogen, karena berfungsi melakukan kontrol negatif (penekanan) pada
pertumbuhan sel. Gen gatekeeper berfungsi mempertahankan integritas genomik
dengan mendeteksi kesalahan pada genom dan memperbaikinya. Mutasi pada
gen-gen ini karena berbagai faktor membuka peluang terbentuknya kanker. Pada
keadaan normal, pertumbuhan sel akan terjadi sesuai dengan kebutuhan melalui
siklus sel normal yang dikendalikan secara terpadu oleh fungsi ketiga gen:
proto-onkogen, gen tumor supressor dan gen gatekeeper secara seimbang. Jika terjadi
ketidakseimbangan fungsi ketiga gen ini, atau salah satu tidak berfungsi dengan
baik karena mutasi, maka keadaan ini akan menyebabkan penyimpangan siklus sel
B. Kanker Payudara
Jaringan payudara merupakan jaringan yang sensitif terhadap tumbuhnya
kanker. Kanker umumnya terjadi pada jaringan yang sel-selnya aktif membelah,
salah satunya adalah payudara. Pembelahan sel payudara dipacu oleh adanya
hormon estrogen. Pembelahan ini dapat meningkatakan resiko terjadinya
kerusakan permanen pada DNA. Sel payudara yang belum mengalami
pematangan secara sempurna lebih kuat mengikat karsinogen dan tidak dapat
mengatasi kerusakan DNA secara efisien seperti pada sel yang telah matang
sepenuhnya (Clark et al, 1997)
Kanker payudara adalah suatu penyakit terjadinya pertumbuhan
berlebihan atau perkembangan tidak terkontrol dari sel-sel (jaringan) payudara
(Khomsah, 2008). Jenis kanker payudara yang paling umum adalah berasal dari
saluran air susu (ductal carcinoma), dan kelenjar air susu (lobular carcinoma)
(Wittens dan Nagtegaal, 2008).
Kanker payudara biasanya didiagnosis dengan adanya benjolan kecil
berukuran kurang dari 2 cm. Pada tumor yang ganas, benjolan ini bersifat soliter,
unilateral, solid, keras, tidak beraturan, dan non-mobile. Tanda yang kurang
umum adalah adanya abnormalitas pada puting dan retraksi. Pada kasus yang
lebih berat dapat terjadi edema kulit, kemerahan, dan rasa panas pada jaringan
payudara (Dipiro, et al, 2005)
C. Kultur Sel
Kultur sel merupakan proses dimana suatu sel berada dalam kondisi yang
maupun organ aslinya kemudian ditumbuhkan dalam kultur media secara invitro
dan dikondisikan sama seperti pada saat sel masih berada dalam jaringan aslinya.
Pemindahan sel ke dalam flask baru dengan medium yang baru disebut dengan
subkultur, hal ini memungkinkan suatu bentuk perluasan kultur dan dikenal
sebagai cell line (Freshney, 2000).
Penggunaan kultur sel sebagai subyek uji dikarenakan selain banyaknya
tekanan publik untuk mengurangi bahkan tidak menggunakan hewan sebagai
subyek uji dalam percobaan mengingat segi moral. Alasan lain tidak
menggunakan hewan percobaan ialah untuk menghemat biaya yang besar apabila
menggunakan hewan percobaan dan juga rendahnya nilai korelasi antara hasil
yang diperoleh dengan penelitian menggunakan hewan jika dikorelasikan dengan
manusia. Dengan menggunakan kultur sel sebagai alternatif subyek dalam
pengujian toksikologi, maka mekanisme toksisitas biokimia dapat dikerjakan
dengan lebih efektif. Hal ini dikarenakan kondisi dari sel dapat dikontrol dan
dimodifikasi (Wallin, 1998).
D. Sel Kanker T47D
Sel T47D merupakan suatu sel yang morfologinya seperti sel epitel yang
diambil dari jaringan payudara seorang wanita berumur 54 tahun. Sel ini dapat
ditumbuhkan dengan media penumbuh RPMI 1640 dengan FBS 10% dan
antibiotic bebas pada suhu 37oC dan dapat tumbuh secara kontinyu dan menempel
pada flask. Sel T47D merupakan sel kanker payudara ER-positif yang dibuktikan
dengan adanya respon peningkatan proliferasi sebagai akibat kemampuan
E. Sirih Merah 1. Keterangan Botani
Tanaman sirih merah termasuk ke dalam famili Piperaceae, genus Piper,
spesies Piper crocatum Ruiz & Pav, sinonim Piper ornatum (Anonim, 2007).
2. Morfologi tanaman
Tanaman sirih merah tumbuh menjalar seperti halnya sirih hijau.
Batangnya bulat berwarna hijau keunguan dan tidak berbunga. Daunnya
bertangkai membentuk jantung dengan bagian atas meruncing, bertepi rata dan
permukaannya mengkilap atau tidak berbulu. Panjang daunnya bisa mencapai 15
sampai dengan 20 cm. Warna daun bagian atas hijau bercorak warna putih keabu–
abuan. Bagian bawah daun berwarna merah hati cerah. Daunnya berlendir, berasa
sangat pahit dan beraroma wangi khas sirih. Batangnya beruas dengan jarak buku
5–10 cm, di setiap buku tumbuh bakal akar (Sudewo, 2005).
3. Khasiat dan kegunaan
Zat yang terkandung dalam sirih merah dapat merangsang saraf pusat dan
daya pikir. Disamping itu memiliki efek pencegah ejakulasi dini antikejang,
antiseptik, analgetik, antiketombe, antidiabetes, pelindung hati, antidiare,
mempertahankan kekebalan tubuh dan penghilang bengkak, mengatasi radang
pada paru, radang pada tenggorok, radang pada gusi, radang pada payudara,
hidung berdarah dan batuk berdarah (Sudewo, 2005).
Dalam penggunaan secara empiris ekstrak daun sirih merah pada
pemakaian tunggal atau dikombinasikan dengan tanaman obat lainnya mampu
tubuh tertentu, luka yang sulit sembuh, kanker payudara dan kanker rahim,
leukemia, TBC, radang pada lever, lemah sahwat, ambeien, jantung koroner,
darah tinggi dan asam urat (Sudewo, 2005).
4. Penelitian tentang sirih merah
Penelitian yang pernah dilakukan sebelumnya adalah penelitian
pemeriksaan skrining fitokimia daun sirih merah, dan hasilnya menunjukkan
bahwa sirih merah mengandung flavonoid, alkaloid, senyawa polifenolat, tannin,
dan minyak atsiri (Sudewo, 2005)
5. Kandungan kimia
Sirih merah mengandung flavanoid, alkaloid, senyawa polifenolat, tanin,
dan minyak atsiri (Sudewo, 2005).
F. Flavonoid
Flavonoid telah menunjukkan peran umumnya sebagai antioksidan,
antimutagenik, antineoplastik, dan aktivitas vasodilatator. Potensi antioksidan
flavonoid dapat digunakan untuk mencegah kerusakan oksidatif pada
pengendalian sejumlah penyakit (Miller, 1996). Tiga senyawa flavonoid alam
telah diisolasi menggunakan etil asetat, yang berasal dari fraksinasi S. feruginosa,
yaitu kuersetin, kuersetrin, dan flavonol glikosida 4-O-asetl kuersetrin memiliki
daya sitotoksik pada kultur jaringan kanker glioblastoma manusia (LeDévéhat, et
al. 2002). Banyak penelitian menyebutkan bahwa interaksi flavonoid dengan
komponen sel diimplikasikan pada patologi saraf dan kanker. Hampir semua jenis
flavonoid menunjukkan aktivitas biologis, dengan sebagian besar dihubungkan
Flavonoid merupakan senyawa polar karena mempunyai sejumlah
gugus hidroksi yang tidak tersubstitusi, atau suatu gula. Oleh karena itu,
umumnya flavonoid cukup larut dalam pelarut polar seperti etanol, metanol,
butanol, aseton, dimetilsulfoksida, dimetilformamid dan air (Markham, 1988).
G. Teknik Penyarian
Penyarian adalah kegiatan penarikan zat yang dapat larut dari bahan
yang tidak dapat larut dengan pelarut air. Faktor yang dapat mempengaruhi
kecepatan penyarian adalah kecepatan difusi zat yang larut melalui lapisan-lapisan
batas antara cairan penyari dengan bahan yang mengandung zat tersebut (Anonim,
1986).
1. Ekstrak
Ekstrak adalah sediaan yang diperoleh dengan mengekstraksi zat aktif
dari simplisia nabati atau hewani dengan menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dari massa atau serbuk yang
tersisa diperlakukan sedemikian hingga memenuhi baku yang telah ditetapkan
(Anonim, 1995).
2. Pelarut
Cairan penyari untuk ekstrak sebaiknya sesuai dengan zat aktif yang
berkhasiat, dalam arti dapat memisahkan zat aktif tersebut dari senyawa lainnya
dalam bahan sehingga ekstrak mengandung sebagian besar senyawa berkhasiat
yang diinginkan (Anonim, 2000).
Etanol meskipun harganya cukup mahal, tetapi dipertimbangkan sebagai
etanol di atas 20%), tidak beracun, netral, absorbsinya baik, dapat bercampur air
pada segala perbandingan, dan pengeringan diperlukan waktu sebentar. Etanol
dapat melarutkan alkaloid, minyak menguap, glikosida, kurkumin, kumarin,
antrakinon, flavonoid, steroid, dammar, klorofil, lemak, tannin, dan saponin,
dengan demikian zat pengganggu yang larut hanya terbatas (Anonim, 1986).
3. Maserasi
Maserasi adalah cara ekstraksi yang paling sederhana (Voight, 1971).
Maserasi dilakukan dengan merendam serbuk simplisia dalam cairan penyari.
Maserasi digunakan untuk penyarian simplisia yang mengandung zat aktif yang
mudah larut dalam cairan penyari, tidak mengandung zat yang mudah
mengembang dalam cairan penyari, tidak mengandung benzoin, stirak, dll.
Kerusakan senyawa yang tidak tahan panas dapat dihindari. Cairan penyari yang
digunakan dapat berupa air, etanol, etanol–air atau pelarut lain. Bila cairan
penyari digunakan air maka untuk mencegah timbulnya kapang dapat
ditambahkan bahan pengawet yang diberikan pada awal penyarian (Hargono et al,
1986).
Selama proses maserasi, cairan penyari akan menembus dinding sel dan
masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dan
karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dan di
luar sel, maka larutan yang lebih pekat didesak keluar. Peristiwa tersebut berulang
sehingga terjadi keseimbangan konsentrasi antara larutan di luar sel dan di dalam
Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol, atau
pelarut lain. Bila cairan penyari digunakan air maka untuk mencegah timbulnya
kapang dapat ditambahkan bahan pengawet yang diberikan pada awal penyarian.
Keuntungan cara ekstraksi dengan maserasi adalah cara pengerjaan dan peralatan
yang digunakan sederhana dan mudah diusahakan, sedangkan kerugiaannya
adalah cara pengerjaannya lama dan penyariannya kurang sempurna (Hargono et
al, 1986).
Maserasi pada umumnya dilakukan dengan cara 10 bagian simplisia
dengan derajat halus yang cocok dimasukkan ke dalam bejana, kemudian dituangi
dengan 75 bagian cairan penyari, ditutup dan dibiarkan selam 5 hari terlindung
dari cahaya matahari untuk mencegah reaksi yang dikatalisis oleh cahaya atau
perubahan warna. Setelah 5 hari, sari diserkai, ampas diperas, ampas ditambah
cairan penyari secukupnya, diaduk dan diserkai sehingga diperoleh seluruh sari
sebanyak 100 bagian. Bejana ditutup, dibiarkan di tempat sejuk, terlindung dari
cahaya, selama 2 hari kemudian endapan dipisahkan. Rendaman harus dikocok
berulang-ulang (kira-kira 3 x sehari). Melalui upaya ini dapat dijamin
keseimbangan konsentrasi bahan ekstraktif yang lebih cepat di dalam cairan.
Keadaan diam selama maserasi menyebabkan turunnya perpindahan bahan aktif
(Hargono et al, 1986). Secara teori, pada suatu maserasi tidak memungkinkan
terjadinya ekstrak absolute. Semakin besar perbedaan simplisia terhadap cairan
H. Uji Sitotoksisitas
Uji sitotoksisitas dilakukan secara in vitro untuk menentukan potensi
sitotoksik senyawa-senyawa seperti produk-produk farmasi, kosmetik, dan
obat-obatan antikanker. Pengembangan metode in vitro sebagai alternatif pengganti
pengujian menggunakan hewan uji mempunyai relevansi yang cukup baik yang
bertujuan untuk mendeteksi potensi ketoksikan suatu obat pada manusia (Doyle
and Griffiths, 2000)
Sitotoksisitas merupakan kejadian kompleks secara in vivo, di mana
terjadi kerusakan sel akibat penggunaan obat antikanker yang bersifat sitotoksik
atau karena efek-efek fisiologi seperti efek inflamasi, neurotoksisitas, dan juga
efek-efek sistemik. Uji secara in vitro harus dapat menggambarkan efek senyawa
uji yang sama bila diberikan secara in vivo. Respon sel terhadap agen-agen
sitotoksik dipengaruhi oleh kerapatan sel (Freshney, 2000)
Metode in vitro menawarkan beberapa keuntungan, antara lain :
a) Dapat digunakan sebagai tahap atau langkah awal dalam penelitian,
b) Untuk berbagai tujuan penggunaan kultur pengembangan suatu obat,
c) Hanya diperlukan sedikit senyawa uji dalam pengujian,
d) Secara drastis mengurangi jumlah hewan yang dikorbankan untuk
pengambilan berbagai organ target (liver, ginjal, paru, kulit, sistem saraf, dsb),
dan
e) Dapat memberikan informasi secara langsung tentang potensi efek obat pada
Uji sitotoksisitas merupakan perkembangan untuk mengidentifikasi obat
sitotoksisitas baru atau deteksi obat dengan aktivitas antitumor. Sistem penetapan
aktivitas biologis akan menghasilkan kurva dosis respon, dan kriteria respon
seharusnya menunjukkan hubungan lurus dengan jumlah sel. Informasi yang
didapat dari kurva seharusnya berhubungan dengan efek in vivo dari obat
sitotoksisitas. Sitotoksisitas senyawa merupakan syarat aktivitas antikanker
(Burger, 1982).
Uji sitotoksisitas ialah suatu uji yang secara in vitro menggunakan kultur
sel dalam mengevaluasi keamanan obat, makanan, kosmetik maupun bahan-bahan
kimia lainnya (Freshney, 2000).
Uji sitotoksisitas ini merupakan suatu uji yang cepat, terstandarisasi,
sensitif dan tidak terlalu mahal, dengan kepentingan untuk menentukan apakah
suatu material mengandung bahan yang berbahaya (toksis) secara biologik dalam
jumlah yang signifikan. Sensitivitas yang tinggi dari uji ini karena adanya sel uji
yang terisolasi dalam kultur dan tidak adanya mekanisme protektif tubuh yang
mempengaruhi sel uji (Wallin, 1998).
Penetapan jumlah sel yang bertahan hidup pada uji sitotoksisitas dapat
dilakukan dengan berbagai cara. Penetapan dapat dilakukan berdasarkan pada
parameter kerusakan membran, gangguan sisntesis, dan degradasi makromolekul,
modifikasi kapasitas metabolisme, serta perubahan morfologi sel. Petunjuk
toksisitas berdasarkan adanya kerusakan membran, meliputi penghitungan sel
perubahan morfologi dapat diketahui dengan mikroskop elektron (Snell and
Mullock, 1987 cit Hussana, 1997).
Ada beberapa metode untuk mengetahui hasil uji sitotoksisitas, yaitu
metode Trypan Blue Staining, Tritium-labeled Thymidine dan MTT. Trypan Blue
Staining adalah cara sederhana untuk mengevaluasi integritas dari membran sel,
yang kemudian dari hasilnya dapat menunjukkan kematian atau proliferasi sel.
Namun metode ini kurang sensitif. Metode kedua yaitu Tritium-labeled Thymidine
adalah metode yang menggunakan senyawa radioaktif tritium yang dilabelkan
pada timidin. Pengukuran jumlah bahan radioaktif yang terambil oleh sel ini
sangat akurat namun metode ini memerlukan waktu yang lebih lama. Sedangkan
metode MTT adalah metode kolorimetrik yang mengukur hasil reduksi dengan
garam tetrazolium menjadi kristal formazan yang berwarna ungu oleh mitokondria
sel hidup melalui metabolismenya. Kemudian warna ungu yang dibentuk diukur
dengan pembacaan ELISA plate reader. Jumlah warna yang dibentuk
proporsional dengan jumlah sel yang hidup. Metode MTT bersifat kuantitatif dan
lebih sensitif bila dibandingkan dengan metode Trypan Blue Staining karena
adanya hubungan yang linear antara keaktifan sel dan absorbansi, jumlah sel yang
tumbuh maupun mati dapat diukur. Sedangkan Trypan Blue Staining bersifat
kualitatif dan hanya mengindikasikan sel yang masih hidup (Anonim, 2006a).
Penggunaan haemocytometer sangat umum dan sering dipakai dalam
penghitungan sel karena keefisienan dan keakuratannya. Digunakan suatu
chamber hitung yang kaku berbentuk kotak dan memiliki kedalaman 0,1 mm.
mikroskop dan sel dihitung pada sejumlah bilik yang dipilih. Dari perhitungan
yang dilakukan, dapat ditentukan jumlah sel per ml dari suspensi. Untuk
mengetahui sel yang hidup dan yang mati dapat digunakan zat penanda seperti
trypan blue (Doyle, 2000).
I. Landasan Teori
Sirih merah diketahui mengandung flavanoid, alkaloid, senyawa
polifenolat, tanin, dan minyak atsiri. Flavanoid mempunyai aktivitas anti-kanker,
yakni sebagai antioksidan yang akan mereduksi spesies oksigen (Grotewold,
2006). Flavonoid umumnya cukup larut dalam pelarut polar seperti etanol,
metanol, butanol, aseton, dimetilsulfoksida, dimetilformamid dan air (Markham,
1988). Saat ini belum terdapat publikasi penelitian mengenai efek sitotoksisitas
ekstrak daun sirih merah, oleh karenanya penelitian ini dilakukan untuk
mengetahui apakah ekstrak daun sirih merah berpotensi sebagai antikanker.
Penelitian ini bertujuan untuk mengetahui apakah ekstrak daun sirih
merah mempunyai efek sitotoksik untuk dikembangkan ke depannya sebagai
senyawa antikanker.
J. Hipotesis
Ekstrak etanolik daun sirih merah (Piper crocatum) memiliki potensi
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian mengenai uji sitotoksisitas ekstrak etanolik daun sirih merah
(Piper crocatum) terhadap kultur sel T47D ini termasuk penelitian eksperimental
murni dengan rancangan acak lengkap pola satu arah.
B. Variabel Penelitian dan Definisi Operasional
1. Variabel Bebas
Kadar ekstrak etanolik daun sirih merah yaitu 500 µg/ml; 750 µg/ml; 1000
µg/ml; 1250 µg/ml; 1500 µg/ml.
2. Variabel tergantung
Persentase kematian sel T47D.
3. Variabel pengacau terkendali
a. tempat tumbuh dan waktu pemanenan daun sirih merah dikendalikan
dengan memanen daun sirih merah pada tempat dan waktu yang sama.
b. medium tumbuh sel dikendalikan dengan menggunakan medium RPMI
1640-serum untuk sel T47D.
c. kematian alami sel dikendalikan dengan kontrol dan pemberian nutrisi.
4. Definisi operasional
a. sitotoksisitas ialah sifat toksik atau beracun dari ekstrak etanolik daun
b. ekstrak etanolik ialah ekstrak etanolik daun sirih merah, dinyatakan dalam
µg/ml.
c. Sel T47D merupakan suatu sel yang morfologinya seperti sel epitel yang
diambil dari jaringan payudara seorang wanita berumur 54 tahun, dan
merupakan sel kanker payudara ER-positif.
d. LC50 ialah konsentrasi ekstrak etanolik daun sirih merah yang mampu
membunuh atau menyebabkan kematian sejumlah 50% sel uji dan
dinyatakan dalam µg/ml.
C. Alat dan Bahan 1. Alat
Peralatan yang digunakan dalam penelitian ini antara lain: alat-alat gelas,
blender, timbangan analitik (Mettler Toledo), ayakan, waterbath, alumunium foil,
magnetic stirrer, tabung conical (Nunc), autoklaf, tissue culture flask (Nunc),
swing rotor sentrifuge (Centrifuge), inkubator (Memmer), mikropipet, lemari
pendingin (Sharp), cell counter (Nunc), 96-well plate (Nunc), ELISA reader
(Bioret), laminar air flow (Labconco), mikroskop (Olympus IMT-2),
haemocytometer (Nebauer Improved), oven, yellow tips, blue tips, effendorf,
tissue, glove, masker.
2. Bahan
a. Bahan utama
b. Bahan kimia
1) Bahan yang digunakan untuk ekstraksi (maserasi) daun sirih merah
adalah etanol 70%
2) Bahan yang digunakan untuk uji sitotoksisitas :
(a) T47D cell line yang diambil dari persediaan di Laboratorium
Penelitian dan Pengujian Terpadu (LPPT) Universitas Gadjah
Mada, Yogyakarta.
(b) Medium penumbuh sel : RPMI 1640 (Gibco), Foetal Bovine Serum
(FBS) 10% (Gibco), Penicillin-Streptomisin 1% (Gibco), Fungison
0,5% (Gibco).
(c) Media pencuci sel : RPMI 1640 (Gibco), natrium bikarbonat, Hepes.
(d) Reagen Stopper : SDS (Sodium Dodesil Sulfat) dalam HCl 0,01 N
(Merck)
(e) MTT (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium
bromide) (Sigma)
(f) Tripsin 0,5% (Sigma)
(g) Trypan blue (Sigma)
(h) DMSO (Sigma)
D. Tata Cara Penelitian 1. Determinasi tanaman
Bahan utama yang akan digunakan dalam penelitian yaitu daun sirih
merah, telah dideterminasi terlebih dahulu di Laboratorium Biologi Farmasi,
Fakultas Farmasi Universitas Gajah Mada, Yogyakarta mengacu pada referensi
Backer dan Brink (1965).
2. Pengumpulan daun sirih merah
Daun sirih merah yang digunakan diambil dari tanaman sirih merah yang
tumbuh di daerah Desa Mantenan, Kecamatan Mertoyudan, Kabupaten Magelang,
Propinsi Jawa Tengah.
3. Pembuatan ekstrak etanolik daun sirih merah
a) Pembuatan serbuk
Daun sirih merah yang telah dikumpulkan selanjutnya dibersihkan
dengan cara dicuci bersih dengan air mengalir untuk menghilangkan kotoran atau
debu yang melekat pada daun. Daun kemudian ditiriskan, dan dilakukan
pengeringan menggunakan oven pada suhu maksimal 60-70oC untuk mencegah
perubahan kimia yang terlalu besar. Simplisia yang sudah kering diblender,
diayak dengan pengayak nomor 80, dan serbuk yang diperoleh disimpan dalam
botol berwarna coklat.
b) Pembuatan ekstrak etanolik daun sirih merah (maserasi)
Serbuk simplisia diekstrak secara maserasi memakai etanol 70%. Untuk
tiap 100 gram serbuk digunakan 700 ml etanol 70%. Maserasi yang digunakan
dengan 500 ml etanol 70% dalam Erlenmeyer, kemudian ditutup dan dibiarkan
selama 24 jam terlindung dari cahaya matahari untuk mencegah reaksi yang
dikatalisis oleh cahaya atau perubahan warna. Setelah 24 jam sari diserkai,
disaring, ampas diperas. Ampas yang diperoleh kemudian ditambah cairan penyari
sebanyak 200 ml, diaduk dan diserkai. Bejana ditutup, dibiarkan di tempat sejuk,
terlindung dari cahaya, selama 2 hari kemudian endapan dipisahkan. Rendaman
harus dikocok berulang-ulang (kira-kira 3 x sehari). Setelah 2 hari maserat
disaring dengan kertas saring, kemudian ditampung. Maserat yang terkumpul
kemudian dipekatkan di atas waterbath dengan suhu 60-65oC, dibantu dengan
kipas angin sampai kental.
4. Sterilisasi alat dan bahan
Untuk mencegah terjadinya kontaminasi oleh organisme, maka alat-alat yang
digunakan dalam penelitian ini harus disterilkan terlebih dahulu. Alat-alat tersebut
dicuci bersih dengan deterjen dan dikeringkan, setelah itu dibungkus dengan
alumunium foil dan disterilkan dalam autoklaf selama 20 menit pada suhu 1210C,
tekanan 2,05 abs bar (Cook dan Martin, 2005).
5. Pembuatan medium pencuci dan medium penumbuh
a. Pembuatan medium pencuci
Medium pencuci dibuat dengan melarutkan RPMI 1640 dalam
aquabidest kurang lebih 80 ml, ditambah 2,3 g natrium bikarbonat, 2 g Hepes,
diencerkan sampai 100 ml, pH dibuat 7,2, lalu disterilkan dengan filter
berdiameter 0,22 μm. Medium disimpan dalam lemari es pada suhu 4oC
b. Pembuatan medium penumbuh (RPMI 1640-serum)
Untuk medium RPMI 1640-serum, ditambahkan FBS (Foetal Bovine
Serum) 10%, penisilin-streptomisin 1%, dan fungison 0,5% dalam medium RPMI
1640 dan disterilkan dengan filter berdiameter 0,22 μm. Media disimpan dalam
almari es pada suhu 4oC (Freshney, 1986; Jacoby dan Pastan, 1979; Sambrook et
al, 1989).
6. Pengaktifan dan panen Sel T47D a. Pengaktifan Sel T47D
Sel diambil dari tangki nitrogen cair, kemudian segera dicairkan dalam
penangas air 37oC, kemudian ampul disemprotkan dengan etanol 70%. Ampul
dibuka dan sel T47D dipindahkan dalam tabung conical steril yang berisi medium
RPMI 1640. Suspensi sel disentrifugasi selama 5 menit, supernatan dibuang,
diganti dengan medium RPMI 1640 yang baru, kemudian disuspensikan perlahan.
Suspensi sel lalu disentrifugasi kembali selama 5 menit kemudian dicuci ulang
sekali lagi. Supernatan dibuang, pelet ditambahkan 1 ml medium penumbuh yang
mengandung 10% FBS. Resuspensikan secara perlahan sampai homogen,
kemudian sel ditumbuhkan dalam tissue culture flask kecil dan diinkubasikan
dalam inkubator dengan suhu 37oC dengan aliran 5% CO2. Setelah 24 jam,
medium penumbuh diganti dan sel ditumbuhkan hingga konfluen dan jumlahnya
cukup untuk penelitian.
b. Panen Sel T47D
Setelah jumlah sel cukup (kurang lebih setelah berumur 7 hari), media
dinding flask dengan cara diresuspensikan menggunakan pipet Pasteur. Sel
dipindahkan dalam tabung conical steril dan ditambahkan medium RPMI sampai
volume 10 ml dan disentrifugasi 3000 rpm selama 5 menit. Supernatan dibuang
dan pelet sel diresuspensikan perlahan dengan 1 ml medium. Sel kemudian
dihitung menggunakan haemocytometer. Suspensi sel ditambah sejumlah medium
sehingga memperoleh konsentrasi sel sebesar 2x104/100 μl dan siap dipakai untuk
penelitian.
7. Pembuatan larutan uji
Ekstrak kental ditimbang, dilarutkan dengan pelarut DMSO dan dikocok
sampai homogen untuk mendapatkan sediaan ekstrak induk dengan konsentrasi
100 mg/ml. Sebelum digunakan, sediaan ekstrak induk disterilkan dengan
membran filter. Dari sediaan steril ekstrak induk tersebut dibuat larutan uji dengan
konsentrasi ekstrak etanolik daun sirih merah 500 µg/ml; 750 µg/ml; 1000 µg/ml;
1250 µg/ml; 1500 µg/ml.
8. Uji sitotoksisitas ekstrak etanolik daun sirih merah pada sel T47D a. Metode MTT
Untuk uji sitotoksisitas, sebanyak 100 μl ekstrak etanolik daun sirih
merah dengan kadar 500 µg/ml, 750 µg/ml, 1000 µg/ml, 1250 µg/ml, dan 1500
µg/ml dimasukkan ke dalam 100 μl suspensi sel T47D dengan kepadatan
2x104/100 μl dalam sumuran-sumuran 96-well plate yang berbeda. Sebagai
kontrol, 100 µl suspensi sel ditambahkan ke dalam sumuran yang berisi medium
diinkubasikan selama 24 jam pada suhu 37oC, dalam inkubator dengan aliran 5%
CO2.
Pada akhir inkubasi, ke dalam masing-masing sumuran ditambahkan 10
μl MTT 2,5 μg/ml dalam media RPMI 1640, lalu diinkubasikan semalam pada
suhu 37oC, dalam inkubator dengan aliran CO2 5%. Sel hidup akan bereaksi
dengan MTT dan membentuk warna ungu. Reaksi dihentikan dengan
menambahkan 50 μl reagen stopper pada setiap sumuran dan inkubasi semalam
pada suhu kamar. Serapan setiap sumuran dibaca deangan ELISA reader pada
panjang gelombang 550 nm. Besarnya serapan berbanding lurus dengan jumlah
sel yang hidup.
b. Metode Perhitungan Langsung (direct counting)
Seratus μl suspensi sel T47D dengan kepadatan 2x104 sel/100 μl
dimasukkan ke dalam sumuran pada mikro plate 96, ditambahkan ekstrak etanolik
uji pada kadar 500 µg/ml; 750 µg/ml; 1000 µg/ml; 1250 µg/ml; 1500 µg/ml.
Untuk kontrol digunakan 200 μl suspensi sel dalam media penumbuh. Selanjutnya
plate diinkubasi dalam inkubator aliran 5% CO2 selama 24 jam pada suhu 37oC.
Pada akhir masa inkubasi tiap sumuran diresuspensi, kemudian ditambahkan 50 μl
trypan blue, lalu diresuspensikan lagi untuk homogenisasi, dan diambil 10 μl yang
ditempatkan di Haemocytometer, sel siap dihitung dengan counter di bawah
mikroskop. Sel yang hidup akan tampak relatif bulat transparan. Sedangkan sel
E. Analisis Hasil
Jumlah sel hidup yang yang telah dihitung pada masing-masing kadar
ekstrak etanolik sirih merah digunakan untuk menentukan persentase kematian
dengan rumus :
% kematian sel = x100%
A B A−
Keterangan : A = Jumlah sel hidup pada sumuran kontrol media
B = Jumlah sel yang hidup pada sumuran yang telah diberi perlakuan ekstrak etanolik sirih merah
Dari data % kematian tersebut, dibuat persamaan regresi linear antara log kadar
ekstrak etanolik sirih merah vs harga probit. Dari persamaan regresi tersebut maka
harga LC50 ekstrak etanolik sirih merah dapat dihitung. Selanjutnya, untuk dapat
mengetahui apakah ekstrak etanolik daun sirih merah bersifat sitotoksik terhadap
kultur sel T47D atau tidak, maka dilakukan analisis menggunakan one-way
ANOVA, dengan sebelumnya dilakukan uji Kolmogorov-Smirnov untuk
BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi tanaman
Determinasi tanaman dilakukan untuk memastikan kebenaran tanaman
yang digunakan dalam penelitian. Determinasi dilakukan di di Laboratorium
Biologi Farmasi, Fakultas Farmasi Universitas Gajah Mada, Yogyakarta dengan
mengacu pada referensi Backer dan Brink (1965).
Hasil determinasi menunjukkan bahwa tanaman yang digunakan adalah
sirih merah (Piper crocatum Ruiz & Pav) (lampiran 11).
B. Pengumpulan daun sirih merah
Penelitian ini menggunakan bagian daun dari tanaman sirih merah. Daun
yang diambil adalah daun yang masih segar dan tidak berpenyakit, selain itu
daunnya haruslah cukup tua karena senyawa yang mempunyai aktivitas biologis
adalah senyawa yang termasuk metabolit sekunder (Harborne, 1987).
Pengambilan dilakukan di daerah Desa Mantenan, Kecamatan Mertoyudan,
Kabupaten Magelang, Propinsi Jawa Tengah. Pemanenan dilakukan pada pagi
hari dengan tujuan agar daun yang dipetik masih dalam keadaan segar, kalau
dipetik pada siang hari maka daun akan menjadi layu. Daun yang telah dipetik
kemudian dicuci dengan air mengalir. Hal ini dilakukan dengan tujuan untuk
menghilangkan kotoran-kotoran yang menempel pada permukaan daun, misalnya
Daun kemudian dikeringkan di dalam oven. Pengeringan dilakukan
dengan tujuan untuk mengurangi kadar air yang terdapat di dalam daun. Air
merupakan media untuk terjadinya reaksi enzimatik. Jika terjadi reaksi enzimatik
maka kandungan metabolit sekundernya akan dipecah menjadi senyawa baru.
Daun yang telah kering kemudian diserbuk. Penyerbukan bertujuan untuk
memperluas area kontak antara bahan yang akan disari dengan cairan penyari.
C. Sterilisasi alat dan bahan
Alat-alat yang akan digunakan dalam penelitian ini harus disterilkan
terlebih dahulu dengan tujuan untuk menghilangkan semua pengotor dan
kontaminan yang dapat mengganggu pada saat proses penelitian. Sterilisasi
dilakukan dengan menggunakan metode uap panas bertekanan yang dilakukan
pada suhu 121°C selama kurang lebih 20 menit dengan tekanan 2,05 abs bar.
Metode uap panas ini dapat membunuh mikroorganisme secara cepat disebabkan
uap air panas yang lebih mudah melakukan penetrasi ke dalam membran sel
mikroorganisme. Prinsip pemusnahan mikroorganisme dengan metode ini adalah
uap air panas yang berpenetrasi ke dalam sel mikroorganisme akan
mengakibatkan koagulasi dan denaturasi protein mikroorganisme. Penetrasi uap
air panas yang cepat mengakibatkan perusakan sel mikroorganisme yang lebih
cepat.
D.Maserasi
Ekstraksi serbuk daun sirih merah dilakukan dengan metode maserasi
dengan menggunakan etanol 70%, dengan menggunakan etanol 70% diharapkan
memperluas area kontak dengan larutan penyari sehingga lebih banyak zat aktif
yang ikut tersari ke dalam pelarut. Maserasi merupakan cara penyarian yang
sederhana. Maserasi dilakukan dengan merendam serbuk simplisia dalam cairan
penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga
sel yang mengandung zat aktif, sehingga zat aktif akan terlarut. Karena adanya
perbedaan konsentrasi antara larutan zat terlarut di dalam sel dengan yang di luar
sel maka larutan yang pekat akan didesak keluar. Peristiwa ini terjadi
berulang-ulang hingga terjadi keseimbangan konsentrasi antara larutan di dalam sel dengan
yang di luar sel.
Etanol memiliki beberapa kelebihan sebagai pelarut penyari, yaitu lebih
selektif, kapang dan kuman sulit tumbuh dalam etanol 20% ke atas, tidak beracun,
netral, absorbansinya baik, dapat bercampur dengan air pada segala perbandingan,
dan panas yang diperlakukan untuk pemekatan lebih sedikit (Hargono et al, 1986).
Maserasi dilakukan selama 3x24 jam. Untuk tetap menjaga gradient
konsentrasi antara cairan penyari di dalam sel dengan yang di luar sel, maka perlu
dilakukan pengadukan. Setelah 3 hari maserat disaring dengan kertas saring,
kemudian ditampung. Maserasi diulang dengan menggunakan cairan penyari
sebanyak 2 kali. Hal ini dilakukan agar kandungan metabolit daun yang terisolasi
semakin banyak. Maserat yang terkumpul kemudian dipekatkan di atas waterbath
dengan suhu 60-65oC dengan bantuan kipas angin, dengan begitu maka suhu
penguapan tidak akan terlalu tinggi sehingga metabolit yang bersifat termolabil
E. Uji sitotoksisitas ekstrak etanolik daun sirih merah pada sel T47D
Uji sitotoksisitas dilakukan untuk mengetahui potensi ketoksikan suatu
senyawa yang dinyatakan dalam parameter LC50 (Lethal Concentration 50%).
Nilai LC50 merupakan konsentrasi ekstrak daun sirih merah yang mampu
membunuh atau menyebabkan kematian sejumlah 50% sel uji dan dinyatakan
dalam µg/ml. Uji sitotoksisitas yang dilakukan dalam penelitian ini merupakan uji
sitotoksisitas secara in vitro, di mana pengujian dilakukan dengan cara
memberikan perlakuan ekstrak daun sirih merah 500 µg/ml; 750 µg/ml; 1000
µg/ml; 1250 µg/ml; 1500 µg/ml pada kultur sel T47D.
Pada penelitian ini dilakukan pengamatan morfologi sel T47D dengan
tujuan untuk mengetahui adanya perbedaan morfologi sel yang dikenai perlakuan
dan tidak dikenai perlakuan.
ii
i
i
(a) (b)
Gambar 1. Sel T47D tanpa perlakuan ekstrak etanolik daun sirih merah (a) sel T47D yang diinkubasi dengan ekstrak etanolik daun sirih merah dengan konsentrasi 1250
μg/ml (b); (i) sel hidup (ii) sel mati (perbesaran 100x)
Sel T47D yang hidup tampak berbentuk panjang dan menempel pada flask. Sel
T47D yang mati tampak berbentuk bulat, berukuran lebih kecil, dan tidak
Uji sitototksisitas terhadap sel T47D pada penelitian ini dilakukan
dengan metode direct counting (perhitungan langsung), namun sebelumnya
terlebih dahulu dilakukan orientasi dengan metode MTT
(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide).
Metode MTT pada prinsipnya merupakan metode spektroskopi, yaitu
dengan menetapkan absorbansi garam formazan yang dilarutkan dalam SDS 10%
dalam HCl. Dalam hal ini garam tetrazolium MTT
(3-(4,5-dimetil-tiazol-2-il)-2,5-dipheniltetrazolium bromid) oleh enzim reduktase akan dipecah menjadi
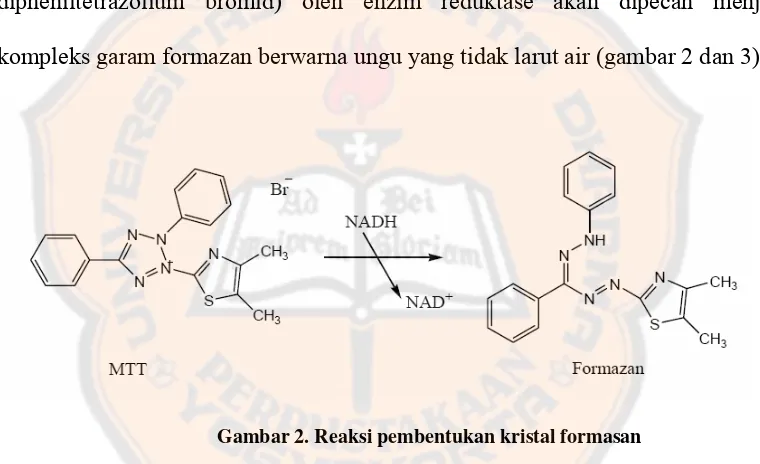
kompleks garam formazan berwarna ungu yang tidak larut air (gambar 2 dan 3).
Gambar 2. Reaksi pembentukan kristal formasan
Dengan penambahan detergen dalam stopper reagent (natrium dodesil sulfat 10%
dalam HCl), garam formasan ini akan larut sehingga intensitas warna ungu yang
terbentuk dapat dibaca dengan ELISA reader. Jumlah sel hidup berbanding lurus
dengan intensitas warna dari formazan yang terbentuk. Pada metode MTT,
absorbansi ini berhubungan dengan jumlah formazan yang terbentuk yang
berhubungan langsung dengan jumlah sel hidup. Formasan ini hanya terbentuk
oleh enzim mitokondria yang berhubungan dengan pernapasan sel, karena itu sel
Gambar 3. Kristal Formazan di Bawah Mikroskop (perbesaran 100x)
Metode MTT ini termasuk metode yang cukup akurat karena absorbansi yang
terbaca sebanding dengan jumlah sel hidup yang masih aktif melakukan
metabolisme. Selain itu, uji ini juga dirasa cukup aman, sederhana, dan cepat.
Aman karena tidak memerlukan penggunaan zat-zat yang berbahaya, sederhana
karena perlakuan yang harus diberikan pada sample sebelum diuji relatif cukup
mudah, dan cepat karena waktu yang dibutuhkan cukup singkat sehingga sangat
memungkinkan untuk menguji sampel dalam jumlah yang cukup banyak. Selain
itu, metode ini relatif lebih mudah karena tidak perlu melepaskan sel dari plate.
Pada penelitian diperoleh hasil absorbansi sampel lebih besar dari absorbansi
kontrol, hal ini disebabkan oleh karena ekstrak daun sirih merah yang diteliti
berwarna sehingga ikut memberikan absorbansi. Selanjutnya tidak dilakukan uji
dengan metode MTT tapi menggunakan metode direct counting.
Metode direct counting, yaitu uji sitotoksisitas secara manual dengan menghitung
jumlah sel dibandingkan dengan kontrol dalam mikro plate 96 sumuran
(Dhopdaker et al, 1998). Metode direct counting dilakukan dengan cara
menghitung sel hidup pada haemocytometer (bilik hitung) secara langsung dengan
counter di bawah mikroskop inverted. Pada metode ini, sel yang telah diinkubasi
dahulu, kemudian ditempatkan pada haemocytometer dan dihitung satu persatu.
Oleh karenanya, sel harus terlepas dan terambil semuanya dari sumuran agar
jumlah sel yang diperoleh benar-benar sesuai dengan keadaan yang sebenarnya.
Sebagaimana telah diketahui bahwa sel T47D yang hidup akan menempel pada
dasar sumuran dengan kuat, sehingga untuk melepaskannya digunakanlah tripsin.
Penggunaan tripsin ini haruslah dengan hati-hati karena dapat membunuh sel
T47D yang berakibat data yang diperoleh menjadi bias, sehingga dalam hal ini
ada dua hal yang perlu diperhatikan, yaitu konsentrasi tripsin dan lama pemaparan
sel dengan tripsin.
Untuk membedakan sel yang hidup dan yang mati digunakan pewarna
trypan blue. Dengan penambahan trypan blue maka sel yang masih hidup di
bawah mikroskop akan terlihat bulat cemerlang, sedangkan sel yang mati akan
tampak gelap dan tidak cemerlang.
Gambar 4. Sel T47D pada kontrol (a) dan sel T47D dengan pemberian ekstrak etanolik daun sirih merah kadar 500 µg/ml (b) setelah pemberian trypan blue, pada bilik
haemocytometer di bawah mikroskop; (i) sel hidup (ii) sel mati (perbesaran 100x)
Prinsip trypan blue adalah sel yang masih hidup akan bersifat impermeable
terhadap trypan blue, sedangkan sel yang mati menyerap trypan blue. Pemberian
yang terlalu lama akan menyebabkan sel yang masih hidup juga akan menyerap
warna, akibatnya tidak bisa dibedakan antara sel yang masih hidup dengan yang
mati (waktu pemaparan jangan sampai lebih dari 2 menit) (Freshney, 2000).
Pemberian pewarna trypan blue dilakukan saat akan dilakukan perhitungan
sehingga dapat meminimalkan pengaruh trypan blue.
F. Analisis Hasil
Data yang diperoleh dari uji toksisitas dengan metode direct counting ini
akan menghasilkan data jumlah sel sel yang hidup dari tiap perlakuan dengan
pemberian ekstrak sirih merah dengan berbagai kadar. Kemudian dari data jumlah
sel yang hidup tersebut ditentukan persentase kematian sel. Konsentrasi ekstrak
sirih merah yang digunakan yaitu 500 μg/ml; 750 μg/ml; 1000 μg/ml; 1250 μg/ml;
1500 μg/ml.
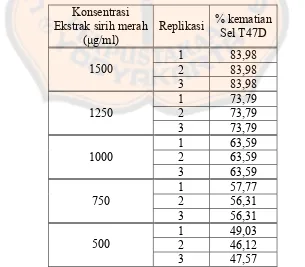
Tabel I. Hasil uji sitotoksisitas ekstrak etanolik daun sirih merah terhadap kultur sel T47D
Konsentrasi Ekstrak sirih merah
(μg/ml)
konsentrasi vs % kematian sel T47D
0 200 400 600 800 1000 1200 1400 1600
konsentrasi (ug/ml)
Gambar 5. Konsentrasi ekstrak etanolik daun sirih merah vs persentase kematian sel T47D
Nilai persentase kematian sel T47D yang didapat cukup tinggi dan relatif terus
meningkat seiring dengan meningkatnya konsentrasi yang diberikan. Pada
konsentarasi 1500 μg/ml, terlihat persen kematian sel yang paling tinggi.
Kemudian dari data persentase kematian tersebut, dibuat persamaan regresi linear
antara log kadar ekstrak sirih merah vs harga probit. Dari persamaan regresi
tersebut maka harga LC50 ekstrak sirih merah dapat dihitung. Harga konversi
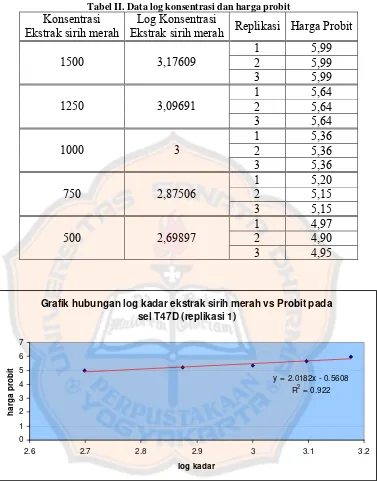
Tabel II. Data log konsentrasi dan harga probit
Konsentrasi Ekstrak sirih merah
Log Konsentrasi
Ekstrak sirih merah Replikasi Harga Probit 1 5,99
Grafik hubungan log kadar ekstrak sirih merah vs Probit pada sel T47D (replikasi 1)
y = 2.0182x - 0.5608
Grafik hubungan log kadar ekstrak sirih merah vs Probit pada sel T47D (replikasi 2)
y = 2.1848x - 1.0795
Gambar 7. Grafik hubungan log kadar ekstrak sirih merah vs probit pada sel T47D pada replikasi 2
Grafik hubungan log kadar ekstrak sirih merah vs Probit pada sel T47D (replikasi 3)
y = 2.0895x - 0.7866
Gambar 8. Grafik hubungan log kadar ekstrak sirih merah vs probit pada sel T47D pada replikasi 3
Dari persamaan regresi tersebut maka dapat ditentukan harga LC50 ekstrak sirih
merah terhadap sel kanker payudara (T47D) dengan analisa probit. Dari hasil
pengolahan data, diperoleh harga LC50, adalah sebesar 587,7 μg/ml. Berdasarkan
NCI (National Cancer Institute), suatu senyawa dinyatakan berpotensi sebagai
antikanker bila memiliki harga LC
50 ≤ 20 μg/ml (Suffness dan Pezzuto, 1991).
antikanker ataupun tidak dikarenakan senyawanya masih berupa ekstrak dan
belum berupa senyawa tunggal.
Hasil yang diperoleh pada penelitian ini berbeda dengan penelitian uji
sitotoksisitas ekstrak daun sirih merah terhadap sel Hela, sel SiHa, sel Raji, dan
sel Myeloma. Pada penelitian terhadap sel Hela, diperoleh nilai LC
50 yang lebih
besar, yakni 1143,1 μg/ml (Atmaningsih, 2008), namun pada penelitian terhadap
sel SiHa, sel Raji, dan sel Myeloma diperoleh nilai LC
50 yang lebih kecil. Pada sel
SiHa diperoleh nilai LC50 sebesar 200,6 μg/ml (Nur’aniyah, 2008), pada sel Raji
diperoleh nilai LC50 sebesar 395,5 μg/ml (Kusumaningtyas, 2008), sedangkan
pada sel Myeloma diperoleh nilai LC50 sebesar 434,1 μg/ml (Meri, 2008).
Perbedaan ini diduga dikarenakan oleh karakteristik dari masing-masing sel
berbeda, seperti halnya pada sel Hela, sel Hela diketahui mempunyai membran
sitoplasma yang lebih tebal, oleh karenanya dibutuhkan jumlah ekstrak daun sirih
merah yang lebih besar untuk dapat berpenetrasi ke dalam sel.
Nilai LC50 ekstrak etanolik daun sirih merah terhadap sel T47D signifikan
untuk taraf kepercayaan 95%, di mana r hitung lebih besar dari r tabel (lampiran
5). Setelah dilakukan penetapan nilai LC50, kemudian dianalisis dengan uji
Kolmogorov-Smirnov untuk melihat distribusi datanya. Dari hasil pengolahan
data, dapat diketahui bahwa data tersebut memenuhi persyaratan uji normalitas
atau mempunyai distribusi normal (lampiran 6). Berdasarkan asumsi tersebut,
perlu diuji signifikansinya untuk melihat adanya perbedaan yang bermakna antara
kontrol dan tiap perlakuan melalui one-way ANOVA. Dari hasil pengolahan data
perlakuan (lampiran 7). Oleh karena itu dapat dikatakan bahwa ekstrak etanolik
daun sirih merah memiliki efek sitotoksik terhadap kultur sel T47D. Hasil
penelitian ini tidak berbeda dengan penelitian terhadap sel Hela, sel SiHa, sel Raji,
dan sel Myeloma, yakni sama-sama mempunyai aktifitas sitotoksik karena
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Ekstrak etanolik daun sirih merah (Piper crocatum) memiliki efek
sitotoksisitas terhadap kultur sel T47D, dengan nilai LC50 sebesar 587,7 μg/ml.
B. Saran
1. Perlu dilakukan uji sitotoksisitas ekstrak etanolik daun sirih merah terhadap
kultur sel normal.
2. Perlu dilakukan penelitian lebih lanjut uji secara in vivo untuk mengetahui
secara pasti mekanisme antikanker dari ekstrak daun sirih merah terhadap sel
kanker payudara T47D, misal apoptosis, antiproliferatif.
3. Perlu dilakukan fraksinasi untuk memperoleh fraksi aktif dari daun sirih
DAFTAR PUSTAKA
Anonim, 1986, Sediaan Galenik, 17, 25-26, Direktorat POM, Jakarta
Albert, et al, 1994, Mollecular Biology of The Cell, 3rd ed., Gerland Publishing, USA
Anonim, 1995, Farmakope Indonesia, edisi IV, 7, Departemen Kesehatan RI, Jakarta
Anonim, 2000, Parameter Standar Umum Ekstrak Tumbuhan Obat, Departemen Kesehatan RI, Jakarta
Anonim, 2005, Kanker, http://www.groups.or.id/wikipedia/id/k/a/n/Kanker.html, Diakses tanggal 4 September 2007
Anonim, 2007, Sirih Merah, http:// www.plantamor.com/ spcdtail.php?recid= 2092&popname=Sirih20%Merah&satugen =&satuspc=, Diakses taanggal 27 Februari 2007
Anonim, 2008a, A-Z Kanker Payudara pada Perempuan,http:// www.conectique. com /women_health_concern/ article.php?article_id =5494, diakses tanggal 10 Mei 2008
Anonim, 2008b, Piper ornatum, http:// toptropicals.com/ catalog/ uid/ Piper_ornatum.htm, diakses tanggal 10 Mei 2008
Atmaningsih, F. R., 2008, Uji Sitotoksisitas Ekstrak Etanolik Daun Sirih Merah (Piper crocatum Ruiz & Pav) terhadap Kultur Sel Hela, Skripsi, Fakultas Farmasi USD, Yogyakarta
Backer, C. A., dan R. C. Bakhuizen Van Den Brink, 1986, Flora of Java, 3rd ed., Noordhoff and Groningen, Netherland
Burger, M., 1982, Burger’s Medicinal Chemistry, 4th Ed, 681-694, John Willey and Son Interscience, New York
De Muth, J. E, 1999, Basic Statistic and Pharmaceutical Statistical Application, 585, Marcell Dekker, Inc., New York