28
miR-21 Expression in Grade I, II, and III Breast Cancer
Juwita1)2), Henny E.S. Ompusunggu1)3),Donny Nauphar4), SumondangM. Pardede5), Hadyanto Lim6)7), Yahwardiah Siregar1)8)
1)MastersProgram in Biomedical Sciences, Faculty of Medicine, North SumatraUniversity, Medan 2) Department of Biochemistry, Faculty of Medicine, Syiah Kuala University, Banda Aceh
3) Department of Cellular and Molecular Biology, Faculty of Medicine, HKBP Nommensen University, Medan
4) Department of Biochemistry, Faculty of Medicine, Swadaya Gunung Jati University, Cirebon 5)Department of Anatomical Pathology Dr H. Adam Malik Hospital, Medan
6) Department of Pharmacology, Faculty of Medicine, Methodist Indonesia University, Medan 7) Department Biomolecular, Faculty of Medicine, Methodist Indonesia University, Medan
8)Department of Biochemistry, Faculty of Medicine, North Sumatra University, Medan ABSTRACT
Background: Breast cancer is the second largest cancer in the world.The gold standard for breast cancer diagnosis and prognosis is grade assessment (mitotic, nuclear pleiomorphism, tubular formation), based on breast tissue histopathology. However, this assessment has limitation in that it is subjective and semi quantitative. A genetic biomarker known as microRNA (miRNA) may regulate human gene expression by targetting mRNA. One of the miRNA, i.e. miR-21, is able to suppress tumor suppressor mRNA, resulting in increased cellular proliferation andneoplastic transformation, and decreased apoptosis. This study aimed to investigate the expression of miR-21in breast cancer with histopathologic grade I, II, and III.
Subjects and Method: This was a descriptive study with cross-sectional design involving paraffin block (FFPE) samples of ductal-type breast cancer tissue. Sixty four samples were obtained from the department of Anatomical Pathology, Haji Adam Malik Hospital, Medan. Patients history were obtained through medical records followed by sample processing (Total RNA Isolation, cDNA Synthesis, and Examination of miR-21 Expression using Real-Time qPCR). MiR-21 expression from every hystopathologic grade was obtained using Fold Change Calculation.
Result: Breast cancer occurred more frequently in age group of 30-49 years old. Based on the histopathologic grade, most breast cancer was found in grade II. Analysis of miR-21 expression showed that miR-21 expression was higher in grade III compared to other grade.
Conclusion: Breast cancer occured more frequently in the productive age group.Most breast cancer were found in grade II. Increased miR-21 expression in grade III may suggest that miR-21 is an oncomiR, which plays an important role in the development of malignant breast cancer.
Keywords: breast cancer, histopathology grade, miRNA, miR-21.
LATAR BELAKANG
Kanker payudara merupakan jenis kanker kedua terbanyak di dunia (Ferlay et al, 2010; Kementerian Kesehatan Indonesia,
2013). Berdasarkan data dari Rumah Sakit Umum Pusat Haji Adam Malik Medan, In-donesia, terdapat 200 penderita baru yang didiagnosa kanker payudara selama tahun Correspondance :
Juwita
MastersProgram in Biomedical Sciences, Faculty of Medicine,
North SumateraUniversity, Medan HP: 08125262339
29 2012. Pemeriksaan histopatologi jaringan
payudara merupakan Gold Standard untuk penegakan diagnosis, dan untuk perkiraan prognosis melalui grade histopatologi. Gra-de histopatologi merupakan penilaian Gra- de-rajat diferensiasi kanker (mitosis sel, plei-omorfisme inti sel, dan formasi tubulus), yang terkait dengan perkiraan prognosis penderita (Tavassoli and Devilee, 2003; Malhotra et al, 2010). Metode penilaiannya sudah banyak digunakan (Rakha et al, 2010), namun memiliki keterbatasan yaitu subjektif dan semikuantitatif. Sehingga di-butuhkan biomarker lain yang lebih objektif untuk melengkapi prognosis. Biomarker kanker payudara yang cukup potensial dan banyak diteliti saat ini adalah microRNA.
MicroRNA (miRNA) merupakan RNA endogen non-coding dengan panjang 18-22 nukleotida, dan berperan penting dalam re-gulasi ekspresi gen. MiRNA bekerja dengan cara mendegradasi atau menghambat trans-lasi mRNA target; sehingga miRNA dapat mempengaruhi ekspresi protein(Calin and Croce, 2006; Cho, 2007), termasuk protein yang berperan dalam perkembangan kanker payudara. MicroRNA-21 (miR-21) meru-pakan microRNA yang mengalami pening-katan ekspresi pada kanker payudara, de-ngan menekan atau menghambat translasi protein tumorsupressor (Iorio et al, 2005). Akibatnya terjadi proliferasi sel tidak ter-kontrol (dapat dinilai melalui komponen grading yaitu penghitungan mitosis sel). Tingginya ekspresi miR-21 pada penderita kanker payudara diduga terkait dengan prognosis buruk (Lee et al, 2011).
Penelitian mengenai microRNA dan kaitannya dengan kanker di Indonesia masih sangat terbatas, sehingga penelitian ini bertujuan untuk mempelajari bagaimana ekspresi miR-21 terhadap grade histopa-tologi jaringan kanker payudara dari
penderita khususnya di kota Medan, Indonesia.
SUBJEK DAN METODE
Izin penelitian telah diperoleh dari Komite Etik Penelitian FK USU Medan Indonesia. Desain penelitian adalah cross sectional dengan jenis deskriptif. Subjek yang di-gunakan adalah blok parafin (FFPE) jaringan kanker payudara tipe duktal inva-sif, dengan jumlah 64 subjek yang diperoleh dari Bagian Patologi Anatomi Rumah Sakit Haji Adam Malik Medan. Pemilihan subjek secara purposive sampling, dibantu oleh ahli Patologi Anatomi. Variabel yang diteliti adalah ekspresi miR-21 (independen)dan grade histopatologi jaringan kanker payudara (dependen).Data subjek peneliti-an dpeneliti-an pengambilpeneliti-an subjek dilakukpeneliti-an di Rumah Sakit Haji Adam Malik Medan. Penilaian grade diperoleh dari data rekam medis penderita kanker payudara. Peme-riksaan miR-21 dilakukan di Laboratorium Biologi Molekular FK UGM, melalui tahap isolasi RNA dari subjek FFPE, pemeriksaan konsentrasi RNA, sintesis cDNA, dan ana-lisis ekspresi miR-21 menggunakan Real Time-qPCR. Menggunakan formulasi Fold
Change, diperoleh ekspresi miR-21 pada
se-tiap grade histopatologis, kemudian dila-kukan uji normalitas dan analisis deskriptif.
ISOLASI RNA TOTAL DARI BLOK PARAFIN (FFPE)
Blok parafin diiris menggunakan mikrotom dengan ketebalan 7 μm, lalu dimasukkan ke tabung sentrifus 1,5 mL. Proses isolasi RNA Total dilakukan berdasar panduan Tiangen RNAprep Pure FFPE Kit. Masukkan Xylene 1 mL ke dalam tabung tersebut, vorteks dan sentrifuga pada kecepatan 12.000 rpm, lalu supernatan diaspirasi dan dibuang. Masuk-kan ethanol 1 mL, dengan tahapan sama seperti Xylene. Keringkan pellet dari
30
ethanol. Masukkan buffer dan Proteinase K ke dalam tabung tersebut, vortex. Tabung diinkubasi pada suhu 550 C dan 800 C.
Sentrifuga tabung, pindahkan supernatan ke tabung baru. Masukkan buffer ke dalam tabung baru, vortex. Tambahkan Ethanol ke dalam tabung, vortex. Campuran tersebut dipindahkan ke Spin Column CR3, sen-trifus, buang cairan dalam tabung. Disiap-kan larutan kerja DNAse I. MasukDisiap-kan laru-tan kerja DNAse I ke Spin Column CR3, in-kubasi 15 menit. Masukkan Buffer RW1 ke dalam Spin Column CR3, sentrifuga, buang cairan dalam tabung. Masukkan buffer RW ke dalam Spin Column CR3, inkubasi 2 menit, sentrifuga, buang cairan dalam tabung. Sentrifuga tabung koleksi selama 2 menit, lalu buang cairan dalam tabung. Membran Spin Column CR3 dikeringkan. Letakkan Spin Column CR3 ke tabung sentrifuga baru, masukkan RNAse-freeH2O
ke membran. Tutup tabung, inkubasi, sen-trifuga sampai diperoleh RNA Total. Tutup tabung sentrifuga yang berisi RNA Total, tutup tabung, simpan dalam lemari pendingin.Selanjutnya konsentrasi RNA total diperiksa menggunakan NanoDrop Spectrophotometer.
SINTESIS CDNA DARI RNA TOTAL
Bahan yang digunakan adalah sampel RNA, Reaction Buffer, Nuclease-Free Water, Spike in (UniSp6, sebagai kontrol internal), dan Mixed Enzyme. Langkah ini dilakukan berdasar panduan kit sintesis cDNA dari miRCURY LNATM Universal RT microRNA
PCR (Exiqon). Sampel RNA dicairkan per-lahan di suhu ruang, vortex, dan spindown. Keluarkan 5x Reaction Buffer, Nuclease-free water, dan Spike in (UniSp6) dari le-mari pendingin dan cairkan di suhu ruang, vortex, spindown. Ambil Mix Enzyme dari lemari pendingin, dilakukan homogenisasi, pembuatan Master Mix, vortex, dan
spindown. Master Mix dibagikan ke setiap tabung PCR, lalu masukkan sampel RNA ke tabung PCR, spindown. Masukkan tabung PCR ke dalam alat RT-PCR, jalankan sesuai program. Setelah selesai, hasil cDNA disimpan dalam lemari pendingin.
ANALISIS miR-21DENGAN qRT-PCR
Bahan-bahan yang digunakan adalah cDNA, SYBR Green Master Mix, primer miR-21 (hsa-miR-21), dan primer UniSp6. Langkah ini dilakukan berdasar panduan kit miRCURY LNATMUniversal RT microRNA
PCR (Exiqon). cDNA dicairkan perlahan di suhu ruang, vortex, spindown. cDNA diencerkan dahulu di dalam tabung sentrifuga 1,5 mL, vortex, kemudian spin-down. Keluarkan SYBR Green Master Mix, Primer set miR-21, dan Primer Spike in (UniSp6) dari lemari pendingin. Dilakukan homogenisasi SYBR Green, primer miR-21, dan primer Spike in dengan Thawing, dan vortex. DibuatMaster Mix untuk hsa-miR-21 dan kontrol Spike in. Master Mix terse-but dimasukkan ke tiap tabung qPCR, kemudian ditambahkansampel cDNA. Diberi identitas pada tiap tabung, tabung dimasukkan ke dalam mesin qRT-PCR, atur program Real-Time qPCR, danjalankan sesuai program.
ANALISIS STATISTIK
Data yang diperoleh berupa ekspresi miR-21 (berdasarkan formulasi Fold Change dari perolehan nilai Cq miR-21 dan UniSp6 menggunakan qRT-PCR), dan kemudian dilakukan uji normalitas. Kolmogorov-Smirnov dan analisis deskriptif.
HASIL
Telah dilakukan penelitian deskriptif me-ngenai gambaran ekspresi miR-21 terhadap grade histopatologi kanker payudara,
31 menggunakan 64 subjek blok parafin
(FFPE) jaringan kanker payudara tipe duk-tal invasif. Dilakukan analisis data seperti berikut ini.
A. Karakteristik Subjek Penelitian
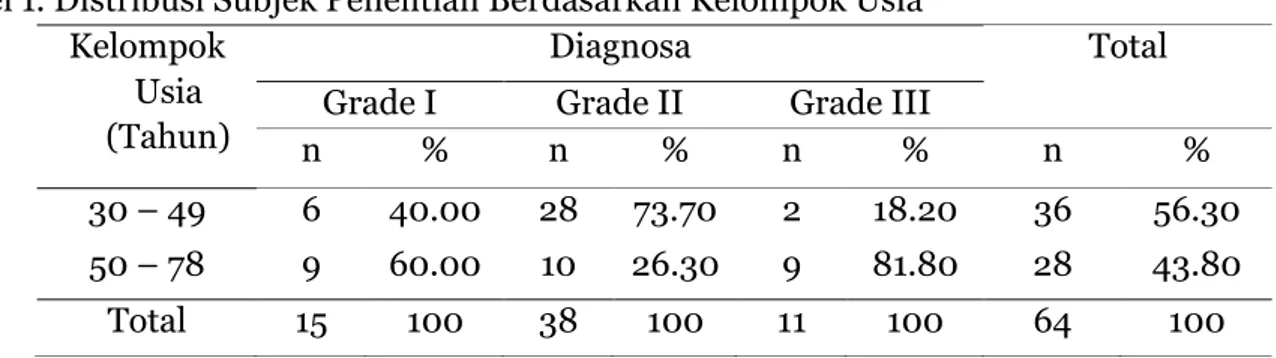
Diperoleh karakteristik subjek penelitian berdasarkan usia seperti pada Tabel 1
berikut ini.Dari tabel 1 dapat dilihat bahwa subjek penelitian paling banyak berasal dari kelompok usia 30-49 tahun yaitu sebanyak 36 subjek (56.30%), bila dibandingkan dengan kelompok usia 50-78 tahun.
Tabel 1. Distribusi Subjek Penelitian Berdasarkan Kelompok Usia Kelompok
Usia (Tahun)
Diagnosa Total
Grade I Grade II Grade III
n % n % n % n %
30 – 49 6 40.00 28 73.70 2 18.20 36 56.30 50 – 78 9 60.00 10 26.30 9 81.80 28 43.80 Total 15 100 38 100 11 100 64 100
B. Proporsi Grade Histopatologi dari Subjek Penelitian
Berdasarkan keseluruhan subjek penelitian, didapatkan proporsi masing-masing grade histopatologis kanker payudara sebagaimana terlihat dari gambar 1 berikut:
Gambar 1. Proporsi Grade Histopatologis Kanker Payudara dari Subjek Penelitian
Dari gambar 1 dapat dilihat bahwa yang proporsi terbanyak berasal dari grade II yaitu 38 subjek (59.4%), sementara proporsi yang paling sedikit adalah grade III yaitu 11 subjek (17.2%).
C. Pengukuran Ekspresi MiR-21 di Jaringan Kanker Payudara dari Subjek Penelitian
Dilakukan pengukuran ekspresi miR-21 menggunakan alat qRT-PCR terhadap keseluruhan subjek penelitian. Berdasarkan nilai Cq miR-21 dan UniSp6 dari qRT-PCR, nilai inidimasukkan ke dalam rumus Fold Change (2-∆Cq) dan diperoleh data ekspresi
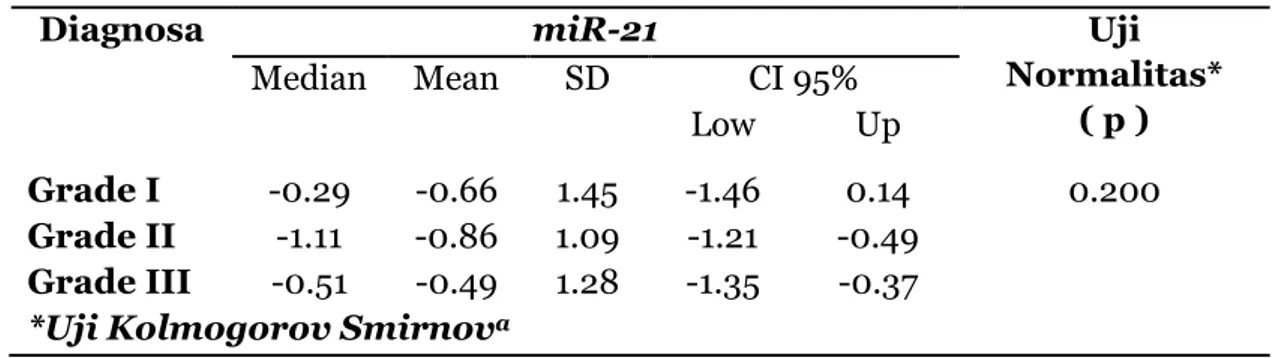
miR-21. Terhadap data tersebut, dilakukan uji normalitas data dan uji deskriptif seperti tertera pada tabel 2.
32
Tabel 2. Ekspresi MiR-21 Terhadap Grade Histopatologis Kanker Payudara
Dari Tabel 2 dapat diketahui bahwa data ekspresi miR-21 berdistribusi normal. Dari hasil uji deskriptif diperoleh rata-rata ekspresi miR-21 pada grade III merupakan ekspresi miR-21 paling tinggi yaitu -0.49 ± 1.28. Sebaliknya, rata-rata ekspresi miR-21 pada grade II merupakan ekspresi paling rendah yaitu -0.86 ± 1.09. Rata-rata ekspresi miR-21 pada grade I sebesar -0.66 ± 1.45.
PEMBAHASAN
Pada penelitian ini, jumlah penderita kanker payudara lebih banyak berasal dari kelompok usia 30-49 tahun dibanding ke-lompok usia 50-78 tahun. Hal ini diduga akibat paparan hormon estrogen atau progesteron terhadap jaringan payudara, yaitu sejak awal menstruasi hingga meno-pause(Hulka and Moorman, 2001). Onset saat menstruasi pertama dan saat meno-pause mempengaruhi jangka waktu paparan hormon ini. Proliferasi epitel payudara dapat diinduksi oleh estrogen(Aguas et al, 2005), dan bentuk aktifnya yaitu estradiol (E2) dapat memicu proses transformasi neoplastik pada epitel payudara manusia (Russo et al, 2006; Fernandez et al, 2009).
Pada perempuan paska-menopause, kanker payudara diduga dipengaruhi oleh sintesis estrogen terkait adipositas. Saat
menopause, ovarium tidak lagi mengha-silkan hormon estrogen. Estrogen diperoleh dari prekursor androgen kelenjar adrenal yang akan mengalami aromatisasi menjadi estrogen di jaringan adiposa(Kluttig and Pokrzywniak, 2009). Perempuan menopau-se dengan obesitas, beresiko tinggi mende-rita kanker payudara akibat tingginya kadar estrogen terutama estradiol (Hulka and Moorman, 2001; Key et al, 2003). Berdasar penelitian McTiernan et al (2003), dite-mukan peningkatan estrone dan estradiol seiring dengan peningkatan parameter adipositas. Pada perempuan paska-meno-pause dengan obesitas dan kanker payu-dara, adanya peningkatan parameter adipo-sitas berkaitan dengan peningkatan kadar hormon pemicu tumor.
Proporsi grade histopatologis dari subjek penelitian menunjukkan proporsi terbanyak berasal dari grade II (59.44%), diikuti grade I (23.44%), dan proporsi paling sedikit berasal dari grade III (17.20%). Hal ini serupa dengan penelitian Yan et al (2008), namun berbeda dengan penelitian Qian et al (2009) yaitu proporsi terbanyak berasal dari grade III dan paling sedikit dari grade I.
Dilakukan analisa ekspresi miR-21 terhadapkeseluruhan sampel penelitian. Berdasarkan perbandingan rata-rata
eks-Diagnosa miR-21 Uji
Normalitas* ( p ) Median Mean SD CI 95% Low Up Grade I -0.29 -0.66 1.45 -1.46 0.14 0.200 Grade II -1.11 -0.86 1.09 -1.21 -0.49 Grade III -0.51 -0.49 1.28 -1.35 -0.37
33 presi miR-21 antar grade, diperoleh
eks-presi miR-21 tertinggi berasal dari grade III, diikuti grade I, dan ekspresi terendah bera-sal dari grade II. Meningkatnya ekspresi miR-21 pada grade III dari hasil penelitian ini sejalan dengan hasil penelitian Qian et al (2009) dan Lee et al (2011).
Ekspresi miR-21 yang sangat tinggi di grade III menyebabkan peningkatan re-gulasi berupa penekanan translasi atau degradasi oleh miR-21 terhadap mRNA target tumorsupressor (antara lain Network of p53 dan PDCD4(Chen et al, 2012)). Aki-batnya fungsi protein tumorsupressor sangat menurun dalam hal pengendalian proliferasi sel dan transformasi neoplastik. Proses proliferasi sel, diferensiasi sel, dan transformasi neoplastik terus berlangsung dan tidak dapat dikendalikan. Dampaknya terlihat dari gambaran grade III yaitu for-masi tubulus dan pleiomorfisme inti sel sangat bervariasi serta mitosis sel yang sangat meningkat, bila dibandingkan de-ngan grade I dan II.
Sebaliknya, ekspresi miR-21 yang rendah pada grade I dan II menyebabkan efek regulasi miR-21 terhadap mRNA target tumorsupressor juga rendah. Sehingga pro-liferasi sel dan transformasi neoplastik masih dapat dikendalikan oleh protein tumorsupressor. Hal ini sesuai dengan gambaran grade I dan II, yaitu pola formasi tubulus, pleiomorfisme inti sel, dan mitosis sel relatif mendekati gambaran jaringan payudara normal.
MiR-21 diketahui memiliki beberapa target mRNAtumorsupressor, di antaranya PDCD4 dan Network of p53 (Frankel et al, 2008; Papagiannakopoulos et al, 2008). PDCD4 adalah protein tumorsupressor yang berfungsi mengendalikan proses trans-formasi sel, dapat menghambat c-Jun dan transaktivasi AP-1 sehingga progresivitas
keganasan dapat diturunkan (Yang et al, 2001; Bitomsky et al, 2004; Jansen et al, 2005). Frankel et al (2008) menemukan bahwa mRNA PDCD4 dapat dihambat oleh miR-21. Bila miR-21 menekan ekspresi PD-CD4, maka akan menimbulkan dampak meningkatnya transformasi dan proliferasi sel.
Selain PDCD4, protein tumorsupressor lainnya yaitu p53 berfungsi meminimalisir kerusakan genetik sehingga proses karsinogenesis dapat dicegah. Proliferasi sel abnormal dapat dikendalikan melalui cycle cell arrest atau apoptosis, tergantung pada derajat kerusakan DNA. Dalam melakukan fungsinya, protein p53 membutuhkan protein lain untuk membantu stabilisasi dan aktivasi p53. Protein yang dimaksud antara lain HNRPK(Moumen et al, 2005), DAXX(Li et al, 2007), TOPORS (Lin et al, 2005). MiR-21 dapat menekan ekspresi protein yang penting untuk fungsi p53, yaitu protein untuk stabilisasi dan aktivasi p53 dan protein yang menjadi target transkripsi p53 (Papagiannakopoulos et al, 2008). Terhambatnya ekspresi protein-protein ini oleh miR-21, akan menimbulkan dampak berupa peningkatan proliferasi sel dan penurunan apoptosis.
Kanker payudara lebih banyak diderita oleh kelompok usia produktif, dan grade II merupakan proporsi grade histopatologis terbanyak. Dengan ditemukannya ekspresi miR-21 yangsangat tinggipada grade III (dibanding grade I dan II), semakin memperkuat dugaan bahwa miR-21 meru-pakan oncomiR yang berperan penting dalam proses perkembangan keganasan pada kanker payudara.
UCAPAN TERIMAKASIH
Terima kasih kepada Badan Penelitian dan Pengembangan Kesehatan Kementerian
34
Kesehatan RI atas dukungan finansial yang telah diberikan. Terima kasih juga kepada Laboratorium Biologi Molekuler Fakultas Kedokteran UGM dan Laboratorium Ter-padu Fakultas Kedokteran USU atas bimbingan teknis dan dukungan pelaksana-an penelitipelaksana-an.
DAFTAR PUSTAKA
Aguas F, Martins A, Gomes TP, de Sousa M, Silva DP. (2005). Portuguese Meno-pause Society and Portuguese Gynae-cology Society: Prophylaxis approach to a-symptomatic post-menopausal women: breast cancer. Maturitas, 52: S23-31.
Bitomsky N, Bohm M, Klempnauer KH. (2004). Transformation suppressor protein Pdcd4 interferes with JNK-mediated phosphorylation of c-Jun and recruitment of the coactivator p300 by c-Jun. Oncogene, 23: 7484– 7493.
Calin GA and Croce CM. (2006). Micro-RNA-Cancer Connection: The Begin-ning of a New Tale. Cancer Res,66: 7390-7394.
Chen PS, Su JL, Hung MN. (2012). Dysre-gulation of MicroRNAs in cancer. Review. Journal of Biomedical Scien-ce, 19 (90): 1-8.
Cho WCS. (2007). OncomiRs: the discovery and progress of microRNAs in cancers. Mol Cancer, 6: 60–66.
Ferlay J, Shin HR, Bray F, Forman D, Mathers C, and Parkin DM. (2010). Estimates of Worldwide Burden of Cancer in 2008: GLOBOCAN 2008. Int. J. Cancer, 127: 2893–2917.
Fernandez SV and Russo J. (2009). Estro-gen and XenoestroEstro-gens in Breast Can-cer. Toxicol Pathol, 38: 110-122.
Frankel LB, Christoffersen NR, Jacobsen A, Lindow M, Krogh A, Lund AH. (2008). Programmed cell death 4 (PDCD4) is an important functional target of the microRNA miR-21 in breast cancer cells. J Biol Chem,283 (2): 1026–1033. Hulka BS and Moorman PG. (2001). Breast Cancer: Hormones and other risk factors. Maturitas, 38: 103-116.
Iorio MV, Ferracin M, Liu CG, Veronese A, Spizzo R, Sabbioni S, Magri E. (2005). MicroRNA gene expression deregulat-ion in human breast cancer. Cancer Res, 65: 7065–7070.
Jansen AP, Camalier CE, Colburn NH. (2005). Epidermal Expression of The Translation Inhibitor Programmed Cell Death 4 Suppresses Tumori-genesis.Cancer Res, 65: 6034-6041. Kementerian Kesehatan Indonesia. (2013).
Profil Kesehatan Indonesia Tahun 2012.http://www.depkes.go.id. Diak-ses Maret 2014.
Key TJ. (2003). Body Mass Index, Serum Sex Hormones, and Breast Cancer Risk in Postmenopausal Women. En-dogenous Hormones and Breast Cancer Collaborative Group. J Natl Cancer Inst, 95: 1218-1226.
Kluttig A and Pokrzywniak AS. (2009). Established and Suspected Risk Factor in Breast Cancer Aetiology. Breast Care, 4: 82-87.
Lee JA, Lee HY, Lee ES, Kim I, and Bae JW. (2011). Prognostic Implications of MicroRNA-21 Overexpression in Invasive Ductal Carcinomas of the Breast. J Breast Cancer,14 (4): 269-275.
Li Q, Wang X, Wu X, Rui Y, Liu W, Wang J, Wang X. (2007). Daxx Cooperates with the Axin/HIPK2/p53 Complex to
35 Induce Cell Death. Cancer Res,67:
66-74.
Lin L, Ozaki T, Takada Y, Kageyama H, Nakamura Y, Hata A, Zhang JH. (2005). topors, a p53 and topoi-somerase I-binding RING finger pro-tein, is a coactivator of p53 in growth suppression induced by DNA damage. Oncogene, 24: 3385–3396.
Malhotra GK, Zhao X, Band H, Band V. (2010). Histological, molecular and functional subtypes of breast cancers. Cancer Biology & Therapy, 10(10): 955-960.
McTiernan A, Rajan KB, Tworoger SS, Irwin M, Bernstein L, Baumgartner R (2003). Adiposity and SexHormones in Postmenopausal Breast Cancer Sur-vivors, J.Clin. Oncol., 21: 1961-1966. Moumen A, Masterson P, O’Connor MJ,
Jackson SP. (2005). hnRNP K: An HDM2 Target and Transcriptional Coactivator of p53 in Response to DNA Damage. Cell, 123: 1065–1078. Papagiannakopoulos T, Shapiro A, Kosik
KS. (2008). MicroRNA-21 Targets a Network of Key Tumor-Suppressive Pathways in Glioblastoma Cells. Cancer Res.,68: 8164-8172.
Qian B, Katsaros D, Lu L, Preti M, Durando A, Arisio R, Mu L. (2009). High miR-21 expression in breast cancer asso-ciated with poor disease-free survival in early stage disease and high TGF-β1. Breast Cancer Res Treat, 117: 131– 140.
Rakha EA, Reis-Filho JS, Baehner F, Dabbs DJ, Decker T, Eusebi V, Fox SB.
(2010). Breast cancer prognostic clas-sification in the molecular era: the role of histological grade. Breast Cancer Res., 12 (207): 1-12.
Russo J, Fernandez SV, Russo PA, Fernbaugh R, Sheriff FS, Lareef HM, Garber J. (2006). 17-Beta-estradiol induces transformation and tumori-genesis in human breast epithelial cells. The FASEB Journal Research Communication, 20: 1622-1634. Tavassoli FA and Devilee P. (2003).
Patho-logy and Genetics of Tumours of the Breast and Female Genital Organs. World Health Organization Classifi-cation of Tumours. France: IARC Press Lyon: 18-19.
Verderio P. (2005). Quality control for histological grading in breast cancer: an italian experience. Pathological, 97: 1-6.
Yan LX, Huang XF, Shao Q, Huang MY, Deng L, Wu QL, Zeng YX. (2008). MicroRNA miR-21 overexpression in human breast cancer is associated with advanced clinical stage, lymph node metastasis and patient poor prognosis. RNA, 14: 2348-2360.
Yang HS, Jansen AP, Nair R, Shibahara K, Verma AK, Cmarik JL, Colburn NH. (2001).A novel transformation sup-pressor, Pdcd4, inhibits AP-1 trans-activation but not NF-kB or ODC transactivation. Oncogene, 20: 669-676.