Elektrokimia adalah ilmu yang mempelajari
hubungan antara perubahan (reaksi) kimia dengan kerja listrik (energi listrik).
Metode elektrokimia :
•
Biasanya melibatkan sel elektrokimia yang menerapkan prinsip reaksi redoks dalam aplikasinya yaitu serah terima elektron dari satu pereaksi ke pereaksi yang lain.•
Proses berlangsung pada elektroda yangsama/berbeda dalam suatu sistim elektrokimia.
ELEKTROKIMI
A
Karena didasarkan pada reaksi redoks,
pereaksi utama yang berperan dalam metode
ini adalah elektron yang di pasok dari suatu
sumber listrik.
Sesuai dengan reaksi yang berlangsung,
elektroda dalam suatu sistem elektrokimia
dapat dibedakan menjadi
Katoda, yakni elektroda di mana reaksi reduksi (reaksi katodik) berlangsung,dan bermuatan negatif ( - ).
Anoda di mana reaksi oksidasi (reaksi Elektaron Inert :
Elektroda (Platina) yang hanya mentransfer elektron ke dan dari larutan.
Elektroda Reaktif : elektroda yang secara kimia memasuki reaksi elektroda dimana selama elektrolisis, terjadi reduksi pada katoda dan oksidasi pada anoda.
Hukum Faraday : Jika 96543 Coulum ( 1 Faraday) muatan dilewatkan melalui suatu elektrolit, satu ekivalen produk diendapkan pada elektroda atau satu ekivalen reaksi kimia terjadi pada elektroda.
Latihan :
1. Jika 50 x 10-3 amp arus listrik dilewatkan melalui coulometer
tembaga selama 60 menit, hitung jumlah tembaga yang diendapkan.
Jwab :
muatan = i x t = (50 x 10-3 A) (60 x 60s)
= 180 C
Reaksi kimia : Cu2+ + 2e- → Cu(s)
Karena 2e- terlibat dalam endapan 1 mol Cu, maka 2 F akan
mengendapkan 1 mol tembaga yaitu :
Jumlah Pb yang diendapkan = (63,5 g mol-1)(180 C) / (2 x
Tipe elektroda secara umum :
1. Arua listrik yang membawa ion akan
dibebaskan pada elektroda.
2. Ion (-) yang sulit untuk dibebaskan pada
anoda menyebabkan penguraian H
2O dan
pembentukan O
2, H
+dan elektron.
3. Ion (+) yang sulit untuk dibebaskan pada
katoda menyebabkan penguraian H
2O dan
pembentukan H
2, OH
-dan absorbsi elektron.
Sel elektrokimia yang menghasilkan energi listrik
karena terjadinya reaksi spontan di dalamnya di sebut SEL GALVANI
Sel elektrokimia di mana reaksi tak-spontan terjadi
di dalamnya di sebut SEL ELEKTROLISIS.
Peralatan dasar dari sel elektrokimia adalah
Dua elektroda -umumnya konduktorlogam-
Elektrolit, konduktor ion (yang dapatberupa larutan maupun cairan) elektroda dicelupkan ke dalam elektrolit ini.
Aplikasi metode elektrokimia
untuk lingkungan dan
laboratorium pada umumnya didasarkan pada proses
elektrolisis, yakni terjadinya
reaksi kimia dalam suatu sistem elektrokimia akibat pemberian arus listrik dari suatu sumber luar.
Misalnya dalam sel bahan bakar
(fuel-cell), pemurnian logam dan elektroplating, elektroanalitik,
elektrokoagulasi, elektrokatalis, elektrodialisis dan elektrorefining
Aplikasi lain yang sekarang sedang marak
dikembangkan adalah elektrosintesis.
Teknik/metode elektrosintesis adalah suatu cara
untuk mensintesis / membuat dan atau memproduksi suatu bahan yang didasarkan pada teknik
elektrokimia.
Pada metode ini terjadi perubahan unsur/ senyawa
kimia menjadi senyawa yang diinginkan.
Keuntungan metode ini seperti :
•
Peralatan yang diperlukan sangat sederhana,•
Potensial elektroda dan rapat arusnya dapatdiatur
•
Tingkat polusi sangat rendah dan mudah dikontrol. Reaksi elektrokimia melibatkan perpindahan
elektron – elektron bebas dari suatu logam kepada komponen di dalam larutan.
Dalam bidang elektrokimia, antaraksi fisika yang
penting adalah antaraksi elektromagnetik.
Dasar antaraksi elektromagnetik adalah adanya
gaya tarik atau gaya tolak antara dua muatan, yaitu Q1 dan Q2.
Hukum ini dirumuskan sebagai Hukum Coulomb
DASAR TEORI
DASAR TEORI
Hukum Coulomb
Tarikan dan tolakan antara dua muatan (Q1 dan Q2)
dimana
F = gaya Coulomb Q = muatan
κ = tetapan dielektrik r = jarak antar muatan
ε0 = permitivitas ruang bebas
2 0 2 1
4
r
Q
Q
F
Untuk menggerakkan muatan dari satu titik ke titik lain diperlukan beda potensial listrik
Kekuatan medan listrik yang mengalir melalui
suatu penghantar, misal larutan elektrolit, ditentukan oleh beda potensial dan tahanan
Menurut Hukum OHM :
dimana :
I = kuat arus (Ampere) V = beda potensial (Volt) R = tahanan (Ohm)
R
V
I
Coulomb (jumlah listrik ) : jumlah listrik yang diangkut oleh listrik 1 Ampere selama 1detik
1 C = 1A. 1s
dimana :
Q = jumlah listrik (Coulomb) I = kuat arus (A)
t = waktu (detik)
1 mol elektron = 1 Faraday = 96.500 Coulomb
Q = I . t
DASAR TEORI
Tahanan (R) : rintangan yang terdapat
dalam sistem terhadap arus listrik
Dari hukum Ohm : E dalam volt
I dalam Amper R dalam Ohm
Hantaran (Konduktansi) : arus listrik yang
dibawa oleh ion-ion atau elektron
Konduktansi merupakan kebalikan dari
tahanan, dimana :
L = konduktansi (mho) atau (ohm -1)
I
E
R
R
L
1
KONDUKTIVITAS ( Hantaran jenis) (Ћ) : atau dimana :
•
l /A = K = konstanta sel (m-1)•
A = daerah elektroda (m2)•
l = jarak antar elektroda (m)•
Ћ = hantaran jenis (konduktivitas) (mho. m-1)
A
L
A
L
.
L
.
DASAR TEORI Elektrolit : suatu senyawa yang bila dilarutkan
dalam pelarut (misal : air), akan menghasilkan larutan yang dapat menghantar arus listrik
Pada suatu larutan elektrolit yang diukur
adalah konduktansinya, bukan tahanannya.
Untuk mengukur hantaran / konduktansi suatu
larutan dapat digunakan alat yang disebut : SEL KONDUKTANSI
Konstanta sel suatu sel konduktansi (
l
/ A)diukur dengan jalan menempatkan suatu
larutan yang telah diketahui konduktivitasnya (misalnya KCl) ke dalam sel.
KONDUKTANSI SPESIFIK ( Λ ) atau
(Hantaran Molar) yaitu : hantaran larutan yang mengandung 1 mol elektrolit dan ditempatkan diantara dua elektroda
sejajar yang berjarak sejauh satu meter
dimana
c = konsentrasi elektrolit ( mol/dm3)
ħ = konduktivitas (mho m-1)
Λ = konduktansi spesifik (mho m2 mol-1)
c
Contoh soal :
1. Hantaran larutan KCl 0,0075 mol/ dm3 adalah 1,49 . 103 μ mho. Jika konstanta sel 105 m-1,
hitunglah konduktivitas (
ħ) dan konduktansi
spesifik (Λ) larutan
Jawab :
ħ = K. L
ħ = (105 m
-1)(1,49, 10
3 μmho) = 1,565.105 μmho/mΛ = ħ /c =
1,565.105. 10-6 mho/m= 0,021 mho.m
2 0,0075x1000mol/m3 mol2. Dimensi elektroda yang digunakan dalam sel hantaran adalah 0,95 cm dan 1,015 cm. Jika kedua elektroda diikat pada jarak antara 0,45 cm, hitunglah konstanta sel (K)
Jawab :
K =
l
/ A = 0,45. 10 -2 m = 46,8 m-13. Tahanan larutan KCl 0,1M dalam suatu sel
konduktansi adalah 325 ohm dan konduktivitasnya 1,29 mho/m. Jika tahanan larutan NaCl 0,05 M
dalam sel yang sama adalah 752,4 ohm, berapakah konduktansi spesifik larutan NaCl tsb ?
Jawab : Konstanta sel : K = ħ / L = ħ R = (1,29 mho/m)(325 ohm) = 419 m-1 Konduktivitas NaCl : ħ = K/ R = 419m-1 / 752,4 ohm = 0,557 mho/m
Maka konduktansi spesifik NaCl adalah :
Λ = ħ /c = 0,557 mho m-1 = 0,011 mho m2 /mol
0,05 mol/dm3
KONDUKTANSI EKUIVALEN
KONDUKTANSI EKUIVALEN
Satu mol ion ( apa saja ! ) mengandung jumlah
ion sebesar No =6,023 x 1023 sama dengan satu
mol ion lain
No = bilangan Avogadro sehingga :
•
Suatu ion akan mengandung jumlah muatan (+) dan (-) sama dengan ion lain Satuan ini dikenal dengan : GRAM EKUIVALEN
Setiap gram ekivalen mengandung muatan yang sama yaitu sebanyak 1 Faraday ≈ 96500 C ekiv. Contoh :
- Massa 1mol HCl terlarut = 36,46 gr, maka 1 grek =
36,46
- Massa 1mol AlCl3 = 133,33 gr, maka 1 grek = 44,44
gr
ion
muatan
al
Jumlah tot
molekul
Berat
ekivalen
Gram
Misal :
Gram ekiv. FeSO4 pada elektrolit = BM / 2 Gram ekiv. FeSO4 pada redoks = BM
Dengan menggunakan gram ekiv.zat, maka
definisi KONDUKTANSI EKIV. adalah :
•
Konduktan antara 2 elektroda yang berjarak satu meter yang diantaranya terdapat larutan yang mengandung tepat 1 gram elektrolitCatatan :
Istilah gram ekivalen pada elektrolit
dengan gram ekivalen pada reaksi redoks
Konduktansi ekivalen lebih berarti dibanding
konduktansi, karena pada konduktansi ekiv. semua perhitungan didasarkan pada satuan konsentrasi Konduktansi ekivalen : c = konsentrasi ekiv / m3 atau c =mol / m3
c
K
.
1000
c
K
100 200 30 0 Λ 0,5 1,0 Mho ekiv-1cm2 NaOH KCl CH3COOH
Kurva Λ sebagai fungsi untuk berbagai larutan pada 25o C, memperlihatkan bahwa elektrolit kuat memotong sumbu vertikal sehingga nilai Λo dapat diperoleh dengan cukup tepat.
Untuk elektrolit lemah Λo sulit ditentukan. Pada pengenceran
tak hingga (c ~ o), Λo dari CH3COOH sulit ditentukan karena
kurva hampir sejajar sumbu vertikal
c
Kurva Λ sebagai
Pada pengenceran tak terhingga (c ~ o), konduktansi ekiv. :
dimana
HUKUM MIGRASI BEBAS KOHLRAUSCH
HUKUM MIGRASI BEBAS KOHLRAUSCH
Hubungan Λ dan konsentrasi, dikemukakan oleh KOHLRAUSCH :
o
o
o
ekiv.anion i konduktans n ekiv.katio i konduktans o o Λ= Λo – B C1/2 Pada pengenceran tak hingga, gaya interionik
kecil sekali sehingga akan terlihat konduktansi yang sesungguhnya.
CONTOH SOAL
1. Dari data dibawah ini, hitunglah nilai ΛoNH4OH
pada 25o C:
Λo (NaOH) = 247,8 x 10-4 mho ekiv-1m2
Λo (NaCl) = 126,45 x 10-4 mho ekiv-1m2
Jawab
:Konduktansi ekiv.NH4OH pada 298oK adalah :
Λo = λo (NH4+ ) + λo (OH-)
maka
Λo(NH4OH) = λo(NH4+)+ λo(Cl-) + λo(Na+) + λo(OH-) -
λo (Na+) - λo (Cl-)
= Λo(NH4Cl) + Λo(NaOH) - Λo(NaCl)
= (149,7+ 247,8 - 126,45 ) x 10-4
= 271,05 x 10-4 mho ekiv-1 m2
Bilangan Transport & Mobilitas Ionik
BILANGAN TRANSPORT
: Fraksi dari jumlaharus total yang dibawa olehsebuahion tertentu disebut bilangan penghantaran
Simbol bil.transport ; kation : t + anion : t – Untuk suatu elektrolit tertentu :
Bil.transport pada pengenceran tak hingga, c~ o disimbolkan dengan :
t + + t - = 1
t
Bil.transport kation dan anion dapat ditentukan dengan cara :
•
Metode Hittorf yaitu Mengukur perubahankonsentrasi elektrolit disekitar katoda dan anoda saat elektrolisis, artinya bil.transport tergantung pada konsentrasi
•
Menggunakan mobilitas ioniknya atau metode pembatasan yang bergerak.t- = Jumlah gran ekivalen elektrulit yang hilang dari katoda
MOBILITAS IONIK (U)
:Laju gerakan suatu ion (m/det) yang melalui suatu medan dengan gradien potensial 1 volt/m
Mobilitas kation dan anion : U+ dan U
- Mobilitas Ionik :
dimana : x = jarak (m) t = waktu (detik)
dε/dx = kekuatan medan (volt/m)
dx d
t
x
U
.
Konduktansi juga dipengaruhi oleh mobilitas ionik Satuan Mobilitas Ionik : m2 V-1 s-1
Kekuatan medan dihitung dengan rumus :
E = d€ /dx = I / A ħ
Jika z = jumlah muatan ion ( z+ dan z - ),
sedangkan c adalah konsentrasi (c+ dan c -)
(mol/m3) , maka dalam larutan terdapat :
Jika u+ dan u- adalah mobilitas kation dan anion :
z+c+= z-c-, maka
Pada konsentrasi tertentu :
λ+= z+u+F atau λ- = z-u-F atau : u F z u
Λ = (z+c+u++ z-c-u-) F Λ = (u+ + u-) F = λ++ λ- Karena bil.transport merupakan fraksi total arus yang dibawa oleh ion, maka :
dan
Atau dan
Sehigga t+ + t- = 1
Untuk pengenceran tak hingga : dan
u
u
u
t
u
u
u
t
t
t
o ot
o o ot
CONTOH SOAL
2. Hitunglah mobilitas ionis dari ion K+ dan OH- pada
pengenceran tak hingga, jika λo(K+) = 73,50. 10 -4mho m2 mol- dan λo(OH-) = 197,6 . 10-4 mho m2
mol
-Jawab :
Mobilitas ionik : untuk kation K+
det
.
/
62
,
7
/
96500
.
.
.
1
mol
m
mho
.10
73,50
.
2 -2 -4volt
m
u
ekiv
coulomb
mol
ekiv
F
z
u
K o K
Mobilitas ionik : untuk anion OH
-KONDUKTANSI IONIK
Konduktansi spesifik setiap ion pada pengenceran tak hingga :
dimana v+ & v- = jumlah ion yang berasosiasi o o o o o o t t . . . .
det
.
/
05
,
2
/
96500
.
.
.
1
mol
m
mho
.10
197,6
.
2 -2 -4volt
m
u
ekiv
coulomb
mol
ekiv
F
z
u
OH o OH
o o o o o ot
t
.
.
.
.
Contoh Soal
3. Konduktan spesifik HCl pada 0,05M adalah 399. 10-4mho m2 mol - dan bilangan transport ion H+ adalah 0,829. Hitunglah konduktansi spesifik ion H+ dan Cl – JAWAB : Untuk H+ :
λ
H+= t
H+. Λ
HCl= (0,829). (399.
10-4mho m2 mol – ) = 330,80. 10-4mho m2 mol - Untuk Cl-λ
Cl-= (1– 0,829) .(399.
10-4mho m2 mol – ) Elektrokimia adalah cabang dari ilmu kimia
yang mempelajari perubahan Energi Listrik dan Energi Kimia.
Proses elektrokimia menerapkan prinsip
reaksi REDOKS.
Energi kimia ---» Energi Listrik
(reaksi spontan) ---» sel Galvani / Volta
Energi Listrik ---» Energi kimia
Terminologi
Redoks
Setengah reaksi oksidasi terjadi di anoda. Elektron diberikan oleh
senyawa teroksidasi (zat pereduksi) dan meninggalkan sel melalui anoda
Setengah reaksi reduksi terjadi di katoda. Elektron diambil oleh senyawa tereduksi (zat pengoksidasi) dan masuk sel melalui katoda
a. Logam Zn dimasukan kedalam larutan yang mengandung Cu2+
b. Logam Cu mengendap dan logam Zn larut
c. Logam Cu dimasukkan ke dalam larutan yang mengandung Ag+
d. Logam Ag mengendap dan logam Cu larut
Sel
Fenomena ini berlangsung secara spontan. Reaksi yang terjadi adalah sbb :
ANODA (kutub - ) : Zn(s ---» Zn2+(aq) + 2e
(oksidasi)
KATODA (kutub +) : Cu2+(aq) + 2e ---» Cu (s)
(reduksi)
Reaksi total : Zn(s)+ Cu2+(aq)---» Zn2+(aq)+ Cu(s)
Jika reaksi diatas disusun sedemikian rupa
dengan seperangkat alat yang dapat membangkitkan arus listrik dari reaksi spontan tersebut maka seperangkat alat
tersebut disebut ---» SEL GALVANI ATAU SEL VOLTA
Adanya aliran elektron dari anoda ke katoda
menunjukkan adanya perbedaan potensial antara anoda dan katoda.
Jika diukur dengan voltmeter, maka harga
potensial yang terukur disebut Potensial Sel atau
Gaya Gerak Listrik (GGL) atau electromotive force (emf) E.
Notasi yang menjadi kesepakatan untuk
menyatakan sel galvani disebut DIAGRAM SEL
Untuk sel di atas dengan mengasumsikan
konsentrasi larutan Zn2+ dan Cu2+ adalah 1M :
Sebuah garis vertikal melambangkan batas fasa.
Double garis vertikal melambangkan jembatan garam. Berdasarkan kesepakatan reaksi di anoda ditulis disebelah kiri garis ll.
Jembatan garam diperlukan bila larutan pada
anoda & katoda dapat saling bereaksi yang
berfungsi untuk memperoleh sebuah rangkaian listrik yang lengkap.
Bisa dibuat dari kertas saring yang direndam
dalam larutan elektrolit seperti NH4NO3 atau KCl
Penumpukan ion (+) diwadah kiri atau ion (-)
dikanan dapat dihindari dengan jembatan garam, dengan jalan mendiffusikan ion kekanan atau kiri
Sel Galvani selalu terdiri dari dua elektroda :
•
Tempat terjadinya rx Oksidasi ---- » ANODA, bermuatan negatif (-)•
Tempat terjadinya rx reduksi ---- » KATODA, bermuatan positif (+) Pada sel elektrolisis, terjadi sebaliknya , anoda bermuatan positif dan katoda
bermuatan negatif
Pada sel Galvani : elektron bergerak dari
anoda ke katoda pada sirkuit eksternal
Pada sel elektrolisis : elektron bergerak dari
sumber tegangan luar (accu atau baterai) masuk ke katoda dan keluar lewat anoda
Baik sel Galvani ataupun sel elektrolisis :
•
Anoda --- elektroda tempat oksidasiKonstruksi dan Operasi Sel
Volta
Elektron mengalir melalui sirkuit luar dari anoda (Zn) menuju elektroda Cu (katoda
Setengah sel oksidasi: anoda berupa batang logam Zn dicelupkan dalam ZnSO4
Setengah sel reduksi: katoda berupa batang logam Cu dicelupkan dalam CuSO4
Terbentuk muatan relatif pada kedua elektroda dimana anoda bermuatan negatif dan katoda bermuatan positif
Kedua sel juga dihubungkan oleh jembatan garam
Dimungkinkan menggunakan elektroda inaktif yang tidak ikut bereaksi dalam sel volta ini
Sel Volta dengan Elektroda
Inaktif
Grafit|I2(s)|I-(aq) H║ +(aq), MnO
4-(aq), Mn2+
Aspek
Thermodinamika
Meninjau kespontanan reaksi sel elektrokimia Dilihat dari perubahan energi Gibbs standar,
hubungan tegangan sel dinyatakan : ΔGo = - n F Eo atau
ΔGo = - z F Eo
dimana
z = n = jumlah elektron yang terlibat F = bilangan Faraday
= 96500 C/mol
Untuk reaksi spontan : ΔG = ( - ) ----» Esel = (+)
non spontan : ΔG = (+) ----» Esel = (-) seimbang : ΔG = 0 ----» Esel = 0
Untuk proses spontan Esel > 0, semakin positif
Esel semakin banyak kerja yang bisa dilakukan oleh sel
Satuan yang digunakan : 1 V = 1 J/C
Potensial sel sangat dipengaruhi oleh suhu dan
konsentrasi, oleh karena itu potensial sel standar diukur pada keadaan standar (298o K, 1 atm untuk
gas, 1 M untuk larutan dan padatan murni untuk solid)
Pada dasarnya semua jenis sel elektrolisis
termasuk elektrosintesis selalu berlaku hukum Faraday yakni:
•
Jumlah perubahan kimia yang terjadidalam sel elektrolisis, sebanding dengan muatan listrik yang dilewatkan di dalam sel tersebut
•
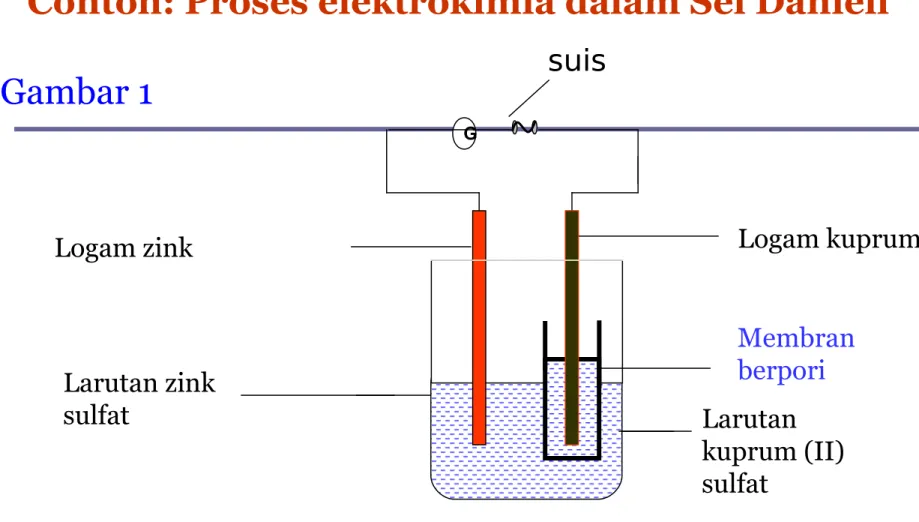
Jumlah muatan listrik sebanyak 96.500 coulomb akan menyebabkan perubahan suatu senyawa sebanyak 1,0suis
Larutan zink
sulfat Larutan
kuprum (II) sulfat
Contoh: Proses elektrokimia dalam Sel Daniell
Membran berpori
Logam zink
Gambar : Sel Daniell menggunakan membran berpori
Logam kuprum
G
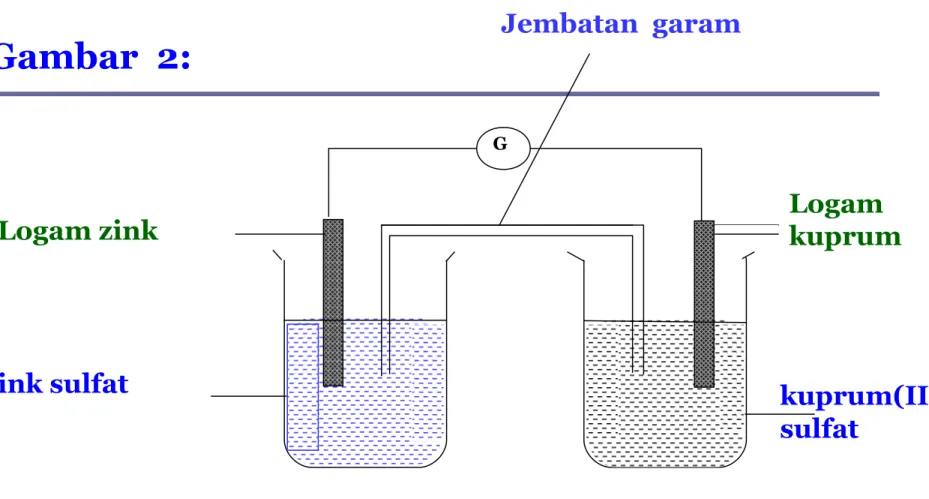
Zink sulfat kuprum(II) sulfat
Jembatan garam
Logam kuprum
Gambar : Sel Daniell menggunakan jembatan garam Gambar 2:
G
Potensial Elektroda Standar (E
Potensial Elektroda Standar (Eoo 1/2
1/2))
Potensial elektroda standar adalah potensial yang terkait dengan setengah reaksi yang ada (wadah elektroda)
Menurut kesepakatan potensial elektroda standar selalu ditulis dalam setengah reaksi reduksi
Bentuk teroksidasi + ne bentuk tereduksi Eo1/2 sel Potensial elektroda standar seperti halnya besaran
termodinamika dapat dibalik dengan mengubah tandanya
Eo
E
osel daya gerak listrik (DGL) standar
Ditentukan dengan asumsi aktifitas = 1
Nilai E
oselditentukan dari besarnya
potensial elektroda (reduksi) standar E
o Sebagai standar E
oHidrogen
•
Bila Eo > Eo H2 reduksi•
Bila Eo < Eo H2 oksidasi Atau :
E
oElektroda Hidrogen Standar
Ilmuwan telah menyepakati untuk memilih
setengah reaksi rujukan dengan nilai 0 untuk reaksi:
2H+(aq, 1 M) + 2e H2(g, 1 atm) Eorujukan = 0,00
H2(g, 1 atm) 2H+(aq, 1 M) + 2e –Eorujukan= 0,00
Dengan nilai rujukan ini kita bisa menyusun sel volta yang menggunakan elektroda hidrogen standar sebagai salah satu elektrodanya dan mengukur potensial sel dengan alat ukur,
kemudian kita dapat menentukan potensial
Elektroda Hidrogen standar, terdiri
dari elektroda Pt yang dilapisi Pt-hitam.
Elektroda dicelupkan dalam larutan asam H+
dengan aktifitas, aH+ = 1 dan dialiri /
digelembungkan gas H2 dengan tekanan 1 atm
Pt bertindak sebagai katalis reaksi dekomposisi H2 ====> H. Reaksi ini diikuti dengan pelepasan
elektron membentuk proton : H ====>H+(aq) + e
- Pada kondisi aH+ = 1 & P = 1atm, dianggap
potensial = nol
Elektroda Hidrogen Standard disebut standard
primer, kerana ia ditakrifkan.
Elektroda Hidrogen sukar dibuat dan digunakan,
sehingga dipakai elektroda pembanding lain yang telah distandarisasi dengan elektroda Hidrogen,
Elektroda pembanding ini disebut Standard
sekunder yang dibuat berdasarkan standard
primer .
Dengan menggabungkan elektroda lain dengan
elektroda Hidrogen standar, maka GGL elektroda lain dapat ditentukan
Elektroda Hidrogen Standar
Standard sekunder digunakan dalam praktek karena standard primer sukar disediakan.
Contoh standar sekunder ialah elektroda Ag, AgCl standard
Setengah reaksinya adalah:
AgCl(s) + e Ag(s) + Cl–(aq); Eo = 0.22233 V
Satu lagi elektroda standar sekunder adalah elektroda kalomel.
½Hg2Cl2(s) + e Hg(c) + Cl–(aq); Eo = 0.3337 V
Dari tabel potensial elektroda standar untuk
setengah reaksi reduksi, terlihat bahwa elektroda hidrogen (H+ | H2 | Pt) merupakan batas pembanding
dengan nilai potensial 0,0000 V.
Bila elektroda pengukur mempunyai nilai lebih besar dari elektroda hidrogen (bernilai positif), maka
elektroda tersebut mempunyai kecenderungan untuk tereduksi (bersifat oksidator).
Bila elektroda pengukur mempunyai nilai lebih kecil dari elektroda hidrogen (bernilai negatif), maka
elektroda tersebut mempunyai kecenderungan untuk teroksidasi (bersifat reduktor).
Penentuan GGL Standar Sel (E
Penentuan GGL Standar Sel (E
oo selsel
)
)
Nilai E
oselditentukan dengan rumus
E
osel= E
oreduksi– E
ooksidasiE
oredadalah nilai potensial elektroda standar
pada elektroda yang mengalami reduksi
E
ooksadalah nilai potensial elektroda standar
dari elektroda yang mengalami oksidasi.
Misal, suatu sel elektrokimia :
Pt, H2(1bar)|H+(1m) ¦¦ Cl– (1m)|AgCl(s)|Ag,
Eo = 0.3337 V
Katoda terdiri dari logam Ag, yang bersentuhan dengan larutan AgCl dan kedua-duanya terendam dalam larutan KCl dengan konsentrasi ion Cl– 1m.
Reaksi sel:
Anoda : 2H+(aq) + 2e H
2(g); Eo = 0.00 V
Katoda: AgCl(s) + e Ag(s) + Cl–(aq);
0.3337 V Total reaksi :
½H2(g) + AgCl(s) H+(aq) + Ag(s) + Cl(aq)
Eo = Eo
Dari tabel data Eo standard, ½ reaksi :
O2 + 4H+ + 4e 2H2O; Eo = 1.229 V
MnO4- + 8H+ + 5e Mn 2+ + 4H2O; Eo = 1.52 V
Gabungkan dua setengah reaksi ini sehingga menghasilkan sel elektrokimia
Misalkan:
Anoda : 5O2 + 20H+ + 20e 10H2O
Katoda : 4MnO4- + 32H+ + 20e 4Mn2++ 16H2O
Reaksi total : 4MnO4- + 12H+ 4Mn2++ 6H2O + 5O2
Eo =
E
ored– E
ooks=
1.52 - 1.229 = 0.291 VJika kita menggabungkan dua ½ reaksi tadi sebaliknya :
"Anoda“ : 4MnO4- + 32H+ + 20e 4Mn2++ 16H2O
"Katoda“ : 5O2 + 20H+ + 20e 10H2O
Reaksi Total :
4Mn2+ + 6H2O + 5O2 4MnO4- + 12H+
Eo =
E
ored– E
ooks=
1.229 - 1.52 = - 0.291 V Nilai Eo yang negatif menunjukkan bahwa gabungan
di atas adalah "terbalik", anoda seharusnya menjadi katoda dan katoda menjadi anoda.
Penentuan GGL Sel (E
Penentuan GGL Sel (E
selsel) dan
) dan
Perubahan Energi Bebas Gibbs (ΔG)
Perubahan Energi Bebas Gibbs (ΔG)
Beda potensial antara elektroda kanan (reduksi)dan elektroda kiri (oksidasi) ditentukan dengan perhitungan GGL sel (Esel).
dan
Bila nilai GGL sel positif, maka ΔG negatif dan
reaksi berlangsung secara spontan.
Sedangkan bila GGL sel negatif,maka ΔG positif
dan reaksi berlangsung tidak spontan
sel
nFE
G
o sel onFE
G
Menurut kesetimbangan kimia,
Bila perubahan energi Gibbs dinyatakan sebagai potensial kimia, maka
Jika nilai μi disubstitusi ke persamaan ΔG, maka
Atau : Q RT G G o ln i o i i RT ln a i i i o sel sel nFE RT a nFE ln
K
nF
RT
E
E
sel
selo
ln
Persamaan Nernst K adalah tetapan kesetimbangan yang
nilainya sama dengan perbandingan aktifitas spesi teroksidasi terhadap spesi tereduksi.
Pada kesetimbangan, nilai Esel = 0 sehingga
Maka nilai K pada kesetimbangan dapat
ditentukan :
] [ ] [ reduksi oksidasi a a K K
nF
RT
E
selo
ln
RT nFEseloe
K
Contoh Soal 1:
Hitung Eo
sel pada 25oC untuk sel berikut :
Cd │ Cd 2+ ║ Cu 2+ │ Cu Jawab : Reduksi : ½ Cu 2+ + e- == ½ Cu Eo = 0,339 V Oksidasi : ½ Cd == ½ Cd 2+ + e-Eo = - 0,4022 V + Total : Cu 2+ + Cd == Cu + Cd 2+ Eo sel= 0,7412 V
Contoh Soal 2.
Carilah potensial standar cell ,Ecell, dibawah ini dan prediksikan arah aliran electron bila kedua electroda ini dihubungkan
Cu(s) | Cu 2+ || Cl – | AgCl(s) | Ag(s)
Jika diketahui potensial reduksi standar : Cu 2+ | Cu = 0,337 volt
Jawab:
Reaksi total untuk cell ini :
2 Ag(s) + 2 Cl–(aq) + Cu 2+(aq) → AgCl(s) +
Cu(s)
Pada reaksi ini terjadi reverse potensial reduksi AgCl, shg :
Ecell = (.337 + .222) v = .559 v
Karena potential = (+), maka reaksi bergeser ke kanan atau bersifat spontan dan electron dilepaskan oleh elektroda Cu dan mengalir melalui circuit external menuju electroda Ag.
Contoh Soal 3.
Hitung E° untuk electroda Fe 3+/ Fe(s) dari data
potential standar Fe 3+ /Fe 2+ dan Fe 2+ /Fe(s)
Jawab:
Dari perhitungan data potensial reduksi, hitung ΔG° sebagai berikut :
(i) Fe3++ e– → Fe2+ E°1 = .771 v , ΔG°1 = –.771F (ii) Fe2++ 2 e– → Fe(s) E°2 = – .440 v, ΔG°2 = +.880F (iii)Fe3++ 3 e– → Fe(s) E°3 = ? , ΔG°3 = + .109 F
Energy bebas untuk setengah reaksi (iii) adalah = . 109nF, sehingga E°3 = – .109/3 = – .036 v
Contoh Soal 4.
Suatu object logam yang akan dilapisi dengan
Cu ditempatkan dalam larutan CuSO4.
a) Ke elektroda manakah object logam harus
dihubungkan supaya arus bisa dialirkan?
b) Berapa berat Cu yang dapat terendapkan
jika arus sebesar 0.22 amp mengalir dalam rangkaian sel selama 1.5 jam?
Penyelesaian :
a) Selama ion Cu2+ direduksi, object logam
bertindak sebagai katoda dan harus dihubungkan ke terminal negatif (tempat dari mana elektron
mengalir)
b) Banyaknya muatan yang melewati sel adalah :
(0.22 amp) × (5400 sec) = 1200 c atau (1200 c) ÷ (96500 c F–1) = 0.012 F
Selama reduksi, 1mol ion Cu2+ memerlukan 2 mol
elektron, maka masa Cu yang mengendap adalah: (63.54 g mol–1) (0.5 mol Cu/F) (0.012 F) = 0.39 g
current (ampere) adalah banyaknya
muatan yang dipindahkan atau mengalir
per detik ; 1 amp = 1 c/sec.
power (watts) yaitu banyaknya energy
yang diproduksi atau dikonsumsi;
1 w = 1 J/sec = 1 volt-amp;
1 watt-sec = 1 J,
1 kw-h = 3600 J.
Contoh soal 5
Berapa daya listrik yang dibutuhkan untuk menghasilkan 1 metric ton (1000 kg) gas chlorine dari larutan brine, bila diasumsikan cell beroperasi pada 2.0 volts selama 24 jam dan efficiency 100 %?
Penyelesaian ;
Mol Cl2 yang dihasilkan :
(106 g) ÷ 70 g mol–1 = 14300 mol Cl2
Muatan faraday :
Muatan dalam coulomb :
(96500 c/F) × (28600 F) = 2.76 × 109 c
Lama electrolysis: (3600 s/h) x (24 h) = 86400 s Arus yang mengalir :
(2.76 × 109 A-sec) ÷ (86400 sec) = 32300 amps
Daya (volt-amps): (2.0 v)×(32300 a) = 64.6 kw
Energy dalam kW-h: (64.6 kw) × (24 h) = 1550 kw-h Energy dalam joule : (1550 kw-h) × (3.6Mj/kw-h) =
1. Permanganat bereaksi dalam larutan basa
dengan ion oksalat membentuk ion karbonat dan mangan dioksida padat. Seimbangkan reaksi
redoks berikut:
MnO4-(aq) + C2O42-(aq) MnO2(s) + CO32-(aq)
2. Seimbangkan persamaan reaksi berikut dengan suasana larutan basa
MnO4-(aq) + I-(aq) MnO42-(aq) + IO3-(aq)
3.Hitunglah GGL standar untuk se-sel dibawah ini dengan menggunakan tabel potensial reduksi standar.
Zn│ Zn 2+ (1M)║ H2+ (1M)│ H2 (g,1atm)Pt
Zn │ Zn 2+ (1M) ║ Cu 2+ (1M) │ Cu
Cu │Cu 2+ (1M) ║ Fe 2+ (1M), Fe3+(1M) │Pt
Pt, H2(1 bar)|H+ (1 m) ¦¦ Cl– (0.1m) |Hg2Cl2(s)|Hg
Buatkan ½ reaksi oksidasi dan redaksi serta reaksi total untuk ketiga sel diatas
4. Suatu sel volta memiliki reaksi antara larutan bromine dan logam Zn
Br2(aq) + Zn(s) Zn2+(aq) + 2Br-(aq) Eo
sel = 1,83 V
Hitung Eo untuk oksidasi Br-(aq) jika Eo
Zn = -0,76 V
5. Suatu sel volta memiliki Eo
sel = 1,39 V berdasarkan
reaksi:
Br2(aq) + 2V3+(aq) + 2H
2O(l) 2VO2+(aq) + 4H+(aq)
+ 2Br-(aq)
Berapa potensial elektroda standar reduksi VO2+
Jenis-Jenis Elektroda
Jenis-Jenis Elektroda
Sel
Sel
Elektroda logam – ion logam
•
Yaitu elektroda yang berisi logam yangberada dalam kesetimbangan dengan larutan
ionnya, contohnya elektroda Cu | Cu 2+ .
Elektroda amalgam
•
Amalgam adalah larutan logam dalam Hg cair.Pada elektroda ini, amalgam logam M akan berada dalam kesetimbangan dengan ionnya
(M 2+ ). Logam – logam aktif seperti Na dan
Ca dapat digunakan sebagai elektroda amalgam.
Elektroda redoks
•
Yaitu elektroda yang melibatkan reaksireduksi – oksidasi di dalamnya, contohnya elektroda Pt | Fe 3+ , Fe 2+ .
Elektroda logam – garam tak larut
•
Elektroda ini berisi logam M yang beradadalam kesetimbangan dengan garam sangat sedikit larutnya
•
Contoh : elektroda Ag – AgCl yang terdiri dari logam Ag, padatan AgCl, dan larutan yangmengandung ion Cl- dari KCl atau HCl.
Elektroda gas
•
Yaitu elektroda yang berisi gas yang berada dalam kesetimbangan dengan ion – iondalam larutan, misalnya elektroda Pt | H2(g) |
H+(aq).
Elektroda non logam non gas
•
Yaitu elektroda yang berisi unsur selainlogam dan gas, misalnya elektroda brom (Pt | Br2(l) | Br-(aq)) dan yodium (Pt | I2(s) | I-(aq)).
Elektroda membran
•
Yaitu elektroda yang mengandung membran semi permiabel.Sel Konsentrasi
Sel Konsentrasi : sel yang reaksi totalnya hanya
berupa perubahan konsentrasi
Pada sel konsentrasi, kedua elektroda dalam sel
sama. Perbedaan keduanya terletak pada
konsentrasi larutan ion-ionnya. Konsentrasi anoda berbeda dengan konsentrasi katoda
Reaksi keseluruhan adalah perpindahan materi
dari konsentrasi (aktivitas) tinggi ke aktivitas lebih rendah 2 1 ln a a nF RT sel
Penentuan pH
Konsentrasi ion H
+pada larutan aqueous
dapat bervariasi mulai 1 mol/L dalam 1
mol/L HCL sampai dengan 10
-14dalam 1
mol/L NaOH. Karena jangkauan nilai yang
luas ini, Sorenson (1909) mendefinisikan
pH sebagai
Saat ini, pH dapat didekati sebagai minus
logaritma dari aktifitas ion hidrogen
pH = - log [H+]
pH dapat diukur dengan menggunakan elektroda
hidrogen (sebagai elektroda pengukur) dan elektroda kalomel (sebagai elektroda
pembanding).
Kedua elektroda dihubungkan oleh jembatan garam, dengan notasi sel
Pt | H2(g) | H+(aH+) Cl- | Hg2Cl2 | Hg.
Reaksi setengah sel yang terjadi pada kedua elektroda adalah
½ Hg2Cl2 + e- == Hg + Cl- Eo = 0,2802 V
Nilai GGL untuk sel diatas adalah :
reduksi
oksidasi sel sel 0,0591log 0
0 0 2 log 0591 , 0 P P a H H sel sel Jika PH2 = Po Esel = Eo sel – 0,0591 log [aH+] = 0,2802 V – 0,0591 log [aH+] Esel - 0,2802 = - 0,0591 log [aH+] Esel - 0,2802 = 0,0591 pH , maka :0591
,
0
2802
,
0
E
selpH
Pengukuran pH biasanya tidak dilakukan dengan elektroda hidrogen, tetapi dengan elektroda kaca, untuk menghindari
keterlibatan ion hidrogen dari elektroda (yang dapat mempengaruhi pengukuran) Elektroda kaca terdiri dari
elektroda kalomel atau elektroda Ag – AgCl
Baterei
Baterei adalah sel elektrokimia yang dapat
digunakan sebagai sumber arus searah dengan tegangan konstan.
Lead-acid storage cell
1859 -
Gaston Planté
(French)
Baterei Kering (C-Zn)
Zn (s) === Zn 2+ (aq) + 2e (anoda)
2MnO2 (s) + 2NH4+ (aq) + 2e === Mn2O3 (s) + 2 NH3(aq) +
H O (katoda)
Baterai sekali pakai disebut juga dengan
baterai primer, sedangkan baterai isi
ulang disebut dengan baterai sekunder.
Baterai primer hanya bisa dipakai sekali,
karena menggunakan reaksi kimia yang
bersifat
irreversible
.
Baterai sekunder dapat diisi ulang
Baterei
alkalin
Reaksi pada Baterei alkalin
Zn (s) + 2OH - (aq) == ZnO (s) + H2O + 2e (anoda)
MnO2 (s) + H2O + 2e== Mn2O3 (s) + 2OH - (aq)
(katoda)
Baterei Perak Oksida
(untuk jam, kalkulator, dll)
Zn (s) + 2OH - (aq)== ZnO (s) + H2O + 2e
(anoda)
Ag2O (s) + H2O + 2e == 2Ag (s) + 2OH - (aq)
Korosi
Korosi adalah peristiwa perapuhan logam karena proses elektrokimia. Salah satu cara untuk menghidari korosi besi selain dengan
melapisinya juga dapat dengan
cara yang disebut Perlindungan Katodik
(menyambungkan besi dengan logam lain yang lebih mudah teroksidasi) .
Terlihat paku yang disambung dengan Zn tidak mengalami korosi, sedangkan paku besi yang lain mengalami korosi.
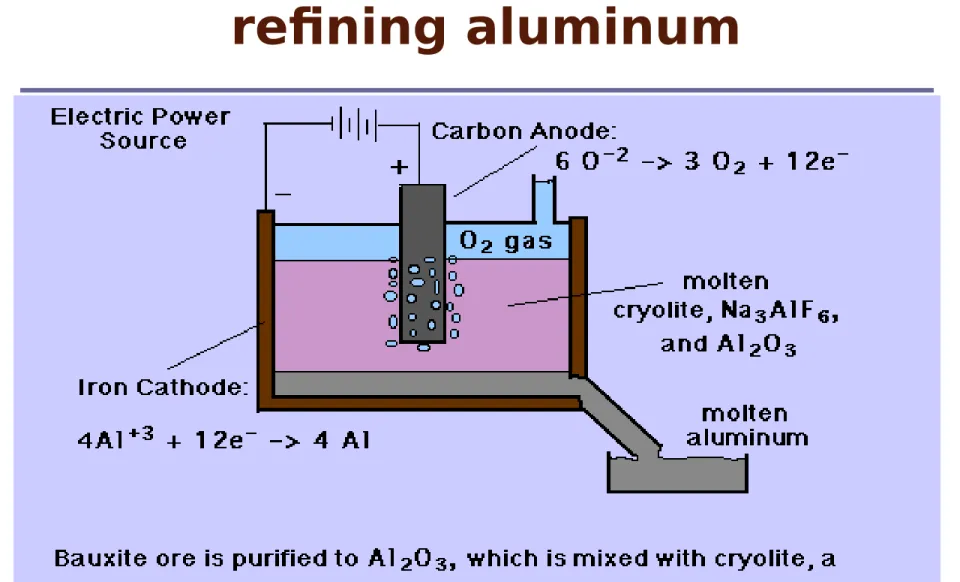
Elektrolisis
Elektrolisis adalah proses dimana energi
listrik digunakan agar reaksi kimia yang
tidak spontan dapat terjadi.
Contoh : Elektrolisis NaCl cair.
Na+(l) + e == Na(l)
(katoda) 2Cl-(l)== Cl
2 (g) + 2e
Elektrolisis Larutan
NaCl
Aplikasi Elektrolisis
Produksi
Diagram Electrolisis
pada
Produk
si
Natriu
m
Industry chloralkali
Electrolysis brine untuk
produksi skala industri chlorine dan soda caustic (sodium hydroxide).
Prinsip sel bahan bakar pertama kali
didemonstrasikan tahun 1839 oleh Sir William
Grove (ahli kimia amatir).
Air bisa didecomposisi jadi hydrogen dan
oxygen dengan electrolysis; Grove mencoba merecombinasikan kedua gas ini dalam
apparatus yang sederhana dan menyebutnya "reverse electrolysis"— yakni menggabungkan
kembali H2 dan O2 jadi air — yang
menimbulkan beda potensial diantara dua elektroda
Reaksi pada fuel cell Grove :
anoda: H2(g) → 2 H+ + 2e– E° = 0 v
katoda: ½ O2 + 2H+ + 2e– → H2O(l) E° = +1.23 v Total : H2(g) + ½ O2(g) → H2O(l) E° = +1.23 v
Tahun 1959 fuel cell hydrogen-oxygen
dikembangkan oleh Francis Thomas Bacon
(England)
Anoda : H2(g) + 2 OH– → 2 H2O + 2 e– E° = 0 v
katoda : ½ O2 + 2 H2O + 2 e– → 2 OH–E° = +1.23 v
Fuel cell menghasilkan potensial listrik dengan cara “membakar” bahan bakar pada kondisi tertentu
Digolongkan menurut suhu
kerja
•
Suhu rendah (25 – 100oC)•
Suhu sedang (100 – 500oC)•
Suhu tinggi (500 – 1000oC)•
Suhu sangat tinggi (<1000oC) Kelebihan sel bahan bakar :
•
Pada suhu tinggi tidak memerlukan katalis kuat•
Dapat digunakan untk pesawat ruang angkasa•
Air yang dihasilkan dapat dikonsumsi•
Efisiensi ≈ 75% Portable fuel cell dikembangkan NASAStoikiometri pada
Elektrolisis
1 mol elektron = 1 Faraday = 96.500 Coulomb 1 C = 1A. 1s
( Q = I x t )
Langkah-langkah untuk menentukan jumlah zat yang direduksi atau dioksidasi dalam elektrolisis :
Arus(A) dan Waktu ( detik) Muatan (Coulomb) Jumlah mol elektron Jumlah mol zat yang
tereduksi atau teroksidasi gram zat yang tereduksi atau teroksidasi