ÖZET ÖZET
Deneyin amacı; herhangi bir maddenin ısıl değerinin kalorimetre cihazı kullanılarak Deneyin amacı; herhangi bir maddenin ısıl değerinin kalorimetre cihazı kullanılarak ölçülmesi ve alt ısıl
ölçülmesi ve alt ısıl değerinin hesaplanmadeğerinin hesaplanmasıdır.sıdır.
Deneyde maddenin alt ısıl değerlerini hesaplanması için kalorimetre cihazı kullanıldı. Deneyde maddenin alt ısıl değerlerini hesaplanması için kalorimetre cihazı kullanıldı. Yakılacak maddenin hassa
Yakılacak maddenin hassas tartımı s tartımı yapıldı ve not edildi. Kalorimetre bombası içindeki yyapıldı ve not edildi. Kalorimetre bombası içindeki yakmaakma teli üzerine pamuk iplik bağlandı
teli üzerine pamuk iplik bağlandı.. ve bu ip krozenin içine numune ile temas edecek Ģekildeve bu ip krozenin içine numune ile temas edecek Ģekilde yerleĢtirildi. Daha sonra kalorimetre bombası kalorimetre içine
yerleĢtirildi. Daha sonra kalorimetre bombası kalorimetre içine yerleĢtirilerek süreç baĢlatıldı.yerleĢtirilerek süreç baĢlatıldı. Kalorimetrik yöntemle maddelerin ısıl değerlerinin belirlenmesi için uygun koĢullarda Kalorimetrik yöntemle maddelerin ısıl değerlerinin belirlenmesi için uygun koĢullarda gerekli iĢlemler yapıldı.
gerekli iĢlemler yapıldı. Tam yanma iĢlemi bittikten sonra gecen süre okundu ve not edildi.Tam yanma iĢlemi bittikten sonra gecen süre okundu ve not edildi. Bu Ģekilde deney sonlandırıldı.
1. TEORĠK BĠLGĠ 1. TEORĠK BĠLGĠ
1.1 Kalorimetre 1.1 Kalorimetre
Kalorimetre,
Kalorimetre, bir bir nicelik nicelik olarak olarak ısıyıısıyı ölçen aygıttır. Kalorimetri ise "ısı ölçüm bilimi"ölçen aygıttır. Kalorimetri ise "ısı ölçüm bilimi" ve "ısı ölçümü" için kullanılır.
ve "ısı ölçümü" için kullanılır. KalorimetreKalorimetre kimyasal reaksiyonların vekimyasal reaksiyonların ve fiziksel fiziksel değiĢimlerin
değiĢimlerin ısılarını veısılarını ve ısı kapasitesiniısı kapasitesini ölçmeye yarayan bir alettir.ölçmeye yarayan bir alettir. Kalorimetri karıĢtırma,Kalorimetri karıĢtırma, sulandırma, çözünme, kristalizasyon ve adsorpsiyon gibi çeĢitli iĢlemlerin veya kimyasal sulandırma, çözünme, kristalizasyon ve adsorpsiyon gibi çeĢitli iĢlemlerin veya kimyasal reaksiyonların entalpi değiĢimlerini ölçmeyi kapsar. Buna ek olarak ısı kapasitesinin reaksiyonların entalpi değiĢimlerini ölçmeyi kapsar. Buna ek olarak ısı kapasitesinin belirlenmesi içinde kullanılan b
belirlenmesi içinde kullanılan bir yöntemdir.ir yöntemdir. Basit bir kalorimetre biBasit bir kalorimetre bir yanma odasının üstünder yanma odasının üstünde asılı su dolu metal bir kaba bağlı bir t
asılı su dolu metal bir kaba bağlı bir termometreden oluĢur.ermometreden oluĢur. A ve B maddeleri arasındaki
A ve B maddeleri arasındaki reaksiyonda reaksiyonda bir bir mol mol A A maddesinin maddesinin entalpientalpi değiĢiminideğiĢimini bulmak
bulmak için için maddeler maddeler kalorimetreye kalorimetreye konur konur ve ve reaksiyonun reaksiyonun baĢlangıç baĢlangıç ve ve bitiĢ bitiĢ sıcaklıklarısıcaklıkları (reaksiyon baĢlamadan önce ve bittikten sonraki) kaydedilir. Sıcaklık değiĢimi,
(reaksiyon baĢlamadan önce ve bittikten sonraki) kaydedilir. Sıcaklık değiĢimi, maddelerin maddelerin kütlesi ve özgül ısıları ile çarpılırsa dıĢarı verilen ya da reaksiyon boyunca
kütlesi ve özgül ısıları ile çarpılırsa dıĢarı verilen ya da reaksiyon boyunca absorbe edilen absorbe edilen enerji değeri ortaya çıkar. Elde edilen bu enerji değeri reaksiyona giren A
enerji değeri ortaya çıkar. Elde edilen bu enerji değeri reaksiyona giren A mol mol sayısı ilesayısı ile bölünerek
bölünerek reaksiyonunreaksiyonun entalpi entalpideğiĢimi bulunur. Bu yöntem kalorimetri teorisini açıklamakdeğiĢimi bulunur. Bu yöntem kalorimetri teorisini açıklamak için
için akadamik akadamiköğretide öncelikli olarak kullanılır. Bu yöntem kullanılırken kaptan olan ısıöğretide öncelikli olarak kullanılır. Bu yöntem kullanılırken kaptan olan ısı kaybı,
kaybı, termometrenin ve kabın kendi ısı kapasiteleri ihmal edilir.termometrenin ve kabın kendi ısı kapasiteleri ihmal edilir. 1.2 Adyabatik
1.2 Adyabatik KalorimetrKalorimetrelereler
Kalorimetre adyabatik bir ortamda çalıĢtırılırsa test edilen malzeme numunesi Kalorimetre adyabatik bir ortamda çalıĢtırılırsa test edilen malzeme numunesi tarafından üretilen herhangi bir ısı enerjisi reaksiyonu hızlandırıp sıcaklığın artmasına neden tarafından üretilen herhangi bir ısı enerjisi reaksiyonu hızlandırıp sıcaklığın artmasına neden olur. Adyabatik kalorimetreler tamamen adyabatik değildir. Çünkü numuneden çevresine olur. Adyabatik kalorimetreler tamamen adyabatik değildir. Çünkü numuneden çevresine doğru bir ısı alıĢ veriĢi olacaktır. Phi olarak bilinen matematiksel bir düzeltme faktörü bu ısı doğru bir ısı alıĢ veriĢi olacaktır. Phi olarak bilinen matematiksel bir düzeltme faktörü bu ısı kayıplarını hesaba katmak için kullanılabilir.
kayıplarını hesaba katmak için kullanılabilir. Phi düzeltme faktörü:
Phi düzeltme faktörü: ɸ ɸ = =ÖÖ ℎüℎü üü öö ğğ üü 1.3 Reaksiyon Kalorimetreleri 1.3 Reaksiyon Kalorimetreleri
Kapalı ve yalıtılmıĢ bir kap içinde baĢlatılmıĢ bir kimyasal reaksiyon kalorimetresidir. Kapalı ve yalıtılmıĢ bir kap içinde baĢlatılmıĢ bir kimyasal reaksiyon kalorimetresidir. Ölçülen reaksiyon ısısı ve toplam ısı, ısı akıĢının zamana karĢı
Ölçülen reaksiyon ısısı ve toplam ısı, ısı akıĢının zamana karĢı integrasyonu ile elde edilir. integrasyonu ile elde edilir. Endüstrideki ısısyı ölçmek için uygulanan standartlardan bir tanesi endüstriyel pr
Endüstrideki ısısyı ölçmek için uygulanan standartlardan bir tanesi endüstriyel pr oseslerinoseslerin sabit sıcaklıkta
sabit sıcaklıkta çalıĢtırılmak üzere çalıĢtırılmak üzere tasarlanmıĢ olmastasarlanmıĢ olmasıdır.ıdır.
Reaksiyon kalorimetresi ayrıca reaksiyon kinetiklerini izlemek ve kimyasal proses Reaksiyon kalorimetresi ayrıca reaksiyon kinetiklerini izlemek ve kimyasal proses mühendisliği için maksimum sıcaklık salınım oranlarını belirlemek için de kullanılabilir. mühendisliği için maksimum sıcaklık salınım oranlarını belirlemek için de kullanılabilir. Reaksiyon k
1.3.1
1.3.1Isı AkıĢ KalorimetresiIsı AkıĢ Kalorimetresi
Isıtma/soğutma ceketi, ya proses sıcaklığını ya da ceket sıcaklığını kontrol eder. Isı, Isıtma/soğutma ceketi, ya proses sıcaklığını ya da ceket sıcaklığını kontrol eder. Isı, proses
proses akıĢkanıakıĢkanı veve ısı transfer akıĢkanı arasındaki sıcaklık farkı izlenerek ölçülür. Buna ekısı transfer akıĢkanı arasındaki sıcaklık farkı izlenerek ölçülür. Buna ek olarak özgül ısı ve ısı transfer katsayasının doğru değeri belirlenmelidir. Geri akıĢtaki olarak özgül ısı ve ısı transfer katsayasının doğru değeri belirlenmelidir. Geri akıĢtaki reaksiyonların ısılarını belirlemek için bu tip kalorimetreler kullanılır. Buna rağmen bu reaksiyonların ısılarını belirlemek için bu tip kalorimetreler kullanılır. Buna rağmen bu k
k alorimetrelerin doğruluğu o kadar da iyi değildir.alorimetrelerin doğruluğu o kadar da iyi değildir.
1.3.2 Isı Denge Kalorimetresi 1.3.2 Isı Denge Kalorimetresi
Soğutma/ısıtma ceketi prosesin sıcaklığını kontrol eder. Isıl değerler, ısı transfer Soğutma/ısıtma ceketi prosesin sıcaklığını kontrol eder. Isıl değerler, ısı transfer akıĢkanı ile elde edilen ya da
akıĢkanı ile elde edilen ya da kaybolan ısının izlenmesi ile ölçülür.kaybolan ısının izlenmesi ile ölçülür.
1.3.3 Güç Kompanzas 1.3.3 Güç Kompanzasyonuyonu
Güç kompanzasyonu sabit sıcaklığı korumak için kap içine yerleĢtirilmiĢ bir ısıtıcıyı Güç kompanzasyonu sabit sıcaklığı korumak için kap içine yerleĢtirilmiĢ bir ısıtıcıyı kullanır. Isıtıcı için sağlanan elektrik enerjisi reaksiyonlar enerji gerektirdiğinden ve kullanır. Isıtıcı için sağlanan elektrik enerjisi reaksiyonlar enerji gerektirdiğinden ve kalorimetre sinyalinin sadece bu elektrik
kalorimetre sinyalinin sadece bu elektrik gücünden elde edildiğinden değiĢgücünden elde edildiğinden değiĢebilmektedir.ebilmektedir. 1.3.4
1.3.4Sabit AkıSabit Akı
Kabın çeperleri boyunca sabit ısı akıĢını korumak için özelleĢtirilmiĢ control Kabın çeperleri boyunca sabit ısı akıĢını korumak için özelleĢtirilmiĢ control mekanizmalarını ve ısı denge kalorimetrelerinin kullanılmasıyla elde edilir.
mekanizmalarını ve ısı denge kalorimetrelerinin kullanılmasıyla elde edilir. 1.4
1.4Sabit basınç kalorimetresiSabit basınç kalorimetresi
Ġç içe geçmiĢ iki stiren köpüğünden yapılmıĢ kahve bardağından oluĢan, yanma
Ġç içe geçmiĢ iki stiren köpüğünden yapılmıĢ kahve bardağından oluĢan, yanma
olmayan reaksiyonların ısı değiĢimlerini tayin etmek için kullanılan basit bir cihazdır. Çözelti
olmayan reaksiyonların ısı değiĢimlerini tayin etmek için kullanılan basit bir cihazdır. Çözelti
ve seyrelme ısıları ,asit
ve seyrelme ısıları ,asit-- baz baz nötralleĢmeleri (Yanma nötralleĢmeleri (Yanma olayı olayı gerçekleĢmeygerçekleĢmeyen en reaksiyonreaksiyonlar) lar) gibigibi çeĢitli reaksiyonların ısı etkilerini ölçmektedir.Prosesin ısı değiĢimi basit sabit olduğu için
çeĢitli reaksiyonların ısı etkilerini ölçmektedir.Prosesin ısı değiĢimi basit sabit olduğu için
entalpi değiĢimine eĢittir. Tamamen izole bir sistemde reaksiyon ısısının çözelti tarafından
entalpi değiĢimine eĢittir. Tamamen izole bir sistemde reaksiyon ısısının çözelti tarafından
absorblandığı kabul edilir. Çözeltinin ısı değiĢimi kadar kalorimetrenin de ısı kapasitesini
absorblandığı kabul edilir. Çözeltinin ısı değiĢimi kadar kalorimetrenin de ısı kapasitesini dede
bilmek gerekir. bilmek gerekir.
1.5 Buz kalorimetresi 1.5 Buz kalorimetresi En basit ısı ölçü birimi, bir
En basit ısı ölçü birimi, bir kilogram buzu kilogram buzu eritmek için gerekli ısı miktarıdır. Birime dayananeritmek için gerekli ısı miktarıdır. Birime dayanan ölçme Ģeklinde, bir buz kütlesi alınır. Ġçinde bir oyuk açılır. Mesela belirli bir sıcaklıktaki bir
ölçme Ģeklinde, bir buz kütlesi alınır. Ġçinde bir oyuk açılır. Mesela belirli bir sıcaklıktaki bir
cismin 0
cismin 0 °C dereceye inmek için vereceği ısıyı ölçmek için, o cisim bu oyuğa konulur ve üstü°C dereceye inmek için vereceği ısıyı ölçmek için, o cisim bu oyuğa konulur ve üstü bir
bir buz buz tabakasıyla kapatılır. tabakasıyla kapatılır. Konulan cismin Konulan cismin sıcaklığı sıcaklığı 00 °C dereceye bir müddet sonra iner.°C dereceye bir müddet sonra iner.
Sonra meydana gelen su alınarak tartılır. Cismin sıfır dereceye inmek için vereceği ısı
Sonra meydana gelen su alınarak tartılır. Cismin sıfır dereceye inmek için vereceği ısı susu
haline geçen buzun erimesi için gerekli olan ısıya eĢit olacağından, kilogram cinsinden
haline geçen buzun erimesi için gerekli olan ısıya eĢit olacağından, kilogram cinsinden
ölçülen su ağırlığı ısı miktarını verir. Daha sonra
ölçülen su ağırlığı ısı miktarını verir. Daha sonra Joseph Black Joseph Black tarafından kullanılan butarafından kullanılan bu alet, Pierre Laplace
alet, Pierre Laplacetarafından geliĢtirilmiĢtir.tarafından geliĢtirilmiĢtir. Robert W. E. Bunsen ise
Robert W. E. Bunsen ise, bu aleti , bu aleti iki hazneli yaparak daha da pratik hale getirmiĢtir. Ġçiki hazneli yaparak daha da pratik hale getirmiĢtir. Ġç hazne ısısı ölçülecek cisim için olup, dıĢta bulunan ve iç hazneyi çeviren haznede buz ve su
hazne ısısı ölçülecek cisim için olup, dıĢta bulunan ve iç hazneyi çeviren haznede buz ve su
karıĢımı bulunur. DıĢ hazneye bir kapiller boru bağlanmıĢtır. Ayrıca aleti, dıĢ tesirlerden
karıĢımı bulunur. DıĢ hazneye bir kapiller boru bağlanmıĢtır. Ayrıca aleti, dıĢ tesirlerden
koru
korumak için bütün dıĢ hazne buz parçacıklarıyla sarılmıĢtır. ÇalıĢma durumunda dıĢmak için bütün dıĢ hazne buz parçacıklarıyla sarılmıĢtır. ÇalıĢma durumunda dıĢ haznedeki buz ve su karıĢımı tamamen dengede olup, ne erime ve ne de donma mevcuttur.
haznedeki buz ve su karıĢımı tamamen dengede olup, ne erime ve ne de donma mevcuttur.
Isısı ölçülecek cisim, iç hazneye konulduğunda buz
Isısı ölçülecek cisim, iç hazneye konulduğunda buz--su karıĢımındaki buzlar erimeye baĢlar.su karıĢımındaki buzlar erimeye baĢlar. Eriyen buz miktarı bu haznede meydana gelen hacim değiĢikliğinden ve bu ise eklenmiĢ
bulunan
bulunan tüpteki tüpteki seviye seviye değiĢikliğinden değiĢikliğinden anlaĢılır. anlaĢılır. Bu Bu değerden, değerden, cismin cismin sahip sahip olduğu olduğu ısıyaısıya
geçmek mümkündür.
geçmek mümkündür.
1.6 Buhar
1.6 Buhar KalorimetreKalorimetresisi
Bir kilogram buharın yoğunlaĢıp aynı sıcaklıkta su haline dönüĢürken verdiği ısı da,
Bir kilogram buharın yoğunlaĢıp aynı sıcaklıkta su haline dönüĢürken verdiği ısı da,
baĢka bir
baĢka bir ısı ısı birimi birimi olarak olarak tarif tarif edilir. edilir. Bugünkü durumuna Bugünkü durumuna fizikçifizikçi John Joly'inJohn Joly'in çalıĢmalarıylaçalıĢmalarıyla gelmiĢtir. Hassas bir
gelmiĢtir. Hassas bir terazininterazinin bir bir kefesine kefesine sahib sahib olduğu olduğu sıcaklığı sıcaklığı ölçülecek ölçülecek cisim cisim konur.konur. Cismin sıcaklığı kendisini saran buharın sıcaklığına çıkarken, buharın bir kısmı cisim
Cismin sıcaklığı kendisini saran buharın sıcaklığına çıkarken, buharın bir kısmı cisim
üzerinde yoğunlaĢır. Daha sonra cisim tartılarak yoğunlaĢmıĢ olan buharın ağırlığı bulunur.
üzerinde yoğunlaĢır. Daha sonra cisim tartılarak yoğunlaĢmıĢ olan buharın ağırlığı bulunur.
Bu kadar buharın yoğunlaĢması için gerekli olan ısı miktarı, cismin bulunduğu sıcaklıktan,
Bu kadar buharın yoğunlaĢması için gerekli olan ısı miktarı, cismin bulunduğu sıcaklıktan,
buharın sıcak
buharın sıcaklığına gelmesi için gerelığına gelmesi için gerekli olan ısı miktarına eĢkli olan ısı miktarına eĢit olacaktır.it olacaktır.
1.7
1.7Kalorimetre BombasıKalorimetre Bombası
Kalorimetre bombası, bir reaksiyondaki yanma ısısını ölçmek için kullanılan bir
Kalorimetre bombası, bir reaksiyondaki yanma ısısını ölçmek için kullanılan bir
kalorimetre cinsidir. Kalorimetre bombaları reaksiyon sonucu oluĢan basınca ve güce karĢı
kalorimetre cinsidir. Kalorimetre bombaları reaksiyon sonucu oluĢan basınca ve güce karĢı
koymak zorundadır. Yakıtı tutuĢturmak için elektrik enerjisi kullanılır, yakıt yanmasıyla
koymak zorundadır. Yakıtı tutuĢturmak için elektrik enerjisi kullanılır, yakıt yanmasıyla
birlikte
birlikte etrafındaki havayı etrafındaki havayı ısıtır. ısıtır. Isınan hava Isınan hava genleĢerek kalorimetrenin genleĢerek kalorimetrenin hava çıkıĢındaki hava çıkıĢındaki tüpetüpe
doğru gider. Hava bakır tüpten geçerken aynı zamanda tüpün dıĢındaki suyu da ısıtır. Suyun
doğru gider. Hava bakır tüpten geçerken aynı zamanda tüpün dıĢındaki suyu da ısıtır. Suyun
sıcaklığındaki artıĢ miktarı yakıtımızın kalorisini hesaplamamıza yardımcı olur.
sıcaklığındaki artıĢ miktarı yakıtımızın kalorisini hesaplamamıza yardımcı olur.
Yeni kalorimetre
Yeni kalorimetre tasarımlarında bomba tek bütün olarak elektrikle tutuĢturulmadantasarımlarında bomba tek bütün olarak elektrikle tutuĢturulmadan önce belirli bir miktar yakıt ve yüksek basınçlı oksijen(genelde 20 atm) ve belirli miktardaki
önce belirli bir miktar yakıt ve yüksek basınçlı oksijen(genelde 20 atm) ve belirli miktardaki
su ile çevrelenir. Bomba –
su ile çevrelenir. Bomba – yakıt ve oksijen – yakıt ve oksijen – kapalı bir sistem oluĢturur ve reaksiyonkapalı bir sistem oluĢturur ve reaksiyon
esnasında
esnasındahava çıkıĢı olmaz. Yanma sırasında oluĢan enerjiyle hava çıkıĢı olmaz. Yanma sırasında oluĢan enerjiyle çelik bombanın, bileĢenlerin veçelik bombanın, bileĢenlerin ve
suyun sıcaklığı yükselir. Ve böylece suyun sıcaklığındaki değiĢim doğru Ģekilde ölçülür. Bu
suyun sıcaklığı yükselir. Ve böylece suyun sıcaklığındaki değiĢim doğru Ģekilde ölçülür. Bu
sıcaklık artıĢı bir bomba faktörüyle (metal bombanın parçalarının ısı kapasitesine bağlı olan)
sıcaklık artıĢı bir bomba faktörüyle (metal bombanın parçalarının ısı kapasitesine bağlı olan)
beraber
beraber yanan yanan yakıtın yakıtın verdiği verdiği enerjiyi enerjiyi ölçmede ölçmede kullanılır. kullanılır. Sıcaklık Sıcaklık değiĢimi değiĢimi hesaplandıktahesaplandıktann
sonra bomba içindeki yüksek basınç dıĢarı verilir. Temel olarak, bu düzenek basit
sonra bomba içindeki yüksek basınç dıĢarı verilir. Temel olarak, bu düzenek basit
kalorimetrelerden daha iyidir, çünkü hesaplanmayan ısı kaybına çok
kalorimetrelerden daha iyidir, çünkü hesaplanmayan ısı kaybına çok fazla izin vermez. fazla izin vermez.
ġekil 1. Kalorimetre Bombası
1.8 Isı ve Sıcaklık 1.8 Isı ve Sıcaklık 1.8.1 Isı nedir? 1.8.1 Isı nedir?
Isı ve
Isı ve sıcaklık sıcaklık kavramı birbirlerine çok yakın kavramlardır. Çoğu insan bu kavramlarıkavramı birbirlerine çok yakın kavramlardır. Çoğu insan bu kavramları karıĢtırabilmektedir. Isı; Sıcaklıkları farklı iki madde'nin bütün moleküllerinin sahip olduğu karıĢtırabilmektedir. Isı; Sıcaklıkları farklı iki madde'nin bütün moleküllerinin sahip olduğu potansiyel enerjileri ile kinetik
potansiyel enerjileri ile kinetik enerjilerinin toplamına,enerjilerinin toplamına, maddemadde arasında alınıp verilen enerjiyearasında alınıp verilen enerjiye ısı denilmektedir. Isı bir enerjidir
ısı denilmektedir. Isı bir enerjidir
1.8.2 Isı birimleri nelerdir? 1.8.2 Isı birimleri nelerdir?
Isı, bir
Isı, bir enerjienerji olduğu için birimi joule ( j )’dur. Bir baĢka ısı birimi ise kalori (cal)’dir.olduğu için birimi joule ( j )’dur. Bir baĢka ısı birimi ise kalori (cal)’dir. 1.8.3
1.8.3Isı nasıl ölçülmektedir?Isı nasıl ölçülmektedir?
Bir maddenin sahip olduğu ısı direkt olarak herhangi bir aletle ölçülemez. Sadece Bir maddenin sahip olduğu ısı direkt olarak herhangi bir aletle ölçülemez. Sadece maddelerin birbirine aktardığı ısı ölçülebilir. Bazı matematiksel ifadeler kullanılarak maddelerin birbirine aktardığı ısı ölçülebilir. Bazı matematiksel ifadeler kullanılarak hesaplanabi
hesaplanabilir. Isı calorimetre kabı ile lir. Isı calorimetre kabı ile ölçülmektedir. 1 kalori = 4,18 joule'e eĢittir.ölçülmektedir. 1 kalori = 4,18 joule'e eĢittir.
1.8.4 Sıcaklık nedir? 1.8.4 Sıcaklık nedir?
Sıcaklık; Bir maddeyi oluĢturan moleküllerin taneciklerden birinin ortalama kinetik Sıcaklık; Bir maddeyi oluĢturan moleküllerin taneciklerden birinin ortalama kinetik enerjisi ifade eden, moleküllerin ortalama sıcaklık oranıdır. Sıcaklık, enerji değildir. Sıcaklık enerjisi ifade eden, moleküllerin ortalama sıcaklık oranıdır. Sıcaklık, enerji değildir. Sıcaklık noktasal bir özellik, enerjinin mikroskobik düzeydeki statik halidir.
noktasal bir özellik, enerjinin mikroskobik düzeydeki statik halidir.
1.8.5 Sıcaklık birimleri nelerdir? 1.8.5 Sıcaklık birimleri nelerdir?
1- Celsius (C) 1- Celsius (C) 2- Fahrenheit (F) 2- Fahrenheit (F) 3- Kelvin (K) 3- Kelvin (K) 4-4-Römür (R)Römür (R) 5-5-Rømer (°Rø)Rømer (°Rø) 6-6-Réaumur (°r)Réaumur (°r) 7-7- Newton (°N) Newton (°N)
8-8-Delisle (°De)Delisle (°De)
Günlük hayatta sıcaklık birimi olarak en çok derece celcius (°C)kullanılır. Bilimsel Günlük hayatta sıcaklık birimi olarak en çok derece celcius (°C)kullanılır. Bilimsel iĢlemlerde ise Kelvin ölçeği kullanılmalıdır.
1.8.6 Sıcaklık nasıl ölçülmektedir? 1.8.6 Sıcaklık nasıl ölçülmektedir?
Sıcaklık genleĢmeye bakılarak dolaylı yoldan ölçülebilmektedir. Sıcaklık doğrudan Sıcaklık genleĢmeye bakılarak dolaylı yoldan ölçülebilmektedir. Sıcaklık doğrudan termo
termometre ile ölçülmektedir.metre ile ölçülmektedir.
1.8.7 Isı ve sıcaklık arasındaki farklar ve benzerlikler nelerdir? 1.8.7 Isı ve sıcaklık arasındaki farklar ve benzerlikler nelerdir?
1-1-Isı ve sıcaklık ölçülebilir büyüklükleIsı ve sıcaklık ölçülebilir büyüklüklerdir.rdir.
2-2- Isı enerji çeĢididir, sıcaklık enerji değildir.Isı enerji çeĢididir, sıcaklık enerji değildir.
3-3- Isı kalorimetre ile, sıcaklık ise termometre ile ölçülür.Isı kalorimetre ile, sıcaklık ise termometre ile ölçülür.
4-4-Isı birimi calori veya Joule'dür, Sıcaklık birimi ise Isı birimi calori veya Joule'dür, Sıcaklık birimi ise sadece Derece'dir.sadece Derece'dir.
5-5- Isı madde miktarına bağlıdır. Sıcaklık ise Isı madde miktarına bağlıdır. Sıcaklık ise madde miktarına bağlı değildir.madde miktarına bağlı değildir.
6-6- Isı ile sıcaklık arasında doğru orantı Ģeklinde bir iliĢki vardır.Isı ile sıcaklık arasında doğru orantı Ģeklinde bir iliĢki vardır.
1.8.8 Özısı nedir? 1.8.8 Özısı nedir?
Maddenin birim
Maddenin birim kütlesinin (örneğin 1 gr.) sıcaklığını 1°C değiĢtirmek için maddeyekütlesinin (örneğin 1 gr.) sıcaklığını 1°C değiĢtirmek için maddeye verilmesi veya maddeden alınması gereken ısı miktarıdır. Maddelerin ayırdedici özelliğidir. verilmesi veya maddeden alınması gereken ısı miktarıdır. Maddelerin ayırdedici özelliğidir. 1.8.9
1.8.9Isı alıĢveriĢi nedir?Isı alıĢveriĢi nedir?
Biri sıcak diğeri soğuk olan iki maddeyi yanyana, kapalı bir ortamd
Biri sıcak diğeri soğuk olan iki maddeyi yanyana, kapalı bir ortamd a koyarsak,a koyarsak, aralarında ısı geçiĢi gerçekleĢir. Bu olaya ısı alıĢveriĢi adı verilir.
aralarında ısı geçiĢi gerçekleĢir. Bu olaya ısı alıĢveriĢi adı verilir. 1.8.10
1.8.10Isı ve Sıcaklığa verilebilecek örneklerIsı ve Sıcaklığa verilebilecek örnekler
Yanan kibrit çöpü ile deniz suyunun sıcaklıklarının karĢılaĢtırılması örneğinde, Kibrit Yanan kibrit çöpü ile deniz suyunun sıcaklıklarının karĢılaĢtırılması örneğinde, Kibrit çöpündeki bir molekülün kinetik enerjisi, deniz suyunu oluĢturan moleküllerden birinin çöpündeki bir molekülün kinetik enerjisi, deniz suyunu oluĢturan moleküllerden birinin kinetik enerjisinden fazla olacağı için kibrit çöpünün sıcaklığı deniz suyunun sıcaklığından kinetik enerjisinden fazla olacağı için kibrit çöpünün sıcaklığı deniz suyunun sıcaklığından fazladır.
fazladır.
Yanan kibrit çöpü ile deniz suyunun ısılarının karĢılaĢtırılması örneğindeyse, Deniz Yanan kibrit çöpü ile deniz suyunun ısılarının karĢılaĢtırılması örneğindeyse, Deniz suyundaki bütün moleküllerin toplam kinetik enerjisi, kibrit çöpündeki moleküllerin toplam suyundaki bütün moleküllerin toplam kinetik enerjisi, kibrit çöpündeki moleküllerin toplam kinetik enerjisinden fazla olacağı için deniz suyunun ısısı kibrit
kinetik enerjisinden fazla olacağı için deniz suyunun ısısı kibrit çöpünün ısısından fazladır.çöpünün ısısından fazladır.
1.8.11 Yakıtın alt ısıl değeri ve üst ısıl değeri nedir? 1.8.11 Yakıtın alt ısıl değeri ve üst ısıl değeri nedir?
Yanma tepkimelerinde bilinm
Yanma tepkimelerinde bilinmesi gereken iki tanımlama alt ısıl değer ve üst ısılesi gereken iki tanımlama alt ısıl değer ve üst ısıl değerdir. Alt ısıl değer, bir yanma tepkimesinde oluĢan suyun buhar fazında olması değerdir. Alt ısıl değer, bir yanma tepkimesinde oluĢan suyun buhar fazında olması durumunda açığa çıkan ısı enerjisidir. Üst ısıl
durumunda açığa çıkan ısı enerjisidir. Üst ısıl değer ise, bir değer ise, bir yanma tepkimesinde oluĢan suyunyanma tepkimesinde oluĢan suyun sıvı fazında olması durumunda açığa çıkan ısı enerjisini tanımlamaktadır. Yani üst ısıl değer, sıvı fazında olması durumunda açığa çıkan ısı enerjisini tanımlamaktadır. Yani üst ısıl değer, buharlaĢma ısısı d
2. DENEY
2. DENEYSEL YÖNTEMSEL YÖNTEM
2.1 Deneyin YapılıĢ Amacı 2.1 Deneyin YapılıĢ Amacı
Herhangi bir maddenin ısıl değerinin kalorimetre kullanılarak ölçülmesi ve alt ısıl Herhangi bir maddenin ısıl değerinin kalorimetre kullanılarak ölçülmesi ve alt ısıl değerinin hesaplanmasıdır.
değerinin hesaplanmasıdır.
2.2 Deney Sisteminin Tanıtımı 2.2 Deney Sisteminin Tanıtımı
KalorimetreKalorimetrecihazıcihazı
2.3 Deneyin YapılıĢı 2.3 Deneyin YapılıĢı
Deneyde benzoik asit ve Ģekerin ısıl değerleri, hem manuel hem de dinamik yöntemle Deneyde benzoik asit ve Ģekerin ısıl değerleri, hem manuel hem de dinamik yöntemle hesaplanıldı. Ġ
hesaplanıldı. Ġlk lk önce sönce sirkülator çalıĢtırılarak, irkülator çalıĢtırılarak, sıcaklık 18sıcaklık 18°°CC'ye ulaĢana kadar 'ye ulaĢana kadar beklenildi,cihazbeklenildi,cihaz anahtar kısımından açıldı . Daha sonra benzoik asit tartıldı ve kütlesi not edildi. Kalorimetre anahtar kısımından açıldı . Daha sonra benzoik asit tartıldı ve kütlesi not edildi. Kalorimetre bombası hazırlanması amacıyla, yakma teli üzerine pamuk
bombası hazırlanması amacıyla, yakma teli üzerine pamuk ipliği bağlanıldı ve ipliği bağlanıldı ve bu ip krozeninbu ip krozenin içine numune ile temas edecek Ģekilde yerleĢtirildi. Amaç pamuk ip yandığı zaman benzoik içine numune ile temas edecek Ģekilde yerleĢtirildi. Amaç pamuk ip yandığı zaman benzoik asitin yanmasını sağlamak içindir. Ġçerisinde numune olan kroze tutucu içerisine
asitin yanmasını sağlamak içindir. Ġçerisinde numune olan kroze tutucu içerisine yerleĢdirilidi.yerleĢdirilidi. Yakma bombası kapatıldıkdan sonra oksijen tüpü ile 30 bar O
Yakma bombası kapatıldıkdan sonra oksijen tüpü ile 30 bar O22 ile dolduruldu. Bu iĢlemleile dolduruldu. Bu iĢlemlerr
yapıldıktan sonra yakma bombası, kalorimetre içindeki 3 adet merkezleyici boĢluk arasına yapıldıktan sonra yakma bombası, kalorimetre içindeki 3 adet merkezleyici boĢluk arasına yerleĢtirildi. Kalorimetre kapağı kapatıldı ve ekranda, tartılan benzoik asit miktarı yazıldı. yerleĢtirildi. Kalorimetre kapağı kapatıldı ve ekranda, tartılan benzoik asit miktarı yazıldı. Ekranda kelvin cinsinden verilen sıcaklık değerleri sabitleninceye kad
Ekranda kelvin cinsinden verilen sıcaklık değerleri sabitleninceye kad ar beklenilip dakikadaar beklenilip dakikada bir
bir not not edildiedildi. Formülde ΔT. Formülde ΔT yerine koyularak alt ısı değeri hesaplanıldı. Yukarıda yapılanyerine koyularak alt ısı değeri hesaplanıldı. Yukarıda yapılan iĢlemlerin aynısı Ģeker içinde yapılarak en sonda Ģekerin alt ısı değeri hesaplanıldı. Alt ısı iĢlemlerin aynısı Ģeker içinde yapılarak en sonda Ģekerin alt ısı değeri hesaplanıldı. Alt ısı değerinin hesaplanılmas
değerinin hesaplanılması ı yöntemlerindeyöntemlerinden biri n biri dede dinamik yöntemdir.dinamik yöntemdir. Bu yöntemle hesaplananBu yöntemle hesaplanan alt ısı
alt ısı değeri değeri diğerinde diğerinde olduğu olduğu gibi aygibi aynı iĢlemler nı iĢlemler yapılır.yapılır. Sadece bu yöntemde, yakmaSadece bu yöntemde, yakma bombası kalorimetre içine koyuldukda
bombası kalorimetre içine koyuldukdan sonra belli bir n sonra belli bir bekleme süresi vardır.bekleme süresi vardır. Bu süre tahminiBu süre tahmini 8 dakika sürdü.
8 dakika sürdü. En sonda ayrı ayrı yapılan deneyler sonucunda benzoik asit ve Ģekerin ısıEn sonda ayrı ayrı yapılan deneyler sonucunda benzoik asit ve Ģekerin ısı değerleri kalorimetre cihazının ekranında verildi.
3.
3. BULGULAR VE TARTIġMABULGULAR VE TARTIġMA
3.1 Manuel Ölçüm Verileri 3.1 Manuel Ölçüm Verileri
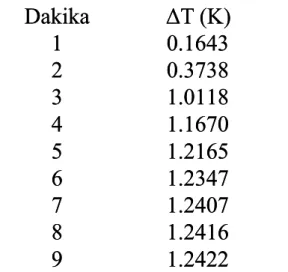
m (benzoik asit) = 0.50g m (benzoik asit) = 0.50g Tablo 1.
Tablo 1. Benzoik asitin Benzoik asitin yanması sonucuyanması sonucu zamana karĢı sıcaklık farkı verilzamana karĢı sıcaklık farkı verilerieri Dakika Dakika ΔT (K)ΔT (K) 1 0.1643 1 0.1643 2 0.3738 2 0.3738 3 1.0118 3 1.0118 4 1.1670 4 1.1670 5 1.2165 5 1.2165 6 1.2347 6 1.2347 7 1.2407 7 1.2407 8 1.2416 8 1.2416 9 1.2422 9 1.2422 m (Ģeker) = 2,7359g m (Ģeker) = 2,7359g Tablo 2.
Tablo 2. ġekerin yanması sonucu zamana karĢı sıcaklık farkı verileriġekerin yanması sonucu zamana karĢı sıcaklık farkı verileri Dakika Dakika ΔT (K)ΔT (K) 1 0,0172 1 0,0172 2 0,7694 2 0,7694 3 3,6588 3 3,6588 4 4,3353 4 4,3353 5 4,4926 5 4,4926 6 4,5403 6 4,5403 7 4,5455 7 4,5455 8 4,5502 8 4,5502 9 4,5523 9 4,5523
3.3 Dinamik Ölçüm Verileri 3.3 Dinamik Ölçüm Verileri
m (benzoik asit) = 0.50g m (benzoik asit) = 0.50g Tablo 3.
Tablo 3. Benzoik asit için dinamik ölçülmüĢ üst ısıl Benzoik asit için dinamik ölçülmüĢ üst ısıl değerideğeri Dakika Hg(cal/g) Dakika Hg(cal/g) 8 6401 8 6401 m (Ģeker) = 2.7024g m (Ģeker) = 2.7024g Tablo 4.
Tablo 4. ġeker için dinamik ölçülmüĢ üst ısıl ġeker için dinamik ölçülmüĢ üst ısıl değerideğeri Dakika Hg(cal/g)
Dakika Hg(cal/g)
8 4136
4. HESAPLAMALAR 4. HESAPLAMALAR
4.1 Benzoik asit için alt
4.1 Benzoik asit için alt ve üst ısıl değer hesaplamalarıve üst ısıl değer hesaplamaları
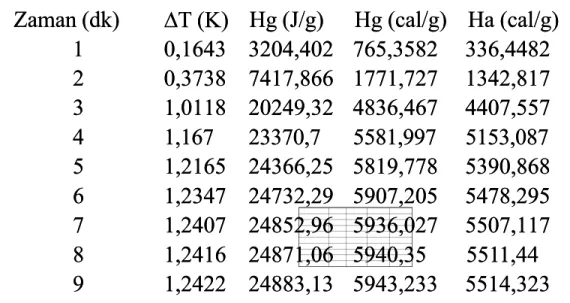
H Hgg== ∗∗ ∆∆−− H Haa== ∗∗ ∆∆−− - H - HH2OH2O Tablo 5.
Tablo 5. Benzoik asit için alt ve üst ısıl değer tablosuBenzoik asit için alt ve üst ısıl değer tablosu Zaman (dk)
Zaman (dk) ∆T (K)∆T (K) Hg Hg (J/g) (J/g) Hg Hg (cal/g) (cal/g) Ha Ha (cal/g)(cal/g) 1 1 0,1643 0,1643 3204,402 3204,402 765,3582 765,3582 336,4482336,4482 2 2 0,3738 0,3738 7417,866 7417,866 1771,727 1771,727 1342,8171342,817 3 3 1,0118 1,0118 20249,32 20249,32 4836,467 4836,467 4407,5574407,557 4 4 1,167 1,167 23370,7 23370,7 5581,997 5581,997 5153,0875153,087 5 5 1,2165 1,2165 24366,25 24366,25 5819,778 5819,778 5390,8685390,868 6 6 1,2347 1,2347 24732,29 24732,29 5907,205 5907,205 5478,2955478,295 7 7 1,2407 1,2407 24852,96 24852,96 5936,027 5936,027 5507,1175507,117 8 8 1,2416 1,2416 24871,06 24871,06 5940,35 5940,35 5515511,441,44 9 9 1,2422 1,2422 24883,13 24883,13 5943,233 5943,233 5514,3235514,323 H Haa= H= Hgg – – H HH2OH2O EE=10056 J/ EE=10056 J/°°CC F=50 J F=50 J Hh Hh2O2O=1795,78 J/g =428,91 cal/g=1795,78 J/g =428,91 cal/g ΔT ΔT((9,dk 9,dk )=1,2422 K)=1,2422 K m(benzoik asit)=0,50 gr m(benzoik asit)=0,50 gr Hg =6401 cal/g Hg =6401 cal/g
Ha=6401 cal/g-428,91 cal/g= 5972,09 cal/g Ha=6401 cal/g-428,91 cal/g= 5972,09 cal/g
4.2 ġeker için alt ve üst ısıl değer hesaplamaları 4.2 ġeker için alt ve üst ısıl değer hesaplamaları
H Hgg== ∗∗ ∆∆−− H Haa== ∗∗ ∆∆−− - H - HH2OH2O Tablo 6.
Tablo 6. ġeker için alt ve üst ısıl değer tablosuġeker için alt ve üst ısıl değer tablosu Zaman (dk)
Zaman (dk) ∆T (K)∆T (K) Hg Hg (J/g) (J/g) Hg Hg (cal/g) (cal/g) Ha Ha (cal/g)(cal/g) 1 1 0,0172 0,0172 245,9264 245,9264 58,73851 58,73851 -370,171-370,171 2 2 0,7694 0,7694 15374,17 15374,17 3672,058 3672,058 3243,1483243,148 3 3 3,6588 3,6588 73485,79 73485,79 17551,78 17551,78 17122,8717122,87 4 4 4,3353 4,3353 87091,55 87091,55 20801,46 20801,46 20372,5520372,55 5 5 4,4926 4,4926 90255,17 90255,17 21557,08 21557,08 21128,1721128,17 6 6 4,5403 4,5403 91214,51 91214,51 21786,21 21786,21 21357,321357,3 7 7 4,5455 4,5455 91319,1 91319,1 21811,19 21811,19 21382,2821382,28 8 8 4,5502 4,5502 91413,62 91413,62 21833,77 21833,77 21404,8621404,86 9 9 1,2422 1,2422 24883,13 24883,13 5943,233 5943,233 5514,3235514,323 H Haa= H= Hgg – – H HH2OH2O EE=10056 J/ EE=10056 J/°°CC F=50 J F=50 J Hh Hh2O2O=1795,78 J/g =428,91 cal/g=1795,78 J/g =428,91 cal/g ΔT ΔT((9,dk 9,dk )=4,5455 K)=4,5455 K m(Ģeker)=2,7359 g m(Ģeker)=2,7359 g Hg =4136 cal/g Hg =4136 cal/g
Ha=4136 cal/g-428,91 cal/g= 3707,09 cal/g Ha=4136 cal/g-428,91 cal/g= 3707,09 cal/g
Grafik 1.
Grafik 1. Benzoik asitin yanması sonucu zamana karĢılık sıcaklık farkının grafik üzerindeBenzoik asitin yanması sonucu zamana karĢılık sıcaklık farkının grafik üzerinde gösterimi
gösterimi
Grafik 2.
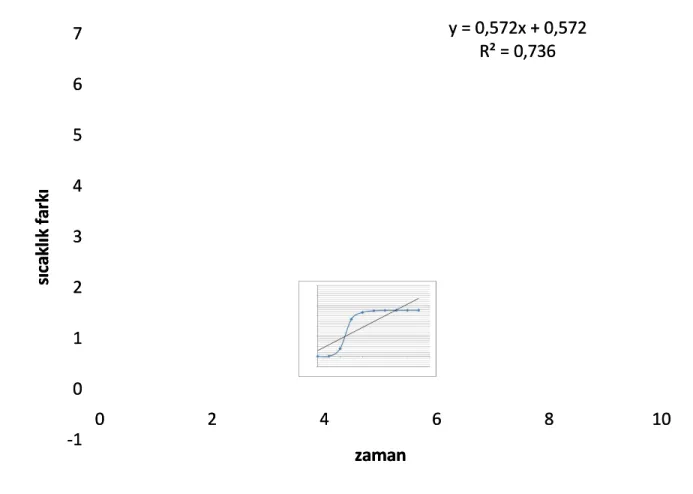
Grafik 2. ġekerin yanması sonucu zamana karĢılık sıcaklık farkının grafik üzerinde gösterimiġekerin yanması sonucu zamana karĢılık sıcaklık farkının grafik üzerinde gösterimi
y = 0,144x + 0,240 y = 0,144x + 0,240 R² = 0,753 R² = 0,753 0 0 0,2 0,2 0,4 0,4 0,6 0,6 0,8 0,8 1 1 1,2 1,2 1,4 1,4 1,6 1,6 1,8 1,8 0 0 22 44 66 88 1100 s s ı ı c c a a k k l l ı ı k k f f a a r r k k ı ı zaman zaman y = 0,572x + 0,572 y = 0,572x + 0,572 R² = 0,736 R² = 0,736 -1 -1 0 0 1 1 2 2 3 3 4 4 5 5 6 6 7 7 0 0 22 44 66 88 1100 s s ı ı c c a a k k l l ı ı k k f f a a r r k k ı ı zaman zaman
5. SONUÇ 5. SONUÇ
Bu deneyde dinamik ve manuel yöntemlerle Ģeker ve benzoik asitin alt ısıl değerlerin Bu deneyde dinamik ve manuel yöntemlerle Ģeker ve benzoik asitin alt ısıl değerlerin hesaplanması yapıldı. Oksijen tüpü ve kalorimetre cihazı hakkında bilgi sahibi olundu. Bu hesaplanması yapıldı. Oksijen tüpü ve kalorimetre cihazı hakkında bilgi sahibi olundu. Bu deney ile katı maddelerin alı ısıl değerlerinin nasıl hesaplanması gerektiği öğrenildi. Tam deney ile katı maddelerin alı ısıl değerlerinin nasıl hesaplanması gerektiği öğrenildi. Tam yanma iĢlemi yapılarak açığa çıkan ısı, bombanın içinde bulunduğu kalorimetre kabında yanma iĢlemi yapılarak açığa çıkan ısı, bombanın içinde bulunduğu kalorimetre kabında soğutulma yapıldı ve bunun sonuncunda ΔT
soğutulma yapıldı ve bunun sonuncunda ΔT sıcaklık artıĢı gözlendi. Sıcaklık değeri artaraksıcaklık artıĢı gözlendi. Sıcaklık değeri artarak belli bil
belli bil değerden sonra sabitlendiği görürdü değerden sonra sabitlendiği görürdü ve son ve son değer notdeğer not edildi. Bulunan sıcaklık değeriedildi. Bulunan sıcaklık değeri formülde yerine koyularak maddelerin alt ısıl değeri hesaplandı.Deneyde çok hassas formülde yerine koyularak maddelerin alt ısıl değeri hesaplandı.Deneyde çok hassas davranıldı. Hataların önüne geçirilerek dikkatlice tartımlar yapıldı ve değerler iyi okunuldu. davranıldı. Hataların önüne geçirilerek dikkatlice tartımlar yapıldı ve değerler iyi okunuldu. Sonuç olarak dinamik ve manuel yöntemle de tam yanma iĢlemi gerçekleĢti. Böylece Sonuç olarak dinamik ve manuel yöntemle de tam yanma iĢlemi gerçekleĢti. Böylece deneyimiz baĢarırı bir Ģekilde sonuçlanmıĢ oldu.
6. KAYNAKLAR 6. KAYNAKLAR [1]
[1] Polik, W. (1997). Bomb Calorimetery. RetrievedPolik, W. (1997). Bomb Calorimetery. Retrieved from
from http://www.chem.hope.edu/~polik/Chem345-2000/bombcalorimetry.htmhttp://www.chem.hope.edu/~polik/Chem345-2000/bombcalorimetry.htm18.10.201618.10.2016 [2]
[2] Bozzelli, J. (2010). Bozzelli, J. (2010). Heat of Combustion Heat of Combustion via Calorimetry: Detailed Procedures. via Calorimetry: Detailed Procedures. ChemChem 339-Physical Chemistry Lab for Chemical Engineers
339-Physical Chemistry Lab for Chemical Engineers – – Lab Manual. 18.10.2016Lab Manual. 18.10.2016 [3] https://en.wikipedia.org/wiki/Calorimeter 18.10.2016
[3] https://en.wikipedia.org/wiki/Calorimeter 18.10.2016 [4] https://tr.wikipedia.org/wiki/Kalorimetre 18.10.2016 [4] https://tr.wikipedia.org/wiki/Kalorimetre 18.10.2016
7.EKLER 7.EKLER
7.1 Tablolar 7.1 Tablolar
Benzoik asit için alt ve üst ısıl değer tablosu Benzoik asit için alt ve üst ısıl değer tablosu
Zaman (dk)
Zaman (dk) ∆T (K)∆T (K) Hg Hg (J/g) (J/g) Hg Hg (cal/g) (cal/g) Ha Ha (cal/g)(cal/g) 1 1 0,1643 0,1643 3204,402 3204,402 765,3582 765,3582 336,4482336,4482 2 2 0,3738 0,3738 7417,866 7417,866 1771,727 1771,727 1342,8171342,817 3 3 1,0118 1,0118 20249,32 20249,32 4836,467 4836,467 4407,5574407,557 4 4 1,167 1,167 23370,7 23370,7 5581,997 5581,997 5153,0875153,087 5 5 1,2165 1,2165 24366,25 24366,25 5819,778 5819,778 5390,8685390,868 6 6 1,2347 1,2347 24732,29 24732,29 5907,205 5907,205 5478,2955478,295 7 7 1,2407 1,2407 24852,96 24852,96 5936,027 5936,027 5507,1175507,117 8 8 1,2416 1,2416 24871,06 24871,06 5940,35 5940,35 5515511,441,44 9 9 1,2422 1,2422 24883,13 24883,13 5943,233 5943,233 5514,3235514,323
ġeker için alt ve üst ısıl değer tablosu ġeker için alt ve üst ısıl değer tablosu
Zaman (dk)
Zaman (dk) ∆T (K)∆T (K) Hg Hg (J/g) (J/g) Hg Hg (cal/g) (cal/g) Ha Ha (cal/g)(cal/g) 1 1 0,0172 0,0172 245,9264 245,9264 58,73851 58,73851 -370,171-370,171 2 2 0,7694 0,7694 15374,17 15374,17 3672,058 3672,058 3243,1483243,148 3 3 3,6588 3,6588 73485,79 73485,79 17551,78 17551,78 17122,8717122,87 4 4 4,3353 4,3353 87091,55 87091,55 20801,46 20801,46 20372,5520372,55 5 5 4,4926 4,4926 90255,17 90255,17 21557,08 21557,08 21128,1721128,17 6 6 4,5403 4,5403 91214,51 91214,51 21786,21 21786,21 21357,321357,3 7 7 4,5455 4,5455 91319,1 91319,1 21811,19 21811,19 21382,2821382,28 8 8 4,5502 4,5502 91413,62 91413,62 21833,77 21833,77 21404,8621404,86 9 9 1,2422 1,2422 24883,13 24883,13 5943,233 5943,233 5514,3235514,323
7.2 Grafikler 7.2 Grafikler
Benzoik asitin yanması sonucu zamana karĢılık sıcaklık farkının grafik üzerinde gösterimi Benzoik asitin yanması sonucu zamana karĢılık sıcaklık farkının grafik üzerinde gösterimi
ġekerin yanması sonucu zamana karĢılık sıcaklık farkının grafik üzerinde gösterimi ġekerin yanması sonucu zamana karĢılık sıcaklık farkının grafik üzerinde gösterimi
y = 0,144x + 0,240 y = 0,144x + 0,240 R² = 0,753 R² = 0,753 0 0 0,2 0,2 0,4 0,4 0,6 0,6 0,8 0,8 1 1 1,2 1,2 1,4 1,4 1,6 1,6 1,8 1,8 0 0 22 44 66 88 1100 s s ı ı c c a a k k l l ı ı k k f f a a r r k k ı ı zaman zaman y = 0,572x + 0,572 y = 0,572x + 0,572 R² = 0,736 R² = 0,736 -1 -1 0 0 1 1 2 2 3 3 4 4 5 5 6 6 7 7 0 0 22 44 66 88 1100 s s ı ı c c a a k k l l ı ı k k f f a a r r k k ı ı zaman zaman