PANDUAN
PRAKTIKUM
KIMIA DASAR
Mahasiswa yang diperkenankan melakukan praktikum adalah mereka yang terdaftar secara akademik, yang selanjutnya disebut sebagai Praktikan. Tata tertib Praktikum Kimia Dasar adalah sebagai berikut:
1. Praktikan wajib hadir 15 menit sebelum praktikum dimulai, keterlambatan lebih dari 10 menit sejak praktikum dimulai, praktikan dianggap tidak hadir; 2. Praktikan wajib mempelajari panduan praktikum dan buku-buku lain yang
relevan dengan praktikum yang akan dilakukan serta mengikuti pre-test sebelum melaksanakan praktikum
3. Jika berhalangan hadir, praktikan harus dapat memberikan keterangan tertulis dan resmi terkait dengan alasan ketidakhadirannya;
4. Praktikan seperti no.2 di atas, jika akan mengganti praktikum pada hari lain, wajib meminta rekomendasi tertulis terlebih dahulu dari koordinator masker dan perlengkapan lain sesuai acara praktikum;
7. Praktikan wajib mengisi daftar absensi;
8. Praktikan tidak diperbolehkan makan, minum, dan atau merokok di dalam laboratorium selama praktikum berlangsung;
9. Praktikan tidak diperkenankan bersenda gurau yang mengakibatkan terganggunya kelancaran praktikum;
10.Praktikan bertanggung jawab atas peralatan yang dipinjamnya, kebersihan meja masing-masing, serta lantai disekitarnya
11.Setelah menggunakan bahan kimia/reagen, praktikan wajib meletakkan kembali pada tempatnya semula
12.Praktikan dilarang menggunakan bahan kimia/reagen praktikum di luar kepentingan praktikum dan di larang membuang sisa praktikum tanpa konfirmasi pada asisten praktikum;
13.Jika akan meninggalkan ruang laboratorium, praktikan wajib meminta ijin kepada dosen atau asisten jaga;
14.Praktikan melakukan analisis sesuai bagiannya masing-masing, mencatat hasilnya pada lembar kerja praktikum, serta memintakan ”ACC” pada dosen atau asisten jaga di akhir pelaksanaan praktikum dengan menyerahkan laporan hasil pengamatan;
ACARA I
PENGENALAN ALAT
Tujuan Percobaan : Mahasiswa dapat memahami jenis dan cara penggunaan alat-alat laboratorium.
Alat-alat yang digunakan : Berbagai alat laboratorium
Penjelasan Umum:
1. Gelas piala (Beaker glass)
Gelas piala (beaker digunakan untuk mengukur volume atau mencampur larutan. Pengukuran volume larutan dengan geasl piala memiliki tingkat
6 7
5 8
4
2 3
akurasi yang rendah (sekitar 10%). Gelas piala pada umumnya terbuat dari dengan pipet ini dilakukan melui penyedotan (dengan mulut atau pompa karet) hingga melebihi batas tera pada bagian atas pipet kemudian larutan dikeluarkan sedikit demi sedikit hingga batas tera tercapai.
3. Pipet ukur
Pipet ukur memiliki skala yang terbagi atas unit pengukuran 1 hingga 1/10 mililiter. Karena memiliki bagian leher yang lebar, pipet ukur memiliki ketelitian yang lebih rendah dibandingkan dengan pipet volumetrik. Pipet ini digunakan pada saat pemindahan larutan tidak memerlukan ketelitian yang sangat tinggi. Cara penggunaan pipet ukur sama dengan pipet volumetrik.
4. Pipet tetes (Pasteur pipet)
Pipet tetes atau dropper adalah jenis pipet yang merupakan tabung kaca kecil dengan bola karet pada bagian atasnya untuk menyedot dan mengeluarkan larutan dengan teknik tetesan.
5. Tabung reaksi
Tabung Erlenmeyer adalah wadah kaca yang memiliki bagian mulut yang sempit dan silindris dengan bentuk tabung yang kerucut. Tabung ini dinamakan sesuai dengan nama penemunya yang merupakan seorang peneliti kimia Jerman, Richard Erlenmeyer (1825-1909). Tabung Erlenmeyer umumnya digunakan pada titrasi untuk menampung larutan yang dititrasi.
7. Gelas ukur
Gelas ukur atau graduated cylinder digunakan untuk mengukur volume dari sampel cair yang tersedia dengan beberapa ukuran. Akurasi pengukuran dengan menggunakan gelas ukur masih berada di bawah akurasi pengukuran dengan menggunakan labu ukur, pipet volumetrik dan buret.
Labu ukur atau volumetric flask adalah jenis labu yang digunakan untuk penyiapan larutan untuk kimia analitik dengan volume yang telah diketahui. Umumnya labu ukur terbuat dari gelas atau plastik dengan bagian bawah berbentuk labu dengan bagian leher yang panjang dan umumnya dilengkapi dengan stopper pada bagian atas.
Prosedur :
1. Pindahkah larutan n-heksana sebanyak 50 ml dengan menggunakan gelas beaker, gelas ukur dan pipet ukur. Bandingkan ketelitian penggunaan ketiga alat tersebut dan uji akurasi pengukuran tersebut dengan pipet volumetrik;
LEMBAR KERJA
Nama Mahasiswa : Asisten pendamping :
NIM : Paraf :
Judul Praktikum : Pengenalan Alat Laboratorium Tanggal Praktikum :
ACARA II
SIFAT ASAM DAN BASA SENYAWA ORGANIK
Tujuan Percobaan : Mengenal dan memahami sifat-sifat asam dan basa senyawa organik
Alat dan bahan yang digunakan: a. Pipet tetes b. PH paper universal c. Lakmus merah dan biru d. Asam Asetat
e. NaOH
f. Asam Benzoat
Penjelasan Umum:
Sifat-sifat asam dan basa menurut Svante Arrhenius (1884) yaitu :
Asam : rasanya asam, dapat bereaksi dengan kebanyakan logam membentuk gas, merubah lakmus dari biru ke merah, menghantarkan arus listrik, menghasilkan CO2 apabila direaksikan dengan carbonat dan
bereaksi dengan basa menghasilkan garam dan air.
Basa : rasanya alkalis, licin, mengubah lakmus dari merah menjadi biru, menghantarkan arus listrik, bereaksi dengan logam aktif, menghasilkan gas hidrogen dan bereaksi dengan asam menghasilkan garam dan air. Kekuatan asam dan basa bisa diukur dengan kertas pH paper universal atau pH meter.
Prosedur Kerja
1. Ambil sejumlah pH paper universal dan lakmus sesuai dengan jumlah bahan yang diperlukan
2. Tetesi masing-masing dengan bahan 3. Periksa dan catatlah hasilnya
LEMBAR KERJA
Nama Mahasiswa : Pembimbing : NIM : Paraf :
Judul Praktikum : Sifat asam dan basa senyawa organik Tanggal Praktikum :
ACARA III
KURVA TITRASI
Pendahuluan
Konsentrasi ion H+ dan konsentrasi ion H- dalam air, larutan asam,
atau larutan basa merupakan bilangan yang sangat kecil. Oleh sebab itu, seorang ahli kimia yang bernama Serensen mengemukakan suatu konsep yang disebut konsep (“pH” berarti potensial dan “H” adalah symbol unsure hydrogen). pH didefinisikan secara matematika sebagai berikut:
pH = - log ( H+ (aq))
untuk air murni yang tidak asam dan tidak basa (yaitu netral) : (H+
(aq)) = 10 -7, maka:
pH = - log ( 10-7) = 7
kalau larutan bersifat asam, maka harga pH lebih kecil dari pada 7. Kalau larutan itu mengandung zat yang bersifat basa misalnya NaOH, maka harga pH lebih besar dari pada 7. Untuk mudahnya perlu diingat:
lingkungan asam pH < 7 lingkungan netral pH = 7 lingkungan basa pH > 7
konsentrasi ion H+ dapat diukur secara elektrik. Elektroda yang paling
banyak digunakan untuk menentukan pH larutan dengan pelarut air adalah “elektroda gelas”. Teori mengenai elektroda gelas cukup sulit dimengerti, tetapi elektroda ini dapat dikalibrasi dengan suatu larutan yang pH nya sudah diketahui. Suatu alat yang didasarkan pada kondisi tersebut “pH meter” yang ditunjukan pada gambar dibawah ini :
1. Melatih menggunakan pH meter.
2. Mencoba membuat kurva dari berbagai macam larutan.
Pereaksi dan Alat- alat:
pH meter dengan
HCL 0,1 M
H3PO4 0,03 M
NaOH 0,1 M
Pengaduk plastic
Gelas piala Pipet 25 ml
Buret
Standar besi
Prosedur percobaan :
1. Celupkan elektroda- elektroda (yang telah dicuci dalam air suling) kedalam 25 ml 0,1 M HCl. Ukuran pH larutan itu.
2. Tambahkan 5 ml NaOH dengan memakai buret dan ukurlah pH pada setiap penambahan 5 ml sampai 20 ml. bila dekat titik akhir, dengan sedikit penambahan NaOH, pH akan berubah secara cepat, jadi sesudah penambahan 20 ml setiap penambahan dilakukan dengan 0,5 ml lagi sampai 40 ml. jangan lupa mengaduk sesudah setiap kali penambahan. Hati- hati dinding elektroda gelas itu sangat tipis dan mudah pecah.
3. Ulangi percobaan dengan 25 ml H3 PO4 tetapi setiap penambahan 2
ml sampai 30 ml.
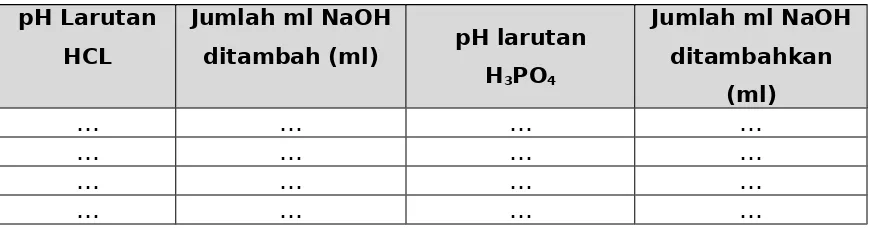
Hasil percobaan
pH Larutan HCL
Jumlah ml NaOH
ditambah (ml) pH larutan H3PO4
Jumlah ml NaOH ditambahkan
(ml)
… … … …
… … … …
… … … …
… … … …
Perhitungan :
1. Buat kurva-kurva berikut:
a) pH sebagai fungsi dari volume NaOH ditambahkan (v ml) untuk larutan HCL.
b) ∆pH /∆v sebagai fungsi dari volume NaOH ditambah (v ml) untuk larutan HCL.
c) pH sebagai fungsi dari volume NaOH ditambahkan untuk larutan H3PO4.
2. Dari kurva (b) berapakah titik ekuivalen ? Berapakah konsentrasi larutan NaOH ?
Table kisaran pH dari beberapa indicator
LEMBAR KERJA
Nama Mahasiswa : Pembimbing : NIM : Paraf :
Judul Praktikum : Kurva Titrasi Tanggal Praktikum :
Hasil Pengamatan :
ACARA IV
PENGARUH KONSENTRASI DAN SUHU PADA LAJU REAKSI
Pendahuluan
laju reaksi. Reaksi yang akan diamati adalah reaksi pengendapan koloid belerang yang terbentuk apabila tiosulfat direaksikan dengan asam. Reaksi ini dikatakan semi kuantitatif, karena disini tidak dilakukan pengukuran konsentrasi seperti yang dilakukan pada percobaan VIII. Yang diukur dalam percobaan ini adalah waktu yang diperlukan agar koloid berlerang mencapai suatu intensitas tertentu. Reaksi pengendapan belerang dapat ditulis sebagai berikut :
S2O32- (aq) + 2 H+ (aq) → H2O (1) + SO2 (g) + S(s)
Tujuan :
1) Mempelajari pengaruh perubahan konsentrasi pada laju reaksi. 2) Mempelajari pengaruh suhu pada laju reaksi.
Pereaksi dan alat-alat :
Gelas ukur 50 ml
Stopwatch
Gelas piala 600 ml
Na2S2O3 0,25
HCL 1 M
Thermometer 0 – 100oC
Pembakar gas/ lampu spritus Pipet Mohr
Prosedur percobaan : Bagian A :
1) Tempatkan 50 ml Na2S2O3 0,25 dalam gelas ukur yang mempunyai
alas rata seperti terlihat pada gambar dibawah ini:
3) Tambahkan 2 ml HCL 1 M dan tepat ketika penambahan dilakukan, hidupkan stopwatch. Larutan diaduk agar pencampuran menjadi merata, sementara pengamatan dari atas tetap dilakukan.
4) Cacat waktu yang di perlukan campai tanda silang hilang tidak dapat lagi diamati dari atas.
5) Suhu larutan di ukur dan di catat.
6) Ulangi langkah - langkah di atas dengan komposisi larytan seperti pada table di bawah ini (mulai dari system 2 sampai system 6 )
System Volume S2O32- Volume H2O Volume HCL
1
(1)Lengkapi tabel di atas
(2)Dalam precubaan ini 1/waktu digunakan untuk mengukur laju reaksi. Buatlah kurva laju reasi sebagai fungsi konsentrasi tiosulfat.
(3)Hitung ordo reaksi terhadap tiosulfat. Bagan B :
(1)Masukkan 10 ml larutan Na-tionsulfat 0.25 ke dalam gelas ukur, lalu encerkan hingga volumenya mencapai 50 ml.
(2)Ukur 2 ml HCL 1 M, lalu masukkan ke dalam tabung reaksi. Tempatkan gelas ukur dan tabung reaksi tersebut kedalam pemanas air yang bersuhu kurang lebih 35 oc. biarkan kedua
larutan tersebut beberapa lama, sampai mencapai suhu keseimbangan. Ukur suhu dengan menggunakn thermometer dan catat.
(3)Tambahkan asam kedalam larutan tiosulfat, dan pada saat bersamaan hidupkan stopwatch. Larutan diaduk, lalu tempatkan gelas ukur di atas tanda silang hitam. Catat waktu yang dibutuhkan sampai tanda silang tidak terlihat lagi bila dilihat dari atas.
(4)Ulangi langkah di atas untuk berbagai suhu sampai 60oc
(lakukan lagi untuk empat suhu yang berbeda).
Suhu
(1)Lengkapilah tabel di atas.
(2)Laju reaksi dinyatakan sebagai 1/waktu. Buat kurva laju reaksi sebagai fungsi suhu (oc) buat kurva log laju reasi sebagai
fungsi 1/suhu (k-)
LEMBAR KERJA
Nama Mahasiswa : Pembimbing : NIM : Paraf :
Judul Praktikum : Pengaruh Konsentrasi dan Suhu Pada Laju Reaksi Tanggal Praktikum :