LAPORAN PRAKTIKUM
KIMIA DASAR
Acara : ……
……….. ………..
Disusun oleh :
Nama : ……….
No. Mhs : ……….
Hari/Tanggal : ……….
Asisten : ………...……….
LABORATORIUM TEKNOBIO PANGAN
FAKULTAS TEKNOBIOLOGI
PENGESAHAN
Acara : ……
……….. ……….. ………..
Disusun oleh :
Nama
: ………...
No. Mhs
: ………...
Hari/Tanggal
: ………...
Asisten
: …………...
Pada tanggal ...
Disahkan oleh :
Asisten praktikum
KREDIT NILAI LAPORAN
PRAKTIKUM KIMIA DASAR
Judul Acara : ……….
NO KRITERIA NILAI
STANDART
NILAI REVISI I
NILAI
ACC
I PENDAHULUAN
JUDUL PERCOBAAN 1
TUJUAN PRAKTIKUM 4
II METODE
ALAT DAN BAHAN 5
CARA KERJA 5
III HASIL DAN PEMBAHASAN 50
IV KESIMPULAN 10
V DAFTAR PUSTAKA 5
JUMLAH 80
Nama Mahasiswa :………..…....
No Mhs :.…………..…………
Mengetahui, Asisten
I. PENDAHULUAN
A. Judul
Penentuan Kadar Karbonat dan Bikarbonat dalam Larutan
B. Tujuan
1. Dapat menyelidiki ada tidaknya ion karbonat, ion bikarbonat, dan ion hidroksida dalam larutan.
II. METODE
4. Pipet tetes 4. Indikator Phenolphthalein (PP) 5. Corong 5. Indikator Methyl Orange (MO)
(NaHCO3), dan C (air kran) diambil dengan menggunakan pipet ukur lalu
diletakkan di dalam erlenmeyer.Sebanyak 3 tetes indikator phenolphthalein ditambahkan di setiap cuplikan dan diamati perubahan warnanya.Larutan yang setelah ditambah indikator phenolphthalein warnanya berubah maka larutan cuplikan dititrasi dengan HCl 0,1N hingga warna merah mudanya hilang (volume dicatat sebagai V1).Larutan yang
setelah ditetesi phenolphthalein warnanya tidak berubah, maka larutan cuplikan ditambah indikator methyl orange dan dititrasi dengan HCl 0,1N hingga warna berubah dari kuning menjadi orange (volume dicatat sebagai V2).Percobaan diulangi sebanyak satu kali.
Setelah itu, dapat dilihat pada data hasil percobaan: jika V1=V2,
maka cuplikan hanya mengandung ion karbonat saja, jika V1<V2, maka
cuplikan mengandung ion karbonat dan bikarbonat, dan jika V1>V2, maka
Kadar Karbonat = V1 x N HCl x 6,00(g/100 ml)
V cuplikan
Untuk rumus perhitungan kadar bikarbonat, dapat menggunakan rumus:
Kadar Bikarbonat = (V2-V1) x N HCl x 6,10(g/100 ml)
V cuplikan
Untuk rumus perhitungan kadar hidroksida, dapat menggunakan rumus:
Kadar Hidroksida = (V1-V2) x N HCl x 1,7(g/100 ml)
III. HASIL DAN PEMBAHASAN
A. Hasil
Berdasarkan percobaan yang telah dilakukan, berikut disajikan tabel hasil analisa kadar dalam cuplikan 1 pada tabel 1, hasil analisa kadar dalam cuplikan 2 pada tabel 2, dan hasil analisa kadar dalam cuplikan 3 pada tabel 3:
Tabel 1. Hasil Analisa Kadar dalam Cuplikan 1 (Na2CO3)
Ulangan V1(ml) V2(ml) Karbonat Bikarbonat Hidroksida
1 2,8ml 2,6ml 0,0672(g/100ml) - 0,00136(g/100ml)
2 2,7ml 2,4ml 0,0648(g/100ml) - 0,00204(g/100ml) x
2,75ml 2,5ml 0,066(g/100ml) - 0,0034(g/100ml)
Tabel 2. Hasil Analisa Kadar dalam Cuplikan 2 (NaHCO3)
Ulangan V1(ml) V2(ml) Karbonat Bikarbonat Hidroksida
1 0,5ml 4,8ml 0,012(g/100ml) 0,10492(g/100ml)
-2 0,3ml 4,9ml 0,0072(g/100ml) 0,11224(g/100ml) -x
0,4ml 4,7ml 0,10858(g/100ml) 0,0096(g/100ml)
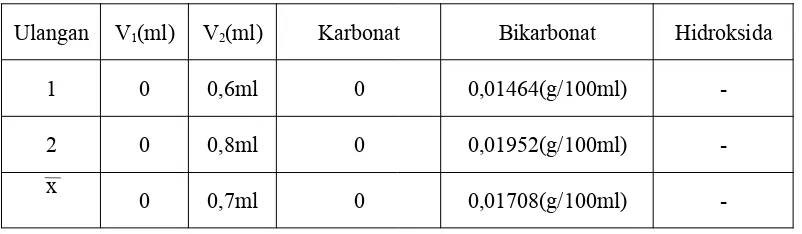
-Tabel 3. Hasil Analisa Kadar dalam Cuplikan 3 (Air Kran)
Ulangan V1(ml) V2(ml) Karbonat Bikarbonat Hidroksida
1 0 0,6ml 0 0,01464(g/100ml)
-2 0 0,8ml 0 0,01952(g/100ml)
-x
0 0,7ml 0 0,01708(g/100ml)
Menurut Bassett dkk. (1994), reaksi yang digunakan dalam analisis titrimetri dibagi dalam dua golongan utama:
a. Reaksi dalam mana tak terjadi perubahan keadaan-oksidasi; reaksi ini bergantung pada bersenyawanya ion-ion.
b. Reaksi oksidasi-reduksi; ini melibatkan suatu perubahan keadaan-oksidasi, atau dengan kata lain, pemindahan elektron.
Namun demi kemudahan, kedua tipe reaksi ini dibagi dalam empat golongan utama: reaksi penetralan (asidimetri dan alkalimetri), reaksi pembentukan kompleks, reaksi pengendapan, dan reaksi oksidasi-reduksi. Reaksi penetralan, atau asidimetri dan alkalimetri melibatkan titrasi basa bebas, atau basa yang terbentuk karena hidrolisis garam yang berasal dari asam lemah, dengan suatu asam standar (asidimetri), dan titrasi asam bebas, atau asam yang terbentuk dari hidrolisis garam yang berasal dari basa lemah, dengan suatu basa standar (alkalimetri). Reaksi-reaksi ini melibatkan bersenyawanya ion hidrogen dan ion hidroksida untuk membentuk air.
Ion karbonat dan bikarbonat dapat terbentuk menjadi asam karbonat.Asam karbonat merupakan asam poliprotik, yaitu asam yang satu molekulnya memiliki lebih dari satu atom hidrogen yang dapat terionisasi.Ionisasi dari asam tersebut menjadi bikarbonat dan karbonat (dengan reaksi kebalikan dari reaksi pada percobaan ini).Asam karbonat pun bersifat tidak stabil karena dapat terurai menjadi air (H2O) dan karbondioksida (CO2) (Petrucci, 1987).
Pembentuk alkalinitas yang utama adalah bikarbonat, karbonat, dan hidroksida.Di antara ketiga ion tersebut, bikarbonat paling banyak terdapat pada perairan alami (Effendi, 2003).Natrium bikarbonat adalah alkali lemah yang mengandung ion bikarbonat, suatu basa lemah (Tambayong, 2000).Asam karbonat ini akan berdisosiasi sebagian menghasilkan ion hidrogen dan ion bikarbonat. Ion bikarbonat akan berperan sebagai akseptor ion hidrogen (James dkk., 2008).
Ion karbonat adalah basa, tetapi ion ini bergabung dengan ion hidrogen dalam dua tahap:
HCO3- + H3O+H2CO3 + H2O (2)
Jika fenolftalein digunakan sebagai indikator, perubahan warna terjadi bila reaksi (1) sempurna; yakni, ion karbonat telah bereaksi hanya dengan satu ion H3O+.Ini
mengakibatkan galat, karena dua ion OH- digunakan dalam pembentukan satu
CO32-.Jika metil oranye digunakan sebagai indikator, perubahan warna terjadi bila
reaksi (2) sempurna dan tidak terjadi galat, karena tiap ion CO32- bergabung
dengan dua ion H3O+.Namun demikian, dalam titrasi asam lemah, fenolftalein
adalah indikator yang tepat digunakan (Day dan Underwood, 2002).
Karbonat dan bikarbonat dapat dimanfaatkan dalam kehidupan sehari-hari, contohnya pada minuman effervescent.Dasar formula minuman effervescent
adalah terjadinya reaksi antara senyawa asam (asidulan) dengan karbonat atau bikarbonat sehingga menghasilkan karbondioksida.Natrium bikarbonatmerupakan hablur yang tidak berwarna dan mudah larut dalam air.Pada minuman effervescent
natrium bikarbonat berfungsi sebagai penghasil gas dalam larutannya.Berdasarkan penjelasan di atas diketahui bahwa konsentrasi asam dan natrium bikarbonat dapat mempengaruhi efek menyegarkan dan pembentukan gas karbondioksida (efek
effervescing) (Sandrasari dan Abidin, 2011).
Larutan cuplikan yang ditetesi oleh indikator PP akan berubah warna menjadi merah muda jika larutan tersebut bersifat basa, namun jika larutan tersebut tidak bersifat basa maka larutan tidak akan berubah warna..Larutan cuplikan A yang digunakan adalah larutan Na2CO3 + 2 H2O yang akan
menghasilkan reaksi H2CO3 + 2 NaOH dan mengakibatkan larutan menjadi basa.
Larutan cuplikan B adalah larutan NaHCO3 + H2O akan menghasilkan reaksi
NaHCO3 + H2OCO2 + NaOH + H2O yang membuat larutan cuplikan tersebut
menjadi basa.Larutan cuplikan C yang berupa air kran dan tidak menunjukkan adanya perubahan warna karena tidak bersifat basa.
perubahan warna di sekitar titik ekivalen dari titrasi untuk asam lemah, pada titik ekivalen di atas 7. Untuk basa lemah, pada titik ekivalen di bawah 7, indikator yang sering digunakan adalah metil orange.
Ketika larutan sampel yang berwarna putih ditetesi fenolftalein akan berubah warna menjadi merah muda. Setelah itu, larutan tersebut dititrasi dengan larutan HCl 0,1N sampai warna merah mudanya hilang. Pada tahap ini, semua ion hidroksida akan bereaksi menghasilkan air , sedangkan ion karbonat akan bereaksi dengan asam , menghasilkan ion bikarbonat. Berikut adalah reaksi kimianya:
OH- + H+H 2O
CO32- + H+HCO3
-Larutan tersebut kemudian ditetesi dengan indikator metil orange, dan berubah warna menjadi kuning. Lalu dititrasi menggunakan larutan HCl 0,1 N, hingga berubah menjadi warna orange.Penambahan HCl tersebut akan menyebabkan ion bikarbonat hasil reaksi tahap 1 berubah menjadi asam bikarbonat.
HCO3- + H3O+ H2CO3 +H2O
Dari percobaan yang dilakukan didapatkan hasil bahwa larutan cuplikan A (Na2CO3) mengandung ion karbonat dan hidroksida, karena warna larutan
cuplikan A berubah pada saat ditetesi indikator PP. Karena V1>V2, maka larutan
cuplikan hanya mengandung karbonat dan hidroksida. Volume HCl rata-rata yang diperlukan untuk menitrasi setelah diberi PP adalah 2,75ml, sedangkan setelah diberi MO volumenya sebesar 2,5ml. Rata-rata kadar karbonat yang terdapat dalam Na2CO3 adalah 0,066 gr/100ml, sedangkan kadar hidroksidanya sebesar
0,0034 gr/100ml.
Dari percobaan yang dilakukan didapatkan hasil bahwa larutan cuplikan B (NaHCO3) mengandung ion karbonat dan bikarbonat, karena warna larutan
cuplikan B berubah pada saat ditetesi indikator PP.Karena V1<V2, maka larutan
dalam NaHCO3 adalah 0,10858 gr/100ml, sedangkan kadar bikarbonatnya sebesar
0,0096 gr/100ml.
Dari percobaan yang dilakukan didapatkan hasil bahwa larutan cuplikan C (air kran) mengandung ion bikarbonat. Warna larutan cuplikan C berubah pada saat ditetesi indikator PP.Karena V1<V2, maka larutan cuplikan hanya
mengandung karbonat dan bikarbonat, namun karena tidak berubah warna maka volume HCl awal adalah 0, sehingga kadar karbonatnya juga menjadi 0. Volume HCl rata-rata yang diperlukan untuk menitrasi setelah diberi PP adalah 0ml, sedangkan setelah diberi MO volumenya sebesar 0,7ml. Rata-rata kadar karbonat yang terdapat dalam NaHCO3 adalah 0 gr/100ml, sedangkan kadar bikarbonatnya
sebesar 0,01708 gr/100ml.
Hasil yang didapat tidak sesuai dengan teori, karena seharusnya jika ditinjau dari reaksinya larutan cuplikan C mengandung ion hidroksida menurut persamaan reaksi:
OH- + H+H 2O
Hasil percobaan larutan cuplikan A juga tidak sesuai dengan teori karena harusnya pada larutan cuplikan A: V1=V2, dan hanya mengandung ion karbonat saja. Hal ini
dapat disebabkan ketika menitrasi larutan cuplikan dengan indikator methyl orange (MO), perubahan dari warna kuning ke orange bersifat subjektif sehingga hasil pengamatan perubahan warna bisa berbeda-beda dari tiap
IV. KESIMPULAN
Berdasarkan percobaan yang telah dilakukan maka dapat ditarik kesimpulan sebagai berikut:
1. Pada larutan cuplikan A mengandung ion karbonat dan hidroksida, larutan cuplikan B mengandung ion karbonat dan bikarbonat, larutan cuplikan C mengandung ion bikarbonat.
DAFTAR PUSTAKA
Bassett, J., Denney, R.C., Jeffery, G.H., dan Mendham, J. 1994. Buku Ajar Vogel: Kimia Analisis Kuantitatif Anorganik. EGC, Jakarta.
Day, R.A. dan Underwood, A.L. 2002.Analisis Kimia Kuantitatif. Erlangga, Jakarta.
Effendi, H. 2003.Telaah Kualitas Air: Bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Kanisius, Yogyakarta.
James, J., Baker, C., dan Swain, H. 2008.Prinsip-prinsip Sains untuk Keperawatan. Erlangga, Jakarta.
Petrucci, R.H. 1987. Kimia Dasar Prinsip dan Terapan Modern. Erlangga, Jakarta.
25ml = 0 g/100ml
Kadar Bikarbonat = (V2-V1) x N HCl x 6,10(g/100 ml)
V cuplikan
= (0,6ml-0ml) x 0,1N x 6,10 25ml
= 0,01464 g/100ml
2. Kadar Karbonat = V1 x N HCl x 6,00 (g/100 ml)
V cuplikan = 0ml x 0,1N x 6,00
25ml = 0 g/100ml
Kadar Bikarbonat = (V2-V1) x N HCl x 6,10(g/100 ml)
V cuplikan
= (0,8ml-0ml) x 0,1N x 6,10 25ml