Phytochemical Test, Toxicity and Antioxidant Activity Leaves Kerehau (Callicarpa
longifolia Lam.) With DPPH Method
Erwin1, Redda An Nisa, dan Daniel
Jurusan Kimia FMIPA Universitas Mulawarman Jl. Barong Tongkok No. 4 Gn. Kelua Samarinda1
Abstract. Phytochemical analysis, toxicity test by the brine shrimp lethality test (BSLT) against
Artemia salina L, and antioxidant activity evaluation of the extracts of Kerehau leaves (Callicarpa
longifolia Lam.) have been carried out. The ethanol extract obtained from Kerehau leaves was
concentrated by using a rotary vacuum evaporator. Furthermore, the crude extract was fractionated with n-hexane and ethyl acetate solvent, successively. The phytochemical analysis of crude extract constitutes alkaloids, phenolics, flavonoids and steroids. n-hexane fraction contains alkaloids, flavonoids and steroids and ethyl acetate fraction contain alkaloids, phenolics and flavonoids. n-Hexane fraction exhibited highest toxic activity with LC50 value 90.05 ppm against Artemia salina L and ethyl acetate fraction has the
highest antioxidant activity with IC50 value 38.94 ppm compared with other extracts.
Keyword: Phytochemical, toxicity, antioxidant, and Artemia salina L
Abstrak.Analisis fitokimia, uji toksisitas dengan udang Artemia salina, dan uji aktivitas antioksidan terhadap ekstrak daun Kerehau (Callicarpa longifolia Lam.) telah dilakukan. Ekstrak total yang diperoleh dari hasil maserasi daun Kerehau dengan metanol, dievaporasi dengan rotary evaporator. Ektrak kasar kemudian difraksinasi dengan n-heksana dan pelarut etil asetat, secara berturut-turut. Berdasarkan hasil uji fitokimia menunjukkan bahwa ekstrak kasarl mengandung alkaloid, fenolik, flavonoid dan steroid. fraksi n-heksana mengandung alkaloid, flavonoid dan steroid. Sedangkan fraksi etil asetat mengandung alkaloid, fenolik dan flavonoid. Hasil uji toksisitas menunjukkan bahwa frakasi n-heksandengan nilai LC5090,05 terhadap udang Artemia salina L dan fraksi etil asetat mempunyai aktivitas
antioksidan yang paling tinggi dengan nilai IC50 38,94 ppmdibandingkan dengan ekstrak yang lain.
Kata Kunci: Fitokimia, toksisitas, antioksidan, dan Artemia salina L
PENDAHULUAN
Sekitar 150 tumbuhan berupa semak dan pohon termasuk dalam genus Callicarpa
yang tersebar di America, Asia tenggara, Pulau pulau di Pasifik, dan Australia (Harden 1992) . Sekitar 11 spesies terdaftar sebagai tumbuhan endemik di Australia, beberapa diantaranya juga terdapat di Malaysia dan Indonesia (Rasikari, 2007).
Calicarpa adalah salah satu genus tumbuhan yang merupakan sumber senyawa alam dan obat-obatan tradisioanal (Harley, 2004). Ada sekita 20 jenis spesies yang telah digunakan secara etnobotani and etnomedikal. Pemanfaatan secara etnomenikal telah dilaporkan untuk mengobati hepatitis, rematik, demam, sakit kepala, pencernaan dan penyakit lainnya. Beberapa spesies Callicarpa telah dilaporkan berpotensi sebagai antikanker (Jones dan Kingnghorn, 2009).
Salah satu spesies Callicarpayang dimanfaatkan sebagai obat tradisional oleh salah satu suku asli Kalimantan yaitu suku Dayak Tunjung adalah kerehau (Callicarpa longifolia Lam.). Kerehau (Callicarpa longifolia Lam.) dimanfaatkan oleh suku Dayak Tunjung sebagai obat masuk angin dan bengkak pada bagian akar, sedangkan pada bagian daun digunakan sebagai bedak basah (Setyowati, 2010) di samping itu tanaman ini mempunyai bunga yang berwarna ungu sehingga juga biasanya ditanam sebagai tanaman hias dipekarangan rumah sekaligus sebagai tumbuhan obat (Susiarti et al, 2000). Pemanfaatan tumbuhan ini pada suku Aborigin sepertinya informasinya masih terbatas namun di north Qld (Australia), imigran Jepang mengunya
Callicarpa longifolia sebagai pengganti sirih bersama dengan kapur untuk mendapatkan efek stimulan (Rasikari, 2007). Hasil penelitian sebelumnya dilaporkan telah diisolasi steroid dari fraksi kloroform
(Novadiana et al, 2013) dan flavonoid dari fraksi etil asetat (Pasaribu, et al, 2014) daun
Kerehau, oleh sebagai penelitian lanjutan akan dilaporkan hasil penelitian lanjutan tentang aktivitas antioksidan dari ekstrak daun Kerehau.
METODOLOGI PENELITIAN
Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah seperangkat alat destilasi, neraca analitik, blender, rotary evaporator, beaker gelas, erlenmeyer, gelas ukur, tiang statif, klem, corong pisah, tabung reaksi, pipet volume, pipet tetes, mikropipet ukuran 100-1000 µL, labu ukur, batang pengaduk, bohlam lampu, hot plate dan spektrofotometer UV-Vis.
Bahan-bahan yang digunakan adalah daun tumbuhan kerehau (Callicarpa longifolia Lam.), kertas saring Whatman no. 1, aluminium foil, etanol, etil asetat, kloroform, heksana, dietil eter, H2SO4 2 M,
asam asetat glasial, Bi(NO3)3.5H2O, HgCl2,
HNO3 pekat, KI, FeCl3, HCl, serbuk Mg,
aquadest, air laut, DPPH (2,2-diphenyl-1 -picrylhidrazyl) dan Vitamin C.
PROSEDUR PENELITIAN
Ekstraksi dan Fraksinasi
Sampel daun kerehau (Callicarpa longifolia Lam.) yang telah dihaluskan ditimbang kemudian diekstraksi dengan caramaserasi yaitu merendam sampel dengan pelarut etanol pada suhu ruang. Filtrat yang diperoleh disaring dengan kertas saring whatman dan corong kaca. Kemudian pelarut diuapkan dengan rotary
evaporator sehingga diperoleh ekstrak
kasar.
Selanjutnya ekstrak kasar difraksinasi dengan n-heksan kemudian dilanjutkan fraksinasi dengan etil asetat. Ektrak kasar,
fraksi n-heksana dan fraksi etil asetat yang diperoleh diuji fitokimia, toksisitas dengan menggunakan larva udang Artemia salinaL(Brine Shrimp Lethality Test) dan aktivitas antioksidan dengan menggunakan metode peredaman radikal bebas
2,2-diphenyl-1-picrylhidrazyl (DPPH) dengan menggunakan spektrofotometer.
Uji Fitokimia
Sampel masing-masing ekstrak ditimbang 10 mg dilarutkan dengan 20 mL etanol, kemudian dibagi dalam 6 tabung reaksi. Uji alkaloid dilakukan dengan pereaksi Dragendroff, uji steroid/triterpenoid dengan pereaksi
Lieberman-Burchard, uji flavonoid dengan pita Mg dan HCl pekat, uji fenolik dengan penambahan larutan FeCl3 dan uji saponin
dengan cara penambahan air panas kemudian dikocok kuat.
Uji Toksisitas (Brine Shrimp Lethality
Test)
Sampel masing-masing ekstrak ditimbang 1 mg, dilarutkan dalam 100 µL DMSO sambil diaduk, kemudian diencerkan dengan 150 µL air laut sehingga volume
Larutan kontrol dibuat sama dengan prosedur di atas tanpa menggunakan sampel. Bibit udang (±1000 bibit) dimasukkan ke dalam 100 mL air laut yang sudah disaring dengan menggunakan aquarium kecil selama 48 jam diberi pencahayaan. masing tiga kolom, sampel dimasukkan 100 µL pada plat uji dan 100 µL larutan kontrol pada plat kontrol.Pada larutan baris II diencerkan dengan 100 µL air laut kemudian diaduk, kemudian dipipet kembali 100 µL dimasukkan ke dalam baris III, larutan baris III diencerkan kembali dengan 100 µL air laut sambil diaduk dan dimasukkan ke dalam baris dan dilakukan dengan cara yang sama sampai baris terakhir. Sehingga konsentrasi larutan untuk masing-masing baris sebagai berikut, baris I = 1000 ppm, baris II = 500 ppm, baris III = 250 ppm, baris IV = 125 ppm, baris V = 62,5 ppm, baris VI = 31,25 ppm, baris VII = 15,625 ppm, dan baris VIII = 7,8 ppm.
Selanjutnya ke dalam larutan sampel pada plat uji dan larutan kontrol pada plat kontrol ditambahkan 100 µL air laut yang mengandung 8-15 larva udang, kemudian dibiarkan selama 24 jam. Setelah itu dihitung jumlah rata-rata larva udang yang mati dan yang hidup untuk setiap baris pada plat uji. Nilai LC50lalu ditentukan dengan uji
probit menggunakan SAS (Statistical Analysis System).
Uji Aktivitas Antioksidan
Pengujian aktivitas antioksidan dilakukan dengan menggunakan spektrofotometer pada suhu kamar (25oC) dengan panjang gelombang antara 512-517 nm namun dicari gelombang optimumnya terlebih dahulu menggunakan larutan blanko dan larutan DPPH (2,2-diphenyl
-1-picrylhidrazyl) digunakan sebagai radikal bebas untuk pengujian.Larutan DPPH dibuat dengan cara menimbang DPPH dan dilarutkan dalam etanol tepat pada konsentrasi 0,024 mg/mL. Ekstrak sampel sebanyak 3 mg dilarutkan dalam DMSO sehingga didapat konsentrasi 100 ppm.
Dengan demikian konsentrasi larutan ekstrak sampel (ekstrak kasar etanol dan masing-masing fraksi) adalah 500 ppm. Ekstrak kasar dan fraksi n-heksana dengan konsentrasi 500 ppm diencerkan untuk mendapatkan konsentrasi 12,5; 25; 50; 75 dan 100 ppm dengan menggunakan mikro pipet dan masing-masing konsentrasi dibuat 3 kali pengulangan. Sedangkan pada fraksi etil asetat dibuat seri konsentrasi dalam 3; 5; 12,5; 25; 50; 75 dan 100 ppm.
Untuk pembanding (vitamin C baku) ditimbang sebanyak 1 mg dan dilarutkan dengan etanol sampai volumenya 1000 mL menggunakan labu ukur coklat, sehingga didapat larutan induk vitamin C dengan konsentrasi 1000ppm, kemudian diambil 1 mL larutan induk vitamin C dan dilarutkan dengan etanol sampai volumenya 10 mL menggunakan labu ukur coklat, sehingga didapat konsentrasi vitamin C 100 ppm. Setelah itu, dari konsentrasi vitamin C 100 ppm dibuat seri konsentrasi larutan vitamin C dengankonsentrasi berturut-turut3; 5; 12,5; 25; 50 75 dan 100 ppm dengan menggunakan mikro pipet dan masing-masing konsentrasi dibuat 3 kali pengulangan.Selanjutnya masing-masing konsentrasi ekstrak dan vitamin C dipipet sebanyak 1 mL dan dimasukan ke dalam tabung reaksi. Kemudian ditambahkan 1 mL larutan DPPH 0,024 mg/mL, dihomogenkan dan dibiarkan selama 30 menit di tempat gelap. Selanjutnya diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang optimum.
Aktivitas antioksidan ditentukan berdasarkan persentase daya hambat radikal bebas. Analisa kuantitatif terhadap aktivitas penghambatan radikal/DPPH dilakukan dengan menggunakan rumus :
%AA = 100 – {[(AB– AA)] x 100 / AKN}
Keterangan :
%AA = Persentase aktivitas antioksidan
AA = Absorbansi blanko (berisi 1 mL
ekstrak dalam etanol + 1 mL etanol)
AB = Absorbansi sampel (berisi 1 mL
ekstrak dalam etanol + 1 mL DPPH)
AKN = Absorbansi kontrol negatif (berisi
1 mL etanol + 1 mL DPPH) (Karamac et al., 2002)
Pengujian ini bertujuan untuk mengindikasi adanya aktivitas antioksidan yang ditunjukkan melalui dekolorisasi warna radikal DPPH dari ungu menjadi kuning sampai bening dan terjadi penurunan nilai absorbansi ekstrak terhadap kontrol, yang ditunjukkan pada monitor pada spektrofotometer. Jika terdapat indikasi tersebut dapat dinyatakan bahwa telah terjadi penghambatan ekstrak terhadap radikal DPPH, yang artinya ekstrak memiliki potensi antioksidan karena telah mampu menghambat kerja radikal bebas.
HASIL DAN PEMBAHASAN
Ekstraksi dan Fraksinasi
Sampel daunKerehau (Callicarpa longifolia Lam.) dimaserasi denganetanol secara berulang sampai larutan ekstrak tidak berwarna lagi. Kemudian maserat disaring dan filtratnya dipekatkan menggunakan
rotary evaporator. Selanjutnya difraksinasi dengan pelarut n-heksana dan etil asetat secara berturut-turut. Adapun berat dari ekstrak total, fraksi n-heksan dan fraksi etil asetat yang diperoleh masing-masing adalah 18,79 gram, 5,30 gram dan 4,47 gram, seperti yang tercantum dalam table 1 berikut.
Tabel 1 Berat dari ekstrak kasar dan masing-masing fraksi
Uji Fitokimia
Berdasarkan hasil uji fitokimia yang telah dilakukan terhadap ekstrak total, fraksi
n-heksana dan fraksi etil asetat dari tumbuhan kerehau (Callicarpa longifolia
Lam.) diketahui jenis senyawa metabolit sekunder yang dapat dilihat pada tabel 2 berikut.
Tabel 2 Hasil uji fitokimia dari ekstrak kasar dan masing-masing fraksi daun tumbuhan kerehau
Keterangan :
+ :Mengandung senyawa metabolit sekunder
˗ : Tidak mengandung senyawa metabolit sekunder
Uji Toksisitas (Brine Shrimp Lethality Test)
Sebagai skrining awal senyawa toksik dilakukan uji toksisitas dengan menggunakan larva udang (Artemia salina
L.). Hasil uji toksisitas ini dapat diketahui dari jumlah kematian larva udang yang dinyatakan dalam LC . Nilai LC
merupakan angka yang menunjukkan konsentrasi ekstrak yang dapat menyebabkan kematian sebesar 50% dari jumlah hewan uji.
Berdasarkan perhitungan dengan analisis probit SAS (Statistic Analysis System) terhadap ekstrak total, fraksi
n-heksana dan fraksi etil asetat pada daun tumbuhan kerehau (Callicarpa longifolia
Lam.) diperoleh LC50 (Lethal Concentration
50%) yang diperlihatkan pada tabel 3 berikut.
Tabel 3 Nilai LC50 uji mortalitas larva udang
ekstrak kasar etanol dan masing-masing fraksi
No. Jenis Ekstrak LC50 (ppm)
1. Ekstrak kasar 447,90 2. fraksi n-heksana 90,04 3. fraksi etil asetat 275,00
Menurut Meyer (1982), nilai tersebut menunjukkan ekstrak termasuk dalam tingkat toksik yang berkisar pada 31 ppm ≤ LC50 ≤ 1000 ppm.Berdasarkan hasil
perhitungan diperoleh bahwa ekstrak kasar mempunyai potensi toksisitas yang paling rendah dibandingkan dengan fraksi n -heksana dan fraksi etil asetat. Hal tersebut berkaitan dengan senyawa metabolit sekunder yang terkandung dari masing-masing ekstrak, dimana pada kadar tertentu memiliki tingkat toksik yang lebih tinggi sehingga dapat menyebabkan kematian yang lebih besar pada larva udang.
Uji Aktivitas Antioksidan
Adapun data uji yang dihasilkan dari uji aktivitas antioksidan dengan metode peredaman radikal DPPH untuk masing-masing ekstrak dan vitamin C dapat dilihat pada tabel berikut ini 4.
vitamin C pada berbagai konsentrasi
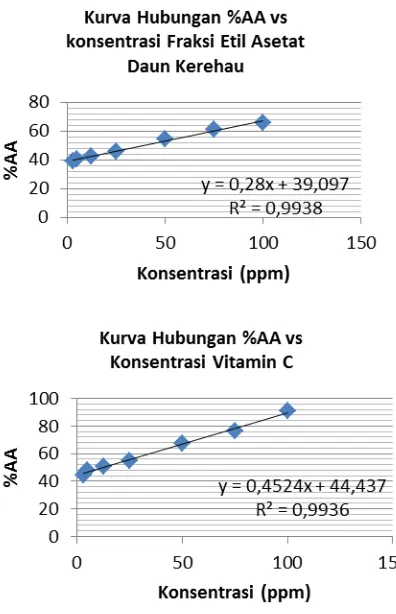
Berdasarkan hasil data di atas, maka dapat dilihat grafik hubungan antara konsentrasi masing-masing ekstrak terhadap peredaman radikal DPPH (%AA) pada gambar 1 berikut.
Gambar 1. Kurva hubungan antara %AA Vs masing masing ekstrak dan vitamin C
sebagai pembanding
Adapun besarnya nilai IC50 pada
ekstrak total, fraksin-heksana, fraksi etil asetat dan vitamin C sebagai pembanding dapat diketahui dari persamaan regresi linier sederhana pada grafik di atas. Nilai IC50
untuk ekstrak total diperoleh 61,38 ppm, fraksi n-heksana diperoleh 87,18 ppm, pada fraksi etil asetat diperoleh 38,94 ppm sedangkan pada vitamin C diperoleh 12,30 ppm. Parameter yang digunakan untuk uji penangkapan radikal DPPH adalah nilai IC50. IC50 didefinisikan sebagai besarnya
konsentrasi ekstrak yang dapat menghambat aktivitas radikal bebas DPPH sebesar 50%. Nilai IC50 diperoleh dari suatu persamaan
regresi linear yang menyatakan hubungan antara konsentrasi ekstrak uji dengan persen penangkapan radikal. Nilai IC50 yang
semakin kecil menunjukkan aktivitas
antioksidan pada bahan yang diuji semakin besar.Secara spesifik, suatu senyawa dikatakan sebagai antioksidan sangat kuat apabila nilai IC50 kurang dari 50 ppm, kuat
apabila nilai IC50 antara 50-100 ppm, sedang
apabila nilai IC50 antara 101-150 ppm dan
lemah apabila nilai IC50lebih dari 151ppm.
Berdasarkan klasifikasi diatas, dapat disimpulkan bahwa pada ekstrak kasardan fraksi n-heksana memiliki potensi sebagai antioksidan kuat, karena nilai IC50 yang
diperoleh berada dalam rentang 50-100 ppm, yaitu diperoleh nilai IC50sebesar 61,38 ppm
pada ekstrak kasar dan 87,18 ppm pada fraksi n-heksana. Sedangkan pada fraksi etil asetat nilai IC50 yang diperoleh sebesar
38,94 ppm sehingga aktivitas antioksidan yang dimiliki fraksi etil asetat dapat dikategorikan sangat kuat, dikarenakan nilai IC50 yang dimiliki kurang dari 50
ppm.Fraksi etil asetat memiliki aktivitas antioksidan paling kuat jika dibandingkan dengan ekstrak yang lain, hal ini dikarenakan terdapat kandungan senyawa golongan alkaloid, fenolik dan flavonoid yang dimiliki fraksi etil asetat yang sudah diketahui memiliki aktivitas sebagai antioksidan. Dugaan ini diperkuat di mana sebelumnya telah diisolasi flavonoid dari fraksi etil asetat daun Kerehau (Pasaribuet al, 2014).
Untuk ekstrak totaljuga mengandung senyawa alkaloid, fenolik, flavonoid dan steroid, namun tidak sekuat pada fraksi etil asetat dikarenakan belum terkonsentrasi, masih bercampur antara senyawa yang polar dan non polar.Sedangkan pada fraksi
n-heksana mengandung senyawa alkaloid, flavonoid dan steroid. Aktivitas antioksidannyatidaksekuat bila dibandingkan dengan ekstrak kasar etanol dan fraksi etil asetat, diduga karena tingginya kandungan steroid sehingga tidak dapat bersinergis dengan baik sebagai antioksidan. DPPH bereaksi dengan senyawa antioksidan melalui pengambilan
atom hidrogen dari senyawa antioksidan untuk mendapatkan pasangan elektron. Senyawa yang bereaksi sebagai penangkap radikal akan mereduksi DPPH yang dapat diamati dengan adanya perubahan warna DPPH dari ungu menjadi kuning ketika elektron ganjil dari radikal DPPH telah berpasangan dengan hidrogen dari senyawa penangkap radikal bebas yang akan membentuk DPPH-H tereduksi.
Antioksidan fenolik biasanya digunakan untuk mencegah kerusakan akibat reaksi oksidasi pada makanan, kosmetik, farmasi dan plastik. Senyawa ini mempunyai aktivitas sebagai penangkap radikal bebas sehingga dapat dimanfaatkan sebagai obat untuk mencegah penyakit yang disebabkan oleh radikal bebas seperti penyakit kanker. Flavonoid merupakan senyawa alami yang tergolong dalam sebagai senyawa aromatis merupakan senyawa pereduksi yang baik, menghambat banyak reaksi oksidasi, baik secara enzim maupun non enzim. Senyawa flavonoid dapat bertindak sebagai antioksidan dan merupakan donor hidrogen, seperti halnya dengan fenolik, radikal bebas yang terbentuk akibat dari donor hidrogen mempunyai energi yang rendah sebagai akibat dari terjadinya delokalisasi elektron dalam cincin benzen sebelum menjadi senyawa yang stabil.
KESIMPULAN
Berdasarkan hasil uji fitokimia terdapat beberapa jenis metabolit sekunder pada ekstrak kasar etanol yaitu, alkaloid, fenolik, flavonoid dan steroid, sedangkan pada fraksi n-heksana terdapat alkaloid, flavonoid dan steroid dan pada fraksi etil asetat terdapat alkaloid, fenolik dan flavonoid. Berdasarkan hasil uji BSLT, fraksi yang memiliki sifat toksik paling tinggi adalah fraksi n-heksan dengan nilai LC50 sebesar 90,05 dan fraksi yang paling
fraksi etil asetat dengan IC50 sebesar 38,94
ppm.
DAFTAR PUSTAKA
Harden GJ, editor. 1992. Flora of New South
Wales. Vol. 3.
Kensington,Australia: New South Wales University Press.
Harley, RM.; Atkins, S.; Budantsev, AL.; Cantino, P.D.; Conn, BJ.; Grayer, R.; Harley, MM.; de Kok, R.; Krestovskaja, T.; Morales, R.; Paton, AJ.; Ryding, O.; Upson, T. Labiatae. In: Kadereit, JW.,editor. 2004, Flowering Plants, Dicotyledons: Lamiales, except Acanthaceae, including Avicenniaceae,The Families and Genera of Vascular Plants. New York: Springer, page 478.
Karamac, M, Bucinski, A., Pegg, R.B., and Amarowicz, R. 2002. Antioxidant and Antiradical Activity Of Ferulate, Czech J. Food Sci. 23, 64-68.
Meyer, B.N., Ferrigny, N.R., Putnam, J.E., Jacobsen, L.B., Nicols, D.E. and McLaughlin, J.L. 1982. Brine Shrimp, A Covenient General Bioassay for Active Plant Contituent. Journal of Medical Plant Research. 45 : 31-34 Novadiana, A., Erwin, dan Pasaribu, S.P,
2013, Uji Toksisitas (Brine Shrimp Lethality Test) Ekstrak dan Isolat Fraksi Kloroform dari daun Karehau (Callicarpa
longifolia Lamk.), Prosiding
Seminar Nasional Kimia
Kalimantan Timur, hal. 134 – 140.
Pasaribu, S.P., Erwin and Istianti, P. 2014, Isolasi dan Identifikasi Senyawa Flavonoid dari Daun Kerehau,
Jurnal Kimia Mulawarman, Vol (2), 81-84.
Rasikari, H, 2007, Phytochemistry and
arthropod bioactivity of
Australian Lamiaceae, Theses, Southern Cross University ePublications@SCU, Australia, page 31.
Setyowati, F. M. 2010. Etnofarmakologi dan Pemakaian Tanaman Obat Suku Dayak Tunjung di Kalimantan Timur.Media Litbang Kesehatan,20, 104-112
Susiati, S., Hoesen, D.S.H, dan Hidayat, A. 2000, Keanekaragaman Tumbuhan yang Berpotensi Sebagai Tanaman Hias di Kutai, Kalimantan Timur, Prosiding Seminar Hari Cinta Puspa dan
Satwa Nasional, Kebun Raya
Bogor, Bogor, 214-219.
Jones, P.W and Kinhorn, A.D. 2009, Biologically Active Natural Products Of The Genus
Callicarpa, Curr Bioact
Compd,4(1): 15–32