commit to user 1
DEGRADASI FOTOELEKTROKATALITIK
RHODAMIN B
PADA ELEKTRODA LAPIS TIPIS TiO
2TERSENSITISASI
PUSPA AYU KARTIKA SARI
M0308090
SKRIPSI
Diajukan untuk memenuhi sebagian
persyaratan mendapatkan gelar Sarjana Sains Kimia
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SEBELAS MARET
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul “DEGRADASI
FOTOELEKTROKATALITIK RHODAMIN B PADA ELEKTRODA LAPIS TIPIS
TiO2 TERSENSITISASI” adalah benar-benar hasil penelitian sendiri dan tidak
terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Juli 2012
DEGRADASI FOTOELEKTROKATALITIK RHODAMIN B PADA
ELEKTRODA LAPIS TIPIS TiO2 TERSENSITISASI
PUSPA AYU KARTIKA SARI
Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret
ABSTRAK
Telah dilakukan penelitian tentang degradasi fotoelektrokatalitik Rhodamin B pada elektroda lapis tipis ITO/TiO2/dye (dye = Fe(bpy)x(dcbq)y(phen)z). Penelitian ini
bertujuan untuk mengetahui pengaruh potensial bias yang diberikan, lama penyinaran sinar visibel, pH larutan awal dan konsentrasi larutan elektrolit NaCl.
Preparasi elektroda ITO/TiO2/dye diawali dengan sintesis TiO2 menggunakan
metode sol gel dengan bahan awal Titanium Tetra Isopropoksida (TTIP). Difraktogram dari TiO2 hasil sintesis menunjukkan puncak karakteristik TiO2 anatase
pada 2θ = 25,35o. Kemudian TiO
2 fase anatase dibuat lapis tipis pada gelas konduktif
ITO. Larutan sensitizer disintesis dari kompleksisasi ion Fe2+ dengan ligan-ligan 2,2’-bipyridine (bpy), 2,2’-biquinoline-4,4’-dicarboxylic acid (dcbq) dan phenanthroline (phen). Sensitisasi ITO/TiO2 dengan larutan kompleks dapat memperluas serapan
TiO2 di daerah visibel diidentifikasikan dengan spektrofotometer UV-Vis pada
panjang gelombang 516 nm.
Proses degradasi fotoelektrokatalitik dilakukan pada konsentrasi Rhodamin B 5 ppm dengan lampu halogen 150 watt melalui sistem one compartment menggunakan elektroda ITO/TiO2/dye dan logam Cu. Hasil degradasi fotoelektrokatalitik Rhodamin
B paling baik dilakukan pada potensial bias +1 Volt, waktu penyinaran selama 4 jam, pH asam atau basa dan konsentrasi NaCl 3M.
Kata Kunci: Degradasi fotoelektrokatalitik, Rhodamin B, Lapis tipis ITO/TiO2,
PHOTOELECTROCATALYTIC DEGRADATION OF RHODAMINB BY
SENSITIZED THIN FILM TiO2 ELECTRODE
PUSPA AYU KARTIKA SARI
Department of Chemistry, Faculty of Mathematic and Science, Sebelas Maret University
ABSTRACT
The photoelectrocatalytic degradation of Rhodamin B by thin film ITO/TiO2/dye (dye = Fe(bpy)x(dcbq)y(phen)z) electrode had been investigated. The
research purposed to determine the effect bias potential, visible radiation time, pH solution and eletrolyte solution concentration.
The first ITO/TiO2/dye electrode was synthesized of TiO2 using sol gel method
with starting material Titanium Tetra Isopropoksida (TTIP). Diffractogram of TiO2
synthesized showed the characteristic peak of anatase TiO2 at 2θ = 25,35o. And then
anatase TiO2 was made thin film on ITO conducting glass. Sensitizer solution was
synthesized using ion Fe2+ with 2,2’-bipyridine (bpy), 2,2’-biquinoline-4,4’-dicarboxylic acid (dcbq) and phenanthroline (phen) ligands. Sensitization of ITO/TiO2 using kompleks solution had extend the photorespon of TiO2 to visible
region at 516 nm.
The photoelectrocatalytic degradation process had been conducted for 5 ppm Rhodamin B under 150 watt halogen lamp using one compartment cell with ITO/TiO2/dye and Cu electrode. The best result photoelectrocatalytic degradation of
Rhodamin B was showed at bias potential +1 Volt, radiation for 4 hours, pH acid or base and NaCl 3M.
Keyword: Photoelectrocatalytic degradation, Rhodamin B, Thin film ITO/TiO2,
MOTTO
“Pergunakanlah (beramallah di waktu) sehatmu sebelum kamu sakit dan pergunakanlah (beramal) di waktu hidup sebelum kamu mati”
(Hadits Imam Bukhari)
“Sesungguhnya sesudah kesulitan itu ada kemudahan. Maka apabila kamu telah selesai (dari suatu urusan), kerjakanlah dengan sungguh-sungguh (urusan) yang lain”
(Alam Nasyarh: 6-7)
“I Must Believe That I Can Do It”
PERSEMBAHAN
Kupersembahkan perjuangan ku ini kepada:
I bu, I bu, I bu……
Bapak………….
KATA PENGANTAR
Puji syukur kepada Allah SWT yang telah memberikan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi yang berjudul “Degradasi Fotoelektrokatalitik Rhodamin B pada Elektroda Lapis Tipis TiO2 Tersensitisasi” ini
disusun atas dukungan dari berbagai pihak. Dari dasar hati penulis menyampaikan terima kasih kepada:
1. Bapak Prof. Ari Handono Ramelan, M. Sc, PhD selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret.
2. Dr. Eddy Heraldy, M.Si selaku Ketua Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret.
3. Dr. Sayekti Wahyuningsih, M.Si selaku pembimbing I yang telah memberikan bimbingan dan arahan.
4. Candra Purnawan, M.Sc selaku pembimbing II dan pembimbing akademik yang telah memberikan bimbingan serta motivasi.
5. Seluruh dosen di Jurusan Kimia, Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret atas ilmu yang berguna dalam menyusun skripsi ini.
6. Para Laboran di Laboratorium Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret atas bantuan dan kerjasama yang baik.
7. Teman-teman Kimia Angkatan 2008 Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret atas kekompakan dan kerjasama yang baik.
8. Semua pihak yang tidak dapat kami sebutkan satu persatu.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna. Oleh karena itu, penulis mengharapkan kritik dan saran yang membangun dalam rangka untuk penyempurnaan skripsi ini. Akhir kata, semoga karya kecil ini dapat memberikan manfaat bagi ilmu pengetahuan dan bagi pembaca.
Surakarta, Juli 2012
6. Rhodamin B... 15
B. Tempat dan Waktu Penelitian... 24
C. Alat dan Bahan yang Digunakan... 24
1. Alat... 24
2. Bahan... 25
D. Prosedur Penelitian... 26
1. Sintesis TiO2... 26
2. Sintesis Dye (Kompleks Fe(bpy)x(dcbq)y(phen)z)... 26
3. Preparasi Elektroda Lapis Tipis ITO/TiO2... 26
4. Preparasi Elektroda ITO/TiO2/dye... 27
5. Karakterisasi... 27
a. Material TiO2... 27
b. Dye (Kompleks Fe(bpy)x(dcbq)y(phen)z)... 27
c. ITO/TiO2/dye... 27
6. Pengukuran Degradasi Fotoelektrokatalitik... 27
E. Teknik Pengumpulan dan Analisa Data... 28
1. Pengumpulan Data... 28
2. Analisa Data... 28
BAB IV. HASIL DAN PEMBAHASAN... 30
A. Sintesis dan Karakterisasi TiO2... 30
B. Sintesis Dye (kompleks Fe(bpy)x(dcbq)y(phen)z)... 32
C. Sensitisasi ITO/TiO2/dye... 34
1. Degradasi Fotoelektrokataltik Rh B dengan Variasi Voltase... 36
2. Degradasi Fotoelektrokatalitik Rh B dengan Variasi Waktu... 41
3. Degradasi Fotoelektrokatalitik Rh B dengan Variasi pH... 42
4. Degradasi Fotoelektrokatalitik Rh B dengan Variasi [NaCl]... 46
BAB V. KESIMPULAN DAN SARAN... 47
A. Kesimpulan... 47
B. Saran... 47
DAFTAR PUSTAKA... 48 LAMPIRAN...
DAFTAR TABEL
Tabel 1. Sifat-Sifat Fisik yang Dimiliki oleh Rhodamin B ... 15 Tabel 2. Panjang Gelombang Maksimum FeCl2.4H2O, Ligan Bpy, Ligan Dcbq,
DAFTAR GAMBAR
Gambar 1. Skema Proses Fotokatalitik... 8
Gambar 2. Struktur Kristal TiO2... 10
Gambar 3. Struktur Ligan Bpy, Dcbq, dan Phen... 11
Gambar 4. Skema Fotosensitisasi TiO2... 12
Gambar 5. Mekanisme Fotosensitisasi Dye pada Permukaan TiO2... 13
Gambar 6. Geometri TiO2 Anatase yang Berikatan dengan Katekol... 13
Gambar 7. Struktur Rhodamin B... 15
Gambar 8. Diagram MO yang Disederhanakan dan Tipe Transisi Elektron yang Memungkinkan Untuk Kompleks d1... 17
Gambar 9. Spekta UV-Vis TiO2 Murni dan TiO2 Tersensitisasi dan Spektra Absorbansi Larutan sensitiser (RuII(bpy-COOH)2)32+... 19
Gambar 10. Spektra Difraksi Sinar-X TiO2 Hasil Sintesis... 32
Gambar 11. Spektra UV-Vis FeCl2.4H2O dan Ligan Bpy, Dcbq, Phen serta dye (Kompleks Fe(bpy)x(dcbq)y(phen)z)... 33
Gambar 12. Spektra UV-Vis Lapis Tipis ITO/TiO2/dye... 35
Gambar 13. Hasil Degradasi Fotoelektrokatalitik Rhodamin B dengan Variasi Voltase... 36
Gambar 14. Skema Degradasi Fotoelektrokatalitik dengan Potensial Bias Positif... 37
Gambar 15. Skema Degradasi Fotoelektrokatalitik dengan Potensial Bias Positif... 40
Gambar 16. Hasil Degradasi Fotoelektrokatalitik Rhodamin B dengan Variasi Waktu... 41
Gambar 17. Spektra Degradasi Fotoelektrokatalitik Rhodamin B pada Variasi waktu... 42
Gambar 18. Hasil Degradasi Fotoelektrokatalitik Rhodamin B dengan Variasi pH... 42
Gambar 19. Struktur Rhodamin B bentuk kationik... 43
Gambar 20. Struktur Rhodamin B bentuk zwitter ion... 44
DAFTAR LAMPIRAN
Lampiran 1. Bagan Alir Cara Kerja... a. Sintesis TiO2...
b. Pembuatan Lapis Tipis ITO/TiO2...
c. Sintesis Dye (Kompleks Fe(bpy)x(dcbq)y(phen)z)...
d. Sensitisasi ITO/TiO2 dengan Dye...
54
b. Proses Sintesis dye (Kompleks Fe(bpy)x(dcbq)y(phen)z)...
c. Proses Preparasi Elektroda ITO/TiO2/dye...
d. Proses Degradasi Fotoelektrokatalitik Rhodamin B...
a. Pola Difraksi Sinar-X TiO2 Anatase pada Standar JCPDS...
b. Data Difraksi Sinar-X TiO2 Hasil Sintesis...
c. Perhitungan Nilai d (Jarak Interlayer)... 58 58 58 66 Lampiran 4. Tabulasi Hasil Degradasi Fotoelektrokatalitik Rhodamin B...
BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Industri tekstil merupakan salah satu bidang industri yang sangat berkembang di Indonesia. Dampak negatif dari perkembangan industri tekstil tersebut terutama berasal dari limbah cair proses pencelupan (dyeing) yang dapat mencemari lingkungan. Warna limbah muncul karena ada gugus kromofor dalam zat warna tekstil yang digunakan pada proses pencelupan. Rhodamin B merupakan suatu senyawa dengan gugus kromofor yang bersifat nonbiodegradable, sulit diuraikan oleh panas dan bakteri. Oleh karena itu penanggulangan limbah zat warna dengan cara praktis dan ekonomis sangat perlu dikembangkan agar industri tekstil mampu mengelola limbahnya dengan baik.
Berbagai teknik atau metode penanggulangan limbah tekstil telah dikembangkan, diantaranya adalah metode adsorpsi dengan zeolit seperti yang dilakukan oleh Suwarni (1997). Namun, metode ini kurang begitu efektif karena zat warna yang diadsorpsi mengunakan zeolit dapat terakumulasi di dalam adsorben yang suatu saat nanti dikhawatirkan akan menimbulkan persoalan baru. Metode lainnya dengan menggunakan bakteri penghancur seperti yang dilakukan oleh Ashadi (2000). Kelemahan dari metode ini adalah memerlukan waktu yang lama untuk medegradasi, kerja mikroba tidak efektif untuk limbah berkonsentrasi tinggi. Selain itu proses panghilangan warna merupakan proses fermentasi yang akan menimbulkan gas yang berbau sebagai hasil pembusukan tersebut. Sebagai alternatif dikembangkan metode dengan memanfaatkan semikonduktor katalis diantaranya degradasi fotokatalitik, degradasi elektrokatalitik dan degradasi fotoelektrokatalitik. Menurut Indri Apriyani (2007) dengan menggunakan semikonduktor grafit/TiO2/Cu dengan lampu UV
77,47% dibanding degradasi fotokatalitik dan 11,52% lebih efisien dibanding degradasi elektrokatalitik.
Oksida logam titanium (TiO2) banyak dilaporkan sebagai material
semikonduktor yang memiliki aktivitas fotokatalitik yang lebih tinggi, lebih stabil dan tidak beracun. Selain itu secara komersial serbuk TiO2 mudah didapat dan
diproduksi dalam jumlah besar. Menurut Tjahjanto dkk (2001) penggunaan TiO2
serbuk di dalam cairan untuk medegradasi komplek senyawa-senyawa organik kurang efisien karena serbuk yang telah terdispersi dalam air sangat sulit diregenerasi. Selain itu bila campuran terlalu keruh maka radiasi dari cahaya yang digunakan tidak mampu mengaktifkan seluruh partikel fotokatalis. Pembuatan lapis tipis semikonduktor pada suatu substrat merupakan inovasi untuk mendapatkan semikonduktor fotokatalis yang mudah ditangani karena tidak mengalami kesulitan pemisahan semikonduktor dari larutan yang didegradasi dan mudah untuk diregenerasi. Kelemahan lain dari TiO2 memiliki energi gap yang tinggi, sebanding
dengan cahaya 388 nm (3,23 eV), padahal cahaya ultraviolet tersebut hanya 10% dari seluruh cahaya matahari. Keterbatasan ini dapat diatasi dengan modifikasi TiO2 oleh
doping ion logam dan fotosensitisasi oleh berbagai senyawa organik dan anorganik berwarna. Sehingga dapat memperpanjang fotorespon TiO2 ke daerah visibel agar
dapat digunakan untuk degradasi kontaminan organik berwarna dan polutan organik lainnya (Lisenbigler et al., 1995). Telah dilaporkan beberapa dye berhasil digunakan sebagai fotosensitiser seperti: Methylen Blue (Catterjee et al., 2002), kompleks tris (4,4’-dicarboxy-2,2’-bipyridyl) ruthenium (II) (Cho et al., 2001) dan kompleks phthalocyanine (lliev, 2002).
Penelitian ini dilakukan untuk medegradasi zat warna Rhodamin B secara fotoelektrokatalitik menggunakan elektroda lapis tipis ITO/TiO2 tersensitisasi dengan
memanfaatkan transfer elektron antara material TiO2 dengan dye. Transfer elektron
terjadi ketika dye mengalami fotoeksitasi yang kemudian elektron tereksitasi tersebut akan diinjeksikan ke material TiO2. Sehingga dapat diaplikasikan sebagai fotokatalis,
B. Perumusan Masalah 1 Identifikasi Masalah
Senyawa TiO2 mempunyai tiga bentuk kristal yang telah dikenal yaitu anatase,
rutil dan brokit. Rutil adalah bentuk yang stabil sedangkan anatase dan brokit adalah bentuk yang metastabil. Namun anatase memiliki aktivitas fotokatalis yang baik untuk degradasi senyawa organik. Kestabilan anatase dipengaruhi oleh temperatur, penambahan zat lain (doping) dan metode sintesis. TiO2 dapat dibuat dengan beberapa
metode yaitu hidrotermal (Rizal dkk., 2007), sol gel (Karami, 2010), spray pirolisis (Di Li et al., 2005), mikroemulsi (Ruslimie et al., 2011), hidrolisis uap (Ani et al., 2005) dan sonokimia (Jiang et al., 2010). Salah satu prekusor yang dapat digunakan dalam pembuatan TiO2 adalah TiCl4 (Wahyuningsih et al., 2007) dan prekursor
alkoksida seperti TTIP (Tjahjanto dkk., 2001; Wang et al., 2007).
Pembuatan lapis tipis TiO2 pada suatu substrat merupakan inovasi untuk
mendapatkan semikonduktor fotokatalis yang mudah ditangani sehingga mudah untuk dipisahkan dan diregenerasi. Nurdin dkk. (2009) berhasil membuat TiO2
berukuran nano, yang dilekatkan pada substrat gelas berlapis ITO (Indium Thin Oxide) dengan cara dip coating ke dalam sol gel yang telah disiapkan dengan cara refluks hidrotermal dan kemudian dikalsinasi pada 450 oC. Maddu dkk. (2007) membuat lapis tipis TiO2 yang dideposisikan pada substrat kaca TCO (Transparent
Counducting Oxide) melalui teknik casting, setelah itu dipanaskan pada suhu 130 oC
selama 25 menit.
Peningkatan aktivitas dan efisiensi katalik TiO2 dapat dilakukan dengan
kompleks tris (4,4’-dicarboxy-2,2’-bipyridyl) ruthenium (II) (Cho et al, 2001). Dan kompleks phthalocyanine (lliev, 2002).
Pada saat TiO2 dikenai cahaya maka akan terjadi absorbsi energi oleh molekul
akibat adanya interaksi energi dengan materi. Absorbsi energi dipengaruhi oleh panjang gelombang dan intensitas sinar. Sulistiya (2011) menggunakan lampu halogen 35 W pada fotoaktivitas TiO2 dengan penambahan Fe2O3 terhadap sinar
visibel.
Metode degradasi fotoelektrokatalitik termasuk sel elektrokimia yang berdasarkan prinsip dari proses elektrolisis dimana reaksi kimia terjadi pada elektroda yang tercelup dalam elektrolit. Elektroda yang umum digunakan dalam fotoelektrokatalitik seperti Pt, Au, C. Larutan elektrolit yang biasa digunakan KCl, HCl dan larutan NaCl.
Karakterisasi kristal TiO2 banyak dilakukan dengan X-Ray Diffraction (XRD)
untuk menentukan tipe kristal dan mengestimasi ukuran kristal material katalis (Riyas et al., 2002). Sifat elektronik dye maupun ITO/TiO2/dye dapat dipelajari dengan
spektrofotometer UV-Vis seperti yang telah dilakukan oleh Sulistiya (2011). Degradasi fotoelektrokatalitik senyawa organik banyak diukur dengan spektrofotometer UV-Vis (Liu et al., 2005; Wahyuni et al., 2003) serta menggunakan Spektrofotometer Serapan Atom (AAS) oleh Slamet dkk. (2003).
2. Batasan Masalah Pada penelitian ini permasalahan dibatasi pada:
a. TiO2 yang digunakan adalah TiO2 hasil sintesis dari bahan awal TTIP dengan
metode sol gel.
b. Lapis tipis TiO2 dibuat dengan metode slip casting yaitu melekatkan TiO2 pada
c. Modifikasi permukaan TiO2 dilakukan dengan cara fotosensitisasi dengan
kompleks Fe(bpy)x(dcbq)y(phen)z.
d. Sumber cahaya yang digunakan adalah lampu halogen 150 watt.
e. Sel elektrolisis menggunakan elektroda ITO/TiO2/dye, elektoda Cu dan larutan
elektrolit NaCl.
f. Karakterisasi TiO2 hasil sintesis dilakukan dengan menggunakan XRD. Sifat
elektronik dye dan ITO/TiO2/dye serta pola penurunan absorbansi dari proses
degradasi fotoelektrokatalitik Rhodamin B dipelajari dengan spektrofotometer UV-Vis.
3. Rumusan Masalah
Dari batasan masalah yang telah disebutkan diatas maka rumusan penelitian ini adalah:
a. Apakah material ITO/TiO2/dye (dye = kompleks Fe(bpy)x(dcbq)y(phen)z) memiliki
respon terhadap cahaya visibel?
b. Bagaimana pengaruh voltase yang diberikan terhadap proses degradasi fotoelektrokatalitik Rhodamin B?
c. Bagaimana pengaruh lama penyinaran sinar visibel terhadap degradasi fotoelektrokatalitik Rhodamin B?
d. Bagaimana pengaruh pH larutan awal terhadap degradasi fotoelektrokatalitik Rhodamin B?
e. Bagaimana pengaruh konsentrasi larutan elektrolit NaCl yang diberikan pada proses elektrolisis terhadap proses degradasi fotoelektrokatalitik Rhodamin B?
C. Tujuan Penelitian
1. Mengetahui respon material ITO/TiO2/dye terhadap cahaya visibel menggunakan
Spektrofotometer UV-Vis.
3. Mengetahui waktu optimum pada degradasi fotoelektrokatalitik Rhodamin B. 4. Mengetahui pH optimum pada degradasi fotoelektrokatalitik Rhodamin B.
5. Mengetahui konsentrasi NaCl optimum pada proses degradasi fotoelektrokatalitik Rhodamin B
D. Manfaat Penelitian
Memberikan alternatif metode penanganan masalah limbah cair industri tekstil menggunakan elektroda lapis tipis ITO/TiO2 tersensitisasi sehingga dapat
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka 1. Degradasi Fotoelektrokatalitik
Reaksi degradasi fotoelektrokatalitik merupakan reaksi yang melibatkan cahaya (foton), aliran listrik dan katalis. Potensial listrik antara fotokatalitik dan elektrokatalitik diaplikasikan untuk meningkatkan mobilitas dari elektron tereksitasi pada fotoelektrokatalitik. Sehingga katalis ini dapat mempercepat fotoreaksi melalui interaksinya dengan substrat baik dalam keadaan dasar atau dalam keadaan tereksitasi. Penelitian tentang reaksi fotodegradasi terkatalis banyak diarahkan untuk keperluan degradasi zat berwarna, salah satunya Nassoko et al. (2011) yang meneliti degradasi fotoelektrokatalitik zat warna Rhodamin B menggunakan semikonduktor TiO2. Hasilnya semikonduktor fotokatalis tersebut dapat mempercepat penguraian zat
warna berdasarkan penurunan absorbansi UV-Vis zat warna setelah degradasi. Reaksi degradasi fotokatalitik (Gambar 1) diawali ketika partikel TiO2
Gambar 1. Skema Proses Fotokatalitik (Palupi, 2006)
Mekanisme reaksi degradasi fotokatalitik yang diusulkan oleh Malato et al. (2002) adalah sebagai berikut:
TiO2 hv e-cb + h+vb h+vb + H2O .OH + H+ e-cb + O2 O2. -2O2.- + 2H
2O H2O2 + 2OH- + O2
H2O2 + e
-cb OH- + .OH
...(4) ...(1)
...(3) ...(2)
...(5)
Potensial sebesar ini cukup kuat untuk mengoksidasi kebanyakan zat organik menjadi air, asam mineral, dan karbondioksida (Fujishima et al., 1998).
Indri Apriyani (2007) medegradasi zat warna Remazol Yellow FG dengan membandingkan metode fotodegradasi (yaitu fotokatalitik, elektrokatalitik dan fotoelektrokatalitik) menggunakan katalis grafit/TiO2/Cu. Hasilnya dengan metode
fotoelektrokatalitik pada 60 menit pertama lebih efisien 77,47% dibanding fotokatalitik dan 11,52% lebih efisien dibanding elektrokatalitik. Pemberian External anodic bias pada iluminasi lapis tipis TiO2 tidak hanya dapat memisahkan
penangkapan elektron dan hole, tetapi juga dapat memisahkan sisi reduksi dan oksidasi. Oleh karenanya, jelas bahwa medan listrik akan secara signifikan meningkatkan pemisahan muatan, sehingga meningkatkan pembentukan radikal hidroksil, suatu fenomena yang diberi nama electric field enchancement effect field (efek peningkatan akibat medan listrik) (Gunlazuardi, 2001).
2. Titanium Dioksida (TiO2)
Titanium dioksida merupakan padatan berwarna putih dengan berat molekul 79,90 dengan titik lebur 1885 oC dan mengalami dekomposisi pada suhu 1640 oC sebelum meleleh. Senyawa ini tidak larut dalam air, asam klorida, dan asam nitrat tetapi larut dalam sulfat pekat (Cotton et al., 1999).
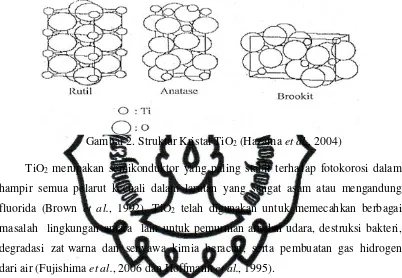
Titanium dioksida mempunyai tiga bentuk polimorfik yang sering ditemukan yaitu: anatase, rutil dan brokit (Gambar 2), akan tetapi hanya anatase dan rutil saja yang mempunyai peran penting dalam aktivitas fotokatalitik (Susanti, 2006). Jenis struktur yang berbeda tentunya berpengaruh pada perbedaan dalam masa jenis (masa jenis anatase 3,9 g/mL dan rutil 4,2 g/mL) dan hal ini dapat mempengaruhi pada luas permukaan dan sisi aktif dari TiO2 (Arutanti dkk., 2009). Selain itu juga
gap diantara keduanya akan berbeda jika lingkungan dan/atau penyusunan atom Ti dan O dalam kristal TiO2 berbeda, seperti pada anatase (Eg = 3,2 eV) dan rutil (Eg =
3,0 eV) (Gunlazuardi, 2001)
Gambar 2. Struktur Kristal TiO2 (Hazama et al., 2004)
TiO2 merupakan semikonduktor yang paling stabil terhadap fotokorosi dalam
hampir semua pelarut kecuali dalam larutan yang sangat asam atau mengandung fluorida (Brown et al., 1992). TiO2 telah digunakan untuk memecahkan berbagai
masalah lingkungan antara lain untuk pemurnian air dan udara, destruksi bakteri, degradasi zat warna dan senyawa kimia beracun, serta pembuatan gas hidrogen dari air (Fujishima et al., 2006 dan Hoffmann et al., 1995).
Kelemahan TiO2 mempunyai band gap yang tinggi, sebanding dengan cahaya
388 nm (3,23 eV) yaitu pada daerah UV dekat. Pemanfaatan TiO2 sebagai fotokatalis
atau sel sutya akan lebih menghemat biaya jika dapat menggunakan sumber energi cahaya tampak pada matahari secara efektif. Alternatif untuk memperbesar keterbatasan sensitivitas spektral TiO2 adalah modifikasi permukaan dengan
menggunakan molekul sensitiser berwarna yang menyerap cahaya tampak (Longo et al., 2003).
3. Sensitiser
terhadap sinar visibel. Sensitiser yang umumnya digunakan dan mencapai efisiensi paling tinggi yaitu jenis kompleks Ruthenium, namun kompleks ini cukup sulit untuk disintesis dan berharga mahal.
Penggunaan bahan sensitiser dapat menyebabkan terjadinya injeksi elektron (sensitisasi) dari senyawa sensitiser ke material TiO2 dengan bantuan energi cahaya
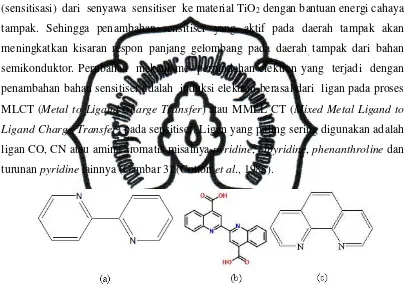
tampak. Sehingga penambahan sensitiser yang aktif pada daerah tampak akan meningkatkan kisaran respon panjang gelombang pada daerah tampak dari bahan semikonduktor. Perubahan mekanisme perpindahan elektron yang terjadi dengan penambahan bahan sensitiser adalah induksi elektron berasal dari ligan pada proses MLCT (Metal to Ligand Charge Transfer) atau MMLL’CT (Mixed Metal Ligand to Ligand Charge Transfer) pada sensitiser. Ligan yang paling sering digunakan adalah ligan CO, CN atau amina aromatis misalnya pyridine, bipyridine, phenanthroline dan turunan pyridine lainnya (Gambar 3) (Cotton et al., 1988).
Gambar 3. Struktur Ligan 2,2’-bipyridine (a); 2,2’-biquinoline-4,4’-dicarboxylic acid (b); Phenanthroline (c)
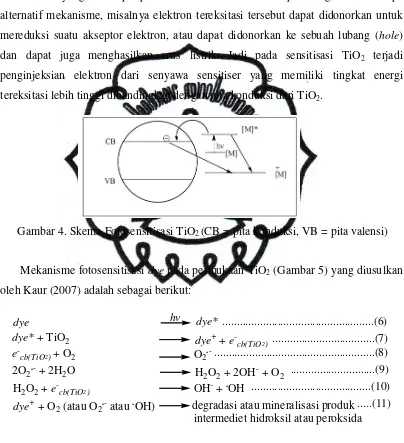
Mekanisme yang terjadi pada proses sensitisasi dari sensitiser ke material semikonduktor ditunjukkan pada Gambar 4. Cahaya tampak akan diserap oleh sensitiser menyebabkan eksitasi elektron dari senyawa kompleks [M] pada keadaan ground state menuju ke [M]*. [M]* menggambarkan tingkat energi orbital π* atau σ* dari ligan L, kemudian elektron tereksitasi tersebut akan diinjeksikan ke CB
tereksitasi dan pita konduksi dari material kecil serta berdekatannya orbital anti bonding ligan dengan pita konduksi material.
Elektron yang terkumpul pada conduction band TiO2 dapat mengalami beberapa
alternatif mekanisme, misalnya elektron tereksitasi tersebut dapat didonorkan untuk mereduksi suatu akseptor elektron, atau dapat didonorkan ke sebuah lubang (hole) dan dapat juga menghasilkan arus listrik. Jadi pada sensitisasi TiO2 terjadi
penginjeksian elektron dari senyawa sensitiser yang memiliki tingkat energi tereksitasi lebih tinggi dibandingkan dengan pita konduksi dari TiO2.
Gambar 4. Skema Fotosensitisasi TiO2 (CB = pita konduksi, VB = pita valensi)
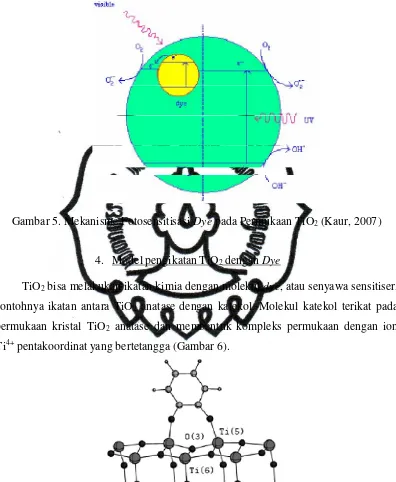
Mekanisme fotosensitisasi dye pada permukaan TiO2 (Gambar 5) yang diusulkan
Gambar 5. Mekanisme Fotosensitisasi Dye pada Permukaan TiO2 (Kaur, 2007)
4. Model pengikatan TiO2 dengan Dye
TiO2 bisa melakukan ikatan kimia dengan molekul dye, atau senyawa sensitiser,
contohnya ikatan antara TiO2 anatase dengan katekol. Molekul katekol terikat pada
permukaan kristal TiO2 anatase dan membentuk kompleks permukaan dengan ion
Ti4+ pentakoordinat yang bertetangga (Gambar 6).
Gambar 6. Geometri TiO2 Anatase yang Berikatan dengan Katekol
Ti(5) menunjukkan ion Ti4+ pentakoordinat yang secara langsung mengikat
katekol. Ti(6) menunjukkan ion Ti4+ heksakoordinat yang berdekatan dengan katekol.
Ikatan antara dye dan TiO2 anatase bisa juga terjadi pada atom oksigen gugus
hidroksil. Lango dan Paoli (2003) menyatakan bahwa gugus karboksilat dapat bereaksi secara spontan dengan gugus hidroksil permukaan pada permukaan TiO2 membentuk senyawa ester, sehingga terjadi ikatan yang stabil antara dye dan
TiO2.
5. Lapis Tipis TiO2
Pembuatan lapis tipis TiO2 merupakan salah satu cara untuk mempemudah
aplikasi TiO2 baik sebagai solar sel maupun fotokatalis dalam degradasi senyawa
kimia berbahaya. Pembuatan lapis tipis TiO2 pada suatu substrat merupakan inovasi
untuk mendapatkan semikonduktor fotokatalis yang mudah ditangani dalam aplikasi fotokatalitik (dalam arti tidak mengalami kesulitan pemisahan semikonduktor dari larutan yang didegradasi) sehingga memungkinkan penggunaan lebih dari satu kali karena pencucian mudah dilakukan.
Rahmawati dkk. (2008) melakukan sintesis material semikonduktor lapis tipis grafit/TiO2 menggunakan metode chemical bath deposition (deposisi dari larutan
kimia) menggunakan surfaktan CTABr (Cetyl Trimethyl Ammonium Bromide) sebagai agen penghubung antara substrat grafit dengan material TiO2 yang terbentuk
dari hidrolisis TiCl4. Variasi konsentrasi surfaktan CTABr yang digunakan adalah 4,
8, 12, dan 19.10-3M dengan variasi waktu perendaman selama 2, 3, 4 hari dengan
pemanasan yang kontinyu pada suhu 60 oC kemudian dikalsinasi 450 oC selama 4 jam. Konsentrasi CTABr 16.10-3M dan waktu perendaman 4 hari ini merupakan kondisi optimal pada deposisi TiO2, hal ini ditunjukkan dari efisiensi konversi foton
Sintesis lapis tipis TiO2 juga dapat diperoleh dengan menambahkan sebanyak 1
mg TiO2 dengan 1 tetes asetilasetonat dan 6 tetes triton-X 100, ditumbuk sampai
diperoleh bentuk pasta TiO2. Selanjutnya dengan menggunakan teknik
Doctor-blading, pasta TiO2 tersebut kemudian dilapiskan pada plat gelas ITO (ukuran 1 cm x
1 cm) dengan bantuan pengaduk gelas. Ketebalan lapisan dibuat sama dengan tebal adhesive tape (~20 m) yang digunakan sebagai pembatas tepi. Setelah lapis tipis dikeringkan di udara pada suhu kamar, lapis tipis TiO2 diannealing pada suhu 400oC
selama 90 menit (Wahyuningsih et al., 2010).
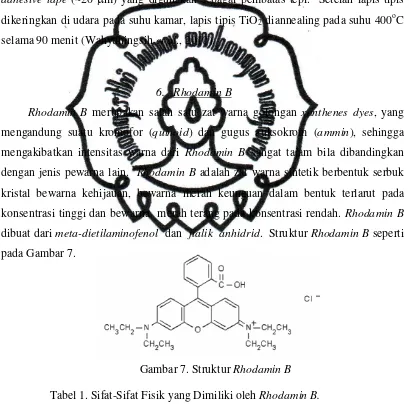
6. Rhodamin B
Rhodamin B merupakan salah satu zat warna golongan xanthenes dyes, yang mengandung suatu kromofor (quinoid) dan gugus auksokrom (ammin), sehingga mengakibatkan intensitas warna dari Rhodamin B sangat tajam bila dibandingkan dengan jenis pewarna lain. Rhodamin B adalah zat warna sintetik berbentuk serbuk kristal bewarna kehijauan, bewarna merah keunguan dalam bentuk terlarut pada konsentrasi tinggi dan bewarna merah terang pada konsentrasi rendah. Rhodamin B dibuat dari meta-dietilaminofenol dan ftalik anhidrid. Struktur Rhodamin B seperti pada Gambar 7.
Gambar 7. Struktur Rhodamin B
Tabel 1. Sifat-Sifat Fisik yang Dimiliki oleh Rhodamin B. Berat molekul: 479 gr/mol
Rumus molekul: C28H31ClN2O3
Kelarutan: sangat larut dalam air dan alkohol, sedikit larut dalam asam klorid dan natrium hidroksida
Nama kimia: N-[9-(2-carboxyphenyl)-6-diethylamino)-3H-xanthen-3ylidene]-N-ethylethanaminium chloride
Nama lain: tetraethylrhodamine; D & C Red No. 19; rhodamine B chloride; C.I. Basic Violet 10; C.I. 45170
Bentuk: kristal bewarna hijau atau serbuk ungu kemerahan
7. Spektrum Elektronik UV-Vis
Absorbsi cahaya ultraviolet atau cahaya tampak mengakibatkan transisi elektronik, yaitu promosi elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan transisi berenergi lebih tinggi. Energi yang diserap selanjutnya dilepaskan sebagai panas, sebagai cahaya atau tersalurkan dalam reaksi kimia (misalnya isomerisasi atau reaksi-reaksi radikal bebas).
Absorbsi energi direkam sebagai absorban pada suatu panjang gelombang tertentu yang didefinisikan sebagai : dengan banyaknya molekul yang mengalami transisi. Oleh karena itu, absorbsi tergantung pada struktur elektronik senyawa dan juga pada kepekatan sampel dan panjangnya sel.
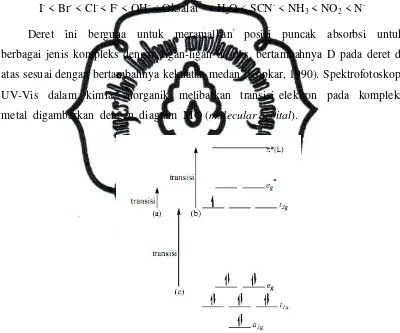
Sifat spektrum dari logam transisi meliputi transisi elektronik antara tingkat-tingkat energi yang berbeda pada orbital d. Berdasarkan teori medan kristal diketahui bahwa orbital t2g (dxy, dyz, dan dxz) dan orbital eg (dx2-y2, dz2) terpecah sebesar D dengan
adanya ligan. Besarnya splitting (D) oleh ligan dapat disusun dalam suatu deret spektrokimia berikut.
I- < Br- < Cl- < F- < OH- < Oksalat2- < H2O < SCN- < NH3 < NO2 < N
-Deret ini berguna untuk meramalkan posisi puncak absorbsi untuk berbagai jenis kompleks dengan ligan-ligan di atas, bertambahnya D pada deret di atas sesuai dengan bertambahnya kekuatan medan (Kopkar, 1990). Spektrofotoskopi UV-Vis dalam kimia anorganik melibatkan transisi elektron pada kompleks metal digambarkan dengan diagram MO (molecular orbital).
Gambar 8. Diagram MO yang Disederhanakan dan Tipe Transisi Elektron yang Memungkinkan untuk Kompleks d1.
MLCT ditunjukkan dengan anak panah (b). Transisi dari t2g ke eg merupakan
transisi yang terkecil dibandingkan transisi yang lain (Gambar 8). Transisi d-d tersebut merupakan transisi yang terlarang menurut hukum seleksi orbital dan
akseptor, maka jenis transisi kedua kemungkinan bisa terjadi (dari t2g ke tingkat π*,
panah (b), pada Gambar 8).
Transisi ini mengubah distribusi muatan metal-ligan, karena densitas elektron bergeser dari orbital dengan karakter logam yang tinggi ke orbital dengan karakter ligan yang tinggi. Karenanya, transisi ini merupakan metal-to-ligand charge transfer. Dan hal itu diperbolehkan oleh aturan seleksi orbital (Dl = 1, dengan asumsi bahwa
π* mempunyai asal usul tipe-p). Pita seperti itu cenderung kuat (e = 103-104 L/mol.cm), dan selalu ditemukan pada level energi yang lebih tinggi dari transisi d-d.
Cho et al. (2001), telah berhasil menunjukkan proses MLCT pada kompleks (RuII(bpy-COOH)2)32+. Pita absorpsi maksimum dari metal-to-ligand charge
transfer (transisi MLCT, dπ→π*) sensitiser terlihat pada 467 nm (Gambar 9).
Gambar 9. Spektra UV-Vis TiO2 murni dan TiO2 Tersensitisasi dan Spektra
Absorbansi larutan sensitiser (RuII(bpy-COOH)2)32+.
8. Difraksi Sinar X
menghasilkan radiasi dengan jarak panjang gelombang kontinyu yang disebut Bremsstrahlung (Bremsse adalah kata Jerman yang berarti rem, strahlung berarti sinar). Tumbukan ini akan mengeluarkan sebuah elektron, dan elektron dengan energi lebih tinggi masuk ke tempat kosong dengan memancarkan kelebihan energinya sebagai foton sinar X.
Difraksi sinar X adalah salah satu alat yang digunakan untuk mengetahui pengaturan atom-atom dalam sebuah tingkat molekul. Pengaturan atom-atom tersebut dapat diinterpretasikan melalui analisa d spacing dari data difraksi sinar X. Selain nilai d spacing, observasi tingkat kristalinitas bahan dan perubahan struktur mesopori dapat pula diketahui melalui data difraksi sinar X. Puncak yang melebar menunjukkan kristalinitas rendah (amorf), sedangkan puncak yang meruncing menunjukkan kristalinitas yang lebih baik.
Nilai d spacing tidak dapat digunakan untuk menentukan jarak interatom dari suatu molekul, namun dapat digunakan untuk merefleksikan jarak interplanar atau jarak interlayer antar kisi-kisi atom dalam satu material. Nilai d spacing sangat tergantung pada pengaturan atom dan struktur jaringan polimer dalam material. Jarak antar interplanar atau interlayer dapat dikalkulasikan melalui persamaan Bragg’s (Park et al., 2004), dinyatakan dengan persamaan berikut:
2 d sin θ = n λ ………...…………...…(13)
Keterangan : d = Jarak interplanar atau interlayer (nm) λ = Panjang gelombang logam standar (nm)
θ = Kisi difraksi sinar X (degree)
lawan 2θ. Nilai d suatu kristal dapat ditentukan dengan hukum Bragg’s, karena λ tetap sesuai dengan logam target penghasil sinar X. Nilai d suatu kristal adalah karakteristik, sehingga difraksi sinar X dapat digunakan untuk analisa kualitatif. Tinggi intensitas dari data difraksi sinar X menggambarkan tingkat kristalinitas dari kristal tersebut. Kristalinitas suatu sampel hasil perlakuan ditentukan dengan membandingkan jumlah intensitas total sampel hasil perlakuan dengan intensitas total sampel sebelum perlakuan.
Suatu zat selalu memberikan pola difraksi yang khas. Apakah zat itu dalam keadaan murni atau merupakan campuran zat. Hal ini merupakan dasar dari analisa kualitatif secara difraksi. Analisa kuantitatif berdasarkan intensitas garis difraksi yang sesuai dengan salah satu komponen campuran bergantung pada perbandingan konstituen tersebut.
Difraksi sinar X sangat penting pada identifikasi senyawa kristalin. Kekuatan dari cahaya yang terdifraksi tergantung pada kuantitas material kristalin yang sesuai di dalam sampel. Oleh karena itu sangat mungkin mendapatkan analisa kuantitatif dari sejumlah relatif konstituen dari campuran senyawa padatan (Ewing, 1960).
Setiap pola bubuk dikarakterisasi oleh kedudukan garis 2θ dan intensitas
B. Kerangka Pemikiran
Titanium dioksida (TiO2) mempunyai energi gap yang lebar dan hanya aktif
dalam cahaya UV, dimana keberadaan cahaya ultraviolet tersebut hanya 10% dari seluruh cahaya matahari yang sampai ke bumi. Keadaan elektronik TiO2 tersebut
dapat diperbaiki dengan modifikasi semikonduktor TiO2 melalui fotosensitisasi oleh
berbagai senyawa organik dan anorganik berwarna (dye). Modifikasi tersebut dapat memperpanjang fotorespon TiO2 ke daerah visibel agar dapat digunakan untuk
degradasi kontaminan organik berwarna dan polutan organik lainnya. Peningkatan kemampuan respon TiO2 terhadap sinar visibel disebabkan oleh keberadaan dye yang
lebih peka terhadap cahaya visibel. Interaksi dye dengan foton (cahaya visibel) menyebabkan eksitasi elektron dye ke pita konduksi TiO2. Eksitasi elektron dengan
cara ini dapat meningkatkan pemisahan elektron dengan hole. Elektron pada pita konduksi TiO2 yang dihasilkan dapat memicu terjadinya reaksi dengan O2 akan
menghasilkan radikal O2.- yang selanjutnya dapat menghasilkan radikal hidroksil.
Radikal hidroksil adalah spesi pengoksidasi kuat yang memiliki potensial redoks sebesar 2,8 V (vs SHE). Potensial sebesar ini cukup kuat untuk mengoksidasi kebanyakan zat organik menjadi air, asam mineral dan karbondioksida.
Penggunaan TiO2 serbuk di dalam cairan untuk medegradasi senyawa-senyawa
organik kurang efisien karena serbuk yang telah terdispersi dalam air sangat sulit diregenerasi. Selain itu bila campuran terlalu keruh maka radiasi dari cahaya yang digunakan tidak mampu mengaktifkan seluruh partikel fotokatalis. Pembuatan lapis tipis TiO2 pada suatu substrat ITO memungkinkan sebagai fotoanoda atau fotokatoda
karena ITO bersifat konduktif sehingga dapat mengantarkan arus pada proses degradasi fotoelektrokatalitik.
mendorong akumulasi elektron yang tereksitasi oleh cahaya pada dye ke pita konduksi TiO2. Sehingga reaksi degradasi terjadi secara fotoreduksi pada permukaan
semikonduktor yang tersensitisasi dye.
Proses degradasi fotoelektrokatalitik selain dipengaruhi oleh pemberian beda potensial juga dipengaruhi oleh lamanya waktu penyinaran, pH larutan awal zat warna, dan konsentrasi dari elektrolit. Semakin lama penyinaran memungkinkan semakin banyak elektron yang tereksitasi, sehingga meningkatkan aktivitas fotokatalis pada permukaan semikonduktor. Selain itu efek pH dapat mempengaruhi bentuk struktur zat warna Rhodamin B. Pada pH relatif rendah (pH asam) Rhodamin B sebagai bentuk kation sedangkan pada pH mendekati 7 struktur Rhodamin B dalam bentuk zwitter ion. Perbedaan struktur Rhodamin B akan mempengaruhi kemampuan TiO2/dye untuk medegradasi Rhodamin B. Konsentrasi elektrolit juga berpengaruh
pada proses degradasi fotoelektrokatalitik. Kemungkinannya semakin besar konsentrasi elektrolit NaCl maka semakin cepat proses degradasinya karena semakin banyak jumlah partikel pembawa muatan. Namun akan optimum pada titik tertentu karena adanya ion Cl- yang dapat menempel/medekat pada permukaan TiO2 sehingga
dapat menutupi permukaan dan mengganggu proses degradasi.
C. Hipotesis
Berdasarkan tinjauan pustaka dan masalah yang ada, maka dapat diajukan hipotesis berikut ini:
1. Dye (kompleks Fe(bpy)x(dcbq)y(phe)z) dapat mensensitisasi TiO2 sehingga material
ITO/TiO2/dye memiliki respon terhadap cahaya visibel.
3. Lama waktu penyinaran sinar visibel berpengaruh terhadap degradasi fotoelektrokatalitik Rhodamin B, semakin lama waktu penyinaran maka semakin besar degradasi Rhodamin B.
4. pH larutan awal berpengaruh terhadap struktur Rhodamin B sehingga mempengaruhi proses degradasi fotoelektrokatalitik Rhodamin B.
BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Metode penelitian yang dilakukan adalah metode eksperimen yang dilakukan di laboratorium untuk menjelaskan proses degradasi fotoelektrokatalitik Rhodamin B pada elektroda ITO/TiO2/dye (dye = kompleks Fe(bpy)x(dcbq)y(phe)z)
menggunakan sumber radiasi visibel yang diperoleh dari lampu halogen 150 watt.
Parameter yang diteliti adalah fase kristal dari TiO2, spektra elektronik dye dan
ITO/TiO2/dye, besar absorbansi pada sampel sebelum dan setelah diberikan
perlakuan.
B. Tempat dan Waktu Penelitian
Eksperimen penelitian dilakukan di Laboratorium Kimia Dasar Fakultas FMIPA UNS, dan Laboratorium Fisika Material Fakultas FMIPA UNS. Analisis UV-Vis dan XRD di lakukan di Laboratorium MIPA Terpadu Fakultas FMIPA UNS. Penelitian dilakukan mulai 10 Agustus 2011 – 18 April 2012.
C. Alat dan Bahan
1. Alat-alat yang digunakan a. Peralatan Gelas dari Pyrex dan Duran
b. Fotoreaktor dengan sumber radiasi visibel (lampu halogen 150 Watt) c. Spektrofotometer UV-Vis Perkin Elmer Lamda 25
d. Spektrofotometer X-Ray Diffraction Bruker AXS D8 Advance
e. Sanwa Multimeter Digital CD 751 (skala µA (dua angka di belakang koma), mV
f. Oven memmert
g. Thermolyne Furnace 48000 (maksimal temperatur 1000 ˚C)
h. Neraca Analitik Sartorius BP 110 (maks : 110 g; min : 0,001 g) i. Magnetik Stirrer
j. Spatula k. Stopwatch
l. Thermometer alkohol 100 0C m. Hot plate
n. Waterbath
o. pH meter Walklab T19000 p. Sonikator
q. Kawat tembaga
r. Gelas konduktif indium thin oxide (ITO)
2 Bahan-bahan yang digunakan a. Titanium Tetra Isopropoksida (TTIP) p.a. (Merck) b. 2,2’-biquinoline-4,4’-dicarboxylic acid (Merck) c. Phenanthroline (Merck)
d. 2,2’-bipyridin (Merck)
D. Prosedur Penelitian
1. Sintesis TiO2
Titanium isopropoksida (TTIP) sebanyak 10 ml dihidrolisis dengan larutan asam asetat sebanyak 100 ml di dalam waterbath (±10 - 15 oC) pada pH 2. Larutan tersebut
kemudian distirer hingga terbentuk campuran TiO2 transparan (bening) selanjutnya
dipanaskan pada suhu maksimum 90 oC hingga membentuk gel TiO2. Setelah
didinginkan sampai dengan suhu kamar, gel yang diperoleh dioven pada suhu 150 oC selama ±24jam (overnight) hingga berbentuk xerogel TiO2 berwarna putih. Kemudian
dikalsinasi 400 oC dengan kecepatan 10 oC/menit untuk optimasi perolehan fase nanokristalin anatase (Wahyuningsih dkk, 2007). Foto eksperimen sintesis TiO2
terlampir pada Lampiran 2.
2. Sintesis Dye (Kompleks Fe(bpy)x(dcbq)y(phen)z)
Larutan dye yang digunakan merupakan kompleks dari Fe dengan ligan 2,2’-bipyridin; 2,2’-biquinoline-4,4’-dicarboxylic acid dan phenanthroline dengan perbandingan (1:2:1:2).10-3M dalam pelarut DMSO/etanol (1:20) ml. Larutan dye ini
dibuat dengan cara larutan Fe ditetesi dengan ligan. Kemudian larutan tersebut distirer selama 3 hari hingga berwarna orange tua (Thummel, 2007). Foto eksperimen sintesis dye terlampir pada Lampiran 2.
3. Preparasi Elektroda Lapis Tipis ITO/TiO2
Pembuatan elektroda lapis tipis ITO/TiO2 (1 x 1 cm) dilakukan dengan cara:
mencampurkan 0,5 gram TiO2 yang telah dihaluskan kedalam 2,1 ml etanol.
suhu 200 oC selama 10 menit, untuk menguapkan etanol (Nuryadi, 2011). Foto
eksperimen preparasi lapis tipis ITO/TiO2 terlampir pada Lampiran 2.
4. Preparasi Elektroda (ITO/TiO2/dye)
Plat ITO/TiO2 yang telah dibuat di sensitisasi dengan cara merendam plat
ITO/TiO2 kedalam larutan dye selama ±24 jam (Maddu, 2007). Foto eksperimen
preparasi elektroda ITO/TiO2/dye terlampir pada Lampiran 2.
5. Karakterisasi a. Material TiO2
Karakterisasi TiO2 dilakukan untuk menentukan fase kristal dengan
menggunakan sinar-x pada 2θ = 20 s/d 60 o. Fase kristal TiO
2 hasil sintesis dapat
diketahui berdasarkan difraktogram XRD. Munculnya puncak serapan karakteristik dibandingkan dengan difraktogram standar.
b. Dye (Kompleks (bpy)x(dcbq)y(phen)z)
Larutan dye hasil sintesis dianalisa dengan spektrofotometer UV-Vis untuk mengetahui respon senyawa dye terhadap cahaya visibel.
c. Elektroda (ITO/TiO2/dye)
Karakterisasi material ITO/TiO2/dye dianalisa dengan menggunakan
spektrofotometer UV-Vis untuk mengetahui respon terhadap cahaya visibel.
6. Pengukuran Proses Degradasi Fotoelektrokatalitik
Eksperimen pengukuran degradasi fotoelektrokatalitik dilakukan dengan one compartement yang dapat dilewati oleh elektrolit NaCl, dimana elektroda ITO/TiO2/dye dan Cu berada dalam satu wadah. Potentiostat digunakan untuk
Cara pengukuran degradasi fotoelektrokatalitik substrat (Rhodamin B) dilakukan dengan menyiapkan larutan substrat (5 ppm) kemudian diberi voltase melalui elektroda ITO/TiO2/dye dan logam Cu dengan variasi (-1; -0,8; -0,6; -0,4; -0,2; 0; 0,2;
0,4; 0,6; 0,8; 1; volt), variasi waktu (0,5; 1; 2; 3; 4 jam), variasi pH (3, 4, 5, 6, 7, 8, 9, 10, dan 11) dan variasi konsentrasi larutan elektrolit NaCl (0; 0,05; 0,5; 1; 2; 3; 4 dan 5 M). Kemudian dianalisis melalui spektrofotometer UV Vis. Foto alat degradasi fotoelektrokatalitik terlampir pada Lampiran 2.
E. Teknik Pengumpulan dan Analisa Data
1. Pengumpulan Data
Karakterisasi material TiO2 dilakukan dengan menggunakan X-Ray Diffraction.
Nilai d spacing TiO2 yang didapat dari rumus hukum Bragg untuk mengidentifikasi
sistem kristal TiO2 hasil sintesis. Panjang gelombang maksimal larutan dye dan
material ITO/TiO2/dye dilakukan untuk mengetahui respon terhadap cahaya visibel.
Data absorbansi sebelum dan sesudah perlakuan untuk menerangkan proses degradasi fotoelektrokatalitik melalui variasi voltase, waktu, pH dan konsetrasi larutan elektrolit NaCl.
2. Analisa Data
Pola difraksi sinar X dari TiO2 dianalisa secara kualitatif dengan
membandingkan harga 2θ dari difraktogram TiO2 hasil sintesis dengan difaktogram
JCPDS (Joint Commite Powder Difraction Standart). Munculnya puncak-puncak dengan hkl dominan TiO2 pada difraktogram sama dengan difraktogram JCPDS
Karakterisasi pergeseran respon panjang gelombang dye dan ITO/TiO2/dye ke
daerah visibel dilakukan dengan spektrofotometer UV-Vis.
BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis dan Karakterisasi Titanium Dioksida (TiO2)
Sintesis material TiO2 mengacu pada penelitian Wahyuningsih (2007) dengan
menggunakan metode sol-gel. Proses sol-gel diawali dengan proses hidrolisis dan kondensasi pada suhu rendah. Proses hidrolisis dilakukan dengan pelarutan secara lambat terhadap prekusor sedangkan proses kondensasi terjadi pembentukan sol dari TiO2. Kemudian sol tersebut mengalami proses aging melalui pemanasan untuk
menguapkan pelarut, sehingga sol tersebut berubah menjadi gel yang kaku. Selanjutnya dilakukan perlakuan termal untuk menghasilkan kristal serta untuk membersihkan material dari pengotor. Perlakuan termal ini hasilnya disebut sebagai xerogel.
Dalam sintesis TiO2 ini menggunakan prekusor Titanium Tetra Isopropoksida
(TTIP) yang dihidrolisis dengan asam asetat glasial berlebih pada pH 2. Proses ini dilakukan dalam waterbath (10 - 15 oC) supaya tidak terjadi aglomerasi pada TTIP.
Campuran tersebut kemudian dihomogenkan dengan pengadukan menggunakan stirrer dan dilanjutkan pemanasan sampai maksimal pada suhu 90 oC untuk membentuk suspensi sol gel dengan penguapan asam asetat pada campuran tersebut. Untuk menghilangkan pengotor-pengotor organik dan sisa pelarut dilakukan pemanasan selama 24 jam pada suhu 150 oC. Hasil sintesis ini kemudian diberikan perlakuan kalsinasi pada suhu 400 oC secara bertahap dengan laju pemanasan 10
oC/menit selama 2 jam untuk membentuk kristal TiO
2 anatase. Spesifikasi TiO2 yang
dihasilkan sebagai berikut: berwarna putih, berbentuk bongkahan, tidak berbau, dengan berat 6,703 gram.
Reaksi secara keseluruhan dari sintesis TiO2 dengan bahan awal TTIP dapat
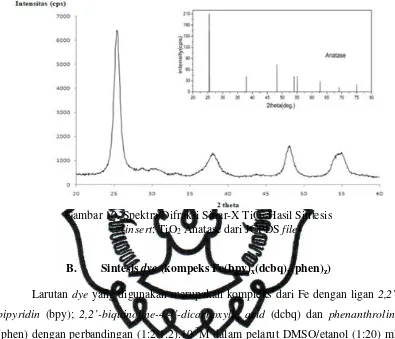
Analisa kristalinitas TiO2 dilakukan dengan difraksi sinar X menggunakan
radiasi Cu kα (λ = 1,54060 Å). Analisa dengan XRD merupakan salah satu teknik untuk identifikasi TiO2 secara kualitatif sebab pola XRD dari partikel TiO2 dapat
digunakan sebagai sidik jari. Selain itu analisis ini mampu memberikan informasi mengenai kemurnian fase dan kristalinitasnya. Puncak-puncak spesifik milik TiO2
hasil sintesis dibandingkan dengan data dari JCPDS (Joint Commite Powder Diffraction Standart). Pola difraksi TiO2 ditunjukkan Gambar 10 dengan adanya
puncak-puncak yang muncul pada sudut difraksi (2θ) tertentu. Difraktogram
menunjukkan bahwa TiO2 hasil sintesis, sudah berfase kristalin karena peak yang
dihasilkan meruncing serta mempunyai fase anatase murni karena tidak ada peak lain yang muncul diluar peak JCPDS TiO2 anatase. Hal ini diperkuat dengan
puncak-puncak dominan pada 2θ = 25,351o (d
101 = 3,514 Å), 2θ = 37,903o (d004 = 2,374 Å);
2θ = 48,105o (d
200 = 1,892 Å); 2θ = 54,156o (d105 = 1,694 Å) 2θ = 54,957o (d211 =
1,671 Å) yang merupakan daerah karakteristik TiO2 anatase sesuai dengan data
Gambar 10. Spektra Difraksi Sinar-X TiO2 Hasil Sintesis
(insert: TiO2 Anatase dari JCPDS file)
B. Sintesis dye (kompeks Fe(bpy)x(dcbq)y(phen)z)
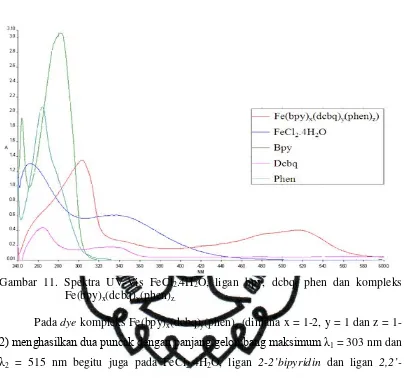
Larutan dye yang digunakan merupakan kompleks dari Fe dengan ligan
Gambar 11. Spektra UV-Vis FeCl2.4H2O, ligan bpy, dcbq, phen dan kompleks
Fe(bpy)x(dcbq)y(phen)z.
Pada dye kompleks Fe(bpy)x(dcbq)y(phen)z (dimana x = 2, y = 1 dan z =
1-2) menghasilkan dua puncak dengan panjang gelombang maksimum λ1 = 303 nm dan
λ2 = 515 nm begitu juga pada FeCl2.4H2O, ligan 2-2’bipyridin dan ligan
2,2’-biquinoline-4,4’dicarboxylic acid sedangkan pada ligan phenanthroline hanya memiliki satu panjang gelombang maksimum seperti yang ditunjukkan pada Tabel 2.
Tabel 2. Panjang Gelombang Maksimum FeCl2.4H2O, Ligan Bpy, Ligan Dcbq, Ligan
Phen dan Dye (Kompleks Fe(bpy)x(dcbq)y(phen)z)
No Senyawa λ1 (nm) λ2 (nm)
1. FeCl2.4H2O 252 332
2. 2,2’-bipyridin (bpy) 244 281
3. 2,2’-biquinoline-4,4’-dicarboxylic acid (dcbq) 265 330
4. Phenanthroline (phen) 264 -
Pada λ1dye memiliki puncak pada panjang gelombang 303 nm dan terjadi
pergeseran panjang gelombang ke arah yang lebih besar (Batokromik) dari logam dan ligan-ligannya yaitu dari 252 nm (FeCl2.4H2O), 244 nm (bpy), 265 nm (dcbq) dan
264 nm (phen) menjadi 303 nm. Pergeseran ini diperkirakan terjadinya transisi intra ligand (*) akibat penyerapan energi oleh elektron-elektron π dari orbital bonding ke orbital nonbonding. Pergeseran batokromik yang terjadi pada ligan menunjukkan terjadinya konjugasi yang menyebabkan energi antara orbital bonding dan orbital nonbonding semakin kecil sehingga diperoleh panjang gelombang yang lebih besar.
Selain itu pada λ1dye juga terjadi pergeseran batokromik dari Pada λ2dye
menunjukkan puncak melebar dengan panjang gelombang maksimum 515 nm dan terjadi pergeseran panjang gelombang ke arah yang lebih besar (Batokromik) dari logamnya yaitu dari 332 nm menjadi 515 nm. Pergeseran batokromik diperkirakan terjadinya transisi metal to ligand charge transfer (MLCT) yang karakteristik memiliki intensitas yang lebih tinggi dibandingkan transisi d-d. Seperti pada penelitian Cho et al. (2001) yang mengatakan bahwa kompleks (RuII(bpy-COOH)2)32+ mengalami pelebaran pita absorbansi pada 467 nm menunjukkan
interaksi charge transfer (MLCT) dalam kompleks.
C. Sensitisasi ITO/TiO2/dye
Pembuatan lapis tipis TiO2 pada kaca ITO untuk memudahkan pemisahan
semikonduktor dari larutan yang akan didegradasi dan dapat diregenerasi. Kemudian dilakukan sensitisasi pada lapis tipis ITO/TiO2 dengan senyawa kompleks sensitiser
Fe(bpy)x(dcbq)y(phen)z (disebut sebagai dye) selama ±24 jam. Hasilnya menunjukkan
adanya perubahan warna dari lapis tipis ITO/TiO2 dari putih menjadi merah muda.
Karakterisasi dari lapis tipis ITO/TiO2/dye menggunakan spektrofotometer
sedangkan pada ITO/TiO2/dye memiliki puncak pada panjang gelombang maksimum
516 nm dari dye yang mempunyai serapan 515 nm.
Gambar 12. Spektra UV-Vis padat lapis tipis ITO/TiO2/dye
Pada lapis tipis ITO/TiO2/dye memiliki respon pada daerah visibel yang lebar
yang dimungkinkan karena interaksi charge transfer (terjadi MLCT) yang merupakan hasil respon dari dye pada permukaan oksida. Pengamatan hasil spektra ini relevan dengan hasil penelitian Cho et al. (2001) yang telah menunjukkan pelebaran pita absorbsi setelah penambahan senyawa kompleks sensitiser. Pelebaran pita absorbansi ini bermanfaat dalam memperluas fotorespon dari TiO2/dye. Fotorespon TiO2/dye di
daerah visibel memungkinkan penggunaan TiO2/dye sebagai material fotokatalis di
daerah visibel.
D. Degradasi Fotoelektrokatalitik Rhodamin B
satu wadah dengan elektroda kerja ITO/TiO2/dye. Potentiostat digunakan untuk
mengatur voltase yang dikenakan ke elektroda kerja. Lampu halogen 150 watt digunakan sebagai sumber energi foton. Proses degradasi fotoelektrokatalitik Rhodamin B dilakukan beberapa variasi yaitu variasi voltase, variasi waktu penyinaran, variasi pH dan variasi konsentrasi elektrolit NaCl.
1. Degradasi Fotoelektrokatalitik Rhodamin B dengan Variasi Voltase
Variasi voltase yang diberikan yaitu -1; -0,8; -0,6; -0,4; -0,2; 0; 0,2; 0,4; 0,6; 0,8; 1; volt dan hasil degradasi fotoelektrokatalitik Rhodamin B untuk masing-masing bias potensial ditunjukkan pada Gambar 13.
Gambar 13. Hasil Degradasi Fotoelektrokatalitik Rh B dengan Variasi Voltase (waktu 3 jam, [NaCl] = 0,05M dan [Rhodamin B] = 5 ppm)
a. Potensial Bias Positif
Pemberian potensial bias positif (Gambar 14) pada lapis tipis TiO2
menyebabkan pengurangan rekombinasi elektron dan hole, tetapi juga dapat memisahkan elektron dari pita konduksi pada proses oksidasi dan juga dapat dan memisahkan sisi oksidasi dan reduksi. Aplikasi pemberian potensial anodik pada permukaan elektroda TiO2 yang dicelupkan didalam air (larutan Rhodamin B)
mengurangi tingkat energi ferminya, sehingga menghasilkan medan listrik didekat interface pada daerah yang disebut lapisan deplesi. Level fermi (Ef) merupakan level transisi yang tempatnya sedikit di pita konduksi. Setiap elektron yang dipromosikan sebagai akibat tereksitasi oleh cahaya maupun penambahan potensial bias eksternal di daerah lapisan deplesi akan dipercepat bergerak dari TiO2 yang selanjutnya dialirkan
ke elektroda counter melalui sirkuit eksternal. Sebaliknya, h+ yang dihasilkan disekitar lapisan deplesi akan dipercepat ke permukaan sebelum berekombinasi di dalam semikonduktor. Oleh karena itu, adanya medan listrik secara signifikan dapat meningkatkan pemisahan muatan sehingga meningkatkan pembentukan radikal hidroksil. Fenomena ini disebut sebagai efek peningkatan akibat medan listrik (electric field enhancement effect) (Gunlazuardi, 2001).
Reaksi yang mungkin terjadi pada pemberian potensial bias positif:
Katoda (Cu): Rh B+ e- → Rh B-
2H2O + 2e- → H2 + 2OH- Eo = -0,83 V
4H+ + 4e- → 2H2 Eo = 0 V
Anoda (TiO2): Rh B → Rh B+ + e
2H2O → O2 + 4H+ + 4e- Eo = -0,83 V
TiO2 → e-cb + h+vb Eo = -1 V
Terjadi reaksi fotosensitisasi:
dye + h → dye*
dye* + TiO2→ dye· + e-cb (TiO2)
Potensial bias positif lebih efektif menurunkan konsentrasi Rhodamin B daripada bias negatif. Kemungkinannya bahwa mekanisme degradasi Rhodamin B dengan pemberian potensial bias positif mengikuti mekanisme dengan eksitasi sensitiser dye (kompleks Fe(bpy)x(dcbq)y(phen)z). Pada pemberian potensial bias
positif, elektroda ITO/TiO2/dye berperan sebagai photoanoda, maka iluminasi cahaya
visibel dapat mengeksitasi elektron dari sensitiser dye, yang selanjutnya dapat diinjeksikan ke conducting band dari TiO2. Elektron pada conducting band ini (e-cb)
segera bereaksi dengan O2 menghasilkan radikal O2·
-O2 + e-cb O2·
-Selanjutnya O2·- bereaksi intensif dengan Rhodamin B yang mendekat ke anoda
(elektroda ITO/TiO2/dye). Reaksi fotosensitisasi oleh iluminasi cahaya visibel (lampu
halogen) ke photoanoda ITO/TiO2/dye kemungkinan mengikuti tahap – tahap berikut
dye hv dye* menghasilkan elektron dan h+ (hole). Dimana h+ vb dapat menginisiasi reaksi oksidasi dan dilain pihak e-cb akan menginisiasi reaksi reduksi pada permukaan semikonduktor. Mekanisme reaksi reduksi-oksidasi yang terjadi adalah h+vb dapat mengoksidasi air atau gugus hidroksil pada Rhodamin B yang teradsorb pada permukaan dan di lain pihak, e-cb dapat mereduksi oksigen yang terabsorb untuk membentuk anion radikal superoksida dan hidroksiperoksida. Sehingga h+ vb dan e-cb dapat menghasilkan radikal hidroksil (OH.) yang merupakan spesi pengoksidasi kuat (2,8 V vs SHE) untuk mengoksidasi kebanyakan zat organik menjadi air, asam mineral dan karbon dioksida (Gunlazuardi, 2001). Mekanisme reaksi yang terjadi mengikuti tahap-tahap berikut seperti yang telah dikemukakan oleh Indri Apriyani (2007):
Kemudian selain adanya reaksi fotosensitisasi dan oksidasi TiO2 secara
(katoda) atau mungkin pada elektroda ITO/TiO2/dye (anoda) sehingga meningkatkan
penurunan konsentrasi Rhodamin B pada sistem.
b. Potensial Bias Negatif
Pemberian potensial bias negatif (Gambar 15) kurang efektif menurunkan konsentrasi Rhodamin B dibandingkan dengan potensial bias positif dimungkinkan mekanisme reaksinya tidak mengikuti eksitasi sensitiser dye (kompleks Fe(bpy)x(dcbq)y(phen)z). Karena elektroda ITO/TiO2/dye difungsikan sebagai katoda
yang mengalami reaksi reduksi dan kondisi ini sangat tidak mendukung proses eksitasi dye. Penurunan konsentrasi Rhodamin B dimungkinkan terjadi karena mendekatnya Rhodamin B di sekitar elektroda ITO/TiO2/dye (katoda) atau mungkin
pada elektroda Cu (anoda) sehingga terjadi penurunan konsentrasi Rhodamin B pada sistem.
Gambar 15. Skema Degradasi Fotoelektrokatalitik dengan Potensial Bias Negatif
Reaksi yang mungkin terjadi pada pemberian potensial bias negatif:
Anoda (Cu): Rh B → Rh B++e-
2H2O → O2 + 4H+ + 4e- Eo = -0,83 V
Cu → Cu2+ + 2e- Eo = 0,34 V
Katoda (TiO2): Rh B+ e - → Rh B-
4H2O + 4e- → 4H2 + 4OH- Eo = -0,83 V
2. Degradasi Fotoelektrokatalitik Rhodamin B dengan Variasi Waktu
Variasi waktu yang digunakan adalah 0,5; 1; 2; 3; 4 jam dan hasil degradasi fotoelektrokatalitik Rhodamin B untuk masing-masing waktu ditunjukkan oleh Gambar 16.
Gambar 16. Hasil Degradasi Fotoelektrokatalitik Rh B dengan Variasi Waktu ([Rhodamin B] = 5 ppm, [NaCl] = 0,05 M, dan Voltase = 1V)
Pada Gambar 16 terlihat bahwa pemberian waktu penyinaran sinar visibel berpengaruh terhadap degradasi Rhodamin B dimana semakin lama waktu penyinaran maka harga A/Ao semakin kecil. Jika harga A/Ao kecil artinya semakin banyak penurunan konsentrasi Rhodamin B. Karena semakin lama penyinaran sinar visibel, foton yang diberikan juga semakin banyak sehingga elektron terus tereksitasi yang berperan dalam aktivitas degradasi fotoelektrokatalitik Rhodamin B.
Menurut penelitian Gudtavvson dan Schuler (2010) terjadinya degradasi Rhodamin B oleh fotokatalis TiO2 dapat diamati pada panjang gelombang maksimum
Gambar 17. Spektra Degradasi Fotoelektrokatalitik Rh B pada Variasi Waktu ([Rhodamin B] = 5 ppm, [NaCl] = 0,05 M, dan Voltase = 1V)
3. Degradasi Fotoelektrokatalitik Rhodamin B dengan Variasi pH
Variasi pH larutan awal yang digunakan adalah 3, 4, 5, 6, 7, 8, 9, 10, 11 dan hasil degradasi fotoelektrokatalitik Rhodamin B untuk masing-masing pH ditunjukkan oleh Gambar 18.
Pada Gambar 18 terlihat bahwa pH larutan awal ternyata berpengaruh terhadap degradasi Rhodamin B dimana semakin ekstrim pH maka harga A/Ao semakin kecil. Jika harga A/Ao kecil artinya semakin banyak penurunan konsentrasi Rhodamin B, karena efek pH mempengaruhi struktur Rhodamin B . Beberapa bentuk struktur Rhodamin B:
a. Bentuk kationik
Struktur Rhodamin B bentuk kationik (bermuatan positif pada N dari gugus =N(Et)2) seperti yang ditunjukkan oleh Gambar 19 dimungkinkan terjadi pada pH
relatif rendah (pH <7).
Gambar 19. Struktur Rhodamin B Bentuk kationik
Reaksi yang mungkin terjadi:
Anoda (TiO2): 2H2O → O2 + 4H+ + 4e- Eo = -0,83 V
TiO2 → e-cb + h+vb Eo = -1 V
Terjadi reaksi fotosensitisasi: dye + h → dye*
dye* + TiO2 → dye· + e-cb(TiO2)
Katoda (Cu): Rh B+ + e- → Rh B
2H2O + 2e-→ H2 + 2OH- Eo = -0,83 V
4H+ + 4e- → 2H
2 Eo = 0 V
Dimungkinkan reaksi degradasi Rhodamin B yang terjadi melalui mekanisme eksitasi sensitiser dye seperti yang ditunjukkan pada persamaan 6 – 11. Serta adanya reaksi oksidasi TiO2 secara elektrokimia seperti yang pada persamaan 12 – 16
B. Selain itu adanya reaksi samping yaitu mendekatnya Rh+ pada elektroda Cu sehingga terjadi pengurangan konsentrasi Rhodamin B pada pH <7 relatif lebih besar dibandingkan bentuk zwitter ion.
b. Bentuk zwitter ion
Struktur Rhodamin B bentuk zwitter ion (Gambar 20) dimungkinkan terjadi pada pH = 7 – 9.
Gamabar 20. Struktur Rhodamin B Bentuk Zwitter Ion
Reaksi yang mungkin terjadi: Anoda (TiO2): Rh B → Rh B+ + e
2H2O → O2 + 4H+ + 4e- Eo = -0,83 V
TiO2 → e-cb + h+vb Eo = -1 V
Terjadi reaksi fotosensitisasi: dye + h → dye*
dye* + TiO2 → dye· + e-cb(TiO2)
Katoda (Cu): Rh B + e- → Rh B
2H2O + 2e-→ H2 + 2OH- Eo = -0,83 V
4H+ + 4e- → 2H2 Eo = 0 V
Dimungkinkan reaksi degradasi Rhodamin B yang terjadi melalui mekanisme eksitasi sensitiser dye seperti yang ditunjukkan pada persamaan 6 - 11. Selain itu adanya reaksi oksidasi TiO2 secara elektrokimia yang dapat menghasilkan e-cb dan
h+vb yang dapat memicu reaksi degradasi Rhodamin B melalui reaksi seperti yang
dominan kationik atau anionik sehingga penurunan konsentrasi Rhodamin B zwitter ion menjadi lebih kecil dibanding bentuk kationik atau anionik.
c. Bentuk anionik
Struktur Rhodamin B bentuk anionik (Gambar 21) karena pelepasan gugus etil yang dipicu oleh basa (N-deethylation) kemungkinan banyak terdapat pada pH sangat basa (pH >9).
Gambar 21. Struktur Rhodamin B Bentuk Anionik
Reaksi yang mungkin terjadi: Anoda (TiO2): Rh B-→ Rh B+ e
2H2O → O2 + 4H+ + 4e- Eo = -0,83 V
TiO2 → e-cb + h+vb Eo = -1 V
Terjadi reaksi fotokatalis TiO2/dye:
dye + h → dye*
dye* + TiO2 → dye· + e-cb(TiO2)
Katoda (Cu): 2H2O + 2e- → H2 + 2OH- Eo = -0,83 V
4H+ + 4e- → 2H
2 Eo = 0 V
Dimungkinkan reaksi degradasi Rhodamin B yang terjadi melalui mekanisme eksitasi sensitiser dye seperti yang ditunjukkan pada persamaan 6 - 11. Dan reaksi oksidasi TiO2 secara elektrokimia yang dapat menghasilkan e-cb dan h+vb yang dapat
memicu reaksi degradasi Rhodamin B melalui tahap-tahap reaksi seperti yang ditunjukkan pada persamaan 12 - 16. Serta adanya reaksi samping yaitu mendekatnya
Rh- pada anoda (elektroda ITO/TiO2/dye) sehingga terjadi pengurangan konsentrasi
4. Degradasi Fotoelektrokatalitik Rhodamin B dengan Variasi Konsentrasi NaCl Variasi konsentrasi larutan elektrolit NaCl yang digunakan adalah 0; 0,05; 0,5; 1; 2; 3; 4; 5 M dan hasil degradasi fotoelektrokatalitik Rhodamin B untuk masing-masing konsentrasi NaCl ditunjukkan oleh Gambar 22.
Gambar 22. Hasil Degradasi Fotoelektrokatalitik Rh B dengan Variasi [NaCl] ([Rhodamin B] = 5 ppm, voltase = 1 V, waktu = 3 jam)
Dari Gambar 22. terlihat bahwa semakin besar konsentrasi larutan elektrolit maka harga A/Ao semakin kecil namun mempunyai titik optimum pada konsentrasi 3M. Jika harga A/Ao kecil artinya semakin banyak penurunan konsentrasi Rhodamin B, karena semakin banyak Rhodamin B yang didegradasi dimungkinkan karena semakin banyak jumlah partikel pembawa muatan sehingga proses degradasi Rhodamin B semakin cepat. Namun jika larutan elektrolit tersebut semakin pekat maka pembawa muatan tersebut tidak dapat bergerak bebas sehingga mempengaruhi proses degradasi fotoelektrokatalitik Rhodamin B. Selain itu adanya ion Cl- yang
bermuatan negatif sehingga dapat mendekat dan menutupi elektroda ITO/TiO2/dye.
Akibatnya dengan semakin bertambahnya konsentrasi NaCl maka semakin banyak ion Cl- yang menutupi permukaan TiO