Abstrak—Khamir (yeast) merupakan kelompok jamur basidiomycetes dan ascomycetes yang mempunyai karakteristik yang unik dan bersifat uniseluler. Praktikum ini bertujuan untuk mengetahui teknik isolasi dan identifikasi khamir. Praktikum dilaksanakan pada bulan Oktober-Desember 2014 di Laboratorium Mikrobiologi dan Bioteknologi, Jurusan Biologi ITS. Isolasi khamir dilakukan dengan sampling menggunakan metode komposit dari daerah Rawa Hutan Kampus ITS. Identifikasi khamir dilakukan dengan mengamati karakteristik makroskopis dan mikroskopis, uji fermentasi gula dan uji urease. Hasil praktikum menunjukkan bahwa isolat uji diduga merupakan genus Debaryomyces spp. yang mempunyai ciri-ciri multilateral budding, berbentuk bulat hingga ovoid, terbentuk askospora dan dapat memfermentasi gula
Kata Kunci—Debaryomyces spp., identifikasi, isolasi, morfologi, fisiologi.
I. PENDAHULUAN
hamir atau yeast merupakan kelompok polifiletik jamur basidiomycota dan ascomycota yang mempunyai karakteristik yang unik dan bersifat uniseluler. Ada sekitar 100 genera dan 800 spesies yeast yang sudah diketahui dan diperkirakan angka ini hanya mewakili sekitar 1% dari spesies yang terdapat di alam, sisanya tidak dapat dikultur ( non-culturable). Yeast tersebar dalam jumlah yang banyak di lingkungan akuatik seperti laut, estuaria, danau dan sungai [1]. Kepadatan relatif yeast yang relatif tinggi (> 2000 viable cells/g) telah dilaporkan ditemukan pada sedimen laut. Selain di perairan, khamir juga ditemukan didaerah terestrial, beberapa studi melaporkan bahwa keberadaan yeast lebih melimpah pada tanah berlumpur daripada sedimen berpasir [2].
Penelitian mengenai keragaman khamir tanah telah banyak dilakukan oleh beberapa peneliti sebelumnya yang telah mengisolasi khamir dari berbagai variasi tipe ekosistem tanah seperti pada daerah antartika, gurun dan hutan sub tropika. Akan tetapi belum banyak peneliti yang melaporkan keragaman khamir yang hidup pada tanah di daerah tropis [3]. Indonesia merupakan negara yang terletak di daerah tropis dengan kelimpahan keanekaragaman hayati berupa keanekaragaman flora, fauna dan mikroorganisme [4].
Keberadaan mikroorganisme khamir di tanah tidak
begitu tinggi jika dibandingkan dengan bakteri dan jamur benang [5].
Akhir – akhir ini, karakteristik utama yang digunakan untuk klasifikasi khamir adalah karakter morfologi, fisiologi dan biokimia [6]. Identifikasi untuk mengetahui nama genus atau spesies khamir dapat dilakukan dengan pengamatan morfologi (morfologi koloni dan sel), uji fisiologis dan biokimia [7]. Pengamatan morfologi merupakan dasar utama yang digunakan untuk melakukan identifikasi dan klasifikasi khamir yaitu dengan pengamatan morfologi sel (pembentukan askospora, morfologi sel vegetatif, reproduksi aseksual, ada tidaknya produksi miselium sejati, pseudomiselium, ciri koloni, dan ciri pertumbuhan pada media cair) [8]. Berdasarkan hal tersebut maka perlu dilakukan penelitian tentang isolasi dan identifikasi khamir berdasarkan karakteristik morfologi dan fisiologisnya. Praktikum ini bertujuan untuk mengetahui teknik isolasi dan cara identifikasi khamir.
II. METODOLOGI
A. Waktu dan Lokasi
Praktikum ini dilaksanakan pada bulan Oktober – Desember 2014 di Laboratorium Mikrobiologi dan Bioteknologi, Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Teknologi Sepuluh Nopember, Surabaya.
B. Alat dan Bahan
Alat yang digunakan pada praktikum ini adalah neraca analitik, spatula, cawan Petri, tabung reaksi, rotary shaker, autoclave, erlenmeyer, pipet tetes, gelas objek, gelas penutup, bak tinta, Laminar Air Flow, batang U, water bath, bunsen, aluminium foil, sumbat, kertas saring, gelas ukur, gelas beker, jarum ose dan mikroskop.
Bahan yang digunakan dalam praktikum ini adalah tanah dari Rawa Hutan Kampus ITS, isolat yeast koleksi Laboratorium Mikrobiologi dan Bioteknologi, Biologi ITS, alkohol, spiritus, aluminium foil, akuades, larutan NaCl, kloramfenikol, safranin, malachitte green, lactophenol cutton blue, medium Yeast Malt Extract Agar, medium uji fermentasi glukosa, medium urea broth, dan medium corn meal agar.
Isolasi dan Identifikasi Khamir Berdasarkan
Karakteristik Morfologi dan Fisiologis
Dwi Wahyu Intani (1511100063)
Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan alam, Institut Teknologi Sepuluh
Nopember (ITS)
Jl. Arief Rahman Hakim, Surabaya 60111 Indonesia
: intan@mhs.bio.its.ac.id
C. Cara Kerja
Pengambilan Sampel Tanah
Pengambilan sampel tanah dilakukan di daerah Rawa Hutan Kampus ITS. Sampel diambil secara komposit yaitu pada keterwakilan ekosistem di rizhosfer tanah rawa Hutan Kampus dengan pengambilan pada 8 titik secara acak. Kemudian sampel tanah dimasukkan ke dalam satu plastik ziplock dan dicampur hingga homogen. Sampel tanah diambil pada kedalaman sekitar 0-10 cm dari lapisan top soil dengan cetok. Sampel kemudian dibawa ke Laboratorium untuk dilakukan preparasi sampel.
Pembuatan Medium
1) Media Yeast Malt Broth (YMB)
Yeast Malt Broth (YMB) merupakan media general yang digunakan untuk mengkultur yeast dalam media cair. Penggunaan media ini pada awal preparasi sampel bertujuan untuk memperkaya mikroorganisme terutama dari kelompok yeast. Medium Yeast Malt Broth (YMB) dibuat dengan cara melarutkan 3g ekstrak yeast, 3 g ekstrak malt, 5 g pepton, dan 10 g glukosa dalam 1 liter air dan disterilisasi dengan autoklaf 121oC, 1.5 atm selama 15 menit [9].
2) Media Yeast Malt Extract Agar (YMEA)
Yeast Malt Extract Agar (YMEA) digunakan sebagai media kultivasi untuk pemeliharaan koloni yeast pada media padat serta untuk mengkarakterisasi yeast berdasarkan morfologi yang tampak pada medium padat, seperti; bentuk koloni, tekstur koloni, warna, permukaan, tepi, dan elevasi. Media ini dibuat dengan menambahkan 2% agar pada medium Yeast Malt Broth (YMB) dan disterilisasi dengan autoklaf 121oC, 1.5 atm selama 15 menit [9].
3) Media Corn Meal Agar
Media Corn Meal Agar digunakan untuk pengamatan karakteristik vegetatif sel pada medium padat seperti; bentuk miselium, pseudomiselium, dan pembentukan askospora [10]. Media ini digunakan berdasarkan teknik Dalmau plate pada pembuatan slide culture. Medium dibuat dengan cara melarutkan 12,5 g tepung jagung kuning dalam 300 ml akuades dan dipanaskan dalam water bath pada suhu 60oC selama 1 jam, lalu disaring menggunakan kertas saring . Hasil saringan ditambahkan air hingga volumenya menjadi 300 ml, kemudian ditambahkan 3,8 g agar , kloramfenikol 200 mg/l dan diaduk. Selanjutnya, media disterilisasi menggunakan autoklaf pada suhu 121oC dan tekanan 1,5 atm selama 15 menit [10].
4) Media Urea Broth
Media ini digunakan untuk uji urease dan dibuat dengan cara melarutkan 0, 1 g/l yeast extract, 9,1 g/l KH2PO4, 9,5 g/l K2HPO4, 20 g/l urea,0,01 g/l phenol red dalam 1 liter akuades, dan kloramfenikol 200 mg/l. Kemudian diatur pH nya menjadi 6,8 - 7. Setelah selesai, 4 - 5 ml media dimasukkan ke dalam tabung reaksi steril (16 mm). Semua tabung disterilisasi menggunakan autoklaf dengan suhu 121oC dan tekanan 1,5 atm selama 15 menit [10].
5) Media Uji Fermentasi Glukosa
Media ini dibuat dengan cara melarutkan glukosa 1% w/v, pepton water 100 ml, Bromthymol blue 0,1%, dan kloramfenikol 200 mg/l dalam 1 liter akuades. Larutan disterilisasi dengan autoklaf 121oC dan tekanan 1,5 atm selama 15 menit setelah itu didinginkan dan media siap digunakan.
Isolasi dan Purifikasi Khamir
Sampel tanah yang telah diambil dari lokasi sampling, ditimbang sebanyak 10 gram dan dimasukkan ke dalam erlenmeyer yang berisi 90 ml air fisiologis steril (NaCl). Selanjutnya erlenmeyer digoyang-goyang supaya larutan tercampur homogen dan diendapkan selama ± 5 menit. Diambil sebanyak 0.1 ml suspensi lalu diinokulasikan pada medium YMEA melalui metode sebar. Kemudian diinkubasi selama 2 – 3 hari pada suhu ruang. Setelah 2-3 hari pertumbuhan khamir, dilakukan purifikasi dengan menginokulasikan ke dalam cawan Petri baru yang berisi medium YMEA menggunakan metode streak. Diinkubasi selama 2-3 hari hingga sel khamir tumbuh. Setelah itu dilakukan purifikasi lebih lanjut yaitu menginokulasikan sel tunggal khamir pada tabung reaksi yang berisi medium YMEA dengan metode streak, kemudian diamati pertumbuhannya selama beberapa hari.
Pengamatan Makroskopis dan Mikroskopis
Pengamatan karakter makroskopis dilihat berdasarkan kenampakan koloni yang tumbuh pada medium YMEA yang meliputi; warna koloni, bentuk tepi koloni, elevasi, permukaan koloni dan tekstur koloni.
Pengamatan karakter mikroskopis dilakukan dengan menggunakan mikroskop dan pewarnaan laktofenol. Pewarnaan laktofenol digunakan untuk melihat karakteristik reproduksi generatif seperti pembentukan askospora, teliospora, dan basidiospora. Selain itu juga untuk melihat reproduksi vegetatif sel khamir yang meliput pembentukan budding dengan tipe multipolar, bipolar, unipolar dan fusi, pembentukan spora aseksual meliputi arthospora, blastospora, dan clamydiospora. Pengamatan mikroskopis lainnya yaitu meliputi bentuk filamen, bentuk sel, ukuran sel, ada tidaknya pembentukan pseudohifa. Pengamatan secara mikroskopis dilakukan dengan cara membuat preparat biakan di atas kaca objek yang telah diwarnai dengan laktofenol, kemudian ditutup dengan cover glass dan ditetesi minyak imersi. Setelah itu dilihat karakter selnya pada mikroskop dengan perbesaran 400x dan 1000x. Untuk pengamatan dengan perbesaran 400x tidak perlu ditambahkan minyak imersi [9].
Uji Fermentasi Gula
Uji fermentasi gula dilakukan dengan menginokulasi sebanyak 1 ose isolat sel khamir yang telah berumur 48 - 78 jam ke dalam medium steril mengandung glukosa dan ditambahkan bromthymol blue (sebagai indikator) [10]. Hasil positif tampak jika terjadi perubahan warna pada medium dari hijau menjadi kuning.
Uji Urease
Uji urease menggunakan media Urea Broth. Satu ose isolat yeast diinokulasi pada media mengandung urea secara aseptis dan diinkubasi pada suhu 28-30oC. Pertumbuhan yeast diamati setiap hari selama 7 hari. Jika yeast positif menghasilkan urease, media akan berubah warna dari merah kuning menjadi merah keunguan.
Uji Askospora
Uji ini dilakukan dengan mengoleskan suspensi yeast (dibuat smear) di atas gelas obyek dan diberi cairan zat warna malachite green 0,5%. Kemudian dipanaskan dengan uap air (di atas air mendidih) selama 5 menit dan sesekali ditetesi malachite green. Setelah gelas obyek cukup dingin, gelas obyek dimiringkan dan dibilas dengan air selama 30 detik dengan hati-hati. Selanjutnya, smear yeast ditetesi safranin 0,5% selama 30 detik. Preparat diamati di bawah mikroskop perbesaran 400x dan 1000x dengan bantuan minyak imersi. Askospora dewasa akan berwarna hijau, sedangkan sel vegetatif akan tampak merah.
III. HASILDANPEMBAHASAN
A. Karakterisasi Isolat Khamir
Pada praktikum ini dilakukan isolasi khamir dari Rawa Hutan Kampus ITS. Khamir diisolasi pada medium YMEA dan diinkubasi pada suhu ruang selama 2-3 hari. Setelah 2-3 hari, ternyata khamir tidak tumbuh pada medium pertumbuhan YMEA dan mengalami kontaminasi yang diduga dari kelompok kapang (mould). Sehingga percobaan ini diulang sebanyak 2x untuk mengetahui penyebab kontaminasi pada medium. Pada pengulangan kedua, ternyata medium mengalami kontaminasi yang sama dan tidak ditumbuhi oleh sel khamir dan didominasi oleh fungi berfilamen. Diduga, pada lingkungan rawa tersebut memiliki kelimpahan khamir yang sangat rendah daripada keberadaan bakteri atau fungi lainnya dan merupakan kelompok khamir yang tidak dapat dikultur (non-culturable). Pada penelitiaan [5] menyatakan bahwa keberadaan mikroorganisme khamir di tanah tidak begitu tinggi jika dibandingkan dengan bakteri dan jamur benang. Selain itu juga diperkirakan karena faktor isolasi dan kultivasi yang menggunakan metode yang tradisional. [11] menjelaskan bahwa metode tradisional pada isolasi khamir mempunyai keterbatasan khusus. Media kultur dan kondisi lingkungan pertumbuhan (terutama suhu) adalah bersifat selektif, strain yang mempunyai pertumbuhan cepat akan mendominasi dari spesies yang pertumbuhannya lambat sehingga konsekwensinya adalah spesies yang jumlahnya sedikit tidak bisa teramati. Sehingga digunakan kultur khamir koleksi
Laboratorium Mikrobiologi dan Bioteknologi, Biologi ITS dalam praktikum ini. Kultur khamir yang digunakan berasal dari Pantai Wonorejo, Surabaya.
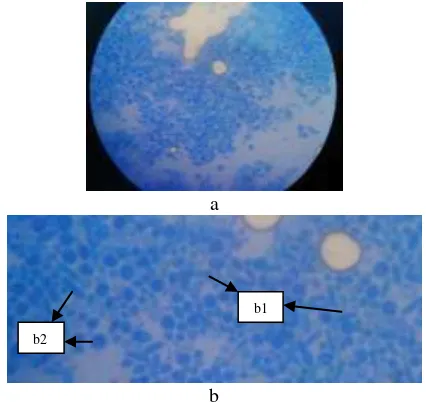
Hasil isolat khamir dari Pantai Wonorejo, Surabaya diidentifikasi berdasarkan pengamatan morfologi baik secara makroskopis dan mikroskopis. Karakter hasil pengamatan secara makroskopis (Gambar 3.1) dan mikroskopis (Gambar 3.2) yaitu sebagai berikut:
Tabel 3.1 Karakteristik makroskopik dan mikroskopik
Morfologi Makroskopik Mikroskopik Bentuk Sirkuler Bulat, ovoid panjang
Elevasi Konvex -
Permukaan Kasar Kasar
Margin Entire -
Warna Putih susu Biru
Ukuran 0.01-0.5 µm -
Budding - Multilateral
Pseudohifa - Tidak ada
a
b
Gambar 3.2 Karakteristik Mikroskopis. a: morfologi mikroskopis khamir, b: insert morfologi (b1: budding, b2:bentuk sel) (dokumentasi pribadi).
a
b
Gambar 3.1 Karakteristik Makroskopis. a: morfologi makroskopis, b: morfologi makroskopis insert, b1 : sel tunggal (dokumentasi pribadi)
b1
b2
B. Karakteristik fisiologis
Pada praktikum ini, dilakukan uji fisiologis dengan uji fermentasi gula, uji urease, dan uji askospora. Pada uji fermentasi gula, gula mempunyai reaksi positif pada gula dekstrosa, galaktosa, sukrosa, maltosa, raffinosa, trehalosa, dan negatif pada gula laktosa [12]. Hasil uji fermentasi gula (Gambar 3.3) menunjukkan hasil positif yang ditandai dengan perubahan warna dari hijau menjadi kuning. Hal ini menunjukkan bahwa isolat uji tersebut mampu memfermentasikan gula dalam medium [13]. Uji fermentasi gula digunakan untuk mendeteksi kemampuan mikroorganisme untuk memfermentasi gula tertentu. Selama proses fermentasi, substrat organik berperan sebagai aseptor elektron akhir [14],[15]. Produk akhir fermentasi gula adalah asam atau asam dengan gas [16],[17]. Reaksi fermentasi dapat dilihat dari adanya perubahan warna ketika produk asam terbentuk.
Pada uji urease (Gambar 3.3), warna medium yang awalnya merah kekuningan menjadi merah keungunan atau merah muda yang menunjukkan hasil uji positif yang berarti isolat uji mampu menghasilkan enzim urease. Pada prinsipnya, urease akan mengubah substrat urea menjadi amoniak dan karbondioksida dan akan menciptakan lingkungan yang alkalin pada medium dimana hal ini dapat dilihat dari adanya perubahan warna dari kuning menjadi merah muda pada indikator phenol red [18].
Selain dilakukan uji fermentasi gula dan uji urease, juga dilakukan uji pewarnaan askospora dengan menggunakan pewarna malachitte green. Malachitte green adalah pewarna antimikrobial sintetis yang merupakan kelompok dari triphenylmethane yang mempunyai kemampuan sebagai agen antibakteri, antifungi dan antiparasit [19],[20]. Pada sel mycobacterium, akan mewarnai membran sel. Protein dalam fraksi membran sel mycobacterium bertanggungjawab dalam pewarnaan malachitte green [21].
Yeast mempunyai mekanisme yang berbeda untuk mengeluarkan askospora pada panjang yang berbeda dari kantung aski. Askospora berbentuk membulat hingga oval berkembang dalam oxylipincoated [22]. Keberadaan gugus 3-hydroxy (3-OH) oxylipin pada yeast dan peranannya dalam proses infeksi sudah berkembang baik [23[,[24]. Hal ini telah
dilaporkan bahwa intermediet tersebut dan produk β-oksidasi dibutuhkan dalam pelepasan askospora dan pelepasan dari aski [25] dengan berperan sebagai lubrikan (pelumas) [22].
Hasil pengamatan praktikum menunjukkan bahwa tampak sel berwarna biru yang menunjukkan terbentuknya askospora dewasa (mature ascospores). [26] menjelaskan bahwa askospora dewasa akan terwarnai menjadi biru-hijau dan sel vegetatif berwarna merah
Berdasarkan hasil pengamatan terhadap karakter makroskopis dan mikroskopis serta uji karakteristik fisiologis, diperoleh ringkasan karakteristik isolat uji yaitu sebagai berikut:
Berdasarkan tabel diatas, diduga isolat uji yang digunakan merupakan genus Debaryomyces spp. Hal ini dapat diketahui berdasarkan karakteristik reproduksi vegetatifnya yaitu multilateral budding, pseudohifa mungkin terbentuk tetapi hifa sejati tidak ada, reproduksi seksual dengan konjugasi, konjugasi antar sel dan tunas biasanya terbentuk sebelum terbentuk askus, aski menghasilkan 1-4 askospora yang berbentuk bulat, elips dan halus atau kasar, bulat dan kasar dengan bentukan cincin, atau halus dan lentikuler. 1-2 askospora biasanya terbentuk dalam satu askus, tetapi pada beberapa spesies mempunyai lebih dari 4 askospora dalam satu askus. Keberadaan aski jarang. Karakteristik fisiologi sel yaitu dapat memfermentasi gula pada beberapa spesies, sedangkan produksi urea tidak diketahui [9]. [27] juga menambahkan bahwa genus Debaryomyces memiliki ciri sel berbentuk bulat, reproduksi vegetatif dengan pertunasan multilateral, pseudohifa dapat dihasilkan atau tidak dihasilkan,
Tabel 3.2 Hasil Karakteristik morfologi dan fisiologis
Karakteristik Keterangan
Bentuk Bulat, ovoid panjang, sirkuler
Elevasi Konvex
Permukaan Kasar
Margin Entire
Warna Putih susu
Ukuran 0.01-0.5 µm
Budding Multilateral
Pseudohifa Tidak ada
Askospora Ada
Uji fermentasi gula (+)
Uji urease (+)
a b
Gambar 3.3 Hasil uji karakteristik fisiologis. a: Hail uji fermentasi gula, b: Hasil uji urease.
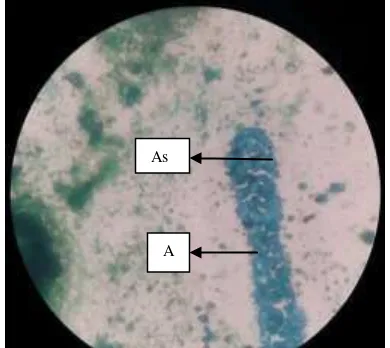
Gambar 3.4 Hasil Pewarnaan askospora dengan malachitte green
(dokumentasi pribadi). (A) askus, (As)askospora. As
menghasilkan askospora berbentuk bulat atau oval dengan dinding spora bergerigi dan biasanya berjumlah 1 - 3 per askus dan tidak mudah dilepaskan dan beberapa spesies dapat menghasilkan 4 spora per askus, kadang menghasilkan blastospora.
IV. KESIMPULAN
Berdasarkan praktikum yang telah dilakukan, diketahui cara bagaimana mengisolasi khamir dari alam dan diketahui metode identifikasi khamir. Isolasi khamir dilakukan dengan sampling dengan metode komposit pada daerah yang mempunyai kandungan bahan organik tinggi dan lembab. Identifikasi khamir dilakukan dengan melakukan pengamatan secara morfologi dan fisiologi. Hasil yang diperoleh yaitu diduga bahwa isolat khamir yang diamati merupakan genus Debaryomyces spp. yang mempunyai ciri-ciri multilateral budding, berbentuk bulat hingga ovoid, terbentuk askospora dan dapat memfermentasi gula.
DAFTARPUSTAKA
[1] J.W. Fell, “Collection and identification of marine yeasts In Methods in Microbiology,” Paul J (ed.). Academic Press: New York (2001) 347–
356.
[2] J.W.Fell, S.P. Ahearn, S.P. Meyers, and F.J. Jr. Roth, “Isolation of
yeasts from Biscayne Bay, Florida, and adjacent benthic areas.” Limnol Oceanogr 5 (1960) 366–371.
[3] A. Kanti, “Identifikasi jenis khamir yang diisolasi dari tanah gambut
Taman Nasional Bukit Duabelas, Jambi,” BioSmart. 6(1) (2003) 10-14. [4] A. Kanti, “Marga Candida, khamir tanah pelarut posfat yang diisolasi
dari tanah Kebun Biologi Wamena Papua,” Biodiversitas. 7(2) (2006) 105-108.
[5] A. Kanti, “Penapisan khamir selulolitik Cryptocoous sp. yang diisolasi dari tanah Kebun Biologi Wamena Jaya Wijaya Propinsi Papua,”
Laporan Penelitian Bidang Mikrobiologi. Bogor: Pusat Penelitian Biologi-LIPI (2007).
[6] J.A. Barnett, R.W. Payne, D, Yarrow, “Yeasts: Characteristics and Identification, 2nd edn,” Cambridge University Press: New York (1990) 1002.
[7] J.A. Barnett and R.J. Pankhurst, “A new key to the yeast,” New York: American Elsevier Publishing Company Inc. (2000).
[8] Jumiyati, S.H. Bintari, I. Mubarok, “Isolasi dan Identifikasi Khamir secara Morfologi di Tanah Kebun Wisata Pendidikan Universitas Negeri
Semarang,” Biosaintifika 4 (1) (2012)
[9] C.P. Kurtzman and J.W. Fell, “The Yeast A Taxonomy Study,” New
York: Elvesier (1998).
[10] N. J. W. Kregen-Van Rij, “The Yeast A Taxonomy Study,” Amsterdam:
Elvesier Science Publisher (1987).
[11] S.N. Kutty and R. Philip, “Marine yeast - a review,” yeast (2008); 25: 465-483.
[12] J. Lodder, “ The Yeast : A Taxonomic Study Second Revised and
Enlarged Edition,” The Netherland, Northolland Publishing Co.,Amsterdam,(1970).
[13] K. Reiner,”Carbohydrate Fermentation Protocol,” Microbe Library, American Society for Microbiology,(2012).
[14] J.F. MacFaddin , “ Biochemical tests for identification of medical
bacteria, 3rd ed.,” Lippincott Williams & Wilkins, Philadelphia, PA, (2000).
[15] R.y. Stanier, M. Doudoroff , and E.A. Adelberg,” The microbial world,
2nd ed.,” Prentice-Hall, Englewood Cliffs, NJ, (1963).
[16] B. Forbes , D.F. Sahm, A.S. Weissfeld.”Bailey and Scott’s diagnostic
microbiology, 12th ed,” Mosby Company, St. Louis, MO (2007). [17] C.R. Mahon,D.C. Lehman, and G. Manuselis,” Textbook of diagnostic
microbiology, 4th ed”. W. B. Saunders Co., Philadelphia, PA, (2011). [18] M.D. Delost,”introduction to Diagnostic Microbiology for the
Laboratory Sciences,” Jones & Bartlett Learning, (2015).
[19] N. Banaei, E.Z. Kincaid, S-Y.G. Lin, E. Desmond, W.R. Jacobs Jr., and
J.D. Ernst,”Lipoprotein Processing Is Essential for Resistance of Mycobacterium tuberculosis to Malachitte Green,” Antimicrobial
Agents and Chemotherapy, September (2009), p. 3799-3802.
[20] D.J. Alderman,” Malachite green: a review,” J. Fish Dis. (1985) 8:289– 298
[21] J.J. Jones, and J. O. Falkinham III.,” Decolorization of malachite green and crystal violet by waterborne pathogenic mycobacteria. Antimicrob. Agents Chemother. (2003) 47:2323–2326.
[22] A.Van-Heerden, P.W.J. Van-Wyk, P.J. Botes, C.H. Pohl, C.J. Strauss, S. Nigam, and J.L.F. Kock, “The Release of elongated, aheathed ascospores from bottle-shaped asci in Dipodasdus geniculatus,”FEMS Yeast Res, (2007) 173-179.
[23] Deva R, Ciccoli R, Schewe T, Kock JLF & Nigam S (2000) Arachidonic acid stimulates cell growth and forms a novel oxygenated metabolite in Candida albicans. Biochim Biophys Acta 1486: 299–311. [24] R. Ciccoli, S. Sahi, S.Singh, H. Prakash, M-P. Zafiriou, G. Ishdorj ,
J.L.F.Kock, and S.Nigam,” Oxygenation by cyclooxygenase-2 (COX-2) of 3-hydroxyeicosa-tetraenoic acid (3-HETE), a fungal mimetic of arachidonic acid, produces a cascade of novel bioactive
3-hydroxy-eicosanoids,”. Biochem Journal (2005) 390: 737–747.
[25] J.L.F. Kock, C.J. Strauss, E.E. Pretoriu, C.H. Pohl, A.S. Bareetseng, P.J. Botes, P.W.J. VanWyk, S.W.Schoombie, and S. Nigam,
“Revealing yeast spore movement in confined space”, S Afr J Sci (2004) 100:237–240.
[26] M. Madam and K.S. Thind,”Physiology of Fungi”, S.B. Nangia and A.P.H. publishing Corporation: New Delhi, (1998).