BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Suatu molekul dapat bersifat polar dan nonpolar yang dapat di tentukan dengan harga momen dipolnya.Momen dipol merupakan suatu besaran yang di gunakan untuk menentukan kepolaran suatu molekul. Dimana jika momen dipol yang di hasilkan lebih besar dari 0 maka molekul tersebut semakin polar dan jika momen dipol yang di hasilkan samadengan 0 maka molekul tersebut bersifat nonpolar. Adanya perbedaan keelektronegatifan Antara dua atom yang memebentuk ikatan kovalen menyebabkan atom yang lebih elektropositif kekurangan rapatan electron, sebaliknya atom yang lebih elektropositif kelebihan rapatan electron. Akibatnya pada atom yang lebih elektropositif terjadi muatan parsial positif sedangkan pada atom yang lebih elektronegatif terjadi muatan parsial negative. Adanya perbedaan muatan parsial ini menyebabkan timbulnya momen ikatan yang arahnya dari atom dengan muatan parsial positif ke atom dengan muatan parsial negative. Sedangkan efek induktif merupakan kemampuan suatu gugus untuk mendorong ataupun menarik electron. Semakin jauh letak gugus atau atom yang memiliki efek induksi, makin kecil pengaruhnya terhadap kepolaran suatu ikatan.Momen dipol dan efek induktif dapat di gunakan untuk menentukan kepolaran suatu molekul. Oleh karena itu untuk lebih memahami tantang momen dipol dan efek induktif kami menulis makalah yang berjudul “MOMEN DIPOL & EFEK INDUKTIF”.
1.2 RUMUSAN MASALAH
1. Apa pengertian dipol dan momen dipol serta cara menentukan nilai dari momen dipol?
2. Apa pengertian dari efek induktif dan pngaruhnya terhadap kepolaran suatu molekul? 3. Apa hubungan antara momen dipol dan efek induktif?
1.3 TUJUAN PENULISAN
1. Mengetahui pengertian dipol dan momen dipol serta memahami cara menentukan momen dipol dengan menggunakan persamaan yang ada.
2. Mengetahui pengertian efek induktif serta memahami pengaruh dari efek induktif terhadap kepolaran suatu molekul.
BAB II
PEMBAHASAN Gaya Antar Molekul
Gaya antar molekul adalah gaya tarik-menarik antar molekul yang saling berdekatan. Gaya antar molekul berbeda dengan ikatan kimia. Ikatan kimia, seperti ikatan ionik, kovalen, dan logam, semuanya adalah ikatan antar atom dalam membentuk molekul. Sedangkan gaya antar molekul adalah gaya tarik antar molekul. Kita akan mempelajari tiga macam gaya antar molekul, yaitu:
Gaya Van der Waals
Ikatan Hidrogen
Gaya London
Agar dapat memahami gaya antar molekul dengan baik. kita harus memahami terlebih dahulu tentang apa yang dimaksud dengan dipol dalam suatu molekul.
Dipol adalah singkatan dari di polar, yang artinya dua kutub. Senyawa yang memiliki dipol adalah senyawa yang memiliki kutub positif (δ+) di satu sisi, dan kutub negatif (δ-) di sisi yang lain. Senyawa yang memiliki dipol biasa disebut sebagai senyawa polar. Senyawa polar terbentuk melalui ikatan kovalen polar. Perlu diperhatikan bahwa dipol berbeda dengan ion. Kekuatan listrik yang dimiliki dipol lebih lemah dibanding kekuatan listrik ion. Kita pasti ingat, bahwa ion terdapat pada senyawa ionik, dimana molekul terbagi menjadi dua , yaitu ion positif/kation (+) dan ion negatif/anion (-).
Untuk memahami perbedaan antara ion dan dipol, mari kita perhatikan gambar berikut:
Dari gambar di atas dapat dilihat bahwa pada senyawa ion, molekul terbagi (bisa juga dikatakan terbelah) menjadi dua bagian. Jadi ion positif dan ion negatif sebenarnya terpisah. Mereka bersatu hanya karena adanya gaya tarik-menarik antar ion positif dan negatif (gaya coulomb).
Pada senyawa polar, tidak terjadi pemisahan. Molekul merupakan satu kesatuan. Hanya saja pada satu sisi/tepi terdapat kutub positif (δ+) dan di sisi/tepi yang lain terdapat kutub negatif (δ-).
Untuk senyawa non polar, sama sekali tidak ada muatan listrik yang terkandung.
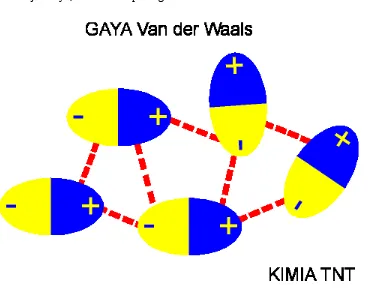
Gaya Van der Waals
(Gaya tarik antara dipol-dipol)
formasinya tidak statis/tetap, kenapa? Karena sebenarnya molekul selalu bergerak dan bertumbukan/tabrakan.
Catatan:
Molekul/atom/zat akan diam tak bergerak jika energi kinetiknya = 0 (nol). Keadaan ini disebut keadaan diam mutlak, dicapai jika benda berada pada suhu 00K (-2730C)
Untuk jelasnya, bisa dilihat pada gambar berikut:
Gaya Van der Waals diperlihatkan dengan garis merah (putus-putus). Kekuatan gaya tarik antara dipol ini biasanya lebih lemah dari kekuatan ikatan ionik atau kovalen (kekuatannya hanya 1% dari ikatan). Kekuatannya juga akan berkurang dengan cepat bila jarak antar dipol makin besar. jadi gaya Van der Waaals suatu molekul akan lebih kuat pada fase padat dibanding cair dan gas.
Ikatan Hidrogen
Ikatan hidrogen diperlihatkan pada garis merah (putus-putus). Meskipun tidak terlalu kuat, ikatan hidrogen tersebar diseluruh molekul. Inilah sebabnya air (H2O) memiliki titik didih yang relatif lebih tinggi bila dibandingkan dengan senyawa lain dengan berat molekul (Mr) yang hampir sama. Sebut misalnya CO2 (Mr=48) dalam suhu kamar sudah berwujud gas, sedangkan air (H2O) dengan berat molekul lebih kecil (Mr=18) pada suhu kamar (20 0C) masih berada pada fase cair.
Gaya London
Ketika dipol sesat terjadi, akan timbul pula gaya london (garis biru putis-putus). Ketika dipol hilang, gaya london pun hilang. Kekuatan Gaya london bergantung pada berbagai faktor:
( http://kimiatangsel.blogspot.com/2011/04/gaya-antar-molekul.html)
Sebuah molekul diatom seperti HF adalah suatu dipol, yakni suatu benda yang memiliki dua muatan berlawanan pada titiknya. Adanya dua muatan yang berlawanan ini dapat dibuktikan dengan medan listrik. Dimana ketika medan listrik dinyalakan molekul HF akan engarahkan ujung negatifnya ke kutub positif dan ujung positifnya ke kutub negatif Untuk molekul semacam ini dapat ditentukan sebuah momen dipol, yaitu suatu ukuran terhadap derajat kepolaran. Secara kuantitatif, momen dipol (µ) merupakan hasil kali muatan Q dan jarak antar muatan r.
µ = Q x r (1)
Untuk mempertahankan kenetralan listrik, muatan pada kedua ujung molekul diatomik yang bermuatan listrik netral haruslah sama besar dan berlawanan arah. Namun, pada persamaan (1), Q hanya merujuk pada besar muatan dan tidak ada tandanya, sehingga nilai Q selalu
1. Kerumitan molekul
makin rumit molekul (Mr makin besar), maka gaya london makin kuat.
2. Ukuran molekul
positif. Momen dipol dinyatakan dalam satuan debye (D), dari nama seorang kimiawan Peter Debye. Faktor konversinya adalah
1 D = 3,336 x 10-30 C m
Di mana C dalam Coulumb dan m dalam meter.
Molekul diatomik yang mengandung atom-atom dari unsur yang berbeda biasanya berupa molekul polar dan memiliki momen dipol, sedangkan molekul diatomik yang mengandung atom-atom dari unsur yang sama tidak memiliki momen dipol dan berupa molekul non-polar. (http://lischer.wordpress.com/2009/08/22/momen-dipol/)
Momen Dipole
Momen dipol Istilah dapat didefinisikan baik sehubungan dengan ikatan kimia atau sehubungan dengan molekul.
1. Obligasi Dipole Momen
Elektron dalam ikatan kovalen menghubungkan dua atom yang berbeda tidak ditanggung bersama oleh atom karena perbedaan elektronegativitas antara dua elemen. Atom dari elemen yang lebih elektronegatif memiliki pangsa yang lebih besar dari elektron dari atom dari unsur yang kurang elektronegatif. Akibatnya, atom yang memiliki bagian yang lebih besar dari elektron ikatan dikenakan muatan negatif parsial dan atom yang memiliki pangsa yang lebih rendah muatan positif parsial yang sama besarnya. Sebagai contoh, pikirkan molekul diatomik AB hipotetis. Asumsikan bahwa elemen B lebih elektronegatif daripada elemen A. Atom B memiliki bagian yang lebih besar dari elektron dalam ikatan AB. Artinya, AB obligasi terpolarisasi ke arah atom B, dan ada muatan negatif parsial (-δ) pada atom B dan muatan parsial positif besarnya sama (+ δ) pada atom A.
SI unit momen dipol adalah Debye (D).
2. Molekul Dipole Momen
Menurut definisi, molekul bermuatan listrik netral. Namun, banyak molekul memiliki wilayah, atau tiang, bantalan muatan positif bersih parsial, dan wilayah yang berlawanan, atau tiang, beruang muatan negatif parsial bersih sama besarnya, seperti yang ditunjukkan di bawah ini secara skematik.
Molekul tersebut memiliki momen dipol, yang sama dengan jumlah vektor momen dipol dari semua obligasi dalam molekul. Momen dipol molekul, menjadi vektor, memiliki arah, yang ditunjukkan dengan menggunakan simbol berikut.
panah simbol yang menunjuk ke arah kutub negatif dan tanda plus menuju kutub positif.
Molekul A mungkin tidak memiliki momen dipol meskipun mengandung ikatan yang melakukan. Sebagai contoh, masing-masing dua ikatan karbon-oksigen dalam CO 2 memiliki momen dipol, tetapi CO 2 molekul tidak memiliki momen dipol karena momen dipol dari dua ikatan karbon-oksigen adalah identik dalam besar dan berlawanan arah, sehingga jumlah vektor dari nol.
Momen dipol ikatan tidak dapat ditentukan secara eksperimental, momen dipol molekul hanya bisa. Namun, ada cara-cara tidak langsung untuk menentukan momen dipol ikatan, kira-kira jika tidak akurat. Sebuah molekul diatomik hanya memiliki satu ikatan. Oleh karena itu, momen dipol ikatan dalam molekul diatomik adalah sama dengan momen dipol molekul. Sebagai contoh, eksperimental, momen dipol dari HF 1.91 D. Dengan demikian, momen dipol ikatan hidrogen fluorida di HF 1.91 D. Dalam beberapa molekul organik, satu ikatan kontribusi sangat untuk momen dipol molekul, membuat kontribusi obligasi lainnya tidak signifikan. Akibatnya, momen dipol ikatan yang memberikan kontribusi untuk momen dipol molekul kira-kira sama dengan momen dipol molekul. Sebagai contoh, perhatikan CH 3 Cl. Eksperimen, momen dipol dari CH 3 Cl 1.87 D, yang berarti momen dipol ikatan C-Cl di CH3 C-Cl adalah sekitar 1,87 D.
(http://science.uvu.edu/ochem/index.php/alphabetical/c-d/dipole-moment/)
Afinitas elektron didefinisikan sebagai kalor reaksi saat elektron ditambahkan kepada atom netral gas, yakni dalam reaksi.
F(g) + e¯ → F¯(g) (5.2)
Nilai positif mengindikasikan reaksi eksoterm, negatif menunjukkan reaksi endoterm. Karena tidak terlalu banyak atom yang dapat ditambahi elektron pada fasa gas, data yang ada terbatas jumlahnya dibandingkan jumlah data untuk energi ionisasi. Tabel 5.6 menunjukkan bahwa afinitas elektron lebih besar untuk non logam daripada untuk logam.
Tabel 5.6 Afinitas elektron atom.
H 72,4 C 122,5 F 322,3
Li 59, O 141,8 Cl 348,3
Na 54,0 P 72,4 Br 324,2
K 48,2 S 200,7 I 295,2
Besarnya kenegativan(elektron) yang didefinisikan dengan keelektronegatifan (Tabel 5.7), yang merupakan ukuran kemampuan atom mengikat elektron. Kimiawan dari Amerika RobertSanderson Mulliken (1896-1986) mendefinisikan keelektronegativan sebanding dengan rata-rata aritmatik energi ionisasi dan afinitas elektron.
Pauling mendefinisikan perbedaan keelektronegativan antara dua atom A dan B sebagai perbedaan energi ikatan molekul diatomik AB, AA dan BB. Anggap D(A-B), D(A-A) dan D(B-B) adalah energi ikatan masing-masing untuk AB, AA dan BB. D(A-B) lebih besar daripada rata-rata geometri D(A-A) dan D(B-B). Hal ini karena molekul hetero-diatomik lebih stabil daripada molekul homo-diatomik karena kontribusi struktur ionik. Akibatnya, ∆(A-B), yang didefinisikan sebagai berikut, akan bernilai positif:
(A-B) = D(A-B) -√D(A-A)D(B-B) > 0 (5.3)
(A-B) akan lebih besar dengan membesarnya karakter ionik. Dengan menggunakan nilai ini, Pauling mendefinisikan keelektronegativan x sebagai ukuran atom menarik elektron. |xA -xB|= √D(A-B) (5.4)
xA dan xB adalah keelektronegativan atom A dan B.
Apapun skala keelektronegativan yang dipilih, jelas bahwa keelektronegativan meningkat dari kiri ke kanan dan menurun dari atas ke bawah. Keelketroegativan sangat bermanfaat untuk memahami sifat kimia unsur.
Informasi lain yang bermanfaat dapat disimpulkan dari Tabel 5.7. Perbedaan keelektronegativan antara dua atom yang berikatan, walaupun hanya semi kuantitatif, berhubungan erat dengan sifat ikatan kimia seperti momen dipol dan energi ikatan..
Arah dipol dapat direpresentasikan dengan panah yang mengarah ke pusat muatan negatif dengan awal panah berpusat di pusat muatan positif. Besarnya dipol, rq, disebut momen dipol. Momen dipol adalah besaran vektor dan besarnya adalah µ dan memiliki arah.
Besarnya momen dipol dapat ditentukan dengan percobaan tetapi arahnya tidak dapat. Momen dipol suatu molekul (momen dipol molekul) adalah resultan vektor momen dipol ikatan-ikatan yang ada dalam molekul. Bila ada simetri dalam molekul, momen dipol ikatan yang besar dapat menghilangkan satu sama lain sehingga momen dipol molekul akan kecil atau bahkan nol.
Contoh Soal 5.3 Momen dipol ikatan dan momen dipol molekul.
(a) Jawab pertanyaan berikut tentang hidrogen khlorida HCl dan karbon tetrakhlorida CCl4. Tunjukkan bagaimana arah momen dipol untuk tiap senyawa. Usulkan apakah senyawa ini memiliki momen dipol atau tidak. (b) Karbon dioksida CO2 dan sulfur trioksida SO3 tidak memiliki momen dipol molekul. Usulkan struktur molekul senyawa-senyawa ini berdasarkan pengamatan ini.
Jawab.
(http://www.chem-is-try.org/materi_kimia/kimia_dasar/sistem_periodik/sifat-periodik-unsur/)
Momen Dipol ( µ )
Adalah suatu besaran yang digunakan untuk menyatakan kepolaran suatu ikatan kovalen. Dirumuskan :
µ = Q x r ; 1 D = 3,33 x 10-30 C.m keterangan :
µ = momen dipol, satuannya debye (D) Q = selisih muatan, satuannya coulomb (C)
r = jarak antara muatan positif dengan muatan negatif, satuannya meter (m)
Efek Induksi
Dalam suatu ikatan kovalen tunggal dari atom yang tak sejenis, pasangan electron yang membentuk ikatan sigma, tidak pernah terbagi secara merata di antara kedua atom. Electron memiliki kecenderungan untuk tertarik sedikit ataupun banyak kea rah atom yang lebih elektronegatif dari keduanya. Misalnya dalam suatu alkil klorida, kerapatan electron cenderung lebih besar pada daerah didekat atom Cl daripada atom C. sebagai penunjuk bahwa atom yang satu lebih elektronegatif, secara umum dituliskan sebagai berikut:
Jika atom karbon terikat pada klorin dan ia sendiri berikatan pada atom karbon selanjutnya, efek induksi dapat diteruskan pada karbon tetangganya.
Sebagai perbandingan relatifitas efek induksi, kita memilih atom hydrogen sebagai molekul standarnya, misalnya CR3-H.
- Jika ketika atom H dalam molekul ini diganti dengan Z (atom ataupun gugus), kemudian kerapatan electron pada bagian CR3 pada molekul ini berkurang daripadadalam CR3-H, maka Z dapat dikatakan memiliki suatu efek – I (efek penarik electron / electron-withdrawing / electron-attracting). Contoh gugus dan atom yang memiliki efek – I: NO2, F, Cl, Br, I, OH, C6H5-.
- Jika kerapatan electron dalam CR3 bertambah besar dari pada dalam CR3-H, maka Z dikatakan memiliki efek + I (efek pendorong electron / repelling / electron-releasing). Contoh gugus dan atom yang memiliki efek + I: (CH3)3C-, (CH3)2CH-, CH3CH2-, CH3-.
Bentuk molekul dan polarisabilitas
Gaya dispersi (gaya London) merupakan gaya yang relatif lemah. Zat yang molekulnya bertarikan hanya berdasarkan gaya London, yang mempunyai titik leleh dan titik didih yang rendah dibandingkan dengan zat lain yang massa molekul relatifnya kira-kira sama. Jika molekul-molekulnya kecil, zat-zat itu biasanya berbentuk gas pada suhu kamar, misalnya hidrogen (H2), nitrogen (N2), metana (CH4), dan gas-gas mulia.
Efek Induktif
Jika kelektronegatifan atom atau gugus yang terikat pada rantai karbon lebih kecil dari atom karbon, maka pergeseran elektron menjauhi gugus sepanjang rantai, yang dikenal sebagai efek induksi (+I)
•Nilai pKa menunjukkan bahwa keasaman amonia lebih kuat dari etilamina. Pada kasus ini efek induksi adalah efek pendorong elektron.
•Gugus alkil pada etilamina meningkatkan muatan negatif basa konyugasi , sehingga mendestabilisasinya, membuat etilamina lebih lemah keasamannya dibanding amonia.
Efek induktif
•Efek induktif dapat menjelaskan perbedaan antara kekuatan asam antara etilamina (pKa ~ 40) dan amonia (pKa ~ 33).
3.1 KESIMPULAN
Adapun yang dapat disimpulkan dari makalah ini adalah sebagai berikut :
1. Dipol adalah singkatan dari di polar, yang artinya dua kutub. Senyawa yang memiliki dipol adalah senyawa yang memiliki kutub positif (δ+) di satu sisi, dan kutub negatif (δ-) di sisi yang lain.
2. Momen dipol (µ ) adalah suatu besaran yang digunakan untuk menyatakan kepolaran suatu ikatan kovalen. Dirumuskan : µ = Q x r
3. Efek induksi adalah
4. Pengaruh efek induksi pada momen dipol adalah
3.2 SARAN
http://science.uvu.edu/ochem/index.php/alphabetical/c-d/dipole-moment/
http://kimiatangsel.blogspot.com/2011/04/gaya-antar-molekul.html
http://lischer.wordpress.com/2009/08/22/momen-dipol/