1 BAB I. PENDAHULUAN
A. Latar Belakang
Kanker leher rahim merupakan salah satu kanker penyebab kematian kedua di dunia pada wanita setelah kanker payudara. Pada negara berkembang kanker leher rahim merupakan kanker yang paling banyak terjadi pada wanita, yaitu hampir 25% dari semua jenis kanker yang menyerang wanita (WHO, 2009). Berdasarkan sepuluh jenis kanker primer pada wanita di Indonesia, kanker leher rahim menempati posisi pertama (28,66%) (Tjindarbumi dan Mangunkusumo, 2002).
Faktor resiko kanker leher rahim meliputi infeksi Human Papiloma Virus (HPV), hubungan seks pada umur yang terlalui dini, imunosuppresi, multiple sexual partner, penggunaaan kontrasepsi oral dan kekurangan betakaroten (Tsao et al., 2004). Banyaknya faktor resiko yang dapat menyebabkan kanker leher rahim ini membuat angka kejadiannya sangat tinggi terutama di negara berkembang seperti Indonesia. Oleh karena itu, pengembangan dan penemuan pengobatan kanker leher rahim perlu terus diupayakan.
Salah satu permasalahan yang sering timbul dalam pengobatan kanker adalah resistensi obat kemoterapi (drug-resistence) (Wong et al., 2006). Salah satu agen kemoterapi kanker yang telah menimbulkan resistensi adalah Doxorubicin. Senyawa golongan antrasiklin ini diberikan pada berbagai jenis kanker. Selain menimbulkan resistensi, Doxorubicin dapat menyebabkan kardiotoksisitas pada penggunaan jangka panjang (Ferreira et al., 2008). Salah satu alternatif untuk mengatasi resistensi adalah mengkombinasikan agen kemoterapi dengan agen kemopreventif sehingga dapat meningkatkan keberhasilan terapi.
Kalkon (1,3-difenilpropen-1-on) merupakan senyawa yang telah banyak di teliti sebagai therapeutic, khususnya sebagai obat antitumor. Hasil penelusuran literatur menyebutkan bahwa sebagian besar target utama dari senyawa-senyawa kalkon adalah mempengaruhi daur sel (cell cycle) (Boumendjel, Ronox, and Boutonnat, 2009).
Indyah, S.A., et al (2000), berhasil mensintesis beberapa senyawa derivat kalkon, yaitu mono para-hidroksi kalkon, diantaranya senyawa yang mengandung substituen fuoro, yaitu
1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-2
on. Berdasarkan uji aktivitas penghambatan lipid peroksidasi non enzimatis, dan aktivitas penghambatan siklooksigenase, senyawa ini menunjukkan sangat poten sebagai antioksidan. Pada beberapa senyawa golongan terpenoid, adanya aktivitas antiinflamasi, antimutagenik dan antioksidan yang dimiliki dapat memacu apoptosis dan menekan karsinogenesis yang di picu oleh bahan kimia (Xu et al., 2007). Penelitian lebih lanjut dalam kaitannyanya dengan efek sitotoksik menunjukkan bahwa senyawa dengan substituen fluoro ini bersifat sitotoksik pada sel HeLa, sel Raji dan sel T47D, dan efek sitotoksis tertinggi pada sel HeLa (Indyah, S.A., 2010 dan Retno, A., et al., 2010). Sejauh ini penelitian tersebut belum menginvestigasi lebih jauh mengenai mekanisme aksi dan target molekuler dari senyawa tersebut untuk cancer chemoprevention pada cancer cel lines HeLa.
Penelitian-penelitian tersebut menjadi dasar awal pengembangan senyawa derivat kalkon bersubstituen fluoro ini sebagai agen ko-kemoterapi untuk meningkatkan potensi agen kemoterapi Doxorubicin, sehingga diperoleh pengobatan kanker leher rahim yang efektif. Oleh karena itu, pada penelitian ini akan dieksplorasi apakah penggunaan senyawa ini secara tunggal dan kombinasinya dengan Doxorubicin dapat memberikan efek sitotoksik, memacu apoptosis, menghambat daur sel (cell cycle arrest), serta mempengaruhi ekspresi protein yang terlibat dalam apoptosis (Bax, p53, dan Bcl-2).
B. Batasan dan Rumusan Masalah
Berdasarkan latar belakang permasalahan di atas, maka ruang lingkup penelitian ini dibatasi pada mensintesis senyawa derivat kalkon bersubstituen fluoro, yaitu 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, selanjutnya mengkaji potensinya sebagai agen ko-kemoterapi Doxorubicin terhadap sel HeLa yang merupakan kultur sel kanker leher rahim. Fokus penelitian yang diamati adalah hal-hal yang berkaitan dengan faktor penghambatan sel kanker, yaitu aktivitas sitotoksik, kemampuan dalam memacu apoptosis, menghambat daur sel, dan mempengaruhi ekspresi protein yang terlibat dalam apoptosis (Bax, p53, dan Bcl-2). Dengan demikian rumusan masalah dalam penelitian yang dilaksanakan dalam 2 (dua) tahun ini adalah sebagai berikut :
3 Pada tahun pertama
1. Bagaimana aktivitas sitotoksik senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya pada sel HeLa ?
2. Bagaimana efek perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya terhadap pemacuan apoptosis ?
Pada tahun kedua
1. Bagaimana efek perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya terhadap daur sel HeLa ?
2. Bagaimana perubahan ekspresi Bcl-2, p53 dan Bax pada sel HeLa akibat perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya?
4 BAB II
TINJAUAN PUSTAKA
A. Kanker, Daur Sel, dan Apoptosis
Penyakit kanker masih merupakan masalah kesehatan utama di dunia. World Health Organization (WHO) melaporkan bahwa pada tahun 1997, dari 50 juta kematian yang terjadi, sebanyak 12% disebabkan oleh kanker dan dua pertiganya terjadi di negara berkembang (WHO, 1998). Di Indonesia kanker merupakan penyebab kematian utama disamping penyakit menular. Jumlah penderita kanker di Indonesia terus bertambah, dari 3,8% pada tahun 1990 menjadi 4,1% pada tahun 1995 (Depkes, 1997).
Kanker adalah penyakit hasil mutasi gen atau kesalahan jalur transduksi sinyal yang memungkinkan terjadinya kerusakan sel (Petak et al., 2006). Pada sel kanker gangguan transduksi sinyal akan menyebabkan pembelahan yang berlebihan, penghambatan deferensiasi sel, dan penurunan kematian sel (apoptosis). Adanya perubahan ini, maka sel kanker akan berkembang dan menyebar ke jaringan lain sekaligus akan mengalami perubahan kromosom dan mutasi genetik. Perubahan genetik pada gen-gen yang mengatur pertumbuhan, yaitu onkogen dan gen tumor supressor merupakan perubahan yang sering terjadi (Meiyanto, 1999). Akibatnya sel akan berproliferasi terus menerus dan menimbulkan pertumbuhan jaringan yang abnormal (Lodish et al., 2000).
Setiap sel baik sel normal maupun sel kanker mengalami perkembangan melalui suatu siklus yang disebut daur sel (cell cycle). Daur sel meliputi beberapa fase, yaitu : membelah (fase proliferatif), dalam keadaan istirahat (tidak membelah, G-0) dan secara permanen tidak membelah. (Foster et al., 2001). Daur sel diawali dari masuknya sel pada fase G-1, pada fase ini sel melakukan persiapan untuk sintesis DNA (Wyllie et al., 2000). Selanjutnya pada fase S terjadi replikasi DNA sel. Di akhir fase ini sel siap memasuki fase G-2 untuk melakukan pertumbuhan dan sintesis protein yang memadai untuk dua sel. Setelah fase mitosis, sel dapat kembali ke fase G-1 untuk melanjutkan cell cycle atau memasuki fase G-0. Fase G-0 adalah fase istirahat (cell cycle arrest), dimana sel mengalami kelelahan dan berhenti membelah (quiescent cells) (Meiyanto, 2002). Sel dapat keluar dari fase G-0 dan memasuki fase G-1 kembali jika melewati restriction
5
point (R) (Pines, 1997). Untuk melewati restriction point (R) dibutuhkan CDK4/6 (cyclin dependent kinase 4/6) yang diaktivasi oleh cyclin D (CycD) (Foster et al., 2001). CycD bersama CDK4/6 akan mengaktifkan faktor transkripsi E2F dengan cara melepaskannya dari protein pRb (Lodish et al., 2000). E2F akan memacu ekspresi CycE, CycA, dan E2F yang lain. Kompleks CycE-CDK2 dan CycA-CDK2 berperan dalam fosforilasi pRb. E2F memacu ekspresi protein lain yang diperlukan dalam replikasi DNA, misalnya dihidrofolat reduktase, timidin kinase, timidilat sintase, dan DNA polimerase sehingga sel memasuki fase S (Teich, 1997). Pada fase S, terjadi aktivasi synthesis promoting factor (SPF) yaitu kompleks CycA-CDK2, yang pada akhir fase ini mengalami degradasi. Pada fase G2 akan terjadi kenaikan jumlah kompleks CycB-CDC2 yang disebut mitosis promoting factor (Gondhowiardjo, 2004).
Regulasi daur sel dihambat oleh Cyclin–dependent kinase inhibitor (CKI). Protein CKI meliputi CDK inhibitory protein/Kinase inhibitory protein (Cip/Kip) yaitu p21, p27 dan p57 yang membentuk kompleks trimerik dengan CDK2-CycE/CycA dan Inhibitor of cyclin–dependent kinase 4 (INK4) yaitu p15, p16, p18, dan p19 yang membentuk dimer dengan protein CDK4/6 (Foster et al., 2001). Tumor suppressor gene pRb dan p53 menghambat siklus sel (Teich, 1997) dan memberi kesempatan sel untuk melakukan perbaikan DNA atau apoptosis (Hanahan and Weinberg, 2000).
Gangguan pada regulator daur sel akan menyebabkan terganggunya program daur seperti halnya pada sel kanker. Pada sel kanker, daur sel sudah tidak dapat diatur lagi sehingga mengalami pembelahan terus menerus (Meiyanto, 2002). Oleh karena itu, pada perkembangan penelitian mengenai kanker, regulator-regulator cell cycle ini potensial untuk dijadikan target obat antikanker. Penghambatan terhadap CDK4/CDK6 menjadi target pengobatan kanker untuk menghambat proliferasi sel dengan menghentikan cell cycle pada fase G0 atau G1 arrested.
Sel kanker juga mampu menghindari mekanisme apotosis (program kematian sel). Apoptosis merupakan kematian sel yang terjadi akibat induksi dari sel itu sendiri. Apoptosis dapat terjadi akibat faktor intrinsik ketika sel mengalami kerusakan yang irreversibel pada DNA. Apoptosis yang terjadi akibat pemicuan faktor ekstrinsik melibatkan peran reseptor tumor necrosis factor tertentu yang disebut reseptor kematian, yaitu TNF-2, reseptor CD95 (Fas/APO-1), dan reseptor TRAIL (Lodish et al., 2000).
6
Protein yang berperan dalam regulasi apoptosis diantaranya p53, keluarga protein Bcl2, Apaf, Caspase, inhibitor protein proapoptosis (serta reseptor yang merespon sinyal kematian. Sel yang mengalami apoptosis memiliki beberapa karakteristik antara lain peningkatan ekspresi protein proapoptosis (Bax, Bid dan Bak) dan penekanan ekspresi protein antiapoptosis (Bcl-2 dan Bcl-xL), peningkatan level sitokrom C sitosolik, aktivasi caspase, aktivasi PARP1, fragmentasi DNA, dan kerusakan membran sel. Akumulasi dari berbagai karakteristik tersebut menyebabkan munculnya badan-badan apoptosis yang terjadi akibat fragmentasi sel (Gerl and Vaux, 2005). Salah satu penyebab resistensi terhadap proapoptosis karena adanya mutasi pada protein p53 atau peningkatan aktivitas antiapoptosis misalnya pada upregulasi jalur PI3 kinase Akt/PKB.
B. Pengobatan Kanker dan Masalah Resistensi
Pengobatan kanker pada umumnya didasarkan pada upaya pengambilan jaringan kanker atau dengan mematikan sel kanker dan meminimalkan efek pengobatan terhadap sel normal disekitarnya. Saat ini pengambilan kanker yang paling utama adalah operasi, radioterapi dan kemoterapi, namun ketiga jenis pengobatan tersebut memiliki kekurangan. Operasi akan berhasil pada beberapa tumor yang telah berkembang, tetapi sulit mengobati pada stadium awal metastasis (Lodish et al, 2000). Pengobatan dengan radiasi mampu membunuh tumor lokal namun radiasi juga akan membunuh sel normal disekitarnya. Sebagian besar obat kemoterapi seperti taxol, 5-fluorourasil (5-FU) dan adriamisin memiliki target pada pembelahan sel (Boyer and Tannock, 2005), tetapi kemoterapi ini dapat menyebabkan diare dan kerontokan rambut. Agen kemoterapi ini juga tidak efektif untuk sel yang mengalami mutasi p53, sehingga perlu dikembangkan agen-agen baru untuk pengobatan kanker yang aman (Lodish et al., 2000).
Salah satu permasalahan yang sering timbul dalam terapi kanker adalah resistensi obat kemoterapi (drug-resistence) (Wong et al., 2006). Berbagai obat kemoterapi yang digunakan dalam terapi kanker menjadi kurang berefek karena disebabkan oleh resistensi obat kemoterapi yang timbul di dalam sel. Doxorubicin merupakan obat kemoterapi dari golongan antrasiklin yang diberikan pada berbagai jenis kanker, seperti kanker payudara dan leukimia. Doxorubicin dapat berinterkalasi dengan DNA sehingga fungsi DNA sebagai template dan pertukaran sister chromatid terganggu
7
dan pita DNA terputus. Obat ini juga dapat bereaksi dengan sitokrom P450 reduktase dengan adanya NADPH membentuk zat perantara. Zat perantara tersebut akan bereaksi dengan oksigen menghasilkan radikal bebas yang dapat menghancurkan sel. Aktivitas sitotoksik doxorubicin tersebut dapat dihasilkan setelah masuk ke dalam sel kanker (Rabbani et al., 2004). Namun, penggunaannya dibatasi karena menyebabkan efek samping seperti mual, myelosuppression, aritmia, dan cardiomyopathy diikuti gagal jantung (Singal and Iliskovic, 1998).
Selain itu, seringkali ditemukan kasus toleransi dan resistensi sel kanker terhadap doxorubicin. Resistensi obat ini disebabkan oleh pompa efflux P-glycoprotein (P-gp). P-gp merupakan salah satu jenis protein transport sel yang diekspresikan oleh gen MDR-1 (Valeria, 2005). Dalam kondisi normal, P-gp berperan dalam absorbsi, distribusi dan eliminasi obat di dalam tubuh (Matheny et al., 2001). P-gp dapat menurunkan konsentrasi zat sitotoksik di dalam sel (Valeria, 2005). Pada kasus kanker payudara, seperti pada sel MCF-7, ekspresi berlebih dari P-gp akan menurunkan konsentrasi agen kemoterapi seperti doxorubicin, paclitaxel, dan vincristin di dalam sel melalui mekanisme pengeluaran obat (efflux) dari dalam sel, sehingga potensi sitotoksik doxorubicin pada sel kanker akan berkurang (Wong et al., 2006). Sampai saat ini, belum ditemukan agen kombinasi yang efektif dengan efek samping yang rendah. Agen kemoterapi tambahan yang diberikan justru menambah efek samping, seperti cardiotoxicity. Peningkatan aksi obat kemoterapi seperti Doxorubicin dapat dibantu oleh adanya senyawa lain yang mampu menghambat CDK4 sebagai protein yang memacu proliferasi sel. CDK4 merupakan protein kinase yang berperan penting dalam transduksi proliferasi sel kanker (Luo et al., 2005). Penghambatan protein ini dapat mencegah sel berproliferasi sehingga jumlah sel kanker tidak bertambah. Perkembangan sel yang terhenti ini akan meningkatkan potensi aksi dari doxorubicin sebagai agen kemoterapi. Oleh karena itu, perlu dikembangkan senyawa yang potensial sebagai agen kombinasi dan memiliki resiko toksisitas rendah.
8
C. Senyawa Derivat Kalkon dan Potensinya Sebagai Antikanker
Berdasarkan studi penelusuran literatur menunjukkan bahwa beberapa senyawa golongan flavonoid dan terpenoid telah diketahui memiliki aktivitas antitumor (Mathivadhani e. al., 2007, Kampa et al., 2004). Senyawa kalkon merupakan senyawa yang banyak di teliti sebagai therapeutic, khususnya sebagai obat antitumor. Bahkan disebutkan oleh karena aktivitasnya sebagai ”high therapeutic index”, kalkon di anggap sebagai ”the new era of medicines ” dalam kapasitasnya sebagai antitumor, antibakterial, dan anti-inflamatory (Afzal et al., 2008). Disebutkan pula bahwa sebagian besar target utama dari senyawa-senyawa kalkon adalah mempengaruhi daur sel (cell cycle) (Boumendjel et al., 2009).
Upaya-upaya untuk melakukan eksplorasi senyawa kalkon sebagai antikanker telah dilakukan, baik dengan isolasi senyawa dari bahan alam maupun sintesis. Diantaranya baru-baru ini empat senyawa flavon dan kalkon glikosida baru berhasil diisolasi dari ekstrak metanol bunga Helichrysum arenarium, keempat senyawa tersebut memiliki aktivitas menghambat tumor necrosis faktor- (TNF- )-induced citotoxixity pada sel L929. TNF- sangat berperan dalam pengaturan mekanisme apoptosis (Toshio et al., 2009).
Beberapa senyawa kalkon hasil sintesis diantaranya : Trans-4-lodo,4-boranyl-chalcone memiliki aktivitas antitumor terhadap malignant glioma cell lines secara in vitro dan in vivo (Sasayama et al., 2007); senyawa 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone bersifat antitumor terhadap enam cancer cell lines secara invitro (Ye et al., 2004) ; senyawa 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone memiliki aktivitas antitumor terhadap ”solid human carcinoma xenograft model”. secara invivo (Ye et al., 2005). Tidak kalah menariknya adalah senyawa 2-hydroxy-4- methoxychalcone yang memiliki aktivitas anti-angiogenic dan antitumor (Lee et al., 2006).
D. Roadmap Penelitian
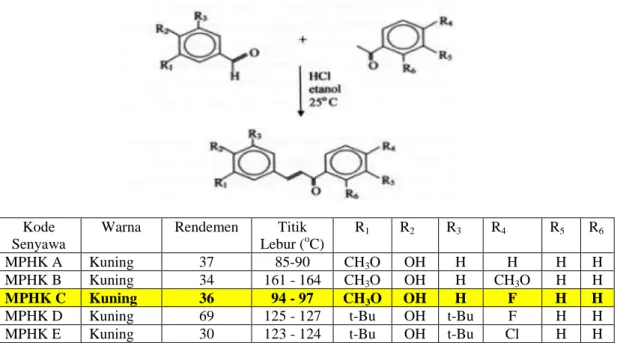
Indyah, dkk. (2000), berhasil mensintesis beberapa derivat kalkon, yaitu senyawa mono para-hidroksi kalkon yaitu : (a) 3-(4’-hidroksi-3’-metoksifenil)-1-fenil-2-propen-1-on atau MPHK A ; (b) 3-(4’-hidroksi-3’-metoksifenil)-1-(4”-metoksifenil)-2-propen-1-on atau MPHK B; (c)
1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-9
propen-1-on atau MPHK C; (d) 3-(3’, 5’-ditersierbutil-4’-hidroksifenil)-1-(4”-fluorofenil)-2-propen-1-on atau MPHK D, dan (e) 3-(3’,5’-ditersierbutil-4’-hidroksifenil)-1-(4”-kloro-fenil)-2-propen-1-on atau MPHK E (Gambar 1). Berdasarkan uji aktivitas penghambatan lipid peroksidasi non enzimatis, dan aktivitas penghambatan siklooksigenase, senyawa-senyawa ini menunjukkan sangat poten sebagai antioksidan (Indyah, 2007).
Kode Senyawa
Warna Rendemen Titik
Lebur (oC)
R1 R2 R3 R4 R5 R6
MPHK A Kuning 37 85-90 CH3O OH H H H H
MPHK B Kuning 34 161 - 164 CH3O OH H CH3O H H
MPHK C Kuning 36 94 - 97 CH3O OH H F H H
MPHK D Kuning 69 125 - 127 t-Bu OH t-Bu F H H
MPHK E Kuning 30 123 - 124 t-Bu OH t-Bu Cl H H
Gambar 1. Senyawa-senyawa mono para-hidroksi kalkon hasil sintesis dari derivat benzaldehida dan asetofenon atau derivatnya melalui reaksi kondensasi aldol silang dalam suasana asam (Indyah dkk., 2000).
Hasil uji sitotoksisitas dari senyawa tersebut terhadap sel HeLa dan sel Raji menunjukkan bahwa senyawa MPHK A dan MPHK C atau 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on memiliki aktivitas sitotoksik dalam menghambat pertumbuhan sel HeLa dan sel Raji (Tabel 1) (Indyah, 2010). Penelitian lebih lanjut terhadap senyawa MPHK A menunjukkan bahwa senyawa ini bersifat sitotoksik pada sel kanker payudara T47D, serta tidak bersifat sitotoksik terhadap sel normal Vero (Retno dkk.,2011). Pada sel T47D, senyawa MPHK A bersifat antiproliferasi dengan menekan viabilitas sel, dan mempengaruhi daur sel dengan menginduksi sel pada fase G1 (Retno dkk., 2012). Sedangkan penelitian lebih lanjut pada
10
senyawa MPHK C, yaitu senyawa derivat kalkon bersubstituen fluoro belum dilakukan, padahal senyawa ini memiliki sifat sitotosik pada sel HeLa.
Tabel 1. Nilai IC50 senyawa –senyawa MPHK terhadap sel HeLa dan sel Raji
Kode Senyawa
IC50 (g/mL)
Sel HeLa Sel Raji
MPHK A 16, 08 36,44
MPHK B 147,43 468, 92
MPHK C 13, 37 30, 46
MPHK D - 98,74
MPHK E 576,63 110,97
Oleh karena itu perlu dilakukan penelitian lebih lanjut untuk mengkaji sifat aktivitas senyawa ini, khususnya senyawa dengan substituen fluoro, yaitu : 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on baik secara tunggal maupun sebagai agen ko-kemoterapi Doxorubicin pada sel HeLa dan mempelajari mekanisme penghambatannya dan target molekuler dari senyawa tersebut. Penelitian-penelitian tersebut menjadi dasar dalam pengembangan senyawa derivat kalkon bersubstituen fluoro sebagai agen ko-kemoterapi untuk meningkatkan potensi aksi agen kemoterapi doxorubicin.
11 BAB III
TUJUAN DAN MANFAAT PENELITIAN
A. Tujuan Penelitian
Penelitian ini bertujuan untuk mengembangkan potensi senyawa derivat kalkon bersubstituen fluoro sebagai agen ko-kemoterapi Doxorubicin pada sel kanker leher rahim HeLa. Tujuan khusus penelitian ini adalah :
Tujuan Tahun I
1. Menginvestigasi aktivitas sitotoksik senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya pada sel HeLa
2. Mengkaji efek perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya terhadap pemacuan apoptosis
Tujuan Tahun II
1. Mengkaji efek perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya terhadap daur sel HeLa
2. Mengamati perubahan ekspresi Bcl-2, p53 dan Bax pada sel HeLa akibat perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya
B. Manfaat Penelitian
Penelitian ini penting dilakukan mengingat obat antikanker yang selektif dan murah masih sangat diperlukan. Apalagi insiden kanker payudara di Indonesia menduduki peringkat kedua dan seringkali terjadi toleransi dan resistensi obat (Dalimartha, 1999). Dengan pengembangan terapi kombinasi ini diharapkan dapat meningkatkan efektivitas kemoterapi, mengatasi masalah resistensi dan menurunkan resiko toksisitas akibat kemoterapi. Penelitian ini akan memberikan sumbangan informasi mengenai aktivitas derivat kalkon bersubstitusi fluoro, baik tunggal maupun kombinasi dengan agen kemoterapi Doxorubicin dalam pengobatan kanker. Hasil penelitian ini, dapat dijadikan dasar aplikasi klinik ko-kemoterapi pengobatan kanker leher rahim. Selain itu penelitian ini juga mengembangkan sistem analisis untuk ko-kemoterapi pada level molekuler.
12 Luaran kegiatan yang ditargetkan yaitu :
1. Pada tahun pertama ditargetkan minimal satu draft paten yang didaftarkan ke Departemen HAKI dan satu artikel publikasi ke jurnal nasional terakreditasi atau seminar nasional.
2. Pada tahun kedua ditargetkan minimal satu artikel yang diterbitkan dalam jurnal nasional terakreditasi atau jurnal internasional.
13 BAB IV
METODE PENELITIAN
A. Rancangan Penelitian
Penelitian ini dilakukan secara rancangan eksperimental murni. Sesuai dengan tujuan penelitian, tahapan penelitian yang akan di lakukan sebagai berikut :
1. Penelitian pada tahun pertama
a. Sintesis senyawa derivat kalkon bersubstituen fluoro dengan mereaksikan p-fluoroasetofenon dengan 4-hidroksi-3-metoksi-benzaldehid, melalui reaksi kondensasi aldol silang dalam suasana asam.
b. Uji sitotoksisitas senyawa derivat kalkon bersubstituen fluoro, Doxorubicin dan kombinasi keduanya pada sel HeLa.
c. Pengamatan insidensi apoptosis perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya pada sel HeLa.
2. Penelitian pada tahun kedua
a. Pengamatan daur sel HeLa pada perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya dengan flowcytometri.
b. Pengamatan ekspresi protein yang terlibat dalam pemacuan apoptosis, yaitu Bcl-2, p53 dan Bax secara imunositokimia pada perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya pada sel HeLa. Variabel-variabel dalam penelitian ini adalah :
1. Variabel bebas : seri konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan Doxorubicin
2. Variabel terikat : persentase viabilitas sel HeLa, IC50 senyawa
1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan Doxorubicin pada sel HeLa, aktivitas pemacuan apoptosis, profil daur sel, serta tingkat ekspresi Bcl-2 dan Bax.
3. Variabel terkendali : suhu dan waktu inkubasi
B. Lokasi Penelitian
Penelitian ini sebagian besar penelitian ini dilakukan di laboratorium Kimia Organik dan Biokimia, Jurdik Kimia FMIPA UNY, analisis spektroskopi UV dan IR
14
dilakukan di laboratorium Kimia Organik UNY. Uji aktivitas sebagai sitotoksik, flowcytometri, dan imunositokimia di lakukan di laboratorium Parasitologi Fakultas Kedokteran Universitas Gadjah Mada.
C. Penelitian Tahun Pertama
1. Sintesis dan Pemurnian Senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on
a. Alat yang digunakan :
penentu titik leleh mikro Fisher John dengan tidak terkoreksi Varian Cary 100 Conc untuk mengukur spektrum ultraviolet (UV) FTIR 8300 Shimadzu untuk mengukur spektrum inframerah (IR) TLC Scaner
alat evaporasi Buchi Rotavapor R-114 untuk menguapkan pelarut pada tekanan rendah
b. Bahan yang digunakan:
p-fluoroasetofenon, 4-hidroksi-3-metoksi-benzaldehid, etanol, HCl., gas N2, plat
KLT, metanol, aseton, n-heksan, etil asetat, metilen klorida, kloroform dengan kualitas tenis dan p.a. sebagai pelarut dalam pemisahan dan pemurnian senyawa. c. Prosedur Kerja
Turunan 4-hidroksi-3-metoksi-benzaldehid (26,6 mmol) dan dengan p-fluoroasetofenon (30 mmol) dilarutkan dalam etanol yang dijenuhkan dengan HCl. Tetes demi tetes HCl dimasukkan dalam campuran reaksi bersamaan dengan itu gas N2 juga
dialirkan ke dalam campuran reaksi. Pengadukan dilakukan selama 6 jam dan setiap jam di cek dengan KLT. Pengadukan dihentikan ketika noktah produk reaksi nampak dominan. Kemudian campuran reaksi dituangkan ke dalam air es dan di aduk sampai terbentuk kristal. Setelah dibiarkan selama 3 jam campuran reaksi disaring dan kristalnya direkristalisasi menggunakan pelarut yang sesuai. Identifikasi dan elusidasi struktur dilakukan dengan membandingkan data kromatografi lapis tipis (KLT) pada berbagai eluen dengan senyawa yang telah ditemukan sebelumnya, dan menggunakan analisis data spektrum UV-VIS dan IR.
15 2. Uji Sitotoksik dengan MTT assay
a. Alat yang digunakan : tangki nitrogen cair, mikroskop fluoresensi, mikroskop fase kontras,mikroskop fluoresensi, penangas air, sentrifuge, inkubator CO2 , incubator,
ELISA (Enzyme Linked Immunosorbent Assay) reader, hemocytometer (New Bauer), tabung conical steril, scraper, tissue culture flask, ampul, plate, laminar airflow, pH meter, mikroplate 96 sumuran, mikropipet, vorteks, timbangan elektrik, eppendorft, pipet, dan tip.
b. Bahan yang digunakan: Cell line cancer Sel HeLa, Medium Rosewell Park Memorial Institut (RPMI) 1640 (GIBCO BRL), medium penumbuh mengandung growth factor 10% dan 20% FBS (Fetal Bovine Serum) (Sigma Chem. CO. St. Louis. USA), DMSO (Dimetil Sulfoksida), natrium karbonat (E.Merck), kertas saring 0,2 m, akuades, fungizon dan antibiotik penisilin dan streptromisin (Sigma Chem. CO. St. Louis. USA), hepes dan tripsin (Sigma Chem. CO. St. Louis. USA). bromida), SDS (Sodium duodecyl sulphate)10% dalam HCl 0,01 N.
c. Prosedur Kerja
Sel dengan konsentrasi 1 x 104 sel/sumuran didistribusikan ke dalam plate 96 sumuran dan diinkubasi selama 24 jam untuk beradaptasi dan menempel di sumuran. Keesokannya media diambil kemudian ditambahkan 100 μl media kultur yang mengandung DMSO 0,2% (kontrol) atau sampel, inkubasi selama 24 jam. Pada akhir inkubasi, media kultur yang mengandung sampel dibuang, dicuci dengan 100 l PBS. Kemudian ke dalam masing-masing sumuran ditambahkan 100 l media kultur yang mengandung MTT 5 mg/ml, inkubasi lagi selama 4 jam pada suhu 37°C. Sel yang hidup akan bereaksi dengan MTT membentuk kristal formazan berwarna ungu. Setelah 4 jam, media yang mengandung MTT dibuang, kemudian ditambahkan larutan SDS untuk melarutkan kristal formazan. Digoyang di atas shaker selama 10 menit kemudian dibaca dengan dengan ELISA reader pada panjang gelombang 595 nm. Data absorbansi perlakuan tunggal dikonversi ke dalam persen sel. Potensi aplikasi dalam terapi kombinasi dianalisis dengan membandingkan viabilitas sel perlakuan tunggal dengan kombinasi. Data absorbansi perlakuan tunggal dikonversi ke dalam persen sel hidup dan digunakan untuk menghitung IC
16
dengan menggunakan metode indeks kombinasi (combinatorial index method/CI) berdasarkan Chou (Reynolds and Maurer, 2005).
3. Uji Pengamatan Apoptosis dengan Flowcytometer
a. Alat yang digunakan : Flowcytometer, perlengkapan perlindungan diri (sarung tangan steril, jas lab.), plate 6 well, Air Flow Hood (LAF), inkubator CO
2, tissue
culture flask/dish, pen marker, mikropipet, tip, rak ampul/tempat eppendorf, tissue, alat-alat gelas, flakon, kamera digital, autoklaf, sentrifus
b. Bahan yang digunakan : Tripsin, media kultur, Phosphat Buffer Saline (PBS) dan Annexin- V-Fluos Staining Kit Roche.
c. Prosedur Penelitian
Sel (kepadatan 5 X 105 sel/sumuran) ditanam dalam plate 6 well sampai 50-60 % konfluen. Setelah itu diinkubasi dengan senyawa uji selama 24 jam. Medium diambil dan dimasukkan dalam tabung sentrifus. Sel di cuci dengan tripsin 0,25% untuk melepas sel dari plate dan dilakukan inkubasi selama 3 menit dalam inkubator CO2. Kemudian
ditambahkan media kultur 1 mL. Sel beserta media kultur tersebut dipindahkan juga dalam tabung sentrifus. Selanjutnya sel yang masih tersisa dalam plate dicuci dengan PBS 2X masing-masing sebanyak 1 mL dan PBS ditambahkan dalam tabung sentrifus. Kemudian disentrifus pada 600 g selama 5 menit. Media dibuang dan sel dicuci dengan PBS 1 mL dan disentrifus pada 200 g selama 5 menit. Larutan PBS dibuang dan sel diresuspensi dengan 100 L Annexin-V-Fluos-labelling solution yang terdiri dari (2 L Annexin-V-Fluos, 100 L buffer, dan 2 L propidium iodide ) untuk 1 kali reaksi. Inkubasi selama 10 menit pada ruang gelap dan dianalis dengan flowcytometer.
D. Penelitian Tahun Kedua
1. Uji Penghambatan Daur sel dengan flowcytometry
a. Alat yang digunakan : Flowcytometer (FACSCalibur), perlengkapan perlindungan diri (sarung tangan steril, jas lab.), waterbath yang telah distel temperaturnya (37°C), Laminar Air Flow Hood (LAF), inkubator CO
2, tissue culture flask/dish,
17
flakon, timbangan analitik, mikroskop cahaya, inverted microscope, tabung konikal, haemocytometer, cell counter, kamera digital, autoklaf, filter, vorteks, sentrifus. b. Bahan yang digunakan: Reagen propidium iodida (PI) : 7% triton X (Merck),
0,2% RNase, 5% PI (Sigma) 0,1 mg% dalam PBS, dilarutkan dengan PBS hingga 100%.
c. Prosedur Kerja
Sel HeLa hasil panen ditumbuhkan pada plate kultur 6 sumuran sejumlah 5 x 105 sel/sumuran. Setelah inkubasi selama 24 jam sel diberi perlakuan dengan 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on pada berbagai konsentrasi. Pemanenan sel dilakukan pada jam ke 24 dan jam 48 setelah perlakuan. Sel dipanen menggunakan tripsin/EDTA 0.25%/0.02%, kemudian disentrifugasi 1000 RPM selama 5 menit, dan dicuci dengan PBS dingin. Sel diinkubasi dengan larutan propidium iodida (PI) 500 l (PI 50 mg/ml dalam PBS yang mengandung 0.1% triton-X). Sel selanjutnya diberi perlakuan dengan RNAse bebas DNAse (20 mg/ml) selama 10 menit pada suhu 370C. Sel dianalisis dengan alat flowcytometer BD FACSCalybur.
2. Uji Penghambatan Ekspresi Protein Bcl-2, p53, dan Bax dengan Imunositokimia
a. Alat yang digunakan : coverslips, plate 24 well, incubator, mikroskop cahaya. b. Bahan yang digunakan : Aseton (E.Merck), serum kambing normal (Novocastra),
antibodi primer terhadap p53, Bax, Bcl-2, CycD, dan CDK2, PBS, streptavidin, biotin, antibodi IgG sekunder terbiotinilasi (Novocastra), konjugat streptavidin terhadap peroksidase kuda (Novocastra), kromogen 3,3-diaminobenzidin (DAB) (Novocastra), akuades, dan mayer-hematoksilin (Dako).
c. Prosedur Kerja
Sel (kepadatan 5 X 10
4
sel/sumuran) ditanam pada coverslips dalam plate 24 sampai 80 % konfluen. Setelah itu diinkubasi dengan senyawa uji selama 4 dan 8 jam. Medium diambil, dicuci dengan PBS. Selanjutnya dilakukan fiksasi dengan formalin 4% selama 20 menit, cuci PBS, dilanjutkan dengan dehidrasi menggunakan etanol konsentrasi bertingkat yaitu 50, 70 dan 95%, masing-masing selama 5 menit. Cover slip yang memuat sel diangkat, diletakan diatas dish 6 cm. Ditetesi dengan normal mouse
18
serum (1:50) selama 15 menit, dibuang (tanpa cuci), lalu ditetesi dengan Primer Antibodi Monoklonal anti p53, Bax, dan Bcl-2 selama 60 menit dan dicuci dalam PBS sebanyak 3 kali. Preparat diinkubasi dalam biotin selama 10 menit dan dicuci dengan PBS sebanyak 2 kali selama 5 menit. Kemudian preparat diinkubasi dalam streptavidin-peroksidase selama 10 menit dan dicuci dengan PBS sebanyak 2 kali selama 5 menit. Selanjutnya, preparat diinkubasi dalam DAB selama 3-8 menit dan dicuci dengan akuades. Preparat direndam dalam hematoksilin selama 3-4 menit untuk counterstain dan dicuci dengan akuades. Ekspresi protein diamati menggunakan mikroskop cahaya. Sel yang mengekspresikan protein tertentu akan memberikan warna coklat/gelap, sedangkan yang tidak mengekspresikan protein tertentu memberikan warna ungu.
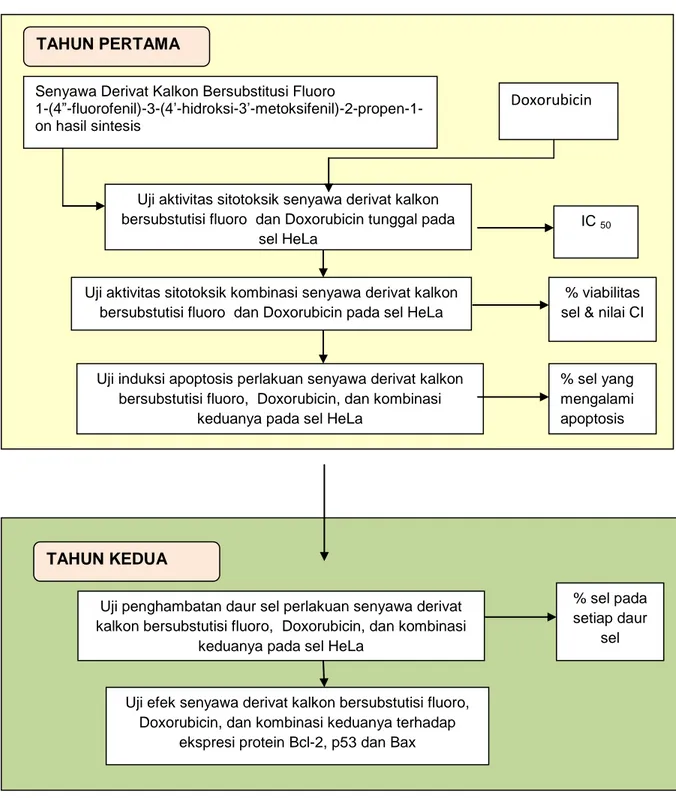
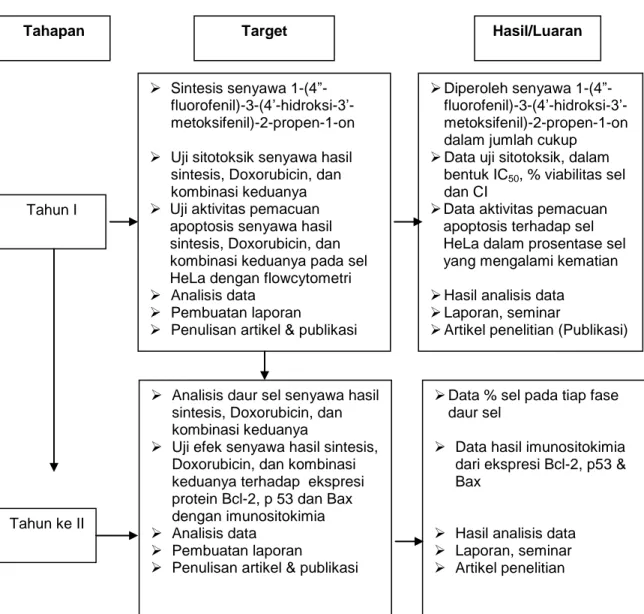
Secara keseluruhan, bagan alir penelitian dan tahapan Tahapan Penelitian dan hasil yang ditargetkan, berturut-tutut disajikan pada Gambar 2 dan Gambar 3.
19
Gambar 2. Bagan alir penelitian
Senyawa Derivat Kalkon Bersubstitusi Fluoro
1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on hasil sintesis
Uji induksi apoptosis perlakuan senyawa derivat kalkon bersubstutisi fluoro, Doxorubicin, dan kombinasi
keduanya pada sel HeLa
Uji aktivitas sitotoksik kombinasi senyawa derivat kalkon bersubstutisi fluoro dan Doxorubicin pada sel HeLa
IC 50
% viabilitas sel & nilai CI
Doxorubicin
Uji aktivitas sitotoksik senyawa derivat kalkon bersubstutisi fluoro dan Doxorubicin tunggal pada
sel HeLa
% sel yang mengalami apoptosis
Uji penghambatan daur sel perlakuan senyawa derivat kalkon bersubstutisi fluoro, Doxorubicin, dan kombinasi
keduanya pada sel HeLa
% sel pada setiap daur
sel Uji efek senyawa derivat kalkon bersubstutisi fluoro,
Doxorubicin, dan kombinasi keduanya terhadap ekspresi protein Bcl-2, p53 dan Bax
pada sel HeLa
TAHUN PERTAMA
20
Gambar 3. Bagan tahapan penelitian dan hasil yang ditargetkan
Tahun I
Sintesis senyawa 1-(4”- fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on Uji sitotoksik senyawa hasil
sintesis, Doxorubicin, dan kombinasi keduanya Uji aktivitas pemacuan
apoptosis senyawa hasil sintesis, Doxorubicin, dan kombinasi keduanya pada sel HeLa dengan flowcytometri Analisis data
Pembuatan laporan
Penulisan artikel & publikasi
Analisis daur sel senyawa hasil sintesis, Doxorubicin, dan kombinasi keduanya
Uji efek senyawa hasil sintesis, Doxorubicin, dan kombinasi keduanya terhadap ekspresi protein Bcl-2, p 53 dan Bax dengan imunositokimia Analisis data
Pembuatan laporan
Penulisan artikel & publikasi Tahun ke II
Tahapan Target Hasil/Luaran
Diperoleh senyawa 1-(4”- fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dalam jumlah cukup Data uji sitotoksik, dalam
bentuk IC50, % viabilitas sel
dan CI
Data aktivitas pemacuan apoptosis terhadap sel HeLa dalam prosentase sel yang mengalami kematian Hasil analisis data
Laporan, seminar
Artikel penelitian (Publikasi)
Data % sel pada tiap fase daur sel
Data hasil imunositokimia dari ekspresi Bcl-2, p53 & Bax
Hasil analisis data Laporan, seminar Artikel penelitian
21 BAB V
HASIL DAN PEMBAHASAN
A. Hasil Penelitian
1. Sintesis 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on
Sintesis senyawa derivat kalkon bersubstituen fluoro dilakukan dengan mereaksikan p-fluoroasetofenon dengan 4-hidroksi-3-metoksi-benzaldehid, melalui reaksi kondensasi aldol silang dalam suasana asam. Identifikasi dan elusidasi struktur dilakukan dengan membandingkan data kromatografi lapis tipis (KLT) pada berbagai eluen dengan senyawa yang telah ditemukan sebelumnya (senyawa marker), dan menggunakan analisis data spektrum IR.
Identifikasi senyawa hasil sintesis yang dilakukan menggunakan KLT dengan eluen kloroforom : heksana = 2 : 1, dan heksana: metilen klorida = 1:2 menunjukkan hasil satu noda yang berarti bahwa senyawa hasil isolasi tersebut telah murni. Saat dibandingkan dengan senyawa marker, senyawa hasil sintesis memiliki harga Rf (Retardation factor) yang sama dengan senyawa marker, yang berarti bahwa senyawa hasil sintesis tersebut adalah senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on.
Untuk lebih memastikan bahwa senyawa hasil sintesis tersebut merupakan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, dilakukan pengukuran titik lebur dan analisis gugus fungsionalnya menggunakan FT-IR dan dibandingkan dengan senyawa marker. Hasil pengukuran titik lebur disajikan pada Tabel 2, sedangkan hasil spektra dan analisis menggunakan FT-IR disajikan pada Tabel 3 dan Lampiran.
Tabel 2. Hasil pengukuran titik lebur senyawa hasil sintesis dibandingkan dengan marker
Senyawa Titik Leleh (oC)
Marker Hasil Sintesis
1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on
22
Berdasarkan data FT-IR (Tabel 3) diketahui bahwa senyawa hasil sintesis memiliki gugus fungsional yang sama dengan senyawa marker. Hal ini lebih memperkuat bukti bahwa senyawa hasil sintesis yang diperoleh adalah senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on.
Tabel 3. Hasil analisis FTIR
Senyawa Bilangan gelombang (cm
-1
) Keterangan Gugus
Fungsional Marker Hasil Sintesis
1-(4”- fluorofenil)- 3-(4’- hidroksi-3’- metoksifenil)- 2-propen-1-on
1637,67 1636,55 C=O, (gugus karbonil) 3439,30 3495,52 OH str aromatik 1597,16 1585,89 C=C str aromatik 3000-2800 & 1444,77 3000-2800 & 1444,46 alkil 1238,38 1340,73 metil
2. Uji Sitotoksik dengan MTT assay
a. Uji sitotoksik senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on pada sel HeLa
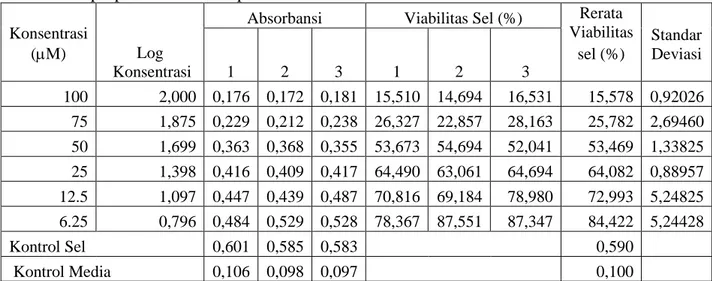
Potensi ketoksikan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on terhadap sel HeLa disajikan pada Tabel 4, dan grafik hubungan antara konsentrasi dengan prosentase viabilitas sel disajikan pada Gambar 4.
Gambar 4. Hubungan konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan % viabilitas sel HeLa.
23
Tabel 4. Hasil uji sitotoksik senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on terhadap kultur sel HeLa
Konsentrasi
(M) Log Konsentrasi
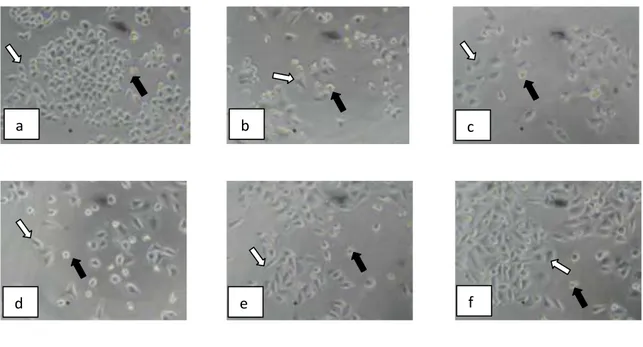
Absorbansi Viabilitas Sel (%) Rerata Viabilitas sel (%) Standar Deviasi 1 2 3 1 2 3 100 2,000 0,176 0,172 0,181 15,510 14,694 16,531 15,578 0,92026 75 1,875 0,229 0,212 0,238 26,327 22,857 28,163 25,782 2,69460 50 1,699 0,363 0,368 0,355 53,673 54,694 52,041 53,469 1,33825 25 1,398 0,416 0,409 0,417 64,490 63,061 64,694 64,082 0,88957 12.5 1,097 0,447 0,439 0,487 70,816 69,184 78,980 72,993 5,24825 6.25 0,796 0,484 0,529 0,528 78,367 87,551 87,347 84,422 5,24428 Kontrol Sel 0,601 0,585 0,583 0,590 Kontrol Media 0,106 0,098 0,097 0,100 Morfologi sel HeLa karena penambahan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on disajikan pada Gambar 5. Bila dibandingkan dengan kontrol sel, nampak bahwa semakin besar konsentrasi penambahan senyawa uji, semakin banyak sel yang mati.
Gambar 5. Morfologi sel HeLa: (a) Tanpa perlakuan (kontrol sel) dan dengan perlakuan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on konsentrasi : (b) 100 M, (c) 75 M, (d) 50 M, (e) 25 M,(f) dan 12,5 M. Panah putih menunjukkan sel yang hidup, dan panah hitam menunjukkan sel yang mati
a b
f
d e
24 b. Uji sitotoksik doxorubicin pada sel HeLa
Potensi ketoksikan Doxorubisin terhadap sel HeLa disajikan pada Tabel 5, dan grafik hubungan antara konsentrasi dengan prosentase viabilitas sel disajikan pada Gambar 6. Semakin tinggi konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, semakin rendah vibilitas sel HeLa. Nilai IC50 Doksorubisin
terhadap sel HeLa diperoleh sebesar 1 M.
Tabel 5. Hasil uji sitotoksik Doxorubicin terhadap kultur sel HeLa Konsentrasi
(M)
Log Konsentrasi
Absorbansi Viabilitas Sel (%) Rerata Standar Deviasi 1 2 3 1 2 3 Viabilitas sel (%) 5 0,699 0,304 0,303 0,298 41,633 41,429 40,408 41,156 0,65603 2.5 0,398 0,314 0,311 0,311 43,673 43,061 43,061 43,265 0,35348 1 0,000 0,356 0,360 0,344 52,245 53,061 49,796 51,701 1,69932 0.5 -0,301 0,379 0,380 0,356 56,939 57,143 52,245 55,442 2,77080 0.25 -0,602 0,396 0,390 0,391 60,408 59,184 59,388 59,660 0,65603 0.125 -0,903 0,433 0,406 0,449 67,959 62,449 71,224 67,211 4,43535 0.0625 -1,204 0,492 0,509 0,478 80,000 83,469 77,143 80,204 3,16820 0.03125 -1,505 0,567 0,558 0,526 95,306 93,469 86,939 91,905 4,39763 Kontrol Sel 0,601 0,585 0,583 0,590 Kontrol Media 0,106 0,098 0,097 0,100
Gambar 6. Hubungan konsentrasi Doxorubicin dengan % viabilitas sel HeLa. IC50 = 1 M
25
Morfologi sel HeLa karena penambahan senyawa Doxorubicin disajikan pada Gambar 7. Bila dibandingkan dengan kontrol sel, nampak bahwa semakin besar konsentrasi penambahan Doxorubicin, semakin banyak sel yang mengalami kematian.
Gambar 7. Morfologi Sel HeLa: (a) Tanpa Perlakuan (kontrol sel) dan dengan Perlakuan Doxorubicin Konsentrasi : (b) 5 M, (c) 2,5 M, (d) 1 M, (e) 0,5 M,(f) dan 0,25 M. Panah putih menunjukkan sel yang hidup, dan panah hitam menunjukkan sel yang mati
c. Uji sitotoksik kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan doxorubicin pada sel HeLa
Uji sitotoksik kombinasi doxorubicin dan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on terhadap sel HeLa dilakukan pada konsentrasi (1/8; 1/4; 3/8 dan 1/2) dari nilai IC50, yaitu konsentrasi senyawa
1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on sebesar 4,25; 8,5; 12,75; dan 17 M, sedangkan konsentrasi Doxorubicin sebesar 0,125; 0,25; 0,375; dan 0,5 M. Kombinasi kedua senyawa ini mampu menurunkan viabilitas sel lebih rendah daripada penggunaan masing-masing senyawa secara tunggal sebagaimana ditunjukkan pada Tabel 6 .
a b c
f e
26
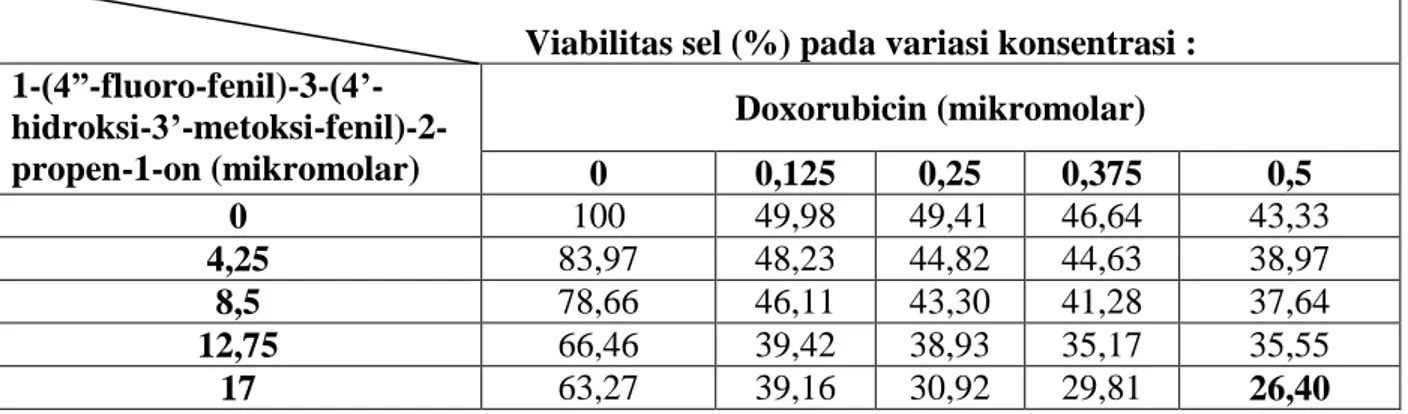
Tabel 6. Persen viabilitas sel perlakuan kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan Doxorubicin pada berbagai variasi konsentrasi.
Viabilitas sel (%) pada variasi konsentrasi : 1-(4”-fluoro-fenil)-3-(4’- hidroksi-3’-metoksi-fenil)-2-propen-1-on (mikromolar) Doxorubicin (mikromolar) 0 0,125 0,25 0,375 0,5 0 100 49,98 49,41 46,64 43,33 4,25 83,97 48,23 44,82 44,63 38,97 8,5 78,66 46,11 43,30 41,28 37,64 12,75 66,46 39,42 38,93 35,17 35,55 17 63,27 39,16 30,92 29,81 26,40
Penurunan viabilitas sel tersebut juga nampak pada Gambar 8. Pada penelitian ini viabilitas sel terendah diperoleh pada kombinasi konsentasri doxorubicin sebesar 0,5 M dan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on sebesar 17 M.
Selain itu sitotoksik kombinasi juga ditetapkan dengan menghitung indeks interaksi antara agen kemoterapi dengan 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on menggunakan persamaan :
Combination Index/CI = (D)1/(Dx)1 + (D)2/(Dx)2
D1 dan D2 adalah konsentrasi sampel yang digunakan dalam perlakuan kombinasi. (Dx)1 dan (Dx)2 adalah konsentrasi tunggal yang dapat menghasilkan efek sebesar yang ditimbulkan perlakuan kombinasi (Reynols and Maurer,2005). Angka CI yang diperoleh diinterpretasikan sebagaimana Tabel 7, sedangkan hasil perhitungannya disajikan pada Tabel 8 dan Gambar 9. (Reynols and Maurer,2005).
Tabel 7. Interpretasi nilai indeks kombinasi (CI)
Nilai CI Interpretasi
< 0,1 sinergi sangat kuat
0,1 - 0,3 sinergis kuat 0,3 - 0,7 sinergis 0,7 - 0,9 sinergis ringan-sedang 0,9 - 1,1 mendekati aditif 1,1 - 1,45 antagonis ringan-sedang 1,45 - 3,3 antagonis
27
Gambar 8. Profil viabilitas sel perlakuan kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan doxorubicin pada berbagai variasi konsentrasi.
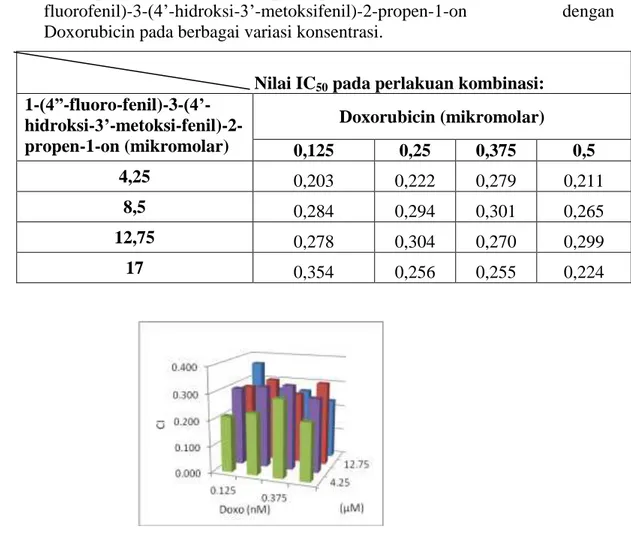
Tabel 8. Hasil perhitungan nilai CI pada perlakuan kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan Doxorubicin pada berbagai variasi konsentrasi.
Nilai IC50 pada perlakuan kombinasi: 1-(4”-fluoro-fenil)-3-(4’- hidroksi-3’-metoksi-fenil)-2-propen-1-on (mikromolar) Doxorubicin (mikromolar) 0,125 0,25 0,375 0,5 4,25 0,203 0,222 0,279 0,211 8,5 0,284 0,294 0,301 0,265 12,75 0,278 0,304 0,270 0,299 17 0,354 0,256 0,255 0,224
Gambar 9. Nilai CI perlakuan kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan Doxorubicin pada berbagai variasi konsentrasi pada kultur sel HeLa.
28
3. Uji Pengamatan Apoptosis dengan Flowcytometer
Pengamatan apoptosis dilakukan pada sel HeLa tanpa perlakukan, dengan perlakukan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, dengan perlakuan doxorubicin, dan kombinasi keduanya pada inkubasi 24 jam. Konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on yang digunakan sebesar 17 M, konsentrasi doxorubicin sebesar 0,5 M, dan kombinasi keduanya. Besarnya konsentrasi tersebut berdasarkan pada hasil uji kombinasi, dimana viabilitas sel terendah diperoleh pada kombinasi konsentrasi doxorubicin sebesar 0,5 M dan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on sebesar 17 M.
Hasil pengamatan apoptosis dengan flowcytometer pada sel HeLa disajikan pada Gambar 10, Gambar 11, Gambar 12, dan Gambar 13, sedangkan rekapitulasi hasil pengamatan disajikan pada Tabel 9.
Gambar 10. Hasil pengamatan apoptosis pada sel HeLa tanpa perlakuan dengan flowcytometer. Warna biru menunjukkan sel yang hidup, warna hijau menunjukkan sel yang mengalami early apoptosis, dan warna orange menunjukkan sel yang mengalami late apoptosis, warna kuning menunjukkan sel mengalami nekrosis.
Sample ID: KONTROL T47D Patient ID: 0717.13 Gated Ev ents: 20000 Quad % Gated % Total
UL 0.52 0.52 UR 1.49 1.49 LL 97.39 97.39 LR 0.60 0.60 R1 R2 R3 R4
Sample ID: KONTROL T47D Patient ID: 0717.13 Gated Ev ents: 20000 Quad % Gated % Total
UL 0.52 0.52 UR 1.49 1.49 LL 97.39 97.39 LR 0.60 0.60 R1 R2 R3 R4
29
Gambar 11. Hasil pengamatan apoptosis perlakuan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on pada sel HeLa dengan flowcytometer. Warna biru menunjukkan sel yang hidup, warna hijau menunjukkan sel yang mengalami early optosis, dan warna orange menunjukkan sel yang mengalami late apoptosis, dan warna kuning menunjukkan sel mengalami nekrosis.
Gambar 12. Hasil pengamatan apoptosis perlakuan Doxorubicin pada sel HeLa dengan flowcytometer. Warna biru menunjukkan sel yang hidup, warna hijau menunjukkan sel yang mengalami early optosis, dan warna orange menunjukkan sel yang mengalami late apoptosis, warna kuning menunjukkan sel mengalami nekrosis.
Sample ID: P10-17-T47D Patient ID: 0717.13 Gated Ev ents: 20000 Quad % Gated % Total
UL 3.44 3.44 UR 7.03 7.03 LL 87.82 87.82 LR 1.71 1.71 R1 R2 R3 R4
Sample ID: DOXO-1-T47D Patient ID: 0717.13 Gated Ev ents: 20000 Quad % Gated % Total
UL 28.80 28.80 UR 10.52 10.52 LL 59.76 59.76 LR 0.92 0.92 R1 R2 R3 R4
30
Gambar 13. Hasil pengamatan apoptosis perlakuan kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dan Doxorubicin pada sel HeLa dengan flowcytometer. Warna biru menunjukkan sel yang hidup, warna hijau menunjukkan sel yang mengalami early optosis, dan warna orange menunjukkan sel yang mengalami late apoptosis, warna kuning menunjukkan sel mengami nekrosis.
Tabel 9. Pengaruh perlakuan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, Doxorubicin dan kombinasi keduanya terhadap kematian sel HeLa menggunakan Annexin dengan pembacaan flowcytometer dengan waktu inkubasi 24 jam.
Perlakuan Prosentase (%) Sel HeLa
Sel Hidup Early Apoptosis Late Apoptosis Nekrosis
Tanpa Perlakuan 97,39 0,6 1,49 0,52 1-(4”-fluorofenil)-3- (4’-hidroksi-3’- metoksifenil)-2-propen-1-on 17 M 87,82 1,71 7,03 3,44 Doxorubicin 0,5 M 59,76 0,92 10,52 28,80 Kombinasi 1-(4”- fluorofenil)-3-(4’- hidroksi-3’- metoksifenil)-2-propen-1-on 17 M & Doxorubicin 0,5 M 49,73 0,83 11,24 38,20
Sample ID: KOM-1-T47D Patient ID: 0717.13 Gated Ev ents: 20000 Quad % Gated % Total
UL 38.20 38.20 UR 11.24 11.24 LL 49.73 49.73 LR 0.83 0.83 R1 R2 R3 R4
31
Dari hasil tersebut menunjukkan bahwa senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on baik senyawa tunggal maupun kombinasi dengan doxorubicin mampu memacu apoptosis sel HeLa dibandingkan tanpa perlakuan. Pada penggunaan kombinasi lebih dapat memacu apoptosis disbanding pemakaian secara tunggal.
B. Pembahasan
Pada penelitian ini senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on berhasil disintesis dengan mereaksikan p-fluoroasetofenon dengan 4-hidroksi-3-metoksi-benzaldehid, melalui reaksi kondensasi aldol silang dalam suasana asam. Analisis dengan membandingkan data spektrum IR menunjukkan adanya kesamaan gugus fungsional antara senyawa hasil sintesis dengan marker, yaitu senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on hasil sintesis Indyah (2010). Kesamaan gugus tersebut antara lain adanya gugus karbonil (C=O), hidroksil, C=C, alkil, dan metil. Adapun struktur senyawa tersebut disajikan pada Gambar 14.
Gambar 14. (1). Struktur dasar senyawa kalkon, dan (2) Struktur senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on
Senyawa-senyawa kalkon dapat memiliki substitusi yang berbeda pada posisi orto dan para. Selain itu kalkon memiliki ikatan rangkap terkonjugasi dan sistem electron- terdelokalisasi yang lengkap pada kedua cincin benzene. Molekul dengan sistem ini umumnya memiliki potensial redoks yang rendah dan mempunyai probabilitas tinggi untuk melakukan transfer elektron (Yadav, et.al., 2012). Senyawa
1-(4”-O HO H3C F (1) (2) CH3O
32
fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on mempunyai gugus hidroksil dan fluoro pada posisi para dan metoksi pada posisi meta.
Hasil uji sitotoksik senyawa tunggal 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on pada sel HeLa menunjukkan senyawa ini bersifat toksik. Berdasarkan hasil pengamatan menunjukkan bahwa terdapat hubungan langsung antara perubahan konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan tingkat kematian sel HeLa. Semakin tinggi konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, semakin rendah viabilitas sel HeLa atau semakin banyak jumlah sel HeLa yang mengalami kematian. Berdasarkan hasil perhitungan diperoleh nilai IC50 dari senyawa ini terhadap sel HeLa
sebesar 34 M yang termasuk kategori aktif. Adanya gugus OH dan gugus fluoro yang terdapat pada senyawa ini diperkirakan memberikan kontribusi pada sifat toksisitas senyawa terhadap sel HeLa. Pada beberapa hasil penelitian tentang aktivitas senyawa derivat kalkon, adanya substitusi gugus metoksi pada cincin A dan substitusi fluoro, kloro, bromo dan cincin B mampu meningkatkan penghambatan aktivitas NF-B, suatu faktor transkripsi yang berperan dalam pengembangan dan progresi kanker (Folmer, et.al., 2006, dan Kim, et. al., 2007). Selain itu adanya gugus karbonil tak jenuh -unsaturated carbonylyang terdapat pada kalkon juga memberikan kontribusi pada aktivitas sitotoksik pada sel HeLa. Menurut Srinivasan, et al, 2009 adanya ikatan tak jenuh yang bersifat sangat elektrofilik dapat menimbulkan radikal thiyl yang mengarah ke pengurangan alkena melalui adisi Michaelis kovalen dari nukleofil, seperti SH dari cystin dari DNA, yang mengikat NF-B.
Perlakuan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on juga menunjukkan perubahan morfologi sel yang signifikan seiring meningkatnya konsentrasi. Perubahan morfologi sel tersebut menyebabkan menurunnya viabilitas sel HeLa.
Bila dibandingkan dengan Doxorubicin, senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on memiliki aktivitas lebih rendah. Doxorubicin merupakan agen kemoterapi yang banyak digunakan dalam terapi berbagai kanker epitel. Doxorubicin dapat berinterkelasi dengan DNA sehingga fungsi DNA sebagai template dan pertukaran sister chromatid terganggu pada pita DNA terputus. Obat ini juga dapat
33
bereaksi dengan sitokrom P450 reduktase dengan adanya NADPH membentuk zat perantara yang akan bereaksi dengan oksigen menghasilkan radikal bebas yang dapat mengancurkan sel. Pada penelitian ini diperoleh nilai IC50 dari doxorubicin sebesar1 M.
Hasil penelitian menunjukkan bahwa kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan doxorubicin mampu meningkatkan aktivitas sitotoksik pada sel HeLa dibandingkan dengan perlakuan tunggal. Kombinasi keduanya menghasilkan efek yang saling menguatkan. Semakin tingi konsentrasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on, semakin kuat peningkatan efek sitotoksik Doxorubicin oleh senyawa ini pada sel HeLa.
Berdasarkan perhitungan nilai CI, terlihat bahwa pada kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan konsentrasi sebesar 4,25; 8,5; 12,75; dan 17 M, dan konsentrasi doxorubicin sebesar 0,125; 0,25; 0,375; dan 0,5 M, memberikan interprestasi sinergi kuat, karena memiliki nilai CI antara 0,1-0,3. Namun pada kombinasi senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on dengan konsentrasi sebesar 17 M dan konsentrasi doxorubicin sebesar 0,125 M memiliki nilai CI di atas 0,3, sehingga masuk kategori sinergi. Dari hasil ini membuktikan bahwa senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on berpotensi untuk digunakan sebagai agen ko-kemoterapi Doxorubicin.
Hasil pengamatan apoptosis menggunakan flowcytometer menunjukkan bahwa perlakuan senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on pada konsentrasi 17 M dengan waktu inkubasi 24 jam menyebabkan 8,74% sel HeLa mengalami apoptosis. Jumlah ini lebih tinggi dibandingkan dengan sel tanpa perlakuan (2,09%). Demikian juga perlakuan dengan Doxorubicin pada konsentrasi 0,5 M menyebabkan 11,44% sel mengalami apoptosis, sedangkan kombinasi keduanya menyebabkan 12,07% sel mengalami apoptosis. Data ini menunjukkan bahwa senyawa 1-(4”-fluorofenil)-3-(4’-hidroksi-3’-metoksifenil)-2-propen-1-on mampu memacu terjadinya apoptosis pada sel HeLa, dan kombinasi senyawa ini dengan Doxorubicin meningkatkan kemampuan Doxorubicin dalam memacu terjadinya apoptosis. Adanya sel yang mengalami apoptosis ini menyebabkan viabilitas sel HeLa menurun. Hasil penelitian ini sejalan dengan penelitian Hsu et al., (2006) yang menunjukkan bahwa struktur inti dari kalkon mampu menghambat proliferasi sel pada sel kanker payudara
34
dengan menghambat progresi daur sel dan menginduksi apoptosis melalui jalur mitokondria dan death receptor. Pada penelitian ini adanya substitusi gugus hidroksil, metoksi dan fluoro pada senyawa kalkon ternyata juga mampu menghambat proliferasi sel dan memacu apoptosis. Selanjutnya perlu dikaji lebih lanjut mekanisme terjadinya apoptosis atau program bunuh diri sel, antara lain dengan melalui perubahan ekspresi protein pengatur apoptosis seperti Bcl-2, p53 dan Bax yang akan dilakukan pada tahun kedua.
Efek sitotoksik selain disebabkan oleh pemacuan apoptosis juga disebabkan oleh pemacuan penghambatan daur sel (cell cycle arrest). Oleh karena itu penelitian selanjutnya juga akan melakukan pengamatan penghambata daur sel sebagai wujud nyata dari perubahan fisiologis atau morfologis.
35 BAB VI
RENCANA TAHAPAN BERIKUTNYA
Pada tahun kedua akan dilakukan penelitian untuk mengkaji lebih lanjut mekanisme penyebab terjadinya apoptosis dengan mengamati ekspresi protein pengatur apoptosis seperti Bcl-2, p53 dan Bax. Selain itu juga akan dilakukan pengamatan daur sel, karena selain induksi apoptosis efek sitotoksik disebabkan juga oleh adanya pemacuan penghambatan daur sel. Dengan demikian tujuan kegiatan pada tahun kedua adalah:
1. Mengkaji efek perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya terhadap daur sel HeLa
2. Mengamati perubahan ekspresi Bcl-2, p53 dan Bax pada sel HeLa akibat perlakuan senyawa derivat kalkon bersubstituen fluoro, Doxorubicin, dan kombinasi keduanya
Pengamatan daur sel dilakukan dengan flowcytometer dan pengamatan ekspresi protein dengan imunositikimia.
36 BAB VII
KESIMPULAN DAN SARAN A. Kesimpulan
1. Senyawa derivat kalkon bersubstituen fluoro bersifat sitotoksik pada sel HeLa dengan IC50 sebesar 34 M, demikian juga doxorubicin dengan IC50 sebesar 1 M,
serta kombinasi senyawa tersebut dengan Doxorubicin umumnya memberikan efek sinergi kuat.
2. Senyawa derivat kalkon bersubstituen fluoro, doxorubicin, dan kombinasinya keduanya memacu terjadinya apoptosis pada sel HeLa.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut untuk menelusuri mekanisme pemacuan apoptosis dengan mengamati ekspresi protein yang terlibat dalam apoptosis seperti Bcl-2, p53 dan Bax.
2. Untuk mengetahui penyebab lain terjadinya efek sitotoksik, perlu dilakukan pengamatan daur siklus sel.
37
DAFTAR PUSTAKA
Afzal S., Asad M. K, Rumana Q. F, Ansari, Muhammad F. N, and Syed S. S. 2008. Redox Behavior of Anticancer Chalcone on a Glassy Carbon Electrode and Evaluation of its Interaction Parameters with DNA, Int. J. Mol. Sci. 2008, 9
Boumendjel A, Ronot X, Boutonnat. 2009 . Chalcone derivatives acting as cell cycle blockers : potensial anticancer drugs ? J Curr Drug Targets. Apr;10(4):363-71. Boyer, M.J., and Tannock, I.F., 2005, The Basic Science of Oncology: Cellular and
Molecular Basis of Drug Treatment for Cancer, Mc Graw Hill Compay, forth edition, New York.
Departemen Kesehatan RI. (1997). Profil Kesehatan Indonesia. Depkes RI. Jakarta Ferreira, A.L.A., Matsubara, L.S., and Matsubara, B.B., 2008, Anthracycline-Induced
Cardiotoxicity, Cardiotoxicity, Cardiovascular & Hematological Agents n Medical Chemistry, 6, 278-281.
Folmer F, Blasius R, Morceau F, Tabudravu J, Dicato M, Jaspars M, et al. Inhibition of TNFalpha induced activation of nuclear factor kappaB by kava (Piper methysticum) derivatives. Biochem Pharmacol. 2006; 71:1206–18.
Foster, J.S., Henley, D.C,. Ahamed, S., and Wimalasena, J., 2001, Estrogen and Cell Cycle Regulation in Breast Cancer, Trend in Endocrinology and Metabolism, 12 (7), 320-327.
Gerl, R., and Vaux, D.L., 2005, Apoptosis in The Development and Treatment of Cancer, Carcin., 26 (2), 263-270
Gondhowiardjo, S., 2004, Proliferasi Sel dan Keganasan, Majalah Kedokteran Indonesia, 54 (7), 289-299.
Hanahan, D., and Weinberg, R.A., 2000, The Hallmarks of Cancer, Cell, 100, 57-70 Hsu, Y.L., Kuo, P.L., Tzeng, W.W., and Lin, C.C., 2006, “Chalcone Inhibits the
Proliferation of Human Breast Cancer Cell by Blocking Cell Cycle Progression and Inducing Apoptosis”, Food Chem Toxicol, 44 (5):704-13
Indyah S.A., 2010, Synthesize and Citotoxicity Test of Several Compounds of mono para hidroxy chalcone, Indo. J. Chem., 2010, 10 91), 110-115
Indyah S.A., Henk T, Samhudi, Sastrohamidjojo, and Henk an der Goot., 2000., Synthesis of benzylideneacetophenones and their inhibition of lipidperoxidation., Eur. J., Med. Chem. 35, 449-457
Kampa, M., Alexaki, Vassilia-Ismini., Notas, George., Nifli, Artemissia-Phoebe., Nistikaki, Anatassia., Hatzoglou, Anastassia., Bakogeorge, Efstathia, Koumtzoglou, Elena., Blekas, George., Boskou, Dimitrios., Gravanis, Achille., and Castanas, E., 2004, Antiproliferatif and Apoptotic Effect of Selective Phenolic Acids on T47D Human Breast Cancer Cells: Potential Mechanisms of Action., Breast Cancer Res, 6: R63-R74
38
Kim YH, Kim J, Park H, Kim HP. Anti-inflammatory activity of the synthetic chalcone derivatives: inhibition of inducible nitric oxide synthase-catalyzed nitric oxide production from lipopolysaccharide-treated RAW 264.7 cells. Biol Pharm Bull. 2007; 30:1450–5.
Lee, Y.S.; Lim, S.S.; Shin, K.H.; Kim, Y.S.; Ohuchi, K.; Jung, S.H.2006. Anti-angiogenic and antitumoractivities of 2-hydroxy-4- methoxychalcone. Biol. Pharm. Bull. 29, 1028-1031.
Lodish, H., Berk, A., Zipursky, Lawrence, S., Matsurada, P., Baltimore, D., and Darnel, J., 2000, Molecular Cell Biology, 4
th
Edition, W.H. Freeman and Company, New York, 1054-1062.
Matheny, C. J. M., Lamb, M. W., Brouwer, K. L. R., and Pollack, G. M., 2001, “Pharmacokinetic and Pharmacodynamic Implications of P-glycoprotein Modulation”, Pharmacotherapy, 21 (7), 778-796.
Mathivadani, P., Shanthi, P., and Sachdanandam, P., 2007, “Apoptotic Effect of Semecarpus anacardium nut Extract on T47D Cancer Cell Line”, Cell.Biol. Int., 31, 1198-1206
Meiyanto, E., 1999, Kurkumin Sebagai Obat Kanker : Menelusuri Mekanisme Aksinya, Majalah Farmasi Indonesia, 10 (4), 224-236.
Meiyanto, E., 2002, Bahan Kuliah Biologi Molekuler: Signal Transduksi-Cell Cycle-Transposon, Proyek Que Fakultas Farmasi UGM, Yogyakarta
Petak, I., Houghton, Janet A., and Kopper, L., 2006, Molecular Targeting of Cell Death Signal Transduction Pathways in Cancer, Current Signal Transduction Therapy, 1, 113-131.
Pines, J., 1997, Mammalian Cell Cycle, Oncogenes and Tumor Suppressors, IRL Press, Oxford University Press, New York, 189-191.
Rabbani, A., Finn R.M., Ausio J., 2004, The anthracycline antibiotics: antitumor drugs that alter choromatin structure, BioEssays 27:50-56.
Retno A, Indyah, S.A., dan Sri A., 2010, Uji Sitotoksisitas Senyawa Mono Para Hidroksi Kalkon terhadap Cancer cell lines T47D, Saintek Jurnal, UNY
Reynold, C.P., and Meurer, B.J., 2005, Evaluating Response to Antineoplastic Drug Combination in Tissue Culture Models, Methods Mol. Med., 110, 173-183
Sasayama, T.; Tanaka, K.; Mizukawa, K.; Kawamura, A.; Kondoh, T.; Hosoda, K.; Kohmura, E. 2007. Trans-4-lodo,4-boranyl-chalcone induces antitumor activity against malignant glioma cell lines in vitro and in vivo. J. Neu-Onc. 85, 123-132 Singal, P.K., and Iliskovic, N., 1998, “Doxorubicin-induced Cardiomyopathy”, N. Engl.
J. Med. 339:900-905
Srinivasan B, Johnson TE, Lad R, Xing C. Structure-activity relationship studies of chalcone leading to 3-hydroxy-4,3′,4′,5′-tetramethoxychalcone and its analogues
39
as potent nuclear factor kappaB inhibitors and their anticancer activities. J Med Chem. 2009; 52:7228–35.
Teich, N. M., 1997, Oncogenes and Cancer in Franks, L.M. dan Teich, N.M., Cellular and Molecular Biology of Cancer, 3
rd
Edition, Oxford University Press, London. Tjindarbumi, D. and Mangunkusumo, R., 2002, “Cancer in Indonesia, Present and
Future”, Jpn. J. Clin. Oncol. 32 (Supplement 1): S17-21
Toshio M. Li-Bo W. ,Seikou N. , Kiyofumi N., Eri Y., Hisashi M., Osamu .M., Li-Jun W., and Masayuki Y., 2009., Medicinal Flowers. XXVII.1) New Flavanone and Chalcone Glycosides, Arenariumosides I, II, III, and IV, and Tumor Necrosis Factor-a Inhibitors from Everlasting, Flowers of Helichrysum arenarium, Chem. Pharm. Bull. 57(4) 361—367 (2009)
Tsao, A.S., Kim, E.S., Hong, W.K., 2004, Chemopevention of Cancer, C.A Cancer J Clin, 54:150-180
Valeria, P., 2005, “Changes in P-Glycoprotein Activity Are Mediated by The Growth of A Tumour Cell Line as Multicellular Spheroids”, Cancer Cell International, 5. Wong, H.L., Bendayan, R., Rauth, A.M., Xue, H.Y., Babakhanian, K., and Wu, X.Y.,
2006, “A Mechanistic Study of Enhanced Doxorubicin Uptake and Retention in Multidrug Resistant Breast Cancer Cells Using A Polymer-Lipid Hybrid
Nanoparticle System”, The Journal of Pharmacology and Experimental Therapeutics, 317 (3), 1372-1381
World Health Organization. (1998). The World Health Report : live in the 21st century, A vision for all, WHO, Geneva
World Health Organization. (2009).Fact Sheet No. 297, Cancer
Wyllie, A., Donahue, V., Fischer, B., Hill, D., Keesey, J., and Manzow, S., 2000, Cell Death Apoptosis and Necrosis, Rosche Diagnostic Corporation
Xu, Z-X., Liang, J., Gaikwad, A., Connoly, F.P., Milss, G.B., and Guttermann, J.U., 2007, A plant Triterpenoid, avicin D, Induces Autophagy by Activation of AMP-activated Protein Kinase, Cell Death and Differentitaion, 14:1948-1957.
Yadav., V.R., Prasad, S., Sung, B., and Anggarwal, B.B., 2011, “The Role of Chalcones in Suppression of NF-kB-mediated Inflammation and Cancer”, International Immunopharmacology, 11 (3) : 295-309
Ye, C.L.; Liu, J.W.; Wei, D.Z.; Lu, Y.H.; Qian, F. 2005. In vivo antitumor activity by 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone in a solid human carcinoma xenograft model. Canc. Chemo.Pharm., 55, 447-452.
Ye, C.L.; Liu, J.W.; Wei, D.Z.; Lu, Y.H.; Qian, F.2004. In vitro anti-tumor activity of 2, 4-dihydroxy-6-methoxy-3, 5-dimethylchalcone against six established human cancer cell lines. Pharmacol. Res. 2004, 50, 505-510