2.8
BAKTERI SIDEROFOR
Edi HusenSiderofor (siderophore) adalah senyawa pengompleks Fe3+ atau
pengkhelat besi spesifik yang dihasilkan oleh beberapa jenis mikroba untuk menyembunyikan unsur besi di lingkungan rizosfir, sehingga tidak tersedia bagi perkembangan mikroba patogen. Kondisi ini umumnya terjadi pada tanah-tanah bereaksi netral sampai basis dimana kelarutan unsur Fe3+
rendah. Namun dalam beberapa kasus, pengkhelatan Fe3+ dari mineral
Fe-P pada tanah-tanah masam pernah pula dilaporkan (Reid et al., 1985; Mullen, 1998). Kemampuan mikroba menghasilkan siderofor berimplikasi pada pengendalian mikroba patogen.
Beberapa jenis rizobakteri telah diidentifikasi mampu menghasilkan siderofor seperti Pseudomonas fluorescens B10 yang memproduksi yellow-green florescent siderophores atau pseudobactin yang kemudian terbukti dapat menghambat perkembangan fungi patogen Erwinia caratovora penyebab busuk pada kentang (Subba-Rao, 1999). Beberapa laporan lain memaparkan kemampuan bakteri siderofor mengendalikan penyakit layu rebah yang disebabkan oleh cendawan Pythium ultimum dan busuk akar oleh cendawan Fusarium oxysporum (Kloepper, 1993). Hasil penelitian Bakker (2006) pada bakteri penghasil siderofor Pseudomonas putida WCS358 juga membuktikan bahwa bakteri ini menginduksi kekebalan sistemik tanaman Arabidopsis thaliana karena mampu menekan penyakit yang menyerang daun walaupun bakteri ini terdapat pada zona perakaran.
Pengujian kemampuan bakteri menghasilkan siderofor dikembang-kan dari media miskin unsur Fe. Pencucian peralatan gelas dengan HCl untuk menghilangkan sisa-sisa Fe yang mungkin masih melekat pada gelas dan penggunaan air deionisasi atau akuades menjadi persyaratan penting dalam pengujian. Fuhrmann (1994) mengembangkan teknik microbial lawn pada media agar King’s B yang defisien Fe untuk menguji reaksi antagonis bakteri penghasil siderofor potensial. Namun saat ini, media agar chrome azurol S (CAS) yang dikembangkan Schwyn & Neilands (1987) lebih populer dipakai karena kemudahan mendeteksi koloni bakteri penghasil siderofor yang berwarna kuning (oranye) yang sangat kontras dengan warna biru media kompleks CAS agar.
Dalam bab ini diuraikan metode pengujian bakteri penghasil siderofor menggunakan media agar kompleks Fe-CAS dari Schwyn & Neilands (1987) yang dimodifikasi oleh Alexander & Zuberer (1991).
2.8.1 Prinsip
Siderofor memiliki afinitas yang tinggi terhadap unsur Fe (Kf >1030). Bakteri penghasil siderofor mengikat unsur Fe di luar dinding sel dan selanjutnya Fe diangkut ke dalam membran sel melalui reseptor spesifik (Neiland, 1982). Media kompleks Fe-CAS menyediakan berbagai nutrisi bagi bakteri kecuali unsur Fe yang jumlahnya sangat terbatas dan terperangkap dalam media. Hanya bakteri penghasil siderofor yang mampu hidup dan berkembang biak pada media agar Fe-CAS karena siderofor dapat melepaskan dari media dan menyembunyikannya yang ditandai oleh koloni bakteri berwarna kuning (oranye) yang sangat kontras dengan warna biru media agar Fe-CAS agar.
2.8.2 Metode Pengujian Bahan
- Suspensi sel bakteri (potential siderophore producing bacteria) yang akan diuji (dari tanah atau biakan murni)
- Cawan Petri - Labu Erlenmeyer - Beker gelas - Pipet mikro
Semua peralatan gelas direndam dan dicuci dengan larutan 3M HCl atau yang lebih pekat untuk menghilangkan sisa-sisa unsur Fe yang mungkin masih melekat pada peralatan gelas, kemudian dibilas dengan akuades.
Bahan kimia dan larutan (media)
- Media Fe Chrome Azurol S (CAS = C23H13Cl2O9SNa3) adalah
campuran dari empat macam larutan (larutan I, II, III, dan IV) yang dibuat dan disterilisasi secara terpisah.
- Larutan I (larutan indikator Fe-CAS) Æ 100 ml
Campurkan 10 ml larutan 1 mM FeCl3.6H20 (dalam 10 mM HCl)
dengan 50 ml larutan CAS (1,21 mg ml-1). Campuran ini menghasilkan warna ungu gelap. Sambil diaduk, secara perlahan campuran ini ditambahkan ke dalam 40 ml HDTMA (hexadecy-ltrimetylammonium bromide) (1,82 mg ml-1).
Larutkan 30,24 g PIPES (peperazine-N,N'-bis[2-ethanesulfonic acid]) dengan 750 ml larutan garam yang mengandung 0,3 g KH2PO4, 0,5 g NaCl, dan 1 g NH4Cl. Atur pH 6,8 dengan KOH
50%, kemudian tambahkan 15 g agar. Cukupkan volume larutan sampai 800 ml dengan akuades.
Autoklaf larutan selama 15 menit, kemudian dinginkan sampai suhu 50oC.
- Larutan III (larutan glukosa dan unsur mikro) Æ 70 ml
Larutkan 2 g glukosa, 2 g manitol, dan unsur mikro (493 mg MgSO4.7H2O; 11 mg CaCl2; 1,17 mg MnSO4.H2O; 1,4 mg
H3BO3; 0,04 mg CuSO4.5H2O; 1,2 mg ZnSO4.7H2O; dan 1 mg
Na2MoO4.2H2O) dalam 70 ml akuades.
Autoklaf larutan selama 15 menit, kemudian dinginkan sampai suhu 50oC.
- Larutan IV (larutan asam cassamino 10%) Æ 30 ml
Larutkan 3 g asam cassamino dalam 30 ml akuades (10%, berat volume), kemudian disterilisasi dengan saringan mikro (0,2 mµ).
Prosedur
7) Pembuatan media Fe-CAS agar
- Pada suhu larutan sekitar 50oC, tambahkan larutan III dan IV ke
dalam Larutan II (larutan bufer + agar). Larutan I (larutan indikator) ditambahkan terakhir dengan mengaduk secara perlahan sampai keempat larutan tercampur rata (hindari terbentuknya gelembung). Campuran ini menghasilkan media kompleks Fe-CAS yang berwarna biru sampai biru kehijauan.
- Tuang larutan kompleks Fe-CAS ke dalam cawan Petri (masing-masing 20 ml), kemudian diamkan sampai agar membeku.
8) Inokulasi dan inkubasi
- Inokulasi Fe-CAS agar dengan suspensi sel bakteri dengan metode gores atau sebar. Untuk metode sebar, gunakan sebanyak 50 µL suspensi sel bakteri dari beberapa tingkat pengenceran. Selanjutnya inkubasi cawan Petri pada suhu kamar.
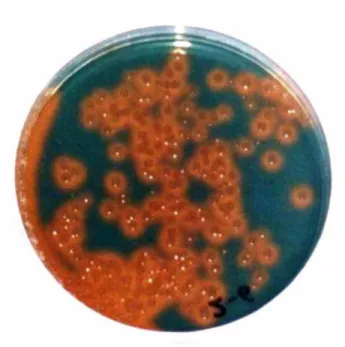
- Setelah masa inkubasi (24 jam atau lebih), bakteri penghasil siderofor yang tumbuh ditandai oleh koloni berwarna kuning (oranye) yang kontras dengan warna biru media Fe-CAS agar seperti tampak pada Gambar 1.
Gambar 1. Koloni bakteri yang berwarna kuning (oranye) mengindikasikan kemampuan bakteri mensekresikan siderofor untuk melepaskan dan mengikat Fe dari kompleks Fe-CAS agar (Husen, 2002)
2.8.3 Ulasan
Beberapa hal yang perlu diperhatikan dalam analisis adalah: (i) semua reagen atau bahan kimia yang digunakan untuk membuat larutan indikator (larutan I) harus dibuat baru (fresh) untuk tiap batch agar dan (ii) penggunaan air akuabides (2 kali distilasi) untuk penyiapan media sering digunakan untuk menjamin keberhasilan analisis.
Media agar Fe-CAS dapat digunakan untuk keperluan isolasi bakteri siderofor dari sampel tanah, rizosfir, maupun dari akar tanaman.
Alexander, D.B. & D.A. Zuberer, 1991. Use of chrome azurol S reagents to evaluate siderophore production by rhizosphere bacteria. Biol. Fertil. Soils 2: 39-45.
Bakker, P.A.H.M., I. van der Sluis, B. Verhagen, M. de Jong, & L.C. van Loon. 2006. Determination of Pseudomonas putida WCS358 that are involved in induced sistemic resistance in Arabidopsis thaliana. Auburn University Web Site, Available: http://www.ag.auburn.edu/ argentina/pdfmanuscripts/ kloepper.pdf. [Accessed 30 June 2006]. Fuhrmann, J.J. 1994. Isolation of Microorganisms Producing Antibiotics. p.
379-405. In R.W. Weaver, S. Angle, P. Bottomley, D. Bezdicek, S. Smith, A. Tabatabai, and A. Wollum (Eds.) Methods of Soil Analysis (Microbiological and Biochemical Properties). SSSA. Wisconsin, USA.
Husen, E. 2002. Growth Enhancement of Hot Pepper (Capsicum annuum L.) by Plant Growth Promoting Rhizobacteria (PGPR). Master Thesis (Soil Science). University of The Philippines at Los Banos. Philippines.
Kloepper, J.W. 1993. Plant growth promoting rhizobacteria as biological control agents. p. 255-274. In F.B. Meeting, Jr. (Ed.) Soil Microbial Ecology, Applications in Agricultural and Environmental Management. Marcel Dekker, Inc. New York.
Mullen, M.D. 1998. Transformation of other elements. p 369-386. In D.M. Silvia, J.J. Fuhrmann, P.G. Hartel, D.A Zuberer (Eds.) Principles and Application of Soil Microbiology. Prentice Hall. New Jersey.
Neilands, J.B. 1982. Microbial envelope proteins related to iron. Annu Rev. Microbiol 36: 285-309
Reid, R. K., C.P.P. Reid, & P.J. Szaniszlo. 1985. Effect of synthetic and microbially produced chelates on the diffusion of iron and phosphorus to a simulated root in soil. Biol. Fertil. Soils 1:45-52.
Schwyn, B & J.B. Neilands. 1987. Universal chemical assay for the detection and determination of siderophores. Anal. Biochem 160: 47-56
Subba-Rao, N.S. 1999. Soil Microbiology (4th Edition of Soil Microorganisms and Plant Growth). Science Publishers, Inc. USA.
2.9
MIKROBA PEROMBAK BAHAN ORGANIK
Rosmimik & Erny YuniartiMikroba perombak bahan organik adalah kelompok mikroba yang berperan mempercepat proses perombakan (dekomposisi) bahan organik yang umumnya terdiri atas senyawa selulosa dan lignin yang dikenal dengan nama lignoselulosa. Dalam proses perombakan bahan organik, mikroba yang berperan sebagai perombak dapat berasal dari kelompok bakteri, cendawan dan aktinomisetes yang akan bekerja secara sinergis dalam menghasilkan produk akhir berupa humus yang stabil (N, P, K, Ca, Mg, dan lain-lain). Mikroba dari kelompok cendawan mempunyai kemampuan yang lebih besar dalam merombak bahan organik dibandingkan dengan kelompok bakteri dan aktinomiset. Kelompok bakteri atau cendawan yang berperan dalam merombak selulosa lebih dikenal dengan nama mikroba selulolitik dan ligninolitik untuk kelompok bakteri atau cendawan yang berperan dalam merombak lignosa.
Bakteri penghasil lignoselulase yang dapat merombak limbah lignoselulosa diantaranya, Mycobacteriales, Actinomycetales, dan Eubacteriales dan anggota Clostridium. Berbagai jenis cendawan yang telah diteliti menghasilkan enzim selulase antara lain A. terreus, A. fumigatus, A. niger, Eupenicillium javanicum, Fusarium solani, Myrothecium verracaria, Neurospora sitophilla, P. funiculosum, Chaetomium spp., P. iriensis, P. vereculosum, Phanerachaete chrysosporium, Polyporus adustus, Pellicullaria filamentosa, Trichoderma reesei, T. harzianum, T. purpurogenum, T. koningi (Enari, 1983). Cendawan-cendawan tersebut diisolasi dari tanah, sampah dan kayu lapuk menghasilkan enzim ekstraseluler selulolitik yang terdiri atas enzim endoglukanase, exoglukanase dan B-glukosidase. Dalam proses perombakan bahan organik, enzim selulolitik bekerja secara sinergis dengan tiga kelompok enzim tersebut. Cendawan putih pembusuk (Phanerachaete chrysosporium, Coriolus versicolor dan Phlebia radiata) yang diisolasi dari jerami padi menghasilkan ekstra seluler ligninolitik. Enzim ini mengandung lignin peroksidase (Lip), peroksidase Mn bebas (MnP) dan beberapa tipe lakase. Enzim ligninolitik ini dapat memutuskan ikatan lignin.
benomyl-guaiacol. Aktivitas mikroba selulolitik pada media agar CMC ditunjukkan dengan adanya warna jernih tepat di sekitar koloni setelah diwarnai merah kongo 1% dan aktivitas ligninolitik pada media agar lignin-benomyl ditunjukkan dengan adanya warna merah tepat di bawah dan sekitar koloni akibat quinon produk oksidasi guaiacol.
2.9.2 Isolasi Mikroba Selulolitik (Coronel & Joson, 1986) Alat
- Labu Enlemeyer - Cawan Petri - Tabung reaksi - Pipet mikro
- Inkubator dengan mesin pengocok
Bahan
- Contoh kayu lapuk, tanah, sampah - Larutan pengencer
Masukan 45 ml dan 9 ml akuades ke dalam botol-botol pengencer lalu sterilisasi dengan autoklaf pada suhu 121oC, tekanan 0,1 Mpa selama 15 menit.
- Medium basal selulolitik
Larutkan 1 g KH2PO4; 0,5 g K2SO4; 0,5 g NaCl; 0,5 g FeSO4; 1
g NH4NO3; 0,01 g MnSO4; CMC 200 ml (10 g dalam 200 ml
akuades); dan 20 g agar, lalu tepatkan 1 L dengan akuades. Autoklaf pada suhu 1210C pada 0,1 Mpa selama 15 menit, lalu setelah hangat kuku tuangkan ke dalam cawan Petri.
- Merah kongo 1 % (1 g merah kongo dalam 100 ml akuades) Larutkan 1 g merah kongo dalam 100 ml akuades. - NaOH 1%
Larutkan 1 g NaOH dalam 100 ml akuades. - Potato dextrose agar (PDA)
Prosedur
- Masukkan 5 g contoh ke dalam 45 ml akuades steril lalu inkubasi selama 30 menit pada inkubator goyang dengan kecepatan 150 rpm. - Buat seri pengenceran hingga 10-8.
- Pipet 100 µl suspensi contoh dari masing-masing tingkat pengenceran, lalu inokulasikan dalam medium agar basal selulolitik dengan metode cawan sebar, inkubasi 3-5 hari di suhu kamar. Adanya mikroba selulolitik ditunjukkan dengan terbentuknya zona bening di sekeliling isolat setelah diberi pewarna merah kongo 1%.
Pemurniaan mikroba selulolitik
- Pindahkan koloni mikroba selulolitik yang sudah tumbuh pada medium basal selulolitik ke medium selulolitik yang baru.
- Inkubasi selama 3–5 hari pada suhu kamar, lakukan pengamatan sampai diperoleh koloni tunggal.
- Simpan di dalam agar miring PDA untuk cendawan selulolitik koloni tunggal dan media Luria Bertani (LB) untuk bakteri selulolitik koloni tunggal. Selain itu bisa juga disimpan dalam agar miring yang berisikan media basal selulolitik.
2.9.3 Isolasi Mikroba Ligninolitik (Thorn et al., 1996) Alat
- Lihat 2.9.2
Bahan
- Medium basal ligninolitik
Larutkan 0,5 g KH2PO4; 0,2 g MgSO4.7H2O; 0,1 g NH4NO3; 0,1
g KCl; 0,02 g FeSO4.7H2O; 0,05 g Ca(NO3)2.4H2O; 2 g malt
ekstrak, dan 15 g agar dalam 1 L akuades. Autoklaf medium basal bersama batang pengocok magnetik dalam Erlenmeyer, lalu ketika suhu media ± 55°C, tambahkan bahan-bahan sebagai berikut: 5 ml larutan KOH 1 M; 0,4 ml guaiakol; 1 g indulin AT (alkali lignin) yang disiapkan dengan cara melarutkan dalam 10 ml dioksan; 60 mg antibiotik Clortetrasycline-HCl; 30 mg streptomisin sulfat; 30 mg penisilin G; dan 4 mg benomil (seperti benlate 50 WP), lalu kocok dan tuang ke dalam cawan Petri. - Larutan Diazodium Blue B (DBB) 1 mg ml-1
Larutkan 10 mg DBB dalam 10 ml bufer Tris HCl 0,1 M pH 7, dingin.
Prosedur
- Sebanyak 5 g berat basah (2,5 – 4,5 g berat kering) contoh tanah dimasukan ke dalam 500 ml natrium pirofosfat 0,1% (w/v) steril dalam botol Mason 1 L.
- Kocok pada inkubator pengoyang selama 1 jam dengan suhu 4°C untuk mendispersikan gumpalan tanah dan koloid.
- Satu ml suspensi partikel organik diencerkan dalam air steril sampai 102 dan sebanyak 0,4 ml dari pengenceran tersebut disebar pada medium agar lignin-guaiacol-benomil, lalu inkubasi pada suhu ruang selama 2 minggu.
- Seujung kecil jarum, partikel pada saringan mesh 53 diinokulasi ke dalam medium agar isolasi lignin-benomil-guaikol.
- Inkubasi pada posisi terbalik selama 1-2 minggu pada suhu ruang. Amati setiap melihat adanya koloni yang membentuk warna merah, warna merah disebabkan aktivitas lakase atau peroksidase.
- Amati koloni yang timbul dengan mikroskop untuk melihat adanya konidia dan clump connections sebagai ciri dari basidiomisetes.
- Tumbuhkan kultur dalam 75 ml medium cair malt ekstrak, pH 6 dalam Erlenmeyer 125 ml, inkubasi pada penggoyang 100 rpm dan suhu ruang, dan selanjutnya panen ketika berumur 2 minggu. Miselium kultur dicuci dengan akuades, lalu ditaruh dalam gelas bening dan langsung warnai dengan larutan DBB. Reaksi positif, yaitu terbentuk warna merah sampai ungu setelah 15 - 60 detik penambahan DBB.
Pemurnian koloni cendawan ligninolitik
- Pindahkan koloni cendawan ligninolitik ke media agar malt ekstrak yang mengandung antibiotik.
- Inkubasi pada suhu ruang selama 5-7 hari, lalu pindahkan satu koloni ke medium agar agar miring malt ekstrak, lalu inkubasi lagi.
- Terhadap biakan murni lakukan pengamatan mikroskop untuk melihat adanya konidia dan clump connection.
DAFTAR PUSTAKA
Coronel, L.M. & L.M. Joson. 1986. Isolation, screening and characterization of cellulose utilizing bacteria. Philip. J. Sci. 2: 223-226.
Enari, T.M. 1983. Microbial cellulase. p. 183 – 223. In W.M. Fogarty (Ed.) Microbial Enzymes and Biotechnology. Appl. Sci Interscience Publisher, New York.
Thorn, R.G, C.A. Reddy, D. Harris, & E.A. Paul. 1996. Isolation of saprophytic Basidiomisetes from soil. Applied and Enviromental Microbiology 62: 4288-4292.