BAB II
TINJAUAN PUSTAKA
II.1 Korosi dan Faktor Penyebab Korosi
Logam yang dibiarkan dalam udara terbuka atau kontak dengan lingkungan yang korosif akan mengalami korosi. Pada pertambangan minyak dan gas bumi adanya gas CO2, H2S, asam organik, garam, dan air dapat mengakibatkan korosi pada peralatan produksi. Berikut beberapa definisi tentang korosi.
II.1.1 Definisi Korosi
Korosi menurut National Asociation Corrrosion Enginerr (NACE) adalah degradasi material, biasanya logam yang dihasilkan oleh interaksi dengan lingkungannya. Menurut IUPAC adalah reaksi irreversible antarmuka material (logam, keramik, polimer) dengan lingkungannya yang mengakibatkan material dikonsumsi atau melarutnya material pada komponen lingkungan. Menurut ISO 8044-1986 korosi adalah interaksi fisika-kimia antara logam dan lingkungannya yang mengakibatkan perubahan sifat dari logam dan seringkali mengakibatkan lemahnya fungsi logam.
Pada pertambangan minyak bumi dan industri masalah korosi mendapat perhatian yang sangat serius kerena menyangkut masalah ekonomi, keselamatan kerja, dan lingkungan kerja. Gambar 2.1 menunjukkan terjadinya korosi pada pipa pertambangan minyak bumi.
Gambar 2.1: korosi yang terjadi pada pipa pertambangan minyak bumi
II.1.2 Faktor-Faktor Penyebab Korosi
Terdapat empat faktor utama yang menyebabkan terjadinya korosi yaitu:
1. Adanya bahan yang berperan sebagai katoda (elektroda positif) atau kation (ion positif dalam bentuk mikro)
2. Adanya bahan yang berperan sebagai anoda (elektroda negatif) atau anion (ion negatif dalam bentuk mikro)
3. Adanya media elektrolit sebagai penghubung atau rangkaian listrik 4. Adanya arus listrik.
Menurut Nerst korosi terjadi karena…
1. Adanya kontak antara anoda sehingga terjadi sel galvanik yang menyebabkan terjadi korosi.
2. Endapan pada suatu paduan (adanya fasa pada fasa induk) akan bersifat katodik terhadap matriksnya sehingga terjadi korosi antar-kristalin.
3. Daerah pada proses pendinginan memiliki tegangan dalam yang lebih besar sehingga daerah tersebut mudah terserang korosi (Supriyatman, dkk, 2002).
II.2 Jenis-Jenis Korosi
Korosi pada logam dapat dikelompokkan ke dalam beberapa jenis, diantaranya: a. Korosi seragam (uniform corrosion)
Korosi jenis ini dicirikan oleh reaksi kimia atau elektrokimia dengan penampakan produk korosi dan peronggaan sekala besar secara merata.
b. Korosi dwilogam (Galvanic corrosion)
Korosi jenis ini terjadi antara dua buah logam yang bersentuhan dengan nilai potensial berbeda satu dan lainnya atau kedua logam berantaraksi dalam larutan elektrolit yang bersifat korosif.
c. Korosi celah (crevice corrosion)
Korosi jenis ini bersifat lokal, terjadi antara dua buah material, baik logam-logam atau logam-logam-non logam-logam yang keduanya mempunyai celah menyebabkan terjadinya perbedaan konsentrasi oksigen.
d. Korosi sumuran (pitting corrosion)
Korosi jenis ini menyerang secara lokal dan selektif menghasilkan bentuk permukaan berlubang pada logam sangat dalam membentuk seperti sumur. e. Korosi erosi (erosion corrosion)
Korosi jenis ini terjadi akibat proses mekanik melalui pergerakan relatif antara aliran gas atau larutan korosif dengan permukaan logam.
f. Korosi retak tegang (stress corrosion cracking)
Korosi jenis ini disebabkan adanhya tegangan tarik (tensile stress) dengan media korosif yang menyebabkan terjadi penampakan retak di dalam logam.
g. Korosi batas butir (intergranular corrosion)
Korosi jenis ini menyerang secara lokal pada batas butir logam sehingga butir-butir logam hilang atau kekuatam mekaniknya berkurang. Korosi ini diakibatkan adanya kotoran (impurity) batas butir, adanya unsur yang berlebih pada sistem perpaduan atau penghilangan salah satu unsur pada daerah batas butir.
h. Peluluhan selectif (dealloying)
Peluluhan selektif atau dealloying merupakan penghilangan salah satu unsur dari paduan logam akibat korosi.
i. Fretting corrosion
Korosi jenis ini terjadi pada dua permukaan logam yang bersentuhan dengan beban besar yang bergerak dengan gerak vibrasi pada dasar permukaan logam di lingkungan korosif.
j. Peronggaan (cavitation)
Peronggaan terjadi saat tekanan operasional cairan turun dibawah tekanan uap gelembung-gelembung gas yang dapat merusak permukaan logam dasar (Priyotomo, 2008).
II.3 Korosi dalam Media Jenuh CO2
Karbon dioksida sering ditemukan dalam pertambangan gas dan minyak bumi terutama pada cairan produksi. Korosi CO2 atau lebih dikenal dengan sweet
corrosion terjadi pada instalasi produksi maupun pada instalasi pengeboran.
dan bakteria. Gas CO2 dan H2S yang terlarut dalam air bersifat asam dan menjadikan cairan tersebut bersifat elektrolit.
Laju korosi gas CO2 terlarut lebih korosif dibandingkan dengan laju korosi gas H2S (Brondel, dkk, 1994). Gas CO2 yang terlarut dalam air akan menghasilkan pH rendah, sehingga meningkatkan laju korosi. Laju korosi menurun seiring dengan kenaikan pH. Hal ini disebabkan CO2 terlarut dapat bereaksi dengan air membentuk ion-ion HCO3- dan H+ (Azko Nobel). Dengan adanya ion bikarbonat dalam larutan akan bereaksi dengan atom-atom logam (misalnya besi) membentuk besi karbonat atau kompleks besi karbonat seperti ditunjukkan melalui persamaan berikut:
( )
( )
2 2 3 3 3 3 2 2 2 3 3 3 2 2 2 2 2 ( ) Fe H O Fe OH H e Fe HCO FeCO H e Fe OH HCO FeCO H O OH FeCO HCO Fe CO H + − + − − − − − + + → + + + → + + + → + + + → +Laju korosi meningkat seiring dengan meningkatnya ion bikarbonat. Jika konsentrasi ion Fe2+, HCO3- dan CO32- dalam larutan mencapai titik jenuh maka akan terbentuk lapisan pasif FeCO3 di permukaan baja membentuk pasivasi (Isdiriyani, dkk, 1999; Akzo Nobel ). Pada suhu yang tinggi, kelarutan CO2 berkurang dan kelarutan FeCO3 makin tidak larut, sehingga laju korosi menurun akibat meningkatnya pasivasi dari kerak FeCO3. Namun demikian, laju pembentukan lapisan pasif menurun seiring dengan meningkatnya pH media, akibat dari melarutnya lapisan pasivasi FeCO3.
II.4 Pencegahan Korosi
Pencegahan korosi dapat dilakukan dengan berbagai cara misalnya (a) memilih bahan yang tahan terhadap lingkungan korosif, (b) melakukan coatiing dan/atau pelapisan pada bagian luar pipa/ logam dan (c) menginjeksikan larutan inhibitor secara berkala pada cairan media untuk melindungi lapisan dalam pipa/logam. Pada umunya penambahan inhibitor pada cairan produksi lebih ekonomis dibandingkan dengan pencegahan korosi yang lainnya, karena selain tidak merusak dan tidak mencemari lingkungan juga lebih aman digunakan (Ilim, dkk, 2008)
II.4.1 Inhibitor Korosi
Untuk melindungi pipa bagian luar dapat dilakukan dengan cara pelapisan (coatting) atau dengan pelindung logam yang potensialnya lebih rendah dari logam yang akan dilindungi (proteksi katodik), sedangkan perlindungan pipa bagian dalam dapat digunakan senyawa kimia sebagai inhibitor korosi. Inhibitor korosi adalah senyawa kimia yang larut dalam air dan/atau larut dalam minyak yang ditambahkan dalam jumlah sedikit pada medium korosif, dan menghambat proses korosi dengan mengubah kondisi permukaan antar muka logam (Isdiriyani, dkk, 1999)
II.4.2 Jenis Inhibitor
Berdasarkan jenis senyawa pembentuknya, inhibitor korosi terdiri dari inhibitor organik dan inhibitor anorganik. Inhibitor organik terdiri dari senyawa-senyawa alipatik dan senyawa-senyawa amina aromatis, poliamina, imidazolie dan garamnya. Senyawa anorganik terdiri dari senyawa kromat, seng posfat, dan silika (Isdiriyani, dkk, 1999).
Berdasarkan proses inhibisinya, inhibitor korosi terdiri dari inhibitor anodik, inhibitor katodik, inhibitor campuran dan inhibitor teradsorpsi. Inhibitor anodik adalah inhibitor yang dapat menurunkan laju korosi dengan cara menghambat transfer ion-ion logam ke dalam larutan ruah karena berkurangnya daerah anoda akibat pasivasi. Inhibitor katodik adalah inhibitor yang dapat menurunkan laju korosi dengan cara menghambat salah satu tahap pada proses katodik, seperti pembebasan ion-ion H+ atau penangkapan O2. Inhibitor campuran adalah inhibitor yang dapat menurunkan laju korosi dengan cara menghambat proses katodik dan anodik secara bersamaan. Pada umumnya, inhibitor komersial berfungsi ganda, yakni sebagai inhibitor katodik dan anodik. Inhibitor teradsorpsi adalah inhibitor dari golongan senyawa organik yang dapat mengisolasi pemukaan logam dari lingkungan korosif melalui pembentukan film teradsoprsi, sehingga dapat menurunkan laju korosi (Antonijevic, dkk, 2007).
II.4.3 Mekanisme inhibisi korosi
Proses inhibisi korosi logam oleh inhibitor dapat berlangsung melalui beberapa tahap atau proses, diantaranya adalah sebagai berikut:
1. interaksi elektrostatik antara logam yang terpolarisasi dengan molekul inhibitor yang polar.
2. jenis interaksi dipole antara pasangan elektron bebas dalam inhibitor dengan orbital-d pada logam
3. interaksi elektron π (ikatan rangkap) dari inhibitor dengan orbital-d pada logam
4. kombinasi ketiganya (Elewady, 2008).
II.5 Metenamina
Metenamina atau hexamine atau disebut juga hexametylenetetramine adalah senyawa organik heterosiklik yang dapat dibuat melalui reaksi formaldehida dengan amonia. Metenamina adalah senyawa kristalin berwarna putih yang memiliki kelarutan yang besar dalam air. Stuktur molekul metenamina ditunjukkan pada gambar 2.2.
Metenamina digunakan dalam kesehatan sebagai antibiotik (metenamina hippurate) dan sebagai bahan bakar tablet yang digunakan untuk memasak ketika kemah ataupun ketika naik gunung. Metenamina hippurate digunakan untuk obat infeksi sistem urin dan juga sebagai perawatan pada penyakit post renal
obstruktif. Dalam dunia industri, metenamine dengan 1,3.5-trioksan digunakan
meninggalkan debu. Selain itu juga metenamina adalah senyawa inhibitor korosi yang potensial, karena mempunyai struktur yang menyerupai sangkar burung dengan 4 buah atom nitrogen tersier. Oleh karena itu penelitian mengenai pemakaian metenamina sebagai inhibitor korosi dilakukan karena belum pernah dilaporkan (wikipedia, 2009).
Gambar 2.2 Struktur Metenamina
II.6 Metode polarisasi potensiodinamik
Metode polarisasi potensiodinamik adalah suatu metoda elektrokimia yang dikembangkan berdasarkan pada tingkat polarisasi logam akibat berinteraksi dengan lingkungan orosif atau dengan molekul yang bersifat polar. Untuk menentukan tingkat polarisasi logam dapat dilakukan dengan berbagai cara, antara lain dengan linear polarization resistance (LPR) atau dengan Tafel extrapolation (Tafel plot).
II.6.1 Persamaan Tafel
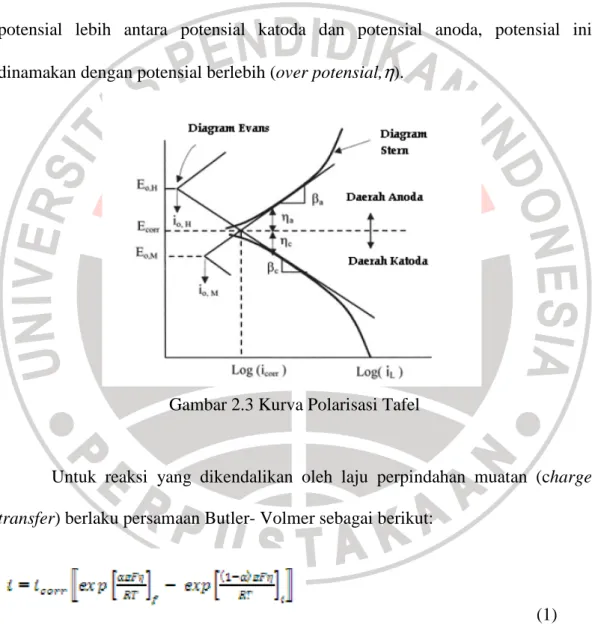
Metode pengujian dengan cara Tafel banyak diaplikasikan untuk mengukur laju korosi pada media uji secara cepat. Metode Tafel dipelajari dari kurva Tafel seperti ditunjukkan pada gambar 2.3. Pada logam yang kontak dengan medium korosif mengakibatkan adanya reaksi reduksi dan oksidasi pada logam
tersebut. Dalam logam akan terbentuk situs-situs mikrosel katodik maupun mikrosel anodik sehingga akan dihasilkan arus, baik dari katodik maupun anodik. Arus yang terjadi menghasilkan potensial yang disebut potensial korosi, Ekor, dimana potensial daerah anoda sama dengan potensial daerah katoda. Ada atau tidak adanya arus yang diberikan dari luar dapat mengakibatkan terbentuk potensial lebih antara potensial katoda dan potensial anoda, potensial ini dinamakan dengan potensial berlebih (over potensial,
η
).Gambar 2.3 Kurva Polarisasi Tafel
Untuk reaksi yang dikendalikan oleh laju perpindahan muatan (charge
transfer) berlaku persamaan Butler- Volmer sebagai berikut:
(1) Jika
η
positif, (E - Ekor) > 0 atau bersifat anodik, maka persamaan untuk anodik dapat diabaikan sehingga persamaannya menjadi:exp( /
o a
i=i
α η
nF RTsu
0 2, 303 2, 303 log log a RT RT i i nF nF η α α = su − su (3)
dan rapat arus anodik, ia, dalam berntuk logaritmanya dinyatakan sebagai
log log a a i a io
η
=β
−β
(4) dengan 2, 303 a RT nFβ
α
= su (5)sedangkan jika
η
negatif, (E - Ekor) < 0 atau bersifat katodik, maka persamaan untuk katodik bisa diabaikan sehingga persamaannya menjadiexp( / o c i=i
α η
nF RT su (6) 0 2, 303 2, 303 log log c RT RT i i nF nFη
α
α
= su − su (7)dan rapat arus katodik, ic, dalam bentuk logaritmanya dapat dinyatakan sebagai
log log c c i c io
η
=β
−β
(8) dengan 2, 303 c RT nFβ
α
= su (9)Besaran
η
a danη
c merupakan persamaan Tafel untuk polarisasi katodik dananodik, besaran
β
a danβ
c merupakan lereng Tafel untuk reaksi deelektronisasidan elektronisasi.
Jika persamaan Tafel dimasukkan ke dalam persamaan Butler-Volmer akan dihasilkan persamaan:
(10) Jika persamaan 10 diturunkan terhadap E akan diperoleh,
(11) (12) (13) dengan P kor B R I = (14)
sehingga dengan menghubungkan persamaan 13 dan 14 diperoleh persamaan Stern-Gerry yaitu
II.6.2 Laju Korosi berdasarkan teknik Tafel
Adanya aliran elektron dari permukaan logam ke dalam larutan ruah atau oksidasi logam dapat mengakibatkan korosi. Kesetaraan antara arus korosi, I dan massa zat yang bereaksi, m, menurut pesamaan hukum Faraday yaitu
e A t
m I
F
= (16)
dengan F menyatakan tetapan Faraday, Ae adalah massa ekivalen logam dan t adalah waktu. Persamaan 16 dibagi dengan waktu dan luas permukaan elektroda (A) menghasilkan laju korosi, Vcorr yaitu
corr corr
m a
V I
tA F
= = (17)
dengan Ikor adalah rapat arus korosi yang harganya sama dengan I/A (A.cm-2). Rapat arus korosi menyatakan arus yang terkonsentrasi pada permukaan elektroda menyebabkan elektroda terkorosi. Nilai Ikor dapat ditentukan dari tahanan polarisasi dan tetapan Tafel anodik/katodik melalui persamaan
corr P B I R = (18)
dengan B adalah tetapan Stern-Gery dan Rp adalah tahanan polarisasi larutan. Satuan laju korosi logam dalam sel elektrokimia dapat menggunakan satuan mm per tahun (ASTM G3-1989), sehingga persamaannya menjadi
3 3, 27 10 corr corr Ae V x I
ρ
− = (19)dengan Vkor menyatakan laju korosi (mm.th-1), Ae adalah masa ekivalen logam (g.mol-1.ek-1),
ρ
adalah masa jenis logam (g.cm-3), dan Ikor adalah rapat arus korosi (µA.cm-2) yang ditransfer.II.7 Metode EIS
Spektroskopi impedansi elektrokimia (electrochemical impedance spectroscopy, EIS) adalah suatu metoda untuk menganalisis respon suatu
elektroda terkorosi terhadap sinyal potensial AC pada amplitudo rendah (∼10 mV) dengan rentang frekuensi sangat lebar. Pada prinsipnya, EIS digunakan untuk menentukan parameter elektrokimia berkaitan dengan unsur-unsur listrik seperti tahanan, R, kapasitansi, C, dan induktansi, L (Jones, 1992).
Tahanan listrik dalam EIS dinyatakan dengan impedansi (Z). Impedansi adalah ukuran kemampuan suatu rangkaian dalam menahan aliran arus listrik. Dalam impedansi, sinyal potensial dan arus AC berada dalam fase berbeda, dan nilainya dipengaruhi oleh frekuensi. Pengukuran impedansi elektrokimia pada umumnya menggunakan potensial AC terhadap sel elektrokimia dan mengukur arus yang mengalir melewati sel. Diasumsikan bahwa pengukuran impedansi elektrokimia menggunakan potensial eksitasi sinusoidal. Reaksi pada potensial ini adalah sinyal arus AC. Sinyal arus ini dapat dianalisis sebagai jumlah fungsi sinusoidal (sebuah rangkaian Fourier).
Pengukuran impedansi elektrokimia biasanya menggunakan sinyal-sinyal kecil yang tereksitasi. Ini dilakukan agar respon dari sel adalah semi linear (pseudo-linear). Pada sistem linear (pseudo-linear) respon arus terhadap respon
sinusoidal akan berbentuk sinusiodal pada frekuensi yang sama tetapi berbeda fasanya.
Gambar 2.4 Respon Arus Sinusoidal pada Sistem Linear
Sinyal tereksitasi digambarkan sebagai fungsi waktu dengan persamaan:
(20) dengan Et adalah potensial pada waktu t, Eo adalah amplitudo dari sinyal, dan ω adalah frekuensi radial. Hubungan antara frekuensi radial ω (rad/detik) dan frekuensi f (Hz) adalah:
(21) dalam sistem linear, respon sinyal, It, pergeseran fasa (φ) dan perbedaan amplituto, Io dinyatakan dengan:
(22) pernyataan di atas dapat disamakan dengan hukum Ohm, untuk menghitung impedansi pada sistem, menggunakan pesamaan :
dengan mengggunakan persamaan Euler,
(24) ini memungkinkan untuk menyatakan impedansi sebagai fungsi kompleks. Dalam potensial fungsi kompleks dinyatakan sebagai :
(25) dan respon dari arus sebagai:
(26) dengan J adalah bilangan kompleks , J = −1. Oleh karena itu, impedansi dalam bentuk kompleks dirumuskan sebagai berikut:
(27) dalam fungsi kompleks, impedasi dapat diungkapkan dalam bentuk impedansi Real, Zr dan impedansi imaginer , Zi, yaitu sebagai berikut:
r i
Z =Z +Z (28)
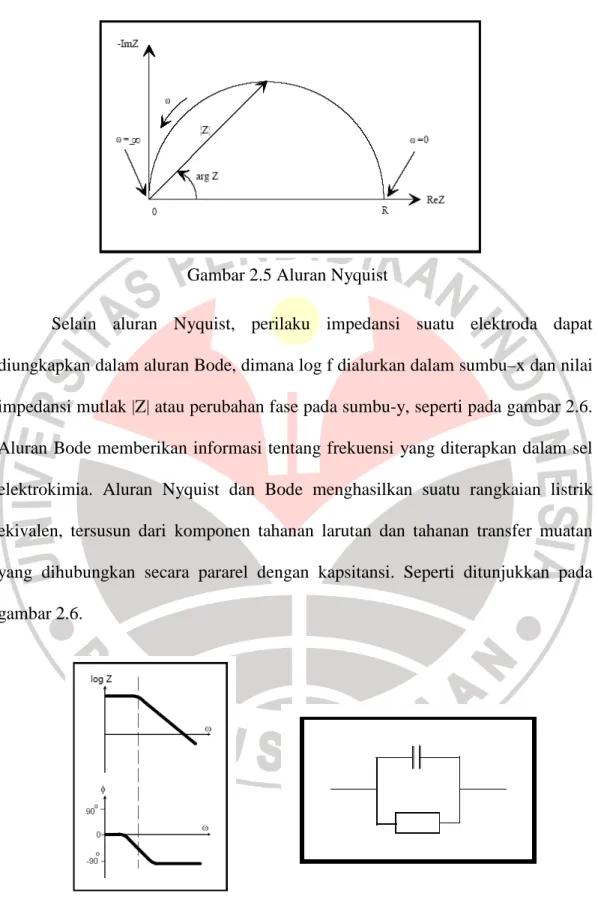
Jika impedansi real dialurkan pada sumbu-x dan impedansi imajiner dialurkan dalam sumbu-y maka diperoleh aluran Nyquist. Berdasarkan aluran Nyquist, impedansi dapat dinyatakan sebagai suatu vektor dengan panjang |Z|. Sudut antara vektor dan sumbu-x adalah φ (= sudut Z), seperti tampak pada gambar 2.5.
Gambar 2.5 Aluran Nyquist
Selain aluran Nyquist, perilaku impedansi suatu elektroda dapat diungkapkan dalam aluran Bode, dimana log f dialurkan dalam sumbu–x dan nilai impedansi mutlak |Z| atau perubahan fase pada sumbu-y, seperti pada gambar 2.6. Aluran Bode memberikan informasi tentang frekuensi yang diterapkan dalam sel elektrokimia. Aluran Nyquist dan Bode menghasilkan suatu rangkaian listrik ekivalen, tersusun dari komponen tahanan larutan dan tahanan transfer muatan yang dihubungkan secara pararel dengan kapsitansi. Seperti ditunjukkan pada gambar 2.6.
Tahanan Larutan (Rp)
Tahanan larutan bergantung pada konsentrasi ion, jenis ion, suhu, dan geometri dari arus yang dibawa. Tahanan larutan didefinisiskan sebagai:
(29) dengan ρ adalah tahanan jenis larutan. Kebalikan dari ρ yakni κ paling umum digunakan. Parameter κadalah konduktifitas larutan dan hubungan antara
κdengan tahanan larutan dirumuskan dengan persamaan sebagai berikut:
(30)
Kapasitansi Lapis Rangkap (Cdl)
Sifat listrik lapisan rangkap terdapat pada lapisan antarmuka antara elektode dan lingkungan larutan elektrolit. Lapisan rangkap ini terdiri dari ion-ion larutan yang teradsorpsi pada permukaan logam. Muatan pada elektroda menyebar sebagai ion- ion, dan penyebarannya sangat kecil bahkan seringkali dalam orde angstrom.
Penyebaran muatan oleh insulator membentuk suatu kapasitor. Nilai dari kapasitansi lapis rangkap tergantung pada banyak variabel, seperti potensial elektrode, suhu, konsentrasi ion, jenis ion, lapisan oksida, kekasaran elektrode, impurity adsorpsion, dan lain-lain.
Tahanan Transfer Muatan (Rct)
Tahanan serupa yang terbentuk dari reaksi setengah sel elektrokimia. Dalam hal ini tidak dalam keadaan potensial campuran tetapi setengah reaksi dalam kesetimbangan. Mengingat substrat logam yang kontak dengan larutan elektrolit. Logam terlarut dalam larutan elektrolit , mengikuti persamaan reaksi;
atau secara umum
dalam persamaan reaksi awal, elektron masuk pada logam dan ion-ion dari logam terdifusi pada larutan elektrolit. Terjadi transfer muatan antara larutan dengan logam. Transfer muatan ini terjadi dengan kecepatan tertentu. Kecepatan bergantung pada jenis reaksi, suhu, konsentrasi reaksi produk dan potensial. Hubungan antara potensial dan arus (secara langsung berhubungan dengan elektron yang sama dan juga transfer muatan melalui hukum faraday) adalah:
(31)
dengan
Io = perubahan rapat arus
Co, Co* = konsentrasi oksidan pada permukaan elektrode dan larutan ruah CR = konsentrasi reduktan pada permukaan elektrode
η = overpotensial; F = konstanta faraday; T = suhu; R = konstanta gas α = orde reaksi
n = jumlah elektron yang terlibat.
Ketika konsentrasi arus pada larutan ruah sama dengan arus pada permukaan elektrode, Co=Co* dan CR=CR*, maka Persamaan 31 menjadi
(32) Persamaan ini disebut dengan persamaan Butler-Volmer. Ini berguna ketika polarisasi hanya tergantung pada kinetika transfer muatan. Ketika overpotensial, η, sangat kecil dan sistem elektrokimia berada dalam kesetimbangan, ungkapan tahanan transfer muatan berubah menjadi:
(33) dari persamaan ini perubahan rapat arus dapat dihitung jika Rct diketahui (Gamry, 2007; Sunarya, 2008).
II.8 Isoterm Adsorpsi
Pada umumnya inhibitor berfungsi dengan baik melalui adsorpsi secara fisika (adsorpsi elektrostatik) maupun adsorpsi secara kimia (Khaled, 2007). Hubungan antara fraksi penutupan permukaan logam (θ) dan konsentrasi inhibitor dalam metode Tafel dapat ditentukan dari rapat arus (Ikor), sedangkan dalam metode EIS ditentukan dari tahanan transfer muatan (Rct) melalui persamaan berikut:
corr corr inh( )
corr i i i
θ
= − (34) ( ) ( ) ct ct inh ct inh R R R θ = − (35)Isoterm adsorpsi langmuir disasarkan pada asumsi bahwa semua situs adsorben setara dan adsorpsi molekul terjadi secara bebas pada situs terdekat yang dihuni atau tidak. Asumsi ini dituangkan ke dalam persamaan berikut:
1
Kc θ
θ =
− (36)
Persamaan 36 dalam bentul logaritmanya menjadi:
log log log
1 Kads Cinh θ θ = + − (37)
dengan θ adalah fraksi penutupan permukaan, Kads adalah konstanta kesetimbangan adsorpsi, dan Cinh adalah konsentrasi zat teradsorpsi (inhibitor).
Isoterm adsorpsi menurut Temkin dapat ditentukan melalui persamaan 1
ln(KadsC)
f
θ
= (38)dengan θ adalah fraksi penutupan permukaan, Kads adalah koefisien atau konstanta kesetimbangan adsorpsi, f adalah parameter interaksi molekuler, dan Cinh adalah konsentrasi senyawa inhibitor (Wahyuningrum, dkk, 2007; Khaled, 2007).
Dalam bentuk persamaan linearnya, persamaan isoterm adasorpsi Langmuir diubah menjadi
1
C
C K
θ = + (39)
dengan demikian, hubungan linear dapat ditentukan dari aluran c/θ sebagai fungsi dari c, dengan kemiringan satu satuan (Khaled, 2007; Elewady, 2008). Perpotongan dari garis lurus menyatakan konstanta kesetimbangan, K, sehingga energi bebas adsorpsi, ∆Gadsdapat ditentukan melalui persamaan:
1 exp ads solvent G K C RT −∆ = (40)
dengan Csolvent adalah konsentrasi molar pelarut, untuk air adalah 55,5 M; R adalah tetapan gas ideal = 8.314 J/mol.K dan T adalah suhu termodinamik dalam Kelvin (Wahyuningrum, dkk, 2007; Khaled, 2007; Elewady, 2008).
II.9 Efisiensi inhibisi
Untuk menentukan efisisensi inhibisi dengan metode Tafel digunakan persamaan
( )
% corr corr inh 100%
corr i i IE x i − = (41)
dengan icorr dan icorr(inh) adalah rapat arus dengan dan tanpa adanya inhibitor, sedangkan untuk menghitung efisiensi inhibisi dengan metode EIS ditentukan melalui persaman ( ) ( ) % ct ct inh 100% ct inh R R IE x R − = (42)
dengan Rct(inh) dan Rct, adalah tahanan transfer muatan dengan dan tampa adanya inhibitor.