KAJIAN PEMBERIAN SINBIOTIK DENGAN DOSIS BERBEDA UNTUK PENCEGAHAN KO-INFEKSI INFECTIOUS MYONECROSIS VIRUS DAN
Vibrio harveyi PADA UDANG VANAME (Litopenaeus vannamei)
DEWI NURHAYATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Dengan ini saya menyatakan bahwa tesis berjudul Kajian Pemberian Sinbiotik dengan Dosis Berbeda untuk Pencegahan Ko-Infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada Udang Vaname Litopenaeus vannamei adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di akhir bagian tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Dewi Nurhayati
NIM C151110201
* Pelimpahan hak cipta atas karya tulis dari penelitian kerja sama dengan pihak luar IPB harus didasarkan pada perjanjian kerja sama yang terkait
untuk Pencegahan Ko-Infeksi Infectious Myonecrosis Virus dan Vibrio harveyi
pada Udang Vaname Litopenaeus vannamei. Dibimbing oleh
WIDANARNI
dan
MUNTI YUHANA
Salah satu permasalahan dalam peningkatan produksi budidaya udang vaname (Litopenaeus vannamei) adalah serangan berbagai wabah penyakit terutama infeksi yang disebabkan oleh virus dan bakteri. Selain itu, adanya ko-infeksi atau ko-infeksi bersama beberapa patogen pada udang vaname juga dapat mempercepat dan meningkatkan mortalitas pada udang. Diketahui ko-infeksi
Infectious Myonecrosis Virus (IMNV) dengan berbagai dosis Vibrio harveyi dapat mempercepat dan meningkatkan mortalitas udang dibanding dengan infeksi tunggal IMNV. Salah satu alternatif yang dapat dilakukan untuk mengendalikan penyakit udang adalah dengan pemberian sinbiotik (kombinasi probiotik dan prebiotik) yang bertujuan untuk menyiapkan sistem pertahanan non spesifik udang sehingga meningkatkan resistensi udang melawan patogen. Sinbiotik yang digunakan adalah kombinasi antara bakteri probiotik SKT-b dan prebiotik dari ekstrak ubi jalar varietas sukuh (Ipomoea batatas L.). Penelitian ini bertujuan untuk mengkaji pemberian sinbiotik dengan dosis berbeda untuk pencegahan ko-infeksi IMNV dan V. harveyi pada udang vaname melalui pengamatan terhadap performa pertumbuhan, sintasan, dan respon imun. Metode penelitian meliputi persiapan bakteri probiotik (pemurnian, identifikasi, dan Total Plating Count
(TPC) bakteri SKT-b), persiapan prebiotik (ekstraksi ubi jalar dan analisis oligosakarida), dan uji in vivo. Pada uji in vivo, udang vaname diberi perlakuan sinbiotik melalui pakan dengan dosis berbeda (probiotik 0% + prebiotik 0% (K-) dan (K+), probiotik 0,5% + prebiotik 1% (A), probiotik 1% + prebiotik 2% (B), dan probiotik 2% + prebiotik 4% (C) (𝑤 𝑤)) selama 30 hari. Setelah itu, dilanjutkan dengan pengujian resistensi udang vaname terhadap ko-infeksi IMNV dan V. harveyi melalui injeksi intra muskular dan pengamatan dilakukan selama 7 hari. Parameter yang diamati meliputi kelimpahan bakteri usus, performa pertumbuhan, respon imun, dan resistensi udang terhadap ko-infeksi IMNV dan V. harveyi.
Ekstrak ubi jalar yang digunakan pada penelitian ini diketahui mengandung jenis oligosakarida fruktooligosakarida (FOS), galaktooligosakarida (GOS), dan inulin. Berdasarkan hasil penghitungan kelimpahan bakteri SKT-bR, diketahui bahwa perlakuan sinbiotik dosis probiotik 1% (𝑤 𝑤) + prebiotik 2% (𝑤 𝑤) menunjukkan jumlah bakteri SKT-bR tertinggi (3,01 LOG CFU/g). Performa pertumbuhan udang vaname setelah pemberian perlakuan sinbiotik berbagai dosis selama 30 hari menunjukkan bahwa perlakuan sinbiotik dengan dosis probiotik 1% + prebiotik 2% menghasilkan nilai laju pertumbuhan harian tertinggi sebesar 7,45±0,16 dan rasio konversi pakan terbaik sebesar 1,14±0,05. Berdasarkan pengamatan terhadap respon imun, menunjukkan terjadinya peningkatan nilai respon imun seiring dengan meningkatnya dosis sinbiotik yang diberikan. Hal ini mengindikasikan bahwa pemberian sinbiotik melalui pakan dapat meningkatkan sistem kekebalan tubuh dan status kesehatan pada udang vaname. Sintasan udang vaname selama 30 hari perlakuan sinbiotik dengan dosis berbeda, tidak
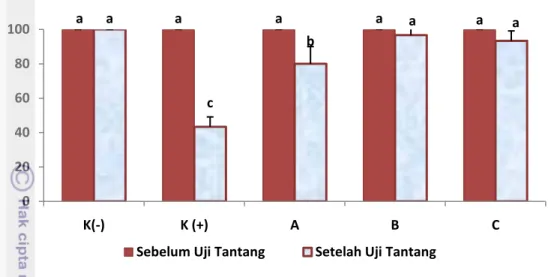
menunjukkan pengaruh yang berbeda nyata. Sementara itu, setelah masa uji tantang dengan ko-infeksi IMNV dan V. harveyi menunjukkan terjadinya penurunan sintasan udang. Sintasan terendah terjadi pada kontrol (+) yaitu sebesar 43,33% dan berbeda nyata dibandingkan dengan kontrol (-) sebesar 100% dan seluruh perlakuan sinbiotik A, B, dan C yaitu 80%, 96,67%, dan 93,33%. Kinerja pertumbuhan, respon imun, dan resistensi udang vaname terhadap ko-infeksi IMNV dan V. harveyi terbaik, diperoleh pada perlakuan dosis probiotik 1% (𝑤 𝑤) + prebiotik 2% (𝑤𝑤).
DEWI NURHAYATI.
Study of Synbiotic with Different Doses to Prevent of Co-Infection Infectious Myonecrosis Virus and Vibrio harveyi in Vaname shrimpLitopenaeus vannamei. Supervised by
WIDANARNI
danMUNTI
YUHANA
One of the problems in white shrimp intensive culture (Litopenaeus vannamei) is the outbreaks of infectious diseases, particularly those caused by viruses and bacteria. Previous studies showed that shrimp diseases not only caused by a single infection. The presence of co-infection or infection with multiple pathogens in white shrimp may accelerate and enhance shrimp mortality. Co-infection IMNV with different doses of V. harveyi could accelerate early mortality and increase mortality compared with IMNV single infection. An alternative that is used to control the disease is by administration of synbiotic (combination of probiotic and prebiotic) to prepare shrimp innate immunity by increasing the resistance of shrimp against pathogens. Synbiotic that used a combination of probiotic bacteria SKT-b and prebiotic of the extract of sukuh variety sweet potatoes (Ipomoea batatas L.).The present study aimed to determine the most optimum combination of probiotic SKT-b and oligosaccharide extracted from sweet potato (I. batatas L) on the growth performance, immune response and disease resistance to co-infection with IMNV and V. harveyi of shrimp (L.
vannamei). This study includes the preparation of probiotic isolate (isolate culture, identification, and total plating count), preparation of prebiotic (exctration from sweet potato, and analysis of oligosaccharides), and in vivo test. In the in vivo test, the white shrimp was given dietary of synbiotic with different doses (0% probiotic + 0% prebiotic (K-), (K+), 0.5% probiotic + 1%prebiotic (A), 1% probiotic + 2% prebiotic (B), 2% probiotic + 4% prebiotic (C) (𝑤 𝑤) ) for 30 days. After that, continued with the testing of shrimp vaname resistance against co-infections by IMNV and V. harveyi through intramuscular injection and conducted for 7 days. Parameters observed were intestine microbial population, growth performance, immune responses and resistance of shrimp to co-infection and V. harveyi IMNV . Sweet potato extract used in this study containing fructooligosaccharides type oligosaccharides (FOS), galactooligosaccharides (GOS), and inulin . Based on the results of the counting of the bacteria, showed that the synbiotic with combination of 1% probiotic (𝑤 𝑤) + 2% prebiotic (𝑤𝑤) was the highest of SKT-bR (3,01 LOG CFU/g). Growth performance of white shrimp after fed by symbiotic with different doses for 30 days showed daily growth rate and food conversion ratio of the shrimp were significantly different in treatment B (pre 1% + pro 2%) than the controls. Based on observations of an immune response, the results showed an improve with increasing doses of synbiotic. This was indicated that the administration of synbiotic through the feed can enhance the immune system and the health status of white shrimp. The results of white shrimp survival after 30 days dietary of synbiotic with different doses, was known did not show a significantly different. Meanwhile, after a period of co-infection challenge test and V. harveyi IMNV through injection caused a decrease in shrimp survival . The
lowest survival occurred in the control (+) (43.33 %) and significantly different compared with control (-) (100%) and the whole treatments of synbiotic A, B, and C were 80% , 96.67 %, and 93.33 %. The results of this study showed that probiotic SKT-b with oligosaccharides from sweet potato (I. batatas L) in shrimp diets can significantly improve the growth, the disease resistance by enhancing immunity, as well as presumably modulating microflora in the shrimp's gut. The most optimum dose of dietary synbiotic in this study was shrimp SKT-b 1% (𝑤 𝑤) and prebiotic 2% (𝑤𝑤).
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apapun tanpa izin IPB
DEWI NURHAYATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Nama : Dewi Nurhayati
NRP : C151110201
Komisi Pembimbing
Dr Ir Widanarni, MSi Dr Munti Yuhana, SPi MSi
Ketua Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian:
(tanggal pelaksanaan ujian tesis)
Tanggal Lulus:
(tanggal penandatanganan tesis oleh Dekan Sekolah
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala nikmat dan karunia-Nya sehingga karya ilmiah ini dapat diselesaikan dengan baik. Karya ilmiah yang berjudul Kajian Pemberian Sinbiotik dengan Dosis Berbeda untuk Pencegahan Ko-Infeksi Infectious Myonecrosis Virus dan Vibrio harveyi pada Udang Vaname (Litopenaeus vannamei) merupakan salah satu syarat untuk memperoleh gelar Magister Sains, Program Studi Ilmu Akuakultur.
Penulis menyampaikan terima kasih kepada Ibu Dr Ir Widanarni, MSi selaku ketua komisi pembimbing serta Ibu Dr Munti Yuhana, SPi MSi selaku anggota komisi pembimbing atas motivasi dan bimbingan yang telah diberikan. Ungkapan terima kasih juga penulis sampaikan kepada Bapak, Ibu, dan adik-adik serta seluruh keluarga tercinta yang tak pernah lelah untuk memberikan dorongan dan do’a yang begitu tulus. Terima kasih juga disampaikan kepada teknisi laboratorium, teman-teman seperjuangan di laboratorium nutrisi dan kesehatan ikan, mahasiswa akuakultur 2011, serta semua pihak yang telah membantu baik langsung maupun tidak langsung.
Akhir kata, penyusun berharap semoga karya ilmiah ini dapat bermanfaat bagi semua pihak yang membutuhkan.
Bogor, Januari 2014
HALAMAN JUDUL LEMBAR PENGESAHAN PRAKATA DAFTAR ISI DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN i ii iii iv v v vi 1 PENDAHULUAN Latar Belakang Tujuan Penelitian Manfaat Penelitian Hipotesis 1 1 2 2 2 2 TINJAUAN PUSTAKA
Infectious Myonecrosis Virus (IMNV)
Vibrio harveyi
Ko-Infeksi Patogen pada Udang Vaname Sinbiotik
Sistem Imun Udang Vaname
3 3 4 5 6 8 3 METODE PENELITIAN
Persiapan Prebiotik (Oligosakarida) Stok Bakteri dan Virus
Uji In Vivo Parameter Pengamatan Analisis Statistik 10 10 12 12 14 17
4 HASIL DAN PEMBAHASAN
Analisa Kandungan Oligosakarida Kelimpahan Bakteri Usus
Performa Pertumbuhan Respon Imun
Sintasan Gejala Klinis
Konfirmasi IMNV dan Vibrio harveyi
17 17 18 19 21 27 29 29
5 SIMPULAN DAN SARAN
Simpulan Saran 30 30 30 DAFTAR PUSTAKA LAMPIRAN RIWAYAT HIDUP 31 35 53
DAFTAR TABEL
Halaman
DAFTAR GAMBAR
Halaman
1 Infectious Myonecrosis (IMN) yang disebabkan oleh Infectious Myonecrosis Virus (IMNV). Bentuk dan ukuran IMNV yang menyerang Litopenaeus vannamei di Brazil (A), juvenil L.
vannamei yang terserang IMNV (B) (C), organ limfoid pada udang yang terserang IMN umumnya mengalami hipertrofi 2-4 kali ukuran normal seperti ditunjukkan pada lingkaran (D) (Lightner 2011)
3
2 Mekanisme sistem pertahanan tubuh non spesifik pada krustasea
(Smith et al. 2003) 9
3 Ubi jalar varietas sukuh (Ipomoea batatas L): (A) buah ubi jalar
varietas sukuh (B) tepung kukus ubi jalar varietas sukuh 10 4 Total Viable Bactery Count (TBC), Total Presumtive Vibrio Count
(TVC), dan Total SKT-bR Count pada usus udang vaname (Litopenaeus vannamei) yang diberi perlakuan pakan sinbiotik
dengan dosis berbeda 19
5 Performa pertumbuhan, laju pertumbuhan spesifik (SGR) (A), rasio konversi pakan (FCR) (B), udang vaname (Litopenaeus vannamei)
selama 30 hari perlakuan sinbiotik dosis berbeda (Duncan; P=0,05) 20 6 Total Haemocyte Count udang vaname (Litopenaeus vannamei)
pada perlakuan sinbiotik dengan dosis berbeda (Duncan; P=0,05) 22 1 Penyakit vertebrata dan invertebrata laut yang disebabkan oleh
Vibrio harveyi (Austin and Zhang 2006) 5
2 Jenis dan konsentrasi gula yang diidentifikasi dengan HPLC
(Marlis 2008) 7
3 Perlakuan dosis sinbiotik dan ko-infeksi IMNV dan V. harveyi pada
udang vaname 13
4 Analisa kandungan FOS, GOS, dan inulin dari ekstrak ubi jalar
8 Respiratory Burst udang vaname (Litopenaeus vannamei) pada
perlakuan sinbiotik dengan dosis berbeda (Duncan; P=0,05) 25 9 Differential Haemocyte (DH), Sel Hialin (A), Sel Granular (B),
udang vaname (Litopenaeus vannamei) pada perlakuan sinbiotik
dengan dosis berbeda (Duncan; P=0,05) 27
10 Sintasan udang vaname (Litopenaeus vannamei) pada perlakuan
sinbiotik dengan dosis berbeda (Duncan; P=0,05) 28
11 Perubahan makro anatomi udang vaname setelah ko-infeksi V.
harveyi dan IMNV 29
12 Hasil pengujian PCR udang vaname terinfeksi IMNV 30
DAFTAR LAMPIRAN
Halaman
1 Pembuatan tepung segar ubi jalar varietas sukuh 35 2 Ekstraksi oligosakarida ubi jalar varietas sukuh 36 3 Hasil penghitungan total padatan terlarut (TPT) dari ekstrak ubi
jalar varietas sukuh 37
4 Pembuatan mutan rifampisin resisten pada isolat bakteri SKT-b 38 5 Pengujian bakteri SKT-b dan V. harveyi secara in vitro 39
6 Komposisi proksimat pakan 40
7 Prosedur pembuatan media kultur bakteri 41
8 Penghitungan bakteri dengan metode hitungan cawan 42
9 Teknik pengambilan hemolymph dan penghitungan Total
Haemocyte Count (THC) pada udang vaname 43
10 Teknik preparasi Differential Haemocyte (DH) 44
11 Analisis statistik terhadap laju pertumbuhan harian (LPH) (A) dan rasio konversi pakan (B) udang vaname pada akhir perlakuan
12 Analisis statistik terhadap respon imun udang vaname: Total Haemocyte Count (THC) (A), Aktivitas Phenoloxidase (PO) (B), Aktivitas Respiratory Burst (RB), dan Differential Haemocyte (DH)
pada sebelum dan sesudah uji tantang 46
13 Analisis statistik terhadap sintasan udang vaname pada sebelum dan
1 PENDAHULUAN
Latar Belakang
Udang vaname (Litopenaeus vannamei) merupakan salah satu komoditas ekspor unggulan dibidang perikanan. Menurut data FAO (2012), Indonesia merupakan negara produsen udang yang menempati urutan keempat dunia setelah negara Cina, Thailand dan Vietnam. Kementrian Kelautan dan Perikanan (KKP), pada tahun 2009 menetapkan target produksi udang vaname meningkat sampai 209% menjadi sebesar 511 ribu ton untuk tahun 2014 (Ditjen Perikanan Budidaya 2010).
Salah satu permasalahan dalam peningkatan produksi budidaya udang vaname adalah serangan berbagai wabah penyakit terutama infeksi yang disebabkan oleh virus dan bakteri. Penyakit viral yang saat ini banyak menyerang udang vaname di Indonesia adalah Infectious Myonecrosis (IMN) yang disebabkan oleh Infectious Myonecrosis Virus (IMNV). IMN dapat menimbulkan tingkat mortalitas diatas 70%. Sedangkan penyakit bakterial yang menyerang udang vaname antara lain vibriosis yang disebabkan oleh bakteri Vibrio harveyi
(Austin and Zhang 2006). V. harveyi telah diakui sebagai patogen serius bagi berbagai organisme akuakultur di seluruh dunia (Soto-Rodriguez et al. 2012).
Penelitian di lapangan telah menunjukkan bahwa patogen tidak hanya menyerang udang vaname sebagai infeksi tunggal. Adanya ko-infeksi atau infeksi bersama beberapa patogen pada udang vaname dapat mempercepat dan meningkatkan mortalitas pada udang. Ko-infeksi virus dan bakteri yang sudah dilaporkan antara lain White Spot Syndrome Virus (WSSV)-Vibrio campbellii
(Phuoc et al. 2009), WSSV-V. harveyi (Phuoc et al. 2009), serta IMNV-V. harveyi
(Hasan 2011). Menurut Hasan (2011), ko-infeksi IMNV dengan berbagai dosis V. harveyi dapat mempercepat dan meningkatkan mortalitas dibanding dengan infeksi tunggal IMNV.
Beberapa metode telah diterapkan untuk mengontrol penyakit antara lain penggunaan antibiotik atau bahan kimia, vaksin, probiotik, penggunaan Specific Pathogen Free (SPF)/Specific Pathogen Resistance (SPR), dan biosekuriti. Penggunaan bahan antibiotik yang tidak tepat telah diketahui dapat menimbulkan masalah serius berupa resistensi pada bakteri patogen (Balcazar et al. 2006) atau terjadinya residu antibiotik pada organisme budidaya yang berbahaya bagi konsumen (FAO 2012). Sementara itu, pengembangan vaksin untuk udang memiliki keberhasilan yang terbatas, karena udang tidak memproduksi limfosit dan tidak memiliki sistem imun spesifik seperti yang dimiliki vertebrata. Salah satu alternatif yang digunakan untuk mengendalikan penyakit udang adalah dengan pemberian sinbiotik (kombinasi antara probiotik dan prebiotik) untuk mensiagakan atau menyiapkan sistem pertahanan non spesifik udang sehingga meningkatkan resistensi udang melawan patogen.
Sinbiotik merupakan kombinasi seimbang probiotik dan prebiotik. Aplikasi sinbiotik muncul sebagai strategi pengendalian biologis untuk meningkatkan pertumbuhan dan resistensi penyakit organisme akuakultur (Cerezuela et al. 2011). Probiotik merupakan mikroba tambahan yang memberikan pengaruh menguntungkan bagi inang melalui peningkatan nilai nutrisi pakan, respon terhadap penyakit atau memperbaiki kualitas lingkungan (Verschuere et al. 2000).
2
Sedangkan prebiotik merupakan bahan pangan yang tidak dapat dicerna oleh inang dan mampu dimetabolisme oleh bakteri menguntungkan yang memiliki kemampuan untuk meningkatkan kesehatan inang (Ringo et al. 2010). Beberapa studi menunjukkan bahwa probiotik yang diberikan bersama prebiotik pada inang dapat meningkatkan kelangsungan hidup dan sistem imun pada udang (Li et al. 2009), lobster (Daniels et al.2010), teripang (Zhang et al. 2010), yellow croaker
(Ai et al. 2011), dan koi (Lin et al. 2012).
Probiotik yang digunakan pada penelitian ini adalah V. alginolyticus (SKT-b). Berdasarkan hasil penelitian, SKT-b merupakan salah satu probiotik yang memiliki kemampuan untuk meningkatkan resistensi udang vaname terhadap infeksi tunggal bakteri V. harveyi (Arisa 2011) dan IMNV (Lesmanawati 2013). Sementara itu, prebiotik yang digunakan adalah oligosakarida dari ubi jalar varietas sukuh (Ipomoea batatas L). Diketahui kombinasi prebiotik dari ubi jalar varietas sukuh dan bakteri NP5 pada ikan nila, telah mampu meningkatkan FCR terbaik dibandingkan perlakuan probiotik dan prebiotik secara terpisah (Putra 2010).
Beberapa penelitian menunjukkan bahwa efektivitas penggunaan probiotik dan prebiotik tergantung pada spesies, dosis, dan lama pemberian (durasi) serta jenis prebiotik dan probiotik (Cerezuela et al. 2011). Dosis pemberian sinbiotik dapat menjadi faktor pembatas untuk mendapatkan hasil yang optimal pada inang. Sehubungan dengan hal tersebut, maka kajian pemberian sinbiotik dengan dosis berbeda diharapkan dapat meningkatkan respon imun untuk pencegahan ko-infeksi IMNV dan V. harveyi serta dapat meningkatkan performa pertumbuhan pada udang vaname
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji pemberian sinbiotik dengan dosis berbeda untuk pencegahan ko-infeksi IMNV dan V. harveyi pada udang vaname melalui pengamatan terhadap sintasan, respon imun, dan performa pertumbuhan.
Manfaat Penelitian
Hasil penelitian ini dapat dijadikan salah satu alternatif pemecahan masalah dalam penanggulangan ko-infeksi IMNV dan V. harveyi serta meningkatkan produktivitas udang vaname.
Hipotesis
Pemberian sinbiotik dengan kombinasi bakteri probiotik SKT-b dan prebiotik dari oligosakarida ubi jalar varietas sukuh dapat meningkatkan resistensi terhadap ko-infeksi IMNV dan V. harveyi serta performa pertumbuhan udang vaname.
2
TINJAUAN PUSTAKA
Infectious Myonecrosis Virus (IMNV)
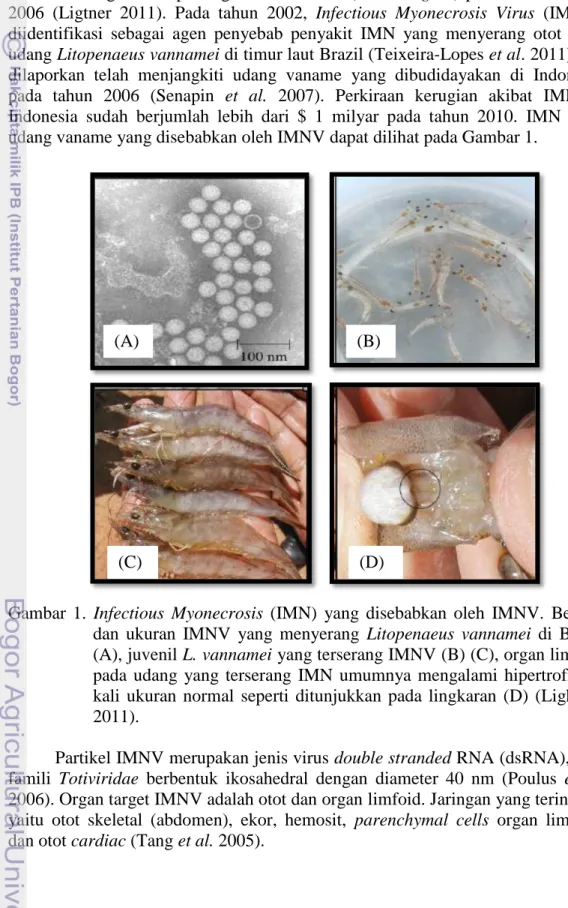
Penyakit IMN merupakan salah satu penyakit viral udang vaname yang terdaftar sebagai virus penting oleh FAO/OIE (Asian Region) pada Januari tahun 2006 (Ligtner 2011). Pada tahun 2002, Infectious Myonecrosis Virus (IMNV) diidentifikasi sebagai agen penyebab penyakit IMN yang menyerang otot pada udang Litopenaeus vannamei di timur laut Brazil (Teixeira-Lopes et al. 2011) dan dilaporkan telah menjangkiti udang vaname yang dibudidayakan di Indonesia pada tahun 2006 (Senapin et al. 2007). Perkiraan kerugian akibat IMN di Indonesia sudah berjumlah lebih dari $ 1 milyar pada tahun 2010. IMN pada udang vaname yang disebabkan oleh IMNV dapat dilihat pada Gambar 1.
Gambar 1. Infectious Myonecrosis (IMN) yang disebabkan oleh IMNV. Bentuk dan ukuran IMNV yang menyerang Litopenaeus vannamei di Brazil (A), juvenil L.vannamei yang terserang IMNV (B) (C), organ limfoid pada udang yang terserang IMN umumnya mengalami hipertrofi 2-4 kali ukuran normal seperti ditunjukkan pada lingkaran (D) (Lightner 2011).
Partikel IMNV merupakan jenis virus double stranded RNA (dsRNA), dari famili Totiviridae berbentuk ikosahedral dengan diameter 40 nm (Poulus et al.
2006). Organ target IMNV adalah otot dan organ limfoid. Jaringan yang terinfeksi yaitu otot skeletal (abdomen), ekor, hemosit, parenchymal cells organ limfoid, dan otot cardiac (Tang et al. 2005).
(B) B (A)
(D) (C)
4
Berdasarkan laporan dari Poulos et al. (2006), indeks kematian kumulatif udang budidaya akibat infeksi IMNV dapat mencapai 70%. Morbiditas dan mortalitas dapat terjadi pada seluruh stadia, tetapi udang juvenil paling rentan terhadap mortalitas. Selain itu, penyakit IMNV ini dapat menyerang udang vaname yang dibudidayakan pada media air laut ataupun air payau bersalinitas rendah (Lightner et al. 2004).
Vibrio harveyi
Vibrio harveyi adalah bakteri berpendar yang bersifat Gram negatif (Austin and Zhang 2006). V. harveyi telah diakui sebagai patogen yang serius untuk berbagai organisme akuatik dalam akuakultur di seluruh dunia (Soto-Rodriguez et al. 2012). Sampai saat ini, V. harveyi merupakan patogen yang paling mematikan dan umum menyerang budidaya udang (Austin and Zhang 2006; Gomez et al.2009). Bakteri V. harveyi merupakan salah satu patogen yang menjadi penyebab penyakit Luminous Vibriosis pada udang vaname (Tabel 1). Penyakit vibriosis pada budidaya udang terjadi pada stadia larva sampai dewasa. Tanda-tanda vibriosis meliputi kerusakan jaringan dan nekrosis, pertumbuhan lambat, metamorfosis larva lambat dan tubuh tidak normal, bioluminescence
(udang bersinar dalam gelap), opacity otot, melanisation, midgut kosong dan anoreksia (Karunasagar et al. 1994).
V. harveyi tergolong dalam divisi Bacteria, kelas Shyzomycetes, ordo Eubacteria, famili Vibrionaceae dan genus Vibrio. Bakteri Vibrio memiliki karakteristik sel tunggal, berbentuk batang pendek yang bengkok (koma) atau lurus, bersifat motil, ukuran sel 1-4 mikron, berpendar dan mempunyai flagella di salah satu kutubnya. Sifat biokimia Vibrio ini yaitu oksidase positif, fermentatif terhadap glukosa. Bakteri V. harveyi menghasilkan lisin dekarboksilase, nitrat reduktase dan sitokrom oksidase serta enzim amilase, kitinase dan lipase (Lavilla-Pitogo et al. 1990). Protease, phospolipase, haemolysin atau eksotoksin merupakan faktor patogenitas penting V. harveyi. V. harveyi akan terlihat berpendar jika diamati di ruang gelap dan pendarannya dapat bertahan 2-3 hari pada media Thiosulphate Citrate Bile-Salt Sucrose (TCBS). Kemampuan berpendar merupakan hasil aktivitas enzim luciferase yang dapat berfungsi sebagai katalisator dalam proses oksidasi reduksi. Proses oksidasi melibatkan flavin mononukleotida dan aldehid alifatik rantai panjang sebagai substratnya. Senyawa-senyawa tersebut masing-masing diubah menjadi flavin mononukelotida dan asam lemak disertai dengan pelepasan emisi cahaya dengan panjang gelombang 490 nm (Lavilla-Pitogo et al. 1990).
Tabel 1. Penyakit vertebrata dan invertebrata laut yang disebabkan oleh Vibrio harveyi (Austin and Zhang 2006)
Inang Nama Penyakit Referensi
Vertebrates Jack crevalle (Caranx hippos)
Deep dermal lesions Kraxbergger-Beatty et al. (1990)
Various fish species Gastro-enteritis Lee et al. (2002)
Various fish species Eye lesions Ishimaru and Muroga (1997) Summer flounder
(Paralichthys dentatus)
Infectious necrotizing
enteritis Soffientino et al. (2002) et al. (1999) and Lee
Sandbar shark
(Carcharhinus plumbeus)
Vasculitis Grimes et al. (1984b) and
Colwell and Grimes (1984) Lemon shark
(Negraprion brevirostris)
Vasculitis
Sandbar shark Skin ulcer Bertone et al. (1996)
Invertebrates
Japanese abalone White spot on the foot Nishimori et al. (1998)
Penaeid shrimp Luminous vibriosis Prayitno and Latchford (1995) Penaeid shrimp Bolitas negricans Robertson et al. (1998)
Sea cucumber (Holothuria scabra)
Skin ulceration Becket et al. (2004)
Ko-Infeksi Patogen pada Udang Vaname
Beberapa penelitian di lapangan telah menunjukkan adanya ko-infeksi atau infeksi bersama beberapa patogen pada udang vaname. Ko-infeksi tersebut dapat disebabkan oleh 2 atau lebih patogen viral, patogen viral-bakterial dan antar bakterial. Hasil penelitian Teixeira-Lopes et al. (2011), menemukan ko-infeksi secara alami untuk pertama kalinya pada udang vaname yang disebabkan oleh
Infectious Hypodermal and Hematopoietic Virus (IHHNV) dan IMNV di timur laut Brazil.
Ko-infeksi dapat meningkatkan mortalitas dan kerentanan udang terhadap penyakit. Ko-infeksi WSSV dan bakteri V. campbellii 104 CFU/udang menyebabkan kematian 100% pada 84 hpi (hours post infection). Sementara itu, infeksi tunggal V. campbelli 104 CFU/udang tidak menyebabkan kematian dan infeksi tunggal WSSV menyebabkan mortalitas 100% pada 156 hpi (Phuoc et al.
2009). Sedangkan ko-infeksi WSSV dengan V. harveyi strain BB120 106 CFU/udang menyebabkan mortalitas 80% dalam 360 hpi, dan infeksi tunggal V.
6
harveyi strain BB120 tidak menyebabkan mortalitas pada dosis injeksi 106 CFU/udang (Phuoc et al. 2009). Ko-infeksi IMNV dengan berbagai dosis V. harveyi juga telah dilaporkan dapat mempercepat awal mortalitas dan meningkatkan mortalitas dibandingkan dengan infeksi tunggal IMNV (Hasan 2011). Dalam penelitian tersebut diketahui bahwa infeksi V. harveyi 107CFU/ml tidak menyebabkan mortalitas, dan infeksi tunggal IMNV menyebabkan mortalitas diawali pada hari ke-10 pasca infeksi dengan kumulatif 13.33%, sedangkan ko-infeksi virus IMNV dan V. harveyi 107CFU/ml menyebabkan awal mortalitas udang lebih cepat (hari ke-4 pasca infeksi) dengan kumulatif lebih tinggi yaitu 40%.
Sinbiotik
Sinbiotik adalah suplemen gizi yang menggabungkan probiotik dan prebiotik, sehingga dapat meningkatkan efek menguntungkan pada inang. Sinbiotik mempengaruhi inang dengan cara meningkatkan kelangsungan hidup dan masuknya mikroba hidup melalui suplemen makanan dalam saluran pencernaan yang secara selektif mampu merangsang pertumbuhan dan mengaktifkan metabolisme bakteri yang dapat meningkatkan kesehatan inang (Cerezuela et al. 2011).
Probiotik adalah aplikasi mikroba hidup yang memiliki efek menguntungkan pada inang dengan memodifikasi komunitas mikroba inang atau lingkungan sekitarnya, untuk meningkatkan efisiensi pakan atau meningkatkan nilai gizi, meningkatkan respon inang terhadap penyakit, atau meningkatkan kualitas lingkungan (Verschuere et al. 2000). Probiotik yang telah digunakan sebagai agen kontrol biologi dalam akuakultur adalah dari kelompok genus
Lactobacillus, Bacillus, Micrococcus, Pseudomonas, Vibrio and Aeromonas
(Nayak 2010). Beberapa probiotik memberi efek manfaatnya dengan menghasilkan molekul antibakteri seperti bakteriosin yang secara langsung mampu menghambat bakteri lain atau virus dan aktif berpartisipasi dalam memerangi infeksi. Selain itu menghambat pergerakan bakteri lain di dinding usus (translokasi), meningkatkan fungsi penghalang mukosa dengan meningkatkan produksi respon imun non spesifik atau memodulasi inflamasi (Cerezuela et al. 2011).
Prebiotik menawarkan metode alternatif untuk memanipulasi mikroba
endogenous untuk meningkatkan kesehatan inang (Cerezuela et al. 2011). Prebiotik adalah bahan makanan tidak tercerna, yang bersifat menguntungkan bagi inang dengan secara selektif merangsang pertumbuhan sejumlah bakteri tertentu di usus. Mekanisme potensi prebiotik mencakup meningkatkan /menurunkan bakteri usus tertentu yang secara selektif memodulasi sitokin dan produksi antibodi, meningkatkan produksi asam lemak rantai pendek pada usus dan meningkatkan pengikatan asam lemak pada reseptor protein G-coupled pada
leycocytes, peningkatan interaksi reseptor karbohidrat pada sel epitel usus dan sel imun. Berdasarkan hasil penelitian pada beberapa parameter, prebiotik dapat meningkatkan pertumbuhan, konversi pakan, mikrobiota usus, kerusakan sel/morfologi, resistensi terhadap bakteri patogen dan parameter sistem imun non spesifik seperti aktivitas pelengkap alternatif (ACH50), aktivitas lisozim, aktivitas
haemaglutination alami, respiratory burst, aktivitas superoksida dismutase dan aktivitas fagositosis (Mahious et al. 2006; Ringo et al.2010).
Prebiotik tidak dapat dipisahkan dengan probiotik, karena target prebiotik adalah memacu pertumbuhan bakteri probiotik (Schrezenmeir and Vrese 2001). Prebiotik yang umum digunakan dalam akuakultur adalah inulin,
fructooligosaccharides (FOS), fructooligosaccharides rantai pendek (scFOS),
mannanoligosaccharides (MOS), galactooligosaccharides (GOS), xylooligo sakarides (XOS), arabinoxylooligosaccharides (Axos), isomaltooligosaccharides
(IMO) dan GroBiotic-A (Ringo et al. 2010).
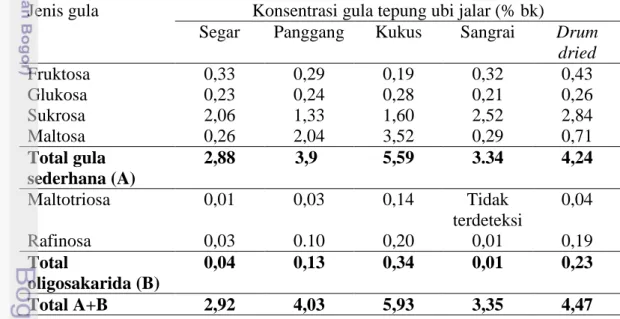
Prebiotik juga dapat ditemukan secara alami dari berbagai jenis bahan tanaman pangan. Salah satunya berasal dari jenis tanaman umbi yaitu ubi jalar (Ipomoea batatas L) (Moongngram et al. 2011). Komposisi kimia ubi jalar bervariasi tergantung pada waktu panen, varietas, dan proses pengolahan (Marlis 2008). Kandungan gula yang terdapat pada ubi jalar varietas sukuh terdiri dari fruktosa, glukosa, sukrosa, maltose, inulin dan maltotriosa (Marlis 2008). Berdasarkan penelitian Marlis (2008), tepung ubi jalar yang mengalami pengolahan memiliki potensi prebiotik karena masih mengandung oligosakarida yaitu maltosa dan maltotriosa. Kandungan gula dari ekstrak tepung kukus ubi jalar varietas sukuh memiliki kandungan ologosakarida terbesar yaitu mencapai 0,34% (Tabel 2).
Tabel 2. Jenis dan konsentrasi gula yang diidentifikasi dengan HPLC (Marlis 2008)
Jenis gula Konsentrasi gula tepung ubi jalar (% bk)
Segar Panggang Kukus Sangrai Drum
dried Fruktosa 0,33 0,29 0,19 0,32 0,43 Glukosa 0,23 0,24 0,28 0,21 0,26 Sukrosa 2,06 1,33 1,60 2,52 2,84 Maltosa 0,26 2,04 3,52 0,29 0,71 Total gula sederhana (A) 2,88 3,9 5,59 3.34 4,24 Maltotriosa 0,01 0,03 0,14 Tidak terdeteksi 0,04 Rafinosa 0,03 0.10 0,20 0,01 0,19 Total oligosakarida (B) 0,04 0,13 0,34 0,01 0,23 Total A+B 2,92 4,03 5,93 3,35 4,47
Sinbiotik mengacu pada suplemen gizi yang menggabungkan probiotik dan prebiotik dalam bentuk sinergisme. Ketika dua bahan gizi atau suplemen yang diberikan bersamaan, efek positif yang dihasilkan umumnya mengikuti salah satu dari tiga pola: aditivitas, sinergisme atau potensiasi. Efek aditif terjadi ketika efek dari dua bahan yang digunakan bersama-sama mendekati dengan jumlah dari efek bahan individu. Dalam kasus sinergisme, dikatakan terjadi ketika efek gabungan dari dua produk secara signifikan lebih besar daripada jumlah efek dari setiap agen yang diberikan sendiri (Cerezuela et al. 2011).
8
Berbagai faktor seperti spesies, waktu pemberian dan suplemen dosis serta jenis prebiotik dan probiotik secara signifikan dapat mempengaruhi aktivitas sinbiotik (Cerezuela et al. 2011). Menurut penelitian Li et al. (2009) aplikasi sinbiotik kombinasi 0,2% isomaltooligosakarida dengan 108 CFU PB/g pakan menghasilkan efek signifikan sinergis positif terhadap sistem kekebalan udang terhadap penyakit. Penelitian lainnya Lin et al. (2012), menunjukkan bahwa penambahan kombinasi 0,1 % probiotik Bacillus coagulans dan 0,2% prebiotik COS (chitosan oligosaccharides) dalam pakan memiliki efek sinergis dalam meningkatkan kekebalan dan resistensi penyakit pada ikan koi (Cyprinus carpio
koi). Sementara itu, hasil penelitian Geraylou et al. (2013), probiotik
Lactobacillus lactis STG45 dosis 109 CFU/g dan 2% arabinoxylan-oligosaccharides (Axos) menyebabkan perubahan signifikan dalam mikrobiota usus , kinerja pertumbuhan yang membaik dan meningkatkan respon imun pada ikan Siberian sturgeon.
Sistem Imun Udang Vaname
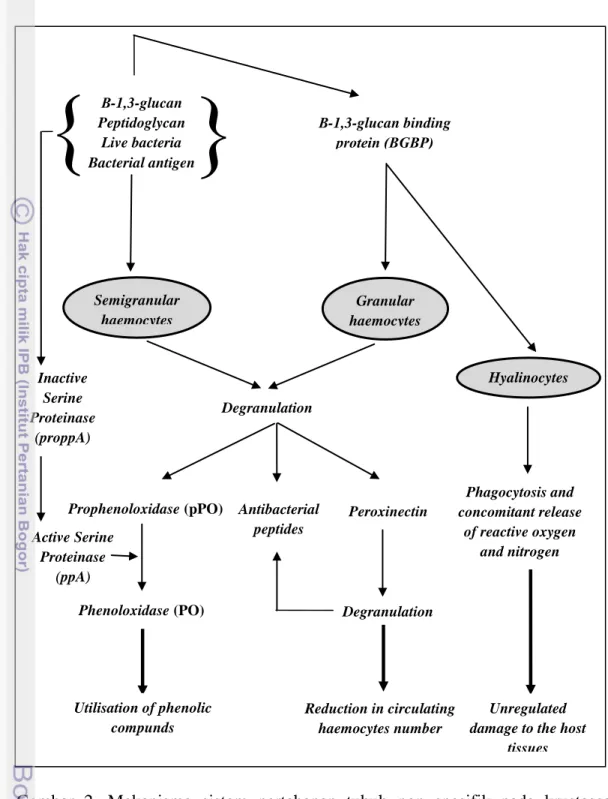
Udang tidak memiliki respon imun spesifik (adaptive immunity) dan sepenuhnya tergantung pada respon imun nonspesifik (innate immunity). Respon imun nonspesifik terdiri atas respon selular dan respon humoral (Gambar 2) . Respon selular berupa aktivitas sel-sel hemosit yang memiliki peran penting dalam sistem pertahanan tubuh. Hemosit krustasea dan invertebrata lain memainkan peranan penting dalam sistem pertahanan tubuh terhadap patogen seperti virus, bakteri, fungi, protozoa, dan metazoa (Rodriquez and Le Muollac 2000; Smith et al. 2003). Hemosit mengeluarkan partikel asing dalam hemocoel
melalui aktivitas fagositosis, enkapsulasi dan agregasi nodular. Hemosit berperan dalam penyembuhan luka melalui ‘cellular clumping’ serta membawa dan
melepaskan sistem prophenoloxidase (proPO). Selain itu hemosit juga berperan dalam sintesa dan pelepasan molekul penting hemolim seperti α2-macroglobulin,
aglutinin, dan peptida antibakteri (Rodiguez and Le Moullac 2000; Smith et al. 2003). Dalam kondisi tidak terinfeksi, faktor-faktor imun-reaktif (misalnya
peroxinectin, antibacterial peptides, komponen penggumpal, disimpan dalam keadaan tidak aktif dalam hemosit (Smith et al. 2003).
Enzim phenoloxidase (PO) terdapat dalam hemolymph sebagai inactive pro-enzyme yang disebut proPO. Sistem proPO merupakan salah satu sistem pertahanan dominan pada krustasea yang berefek pada perilaku sel, pembebasan dan aktivasi molekul fungsional penting serta netralisasi dari agen infektif (Smith
et al. 2003). Transformasi proPO menjadi PO melibatkan beberapa reaksi yang dikenal sebagai proPO activing system (sistem aktivasi proPO). Sistem ini terutama diaktifkan oleh beta glukan, dinding sel bakteri dan lipopolisakarida (LPS). Sistem proPO dapat digunakan sebagai marker kesehatan udang dan lingkungan karena perubahan sistem proPO berkorelasi dengan tahap infeksi dan variasi lingkungan.
Gambar 2. Mekanisme sistem pertahanan tubuh non spesifik pada krustasea (Smith et al. 2003).
Fagositosis merupakan reaksi yang paling umum dalam pertahanan seluler udang. Proses fagositosis dimulai dengan perlekatan (attachment) dan penelanan (ingestion) partikel mikroba ke dalam sel fagosit. Sel fagosit kemudian membentuk vakuola pencernaan (digestive vacuola) yang disebut phagosome
(Rodriquez and Le Moullac 2000). Lysosome (granula dalam sitoplasma fagosit) kemudian menyatu dengan phagosome membentuk phagolysosome. Mikroorganisme selanjutnya dihancurkan dan debris mikroba dikeluarkan dari dalam sel melalui proses egestion. Pemusnahan partikel mikroba yang difagositik
}
{
Semigranular haemocytes Granular haemocytes Hyalinocytes Degranulation Phagocytosis and concomitant release of reactive oxygen and nitrogen Antibacterial peptides Peroxinectin Prophenoloxidase (pPO) Phenoloxidase (PO) Utilisation of phenolic compunds Degranulation Reduction in circulating haemocytes number Β-1,3-glucan binding protein (ΒGBP) Β-1,3-glucan Peptidoglycan Live bacteria Bacterial antigen Active Serine Proteinase (ppA) Inactive Serine Proteinase (proppA) Unregulated damage to the host
10
melibatkan pelepasan enzim ke dalam phagosome dan produksi Reactive Oxygen Intermediate (ROI) yang kini disebut respiratory burst (Rodriquez and Le Moullac 2000).
Klasifikasi tipe hemosit pada krustasea berdasarkan keberadaan
cytoplasmic granules, yaitu sel hialin (HCS), sel hemosit semigranular (SGHs) dan sel hemosit granular (GHS) (Smith et al. 2003; Hauton 2012). Sel hialin merupakan tipe sel yang paling kecil dengan rasio nukleus sitoplasma tinggi dan tanpa atau hanya sedikit granula sitoplasma; sel granular merupakan tipe sel paling besar dengan nukleus yang lebih kecil dan terbungkus dengan granula; sel semi-granular merupakan tipe sel diantara hialin dan sel granular. HCS memiliki peran dalam fagositosis sementara SGHs memiliki peran dalam enkapsulasi, pengenalan awal, melanisation dan koagulasi di sebagian kelompok dan GHS berfungsi dalam proses melanisation, menghasilkan dan mengeluarkan peptida antimikroba dan terlibat dalam reaksi sitotoksik (Smith et al. 2003).
3 METODE PENELITIAN
Persiapan Prebiotik (Oligosakarida) Pembuatan Tepung Kukus Ubi Jalar (Marlis 2008)
Ubi jalar segar dibersihkan dan dikupas, lalu diiris dengan menggunakan pisau. Setelah itu, ubi jalar dikeringkan dalam oven pengering pada suhu 55oC selama 5 jam atau hingga irisan ubi jalar dapat dipatahkan dengan tangan. Irisan ubi jalar kemudian digiling dengan willey mill dan diayak pada size 60 mesh. Tahapan dalam pembuatan tepung segar ubi jalar dapat dilihat pada Lampiran 1.
Sebanyak 500 gram tepung segar ubi jalar ditambahkan air dengan perbandingan 1:1 (w/v) dan dikukus pada suhu 100oC selama 30 menit. Hasil pengukusan tersebut dikeringkan dalam oven pada suhu 55oC selama 18 jam (Gambar 3).
(A) (B)
Gambar 3. Ubi jalar varietas sukuh (Ipomoea batatas L): (A) buah ubi jalar varietas sukuh (B) tepung kukus ubi jalar varietas sukuh.
Ekstraksi Oligosakarida (Muchtadi 1989)
Pada proses ekstraksi, sebanyak 100 gram tepung kukus ubi jalar disuspensikan ke dalam 1 L etanol 70% dan diaduk selama 15 jam menggunakan
magnetic stirer pada suhu ruang. Penyaringan dilakukan dengan menggunakan kertas saring whatman no.1 dan residu dibilas dengan menggunakan etanol 70%. Filtrat yang diperoleh dipekatkan menggunakan evaporator vakum pada suhu 40oC. Hasil pemekatan disentrifuse pada 5000 rpm selama 10 menit untuk mengendapkan kotoran, sehingga ekstrak mudah disterilisasi dengan kertas saring. Tahapan pembuatan ekstrak oligosakarida dapat dilihat pada Lampiran 2.
Pengukuran Konsentrasi Oligosakarida (Apriyantono 1989)
Pengukuran konsentrasi oligosakarida atau Total Padatan Terlarut (TPT) bertujuan untuk mengetahui kepekatan padatan terlarut prebiotik yang diperlukan pada pengujian in vivo. Cawan porselin dikeringkan selama 2 jam dalam oven 100oC, kemudian didinginkan dalam desikator hingga diperoleh berat tetap. Cawan tersebut kemudian ditimbang (a gram). Sebanyak 1 ml oligosakarida yang diekstraksi dari ubi jalar ditempatkan dalam cawan porselen tersebut dan ditimbang (b gram). Kemudian dimasukkan ke dalam oven selama 24 jam dengan suhu 100oC. Setelah kering, cawan didinginkan dalam desikator selama 10 menit atau hingga berat cawan stabil, kemudian cawan tersebut ditimbang (c gram). Total padatan terlarut dihitung dari hasil perbandingan berat ekstrak setelah dikeringkan dengan berat ekstrak sebelum dikeringkan. Rumus yang digunakan untuk TPT yaitu sebagai berikut:
TPT =c − a
𝑏 × 100 %
Keterangan: a = berat cawan sebelum diisi ekstrak oligosakarida b = berat cawan setelah diisi ekstrak oligosakarida
c = berat cawan sebelum diisi ekstrak oligosakarida dan di oven 24 jam
Konsentrasi oligosakarida (prebiotik) yang digunakan pada penelitian ini adalah konsentrasi TPT 5% (Marlis 2008). Hasil penghitungan TPT dapat dilihat pada Lampiran 3.
Analisis Kandungan Oligosakarida
Analisis oligosakarida dilakukan dengan menggunakan High Performance Liquid Chromatography (HPLC). Analisa ini bertujuan untuk mengetahui jenis dan konsentrasi oligosakarida yang terkandung dalam prebiotik hasil ekstraksi. Kolom yang digunakan adalah carbohydrate column (4,6 mm x 250 mm), ukuran partikel 4 µm dengan refraktif indeks detector dan berlaju alir (flow rate) 2,0 ml/menit. Fase gerak yang digunakan adalah asetonitril dan air dengan perbandingan asetonitril: aquabidest (80:20). Volume sampel yang diinjeksikan adalah 20 µl dengan temperatur kolom 40oC. Standar gula yang digunakan adalah fruktooligosakarida (FOS), galaktooligosakarida (GOS), dan inulin.
12
Stok Bakteri dan Virus Bakteri Probiotik SKT-bR
Bakteri probiotik SKT-b merupakan bakteri Vibrio alginolyticus yang diperoleh dari hasil penapisan pada media kultur Skeletonema sp. di lingkungan pembenihan udang windu, Labuan Banten (Widanarni et al. 2003). Bakteri SKT-b dibuat resisten terhadap antibiotik rifampisin sebagai penanda molekuler untuk membedakan bakteri yang diinokulasikan dengan bakteri yang sebelumnya telah ada pada media pemeliharaan maupun tubuh udang. Tahapan dalam Pembuatan bakteri menjadi resisten terhadap rifampisin (RfR) dapat dilihat pada Lampiran 4. Untuk selanjutnya bakteri SKT-b yang telah resisten rifampisin disebut dengan SKT-bR. Bakteri dikultur ulang dan dimurnikan. Lalu dikonfirmasi melalui uji morfologi, fisiologi dan biokimia serta ditentukan nilai Total Plating Count
(TPC). Hasil Pengujian SKT-bR ditampilkan dalam Lampiran 5. Bakteri Vibrio harveyi
Jenis bakteri patogen yang digunakan pada penelitian ini adalah V. harveyi
MR 5339. Isolat V. harveyi merupakan koleksi Laboratorium Kesehatan Ikan, Departemen Budidaya Perairan, Institut Pertanian Bogor. Bakteri dikultur ulang dan dimurnikan. Lalu dikonfirmasi melalui uji morfologi, fisiologi dan biokimia serta ditentukan nilai Total Plating Count (TPC). Hasil pengujian V. harveyi MR 5339 ditampilkan dalam Lampiran 5.
Virus IMN (Infectious Myonecrosis)
Udang vaname positif IMNV didapatkan dari Balai Pengembangan Budidaya Air Payau (BPBAP) Situbondo, Jawa Timur. Prosedur pembuatan ekstrak IMNV adalah daging udang positif IMNV dicacah (tanpa hepatopankreas, usus, dan karapas), kemudian dilarutkan dalam PBS (10x) dan sentrifuse pada suhu 4 oC dengan kecepatan 6500 rpm selama 20 menit. Setelah itu supernatan diambil dan dimasukkan dalam mikrotube baru. Selanjutnya mikrotube disentrifuse dengan kecepatan 13.000 rpm (4 oC) selama 20 menit. Supernatan diambil dan difilter dengan syringe filter (0,45 µm) yang diekstrak untuk didapatkan stok virus IMNV. Hasil ekstrak virus IMNV disimpan pada suhu -70oC.
Uji In Vivo
Uji in vivo dilakukan dalam dua tahap yaitu aplikasi sinbiotik pada udang vaname melalui pakan dan pengujian resistensi udang vaname terhadap ko-infeksi IMNV dan V. harveyi. Pengujian dilakukan sebanyak lima perlakuan dan tiga kali ulangan (Tabel 3).
Tabel 3. Perlakuan dosis sinbiotik dan ko-infeksi IMNV dan V. harveyi pada udang vaname.
Aplikasi Sinbiotik pada Udang Vaname
Pemberian sinbiotik berbagai dosis (probiotik 0% + prebiotik 0% (K-) dan (K+), probiotik 0,5% + prebiotik 1% (A), probiotik 1% + prebiotik 2% (B), probiotik 2% + prebiotik 4% (C)) dilakukan selama 30 hari pemeliharaan. Perlakuan diberikan melalui pakan untuk membandingkan efektivitas dosis sinbiotik dalam meningkatkan performa pertumbuhan dan sistem imun pada udang vaname.
a. Persiapan wadah dan media pemeliharaan
Wadah pemeliharaan berupa akuarium kaca berukuran 60x30x40 cm3. Sebelum digunakan, wadah didesinfeksi dengan klorin 100 ppm selama 24 jam. Wadah dibilas dengan air tawar dan dijemur di bawah sinar matahari untuk menghilangkan residu klorin. Setelah itu akuarium ditutup dengan plastik hitam untuk mengurangi intensitas cahaya yang masuk. Masing-masing akuarium dilengkapi dengan shelter (pipa paralon 0,5 inchi), batu aerasi, dan jaring penutup. Bagian atas akuarium diberi lampu pijar (40 Watt) yang berfungsi untuk mempertahankan suhu pada malam hari. Air laut yang digunakan pada penelitian ini berasal dari pantai Ancol. Air laut disimpan dalam tandon dan didesinfeksi dengan klorin 30 ppm selama 24 jam. Setelah itu residu klorin dihilangkan dengan menambahkan Na-Thiosulfat 15 ppm dan diaerasi. Setiap akuarium diisi air laut dengan volume 30 liter. Kualitas air dalam akuarium selama perlakuan, dipertahankan stabil dan pergantian air dilakukan 10%/hari. Kotoran dan sisa pakan yang terakumulasi dalam akuarium dikeluarkan melalui penyiponan. Kualitas air media pemeliharaan selama penelitian adalah temperatur air 28-29o C, salinitas 29-32 ppt, amonia-nitrogen 0,005-0,016 mg/l, oksigen 4,5– 6,5 mg/l, pH 7,4-7,5.
b. Organisme uji
Organisme uji adalah udang Litopenaeus vannamei Specific Pathogen Free (SPF) terhadap White Spot Syndrome Virus (WSSV), InfectiousHypodermal and Hematopoietic Necrosis (IHHNV), Taura Syndrome Virus (TSV), dan
No Perlakuan Keterangan
1 K- Pemberian pakan tanpa penambahan sinbiotik dan tanpa perlakuan ko-infeksi (kontrol negatif)
2 K+ Pemberian pakan tanpa penambahan sinbiotik serta perlakuan ko-infeksi (kontrol positif)
3 A Pemberian pakan dengan penambahan sinbiotik dosis A (probiotik sebesar 0,5% dan prebiotik sebesar 1%) serta perlakuan ko-infeksi
4 B Pemberian pakan dengan penambahan sinbiotik dosis B (probiotik sebesar 1% dan prebiotik sebesar 2%) serta perlakuan ko-infeksi
5 C Pemberian pakan dengan penambahan sinbiotik dosis C (probiotik sebesar 2% dan prebiotik sebesar 4%) serta perlakuan ko-infeksi.
14
Infectious Myonecrosis Virus (IMNV). Udang vaname diperoleh dari hatchery
komersial di Anyer, Banten. Perlakuan diberikan pada udang dengan berat rata-rata 0,3 ± 0.02 g. Udang dipelihara dalam lingkungan terkontrol pada akuarium dengan kepadatan 15 ekor/akuarium selama 30 hari. Pakan yang diberikan berupa pakan komersil dengan frekuensi pemberian sebanyak empat kali sehari.
c. Pembuatan pakan perlakuan
Perlakuan sinbiotik diberikan ke udang melalui pakan berupa pelet udang komersial dan binder berupa putih telur sebanyak 2% dari bobot pelet. Bakteri SKT-bR dan ekstraksi oligosakarida ditambahkan ke pakan dengan dosis sesuai perlakuan (probiotik 0,5% + 1% prebiotik (A), probiotik 1% + prebiotik 2% (B), probiotik 2% + prebiotik 4% (C)). Pakan untuk udang kontrol juga ditambahkan putih telur 2% tanpa bakteri SKT-bR dan oligosakarida. Pelet dikeringanginkan selama 15 menit, dibungkus dalam plastik tertutup dan disimpan pada suhu 4oC. Pembuatan pakan perlakuan dilakukan setiap hari dan diberikan ke udang pada empat kali pemberian pakan, yaitu pada pukul 08.00, 12.00, 16.00, dan 20.00 WIB. Hasil proksimat pakan uji dapat dilihat pada Lampiran 6.
Pengujian Resistensi Udang Vaname terhadap Ko-Infeksi (Uji Tantang) Uji tantang dilakukan untuk mengevaluasi kinerja sinbiotik dalam meningkatkan resistensi udang vaname terhadap ko-infeksi IMNV dan V. harveyi. Udang yang telah diberi pakan perlakuan selama 30 hari, dipuasakan selama 24 jam. Pada hari ke 32 udang diinfeksi dengan IMNV (kecuali kontrol negatif) melalui injeksi bagian punggung antara segmen tiga dan empat. Dosis virus yang diberikan sebanyak 100 µL/udang. Setelah itu dilakukan kultur bakteri V. harveyi
yang digunakan untuk infeksi selanjutnya pada udang melalui injeksi setelah 72 jam penyuntikan virus. Kepadatan bakteri V. harveyi yang digunakan adalah 103 CFU/mL. Pengamatan dilakukan selama tujuh hari setelah infeksi pertama. Pakan yang diberikan pada perlakuan uji tantang adalah pelet udang komersial tanpa penambahan sinbiotik.
Parameter Pengamatan Penghitungan Kelimpahan Bakteri Usus
Penghitungan kelimpahan bakteri dilakukan dengan metode hitungan cawan sebar (Madigan et al. 2003). Usus udang (berat 0,1 g) yang dikumpulkan dari 3-5 ekor udang pada masing-masing akuarium dihomogenisasi dalam 0,9 ml
phosphate buffer saline (PBS) steril. Pengamatan yang dilakukan meliputi Total Viable Bacterial Count (TBC), Total Presumtive Vibrio Count (TVC) dan Total
SKT-bR Count. Media yang digunakan pada percobaan ini adalah Sea Water Complete (SWC) agar, media selektif Thiosulphate Citrate Bile-Salt Sucrose
(TCBS) agar, dan TCBS agar+Rif 50 µg/ml. Prosedur pembuatan media dan penghitungan bakteri dengan metode hitungan cawan sebar dapat dilihat pada Lampiran 7 dan 8.
Performa Pertumbuhan
a. Laju pertumbuhan harian (LPH)
Nilai LPH selama pemeliharaan dengan perlakuan sinbiotik dosis berbeda dihitung berdasarkan Huisman (1987) dengan menggunakan rumus berikut:
LPH (%) = 𝑊𝑡
𝑊𝑜 𝑡
− 1 × 100%
Keterangan :
We = Bobot rata-rata udang pada akhir perlakuan Ws = Bobot rata-rata udang pada awal perlakuan d = Periode pemeliharaan
b. Rasio konversi pakan (FCR)
Rasio konversi pakan selama pemeliharaan dengan perlakuan sinbiotik dosis berbeda dihitung berdasarkan Zonneveld et al. (1991) dengan menggunakan rumus berikut:
𝐹𝐶𝑅 = 𝐹
𝐵𝑡 + 𝐵𝑚 − 𝐵𝑜
Keterangan:
FCR = Konversi pakan F = Jumlah pakan (gram)
Bt = Biomassa udang pada saat akhir pelakuan (g) Bm = Biomassa udang yang mati saat perlakuan (g) Bo = Biomassa udang pada saat awal perlakuan (g) Parameter Sistem Imun
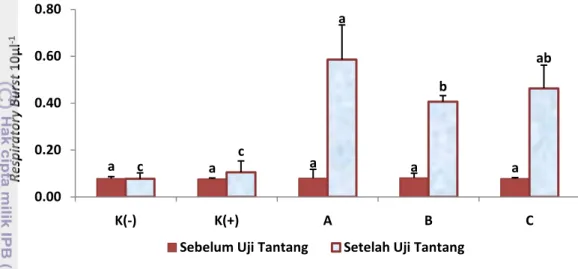
Parameter imun diukur pada akhir perlakuan sinbiotik (sebelum uji tantang) dan setelah masa pengujian resistensi udang vaname terhadap ko-infeksi IMNV dan V. harveyi selama 7 hari (setelah uji tantang). Parameter yang diukur adalah Total HaemocyteCount (THC), Aktivitas Phenoloxidase (PO), Respiratory Burst (RB), dan Differential Haemocyte (DH).
a. Total Haemocyte Count (THC)
Sebanyak 0,2 mL hemolim udang diambil dengan menggunakan syringe 1 mL yang telah berisi 0,1 mL antikoagulan. Campuran hemolim-antikoagulan kemudian divorteks hingga merata. Lalu diteteskan pada haemocytometer dan THC dihitung di bawah mikroskop dengan pembesaran 40x.
b. Aktivitas Phenoloxidase (PO) (Liu and Chen 2004)
Aktivitas PO haemocyte diukur berdasarkan formasi dopachrome yang dihasilkan oleh L-DOPA. Sebanyak 1 mL campuran hemolim-antikoagulan disentrifuse pada 1500 rpm selama 10 menit pada temperatur 4 oC. Supernatan dibuang dan pelet disuspensi kembali secara perlahan-lahan dengan
16
menambahkan 1 mL larutan cacodylate-citrate buffer (0,01 M sodium cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7) dan disentrifuse kembali (1500 rpm selama 10 menit pada temperatur 4 oC). Supernatan yang terbentuk dibuang dan ditambahkan 200 µL cacodylate-citrate buffer (0,01 M sodium
cacodylate, 0,45 M sodium chloride, 0,10 M trisodium citrate, pH 7).
Suspensi sel sebanyak 100 µL kemudian diinkubasi dengan 50 µL tripsin (1 mg/mL cacodylate buffer) sebagai aktivator selama 10 menit pada temperatur 25-26 oC. Selanjutnya ditambahkan 50 µL L-DOPA (3 mg/mL cacodylate buffer), didiamkan selama 5 menit dan ditambahkan 800 µL cacodylate buffer. Densitas optikal (OD) diukur dengan menggunakan spektrofotometer dengan panjang gelombang 490 nm. Larutan standar mengandung 100 µL suspensi hemosit, 50 µL
cacodylate buffer (pengganti tripsin) dan 50 µL L-DOPA. Densitas optikal (OD) dari aktivitas PO dinyatakan sebagai formasi dopachrome dalam 50 µL hemolim. c. Respiratory Burst (RB) (Song and Hsieh 1994)
Respiratory burst dari hemosit diukur berdasarkan reduksi NBT (nitroblue tetrazolium) sebagai ukuran superoxide anion (O2-). Sebanyak 300 µL campuran
hemolim-antikoagulan diinkubasi selama 30 menit dalam suhu ruang. Selanjutnya disentrifuse dengan kecepatan 3000 rpm selama 20 menit dan supernatan dibuang. Ditambahkan 100 µL NBT (larutan HBSS dengan 0,3 % NBT) dan didiamkan selama 2 jam pada suhu ruang. Kemudian disentrifuse 3000 rpm selama 10 menit, supernatan dibuang dan ditambahkan 100 µL metanol absolut untuk selanjutnya disentrifuse 3000 rpm selama 10 menit (supernatan dibuang). Pelet yang terbentuk kemudian dibilas sebanyak 2 kali dengan metanol 70 %. Selanjutnya 120 µL KOH (2M) dan 140 µL DMSO ditambahkan untuk melarutkan pelet. Pelet yang telah larut kemudian dimasukkan ke dalam microplate untuk diukur densitas optikal (OD) menggunakan microplate reader dengan panjang gelombang 630 nm. Respiratory burst dinyatakan sebagai reduksi NBT per 10 µL hemolim. d. Differential Haemocyte (DH)
Differential Haemocyte (DH) dihitung berdasarkan metode yang dilakukan Martin and Graves (1995). Jumlah hemosit dihitung hingga 100 sel dan ditentukan persentase setiap jenisnya (hialindan granular). Persentase setiap jenis sel hemosit dihitung dengan menggunakan rumus:
Persentase jenis sel hemosit = jumlah tiap jenis sel hemosit
Total hemosit × 100%
Sintasan (Survival)
Sintasan atau tingkat kelangsungan hidup udang dalam penelitian ini dihitung pada akhir perlakuan sinbiotik dan setelah masa uji tantang. Sintasan udang dihitung dengan menggunakan rumus berikut :
Survival = (Nt / No) x 100 % Keterangan :
Nt : Jumlah udang yang hidup pada akhir pengamatan (ekor) No : Jumlah udang pada awal pengamatan (ekor)
Pengamatan gejala klinis dilakukan secara visual selama 7 hari masa uji tantang ko-infeksi IMNV dan V.harveyi. Gejala-gejala klinis tersebut diamati untuk mengatahui gejala abnormalitas dan perkembangan makro anatomi udang vaname setelah ko-infeksi IMNV dan V. harveyi. Udang vaname yang telah menunjukkan gejala abnormalitas akibat ko-infeksi, dilakukan uji konfirmasi. Konfirmasi IMNV dan V. harveyi ditujukan untuk memastikan penyebab kematian pada udang.
Konfirmasi keberadaan virus IMNV di tubuh udang uji dilakukan dengan analisis PCR (Kit komersial Nugen-IMNV) di Laboratorium Uji Loka Pemeriksaan Penyakit Ikan dan Lingkungan, Serang. Sementara itu, konfirmasi bakteri V. harveyi dilakukan dengan metode gores kuadran (Madigan et al. 2003) pada media spesifik TCBS-Rif 50 µg/ml. Pengujian dilakukan pada pengamatan hari ke tujuh yakni pada akhir periode uji tantang ko-infeksi IMNV dan V.
harveyi.
Analisis Statistik
Analisis data dilakukan dengan dua metode yaitu analisis deskriptif dan analisis statistik pada selang kepercayaan 95% (alpha=0,05). Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan satu faktor dengan menggunakan statistical software IBM SPSS statistics version 17.0. Apabila berbeda nyata akan dilanjutkan dengan Duncan’s Multiple Range Test (DMRT). Analisis deskriptif digunakan untuk data kandungan oligosakarida dari prebiotik dan kelimpahan bakteri pada usus. Sedangkan analisis statistik digunakan untuk analisis data performa pertumbuhan, respon imun, dan sintasan (Lampiran 11-13).
4.
HASIL DAN PEMBAHASAN
Analisis Kandungan Oligosakarida
Komposisi ubi jalar dipengaruhi oleh waktu panen, varietas dan proses pengolahan (Marlis 2008). Ubi jalar mengandung karbohidrat tinggi yang terdiri dari monosakarida, oligosakarida, dan polisakarida. Oligosakarida dari tepung kukus ubi jalar varietas sukuh diindikasikan berpotensi sebagai prebiotik karena mengandung rafinosa dan sukrosa (Marlis 2008; Putra 2010). Pada penelitian ini, dilakukan pengujian terhadap kandungan oligosakarida fruktooligosakarida (FOS), galaktooligosakarida(GOS), dan inulin. Oligasakarida ini merupakan jenis prebiotik yang umum dipelajari pada manusia dan hewan darat. Kandungan ketiga jenis oligosakarida ini diharapkan dapat memberikan manfaat bagi kesehatan inang dan mampu menstimulir pertumbuhan bakteri probiotik. Berikut ini adalah konsentrasi FOS, GOS, dan inulin dari ekstrak ubi jalar varietas sukuh pada total padatan terlarut (TPT) 5% (Tabel 4).
Tabel 4. Analisa kandungan FOS, GOS, dan inulin dari ekstrak ubi jalar varietas sukuh (TPT 5%)
18
Parameter Unit Hasil Alat
FOS g / 100 g 1,015 HPLC
GOS g / 100 g 1,488 HPLC
Inulin g / 100 g 1,115 HPLC
Berdasarkan hasil pada Tabel 4, diketahui GOS merupakan jenis oligosakarida dengan persentase tertinggi (1,488%), diikuti dengan inulin (1,115%) dan FOS (1,0155%). GOS adalah oligosakarida yang terdiri dari molekul galaktosa dan glukosa yang diproduksi secara enzimatis oleh laktosa. Pada penelitian Hoseinifar et al. (2013), diketahui pemberian GOS dengan dosis 2% dalam pakan dapat meningkatkan performa pertumbuhan, kelangsungan hidup, dan resistensi terhadap stress salinitas, serta memodulasi mikrobiota pada usus Caspian roach (Rutilus rutilus). Sedangkan FOS merupakan salah satu jenis prebiotik yang dapat difermentasi oleh bakteri tertentu seperti kelompok
Lactobacilli dan Bifidobacteria (Manning and Gibson 2004). Pemberian FOS pada pakan diduga secara selektif dapat mendukung pertumbuhan dan kelangsungan bakteri yang menguntungkan pada saluran pencernaan inang (Ringo
et al. 2010). Pada penelitian Grisdale-Helland et al. (2008), diketahui pemberian FOS pada pakan sebesar 1% pada ikan salmon Atlantik selama 4 bulan, menunjukkan efisiensi pakan dan retensi energi, masing-masing 5% dan 6% lebih tinggi dibandingkan dengan ikan yang diberi pakan kontrol. Adapun inulin merupakan kelompok oligosakarida yang berasal dari sukrosa yang diisolasi dari sumber nabati alami. Inulin dapat dimanfaatkan sebagai sumber prebiotik yang diindikasikan mampu merangsang bakteri menguntungkan pada usus, menekan jumlah patogen, dan meningkatkan respon imun pada inang (Delgado 2010).
Kelimpahan Bakteri Usus
Hasil penghitungan kelimpahan bakteri pada usus udang meliputi Total Viable Bacterial Count (TBC), Total Presumtive Vibrio Count (TVC), dan Total
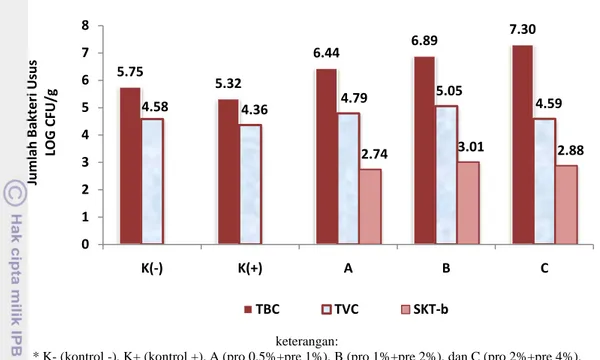
SKT-bR Count setelah 30 hari perlakuan sinbiotik dengan dosis berbeda dapat dilihat pada Gambar 4. Berdasarkan hasil penghitungan bakteri pada usus udang, diketahui bahwa perlakuan sinbiotik dosis B menunjukkan jumlah bakteri SKT-bR tertinggi yaitu sebesar 3,01 LOG CFU/g; kemudian diikuti oleh perlakuan sinbiotik dosis C sebesar 2,88 LOG CFU/g dan perlakuan sinbiotik dosis A sebesar 2,74 LOG CFU/g. Sementara itu pada kontrol tidak ditemukan bakteri SKT-bR. Hal ini mengindikasikan bahwa probiotik SKT-bR yang diberikan bersama dengan prebiotik memiliki kemampuan bertahan dan memanfaatkan prebiotik pada usus udang. Dengan demikian dari bakteri TVC yang diperoleh pada perlakuan sinbiotik, diduga 57,20 %, 59,60%, dan 62,74% dari masing-masing perlakuan A, B, dan C adalah kelompok bakteri Vibrio dari bakteri probiotik SKT-b yang diberikan.
keterangan:
* K- (kontrol -), K+ (kontrol +), A (pro 0,5%+pre 1%), B (pro 1%+pre 2%), dan C (pro 2%+pre 4%). Gambar 4. Total Viable Bacterial Count (TBC), Total Presumtive Vibrio Count
(TVC), dan Total SKT-bR Count pada usus udang vaname (Litopenaeus vannamei) yang diberi perlakuan sinbiotik dengan dosis berbeda.
Hasil penelitian menunjukkan bahwa jumlah TBC pada pada perlakuan C menghasilkan jumlah tertinggi yaitu 7,30 LOG CFU/g, kemudian diikuti oleh perlakuan B sebesar 6,89 LOG CFU/g; perlakuan A sebesar 6,44 LOG CFU/g; dan jumlah TBC terkecil terdapat pada perlakuan kontrol yaitu sebesar 5,32 LOG CFU/g dan 5,75 LOG CFU/g. Penambahan prebiotik pada pakan diduga telah menstimulir pertumbuhan bakteri menguntungkan lainnya atau mikroflora normal di dalam saluran pencernaan udang vaname selain dari bakteri probiotik yang diberikan, sehingga jumlah populasi bakteri pada perlakuan sinbiotik lebih tinggi daripada perlakuan kontrol. Hasil yang sama juga diperoleh Mahious et al. (2006), penambahan FOS dalam pakan telah meningkatkan komposisi bakteri probiotik dalam saluran pencernaan larva ikan turbot. Li et al. (2007) juga menemukan bahwa FOS secara selektif dapat mendukung pertumbuhan bakteri spesies tertentu di dalam saluran pencernaan udang vaname. Menurut Delgado et al. (2010), prebiotik dapat menghasilkan asam lemak rantai pendek (SCFA) yang menyebabkan pH usus menurun sehingga dapat menghambat pertumbuhan bakteri patogen dan menstimulasi populasi bakteri fakultatif anaerob seperti kelompok bakteri Bifidobacteria dan Lactobacilli.
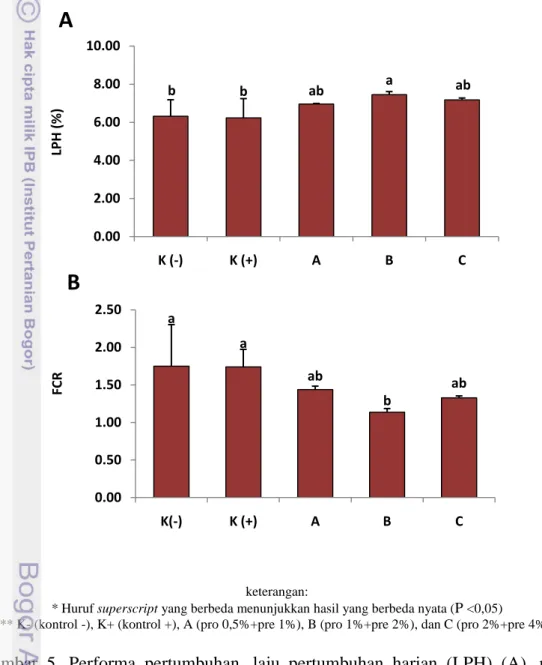
Performa Pertumbuhan
Parameter produksi budidaya selama masa pemeliharaan dengan perlakuan sinbiotik dosis berbeda dapat dilihat berdasarkan laju pertumbuhan harian (LPH) dan rasio konversi pakan (FCR) (Gambar 5). LPH dari udang vaname setelah pemberian perlakuan sinbiotik berbagai dosis (A (pro 0,5% + pre 1%), B (pro 1%
5.75 5.32 6.44 6.89 7.30 4.58 4.36 4.79 5.05 4.59 2.74 3.01 2.88 0 1 2 3 4 5 6 7 8 K(-) K(+) A B C Ju m lah B akt e ri Usu s LO G CFU /g TBC TVC SKT-b
20 b b ab a ab 0.00 2.00 4.00 6.00 8.00 10.00 K (-) K (+) A B C LP H ( % ) a a ab b ab 0.00 0.50 1.00 1.50 2.00 2.50 K(-) K (+) A B C FCR
A
B
+ Pre 2%), C (pro 2% + pre 4%)) selama 30 hari menunjukkan bahwa perlakuan sinbiotik dosis B menghasilkan nilai LPH tertinggi sebesar 7,45±0,16 dan memberikan hasil yang berbeda nyata (P<0,05) dibandingkan dengan kontrol, namun tidak berbeda nyata terhadap perlakuan sinbiotik dosis A dan dosis C (P>0,05). Sementara itu, FCR kontrol tanpa pemberian sinbiotik menghasilkan nilai sebesar 1,74±0,23 dan 1,75±0,55, lebih tinggi dari semua perlakuan dan menunjukkan nilai yang berbeda nyata terhadap perlakuan sinbiotik dosis B yaitu sebesar 1,14 ±0,05 (P<0,05).
keterangan:
* Huruf superscript yang berbeda menunjukkan hasil yang berbeda nyata (P <0,05) ** K- (kontrol -), K+ (kontrol +), A (pro 0,5%+pre 1%), B (pro 1%+pre 2%), dan C (pro 2%+pre 4%). Gambar 5. Performa pertumbuhan, laju pertumbuhan harian (LPH) (A), rasio
konversi pakan (FCR) (B), udang vaname (Litopenaeus vannamei) selama 30 hari perlakuan sinbiotik dosis berbeda (Duncan; P=0,05). Hal ini menunjukkan bahwa perlakuan pemberian sinbiotik pada pakan memberikan hasil kinerja pertumbuhan lebih baik dibandingkan dengan kontrol. Hasil serupa juga terjadi pada penelitian penambahan sinbiotik pada pakan dapat memperbaiki pertambahan bobot tubuh, laju pertumbuhan harian (LPH), dan rasio