I.
I. Judul Judul PercobaaPercobaann : Kekuatan Medan Ligan II.
II. Hari, Hari, Tanggal Tanggal PercobaaPercobaan n ::
Mulai Mulai ::Selasa, 4 Nopember 2014 Pukul 13.00 WIB
Selesai Selesai ::Selasa, 4 Nopember 2014 Pukul 16.00 WIB III.
III. Tujuan PercobaanTujuan Percobaan :
- Mempelajari perbedaan kekuatan medan ligan antara ligan ammonium dan air - Mengenal cara mncari panjang gelombang pada absorbansi maksimum - Mengenal variabel yang mempengaruhi panjang gelombang maksimum
IV.
IV. Dasar TeoriDasar Teori
Ion unsur transisi dapat mengikat molekul-molekul atau ion-ion yang memiliki pasangan elektron tak berikatan (ligan) dengan ikatan kovalen koordinasi yang membentuk ion kompleks. Ion kompleks adalah gabungan ion (atom pusat) dengan ion atau molekul lain (ligan) membentuk ion baru.
Berdasarkan ligan yang diikat oleh atom pusat dalam ion kompleks, maka ada dua macam ion kompleks:
1. Ion kompleks positif : terbentuk apabila ion logam transisi (atom pusat) berikatan dengan ligan yang merupakan molekul netral, sehingga ion
kompleks yang terbentuk bermuatan positif.
2. Ion kompleks negatif : terbentuk apabila ion logam transisi (atom pusat) berikatan dengan ligan yang merupakan ion negatif.
Teori medan kristal (Bahasa Inggris: Crystal Field Theory), disingkat CFT, adalah sebuah model yang menjelaskan struktur elektronik dari senyawa logam transisi yang semuanya dikategorikan sebagai kompleks koordinasi. CFT berhasil menjelaskan beberapa sifat-sifat magnetik, warna, entalpi hidrasi, dan struktur spinel senyawa kompleks dari logam transisi, namun ia tidak ditujukan untuk menjelaskan ikatan kimia. CFT dikembangkan oleh fisikawan yang bernama Hans Bethe dan John Hasbrouck van Vleck pada tahun 1930-an. CFT pada akhirnya digabungkan dengan teori orbital molekul, membentuk teori medan ligan yang lebih akurat dan menjelaskan proses ikatan kimia pada senyawa kompleks logam transisi (Utama, 2009).
Bentuk koordinasi ikatan yang lain adalah ikatan ligan ke logam. Hal ini terjadi apabila orbital simetri- p atau orbital pada ligan terisi. Ia bergabung dengan orbital dxy, dxz dan dyz logam, dan mendonasikan elektron-elektronnya, sehingga menghasilkan ikatan simetri- antara ligan dengan logam. Ikatan logam
-ligan menguat oleh interaksi ini, namun orbital molekul anti-ikatan dari ikatan -ligan ke logam tidak setinggi orbital molekul anti-ikatan dari ikatan Ia terisi dengan elektron yang berasal dari orbital d logam dan menjadi Homo kompleks tersebut. Oleh karena itu, Omenurun ketika ikatan ligan ke logam terjadi (Admin, 2009).
Didalam ion bebas kelima orbital d bersifat degenerate artinya mempunyai energi yang sama dan elektron dalam orbital ini selalu memenuhi hukum multiplicity yang maksimal. Teori medan kristal terutama membicarakan pengaruh dari ligand yang tersusun secara berbeda-beda disekitar ion pusat terhadap energi dari orbital d. Pembagian orbital d menjadi dua golongan yaitu orbital eg (dj) dan orbital t2g (de)
mempunyai arti penting dalam hal pengaruh ligand terhadap orbital-orbital tersebut Pemisahan energy orbital d, dipengaruhi oleh faktor-faktor berikut:
- Sifat-sifat ion logam: Keadaaan oksidasi logam. Keadaan oksidasi yang lebih besar menyebabkan pemisahan yang lebih besar
- Susunan ligan disekitar ion logam: Sifat-sifat ligan yang mengelilingi ion logam. Efek ligan yang lebih kuat akan menyebabkan perbedaan energi yang lebih besar antara orbital 3d yang berenergi tinggi dengan yang berenergi rendah. (Rian, S., 2008)
Kelima orbital d (dx2-y2, dz2, dxy, dyz dan dxz) dalam ion logam bentuk gas mempunyai tingkat energi yang sama, karenanya mempunyai kesamaan kemungkinan yang sama untuk mendapatkan elektron dalam kelima orbital tersebut.. Gambar 1 menunjukkan pendekatan teori medan kristal tentang perubahan yang terjadi pada ion logam karena suatu ligan mendekati ion logam
untuk membentuk suatu ion kompleks. Energi
Gambar 1
Gambar 1. Pemisahan tingkat energi elektron orbital d oleh medan kristal oktahedral
Dalam teori medan kristal, ligan-ligan direduksi menjadi titik yang bermuatan. Interaksi muatan-muatan titik ini dengan elektron dalam orbital d ion logam akan menaikkan energi semua orbital d, tetapi mereka tidak lagi memiliki energi yang sama. Elektron-elektron dalam orbital dz2 dan dx2-y2 akan mengalami
interaksi yang lebih besar dengan muatan-muatan ligan yang mendekatinya daripada elektron-elektron dalam orbital dxy, dxz, dyz. Pertimbangan simetri juga menghasilkan kesimpulan yang sama terhadap orbital-orbital d lainnya
Pola pemisahan tersebut berlaku untuk semua ion kompleks yang terkoordinasi secara oktahedral. o (didefi ni si kan sebagai 10 Dq ) menunjukkan perbedaan energi antara tiga orbital setingkat dxy, dyz, dxz dengan dua orbital
setingkat dx2-y2, dz2.
Spektrum oktahedral [Ti(H2O)6]3+ dengan elektron d tunggal dapat ditemukan dalam salah satu orbital dxy, dyz, dxz. Pada absorpsi suatu photon ekivalen energi dengan o, elektron dalam salah satu orbital d dengan energi lebih rendah akan dinaikkan ke orbital d dengan energi lebih tinggi dx2-y2 atau dz2. Suatu harga yang khas untuk o, perbedaan energi antara dua tingkat energi dalam gambar 1 adalah 5,8 x 104 kalori/mol (frekuensi 20.300 cm-1)
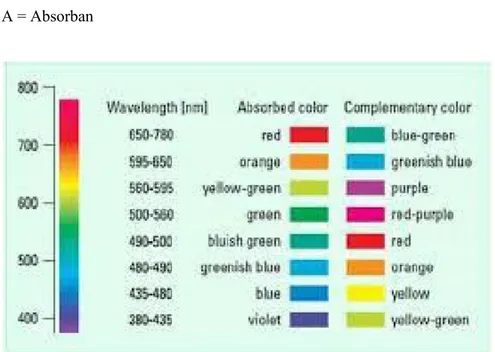
Ini sesuai dengan radiasi sebesar 6,1 x 1014 Hz atau panjang gelombang 490 nm. Besarnya 10 Dq tersebut dipengaruhi oleh jenis ion logam, bilangan oksidasi dan ligan yang terlibat. Transisi elektrinik dari tingkat energi pertama ke tingkat energi yang lain jatuh pada daerah sinar tampak atau spektrum elektromagnetik. Warna yang nampak adalah komplemen warna cahaya yang diserap, sebagai contoh kompleks [Ti(H2O)6]3+ berwarna violet berarti warna yang diserap adalah
komplemen warna violet yaitu hijau kekuningan. Hubungan antara daerah panjang gelombang yang diabsorbsi dan warna yang nampak
Ligan yang berbeda berinteraksi secara berbeda dengan orbital-orbital d ion logam pusat. o , merupakan ukuran interaksi yang dapat membedakan komplek -komplek yang berbeda dari ion logam. Sebagai contoh, telah diteliti bahwa Δo umumnya bertambah menurut urutan Cl- < H2O < NH3 < CN- , ini merupakan
ukuran spektrokimia sejumlah ligan. Jika o bertambah, absorpsi maksimum akan memiliki panjang gelombang yang lebih pendek. sesuai dengan bertambahnya energi orbital dxy, dyz atau dxz untuk menaikkannya ke orbital dx2-y2 atau dz2. Makin pendek absorpsi maksimum panjang gelombang, makin besar perbedaan energi antara tingkat energi awal dan akhir.
Harga 10 dq dipengaruhi oleh beberapa faktor, diantaranya.
1. Muatan ion logam
Makin banyak muatan ion,makin besar pula harga 10 Dq nya,karena makin banyak muatan ion logam maka makin besar pula untuk menarik ligan lebih dekat. Akibatnya pengaruh ligan makin kuat sehingga pembelahan orbital makin besar.
2. Jenis Ion pusat
Logam logam yang terletak pada satu periode, harga 10 Dq nya tidak terlalu berbeda. Untuk satu golongan, Semakin kebawah, harganya akan semakin besar.
Mn2+< Ni2+< Co2+< Fe2+< V2+< Fe3+< Co3+< Mn3+< Co3+< Rh3+< Ru3+< Pd4+< Ir 3+< Pt4+
3. Ligan
Berikut adalah deret spektrokimia.
I-< Br -< SCN-~ Cl-< F-< OH-~ NO-< C2O42-< H2O<CS-< EDTA4-< NH3~ pyr~ en<
phen < CN- ~ CO
Semakin kuat ligannya, maka 10 dq juga akan semakin besar. Jika 10 dq kecil, maka ligannya adalah ligan lemah. Ligan yang kuat dapat menggantikan ligan yang lebih lemah.
Berdasarkan banyaknya pasangan elektron yang didonorkan, ligan dapat dikelompokkan menjadi,
a. Ligan Monodentat yaitu ligan yang hanya mampu memberikan satu pasang elektron kepada satu ion logam pusat dalam senyawa koordinasi. Misalnya : ion halida, H2O dan NH3.
b. Ligan Bidentat yaitu ligan yang mempunyai dua atom donor sehingga mampu memberikan dua pasang elektron. Dalam pembentukan ikatan koordinasi, ligan bidentat akan menghasilkan struktur cincin dengan ion logamnya (sering disebut cincin kelat). Ligan bidentat dapat berupa molekul netral (seperti diamin, difosfin, disulfit) atau anion (C2O42-, SO42-, O22-).
c. Ligan Polidentat yaitu ligan-ligan yang memiliki lebih dari dua atom donor. Ligan ini dapat disebut tri, tetra, penta, atau heksadentat, bergantung pada jumlah atom donor yang ada. Ligan polidentat tidak selalu menggunakan semua atom donornya
untuk membentuk ikatan koordinasi. Misalnya : EDTA sebagai heksadentat mungkin hanya menggunakan 4 atau 5 atom donornya bergantung pada ukuran dan stereokimia kompleks.
Teori medan kristal ini hampir selama 20 tahun semenjak ditemukan hanya digunakan dalam bidang fisika zat padat. Teori medan kristal digunakan pada pakar fisika zat padat untuk menjelaskan warna dan sifat magnetik garam-garam logam transisi terhidrat,khususnya yang memiliki atom pusat ion logam transisi dengan orbital d yang belum sepenuhnya terisi elektro seperti CuSO4.5H2O. Baru pada
tahun 1950an. Pada awal tahun 1950an barulah pakar kimia koordinasi menerapkan teori medan Kristal (Sukardjo, 1992).
Kebanyakan senyawaan CuI cukup mudah teroksidasi menjadi CuII, namun oksidasi selanjutnya menjadi CuIII adalah sulit. Terdapat kimiawi larutan Cu2+ yang dikenal baik, dan sejumlah besar garam berbagai anion didapatkan, banyak diantaranya larut dalam air, menambah perbendaharaan kompleks (Syabatini, 2009).
Reaksi pembentukan senyawa kompleks dapat dirumuskan sebagai berikut :
M + nL MLn dimana,
M = ion logam
L = ligan yang mempunyai pasangan elektron bebas
n = bilangan koordinasi senyawa kompleks yang terbentuk (biasanya 2, 4, dan 6).
Spektrofotometer UV-Vis Spektrofotometer UV-Vis
Spektrofotometri UV-Vis merupakan salah satu teknik analisis spektroskopi yang memakai sumber radiasi eleltromagnetik ultraviolet dekat (190-380) dan sinar tampak (380-780) dengan memakai instrumen spektrofotometer (Mulja dan Suharman dalam Fitriani, 2012 ). Serapan cahaya oleh molekul dalam daerah spektrum ultraviolet dan visibel tergantung pada struktur elektronik dari molekul. Serapan ultraviolet dan visibel dari senyawa-senyawa organik berkaitan erat transisi-transisi diantara tingkatan-tingkatan tenaga elektronik. Disebabkan karena hal ini, maka serapan radiasi ultraviolet atau terlihat sering dikenal sebagai spektroskopi elektronik. Transisi-transisi tersebut biasanya antara orbital ikatan antara orbital ikatan atau orbital pasangan bebas dan orbital non ikatan tak jenuh atau orbital anti ikatan. Panjang gelombang serapan merupakan ukuran dari pemisahan tingkatan-tingkatan tenaga dari orbital yang bersangkutan. Spektrum ultraviolet adalah gambar antara panjang gelombang atau frekuensi serapan lawan intensitas serapan
(transmitasi atau absorbansi). Sering juga data ditunjukkan sebagai gambar grafik atau tabel yang menyatakan panjang gelombang lawan serapan molar atau log dari serapan molar, Emax atau log Emax (Sastrohamidjojo dalam Fitriani, 2012).
Penyerapan dalam rentang yang terlihat secara langsung mempengaruhi warna bahan kimia yang terlibat. Di wilayah ini dari spektrum elektromagnetik, molekul mengalami transisi elektronik. Teknik ini melengkapi fluoresensi spektroskopi, di fluoresensi berkaitan dengan transisi dari ground state ke eksited state. Penyerapan sinar uv dan sinar tampak oleh molekul, melalui 3 proses yaitu :
a) Penyerapan oleh transisi elektron ikatan dan electron anti ikatan b) Penyerapan oleh transisi electron d dan f dari molekul kompleks.
c) Penyerapan oleh perpindahan muatan.
Absorbsi radiasi oleh suatu sampel diukur pada berbagai panjang gelombangdan dialirkan oleh suatu perkam untuk menghasilkan spektrum tertentu yang khas untuk komponen yang berbeda.Absorbsi sinar oleh larutan mengikuti hukum Lambert-Beer, yaitu :
A = log ( Io / It ) = a b c Keterangan :
Io = Intensitas sinar datang
It = Intensitas sinar yang diteruskan a = Absorptivitas
b = Panjang sel/kuvet c = konsentrasi (g/l) A = Absorban
V.
V. Alat dan BahanAlat dan Bahan
1. Alat-alat - Labu ukur 10 mL - Pipet gondok 5 mL - Pipet gondok 2 mL - Gelas ukur 5 mL - Gelas kimia 100 mL - Gelas kimia 250 mL - Spektrofotometer UV-VIS - Alat-alat gelas yang lain
2. Bahan-bahan
- Larutan Ammonium 1 M - Larutan ion Cu2+
VI.
VI. Prosedur KerjaProsedur Kerja
1.
1. Aquadest/blanko
10 mL
- Diamati serapannya pada 400-600 nm menggunakan spektrofotometer UV-VIS
- Dicatat absorbansi maksimum
2. 2. 3. 3. Labu ukur 10 mL I (2 mL larutan Cu2+ 0,1 M)
- Diencerkan aquadest sampai tanda
batas
Absorbansi maksimum
- Diamati serapannya pada 600-900 nm
- Jika, absorbansi > 1 dilakukan
pengenceran hingga absorbansi maksimum 1 Larutan Cu 2+ 0,02 M Labu ukur 10 mL II (2 mL larutan Cu2+ 0,1 M)
- Diencerkan dengan 5 mL larutan
ammonium 1 M
- Ditambahkan aquadest sampai tanda
batas
Absorbansi maksimum
- Diamati serapannya pada 350-700 nm
- Jika, absorbansi > 1 dilakukan
pengenceran hingga absorbansi maksimum 1
4. 4.
5.
5. Abs. I
- Dibuat grafik masing-masing larutan
- Ditentukan panjang gelombang pada
absorbansi maksimum Hasil
Labu ukur 10 mL III (2 mL larutan
Cu2+ 0,1 M)
- Diencerkan dengan 2,5 mL larutan
ammonium 1 M
- Ditambahkan aquadest sampai tanda
batas
Absorbansi maksimum
- Diamati serapannya pada 350-700 nm
- Jika, absorbansi > 1 dilakukan
pengenceran hingga absorbansi maksimum 1
Larutan Cu+ 0,02
VII.
VII. Hasil PengamatanHasil Pengamatan
No.
No. Prosedur Prosedur Percobaan Percobaan Hasil Hasil Pengamatan Pengamatan Dugaan/Reaksi Dugaan/Reaksi KesimpulanKesimpulan
1 - Aquadest tidak berwarna
- Absorbansi = 0
Absorbansi larutan blanko adalah 0
2 - Larutan CuSO4.5H2O berwarna
biru
- Setelah diencerkan berwarna biru muda (+)
- maks = 813,4 nm
- Absorbansi = 0,207
Cu+(aq) + 6H2O(aq)
[Cu(H2O)6]2+(aq)
λ maks larutan[Cu(H2O)6]+
adalah 813,4 nm Dq = Aquadest/blanko
10 mL
- Diamati serapannya pada 400-600 nm menggunakan spektrofotometer UV-VIS
- Dicatat absorbansi maksimum
Absorbansi Maksimum
Labu ukur 10 mL I (2 mL larutan Cu2+
0,1 M)
- Diencerkan aquadest sampai tanda batas
Absorbansi maksimum
- Diamati serapannya pada 700-850 nm
- Jika, absorbansi > 1 dilakukan pengenceran hingga absorbansi
maksimum 1 Larutan Cu2+
3. - Larutan CuSO4.5H2O berwarna
biru
- Larutan ammonia tidak berwarna - Larutan Cu + ammonium berwarna
biru (++)
- Diencerkan dengan dengan aquadest berwarna biru (+) - maks = 608,8 nm
- Absorbansi = 0,959
Cu+
(aq)+ 6H2O(aq)
[Cu(H2O)6]2+(aq)
[Cu(H2O)6]2+(aq)+ 3NH3(aq)
[Cu(H2O)3 (NH3)3]2+(aq)
λ maks larutan[Cu(H2O)3
(NH3)2]2+ adalah 608,8 nm
Dq = Labu ukur 10 mL II
(2 mL larutan Cu2+
0,1 M)
- Diencerkan dengan 5 mL larutan ammonium 1 M
- Ditambahkan aquadest sampai tanda batas
Absorbansi maksimum
- Diamatiserapannya pada 350-700 nm
- Jika, absorbansi > 1 dilakukan pengenceran hingga absorbansi
maksimum 1 Larutan Cu2+
4 - Larutan CuSO4.5H2O berwarna
biru
- Larutan ammonia tidak berwarna - Larutan Cu + ammonium berwarna
biru (++)
- Diencerkan dengan dengan aquadest berwarna biru (+) - maks = 612,4 nm
- Absorbansi = 0,912
Cu+
(aq)+ 6H2O(aq)
[Cu(H2O)6]2+(aq)
[Cu(H2O)6]2+(aq)+ 2NH3(aq)
[Cu(H2O)4 (NH3)2]2+(aq)
λ maks larutan[Cu(H2O)3
(NH3)2]2+ adalah 612,4 nm
Dq =
5 No.
tabung λ maks absorbansi 1 813,4 nm 0,207 2 608,8 nm 0,959 3 612,4 nm 0,912
Semakin banyak mengandung ligan NH3maka maks
semakin kecil. Labu ukur 10 mL
III (2 mL larutan Cu2+
0,1 M)
- Diencerkan dengan 2,5 mL larutan ammonium 1 M
- Ditambahkan aquadest sampai tanda batas
Absorbansi maksimum
- Diamati serapannya pada 350-700 nm
- Jika, absorbansi > 1 dilakukan pengenceran hingga absorbansi
maksimum 1 Larutan Cu2+
0,02
- Dibuat grafik masing-masing larutan - Ditentukan panjang gelombang pada
absorbansi maksimum Hasil
VIII.
VIII.Analisis dan PembahasanAnalisis dan Pembahasan
Percobaan yang telah kami lakukan berjudul kekuatan medan ligan yang bertujuan untuk mengetahui perbedaan kekuatan medan ligan antara ligan ammonium dan air, mengetahui panjang gelombang pada absorbansi maksimum serta mengetahui faktor-faktor yang mempengaruhi panjang gelombang maksimum.
Pada percobaan ini digunakan 3 larutan yang akan diukur absorbansinya pada spektrofotometer UV-Vis. Ammonium dan air bertindak sebagai ligan sedangkan Cu bertindak sebagai atom pusat. Absorbansi pada panjang glombang maksimum akan dipengaruhi oleh banyaknya ligan yang disubtitusi serta kekuatan medan ligan yang ditimbulkan oleh ligan tersebut. Pengukuran pada panjang gelombang yang berbeda-bda sesuai warna yang dibentuk dengan warna komplemennya. Pengamatan terhadap serapan kompleks dapat digunakan untuk menentukan harga 10 Dq. Nilai maksimum yang didapat disubstitusikan ke dalam persamaan:
Menurut teori medan kristal, orbital d yang terurai oleh ligan disebut splitting. Dengan perbedaan tingkat energi sebesar 10 Dq. Adanya perbedaan tingkat energi yang menyebabkan terjadinya perbedaan warna kompleks.
Semakin kuat ligannya maka 10 Dq juga akan semakin besar. Ligan yang kuat dapat mnggantikan ligan yang lemah. Kekuatan ligan digambarkan dalam deret spektrokimia dimana ammonium lebih kuat dibanding air, sehinggan akan diperoleh 10 Dq yang lebih besar.
Larutan blanko yaitu akuades yang diukur absorbansinya pada panjang gelombang 400-600 nm. Didapatkan absorbansi maksimumnya adalah 0 karena merupakan larutan pembanding.
Larutan pertama yang digunakan adalah larutan Cu2+ 0,02 M. Sebanyak 2 ml larutan Cu2+ berwarna biru dimasukkan ke dalam labu ukur 100 ml kemudian ditambahkan akuades sampai tanda batas menjadi larutan berwarna biru. Volume akuades yang digunakan dalam proses pengnceran berkaitan dengan banyaknya ligan yang akan disubtitusi oleh logam Cu. Larutan yang terbentuk adalah senyawa kompleks [Cu(H2O)6]2+
sesuai persamaan reaksi berikut:
Cu2+(aq)+ 6H2O(aq) [Cu(H2O)6]2+(aq)
Logam Cu bertindak sebagai atom pusat dan air sebagai ligan. Hibridaisasi senyawa kompleks tersebut menurut VBT (Valence Bond Theory) dengan 6 ligan H2O adalah sp3d2.
Larutan ini diamati serapannya pada panjang gelombang 600-900. Panjang gelombang ini ada pada rentang warna radiasi elektromagnetik yang diserap yaitu merah. Didapatkan panjang gelombang maksimum pada 813,4 nm dengan absorbansi 0,207. Hasil ini sesuai dengan teori dimana komplemen warna biru-hijau ada pada panjang gelombang 610-800 nm. Harga 10 Dq yang didapatkan adalah . Dalam deret spektokimia H2O termasuk ligan yang lebih lemah dibanding NH3 sehingga menghasilkan
10 Dq yang kecil.
Larutan kedua berisi 2 ml larutan Cu2+ ditambahkan 5 ml larutan ammonium 1M berwarna biru (++) kemudian ditambahkan air sampai tanda batas pada labu ukur 100 ml menjadi berwarna biru (+). Perbandingan volume ini berkaitan dengan banyaknya ligan yang disubtitusi oleh logam Cu. Larutan yang terbentuk larutan [Cu(H2O)3 (NH3)2]2+.
Dimana Cu bertindak sebagai atom pusat sedangkan NH3 dan H2O bertindak sebagai ligan.
Persamaan reaksi yang terjadi:
[Cu(H2O)6]2+(aq)+ 3NH3(aq) [Cu(H2O)3 (NH3)3]2+(aq)
Hibridaisasi senyawa kompleks tersebut menurut VBT (Valence Bond Theory) dengan 6 ligan H2O adalah sp3d2.
Larutan ini diamati serapannya pada panjang gelombang 500-800. Panjang gelombang ini sesuai dengan warna radiasi elektromagnetik yang diserap yaitu jingga. Didapatkan panjang gelombang maksimum pada 608,8 nm dengan absorbansi 0,959. Hasil ini sesuai dengan teori komplemen warna biru kehijauan ada pada panjang gelombang 595-650 nm. Harga 10 Dq yang didapatkan adalah. . Harga 10 Dq yang didapatkan lebih besar dibandingkan larutan pertama karena adanya penambahan NH3.
Dimana NH3 adalah ligan yang lebih kuat dibandingkan air sehingga ia mampu
menggantikan H2O. Splitting yang terjadi akan lebih lebar karena pengaruh NH3.
Larutan ketiga berisi 2 ml larutan Cu2+ ditambahkan 2,5 ml larutan ammonium 1M berwarna biru (++) kemudian ditambahkan air sampai tanda batas pada labu ukur 100 ml menjadi berwarna biru (+). Perbandingan volume ini berkaitan dengan banyaknya ligan yang disubtitusi oleh logam Cu. Larutan yang terbentuk larutan [Cu(H2O)3 (NH3)2]2+.
Dimana Cu bertindak sebagai atom pusat sedangkan NH3 dan H2O bertindak sebagai ligan.
Persamaan reaksi yang terjadi:
[Cu(H2O)6]2+(aq)+ 2NH3(aq) [Cu(H2O)4 (NH3)2]2+(aq)
Hibridaisasi senyawa kompleks tersebut menurut VBT (Valence Bond Theory) dengan 6 ligan H2O adalah sp3d2.
Larutan ini diamati serapannya pada panjang gelombang 500-800. Panjang gelombang ini sesuai dengan warna radiasi elektromagnetik yang diserap yaitu jingga. Didapatkan panjang gelombang maksimum pada 612,4 nm dengan absorbansi 0,912. Hasil ini sesuai dengan teori komplemen warna biru kehijauan ada pada panjang gelombang 595-650 nm. Harga 10 Dq yang didapatkan adalah. . Harga 10 Dq yang
didapatkan lebih besar dibandingkan larutan kedua karena adanya perbedaan penambahan NH3.
Dimana semakin banyak NH3 yang ditambahkan maka panjang gelombangnya
semakin kecil. Karena panjang gelombang berbanding terbalik dengan frekuensi. Penambahan NH3 menyebabkan larutan berwarna biru (++) sehingga frekuensinya
semakin besar yang akan mempengaruhi harga Dq. Harga Dq pada larutan ketiga juga lebih kecil karena penambahan NH3 yang lebih sedikit sehingga banyaknya NH3 yang
menggantikan posisi ligan air lebih sedikit dibanding larutan 2.
Pada percobaan diatas harga Dq paling besar adalah pada larutan 2 > larutan 3 > larutan 1. Perbedaan harga Dq ini berkaitan dengan penambahan NH3. Penambahan NH3
menyebabkan larutan berwarna biru yang berarti penyerapan panjang gelombangnya berada pada panjang gelombang lebih rendah. Karena menyerap warna komplemennya. NH3 merupakan ligan yang lebih kuat dibandingkan H2O.
IX.
IX. KesimpulanKesimpulan
Berdasarkan prcobaan yang telah dilakukan dapat disimpulkan
Kekuatan medan ligan yang ditimbulkan ligan NH3 lebih kuat dibandingkan H2O.
Hal ini dibuktikan dengan harga Dq yang lebih besar pada larutan 2 dan 3 dibandingkan larutan 1 yang hanya mengandung ligan H2O.
Panjang gelombang maksimum pada larutan 1 sebesar 813,4, larutan 2 sebesar 608,8, larutan 3 sebesar 612,4.
Panjang gelombang maksimum yang didapatkan pada larutan 1, 2, dan 3 dipengaruhi oleh kekuatan ligan dan banyaknya ligan yang disubstitusikan.
X.
X. Daftar PustakaDaftar Pustaka
Anas, dkk. 2013.Spektrofotometer Ultraviolet-Visible.
https://www.academia.edu/5501159/UV-Vis. (diakses pada 9 november 2014)
Anonim. Tanpa Tahun.CHM401.
http://bilbo.chm.uri.edu/CHM401/CrystalFieldTheory.html. (diakses pada 9 november 2014)
Fitriana. 2012. Bab II Tinjauan Pustaka.
http://digilib.ump.ac.id/files/disk1/14/jhptump-a-fitriyani-662-2-babii.pdf. (diakses pada 9 november 2014)
Hanif. 2012. Kekuatan Ligan Amonia dan Air pada Kompleks Ni(II) dan Cu(II). http://hanifkimia.files.wordpress.com/2012/04/modul-p-anor.pdf. (diakses pada 7 november 2014).
Wahyuni, Endang Tri, 2007, Handout Analisis Instrumental I, “Spectrophotometer
UV-Vis”.
Tim Dosen Kimia Anorganik.2012.Penuntun Praktikum Kimia Anorganik II. Surabaya : Jurusan Kimia Unesa.
Vogel, 1990, Analisis Anorganik Kualitatif Makro dan Semimikro, Jilid 2, Cetakan ke 2. Jakarta: Kalman Media Pusaka.
XI.
XI. Jawaban PertanyaanJawaban Pertanyaan
Pertanya
Pertanyaan dan an dan JawabanJawaban
1. Jelaskan perbedaan kekuatan medan ligan antara ligan ammonium dan air!
Jawab: Jawab:
Ligan air memiliki energi 40,85 kkal/mol yang lebih rendah daripada amonia, yaitu 46,87 kkal/mol. Hal ini disebabkan oleh ligan H2O yang bersifat sebagai ligan
lemah. Ligan lemah dalam kompleks menyebabkan elektron memiliki spin tinggi (high spin) pada tingkat energi eg, karena pada ion Cu(II) elektron di orbital d lebih
mudah ditempatkan pada arah energi orbital yang lebih tinggi sebagai elektron
sunyi (tidak berpasangan) daripada ditempatkan pada kamar orbital yang sama, namun sebagai elektron berpasangan. Sebab pada kamar yang sama akan terjadi gaya tolak menolak antara dua elektron jika akan berpasangan. Oleh karena energi untuk tolak menolak (P) lebih besar daripada harga 10 Dq, justru ada interaksi tingkat energi atas dengan energi bawah menyebabkan jarak t2g dan eg menjadi
lebih pendek sehingga energi 10 Dq menjadi lebih kecil.
2. Tuliskan reaksi yang terjadi dalam percobaan tersebut
Jawab: Jawab:
[Cu(H2O)6]2+ + 4NH3 [Cu(H2O)3(NH3)3] 2++ H2O
3. Faktor-faktor apakah yang mempengaruhi warna ion kompleks logam transisi!
Jawab: Jawab:
Warna-warna cerah yang terlihat pada kebanyakan senyawa koordinasi dapat dijelaskan dengan teori medan kristal ini. Jika orbital-d dari sebuah kompleks berpisah menjadi dua kelompok seperti yang dijelaskan di atas, maka ketika molekul tersebut menyerap foton dari cahaya tampak, satu atau lebih elektron yang berada dalam orbital tersebut akan meloncat dari orbital-d yang berenergi lebih rendah ke orbital-d yang berenergi lebih tinggi, menghasilkan keadaam atom yang tereksitasi. Perbedaan energi antara atom yang berada dalam keadaan dasar dengan yang berada dalam keadaan tereksitasi sama dengan energi foton yang diserap dan berbanding terbalik dengan gelombang cahaya. Karena hanya gelombang-gelombang cahaya ( ) tertentu saja yang dapat diserap (gelombang yang memiliki energi sama dengan energi eksitasi), senyawa-senyawa tersebut akan memperlihatkan warna komplementer (gelombang cahaya yang tidak terserap). Seperti yang dijelaskan di atas, ligan-ligan yang berbeda akan menghasilkan medan kristal yang energinya berbeda-beda pula, sehingga kita bisa melihat warna-warna yang bervariasi. Untuk sebuah ion logam, medan ligan yang lebih lemah akan membentuk kompleks yang Δ-nya bernilai rendah, sehingga akan menyerap cahaya dengan yang lebih panjang dan merendahkan frekuensi Sebaliknya medan ligan yang lebih kuat akan menghasilkan yang lebih besar, menyerap yang lebih pendek, dan meningkatkan ν
4. Gambarlah grafik panjang gelombang terhadap absorbansi dari masing-masing pengamatan anda! Jawab: Jawab: y = -0.0036x + 3.1304 y = -0.0036x + 3.1304 R² = 0.9984 R² = 0.9984 0 0 0.2 0.2 0.4 0.4 0.6 0.6 0.8 0.8 1 1 1.2 1.2 0 0 220000 440000 660000 880000 11000000 a b s o r b a n s i panjang gelombang panjang gelombang
absorbansi Vs panjang gelombang
absorbansi Vs panjang gelombang
5. Hitunglah besar energi 10 Dq ketiga larutan tersebut (gunakan persamaan 1, lihatlah contoh perhitungan energi kompleks Ti)!
Besarnya energy 10Dq:
1. Labu ukur I larutan Cu2+ 0,02 M
2. Labu ukur II larutan [Cu(H2O)3 (NH3)2]2+
3. Labu ukur III larutan [Cu(H2O)3 (NH3)2]2+
6. Dari hasil percobaan, apa yang dapat anda simpulkan?
Jawab Jawab
Kekuatan medan ligan yang ditimbulkan ligan NH3 lebih kuat dibandingkan H2O. Hal ini dibuktikan dengan harga Dq yang lebih besar pada larutan 2 dan 3 dibandingkan larutan 1 yang hanya mengandung ligan NH3.
Panjang gelombang maksimum pada larutan 1 sebesar 813,4, larutan 2 sebesar 608,8, larutan 3 sebesar 612,4.
Panjang gelombang maksimum yang didapatkan pada larutan 1, 2, dan 3 dipngaruhi oleh kkuatan ligan dan banyaknya ligan yang disubstitusikan.
XII.
XII. PerhitunganPerhitungan
Besarnya energy 10Dq:
4. Labu ukur I larutan Cu2+ 0,02 M
5. Labu ukur II larutan [Cu(H2O)3 (NH3)2]2+
6. Labu ukur III larutan [Cu(H2O)3 (NH3)2]2+