KAJIAN APLIKASI BAKTERI Nitrosomonas sp. PADA TEKNIK BIOFILTER
UNTUK PENGHILANGAN EMISI GAS AMONIAK
Oleh :
PUJI RAHMAWATI NURCAHYANI
F03400038
2006
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
Puji Rahmawati Nurcahyani (F03400038). Study of Application of Nitrosomonas sp. at Biofilter Technique for Removing Ammonia Gaseous Emissions. Supervised by : Mulyorini Rahayuningsih dan Mohamad Yani.
SUMMARY
Air is the main requirement of live for all living being. Air pollution cause by presence of pollutant in the environment from industrial activities, one of them is condensed latex processing industry using ammonia. The air pollution control can be done with chemical-physical methods which is relatively higher cost and biological method using bacteria to degrade the pollutant. Biofilter technique represent one of those methods. Biofilter is a reactor with solid material as packing material in which microbes are attached naturally, forming biolayer (thin layer) to reduce polutant gases.
The aim of the research is to determine the type of packing material for application of ammonia gaseous emission, determining capacities of absorption and estimated kinetics of biofilter during the time operated.
The type of packing material that used are coral, activated carbon, compost and soil. The gas source is condensation of NH4OH with certain thinning. The
thinning function to determine ammonia concentration to be added at the time of biofilter operated. The column is made from the polivinyl chloride (PVC) pipe with height of 60 cm and diameter of 15.24 cm.
The bacteria that inoculated is nitrifying bacteria, Nitrosomonas sp.. Conditioning the bacterium has done before its application in the biofilter, by giving nutrient with the change of colour as the indicator. The data is analyzed by descriptive analysis methods for the removal gaseous capacity, the growth rate of microorganism and nitrat forming. Those parameters is measured to determine the best conditions of removal gas emission.
The characteristic of material packing examination got a highest water content is soil, activated carbon, compost and coral that is 33.12 %, 32.35 %, 18.86 %, 27.74 %. Respectively, the density of each material is 206.10 kg-dried koral/m3, 153.66 kg-dried activated carbon/m3, 373.17 kg-dried soil/m3, 403.66 kg-dried compost/m3. Respectively, the organic nitrogen content of each material
content is 27.74 %, 33.12 %, 32.35 % and 28.86 %. The pH value of each packing material is neutral, but there is addition dolomite at activated carbon to stable pH value.
The absoption capacities of coral and activated carbon are 0.53 g-N/kg-dried coral/day and 0.41 g-N/kg-g-N/kg-dried activated carbon/day. Biofilter soil and compost has absorption capacities are 1.16 N/kdried soil/day and 0.59 g-N/kg-dried compost/day. During application periode, each material packing increasing pH value, decreasing the nitrifying bacteria number and nitrat forming. Water content range is between 20-40 %, the range of temperature around biofilter is 28 – 31 oC.
Kinetics of biofilter operated has Vm at coral, activated carbon, soil and compost is 0.0015 g-N/kg-dried coral/hour, 0.028 g-N/kg-dried activated carbon/hour, 0.012 g-N/kg-dried soil/hour, 0.012 g-N/kg-dried compost/hour. The Ks value of each biofilter is 4.31 ppm, 6.34 ppm, 36.6 ppm and 23.09 ppm.
The best biofilter performance that operated is soil biofilter because showing highest removal capacity, that is 1.16 g-N/kg-dried soil/day.
Demikianlah sosok pahlawan yang menjadikan tanggungjawab sebagai energi pendorongnya, pengorbanan sebagai hakikat dan tabiatnya, keberanian jiwa sebagai
perisainya. Kesabaran sebagai nafas panjangnya.
Seorang pahlawan boleh salah, boleh gagal, boleh tertimpa musibah. Akan tetapi, dia tidak boleh kalah. Dia tidak boleh menyerah kepada kelemahannya, dia tidak
boleh menyerah kepada tantangannya, dia tidak boleh menyerah kepada keterbatasannya. Dia harus tetap melawan, menembus gelap, supaya dia bisa menjemput fajar. Sebab, kepahlawanan adalah piala yang direbut, bukan
kado yang dihadiahkan.
Dalam tradisi perlawanan, taruhannya adalah keberanian. Disini, taruhannya adalah kearifan. Tapi dalam dua-duanya ada kesunyian. Disana kamu melawan dalam sunyi, disini kamu bekerja dalam sunyi. Disana kamu berdarah-darah sendiri,
disini kamu menguras semua energi jiwamu. Memeras serat-serat pikiranmu. Sendiri. Ketika orang tertidur kamu terbangun itulah susahnya. Ketika orang
merampas kamu membagi itulah peliknya. Ketika orang menikmati kamu menciptakan itulah rumitnya. Ketika orang mengadu kamu bertanggungjawab itulah
repotnya. Makanya tidak banyak orang bersamamu disini, mendirikan imperium kebenaran.
(anis matta)
.... Sahabat, Semoga Allah mencintaimu karena kau
mencintaiku karena-Nya....
KAJIAN APLIKASI BAKTERI Nitrosomonas sp. PADA TEKNIK BIOFILTER UNTUK PENGHILANGAN EMISI GAS AMONIAK
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
PUJI RAHMAWATI NURCAHYANI F03400038
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
KAJIAN APLIKASI BAKTERI Nitrosomonas sp. PADA TEKNIK BIOFILTER UNTUK PENGHILANGAN EMISI GAS AMONIAK
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
PUJI RAHMAWATI NURCAHYANI F03400038
Lahir di Tuban, 17 Februari 1982 Tanggal Lulus : 6 maret 2006
Menyetujui Bogor, 10 Maret 2006
DAFTAR ISI
halaman
DAFTAR ISI ... ii
DAFTAR TABEL ... iii
DAFTAR GAMBAR... iv
DAFTAR LAMPIRAN... vi
I. PENDAHULUAN ... 1
A. LATAR BELAKANG... 1
B. TUJUAN ... 3
II. TINJAUAN PUSTAKA... 4
A. GAS AMONIAK ... 4
B. BAKTERI PENGOKSIDASI AMONIAK ... 6
C. BIOFILTER... 10
D. BAHAN PENGISI BIOFILTER ... 11
E. KORAL... 13
F. ARANG AKTIF... 15
G. KOMPOS ... 16
H. TANAH ... 17
III. METODE PENELITIAN ... 19
A. BAHAN DAN ALAT ... 19
B. METODE PENELITIAN ... 19
IV. HASIL DAN PEMBAHASAN... 28
A. KARAKTERISTIK BAHAN PENGISI ... 28
B. BIOFILTER KORAL ... 29
C. BIOFILTER ARANG AKTIF... 37
D. BIOFILTER TANAH... 44
E. BIOFILTER KOMPOS ... 51
F. PEMBAHASAN UMUM ... 58
V. KESIMPULAN DAN SARAN ... 62
A. KESIMPULAN ... 62
B. SARAN... 62
DAFTAR PUSTAKA... 64
DAFTAR TABEL
Halaman
Tabel 1. Beberapa kegiatan yang menghasilkan polutan amoniak ... 3
Tabel 2. Daftar bakteri pengoksidasi senyawaan nitrogen ... 10
Tabel 3 . Beberapa bahan pengisi biofilter yang pernah diaplikasikan ... 12
Tabel 4. Ringkasan ciri-ciri penting bahan pengisi biofilter yang biasa digunakan
13
Tabel 5. Komposisi media pertumbuhan
Nitrosomonas
sp ... 21
Tabel 6. Karakteristik bahan pengisi yang digunakan ... 28
Tabel 7. Kapasitas penyerapan beberapa polutan gas pada beberapa jenis bahan
pengisi biofilter... 60
Tabel 8. Nilai kinetika beberapa jenis bahan pengisi biofilter. ... 60
Tabel 9. Nilai kinerja biofilter untuk penghilangan polutan NH
3... 61
DAFTAR GAMBAR
Halaman
Gambar 1.
Diagram Reaksi Unsur Nitrogen... 4
Gambar 2.
Bakteri
Nitrosomonas
sp. dengan perbesaran 39 000 x (Suwa,
1995,
http://biology.kenyon.edu
... 7
Gambar 3.
Tahapan propagasi
Nitrosomonas
sp... 20
Gambar 4.
Grafik hubungan beban (x) dan kapasitas penyerapan (y)
untuk menentukankapasitas penyerapan bahan. ... 24
Gambar 5.
Model kolom biofilter skala laboratorium...
26
Gambar 6.
Perubahan penyerapan gas NH
3oleh biofilter dengan
bahan pengisi koral dinokulasi dengan
Nitrosomonas
sp. ...
31
Gambar 7.
Kapasitas penyerapan biofilter koral terhadap beban... 32
Gambar 8.
Analisa kinetika biofilter dengan bahan pengisi koral
dinokulasi dengan
Nitrosomonas
sp………... 33
Gambar 9.
Perubahan jumlah sel bakteri pengoksidasi NH
3selama
pengoperasian biofilter koral ………. 36
Gambar 10.
Perubahan penyerapan gas NH
3oleh biofilter dengan
bahan pengisi arangaktif diinokulasi dengan
Nitrosomonas
sp……. 39
Gambar 11.
Kapasitas penyerapan biofilter arang aktif terhadap beban... 40
Gambar 12.
Analisa kinetika biofilter dengan bahan pengisi arang aktif
dinokulasi dengan
Nitrosomonas
sp………... 41
Gambar 13.
Perubahan jumlah sel bakteri pengoksidasi NH
3selama
pengoperasian biofilter arang aktif ……… 43
Gambar 14.
Perubahan penyerapan gas NH
3oleh biofilter dengan bahan
pengisi tanah diinokulasi dengan
Nitrosomonas
sp………
45
Gambar 15.
Kapasitas penyerapan biofilter tanah terhadap beban... 46
Gambar 16.
Perubahan konsentrasi inlet-outlet selama kinetika biofilter
dengan bahan pengisi tanah dinokulasi dengan
Nitrosomonas
sp...
47
Gambar 17.
Analisis kinetika penghilangan NH
3biofilter berbahan
pengisi tanah dengan diinokulasi oleh
Nitrosomonas
sp………
48
Gambar 18.
Perubahan jumlah sel bakteri pengoksidasi NH
3selama
pengoperasian biofilter tanah ……… 49
Gambar 19.
Perubahan penyerapan gas NH
3oleh biofilter dengan bahan pengisi
kompos diinokulasi dengan
Nitrosomonas
sp……… 52
Gambar 20.
Kapasitas penyerapan biofilter kompos terhadap beban... 53
Gambar 21.
Perubahan konsentrasi inlet-outlet selama kinetika biofilter dengan
bahan pengisi kompos dinokulasi dengan
Nitrosomonas
sp……….
54
Gambar 22.
Analisis kinetika penghilangan NH
3biofilter berbahan pengisi
kompos dengan diinokulasi oleh
Nitrosomonas
sp……… 55
Gambar 23.
Perubahan jumlah sel bakteri pengoksidasi NH
3selama
pengoperasian biofilter kompos ……… 56
Gambar 24.
Mekanisme biofiltrasi dalam kolom………... 58
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Metode Analisis Gas NH
3... 69
Lampiran 2. Metode Analisis Proksimat ... 70
Lampiran 3. Metode Pengukuran Nitrat ... 72
Lampiran 4. Metode
Total Plate Count
untuk Sel Bakteri Heterotrof ... 73
Lampiran 5. Metode
Most Probable Number
untuk Sel
Nitrosomonas
sp. ... 74
Lampiran 6. Biofilter yang dioperasikan ... 75
Lampiran 7. Kurva Standar NH
3... 76
Lampiran 8. Data Inlet – outlet Biofilter Kolom Koral ... 77
Lampiran 9. Data Inlet – Outlet Biofilter Kolom Arang Aktif ... 79
Lampiran 10. Data Inlet – Outlet Biofilter Kolom Tanah ... 83
Lampiran 11. Data Inlet – Outlet Biofilter Kolom Kompos ... 87
Lampiran 12. Data Beban dan Penyerapan Biofilter Kolom Koral ... 91
Lampiran 13. Data Beban dan Penyerapan Biofilter Kolom Arang aktif ... 93
Lampiran 14. Data Beban dan Penyerapan Biofilter Kolom Tanah ... 97
I. PENDAHULUAN
A. LATAR BELAKANG
Pencemaran udara merupakan faktor yang sangat penting untuk diperhatikan. Kualitas udara yang melebihi baku mutu emisi yang ditetapkan akan menyebabkan kerusakan lingkungan. Kebutuhan akan udara bersih tidak saja untuk manusia tetapi juga hewan dan tumbuhan. Semakin banyak polutan berbahaya akan menyebabkan keseimbangan lingkungan terganggu. Akumulasi dapat terjadi secara berangsur seperti halnya yang terjadi pada polutan industri.
Amoniak merupakan gas yang sangat berbau, sangat mudah terbang sehingga sangat mengganggu pernafasan dan menyebabkan perih di mata. Ketika amoniak ini teroksidasi menjadi nitrit akan bersifat toksik dan dapat menyebabkan keracunan. Agroindustri yang menghasilkan polutan ini antara lain industri pengolahan lateks pekat dapat dilihat pada Tabel 1. Indriasari (2005) mengungkapkan bahwa konsentrasi polutan di gudang leum berkisar antara 12 -100 ppm. Cho et al., (2000) menambahkan hal ini dapat
menyebabkan gangguan pada kesehatan baik bagi pekerja maupun penduduk sekitar, sebab emisi gas penyebab bau ini tidak berwarna namun bersifat sangat korosif terhadap logam.
Beberapa metode telah dikaji sebagai upaya pengendalian pencemaran udara. Metode pengendalian secara fisik dan kimia antara lain : kondensasi, insinerasi, adsorbsi, absorbsi dan sistem membran. Metode fisik-kimia memiliki berbagai kelemahan, yaitu gas tidak musnah sempurna, tetapi justru memberi dampak lain dengan adanya residu maupun senyawa gas lain yang dapat membahayakan lingkungan. Dalam hal ini dilakukan pengkajian terhadap penggunaan agen biologis untuk mendegradasi polutan sehingga gas dapat dibuang ke lingkungan tanpa ada efek samping. Perlakuan gas secara biologi memanfaatkan kemampuan mikroorganisme yang dapat mengubah senyawa kompleks menjadi senyawa lebih sederhana (Devinny et al., 1999).
Penanganan polusi gas yang berbau secara biologis terbagi atas dua metode yaitu: sistem gas-padatan dan sistem gas-cairan. Metode yang menggunakan tabung sebagai alat penghilang gas merupakan salah satu bentuk sistem gas-padatan yang memiliki biaya yang lebih efisien. Biofilter merupakan salah satu metode yang digunakan untuk penghilangan gas berbau secara biologis. Cara lainnya adalah dengan menggunakan metode
bioscrubber dan metode biotrickling filter (Hirai et al., 2001, Ottengraf,
1987).
Biofilter merupakan teknologi yang sedang dikembangkan untuk pengendalian pencemaran udara. Industri yang menghasilkan polutan berbahaya dapat menerapkan teknologi ini dengan berbagai keuntungan terutama biaya investasi dan pemeliharaan yang rendah, operasi stabil pada jangka waktu yang lama, dan tidak menimbulkan polusi baru dibandingkan dengan metoda fisik-kimia. Dari tiga metode biologi, bioscrubber, trickling filter dan biofilter, biofilter merupakan pilihan yang terbaik.
Tabel 1. Beberapa kegiatan yang menghasilkan polutan amoniak
Kegiatan penghasil NH3 Sumber polutan NH3 Konsentrasi Referensi 1. Industri pertanian : a. Industri pupuk b. Industri pengolahan karet alam c. Industri kayu 2. Industri kimia : a. Industri amoniak 3. Wisata bahari : a. Pantai karnaval b. Perairan c. Biota akuatik 4. IPAL 5. Tempat pembuangan akhir (TPA) 6. Reaksi biokimia - Proses produksi - Emisi gudang leum - Pembersihan kayu
- Ledakan di unit amoniak pabrik
- Limbah industri - Peristiwa pasang merah - Aktivitas metabolisme ikan mas dengan berat 30 gram
pada suhu 16-25 oC
- Buangan limbah cair pabrik - Proses pengomposan - Fertilizer ammoniator
- Substrat urea dengan menggunakan enzim proteinase
Urea + H2O CO2 + 2NH3 - 12-100 ppm 2.48 ppm - 0.60 mg/l 1.06 mg/l 10-20 mg/hari - - 4 lb/ton - PT. Pupuk iskandar muda Indriasari et al., 2005 Lembaga kajian ekologi dan konservasi lahan basah, 2005 Kompas, 5 Februari 2006 Kompas, 11 Mei 2004 Kompas, 13 Mei 2004 - - Kompas, 31 Agustus 2003 Fogiel et al., 1978 Paul et al., 1989 B. TUJUAN
Tujuan penelitian ini adalah :
1. Menentukan jenis bahan pengisi terbaik untuk diaplikasikan pada biofilter dengan gas amoniak sebagai polutan
2. Menentukan kapasitas penyerapan bahan pengisi biofilter selama waktu operasi
II. TINJAUAN PUSTAKA
A. GAS AMONIAK
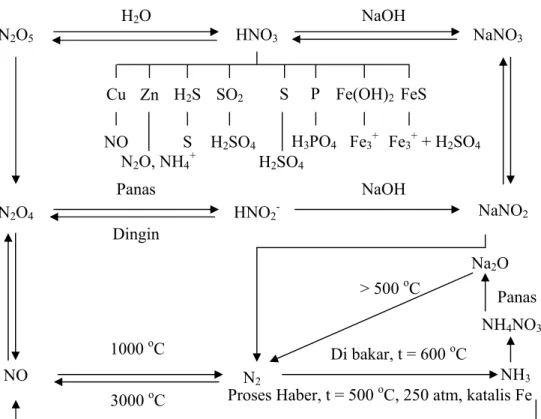
Komponen utama siklus nitrogen adalah unsur nitrogen di udara. NO2
didapatkan jika udara berinteraksi dengan oksigen. Nitrogen akan bereaksi dengan oksigen pada suhu 1000 oC dan tekanan tinggi, elektron akan saling berinteraksi sebagai sebuah ikatan dan kemudian terjadi reaksi oksidasi dengan tingkat energi tertentu. Pada kondisi tersebut maka terbentuklah NO dan NO2. Jika NO2 bereaksi dengan air hujan maka terbetuklah HNO3. Nitrat
yang terbentuk akan digunakan tanaman sebagai cadangan makanan pembentuk energi.
N2 (g) + O2 (g) Ù 2 NO (g)
Pada suhu 3000 oC dalam kesetimbangan hanya terdapat 5% gas NO.
Gas NO terbentuk juga di atmosfer pada waktu terjadi loncatan bunga api listrik (kilat).
Proses pengikatan nitrogen dari udara disebut fiksasi nitrogen. Tanaman jenis polong-polongan seperti semanggi, alfalfa, dan kacang kedelai membentuk bintil-bintil pada akar sehingga bakteri pengikat nitrogen dapat mengikat nitrogen dari udara dan dikonversi menjadi amoniak (NH3). NH3
dapat dikonversi lagi menjadi ion NO2 dan dikonversi lebih lanjut menjadi
NO3. Tanaman menggunakan ion nitrat sebagai nutrien pertumbuhan.
Nitrogen terdapat dalam asam amino yang akan bereaksi lebih lanjut membentuk protein.
Amoniak terbentuk selama proses yang disebut Proses Haber-Bosch.
Nitrogen dan hidrogen bereaksi pada kondisi tekanan (200-300 atm) dan temperatur tinggi (550 oC) yang disertai katalis reaksi (Fe diberi promotor). Promotor digunakan untuk meningkatkan keaktifan katalis. Reaksi pembuatan NH3 secara ekonomis, faktor-faktor tekanan, suhu dan konversinya
bervariasi, bergantung jenis pabrik yang dioperasikan. Secara umum reaksinya sebagai berikut :
Amoniak dapat langsung direaksikan dengan oksigen menjadi asam nitrit. Reaksi antara amoniak dengan asam nitrit dapat menghasilkan amonium nitrat yang memungkinkan diaplikasikan sebagai pupuk. Kotoran hewan yang membusuk juga dapat menghasilkan nitrat.
Selain proses nitrifikasi, bakteri dalam tanah dapat bekerja dalam proses denitrifikasi, yaitu perombakan senyawa nitrat menjadi gas nitrogen. Namun, memiliki efek samping yaitu menghasilkan gas NO dan N2O. Kedua
gas ini bersifat anti bius serta merupakan gas yang dapat menyebabkan efek rumah kaca dan pemanasan global. Beberapa reaksi yang dapat terjadi dari senyawa nitrogen dapat dilihat pada Gambar 1.
N2O5 HNO3 NaNO3 H2O NaOH NaNO2 HNO2 -N2O4 Panas Dingin N2O, NH4+ H2SO4 Fe3+ + H2SO4 Cu Zn H2S SO2 S P Fe(OH)2 FeS NO S H2SO4 H3PO4 Fe3+ NaOH NO N2 1000 oC 3000 oC NH3
Proses Haber, t = 500 oC, 250 atm, katalis Fe Di bakar, t = 600 oC
Na2O
> 500 oC
NH4NO3
Panas
Gambar 1. Diagram Reaksi Unsur Nitrogen (Cotton, 1989). Proses Ostwald udara dengan Pt/Rn pada t = 930oC, 8 atm
B. BAKTERI PENGOKSIDASI AMONIAK
Nitrifikasi adalah proses oksidasi terhadap amoniak menjadi nitrat. Proses ini melibatkan dua jenis bakteri yaitu bakteri pengoksidasi amoniak yang mengoksidasi amoniak menjadi nitrit dan bakteri pengoksidasi nitrit yang mengoksidasi nitrit menjadi nitrat. Bakteri pengoksidasi amoniak menghasilkan oksida nitrit selama oksidasi amoniak selama masa pertumbuhan. Klasifikasi bakteri pengoksidasi amoniak dapat dijelaskan sebagai berikut (Kuenen et al., 1994) :
1. Bakteri pengoksidasi amoniak litotrof, yaitu bakteri jenis gram negatif yang melepaskan energi bebas untuk metabolismenya dari oksidasi amoniak menjadi nitrit dan mendapatkan karbon untuk pertumbuhan dengan asimilasi karbon dioksida. Reaksi nitrifikasi secara autotrofik adalah sebagai berikut :
2. Bakteri nitrifikasi heterotrof, campuran nitrogen organik dan anorganik (seperti amoniak) dan campuran nitro-organik dioksidasi menjadi bahan organik dan anorganik seperti nitrat (NO3-), nitrit (NO2-), hidroksilamin
(NH2OH) dan asam trihidroksamik. Proses nitrifikasi heterotrof hanya
terjadi jika terdapat sumber energi eksternal yang mencukupi. Adapun nitrifikasi heterotrof juga membutuhkan NADH yang berasal dari bahan organik, tapi tidak menghasilkan ATP. Reaksi nitrifikasi secara heterotrofik adalah sebagai berikut :
3. Bakteri nitrifikasi yang mengoksidasi amoniak secara anaerobik. Mereka menggunakan yang disebut anamox proses yang mana mengoksidasi
NH4+ NH2OH NO2- NO3 -NAD(P)H NH4+ NH2OH NO2- NO3 ATP ATP NAD(P)H
pasangan amoniak untuk direduksi menjadi nitrit dan menghasilkan N2.
Hal ini menunjukkan terjadinya proses biologi meskipun mekanisme yang tepat belum dapat diterangkan. Mikroorganisme yang dominan pada komunitas anamox adalah Planctomycete.
Nitrifikasi adalah proses mengkonversi amonium menjadi nitrat. Hal ini terjadi dengan bantuan bakteri nitrifikasi yaitu yang mendapatkan energi dari oksidasi amoniak dengan menggunakan CO2 sebagai sumber karbon.
Bakteri nitrifikasi ditemukan pada tanah, air pada rentang pH cukup luas, tetapi pada tanah yang terlalu asam bakteri tidak aktif. Bakteri ini akan ditemukan dalam sebuah konsorsium, karena sebagian bakteri memiliki spesialisasi untuk mendekomposisi zat organik tertentu. Dalam hal ini
nitrosomonas yang mengubah amoniak menjadi nitrit, sedangkan nitrobacter
mengubah nitrit menjadi nitrat (Stewart, 1980).
Nitrosomonas sp. memiliki bentuk sel elips, rantai pendek, motil dan
non-motil, terdapat dalam bentuk konsorsium, berpasangan sebagai rantai pendek maupun sendiri. Bakteri ini adalah bakteri gram negatif dan memiliki sitomembran. Sel tumbuh bebas pada medium dan membentuk matriks tipis. Pertumbuhan sel dapat diamati pada media dengan penambahan indikator fenolftalein sehingga terjadi perubahan warna merah menjadi kuning jika terbentuk nitrat (Yani, 1999).
Gambar 2. Bakteri Nitrosomonas sp. dengan perbesaran 39 000 x (Suwa, 1995,
Bakteri ini termasuk jenis mikroorganisme chemoautotrof yaitu
mendapatkan energi dengan oksidasi kimiawi secara autotrof, karena tidak tergantung dari pembentukkan zat organik. Prinsip oksidasi amoniak pada bakteri hampir sama dengan oksidasi karbohidrat pada manusia. Bakteri menggunakan CO2 untuk memproduksi zat organik yang mana secara prinsip
tidak berbeda dengan tumbuhan (Deacon, http://web.reed.edu).
Reaksi oksidasi amoniak secara biokimia oleh Nitrosomonas sp.
(Hopper et al., 1989) adalah sebagai berikut :
Mekanisme oksidasi amoniak dengan Nitrosomonas europaea telah di
laporkan oleh McTavish et al. (1995) bahwa bakteri ini mendapatkan energi
untuk tumbuh dari oksidasi amoniak menjadi nitrit. Tahap pertama, amoniak dioksidasi hidroksilamin dengan bantuan amoniak monoksigenase (AMO). Hidroksilamin dioksidasi oleh enzim multiheme yaitu hidroksilamin oksidoreduktase (HAO). Elektron yang terlepas dari NH2OH dapat ditransfer
sebagai pasangan elektron dari HAO tetraheme sitokrom c554. Dua elektron
kembali ke reaksi amoniak monoksigenase sementara dua elektron yang lain menuju sitokrom terminal oksidase tipe aa3 atau ke NADP+ reduktase via
”aliran elektron dapat balik”. Elektron pembawa terdiri dari periplasmik sitokrom monoheme c552, membran lokal ubiquinon-8 dan beberapa
membran terikat c-sitokrom yang mana tidak diketahui sifatnya.
2H+ + NH3 + 2é + O2Æ NH2OH + H2O ... (1)
Ammonia monooxygenase (AMO)
NH2OH + H2O Æ HONO + 4e + 4 H+... (2)
Hydroxylamine oxidoreduktase (HAO) 2 H+ + ½ O
2 + 2e Æ H2O (Terminal Oksidase)... (3)
HNO2 + O2Æ HNO3 + H2O...(5)
HNO2 + H2O Æ HNO3 + 2e + 2 H+...(6)
Dua c-sitokrom terikat pada membran Nitrosomonas sp. yang telah
dilaporkan oleh Hooper, A.B dan McTavish, et al. (1995). Sitokrom c554
merupakan protein yang mudah larut dan periplasmik. Konsentrasi Fe dan Cu dalam media pertumbuhan menentukan total sel sitokrom c554. 50-100 %
total sel sitokrom c554 merupakan membran sel. sitokrom c554 berikatan
dengan organel phospholipid. Hal ini diduga phospholipid memiliki peranan dalam interaksi sitokrom dengan membran. Selama oksidasi NH2OH,
kemampuan hidroksilamin oksidoreduktase (HAO) untuk mentransfer elektron ke aseptor elektron, sitokrom c554 pada hakekatnya terikat lemah dengan organel phospholipid. Sitokrom kedua, berikatan dengan membran
Nitrosomonas sp. hal ini teridentifikasi sebagai HAO pada aktifitas katalitik
dan keberadaannya pada panjang gelombang 464 nm. Fraksi HAO ditemukan sebagai ikatan membran dan hanya pada sel yang tumbuh pada Fe atau Cu konsentrasi lemah (Yani, 1999).
Nitrit yang telah dihasilkan oleh Nitrosomonas sp. dapat dioksidasi
oleh bakteri pengoksidasi nitrit. Nitrobacter dapat mengoksidasi nitrit menjadi
nitrat. Menurut Paul et al. (1989) proses terbentuknya nitrat melibatkan enzim
nitrit dehydrogenase sehingga terbetuk HNO3+ dan 2 H+. Yani et al., (1999)
menambahkan bakteri ini merupakan bakteri gram negatif yang memiliki sitomembran yang bersifat polar. Genus ini menggunakan oksigen sebagai elektron aseptor, tumbuh pada pH 6.5 – 8.5, suhu 5-40 oC. Adapun reaksi oksidasi nitrit oleh Nitrobacter sp adalah sebagai berikut :
Denitrifikasi adalah proses dimana nitrat terkonversi menjadi campuran gas (oksida nitrit, oksida nitrogen dan N2) oleh mikroorganisme.
Beberapa jenis bakteri terlibat pada tahap ini ketika fase pertumbuhan dengan menggunakan bahan organik pada kondisi anaerobik. Karena kekurangan jumlah oksigen untuk respirasi, mereka menggunakan nitrat pengganti oksigen sebagai akseptor elektron. Pada respirasi anaerobik manusia, molekul organik
dioksidasi menjadi energi, oksigen yang terbentuk direduksi menjadi molekul air (Burlage, 1998)
C6H12O6 + 6 O2 = 6 CO2 + 6 H2O + energi
Ketiadaan oksigen dapat digantikan oleh senyawa lain yang dapat direduksi. Sebagai contoh senyawa nitrat dapat berperan sebagai akseptor elektron dan dapat direduksi menjadi nitrit, oksida nitrit, oksida nitrogen atau sebagai N2. Ciri-ciri kondisi dimana kita bisa menemukan mikroorganisme
denitrifikasi adalah (1) terdapat bahan organik yang mudah dioksidasi, (2) ketidaktersediaan oksigen tetapi terdapat senyawa sebagai sumber nitrogen yang mudah direduksi. Hal ini terjadi pada kondisi anaerobik, sehingga senyawaan yang dapat menggantikan peran oksigen dapat tetap membuat proses denitrifikasi berlangsung dengan baik. Mikroorganisme yang berperan dalam hal ini adalah B. stutzeri, B. denitrofluorecens, B. vulpinus dan Thiobacillus denitrificans (Waksman et al., 1957). Berikut daftar bakteri
kemoautotrof pengoksidasi senyawaan nitrogen.
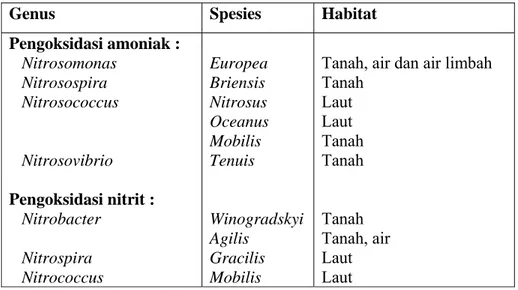
Tabel 2. Daftar bakteri pengoksidasi senyawaan nitrogen
Genus Spesies Habitat
Pengoksidasi amoniak : Nitrosomonas Nitrosospira Nitrosococcus Nitrosovibrio Pengoksidasi nitrit : Nitrobacter Nitrospira Nitrococcus Europea Briensis Nitrosus Oceanus Mobilis Tenuis Winogradskyi Agilis Gracilis Mobilis
Tanah, air dan air limbah Tanah Laut Laut Tanah Tanah Tanah Tanah, air Laut Laut Sumber : Jenie dan Rahayu (2004)
C. BIOFILTER
Menurut Chou dan Cheng (1997), biofilter adalah reaktor dengan material padat sebagai bahan pengisi dimana mikroba terjerat secara alami di
dalamnya dengan membentuk biolayer (lapisan tipis). Gas-gas yang melalui
biofilter akan larut atau terserap kedalam lapisan biolayer dan akan diuraikan oleh mikroba yang ada (Ottenggraf, 1986).
Metode biofilter baik untuk dikembangkan karena biaya investasi dan operasional rendah, stabil dalam waktu yang relatif lama dan memiliki daya penguraian/pengolahan yang tinggi jika dibandingkan dengan metode pengolahan yang dipakai saat ini (Adrew dan Noah, 1995). Bahan pengisi alami yang biasa digunakan adalah gambut, kompos, arang aktif, sabut kelapa, humus, dan tanah. Bahan-bahan ini mengandung sejumlah nutrisi yang mencukupi untuk pertumbuhan mikroba sehingga penambahan nutrisi tidak diperlukan untuk pemakaian yang tidak terlalu lama (kurang dari 3 bulan) (Shoda, 1991).
Menurut Ottenggraf (1986), kinerja biofilter dapat dinilai berdasarkan beberapa hal berikut :
1. laju atau kapasitas penghilangan maksimum (g-senyawa polutan/kg-media kering)
2. kecepatan tercapainya kondisi aklimatisasi mikroba. Parameter ini akan menunjukkan kinerja dari bioavailabilitas konsorsium mikroba yang dikembangkan untuk pendegradasian polutan target. Semakin cepat masa adaptasi (lag phase), maka kinerja biofilter akan semakin baik.
3. kemampuan mempertahankan rasio penghilangan gas (efisiensi) dalam waktu yang relatif lama. Rasio penghilangan polutan gas dari biofilter umumnya diatas 95 % dalam waktu yang relatif lama.
4. kemampuan bahan pengisi dalam mempertahankan kondisi pH, suhu, dan kadar air. Kemampuan ini menggambarkan kinerja biofilter terhadap fluktuasi beban polutan gas yang tinggi, kurangnya humidifikasi dan masa tidak terpakainya biofilter akibat fluktuasi proses produksi pada industri.
D. BAHAN PENGISI BIOFILTER
Penentuan bahan pengisi biofilter mutlak dilakukan. Karena bahan yang dipilih akan menjadi media tempat tumbuh bakteri, sehingga bahan pengisi dipilih yang bisa mendukung kehidupan bakteri (Hirai et al., 2001).
Persyaratan untuk bahan pengisi/penyangga antara lain : 1. Kapasitas menahan air yang tinggi (Water Holding Capacity).
2. Porositas yang tinggi dan area permukaan spesifik yang luas. 3. Sifat kepadatan yang rendah.
4. Penurunan tekanan yang rendah pada berbagai kandungan air. 5. Perubahan bentuk yang sedikit pada waktu penggunaan yang lama. 6. Tingkat keringanan (lightness).
7. Murah.
8. Kemampuan menyerap bau yang sesuai.
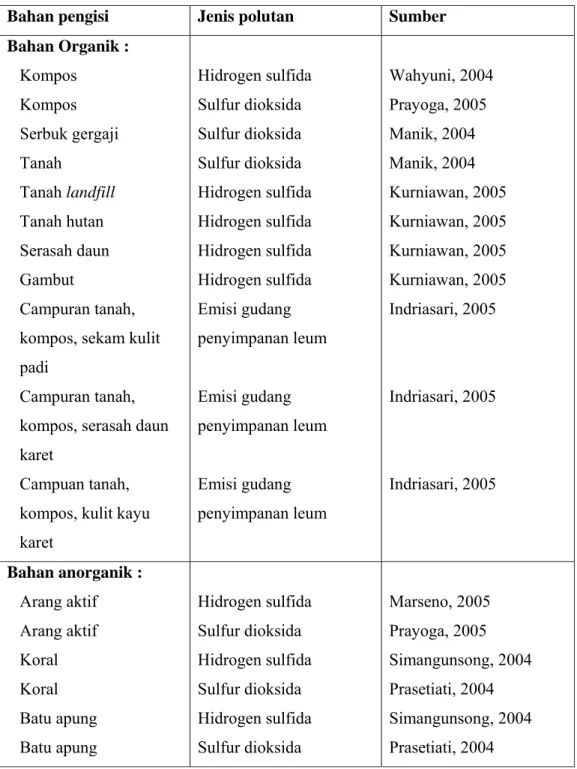
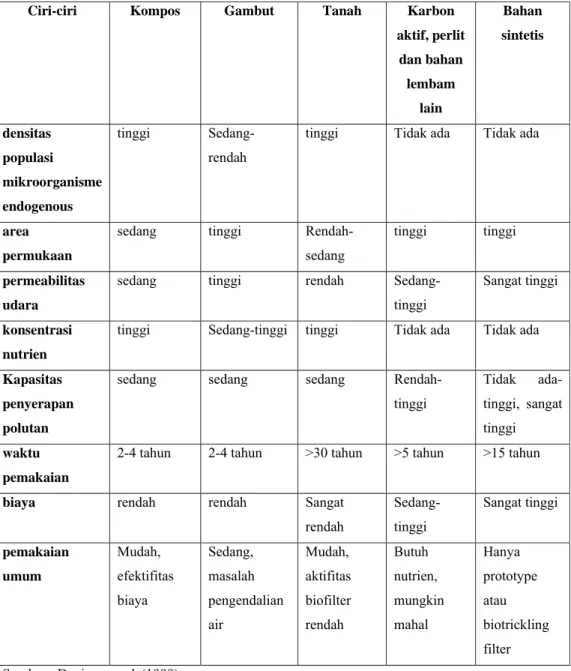
Tabel 3 menunjukkan beberapa jenis bahan pengisi baik organik maupun anorganik yang pernah diaplikasikan pada biofilter dengan jenis polutan yang berbeda-beda. Tabel 4 menunjukkan ringkasan ciri-ciri bahan pengisi menurut Devinny et al. (1999)
Tabel 3 . Beberapa bahan pengisi biofilter yang pernah diaplikasikan
Bahan pengisi Jenis polutan Sumber
Bahan Organik : Kompos Kompos Serbuk gergaji Tanah Tanah landfill Tanah hutan Serasah daun Gambut Campuran tanah, kompos, sekam kulit padi
Campuran tanah, kompos, serasah daun karet
Campuan tanah, kompos, kulit kayu karet Hidrogen sulfida Sulfur dioksida Sulfur dioksida Sulfur dioksida Hidrogen sulfida Hidrogen sulfida Hidrogen sulfida Hidrogen sulfida Emisi gudang penyimpanan leum Emisi gudang penyimpanan leum Emisi gudang penyimpanan leum Wahyuni, 2004 Prayoga, 2005 Manik, 2004 Manik, 2004 Kurniawan, 2005 Kurniawan, 2005 Kurniawan, 2005 Kurniawan, 2005 Indriasari, 2005 Indriasari, 2005 Indriasari, 2005 Bahan anorganik : Arang aktif Arang aktif Koral Koral Batu apung Batu apung Hidrogen sulfida Sulfur dioksida Hidrogen sulfida Sulfur dioksida Hidrogen sulfida Sulfur dioksida Marseno, 2005 Prayoga, 2005 Simangunsong, 2004 Prasetiati, 2004 Simangunsong, 2004 Prasetiati, 2004
Tabel 4. Ringkasan ciri-ciri penting bahan pengisi biofilter yang biasa digunakan
Ciri-ciri Kompos Gambut Tanah Karbon
aktif, perlit dan bahan lembam lain Bahan sintetis densitas populasi mikroorganisme endogenous tinggi Sedang-rendah
tinggi Tidak ada Tidak ada
area permukaan
sedang tinggi Rendah-sedang
tinggi tinggi permeabilitas
udara
sedang tinggi rendah Sedang-tinggi
Sangat tinggi
konsentrasi nutrien
tinggi Sedang-tinggi tinggi Tidak ada Tidak ada Kapasitas
penyerapan polutan
sedang sedang sedang Rendah-tinggi Tidak ada-tinggi, sangat tinggi waktu pemakaian
2-4 tahun 2-4 tahun >30 tahun >5 tahun >15 tahun
biaya rendah rendah Sangat
rendah Sedang-tinggi Sangat tinggi pemakaian umum Mudah, efektifitas biaya Sedang, masalah pengendalian air Mudah, aktifitas biofilter rendah Butuh nutrien, mungkin mahal Hanya prototype atau biotrickling filter Sumber : Devinny et al. (1999)
E. KORAL
Terumbu karang dapat berkembang baik di daerah tropis dan mampu menahan nutrien dalam sistemnya sehingga berfungsi sebagai kolam untuk menampung segala masukkan dari luar. Tiap nutrien yang dihasilkan dapat digunakan langsung oleh tumbuhan tanpa mengedarkannya terlebih dahulu ke perairan (Nybakken, 1992). Terumbu karang adalah endapan masif yang
merupakan hasil akhir dari kombinasi dinamika produksi kalsium karbonat oleh alga berkapur, organisme-organisme lain penghasil kalsium karbonat dan hewan karang dengan erosi terumbu akibat faktor biologis dan fisik (Webber dan Thurman, 1991). Keberhasilan terbentuknya karang pembentuk terumbu dengan alga mikroskopik uniseluler dinoflagellata (Symbiodinium microadriaticum), yang umum disebut zooxanthellae.
Koral merupakan penyusun utama dari terumbu karang. Koral termasuk anggota filum Cnidaria, klas Anthozoa, dan ordo Madreporaria atau Scleractinia. Koral memiliki kerangka luar dari kalsium karbonat (CaCO3).
Pada umumnya karang hidup secara koloni. Koloni karang dengan kerangka-kerangka yang padat dan keras dari CaCO3 tidak akan rusak oleh gelombang
yang kuat. Karang akan mati karena terlalu lama di udara terbuka (Nybakken, 1992).
Proses kalsifikasi adalah proses mineralisasi karikoblast epidermis. Bahan utama yang digunakan dalam proses kalsifikasi sebenarnya merupakan hasil sekresi metabolisme. Pembentukkan CaCO3 tergantung kepada
kecepatan pemindahan asam karbonat pada proses kalsifikasi (Suharsono, 1984). Menurut pengamatan laboratoris terbentuknya endapan (kalsium karbonat) adalah sebagai berikut :
Ca2+ + 2HCO3- Q Ca(HCO3)2 Q CaCO3 + H2CO3
CaCO3 (aroganit kristal) inilah yang mengendap dan membentuk
karang (Sya`rani, 1982). Asam karbonat (H2CO3) berubah menjadi ion
hidrogen (H+) dan karbonat (HCO
3-) yang cenderung berubah menjadi H2O
dan CO2. semua reaksi ini terjadi di dalam tubuh karang, dimana
pembentukkan air dan karbondioksida dipercepat oleh adanya enzim anhydrase (Mapstone, 1990). Zooxanthellae memanfaatkan hasil-hasil
metabolisme dari terumbu karang yang berupa bahan-bahan organik dan respirasi (CO2) dari terumbu karang, yang digunakan untuk proses fotosintesa.
Di dalam air CHO tidak stabil dalam bentuk 2 HCO3-, yang kemudian
mengikat kalsium (Ca2+) dari perairan yang akan membentuk Ca(HCO3)2 yang
berada dalam keadaan stabil (Suharsono, 1984). Apabila proses ini berjalan cepat, maka keseimbangan akan bergeser ke arah kanan, dan terurai menjadi
CaCO3 + H2CO3. Hal ini terjadi setiap hari dan pusat pendepositan CaCO3
adalah pada siang hari dimana proses asimilasi mencapai level tertinggi (Mapstone, 1990).
Hewan karang atau polip memperoleh energi dalam bentuk makanan dan oksigen langsung dari zooxanthellae dimana hal ini sangat membantu
pertumbuhan dari polip karang itu sendiri. Sebaliknya, zooxanthellae yang
hidup pada jaringan karang, selain memperoleh tempat berlindung dari pemangsa, dapat juga memakai karbondioksida yang dihasilkan polip karang dari proses respirasi, nutrien-nutrien (PO43-, NH3-) dan produk-produk
metabolisme lainnya (urea, asam amino) yang berasal dari ekskresi karang untuk proses fotosintesis (Burke et al., 2002).
Zooxanthellae adalah algae bersel tunggal dengan ukuran mikroskopis
berwarna coklat dan memerlukan cahaya matahari untuk berfotosintesa. Warna coklat dari algae ini mempengaruhi sebagian besar warna karang, sehingga hampir semua karang berwarna coklat walaupun sebenarnya karang juga mempunyai pigmen sendiri (Suharsono, 1996). Dalam kondisi perairan tertentu zooxanthellae dapat keluar dari karang misalnya sebagai akibat dari
stress lingkungan (kecerahan yang kurang atau berlebihan, salinitas rendah, suhu terlalu tinggi) atau adanya penyakit yang menimpa karang tersebut dan menyebabkan karang menjadi putih (Veron, 1993).
F. ARANG AKTIF
Arang dapat diaktifkan dengan menggunakan gas CO2, uap air, dan
bahan kimia. Bahan-bahan yang menutup pori-pori arang dihilangkan sehingga arang tersebut akan menjadi arang aktif dengan daya adsorbsi yang lebih tinggi. Proses pengaktifan arang bertujuan agar arang lebih mampu menyerap zat warna dan gas secara efektif walaupun dalam jumlah yang kecil (Ketaren dan Djatmiko, 1978).
Sifat fisik dan kimia arang aktif tergantung dari cara pengaktifannya. Arang yang diaktifkan dengan menggunakan gas, masih menunjukkan struktur bahan mentahnya dan mempunyai reaksi basa, sedangkan arang yang
diaktifkan dengan menggunakan bahan kimia, menunjukan struktur yang berlainan dengan bahan mentah dan bereaksi asam (Djatmiko et al., 1985).
Dibandingkan dengan adsorben komersial lainnya, arang aktif mudah dibuat dari bahan-bahan yang mengandung karbon seperti bahan-bahan buangan. Kelebihan lainnya yaitu memiliki aktivitas dengan spektrum penyerapan yang luas dan stabilitas fisik dan kimia yang sangat baik. Arang aktif mempunyai sifat penyerapan yang selektif, lebih menyukai bahan-bahan non polar daripada bahan polar. Pada bahan-bahan dalam satu deret homolog, biasanya daya serap arang aktif meningkat dengan meningkatnya titik didih. Kemampuan daya serap bertambah dengan meningkatnya tekanan dan menurunnya temperatur (Djatmiko et al., 1985).
Mutu arang aktif tergantung dari luas permukaan, luas melintang dan isi kapiler untuk setiap unit bobot, ukuran partikel, sifat kimia permukaan, dan bahan baku serta cara pengaktifan yang dilakukan. Arang yang baik mutunya adalah arang dengan kadar karbon tinggi dan kadar abu serta hidrogen rendah (Djatmiko et al., 1985).
G. KOMPOS
Kompos merupakan bahan organik yang berfungsi sebagai pupuk. Selain itu dapat memperbaiki sifat fisik tanah karena tanah menjadi remah dan mikroba-mikroba tanah yang bermanfaat dapat hidup dengan subur (Wudianto, 1996).
Menurut Cosico (1985) pengomposan berarti suatu proses yang dapat mengakibatkan suatu campuran bahan-bahan organik akan terurai menjadi produk akhir (kompos) yang stabil di bawah kondisi yang optimum ataupun buruk yang kemudian kompos tersebut dapat dipergunakan ataupun buruk yang kemudian kompos tersebut dapat dipergunakan sebagai pupuk dan penyubur tanah.
Harada et al. (1993), menyatakan bahwa bahan organik yang
dikomposkan dan akan digunakan untuk tanah pertanian sebaiknya terdekomposisi dengan baik dan tidak menimbulkan berbagai efek yang
merugikan terhadap pertumbuhan tanaman. Kompos dicirikan oleh sifat-sifat berikut :
1. berwarna coklat tua sampai hitam
2. tidak larut dalam air meskipin sebagian dari kompos dapat membentuk suspensi
3. sangat larut dalam pelarut alkali, natrium pirifosfat, atau larutan amoniak oksalat menghasilkan ekstrak berwarna gelap dan dapat difraksinasi lebih lanjut menjadi humic, fulfic, dan humin
4. nisbah C/N berkisar antara 10 – 20 (tergantung bahan baku dan derajat humidifikasi)
5. memiliki kapasitas pemindahan kation dan absorbsi air yang tinggi
6. jika digunakan pada tanah, kompos menberikan efek-efek menguntungkan bagi tanah dan pertumbuhan tanaman. Nilai pupuknya ditentukan oleh N, P, K, Ca, dan Mg.
7. tidak berbau
8. secara biokimiawi tidak stabil tetapi komposisinya berubah karena aktifitas mikroba, sepanjang kondisi lingkungannya sesuai (seperti suhu dan kelembaban), yang akan dioksidasi menjadi garam-garam anorganik, karbondioksida, dan air.
Mutu kompos dipengaruhi oleh tingkat kematangannya. Kompos yang telah matang akan memiliki kandungan bahan organik yang dapat didekomposisi dengan mudah dan nisbah C/N yang rendah. Kompos yang baik tidak mengandung bahan-bahan yang dapat merugikan pertumbuhan tanaman dan tidak menebarkan bau yang ofensif serta kandungan airnya mencukupi.
Kompos juga bisa digunakan sebagai bahan pengisi organik, karena memiliki keragaman dan jumlah mikroorganisme yang tinggi, mempunyai kapasitas penyangga air yang tinggi serta pH yang netral. Bahan kompos mempunyai tahanan penurunan permukaan lebih tinggi dibanding gambut (Devinny et al., 1999).
H. TANAH
Menurut Devinny et al., (1999) tanah dapat digunakan sebagai bahan
pengisi biofilter sebab tanah sangat murah, mudah didapat, tersedia dalam jumlah melimpah, serta mengandung populasi mikroba yang tinggi. Tanah secara alami bersifat hidrofilik dan kemampuan untuk menahan kehilangan air lebih tinggi bila dibandingkan dengan kompos dan gambut walaupun dalam kondisi yang kering. Namun kekurangan tanah sebagai bahan pengisi adalah mempunyai daya penurunan tekanan yang besar dan mudah terbentuk celah untuk aliran udara. Tanah mempunyai permeabilitas yang rendah terhadap gas. Tanah adalah faktor lingkungan yang mengandung komponen-komponen biotik maupun abiotik yang diperlukan oleh organisme termasuk aktifitas organik. Bahan organik pada tanah harus cukup tinggi karena untuk mempertahankan tanah berstruktur remah, sebab tanaman pada tanah tersebut memerlukan struktur remah agar sirkulasi udara dan air berjalan dengan baik. Tanah yang cukup mengandung bahan organik, maka tanah tidak terlalu cepat kering karena adanya bahan organik kemampuan tanah tersebut menahan air diperbesar, air tidak lepas tetapi diikat, disamping itu juga akan menjelmakan tanah dari struktur ringan menjadi lebih baik dan daya mengikat air tinggi, sedangkan pada tanah berat akan menjadi ringan (Soesrosudirdjo et al., 1977).
Pengaruh fisik yang lain bahwa bahan organik bersama tanah membentuk koloid yang dapat mengikat ion-ion hara tanaman sehingga tidak mudah tercuci oleh air hujan meupun air pengairan. Keadaan adalah sebaliknya apabila tanah hanya mengandung sedikit bahan organik, maka tanah akan cepat mengeras dan mengering, dimana keadaan tersebut sudah barang tentu tidak dikehendaki oleh tanaman (Hadmadi, 1977).
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Bahan yang digunakan untuk penelitian ini adalah: NH4OH, pereaksi
Nessler, larutan penyerap asam borat 0.01 %, larutan induk standar NH4Cl 10
ppm, Nutrient Agar, Bacto Agar dan aquabidest.
Alat yang digunakan dalam penelitian ini antara lain aerator, selang plastik, flowmeter, kolom dari pipa peralon PVC, bahan pengisi (koral, arang aktif, kompos, tanah landfill TPA Galuga), inkubator, peralatan gelas,
spektrofotometer.
B. METODE PENELITIAN
1. Pembuatan Reaktor Biofilter
Kolom biofilter yang digunakan terbuat dari pipa PVC dengan ketinggian tabung 60 cm dan diameter dalam 15.24 cm. Masing-masing kolom biofilter diberi 5 lubang yaitu 2 lubang untuk lubang pemasukan dan pengeluaran gas, 3 lubang untuk pengambilan sampel bahan pengisi. Rancangan biofilter dapat dilihat pada Gambar 5.
Masing-masing kolom diberi ukuran untuk pengisian bahan pengisi. Setiap kolom diberikan jarak untuk udara sebesar 5 cm pada bagian atas dan 10 cm pada bagian bawah. Ketinggian bahan pengisi dalam kolom dibagi menjadi 3, masing-masing 15 cm. Lubang pengambilan contoh bahan pengisi berada di tengah bahan pengisi itu. Masing-masing bahan pengisi memiliki berat densitas yang berbeda, sehingga berat bahan pengisi yang diisikan pada masing-masing kolom juga berbeda. Biofilter yang dioperasikan dapat dilihat pada Lampiran 4.
2. Penyiapan inokulum bakteri Nitrosomonas sp. dan penghitungan bakteri
heterotrof pada bahan pengisi
Bakteri yang digunakan adalah bakteri Nitrosomonas sp.
diaplikasikan dalam biofilter, yaitu memberikan asupan nutrien dengan pengamatan perubahan warna sebagai indikator. Menurut Yani (1999), bakteri pengoksidasi amoniak dapat tumbuh pada kondisi pH 5.8 - 8.5 dan suhu 5 - 30 oC. Sedangkan bakteri pengoksidasi nitrit dapat tumbuh pada suhu 5 - 40 oC dan pH 6.5 – 8.5.
Media yang digunakan untuk memperbanyak Nitrosomonas sp.
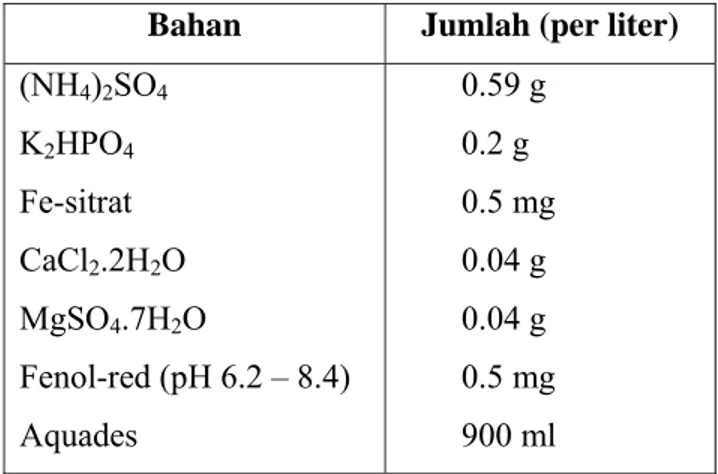
adalah media Alexander (AL). Indikator warna menggunakan fenol red.
Adapun komposisi media AL dapat dilihat pada Tabel 5. Nilai pH media diatur sampai 8 dengan menggunakan NaOH 0.1 N sehingga media berwarna merah. Jika pH turun, warna akan berubah menjadi kuning, nilai pH mencapai 6. Bakteri diinkubasi selama empat minggu, kemudian dilakukan penambahan media untuk perbanyakan. Hal ini dilakukan sampai perubahan pH media relatif cepat dari 8 ke 6. Perubahan nilai pH yang relatif cepat, yaitu sekitar 3-4 hari sudah berubah dari nilai pH 8 menjadi 6, mengindikasikan pertumbuhan bakteri Nitrosomonas sp.
Gambar 3. Tahapan propagasi Nitrosomonas sp.. (a) Media pertumbuhan Nitrosomonas sp., (b) Nitrosomonas sp. diinkubasi selama 1
minggu, (c) Nitrosomonas sp. diinkubasi selama 4 minggu.
Tabel 5. Komposisi media pertumbuhan Nitrosomonas sp.
Bahan Jumlah (per liter)
(NH4)2SO4 K2HPO4 Fe-sitrat CaCl2.2H2O MgSO4.7H2O Fenol-red (pH 6.2 – 8.4) Aquades 0.59 g 0.2 g 0.5 mg 0.04 g 0.04 g 0.5 mg 900 ml Sumber : Verstraete (1981) di dalam Anas (1989).
Pengujian TPC terhadap bakteri heterotrof dan MPN terhadap bakteri Nitrosomonas sp. Hal ini dilakukan untuk mengetahui jumlah sel
mikroorganisme yang terdapat dalam bahan pengisi sebelum aplikasi biofilter.
3. Karakterisasi bahan pengisi
Tahap ini merupakan tahap persiapan bahan pengisi biofilter. Bahan pengisi terdiri dari :
1. Koral 2. Arang aktif
3. Kompos dari tempat pengomposan Tumaritis, TPA Galuga, Bogor. 4. Tanah landfill dari TPA Galuga, Bogor.
Bahan pengisi yang akan digunakan dilakukan pengujian awal bahan antara lain kadar air, pH, kadar nitrogen organik dan karbon organik.
3. Penelitian Utama
Biofilter yang digunakan sebanyak 4 buah kolom yang diisi dengan bahan pengisi yang berbeda setinggi ± 45 cm. Gas NH3 diperoleh dari
larutan NH4OH teknis yang diaerasi dengan flow 1-1.3 liter/menit dengan
Gas NH3 yang digunakan dinaikkan secara bertahap. Hal ini
dilakukan untuk menambah beban pada biofilter, tetapi disesuaikan dengan kapasitas penyerapannya. Secara teknis, konsentrasi dinaikkan jika efisiensi lebih dari 90%).
4. Analisis data
Analisis data dilakukan dengan analisis deskriptif untuk parameter laju penghilangan gas, laju pertumbuhan mikroorganisme dan laju pembentukan nitrat. Data yang diperoleh digunakan untuk menentukan kondisi terbaik penghilangan gas.
Contoh perhitungan pengolahan data adalah sebagai berikut :
a). Perhitungan g-N dalam kurva standar :
b). Perhitungan g-N dalam contoh :
Contoh : Y = a X + b = 11.314 X + 0.0746 Y = Nilai absorbansi X = Konsentrasi (g-N)
c). Perhitungan g-N per udara yang masuk :
g-N = ml standar x 53.5 14 x 10 ppm x 1 gram 1000 mg x 1 liter 1000 ml
g-N = ((nilai absorbansi x pengenceran) - b) a x 5 ((0.450 x 1) – 0.0746) = g-N x 5 11.341 = 0.00017 g-N/l = g-N yang terserap
Volume (m3) = (waktu sampling (menit) x Flow (liter/menit) x (273+25 0C)) (273 + t 0C) x 1000 (m3)
Contoh :
d). Perhitungan konsentrasi NH3 dalam ppm :
e). Perhitungan beban yang ditambahkan dan penyerapan NH3 dalam
bahan pengisi :
Berat kering bahan = (100 % - % kadar air) x berat bahan pengisi = (100 % - 22.16 %) x 3.477 kg = 2.71 kg berat kering Contoh : = 0.00017 0.0010 g-N/l = 0.00017 µg/m3 = (g-N/l x (17/14) x 109) 1000 (0.00017 x (17/14) x 109) 1000 = = 202.994 ppm = (8.314 x (273 + t 0C) x µg NH3/m3) 103205 x BM NH3 (8.314 x (273+28) x 202.994)) 103250 x 17 = = 0.29 ppm
g-N total/hari = g-N/l udara x flow (l/menit) x 24 jam x 60 menit x ((H+1) – H)
0.00017 x 1 x 24 x 60 (2-1) =
= 202.994 g-N total/hari
Penyerapan = Beban inlet – Beban outlet = 0.09 – 0.03
= 0.06 g-N/kg berat bahan kering
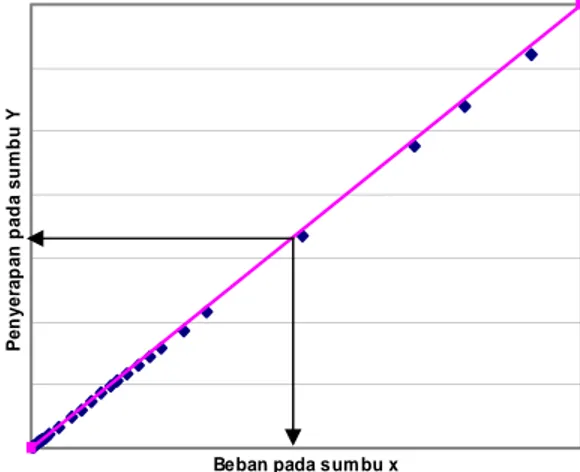
Penentuan kapasitas penyerapan optimal bahan pengisi dapat dilihat pada Gambar 4, yaitu dilakukan dengan plot data beban (sumbu x) dan kapasitas penyerapan (sumbu y). Kapasitas penyerapan optimum ditentukan sebagai titik dimana kurva penyerapan menyimpang dari kurva penyerapan ideal (Hirai et al.).
Gambar 4. Grafik hubungan beban (x) dan kapasitas penyerapan (y) untuk menentukan kapasitas penyerapan bahan.
f). Perhitungan persen penghilangan polutan (efisiensi) biofilter :
Contoh :
g-N/ kg berat kering bahan = 0.241 g-N total/hari 2.71 kg berat kering = 0.09 g-N/kg berat kering/hari
Efisiensi = (Konsentrasi inlet – Konsentrasi oulet) Konsentrasi inlet x 100 % Efisiensi = (0.29 ppm – 0.097 ppm) 0.29 ppm x 100 % = 67 %
Beban pada sum bu x
P e n y e ra p a n pa da s u m bu Y
g). Perhitungan kinetika biofilter :
Rumus umum kinetika menurut persamaan Michaelis-Menten :
Keterangan :
Vm : Laju penghilangan maksimum (g-N/kg-bahan kering/hari) Ks : Konstanta jenuh (ppm)
α : Koefisien konversi (kg-bahan kering/g-N) SV : Space velocity (per hari)
Contoh :
Grafik dibuat dengan C ln pada sumbu X dan C ln/R pada sumbu Y
untuk mencari V maksimum (Vm) dan konstanta jenuh (Ks), dengan menggunakan persamaan umum kinetika. Perhitungan dilakukan dengan persamaan garis Y= aX + b, sehingga didapatkan a = 1/Vm dan b = Ks/Vm atau Vm = 1/a dan Ks = Vm x b.
C ln = (konsentrasi inlet – konsentrasi outlet)
konsentrasi outlet x ln konsentrasi inlet C ln = (3.244 ppm – 0.142 ppm) 0.142 ppm x ln 3.244 ppm = 9.71
R = SV x (konsentrasi inlet – konsentrasi outlet) α R = 1020.13 x (3.244 ppm – 0.142 ppm) 4748392.16 = 0.00067 C ln = R Ks Vm + C ln Vm
Gambar 5. Model kolom biofilter skala laboratorium. (a) Pompa udara, (b) Larutan NH4OH pekat, (c) Flow meter, (d) Larutan NH4OH
cair, (e) Lubang inlet, (f) Lubang sampling, (g) Lubang outlet.
a
b
d
c
e
f / L-2a
g
5 cm ruang kosong 15 cm bahan pengisi 15 cm bahan pengisi 15 cm bahan pengisi 10 cm ruang kosong L-1 L-3Biofilter yang dioperasikan menggunakan larutan NH4OH teknis
yang diencerkan pada konsentrasi tertentu dan dimasukkan pada wadah b. Dari wadah b diteteskan pada wadah d untuk menghasilkan gas amoniak tambahan yang kemudian gas tersebut diakumulasikan ke dalam wadah b. Pompa udara memompa gas yang terkumpul untuk dialirkan ke dalam kolom biofilter dengan diatur kecepatan alirannya sebesar 1 liter per menit. Gas yang dialirkan dilakukan pengambilan contoh dengan menggunakan tabung sampling yang diisi larutan penyerap asam borat 0.01 % sebanyak 10 ml. Sampling dilakukan selama 1 menit, kemudian diberikan peraksi nessler sebanyak 1 ml, kemudian dilanjutkan dengan pengukuran nilai absorbansi pada panjang gelombang 420 nm dengan blanko. Pengambilan contoh udara dilakukan pada inlet dan outlet.
IV. HASIL DAN PEMBAHASAN
A. KARAKTERISTIK DAN FUNGSI BAHAN PENGISI
Bahan pengisi yang digunakan sangat menentukan kinerja biofilter. Hal ini terkait dengan sifat fisik dan kimia bahan pengisi. Sifat fisik berpengaruh pada penyerapan secara fisik polutan ke bahan pengabsorb. Menurut Devinny et al., (1999) absorbsi menghilangkan polutan dengan
mengubahnya dari fasa gas menjadi fasa cair.
Bahan pengisi yang digunakan terdiri dari bahan organik dan anorganik. Bahan ini dipilih karena memiliki karakteristik yang berbeda, yaitu koral dan arang aktif sebagai media anorganik, kompos dan tanah sebagai media organik. Berikut data analisis bahan pengisi yang akan digunakan dapat dilihat di Tabel 6.
Tabel 6. Karakteristik bahan pengisi yang digunakan
Analisa Koral Arang aktif Kompos Tanah
Berat basah (g) 3 500 2 040 5 000 5 000
Densitas (Kg-bahan kering/m3) 206.10 153.66 373.17 403.66
Kadar air (%) 22.16 38.12 33.77 38.8
Kadar nitrogen organik (%) 0.03 0.05 0.43 0.34 Kadar karbon organik (%) 27.74 33.12 32.35 28.86
pH 7.99 7.28 7.54 7.34
Koral yang digunakan memiliki kadar air yang cukup rendah. Hal ini disebabkan oleh sifat koral yang memiliki porositas yang tinggi dan tidak mudah menyerap air. Oleh karena itu, pada kolom koral diperlukan penambahan air secara berkala agar kadar air bahan relatif stabil. Kadar karbon total koral relatif lebih rendah dibanding bahan pengisi yang lain, demikian halnya kadar nitrogen relatif lebih rendah dari bahan pengisi lainnya. Nilai pH koral relatif netral. Densitas menentukan tingkat kerapatan
secara fisik yang akan menentukan besarnya penyerapan polutan terhadap bahan.
Arang aktif yang digunakan memiliki kadar air paling tinggi dari bahan pengisi lainnya. Arang aktif dipilih sebagai bahan pengisi biofilter karena memiliki sifat penyerapan yang selektif, terutama terhadap bahan nonpolar. Nilai pH arang aktif cenderung netral, namun untuk mengantisipasi cepat basanya kondisi arang aktif, maka diberikan dolomit 2% dari berat bahan pengisi. Dolomit berfungsi sebagai penstabil nilai pH. Dalam hal ini kadar karbon arang aktif lebih tinggi dibanding bahan pengisi lain. Karena komponen utama arang aktif adalah karbon yang diberikan perlakuan untuk mengaktifkan ion pada arang. Menurut Djatmiko et al., (1985) nilai pH sangat
berpengaruh dalam proses adsorbsi secara fisik, karena pH mempengaruhi kelarutan suatu zat. Sifat adsorbsi disebabkan karena adanya perbedaan muatan listrik, perbedaan potensial dalam sifat kimia dan perbedaan potensial panas. Muatan listrik dari arang adalah elektro positif dalam larutan asam dan elektro negatif dalam larutan alkali.
Bahan pengisi tanah, memiliki kandungan kadar air yang paling tinggi. Hal ini sangat memungkinkan tercukupi kebutuhan air untuk pertumbuhan bakteri dan proses lainnya dalam kolom baik secara kimiawi, fisis maupun biologis. Biofilter kompos juga memiliki kadar air yang relatif tinggi, selain itu nilai pH kompos juga cenderung netral. Devinny et al.,
(1999) kompos yang sudah jadi memiliki banyak ragam dan populasi mikroorganisme. Selain itu, kompos memiliki pH yang netral, kadar air tinggi dan kandungan bahan organik tinggi.
B. BIOFILTER KORAL
1. Kinerja Penghilangan Amoniak
Bahan pengisi koral merupakan bahan anorganik dengan komponen utama penyusunnya adalah kapur karbonat, sedangkan kapur karbonat adalah hasil ekskresi batu koral saat masih hidup. Karakteristik ini
mempengaruhi koral yang cenderung memiliki sifat buffer asam yang kuat dan mempengaruhi nilai pH kolom.
Pada H-0 biofilter dioperasikan hingga hari ke tujuh, konsentrasi inlet yang diberikan adalah fluktuatif antara 0.09 sampai 0.40 ppm. Outlet biofilter berkisar antara 0.04 sampai 0.10 ppm. Pada Gambar 6a dapat dilihat efisiensinya sangat beragam. Kondisi awal operasi, efisiensi biofilter adalah 67% kemudian berangsur naik menjadi 86% pada hari ke 5. Kemudian kembali mengalami penurunan sampai 44% pada hari ke 9. Fase ini adalah masa penyesuaian kolom biofilter beroperasi. Nilai pH pada fase ini berkisar antara 7.78 – 7.99. Gambar 6d menunjukan kisaran nilai pH ini menunjukkan aktifitas bakteri yang sedang dalam tahap penyesuaian dengan aktifitas fisiko-kimiawi bahan pengisi, selain itu nilai pH ini menunjukkan bahwa telah diproduksinya nitrat sebagai hasil oksidasi amoniak oleh bakteri. Nitrat yang terbentuk pada hari ke-7 adalah 1918.70 ppm.
Fasa penyesuaian ini menunjukkan bahwa semua kondisi dalam keadaan baru. Pertumbuhan bakteri pengoksidasi amoniak sangat pesat, sehingga amoniak dapat teroksidasi dengan baik. Pembentukkan nitrat yang sangat tinggi terjadi pada hari ke-7.
Pada hari ke 10, konsentrasi inlet dinaikkan menjadi 1.04 ppm hingga 1.29 ppm pada hari ke 14. Efisiensi biofilter naik berkisar antara 93-96%. Pada fase ini Nitrosomonas sp. sedang melakukan aktifitas oksidasi
amoniak dengan baik sehingga terbentuk nitrat sebesar 80.30 ppm.
Pada hari ke 21, inlet ditambahkan 2.37 ppm. Bakteri sudah berada pada fase lisis, karena beban yang ditambahkan banyak tetapi bahan organik yang tersedia terlalu sedikit. Hal ini juga dibuktikan nitrat yang terbentuk cenderung menurun, yaitu 77.80 ppm, sehingga pH kolom cenderung basa. Demikian halnya pada hari ke 22, inlet yang ditambahkan sebesar 2.49 ppm. Suasana kolom lebih basa karena kondisi sebelumnya juga demikian. Nitrat yang terbentuk lebih sedikit, yaitu 74.32 ppm. Gambar 6c menunjukkan biofilter dengan bahan pengisi koral ini memiliki kapasitas penyerapan sebesar 0.53 g-N/kg-koral kering/hari.
0 0.2 0.4 0.6 0.8 1 0 2 4 6 8 10 12 14 16 18 20 22 P e ny e ra p a n ( g -N /k g b a ha n k e ri n g ) Inlet Outlet 6 6.5 7 7.5 8 8.5 9 0 7 14 17 21 23 Hari ke -pH L-1 L-2 L-3 0 0.5 1 1.5 2 2.5 3 3.5 0 2 4 6 8 10 12 14 16 18 20 22 K o n s e n tr asi N H 3 ( ppm ) 0 20 40 60 80 100 e fi s ie n s i ( % ) Inlet Outlet Efisiensi 0 500 1000 1500 2000 2500 0 2 4 6 8 10 12 14 16 18 20 22 N itr a t y a n g te rb e n tu k (p p m )
Gambar 6. Perubahan penyerapan gas NH3 oleh biofilter dengan bahan pengisi
koral dinokulasi dengan Nitrosomonas sp. (a) konsentrasi
inlet-outlet gas, (b) penyerapan NH3, (c) pembentukkan NO3-, (d)
perubahan nilai pH.
(a )
( b )
( c )
0 0.2 0.4 0.6 0.8 1 0 0.2 0.4 0.6 0.8 1
Beban (g-N/kg koral kering)
P e n y er a p a n ( g -N /k g ko ra l ke ri n g )
Biofilter koral yang dioperasikan selama 22 hari diberikan inlet dengan rentang konsentrasi antara 0.05 – 3.22 ppm, rentang outlet antara 0 – 0.1 ppm. Persen penghilangan amoniak berkisar antara 44 – 100%. Beban yang diberikan sebesar 0.01 – 0.95 g-N/kg-koral kering/hari. Gambar 7 menunjukkan kapasitas penyerapan bahan pengisi sebesar 0.53 g-N/kg-koral kering/hari.
2. Analisa Kinetika Biofilter
Kinetika dilakukan setelah hari ke 22 biofilter dioperasikan. Inlet NH3 yang diberikan pada jam pertama adalah 3.24 ppm seperti yang di
tunjukkan pada Gambar 8a, efisiensi biofilter bertahan 96%. Inlet selalu dinaikkan setiap 1 jam sekali. Efisiensi menurun 95% pada jam ke-3, dan terus menurun sampai dibawah 90% pada jam ke-5. Kemudian inlet ditambahkan konsentrasinya sampai 5.15 ppm dan efisiensi menurun hingga dibawah 69%. Nilai pH kolom pada kondisi ini adalah 8, bakteri
Nitrosomonas sp. tidak teridentifikasi, sehingga oksidasi terhadap amoniak
dilakukan oleh bakteri heterotrof.
Gambar 8. Analisa kinetika biofilter dengan bahan pengisi koral dinokulasi dengan Nitrosomonas sp. (a) perubahan konsentrasi inlet-outlet
selama kinetika, (b) analisis kinetika penghilangan NH3.
y = 666.45x + 2874.4 R2 = 0.8314 0 2500 5000 7500 10000 12500 15000 0 5 10 15 C ln C ln /R 0 5 10 15 20 25 30 35 1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 jam ke -K o n sen tr asi N H 3 ( ppm ) 0 10 20 30 40 50 60 70 80 90 100 ef is ie n s i inlet outlet efisiensi
Efisiensi terus-menerus turun hingga 55% pada jam ke-14, dengan penambahan konsentrasi inlet. Tetapi pada jam ke-15, efisiensi naik lagi hingga 85% dengan penambahan konsentrasi inlet sebesar 18.71 ppm. Nilai efisiensi terus berfluktuasi hingga mencapai 92% dengan konsentrasi inlet yang ditambahkan sebesar 8.99 ppm. Kemudian efisiensi mengalami penurunan sedikit demi sedikit hingga mencapai 75% pada jam ke-29, dengan penambahan inlet sebesar 6.82 ppm. Pada jam ke-33, efisiensi mengalami penurunan hingga 60%, tetapi naik lagi pada jam ke-34 efisiensi menjadi 83%, dengan inlet yang ditambahkan sebesar 12.92 ppm. Kemudian berangsur turun hingga efisiensi mencapai 39% pada jam ke-37, dengan inlet yang ditambahkan sebesar 31.40 ppm.
( b ) ( a )
Pada Gambar 8 b, telah diketahui nilai penghilangan amoniak maksimum, Vm, adalah 0.0015 g-N/kg koral kering/jam. Sedangkan nilai kejenuhan konstan biofilter, Ks, adalah 4.31 ppm.
3. Jumlah Sel Bakteri dan Kadar Air
Bakteri yang diinokulasikan adalah Nitrosomonas sp.. Gambar 9a,
menunjukkan perubahan jumlah bakteri Nitrosomonas sp. selama
dioperasikan. Aplikasi biofilter dilakukan dengan nilai logaritma jumlah bakteri H-0 pada lubang 1, lubang 2, lubang 3 adalah 7.54, 6.48, 5.48 sel/g-contoh. Metode MPN dilakukan untuk menghitung jumlah Nitrosomonas sp.
per tujuh hari.
Bakteri Nitrosomonas sp. dapat mengoksidasi amoniak menjadi
nitrit, kemudian bakteri Nitrobacter sp. akan mengoksidasi nitrit menjadi
nitrat. Pada kolom koral ini, secara umum bakteri Nitrosomonas sp.
mengalami kenaikan nilai logaritma jumlah selnya setelah biofilter beroperasi selama 7 hari. Gambar 9a memperlihatkan pertumbuhan bakteri
Nitrosomonas sp. Berturut-turut setelah hari ke tujuh, lubang 1, lubang 2,
lubang 3 adalah 7.60 sel/g-contoh, 3.60 sel/g-contoh, 7.60 sel/g-contoh. Hal ini didukung oleh kadar air yang memenuhi untuk pertumbuhan bakteri, dimana berturut-turut lubang 1, lubang 2, lubang 3 adalah 20.79 %, 22.90 %, 22.79 % pada H-0 dan 10.21 %, 11.20 %, 12.50 % pada hari ke tujuh. Hal ini ditunjukkan pada Gambar 9c.
Pada hari ke 14, nilai logaritma jumlah sel Nitrosomonas sp.
cenderung naik pada lubang 1, lubang 2, lubang 3 menjadi 10.04 sel/g-contoh, 8.40 sel/g-sel/g-contoh, 8.81 sel/g-contoh. Meskipun kadar air bahan cenderung turun, karena bahan pengisi ini tidak bisa berfungsi optimal dalam menyerap air, tetapi bakteri cenderung naik dengan nilai logaritma jumlah sel berturut-turut adalah 10.04 sel/g-contoh, 8.40 sel/g-contoh, 8.81 sel/g-contoh. Hal ini menunjukkan fenomena terjadinya oksidasi amoniak menjadi nitrat oleh Nitrosomonas sp., sehingga jumlah sel Nitrosomonas sp.
tidak membuat bakteri kemudian mati karena kadar air bahan sangat membantu metabolisme bakteri sehingga membuat bakteri pengoksidasi amoniak ini hidup. Hal ini dibuktikan dengan nilai pH pada hari ke-7 yang cenderung basa kemudian pada hari ke-14 menjadi netral kembali.
Pada hari ke-21 dan 22, jumlah sel tidak diketahui karena gagal analisa. Nilai pH pada hari ke-21 ini cenderung naik dan mendekati basa, berturut-turut lubang 1, lubang 2, lubang 3 adalah 7.8, 7.1, 7.86. Kadar air yang sengaja dinaikkan ini membuat kondisi biofilm pada bahan pengisi menipis, karena terjadi proses pencucian, hal ini yang mengakibatkan proses oksidasi amoniak tidak berlangsung dengan baik. Pada hari ke 22, kadar air ditambah menjadi 20.53 % pada lubang 1, 20.16 % pada lubang 2, 23.04 % pada lubang 3. Nilai pH menjadi naik berturut-turut adalah 7.90, 8, 8.
Bakteri pengoksidasi amoniak diduga tidak saja Nitrosomonas sp.
tetapi ada bakteri heterotrof yang mendegradasi polutan ini. Oleh karena itu, bakteri yang tumbuh secara heterotrof pun dihitung jumlahnya, agar diketahui jumlah bakteri pendukung oksidasi amoniak yang lain. Gambar 9b memperlihatkan pertumbuhan sel bakteri heterotrof pada kolom biofilter selama dioperasikan.
Pada H-0, nilai logaritma jumlah sel bakteri ini berturut-turut lubang 1, lubang 2, lubang 3 adalah 7.48 contoh, 4.48 contoh, 7 cfu/g-contoh. Setelah hari ke tujuh, nilai logaritma jumlah sel bakteri berturut-turut adalah 6 cfu/g-contoh, 6.48 cfu/g-contoh, 6 cfu/g-contoh, kemudian pada hari ke 21 dan 22 bakteri cenderung turun pada lubang 1 dan lubang 2, tetapi cenderung naik pada lubang 3, karena bakteri tidak tersuspensi pada bahan pengisi tetapi hanya menempel, sehingga kemungkinan untuk luruh ke bagian bawah sangat mudah.
0 2 4 6 8 10 12 0 7 14 21 N ila i Loga ri tm a J u m la h S e l N it ros om ona s L-1 L-2 L-3 0 1 2 3 4 5 6 7 8 0 7 14 21 N il a i L o g a rit m a J u m la h S e l H e te ro tr o f L-1 L-2 L-3 4. Pengamatan pH
Perubahan pH dalam biofilter ditunjukkan pada Gambar 6d. Pengamatan pH dilakukan untuk mengetahui perubahan keasaman bahan pengisi biofilter. Rata-rata pH awal koral adalah 7.99. Kondisi pH diatur Gambar 9. Perubahan jumlah sel bakteri pengoksidasi NH3 selama
pengoperasian biofilter koral. (a) grafik pertumbuhan untuk
Nitrosomonas sp., (b) grafik pertumbuhan untuk bakteri
heterotrof., (c) kadar air, L-1 : lubang 1, L-2 : lubang 2, L-3 : lubang 3 (b) (c) 0 5 10 15 20 25 0 7 14 21 Hari ke -Ka d a r Ai r (% ) L-1 L-2 L-3 (a )
agar selalu berada dalam rentang 6-8, karena Nitrosomonas sp. dapat
tumbuh dengan baik pada rentang pH tersebut.
Nilai pH awal lubang 1, lubang 2, lubang 3 berturut-turut adalah 7.91, 7.97, 8.1. Kondisi ini berubah dengan adanya akumulasi inlet dalam bahan. Setelah hari ke-7, pH lubang 1, lubang 2, lubang 3 berturut-turut adalah 8.79, 8.43, 8.36. Kemudian pada hari ke-14, pH turun, berturut-turut 7.75, 7.75, 7.83. Demikian halnya pada hari ke-17, berturut-turut pH biofilter adalah 7.77, 7.04, 7.88. Pada hari ke-21, pH biofilter masih netral. Berturut-turut lubang 1, lubang 2, lubang 3 adalah 7.8, 7.1, 7.86.
Penurunan pH ini mengindikasikan tumbuhnya bakteri pengoksidasi amoniak. Amoniak yang bersifat basa akan dioksidasi menjadi nitrit yang bersifat asam. Asam nitrit ini akan dioksidasi menjadi nitrat yang bersifat asam pula. Selain itu karena adanya pengaruh bahan pengisi koral yang mengandung ion Ca2+ dari bahan pengisi koral. Menurut Spotte
et al.,
(1970) jika kapur CaCO3 ditambahkan ke dalam air akan terjadi reaksi
dengan CO2 bebas dan membentuk ion bikarbonat Ca(HCO3)2 yang
merupakan buffer utama serta mampu menetralkan setiap penambahan CO2.
Bear (1917) menambahkan, adanya sistem buffer yang dapat menjaga terjadinya perubahan pH selama berlangsungnya proses oksidasi limbah organik.
C. BIOFILTER ARANG AKTIF
1. Kinerja Penghilangan Amoniak
Secara umum, kolom arang aktif memiliki efisiensi kurang dari 95% seperti yang di tunjukkan pada Gambar 10a. Konsentrasi inlet awal amoniak yang ditambahkan 0.33 ppm, kolom mempunyai efisiensi 82 %. Kemudian konsentrasi dinaikkan sampai 0.24 ppm, efisiensi berangsur naik menjadi 90%, namun setelah itu efisiensi berfluktuasi dari 42-86%, dengan konsentrasi inlet berkisar antara 0.26 – 0.27 ppm. Nitrat yang terbentuk karena oksidasi amoniak adalah 2111.60 ppm. Nilai ini mengalami kenaikan