pengukuran nilai BOD pada air
KEBUTUHAN OKSIGEN BIOKIMIAWI (BOD) I. MAKSUD DAN TUJUANa. Maksud
Metode pengukuran ini dimaksudkan mengukur Kebutuhan Oksigen Biokimiawi (KOB/BOD) dalam air. b. Tujuan
Tujuan metode pengukuran ini adalah untuk memperoleh kadar KOB/BOD dalam air.
II. PERALATAN DAN BAHAN a. Peralatan
Peralatan yang digunakan terdiri atas:
1) Lemari pengeram KOB dengan kisaran suhu -10 hingga 50ºC dan stabilkan pada suhu 20ºC pada saat pengukuran;
2) Botol KOB 300 mL; 3) Aerator;
4) Gelas ukur 1000 mL; 5) Gelas piala 2000 mL;
6) Peralatan untuk pengukuran oksigen terlarut sesuai dengan SNI 06-6989.14.2004 b. Bahan
Bahan kimia yang berkualitas p.a dan bahan lain yang digunakan pengukuran ini terdiri atas: 1) Larutan pengencer;
2) Larutan natrium hidroksida (NaOH) 0,1 N; 3) Larutan asam sulfat (H2SO4) 0,1 N; 4) Larutan natrium sulfit (Na2SO3) 0,025 N.
III. DASAR TEORI
Kebutuhan oksigen biologi (BOD) didefinisikan sebagai banyaknya oksigen yang diperlukan oleh organisme pada saat pemecahan bahan organik. Pada kondisi aerobic, pemecahan bahan organik diartikan bahwa bahan organik ini digunakan oleh organisme sebagai bahan makanan dan energinya diperoleh dari proses oksidasi
(PESCOD,1973). Parameter BOD, secara umum banyak dipakai untuk menentukan tingkat pencemaran air buangan. Sehingga makin banyak bahan organik dalam air, makin besar BOD nya sedangkan DO akan makin rendah. Air yang bersih adalah yang BOD nya kurang dari 1 mg/l atau 1 ppm, jika BOD nya di atas 4 ppm, air dikatakan tercemar. Penentuan BOD sangat penting untuk menelusuri aliran pencemaran dari tingkat hulu ke muara. Sesungguhnya penentuan BOD merupakan suatu prosedur bioassay yang menyangkut pengukuran banyaknya oksigen yang digunakan oleh organisme selama organisme tersebut menguraikan bahan organik yang ada dalam suatu perairan, pada kondisi yang harnpir sama dengan kondisi yang ada di alam. Selama
pemeriksaan BOD, contoh yang diperiksa harus bebas dari udara luar untuk rnencegah kontaminasi dari oksigen yang ada di udara bebas. Konsentrasi air buangan/sampel tersebut juga harus berada pada suatu tingkat pencemaran tertentu, Hal ini untuk menjaga supaya oksigen terlarut selalu ada selama pemeriksaan. Hal ini penting diperhatikan mengingat kelarutan oksigen dalam air terbatas dan hanya berkisar ± 9 ppm pada suhu 20°C. Penguraian bahan organik secara biologis di alam, melibatkan bermacam-macam organisme dan menyangkut reaksi oksidasi dengan hasil akhir karbon dioksida (CO2) dan air (H2O). Pemeriksaan BOD tersebut dianggap sebagai suatu prosedur oksidasi dimana organisme hidup bertindak sebagai medium untuk
menguraikan bahan organik menjadi CO2 dan H2O. Reaksi oksidasi selama pemeriksaan BOD merupakan hasil dari aktifitas biologis dengan kecepatan reaksi yang berlangsung sangat dipengaruhi oleh jumlah populasi dan suhu. Karenanya selama pemeriksaan BOD, suhu harus diusahakan konstan pada 20°C yang merupakan suhu yang umum di alam. Secara teoritis, waktu yang diperlukan untuk proses oksidasi yang sempurna sehingga bahan organik terurai menjadi CO2 dan H2O adalah tidak terbatas. Dalam prakteknya dilaboratoriurn, biasanya berlangsung selama 5 hari dengan anggapan bahwa selama waktu itu persentase reaksi cukup besar dari total BOD. Nilai BOD 5 hari merupakan bagian dari total BOD dan nilai BOD 5 hari merupakan 70 – 80% dari nilai BOD total (SAWYER & MC CARTY, 1978). Penentuan waktu inkubasi adalah 5 hari, dapat mengurangi kemungkinan hasil oksidasi ammonia (NH3) yang cukup tinggi. Sebagaimana diketahui bahwa, ammonia sebagai hasil sampingan ini dapat dioksidasi menjadi nitrit dan nitrat, sehingga dapat mempengaruhi hasil penentuan BOD. Reaksi kimia yang dapat terjadi adalah :
2NH3 + 3O2 2NO2 - + 2H+ + 2H2O 2NO2 + O2 2 NO3
-Oksidasi nitrogen anorganik ini memerlukan oksigen terlarut, sehingga perlu diperhitungkan.
Dalam praktek untuk penentuan BOD yang berdasarkan pada pemeriksaan oksigen terlarut (DO), biasanya dilakukan secara langsung atau dengan cara pengenceran. Prosedur secara umum adalah menyesuaikan sampel pada suhu 20°C dan mengalirkan oksigen atau udara kedalam air untuk memperbesar kadar oksigen terlarut dan mengurangi gas yang terlarut, sehingga sampel mendekati kejenuhan oksigen terlarut. Dengan cara pengenceran pengukuran BOD didasarkan atas kecepatan degradasi biokimia bahan organik yang berbanding langsung dengan banyaknya zat yang tidak teroksidasi pada saat tertentu. Kecepatan dimana oksigen yang digunakan dalam pengenceran sampel berbanding lurus dengan persentase sampel yang ada dalam pengenceran dengan anggaapan faktor lainnya adalah konstan. Sebagai contoh adalah 10 % pengenceran akan menggunakan sepersepuluh dari kecepatan penggunaan sampel 100% (SAWYER & MC CARTY, 1978). Dalam hal dilakukan pengenceran, kualitas aimya perlu diperhatikan dan secara umum yang dipakai aquades yang telah mengalami demineralisasi. Untuk analisis air laut, pengencer yang digunakan adalah standard sea water (SSW). Derajat keasaman (pH) air pengencer biasanya berkisar antara 6,5 – 8,5 dan untuk menjaga agar pH-nya konstan bisa digunakan larutan penyangga (buffer) fosfat. Untuk menentukan BOD, terlebih dahulu diukur DO nya (DO 0 hari), sementara sampel yang lainnya diinkubasi selama 5 hari pada suhu 20°C, selanjutnya setelah 5 hari diukur DO nya (DO 5 hari). Kadar BOD ditentukan dengan rumus :
5 X [ kadar { DO(0 hari) - DO (5 hari) }] ppm
Selama penentuan oksigen terlarut, baik untuk DO maupun BOD, diusahakan seminimal mungkin larutan sampai yang akan diperiksa tidak berkontak dengan udara bebas. Khusus untuk penentuan BOD, sebaiknya digunakan botol sampel BOD dengan volume 250 ml dan semua isinya dititrasi secara langsung. Perhitungan kadar DO nya : DO,ml/L = B/B -2 x 5,6 x 10 x N x V
Dimana :
B = volume botol sampel BOD = 250 ml
B – 2 = volume air dalam botol sampel setelah ditambah 1 ml MnCl2 dan 1 ml NaOH-KI. 5,6 = konstanta yang sama dengan ml oksigen ~ 1 mgrek tiosulfat
10 = volume K2Cr2O7 0,01 N yang ditambahkan N = normalitas tiosulfat
V = volume tiosulfat yang dibutuhkan untuk titrasi.
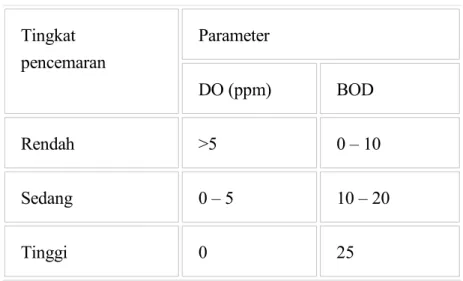
Berikut ini adalah tabel nilai DO dan BOD untuk tingkat pencemaran perairan
Tabel 1. Tingkat pencemaran perairan berdasarkan nilai DO dan BOD
Sumber : WIROSARJONO (1974)
Berdasarkan PP no 82 tahun 2001 pasal 8 tentang Pengelolaan Lingkungan Hidup, klasifikasi dan kriteria mutu air ditetapkan menjadi 4 kelas yaitu:
Kelas 1 : yaitu air yang dapat digunakan untuk bahan baku air minum atau peruntukan lainnya mempersyaratkan mutu air yang sama
Kelas 2 : air yang dapat digunakan untuk prasarana/ sarana rekreasi air, budidaya ikan air tawar, peternakan, dan pertanian
Kelas 3 : air yang dapat digunakan untuk budidaya ikan air tawar, peternakan dan pertanian Kelas 4 : air yang dapat digunakan untuk mengairi pertanaman/ pertanian
Beberapa parameter yang digunakan untuk menentukan kualitas air diantaranya adalah :
-
DO (Dissolved Oxygen)
-
BOD (Biochemical Oxygen Demand)
Tingkat
pencemaran
Parameter
DO (ppm)
BOD
Rendah
>5
0 – 10
Sedang
0 – 5
10 – 20
Tinggi
0
25
-
COD (Chemical Oxygen Demad), dan
-
Jumlah total Zat terlarut
IV. PERSIAPAN DAN PENGUKURANa. Persiapan Contoh/sampel
1) Sample yang bersifat asam atau basa harus dinetralkan sampai pada pH 7,0 ± 0,1 dengan menggunakan asam atau basa.
2) Sampel yang diduga mengandung sisa klor aktip (yang dapat menghalangi proses mikrobiologi) harus ditentukan konsentrasi klor aktipnya. Per mol klor aktip yang dikandung sampel, dibutuhkan satu mol zat pereaksi seperti Na2SO3
3) Sampel yang diduga mengandung zat beracun.
4) Sampel yang mengandung oksigen melebihi kejenuhannya (terlalu jenuh), misalnya lenih dari 9 mg O2 / l pada 20ºC, perlu diturunkan kadar oksigennya dengan cara pengocokan. Keadaan tersebut dapat terjadi pada sampel yang ditumbuhi ganggang.
5) Pengenceran sampel:
Oleh karena jumlah oksegen dalam botol terbatas, maksimum 9 mg/L tersedia, dan sebaiknya oksigen terlarut pada masa akhir masa inkubasi antara 3-6 mg O2/L, maka sampel perlu diencerkan.
b. Cara Pengukuran
Pengukuran kadar KOB/BOD dengan tahapan sebagai berikut:
a. Mengambil sampel air sebanyak 500 mL diencerkan di beaker glass dengan air suling yang sudah diaerasi selama 2 jam sehihingga volumenya menjadi 2000 mL.
b. Membagi sample menjadi 6 botol winkler dan botol winkler diberi nama. Misalnya BOD hari ke 0, BOD hari ke 1 dan seterusnya sampai hari ke 5.
c. Menambahkan 1 ml MnSO4 dan 1 ml alkali iodide azida ke dalam botol winkler BOD hari ke 0, sementara itu ke 5 botol winkler lainnya dimasukkan ke dalam inkubator.
d. Menutup botol winkler BOD hari ke 0 dan menghomogenkan hingga terbentuk gumpalan yang sempurna. e. Membiarkan gumpalan mengendap 5 menit sampai 10 menit.
f. Menambahkan 5 ml H2SO4 pekat, menutup dan menghomogenkan hingga endapan larut sempurna. g. Mengambil 50 ml sampel dengan pipet dan memasukkannya ke dalam Erlenmeyer 150 ml
h. Meneteskan indikator amilum/ kanji berwarna biru kemudian menitrasi sampel dengan Na2SO3 sampai warna biru tepat hilang dan mencatan volume Na2SO3 yang terpakai.
i. Botol winkler selanjutnya diukur nilai DO nya seperti tahapan d-h.
V. PENGOLAHAN DATA
Data yang didapat dari praktikum ini adalah volume natrium thiosulfat dari hari ke 0 sampai hari ke 5 disajikan dalam table berikut :
hari
ke
volume
Na2SO3
0
0.4 mL
1
0.3 mL
2
0.25 mL
3
0.2 mL
4
0.3 mL
5
0.15 mL
V1N1 = V2N2 N1 == 6,44 gr/mL
Untuk nilai DO1 sampai DO4 dapat dilihat pada table dibawah dan dihitung menggunakan rumus yang sama dengan DO0
DO
T
v
c
ln c
0
1
0.4
6.44
1.863
1
2
0.3
4.83
1.575
2
3
0.25
4.03
1.394
3
4
0.2
3.22
1.169
4
5
0.3
4.83
1.575
5
6
0.21
3.39
1.221
7
8
0.15
2.42
0.884
Dari tabel perhitungan diatas maka didapat grafik seperti dibawah ini
Maka, nilai k = 0,0982 dan ln c0 = 1,8098
VI. Analisa
a. Analisa Praktikum
Praktikum ini bertujuan untuk mengukur kebutuhan oksigen biokimiawi dari suatu sampel air. Sebelum memulai praktikum, praktikan diharuskan untuk mempersiapkan alat. Alat yang digunakan harus benar-benar bersih dan tidak terdapat sisa-sisa zat lain.
Langkah selanjutnya praktikan mengambil 500 mL air sample dan memasukkan sampel ke dalam beaker glass kemudian sampel dicampurkan dengan 1500 mL air suling yang telah diaerasi selama 2 jam dan dihomogenkan agar air sampel dan air suling yang sudah diaerasi bercampur sempurna. Setelah itu, sample dalam beaker glass
dibagi ke dalam 6 winkler yang diisi sampai penuh. Hal ini bertujuan agar tidak ada udara yang masuk ke dalam tabung winkler yang nantinya akan mempengaruhi besarnya DO dalam air. 6 botol winkler yang sudah diisi dengan sample diberi label bertuliskan BOD hari ke 0 sampai BOD hari ke 5.
Sampel pada botol winkler BOD hari ke 0 dihitung nilai DO nya dan 5 botol winkler lain dimasukkan ke dalam inkubator yang suhunya dijaga sebesar 20ºC. Pada botol winkler hari ke 0 dimasukkan 1ml MnSO4 dan 1 ml alkali iodida azida langsung ditutup agar oksigen dalam botol winkler tidak terpengaruh oleh udara luar dan
dihomogenkan. Setelah itu, larutan sampel ditunggu sampai gumpalan dalam sampel mengendap sempurna dalam waktu 5 – 10 menit. Penambahan iodide azida akan menhasilkan endapan coklat yang berarti bahwa oksigen dalam sample telah terikat sehingga dapat diukur besarnya. Oksigen yang terdapat didalam larutan sampel akan mengoksidasi MnSO4 yang ditambahkan ke dalam larutan, sehingga di dalam larutan akan terjadi endapan MnO2. Setelah itu dimasukkan 1 mL H2SO4 dan dihomogenkan sampai semua gumpalan dalam botol winkler menghilang. Penambahan asam sulfat ke dalam larutan sampel dan kalium iodide akan membebaskan iodine yang ekuivalen dengan oksigen terlarut di dalam larutan sampel. Iodine yang dibebaskan akan dianalisa dengan titrasi iodometris yaitu dengan larutan standar thiosulfat.
Langkah selanjutnya mengambil 50 mL sampel dan dimasukkan ke dalam tabung Erlenmeyer dan ditambahkan beberapa tetes indikator amilum sampai sample berwarna biru. Warna biru ini menunjukkan bahwa di dalam sampel terdapat oksigen terlarut. Setelah itu, sample dititrasi menggunakan natruim thiosulfat Na2SO3 sampai warna biru tepat hilang dan kemudian praktikan mencatat volume thiosulfat yang digunakan. Volume thiosulfat yang digunakan dalam titrasi inilah yang dianggap sebagai volume oksigen terlarut dalam sampel tersebut. Pada hari-hari selanjutnya yaitu hari ke 1 sampai hari ke 5, botol winkler dikeluarkan dari dalam inkubator dan praktikan mengukur nilai DO dari botol ini. Tahapan kerja yang dilakukan sama halnya dengan yang dilakukan pada botol winkler hari ke 0. Kemudian praktikan mencatat volume thiosulfat yang digunakan pada saat titrasi untuk mendapatkan nilai BOD dari sampel ini.
Reaksi pada percobaan pengukuran BOD ini tidak berbeda dengan yang terjadi pada percobaan DO. Sehinggan reaksi yang terjadi adalah sebagai berikut:
(1) MnSO4 + 2KOH Mn(OH)2 + K2SO4 (2) Mn(OH)2 + ½ O2 MnO2 + H2O
(3) MnO2 + KI + 2 H2O Mn(OH)2 + I2 + 2KOH (4) I2 + 2S2O32- S4O6- + 2I
-b. Analisa hasil
Volume titrasi larutan thiosulfat yang didapat dari hari ke 0 sampai hari ke 5 dapat dilihat dari table berikut ini
hari
ke
volume
Na2SO3
0
0.4 mL
1
0.3 mL
2
0.25 mL
3
0.2 mL
4
0.3 mL
7
0.15 mL
Setelah dari perhitungan maka didapat nilai BOD dengan menggunakan rumus
Dan didapat besarnya nilai BOD sebesar 3.05 gr/mL
Menurut tabel tingkat pencemaran perairan berdasarkan nilai DO dan BOD, air sampel yang memiliki nilai BOD sebesar 3.05 gr/mL ini dapat dikategorikan sebagai air dengan tingkat pencemaran yang rendah. Mungkin pada tempat dimana sampel ini diambil belum banyak pencemaran yang terjadi sehingga nilai BOD pun berkisar antara 0-10 gr/Ml.
Dalam grafik yang disajukan dalam perhitungan, seharusnya nilai DO makin lama makin kecil dan ketika
perhitungan nilai DO pada hari ke 5 nilai oksigen terlarutnya sudah tetap. Hal ini disebabkan oleh aktifitas bakteri yang yang menurun setiap harinya dan berhenti pada hari ke 5
c. Analisa kesalahan
•
Kesalahan dalam mengambil volume sampel, kurang teliti dalam membaca volume dari larutan yang akan dimasukkan ke dalam sampel dan juga kuranh teliti dalam membaca volume thiosulfat yang digunakan dalam titrasi.•
Kesalahan praktikan dalam melakukan titrasi thiosulfat sehingga volume yang tercatat bisa berlebih dari yang seharusnya.VII. KESIMPULAN
•
Untuk menghitung besarnya nilai BOD dari suatu sampel air dilakukan dengan mengitung besarnya nilai DO dari hari ke 0 sampai hari ke 5. Kemudian mengurangi nilai DO hari ke 0 denagn nilai DO hari ke 5•
Besar nilai BOD yang didapat dari pengukuran sampel ini sebesar 3.05 gr/mL.•
Menurut tabel tingkat pencemaran perairan berdasarkan nilai DO dan BOD, air sampel yang memiliki nilai BOD sebesar 3.05 gr/mL ini dapat dikategorikan sebagai air dengan tingkat pencemaran yang rendah.VIII. REFERENSI
www.wikipedia.org diunduh pada tanggal 6 April 2010