KATA PENGANTAR
Puji dan Syukur kami panjatkan ke Hadirat Tuhan Yang Maha Esa, karena berkat limpahan Rahmat dan Karunia-nya sehingga kami dapat menyusun makalah ini dengan baik dan tepat pada waktunya. Dalam makalah ini kami menyajikan tentang alat-alat instrument seperti FTIR, GC, GC-MS, dan HPLC.
Makalah ini dibuat dari berbaga sumber dan beberapa bantuan dari berbagai pihak untuk membantu menyelesaikan tantangan dan hambatan selama mengerjakan makalah ini. Oleh karena itu, kami mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak yang telah membantu dalam penyusunan makalah ini.
Kami menyadari bahwa masih banyak kekurangan yang mendasar pada makalah ini. Oleh karena itu kami mengundang pembaca untuk memberikan saran serta kritik yang dapat membangun kami. Kritik konstruktif dari pembaca sangat kami harapkan untuk penyempurnaan makalah selanjutnya.
Akhir kata kami berharap semoga makalah ini dapat memberikan manfaat maupun inpirasi terhadap pembaca.
Bogor, July 2016
DAFTAR ISI
KATA PENGANTAR... 1 DAFTAR ISI... 2 PENDAHULUAN... 4FTIR (FOURIER TRANSFORM INFRA RED)...5
PENDAHULUAN... 5
INSTRUMENTASI...7
JENIS SAMPEL...11
METODE PREPARASI SAMPEL...11
METODE ANALISIS...12
METODE PENGOLAHAN DATA HASIL ANALISIS...14
GC (GAS CHROMATOGRAPHY)...16
PENDAHULUAN...16
PRINSIP... 17
INSTRUMENTASI...18
JENIS SAMPEL...26
METODE PREPARASI SAMPEL...27
METODE ANALISIS...29
METODE PENGOLAHAN DATA HASIL ANALISIS...30
GC-MS... 32
PENDAHULUAN...32
PRINSIP... 32
INSTRUMENTASI...33
JENIS SAMPEL...37
METODE PREPARASI SAMPEL...37
METODE ANALISIS...38
METODE PENGOLAHAN DATA HASIL ANALISIS...38
HPLC (HIGH PERFORMANCE LIQUID CHROMATOGRAPHY)...41
PENDAHULUAN...41 PRINSIP... 43 Prinsip dasar HPLC...43 Prinsip kerja HPLC...43 INSTRUMENTASI...44 JENIS SAMPEL...48
METODE PREPARASI SAMPEL...48
METODE ANALISIS...49
METODE PENGOLAHAN DATA HASIL ANALISIS...50
PENDAHULUAN
Kromatografi adalah suatu teknik pemisahan molekul berdasarkan perbedaan pola pergerakan antara fase gerak dan fase diam untuk memisahkan komponen (berupa molekul) yang berada pada larutan. Molekul yang terlarut dalam fase gerak, akan melewati kolom yang merupakan fase diam.Tswett adalah penemu kromatografi pada tahun 1903. Perkembangan kromatografi antara lain:
a. kromatografi cair-padat (KCP).
b. Kemudian, pada akhir tahun 1930an dan pada awal tahun 1940an, cara ini mulai berkembang. Dasar kromatografi lapis tipis (KLT) diletakkan oleh Izmailov.
c. Schraiber pada tahun 1938, dan kemudian diperhalus oleh Stahl pada tahun 1958. Karya Martin dan Synge yang pada tahun 1041 membuahkan hadian Nobel, tidak hanya merevolusikan kromatografi cair, tetapi juga secara umum meletakkan landasan bagi perkembangan kromatografi gas dan kromatografi kertas.
d. Pada tahun 1952, Martindan James mempublikasikan makalah pertamanya mengenaim kromatografi gas. Antara tahun 1952 dan akhir tahun 1960 an kromatografi gas berkembang menjadi alat analisis yang canggih.
e. Hal ini menjadi dasar ditemukannya kromatografi yang canggih yaitu kromatografi cair kinerja tinggi (High Perfomance Liquid Chromatografi).
Kromatografi dibedakan menjadi 2 jenis yaitu:
Kromatografi cair (Liquid Chromatography) merupakan teknik yang tepat untuk memisahkan ion atau molekul yang terlarut dalam suatu larutan. Terdapat beberapa jenis kromatografi cair, diantaranya: reverse phase chromatography, High Performance Liquid Chromatography (HPLC), size exclusion chromatography, serta supercritical fluid chromatography.
Reverse phase chromatography merupakan alat analitikal yang kuat dengan memadukan sifat hidrofobik serta rendahnya polaritas fase stasioner yang terikat secara kimia pada padatan inert seperti silika.
High performance liquid chromatography (HPLC) mempunyai prinsip yang mirip dengan reverse phase. Hanya saja dalam metode ini, digunakan tekanan dan kecepatan yang tinggi.
Size exclusion chromatography atau yang dikenal juga dengan gel permeation atau filtration chromatography biasa digunakan untuk memisahkan dan memurnikan protein.
Kromatografi pertukaran ion (ion-exchange chromatography) biasa digunakan untuk pemurnian materi biologis, seperti asam amino, peptida, protein.
FTIR (FOURIER TRANSFORM INFRA RED)
PENDAHULUAN
FTIR merupakan singkatan dari Forier Transform Infra Red. Dimana FTIR ini adalah teknik yang digunakan untuk mendapatkan spektrum inframerah dari absorbansi, emisi, fotokonduktivitas atau Raman Scattering dari sampel padat, cair, dan gas. Karakterisasi dengan menggunakan FTIR bertujuan untuk mengetahui jenis-jenis vibrasi antar atom. FTIR juga digunakan untuk menganalisa senyawa organik dan anorganik serta analisa kualitatif dan analisa kuantitatif dengan melihat kekuatan absorpsi senyawa pada panjang gelombang tertentu (Hindrayawati, 2010; Mujiyanti dkk, 2010).
PRINSIP
Spectroscopy FTIR menggunakan sistem optik dengan laser yang berfungsi sebagai
sumber radiasi yang kemudian diinterferensikan oleh radiasi inframerah agar sinyal radiasi yang diterima oleh detektor memiliki kualitas yang baik dan bersifat utuh (Giwangkara,2006). Prinsip kerja FTIR berupa infrared yang melewati celah kesampel, dimana celah tersebut berfungsi mengontrol jumlah energi ysng disampaikan kepada sampel. Kemudian beberapa
infrared diserap oleh sampel dan yang lainnya ditransmisikan melalui permukaan sampel sehingga sinar infrared lolos ke detektor dan sinyal yang terukur kemudian dikirim kekomputer seperti yang ditunjukkan pada Gambar 3 dibawah ini (Thermo, 2001)
Prinsip kerja spektroskopi FTIR adalah adanya interaksi energi dengan materi.Fourier mengemukakan deret persamaan gelombang elektronik sebagai :
f(t) = a0 + a1 cos w0t + a2 cos 2w0t + … + b1 cos w0t + b2 cos 2w0t dimana :
- a dan b merupakan suatu tetapan - t adalah waktu
- ω adalah frekwensi sudut (radian per detik) ( ω = 2 Π f dan f adalah frekwensi dalam Hertz)
Atom-atom dalam suatu molekul tidak diam melainkan bervibrasi. Bila radiasi infra merah yang kisaran energinya sesuai dengan frekuensi vibrasi rentangan (stretching) dan
vibrasi bengkokan (bending) dari ikatan kovalen dalam kebanyakan molekul dilewatkan dalam suatu cuplikan, maka molektul-molekul akan menyerap energi tersebut dan terjadi transisi diantara tingkat energi vibrasidasar dan tingkat vibrasi tereksitasi (Hendayana, dkk., 1994). Namun demikian tidak semua ikatan dalam molekul dapat menyerap energi infra merah meskipun mempunyai frekuensi radiasi sesuai dengan gerakan ikatan. Hanya ikatan yang mempunyai momen dipol dapat menyerap radiasi infra merah (Sastrohamidjojo, 1992). Umumnya daerah radiasi infra merah (IR) terbagi dalam daerah IR dekat (14290-4000 cm-1), IR jauh (700-200 cm-1) dan IR tengah (4000-666 cm-1). Daerah yang paling banyak digunakan untuk keperluan penyidikan terbatas pada daerah IR tengah. Hukum Hooke dapat memperkirakan daerah dimana vibrasi terjadi.
´
ѵ
=
1
2
πc
√
K
(
m
1+
m
2)
m
1m
2 atau´
ѵ
=4,12
√
K
µ
Dimana: ´ ѵ = jumlah gelombang (cm-1) c = kecepatan cahaya (ms-1) m1 = massa atom 1 (g) m1 = massa atom 2 (g)K = tetapan gaya (dyne cm-1 = g s-2)
m
1+¿m2µ
=
m
1m
2¿
Posisi relatif suatu atom dengan atom lainnya dalam suatu molekul selalu berubah-ubah akibat dari gerakan vibrasi. Untuk molekul dwiatom atau tri-atom, vibrasi berhubungan dengan energi absorpsi, namun untuk poliatom vibrasi tidak mudah diperkirakan karena banyaknya pusat vibrasi yang berinteraksi. Adapun cara vibrasi untuk molekul poliatom dapat dikelompokkan untuk molekul linier dan molekul non linier. Vibrasi fundamental untuk molekul linier = 3n – 5, sedangkan untuk molekul non linier = 3n – 6, dengan n = banyaknya atom.
Analisis menggunakan spektrometer FTIR memiliki beberapa kelebihan utama dibandingkan dengan metode konvensional yaitu:
a Dapat digunakan pada semua frekuensi dari sumber cahaya secara simultan, sehingga analisis dapat dilakukan lebih cepat dari pada menggunakan cara scanning.
b Sensitivitas FTIR adalah 80-200 kali lebih tinggi dari instrumentasi dispersi standar karena resolusinya lebih tinggi (Razi, 2012). Sensitifitas dari metoda Spektrofotometri FTIR lebih besar dari pada cara dispersi, sebab radiasi yang masuk ke sistim detektor lebih banyak karena tanpa harus melalui celah (slitless) (Giwangkara S, 2012).
c Pada FTIR, mekanik optik lebih sederhana dengan sedikit komponen yang bergerak dibanding spektroskopi infra merah lainnya, dapat mengidentifikasi meterial yang belum diketahui, serta dapat menentukan kualitas dan jumlah komponen sebuah sampel (Hamdila, 2012).
INSTRUMENTASI
x 4
1
2 Keterangan :
1. Sumber cahaya IR polikromatik
2. Beam splitter
5 3. Cermin tetap (Cermin 1)
4. Cermin dapat digerakkan naik/turun (Cermin 2)
5. Sampel
6 6. Detektor dengan PMT
(Photomultiplier)
Beam Splitter
Beam splitter digunakan untuk memecah dan menyatukan kembali berkas sinar karena sifatnya dapat meneruskan (transmisi) dan memantulkan (refleksi) sinar yang mengenainya. Berkas sinar hasil penggambungan dan 2 berkas yang telah
dipecah akan terjadi interferensi dengan menvariasi jarak tempuh berkas dengan mengubah posisi cermin 2 menjauh dan mendekat.
Cermin Datar
Cermin datar berjumlah 2 buah digunakan untuk memantulkan dari beam splitter kembali ke beam splitter lagi untuk digabung agar terjadi proses interferensi gelombang cahaya. Salah satu cermin (cermin 1) dapat digerakkan mendekati atau menjauhi beam splitter, sedangkan cermin yang lain (cermin 2) dibuat tetap. Ukuran cermin ini disesuaikan dengan lebar cahaya yang terbentuk yaitu dengan bentuk lingkaran dengan diameter sekitar 5 cm.
Perancangan Perangkat Elektronika
Rangkaian elektronik terdiri dari beberapa bagian utama, yaitu power supply
sebagai penyedia tegangan pada semua perangkat elektronik, penguat tegangan pada detektor IR, ADC (Analog to Digital Converter) 0804 untuk mengubah data analog dari detektor menjadi data digital.
Perancangan sistem peralatan secara keseluruhan pada penelitian ini dapat digambarkan lagi menurut jenis sinyal yang dihasilkan seperti pada gambar 4.
Keterangan jalur keluaran tiap bagian sistem peralatan yaitu sumber cahaya IR menghasilkan cahaya polikromatik daerah inframerah, setelah melewati interferometer diubah menjadi sinyal interferogram, sinyal tersebut diserap sampel, yang diteruskan mengenai sensor diubah dalam bentuk tegangan yang sebanding dengan pola interferogram juga, nantinya setelah dilakukan proses di komputer menggunakan perhitungan FFT akan diperoleh grafik spektrum hubungan antara intensitas serapan sampel dan panjang gelombang.
Sumber radiasi
Prinsip dari sumber radiasi IR adalah dipancarkannya sinar oleh padatan lembam yang dipanaskan sampai pijar dengan aliran listrik. Ada 3 macam sumber radiasi yaitu :
- Globar source : tabung silica carbida dengan ukuran diameter 5mm dan panjang 5cm
- Nernst Glower : senyawa-senyawa oksida
- Tungsten Filament Lamp : untuk analisis dengan nir-IR
- Incandescent Wire : merupakan lilitan kawat nikrom.
Sumber Samp Komput
er FFT
Spektru Detektor
IR Interferome
Pada sistim optik FTIR digunakan radiasi LASER (Light Amplification by Stimulated
Emmission of Radiation) yang berfungsi sebagai radiasi yang diinterferensikan dengan
radiasi infra merah agar sinyal radiasi infra merah yang diterima oleh detektor secara utuh dan lebih baik.
Sampel kompartemen.
Cuplikan atau sampel yang dianalisis dapat berupa cairan, padatan atau pun gas. Karena energi vibrasi tidak terlalu besar sampel dapat diletakan langsung berhadapan dengan sumber radiasi IR. Karena gelas kuarsa atau mortar yang terbuat dari porselene dapat memberikan kontaminasi yang menyerap radiasi IR, maka pemakaian alat tersebut harus dihindari. Preparasi cuplikan harus menggunakan mortar yang terbuat dari batu agate dan pengempaan dilakukan dengan menggunakan logam monel.
Monokromator
Monokromator merupakan suatu alat yang berfungsi untuk mendispersikan sinar dari sinar polikromatik menjadi sinar monokromatik. Ada dua macam tipe monokromator yaitu monokromator prisma dan monokromator gratting (kisi difraksi).
Detektor
Detektor berfungsi mengubah sinyal radiasi IR menjadi sinyal listrik. Selain itu detektor dapat mendeteksi adanya perubahan panas yang terjadi karena adanya pergerakan molekul. Detektor spelktrofotometer yang bersifat menggandakan elektron tidak dapat dipakai pada spektrofotometer IR sebab radiasi IR sanngat lemah dan tidak dapat melepaskan elektron dari katoda yang ada pada system detektor. Ada tiga tipe detektor yang dapat digunakan pada spektrofotometer IR, yaitu :
Thermal transducer
Terdiri dari dua logam bercabang dimana suhu tergantung pada potensialnya. Intrumen yang menggunakan detektor ini harus disimpan pada tempat yang ber-AC atau bersuhu konstan karena dapat dipengaruhi oleh suhu sehingga dapat terjadi kesalahan dalam mendeteksi suatu senyawa. Responnya lambat sehingga jarang digunakan.
Pyroelectric transducer
Berupa kristal cairan dari triglisin sulfat (TGS) dimana temperatur dipengaruhi oleh polaritas senyawa. Memiliki respon yang cepat dalam menganalisis suatu senyawa
Photoconducting transducer
Terbuat dari bahan semikonduktor seperti timbal sulfida, eaksa telurida, dan cadmium telurida, indium antimonida. Harus menggunakan pendingin gas nitrogen sehingga responnya cepat.
Detektor yang digunakan dalam Spektrofotometer FTIR adalah TGS (Tetra
Glycerine Sulphate) atau MCT (Mercury Cadmium Telluride). Detektor MCT lebih
banyak digunakan karena memiliki beberapa kelebihan dibandingkan detektor TGS, yaitu memberikan respon yang lebih baik pada frekuensi modulasi tinggi, lebih sensitif, lebih cepat, tidak dipengaruhi oleh temperatur, sangat selektif terhadap energi vibrasi yang diterima dari radiasi infra merah
Amplifier / penguat dan read out.
Penguat dalam sistem optik spektrofotometer IR sangat diperlukan karena sinyal radiasi IR sangat kecil atau lemah. Penguat berhubungan erat dengan derau instrumen serta celah monokromator, jadi keduanya harus diselaraskan dengan tujuan mendapatkan resolusi puncak spektrum yang baik dengan derau maksimal. Sedangkan pencatat atau read out harus mampu mengamati spektrum IR secara keseluruhan pada setiap frekuensi dengan seimbang. Rentang bilangan gelombang 4000 cm-1 sampai 650 cm-1 dalam keadaan normal harus dapat teramati dalam selang waktu 10 – 15 menit. Untuk maksud pengamatan pendahuluan selang waktu tersebut dapat dipersingkat ataupun diperlambat untuk mendapatkan hasil resolusi puncak spektrum IR yang baik.
Perangkat optik spektroskopi FTIR berupa interferometer pada box posisi terbuka
Hasil interferogram menggunakan laser He-Ne. Pola-pola interferensi untuk laju pergeseran cermin sebesar 24 m/s. (a) kondisi awal, (b) kondisi saat beda lintasan optis sebesar kira-kira
Cermin geser Beam splitter Sensor IR Penahan Cermin Tetap Sumber Tempat/box
Untuk menguji kualitas interferogram yang dihasilkan, sumber IR diganti dengan laser He-Ne (panjang gelombang 632,8 nm). Semua komponen optik diatur sehingga posisi awal diperoleh pola interferensi maksimal. Kemudian, cermin geser digerakkan sampai kondisi akhir berjarak sekitar 4,0 mm dari posisi awal. Gambar di atas menampilkan kondisi awal dan akhir dari interferogram menggunakan laser He-Ne.
Dari gambar tersebut dapat disimpulkan bahwa kondisi interferogram berhasil dengan baik, meskipun pola interferensi tidak berupa lingkaran konsentris sempurna. Jarak pergeseran cermin yang maksimum 4,0 mm menghasilkan resolusi spektrum kira-kira sebesar 2,5 cm-1. Meskipun resolusi spektrometer FTIR pada umumnya terletak antara 0,01 cm-1 sampai 2 cm-1 .
JENIS SAMPEL
Senyawa organik yang memiliki gugus fungsional yang pokok yaitu C=O, O-H, N-H, C-O, C=C, CC, CN, dan NO2.
METODE PREPARASI SAMPEL
Sampel yang digunakan dalam analisis menggunakan spektrofotometer IR dapat berupa sampel cair, gas dan padatan.
Gas
Sampel berbentuk gas dimasukkan ke dalam sel gas, sel ini menghadap langsung pada berkas sinar. Dalam bentuk yang dimodifikasi, cermin internal yang digunakan dapat memantulkan berkas sinar berulang kali melalui sampel untuk menaikkan sensitivitas. Sejumlah kecil senyawa-senyawa organik dapat ditentukan dalam bentuk gas, bahkan dalam sel-sel yang dipanaskan.
Cairan
Sampel berbentuk cairan ditempatkan pada sel sebagai film yang tipis di antara dua lapis NaCl yang transparan terhadap inframerah. Karena digunakan NaCl maka setelah selesai harus segera dibersihkan dengan mencuci menggunakan
pelarut seperti toluene, kloroform, dan sebagainya. NaCl harus dijaga tetap kering dan selalu dipegang pada ujung-ujungnya. Untuk spektra di bawah 250 cm-1, maka digunakan CsI, untuk sampel yang mengandung air dapat digunakan CaF2. Sampel cairan dapat juga ditentukan dalam larutan.
Padatan
Wujud sampel padat dapat bermacam-macam di antaranya kristal, amorf, serbuk, gel dan lain-lain. Padatan juga dapat ditentukan dalam larutan tetapi spektra larutan mungkin memberikan kenampakan yang berbeda dari spektra bentuk padat, karena gaya-gaya intermolekul akan berubah. Bermacam metoda telah dikembangkan untuk penyediaan sampel padat hingga dapat langsung diukur. Ada beberapa cara yang umum untuk penyiapan sampel bentuk padatan :
o Pelet KBr, dibuat dengan menumbuk sampel (0,1–2,0%) dengan KBr kemudian ditekan hingga diperoleh pellet KBr, campuran harus kering dan akan baik bila penumbukan dilakukan dibawah lampu inframerah untuk mencegah terjadinya kondensasi uap dari atmosfer yang akan memberikan serapan lebar pada 3500 cm-1.
o Mull atau pasta, dibuat dengan mencampursampel dengan setetes minyak, pasta kemudian dilapiskan di antara dua keeping NaCl yang transparan. Bahan pasta harus transparan terhadap inframerah, tetapi hal ini tidak pernah ada dan struktur yang dihasilkan selalu menunjukkan serapan yang berasal dari bahan pasta adalah parafin cair.
o Lapisan tipis padatan, dilapiskan pada keping-keping NaCl dengan cara meneteskan larutan dalam pelarut yang mudah menguap pada permukaan kepingan NaCl dan dibiarkan hingga pelarut menguap. Polimer-polimer berbagai lilin atau bahan-bahan lemak sering memberikan hasil yang baik, tetapi ada juga yang membentuk kristal yang tajam hingga tidak memberikan serapan.
o Larutan, sampel dilarutkan dalam pelarut seperti karbon tetraklorida, karbon disulfide atau kloroform, dan spektrum dari larutan ini dicatat. Larutan (biasanya 1–5%) ditempatkan dalam sel larutan yang terdiri dari bahan transparan. Sel yang kedua berisi pelarut murni yang ditempatkan pada berkas sinar standari, sehingga serapan dari pelarut dapat dihilangkan dan spektrum yang dicatat merupakan senyawanya sendiri. Meskipun demikian untuk meyakinkan bahwa serapan dari pelarut tidak mengganggu spektrum dari sampel, maka sebaiknya perlu dibuat spektrum dari pelarut yang digunakan untuk mengetahui serapan-serapan yang diberikan.
METODE ANALISIS
FTIR digunakan untuk melakukan analisa kualitatif yaitu untuk mengetahui ikatan kimia yang dapat ditentukan dari spektra vibrasi yang dihasilkan oleh suatu senyawa pada panjang gelombang tertentu. Analisis kualitatif yang dapat dilakukan adalah memperhatikan ada tidaknya gugus fungsional yang pokok yaitu C=O, O-H, N-H, C-O, C=C, CC, CN, dan NO2, kemudian menginterpretasikannya dengan menggunakan bagan korelasi dan tabel, sehingga peak-peak yang ada dapat dianalisis. Selain itu digunakan juga untuk analisa kuantitatif yaitu melakukan perhitungan tertentu dengan menggunakan intensitas berdasarkan gugus Fungsi yang dimiliki oleh suatu sampel.
Dalam metode menganalisis suatu spektra yang tak diketahui, perhatian harus dipusatkan pada penentuan ada atau tidaknya beberapa gugus fungsional utama seperti C=O, O-H, N-NH, C-O, C=C, , dan NO2. Janganlah membuat analisis yang detail terhadap pita serapan CH dekat
3000 cm-1 (3,33 m). Hampir semua senyawa mempunyai pita serapan pada daerah tersebut. Tidak perlu risau terhadap adanya suatu lingkungan yang tepat dari gugus fungsional yang diperoleh. Berikut ini langkah umum untuk memeriksa pita-pita yang penting.
Gugus C=O terdapat pada daerah 1820 – 1600 cm-1 (5,6 – 6,1 m). Puncak ini biasanya yang terkuat dengan lebar mediun dalam spektrum. Serapan tersebut sangat karakteristik.
1 Bila gugus C=O ada, ujilah daftar berikut.
Asam : Apakah ada –OH?
Serapan melebar didekat 3400-2400 cm-1 (biasanya tumpang tindih dengan C–H).
Amida : Apakah ada –NH?
Serapan medium didekat 3500 cm-1 (2,85 m) kadang-kadang puncak rangkap, dengan perubahan yang sama.
Ester : Apakah ada C-OH atau C-OR?
Serapan kuat didekat 1300 – 1000 cm-1 (7,7 – 10 m)
Anhidrida : Mempunyai dua serapan C=O didekat 1870 dan 1700 cm-1 (5,5 dan 5,7 m)
Aldehida : Apakah ada CH aldehida?
Dua serapan lemah didekat 2850 dan 2750 cm-1 (3,50 m dan 3,65 m), yaitu disebelah kanan serapan CH.
Keton : Bila kelima kemungkinan diatas tidak ada
2 Bila gugus C=O tidak ada.
Alkohol : Ujilah untuk OH
- Serapan melebar didekat 3600 – 3300 cm-1 (2,6 m
-3,0 m).
- Pembuktian selanjutnya yaitu adanya serapan C-O didekat 1300 – 1000 cm-1 (7,7 -10 m)
Amida : Ujilah untuk NH
Serapan medium didekat 3500 cm-1 (2,85 m).
Ester : Ujilah serapan C-O (serapan OH tidak ada) didekat 1300 – 1000 cm-1 (7,7 m - 10 m).
3 Ikatan rangkap dua dan/atau cincin aromatik.
C=C memiliki serapan lemah didekat 1650 cm-1 (6,1 m) Serapan medium tinggi kuat pada daerah 1650-1450 cm-1 (6,7 m). Buktikanlah kemungkinan diatas dengan memperhatikan serapan didaerah CH. Aromatik dan vinil CH terdapat disebelah kiri 3000 cm-1 (3,3 m). Sedangkan CH alifatik terjadi disebelah kanan daerah tersebut.
4 Ikatan rangkap tiga
Memiliki serapan medium dan tajam didekat 2250 cm-1 (4,5 m). memiliki serapan lemah tapi tajam didekat 2150 cm-1 (4,65 m). Ujilah CH asetilenik didekat 3300 cm-1 (3,30 m).
5 Gugus Nitro
Dua serapan kuat pada 1600 – 1500 cm-1 (6,25 – 6,67) dan 1390 – 1300 cm-1 (7,2 m - 7,7 m).
6 Hidrokarbon
Serapan utama untuk CH didekat 3000 cm-1 (3,3 m). Spektrumnya sangat sederhana, hanya terdapat serapan lain-lain didekat 1450 cm-1 (6,90 m) dan 1375 cm-1 (7,27 m).
Langkah-langkah pada waktu menginterpretasi data inframerah.
a) Kebanyakan senyawa dapat dicatat pada serapan di atas 1400 cm-1 dan dibawah 900 cm-1. (Daerah finger print, 900-1400 cm-1, mengandung banyak serapan yang tidak dapat ditelaah).
b) Gugus/kelompok fungsional jauh lebih berguna dari pada pita-pita tunggal. Dengan perkataan lain, gugus fungsional yang memberikan banyak serapan karakteristik biasanya dapat diidentifikasi lebih tepat dari pada gugus fungsional yang memberikan hanya satu serapan karakteristik. Jadi keton (C=O str) lebih sukar/diidentifikasi dari pada ester (C=O str dan C–O str) ester lebih sukar diidentifikasi dari pada amida (C=O str, N – H str, N – H def, dan sebagainya).
c) Kerangka karbon harus diperhatikan paling awal : lihat apakah alkana, alkena, alkuna atau aromatik. (Gunakan C–H str, C–H def dan berbagai frekuensi rentangan ikatan karbon-karbon). Kenyataan bahwa spektrum NMR sangat membantu. Lihat apakah ada C=O str, jika ada ia mungkin berhubungan dengan C–H str dalam aldehida, N–H str dalam amida, C-O str dalam ester dan sebagainya. Carilah O-H str atau N-H str demikian juga C=N str. Dalam senyawa belerang amati adanya S-H str, S=O str, dan –SO2 –str; dalam senyawa fosfor lihat adanya P–O str.
METODE PENGOLAHAN DATA HASIL ANALISIS
Dari hasil pengujian sampel pada FTIR didapatkan hasil berupa spektra masing-masing sampel. Maka dari data tersebut dapat diketahui gugus fungsi dari senyawa sehingga dapat ditentukan senyawa yang terdapat pada sampel, seperti contoh
3600-3000 3600-3300 2400-2000 1700-1500 1300-1000 1000-700 700-500 <500 O-H N-H Fenol, ikatan H C=C stretching C-O C-C Vibrasi C-H bending
Dianggap finger print
Sedangkan data analisa dari garam kompleks adalah sebagai berikut :
Daerah frekuensi Jenis ikatan
3600-3300 2400-2000 1700-1500 1500-1250 1300-1200 1000-700 700-500 <500 N-H Fenol, ikatan H C=C stretching C-H C-N C-C Vibrasi C-H bending
Dianggap finger print
Dari data tersebut dapat dilihat perbedaan antara sepktra dari garam rangkap dan juga garam kompleks. Salah satunya adalah gugus O-H yang terdapat pada garam rangkap tetapi tidak terdapat pada garam kompleks. Selain itu ditemukan serapan C-O pada 1300 – 1000 cm-1. Sedangkan pada garam kompleks, serapan 3600-3000 cm-1 bentuknya tidak lebar melainkan meruncing yang diperkirakan adalah N-H. Garam kompleks memiliki harga serapan 1402,25 sedangkan pada garam rangkap 1400,32 pada serapan 1500-1250 cm-1. Adanya beberapa perbedaan serapan antara garam rangkap dan juga garam kompleks dapat disebabkan oleh adanya perbedaan interaksi yang terjadi antara atom pusat molekul ligan. Berdasarkan spectra yang diperoleh ada serapan yang kurang sesuai yaitu gugus C-H, karena dalam senyawa sampel yang digunakan tidak terdapat ikatan C-H. Hal ini mungkin dapat terjadi yang disebabkan adanya ganguan dari luar ataupun saat pembuatan sampel yang kurang sempurna, sehingga sampel yang terbentuk telah terkontaminasi yang mengakibatkan adanya pergeseran spektra.
Hasil analisa FTIR hanya dapat digunakan untuk mengetahui ikatan yang terdapat dalam suatu senyawa sampel. Hasil ini tidak dapat digunakan untuk menentukan bentuk struktur dari sampel tersebut. Jadi untuk analisa suatu senyawa perlu didukung dengan analisa lain seperti H-NMR, C-NMR, dan MS.
GC (GAS CHROMATOGRAPHY) PENDAHULUAN
Berbagai teknik pemisahan campuran zat cair yang banyak digunakan diantaranya, destilasi ( fraksionasi, destilasi uap) dan ekstraksi. Kromatografi merupakan teknik pemisahan yang lebih baik dan lebih cepat dari kedua teknik tersebut di atas, teknik ini telah dikenal sejak abad ke-19.
Dasar pemisahan pada kromatografi adalah pendistribusian sampel di antara dua fase, yaitu fase diam dan fase gerak. Berdasarkan pemakaian fase gerak, kromatografi dapat dibagi menjadi : Kromatografi Cair da Kromatografi Gas.
Kromatografi gas adalah teknik pemisahan yang didasarkan atas sampel di antara suatu fase gerak yang bisa berupa gas dan fase diam yang juga bisa berupa caira ataupun suatu padatan. Sedangkan kromatografi cair merupakan teknik pemisahan yang didasarkan atas sampel di antara suatu fase gerak berupa cairan dan fase diam yang juga didasarkan atas sampel di antara suatu fase gerak yang bisa berupa gas dan fase diam yang juga bisa berupa caira ataupun suatu padatan. Hal ini dikarenakan adanya perbedaan polaritas dar fase diam dan fase gerak.
Banyaknya macam-macam kromatografi yang salah satunya adalah kromatografi gas, yang merupakan metode kromatografi pertama yang dikembangkan pada zaman instrumen dan elektronika. Kromatografi gas dapat dipakai untuk setiap campuran dimana semua komponennya mempunyai tekanan uap yang berarti, suhu tekanan uap yang dipakai untuk proses pemisahan. Tekanan uap memungkinkan komponen menguap dan bergerak bersama-sama dengan fase gerak berupa gas.
Kromatografi gas metode yang tepat dan cepat untuk memisahkan camputan yang sangat rumit. Waktu yang dibutuhkan beragam, mulai dari beberapa detik untuk campuran sederhana sampai berjam-jam untuk campuran yang mengandung 500-1000 komponen. Metode ini sangat baik untuk analisis senyawa organik yang mudah menguap seperti
hidrokarbon dan eter. Efisiensi pemisahan ditentukan dengan besarnya interaksi antara sampel dan cairan, dengan menggunakan fasecair standar yang diketahui efektif untuk berbagai senyawa.
Kromatografi gas (GC) adalah jenis umum dari kromatografi yang digunakan dalam kimia analitikuntuk memisahkan dan menganalisis senyawa yang dapat menguap tanpa dekomposisi. GC dapat digunakan untuk pengujian kemurnian zat tertentu, atau memisahkan komponen yang berbeda dari campuran (jumlah relatif komponen tersebut juga dapat ditentukan). GC dapat digunakan dalam mengidentifikasi suatu senyawa.
Kromatografi gas, berdasarkan fasa gerak dan fasa diamnya merupakan kromatografi gas-cair. Dimana fasa geraknya berupa gas yang bersifat inert, sedangkan fasa diamnya berupa cairan yang inert pula, dapat berupa polimer ataupun larutan. Adapun gambaran umum dari GC adalah sebagai berikut :
Pengertian kromatografi menyangkut metode pemisahan yang didasarkan atas distribusi deferensial diantara dua fasa mengacu pada beberapa sifat komponen sampel, yaitu : · Melarut dalam cairan
· Melekat pada permukaan padatan halus · Bereaksi secara kimia
Sifat-sifat tersebutlah yang dimanfaatkan dalam metode kromatografi ini, yaitu perbedaan migrasi komponen-komponen di dalam sampel.
Pada prinsipnya pemisahan dalam GC adalah disisebabkan oleh perbedaan dalam kemampuan distribusi analit diantara fase gerak dan fase diam di dalam kolom pada kecepatan dan waktu yang berbeda.
Kromatografi gas terdiri dari 2 yaitu kromatografi gas cairan dengan mekanisme pemisahan partisi, yaitu:
1. Kromatografi gas–cair (KGC),
Fase diamnya berupa cairan yang diikatkan pada suatu pendukung sehingga solut akan terlarut dalam fase diam. Partisi komponen cuplikan didasarkan atas kelarutan uap komponen bersangkutan pada zat cair (fasa diam).
2. Kromatografi gas-padat (KGP)
Fase diamnya berupa padatan dan kadang-kadang berupa polimerik. Pada kromatografi gas-padat, partisi komponen cuplikan didasarkan atas fenomena adsorpsi pada permukaan zat padat (fasa diam). Namun KGP jarang digunakan sehingga pada umumnya yang disebut dengan GC saat ini adalah KGC.
PRINSIP
Kromatografi gas mempunyai prinsip yang sama dengan kromatografi lainnya, tapi memiliki beberapa perbedaan misalnya proses pemisahan campuran dilakukan antara stasionary fase cair dan gas fase gerak dan pada oven temperur gas dapat dikontrol sedangkan pada kromatografi kolom hanya pada tahap fase cair dan temperatur tidak dimiliki.
Kromatografi gas merupakan teknik pemisahan yang mana solut-solut yang mudah menguap (dan stabil terhadap panas) bermigrasi melalui kolom yang mengandung fase diam dengan suatu kecepatan yang tergantung pada rasio distribusinya. Pemisahan pada kromatografi gas didasarkan pada titik didih suatu senyawa dikurangi dengan semua interaksi yang mungkin terjadi antara solute dengan fase diam. Selain itu juga penyebaran cuplikan diantara dua fase. Salah satu fase ialah fase diam yang permukaannya nisbi luas dan fase yang lain yaitu gas yang mengelusi fase diam. Fase gerak yang berupa gas akan mengelusi solute dari ujung kolom lalu menghantarkannya ke detector. Prinsip utama pemisahan dalam kromatografi gas adalah berdasarkan perbedaan laju migrasi masing-masing komponen dalam melalui kolom. Komponen-komponen yang terelusi dikenali (analisa kualitatif) dari nilai waktu retensinya (Tr).
Gas pembawa (biasanya digunakan Helium, Argon atau Nitrogen) dengan tekanan tertentu dialirkan secara konstan melalui kolom yang berisi fase diam. Selanjutnya sampel di injeksikan kedalam injektor (Injection Port) yang suhunya dapat diatur. Komponen-komponen dalam sampel akan segera menjadi uap dan akan dibawa oleh aliran gas pembawa menuju kolom. Komponen- komponen akan teradopsi oleh fase diam pada kolom kemudian akan merambat dengan kecepatan berbeda sesuai dengan nilai Kd masing- masing komponen sehingga terjadi pemisahan.
Komponen yang terpisah menuju detektor dan akan terbakar menghasilkan sinyal listrik yang besarnya proporsional dengan komponen tersebut. Sinyal lau diperkuat oleh amplifier dan selanjutnya oleh pencatat (recorder) dituliskan sebagai kromatogram berupa puncak. Puncak konsentrasi yang diperoleh menggambarkan arus detektor terhadap waktu.
Secara sederhana prinsip kromatografi gas adalah udara dilewatkan melalui nyala hydrogen (hydrogen flame) selanjutnya uap organik tersebut akan terionisasi dan menginduksi terjadinya aliran listrik pada detektor, kuantitas aliran listrik sebanding dengan ion.
INSTRUMENTASI
Sistem peralatan dari kromatografi gas terdiri dari 6 bagian utama diantaranya:
1 Tabung gas pembawa
2 Pengontrolan aliran dan regulator tekanan
3 Injection port (tempat injeksi cuplikan)
4 Kolom
5 Detektor
Cara pemisahan dari sistem ini sangat sederhana sekali, cuplikan yang akan dipisahkan diinjeksikan kedalam injektor, aliran gas pembawa yang inert akan membawa uap cuplikan kedalam kolom. Kolom akan memisahkan komponen-komponen cuplikan tersebut. Komponen-komponen yang telah terpisah tadi dapat dideteksi oleh detektor sehingga memberikan sinyal yang kemudian dicatat pada rekorder dan berupa puncak-puncak (kromatogram).
1 Gas Pembawa
Gas pembawa ditempatkan dalam tabung bertekanan tinggi. Biasanya tekanan dari silinder sebesar 150 atm. Tetapi tekanan ini sangat besar untuk digunakan secara Iansung.
Untuk memperkecil tekanan tersebut agar memenuhi kondisi pemisahan maka digunakan
drager yang dapat mengurangi tekanan dan mengalirkan gas dengan laju tetap. Aliran gasakan
mengelusi komponen-komponen dengan waktu yang karaterisitik terhadap komponen tersebut (waktu retensi). Karena kecepatan gas tetap maka komponen juga mempunyai volume yang karateristik untuk gas pembawa (volume retensi).
Adapun persyaratan-persyaratan yang harus dipenuhi oleh gas pembawa adalah :
1 Inert, agar tidak terjadi interaksi dengan pelarut.
2 Murni, mudah didapat dan murah harganya.
3 Dapat mengurangi difusi dari gas
4 Cocok untuk detektor yang digunakan.
Gas-gas yang sering dipakai adalah : helium, argon, nitrogen, karbon dioksida dan hidrogen.Gas helium dan argon sangat baik, tidak mudah terbakar, tetapi sangat mahal. H2 mudah terbakar, sehingga harus berhati-hati dalam pemakaiannya. Kadang-kadang digunakan juga CO2.
Pemilihan gas pengangkut atau pembawa ditentukan oleh detektor yang digunakan. Tabung gas pembawa dilengkapi dengan pengatur tekanan keluaran dan pengukur tekanan. Sebelum masuk ke kromatografi, (harusnya) ada pengukur kecepatan aliran gas serta sistem penapis molekuler untuk memisahkan air dan pengotor gas lainnya. Pada dasarnya kecepatan alir gas diatur melalui pengatur tekanan dua tingkat yaitu pengatur kasar (coarse) pada tabung gas dan pengatur halus (fine) pada kromatograf. Tekanan gas masuk ke kromatograf (yaitu tekanan dari tabung gas) diatur pada 10 s.d 50 psi (di atas tekanan ruangan) untuk memungkinkan aliran gas 25 s.d 150 mL/menit pada kolom terpaket dan 1 s.d 25 mL/menit untuk kolom kapiler.
Laju alir gas pembawa mempengaruhi resolusi. Laju alir yang minimum diperlukan untuk resolusi maksimum. Namun, perlu diketahui bahwa pada laju alir yang sangat lambat resolusinya secara dramatis menurun oleh karena faktor-faktor: packing tidak teratur, ukuran partikel, diameter kolom, dan lain-lain.
Laju alir harus dikontrol dengan tepat. Tekanan dari silinder gas bertekanan pada gas pembawa harus cukup untuk mendorong gas melewati kolom packing. Flow controller atau
needle valve harus ada pada sistem GC dan sering disatukan dalam bagian depan instrumen.
Laju alir harus dapat diatur secara hati-hati sehingga dapat diketahui berapa laju alir optimumnya dan harus dapat disamakan dalam percobaan berikutnya. Berbagai flow meter
tersedia, dan kadang-kadang oleh pabrik pembuat instrumen disatukan di dalam instrumen sehingga laju alir terpantau secara kontinyu dan dapat diatur lagi (bila perlu) dengan memutar
needle valve. Bila tidak ada flow meter maka flow meter gelembung sabun sering digunakan,
flow meter gelembung sabun tersusun dari pipet ukur (measuring pipet), tabung gelas (glass
tubing), dan pipet bulb. Dengan perangkat flow meter gelembung sabun, stop watch digunakan
untuk mengukur waktu pada gelembung yang bergerak di antara dua tanda garis, misalnya 0–2 ml. Dengan demikian laju alir gas pembawa (ml/menit) dapat dihitung.
2 Tempat Injeksi
Dalam pemisahan dengan GLC cuplikan harus dalam bentuk fase uap. Gas dan uap dapatdimasukkan secara langsung. Tetapi kebanyakan senyawa organik berbentuk cairan dan padatan. Hingga dengan demikian senyawa yang berbentuk cairan dan padatan pertama-tama harus diuapkan. Ini membutuhkan pemanasan sebelum masuk dalam kolom. Panas itu terdapat pada tempat injeksi seperti pada gambar 9. bagan injektor.
Tempat injeksi dari alat GLC selalu dipanaskan. Dalam kebanyakan alat, suhu dari tempat injeksi dapat diatur. Aturan pertama untuk pengaturan suhu ini adalah bahwa suhu tempat injeksi sekitar 50°C lebih tinggi dari titik didih campuran dari cuplikan yang mempunyai titik didih yang paling tinggi. Bila kita tidak mengetahui titik didih komponen dari cuplikan maka kita harus mencoba-coba. Sebagai tindak lanjut suhu dari tempat injeksi dinaikkan. Jika puncak-puncak yang diperoleh lebih baik, ini berarti bahwa suhu percobaan pertama terlalu rendah. Namun demikian suhu tempat injeksi tidak boleh terlalu tinggi, sebab kemungkinan akan terjadi perubahan karena panas atau penguraian dari senyawa yang akan dianalisa.
Cuplikan dimasukkan ke dalam kolom dengan cara menginjeksikan melalui tempat injeksi.Hal ini dapat dilakukan dengan pertolongan jarum injeksi yang sering disebut "a gas tight syringe".
Perlu diperhatikan bahwa kita tidak boleh menginjeksikan cuplikan terlalu banyak, karena GC sangat sensitif. Biasanya jumlah cuplikan yang diinjeksikan pada waktu kita mengadakan analisa 0,5 -50 ml gas dan 0,2 - 20 ml untuk cairan.
Ketepatan volum injeksi menjadi sangat penting untuk analisa kuantitatif di mana jumlah analit yang diukur oleh detektor tergantung pada konsentrasi analit dalam cuplikan. Apabila prosedur dikehendaki hanya untuk identifikasi (analisis kualitatif), maka ketepatan volum injeksi menjadi kurang penting.
Untuk mengisi alat injeksi dapat dipakai teknik sebagai berikut:
- Alat injeksi dibersihkan.
- Alat injeksi dikuras dengan menghisap cuplikan beberapa kali (dan mengeluarkan isinya di luar tempat cuplikan).
- Jumlah cuplikan yang diperlukan dihisap. Cara untuk mengeluarkan gelembung-gelembung udara yang masih tertinggal pada tabung injeksi adalah dengan jalan menekan torak injeksi secepatnya beberapa kali dan ujung jarum harus selalu berada di dalam cairan.
- Udara 1/10 dari volum maksimum dihisap lagi.
- Jarum bagian luar dibersihkan dengan kain yang tidak mudah lepas serat- seratnya.
- Cuplikan diinjeksikan dengan menusukkan jarum menembus septum, dan menekan penghisap sampai ujungnya dengan gerakan yang cepat dan tidak terputus-putus, kemudian tarik jarum keluar dari septum.
- Torak injeksi ditarik kembali sedikit dan lihat berapa banyak cairan yang masih tertinggal.
- Diameter kolom yang digunakan tetap diperhatikan dalam melakukan pemisahan agar sesuai dengan batasan volum penyuntikan. Tabel berikut memperlihatkan hal itu.
Tabel : Batasan Volum Penyuntikan
Diameter Kolom
Volum Injeksi
Maksimum
¼ in. (packed column) 100 μl 1/8 in. (packed column) 20 μl Kapiler (open tubular) 0,1 μl
3 Kolom
Kolom merupakan jantung dari kromatografi gas. Bentuk dari kolom dapat lurus, bengkok, misal berbentuk V atau W, dan kumparan/spiral. Biasanya bentuk dari kolom adalah kumparan. Kolom ini dapat terbuat dari :
a Tembaga (murah dan mudah diperoleh)
b Plastik (teflon), dipakai pada suhu yang tidak terlalu tinggi.
c Baja (stainless steel), (mahal)
d Alumunium
e Gelas
Panjang kolom dapat dari 1 m sampai 3 m. Diameter kolom mempunyai berbagai ukuran, biasanya pengukuran berdasarkan diameter dalam dari kolom gelas yaitu antara 0,3 mm hingga 5 min. Kebanyakan kolom yang digunakan berupa stainles steel dengan diameter luar (OD) dari I/S atau 1/4 inch (0,3 atau 0,6 cm). Pada GSC kolom diisi dengan penyerap (adsorbent), sedangkan pada GLC kolom diisi dengan "solid support" (padatan pendukung) yang diikat oleh fase diam.
Instrumen GC didisain supaya kolom dapat diganti secara mudah dengan melepaskan fitting di dalam oven. Fitting ini tidak hanya memudahkan penggantian fasa diam yang berbeda, tetapi juga mengijinkan operator mengganti kolom yang lebih panjang yang berisi fasa diam yang sama. Ide penggantian kolom yang lebih panjang adalah memberikan kesempatan kontak lebih lama antara campuran komponen dengan fasa diam yang pada gilirannya memperbaiki pemisahan.
Interaksi campuran komponen dengan cairan fasa diam memainkan peran kunci dalam proses pemisahan sehingga sifat-sifat fasa diam menjadi penting. Berbagai jenis kolom biasanya menyebutkan nama komersialnya, komposisi, dan klasifikasi senyawa untuk penggunaannya (kaitannya dengan polaritas).
Ada 2 jenis kolom yang digunakan dalam kromatografi gas secara umum, yaitu kolom jejal (packed columns) dan kolom tubuler terbuka (open tubular columns). Kolom jejal (packed columns) adalah kolom metal atau gelas yang diisi bahan pengepak terdiri dari penunjang padatan yang dilapisi fase cair yang tidak menguap (untuk kromatografi gas-padatan). Kolom tubuler terbuka sangat berbeda dengan kolom jejal, yaitu gas yang mengalir sepanjang kolom tidak mengalami hambatan, karena kolomnya merupakan tabung tanpa bahan pengisi.
Kolom jejal umumnya mempunyai panjang yang berkisar antara 0,7 sampai 2 meter, sedangkan kolom tubuler terbuka dapat mempunyai panjang dari 30 sampai 300 meter. Kolom yang panjang ini biasanya dibuat dalam bentuk melilit bergulung seperti spiral. Kemampuan memisahkan komponen per meter kolom pada kolom tubuler terbuka tidak jauh berbeda dengan pemisahan pada kolom jejal. Meskipun demikian, penggunaan kolom yang sangat panjang bersama-sama dengan waktu analisis yang relatif cepat merupakan alat penolong yang berharga bagi para ahli kimia untuk dapat memisahkan komponen-komponen yang perbedaannya kecil didalam sifat-sifat fisiknya.
Ada 2 jenis kolom tubuler terbuka, yaitu WCOT (Wall Coated Open Tubular Columns) dan SCOT (Support Coated Open Tubular Columns).
4 Detektor
Detektor berfungsi sebagai pendeteksi komponen-komponen yang telah dipisahkan dari
kolom secara terus-menerus, cepat, akurat, dan dapat melakukan pada suhu yang lebih tinggi. Detektor harus dapat dipercaya dan mudah digunakan. Fungsi umumnya mengubah sifat-sifat molekul dari senyawa organik menjadi arus listrik kemudian arus listrik tersebut diteruskan ke rekorder untuk menghasilkan kromatogram. Detektor yang diinginkan adalah detektor yang mempunyai sensitifitas yang tinggi, noisenya rendah, responnya linear, dapat memberikan respon dengan setiap senyawa, tidak sensitif terhadap perubahan temperatur dan kecepatan aliran dan juga tidak mahal harganya.
Detektor dalam GC digunakan untuk memunculkan sinyal listrik hasil elusi gas pembawa dari kolom. Berbagai jenis detektor dibuat untuk melakukan deteksi. Tidak hanya berupa variasi disain, tapi juga variasi sensitivitas dan selektivitas. Sensitivitas mengacu pada kuantitas terkecil komponen campuran di mana sensitivitas menghasilkan sinyal yang masih teramati. Sementara, selektivitas mengacu pada jenis senyawa di mana sinyalnya dapat dimunculkan.
Detektor yang umum digunakan:
Detektor hantaran panas (Thermal Conductivity Detector/TCD)
Prinsip kerja TCD :
Berdasarkan perbedaan daya hantar panas, relatif terhadap gas pembawa. Filament dipanaskan, dimana suhu filament tergantung pada konduktivitas panas gas di sekelilingnya. Konduktivitas panas efluen kolom lebih rendah (karena adanya sampel). Adanya sampel melewati kolom menyebabkan jembatan Wheatstone tak seimbang sehingga terjadi signal.
TCD berdasar atas prinsip, suatu benda yang panas akan kehilangan panasnya pada suatu kecepatan yang tergantung kepada komposisi gas di sekitarnya. Jadi, kecepatan hilangnya panas itu dapat digunakan sebagai ukuran tentang komposisi gas. Gas pembawa yang mengandung sample atau analit masuk ke dalam kolom, maka konduktivitas gas akan turun dan suhu filamen akan meningkat serta resistansi. Lewatnya sampel melalui kolom menyebabkan Jembatan Wheatstone yang tak seimbang sehingga terjadi signal yang terbaca pada detektor.
Detektor ionisasi nyala (Flame Ionization Detector_ FID) Prinsip kerja detector FID :
Senyawa yang terbawa fasa gerak diionisasi dengan nyala (H2 + O2 / udara). Perubahan arus akibat ionisasi diukur sebagai respon analit. Tidak senstif terhadap karbon yang teroksidasi penuh. FID merupakan detektor yang paling luas penggunaannya, bahkan dianggap sebagai detektor yang universal untuk analisis obat dalam cairan biologis menggunakan GLC. Pada detector ini, komponen-komponen sampel yang keluar dari kolom dibakar dalam nyala (campuran gas hidrogen dan udara atau oksigen). Sejumlah besar ion yang terbentuk dalam nyala masuk ke dalam celah elektrode dan menurunkan tegangan listrik dari celah elektrode mula-mula. Penurunan tegangan ini yang kemudian dicatat sebagai sinyal oleh rekorder. Intensitas sinyal ini berbanding lurus dengan konsentrasi solute dalam gas pembawa.
Prinsip kerja detector ECD :
Mekanisme deteksi melibatkan emisi partikel radioaktif (β) dari 63Ni. Partikel β menghasilkan elektron termal dari gas pembawa. Berdasarkan penangkapan elektron termal oleh molekul sampel. Pada ECD terdapat pemancar radioaktif β, seperti 3H atau 63Ni yang akan mengionisasi gas pembawa. Aliran elektron sebagai hasil ionisasi gas pembawa (nitrogen atau argon/methan) dalam ECD memberikan sinyal yang berupa baseline suatu kromatogram. Bila kemudian suatu senyawa masuk ke dalam detektor, sebagian dari elektron tersebut akan ditangkap oleh senyawa sebelum mereka mencapai plat detektor. Ini mengakibatkan aliran arus listrik dalam detektor berkurang, yang oleh rekorder akan dicatat sebagai suatu peak.
Detektor fotometrik nyala (Falame Photomertic Detector _FPD)
Detektor nyala alkali
Detektor spektroskopi massa
Detektor yang peka terhadap senyawa organik yang mengandung fosfor adalah FID, ECD, dan FPD. Detektor penangkap elektron (Electron Capture Detector – ECD). Pada penetapan ini, digunakan detektor penangkap elektron. Detektor ini merupakan modifikasi dari FID yaitu pada bagian tabung ionisasi. Dasar dari ECD ialah terjadinya absorbsi e- oleh senyawa yang mempunyai afinitas terhadap e- bebas (senyawa-senyawa elektronegatif). Dalam detektor gas terionisasi oleh partikel yang dihasilkan dari 3H atau 63Ni. Detektor ini mengukur kehilangan sinyal ketika analit terelusi dari kolom kromatografi. Detektor ini peka terhadap senyawa halogen, karbonil terkoyugasi, nitril, nitro, dan organo logam, namun tidak peka terhadap hidrokarbon, ketone, dan alkohol.
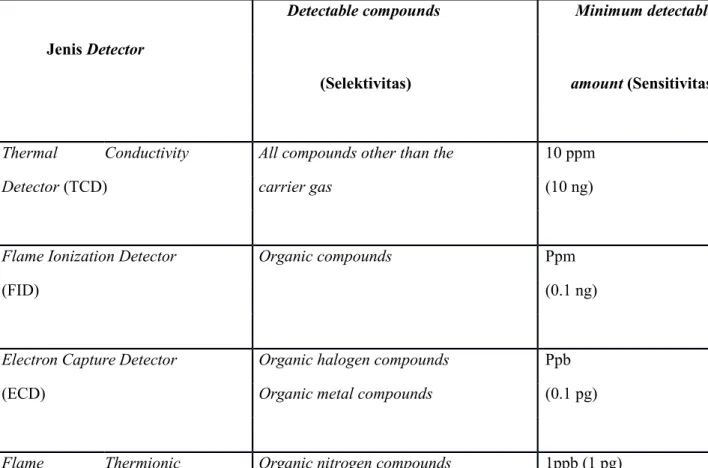
Tabel : Beberapa jenis detektor GC
Jenis Detector
Detectable compounds Minimum detectable
(Selektivitas) amount (Sensitivitas)
Thermal Conductivity All compounds other than the 10 ppm
Detector (TCD) carrier gas (10 ng)
Flame Ionization Detector Organic compounds Ppm
(FID) (0.1 ng)
Electron Capture Detector Organic halogen compounds Ppb
(ECD) Organic metal compounds (0.1 pg)
Detector (FTD) Organic phosphorous 0.1 ppb (0.1 pg)
compounds
Flame Photometric Inorganic, organic sulfur 10 ppb
Detector (FPD) compounds (10 pg)
Inorganic, organic
phosphorous compounds
Surface Ionization Level 3 amine compounds ppb (0.1 pg)
Detector (SID) Polycyclic aromatics 1 ppb (1 pg)
5 Recorder (pencatat)
Recorder berfungsi sebagai pengubah sinyal dari detektor yang diperkuat melalui elektrometer menjadi bentuk kromatogram. Dari kromatogram yang diperoleh dapat dilakukan analisis kualitatif dan kuantitatif. Analisis kualitatif dengan cara membandingkan waktu retensi sampel dengan standar. Analisis kuantitatif dengan menghitung luas area data. Sebuah rekorder bekerja dengan menggerakkan kertas dengan kecepatan tertentu. di atas kertas tersebut dipasangkan pena yang digerakkan oleh sinyal keluaran detektor sehingga posisinya akan berubah-ubah sesuai dengan dinamika keluaran penguat sinyal detektor. Hasil rekorder adalah sebuah kromatogram berbentuk pik-pik dengan pola yang sesuai dengan kondisi sampel dan jenis detektor yang digunakan.
Rekorder biasanya dihubungkan dengan sebuah elektrometer yang dihubungkan dengan sirkuit pengintregrasi yang bekerja dengan menghitung jumlah muatan atau jumlah energi listrik yang dihasilkan oleh detektor. Elektrometer akan melengkapi pik-pik kromatogram dengan data luas pik atau tinggi pik lengkap dengan biasnya.
Sistem data merupakan pengembangan lebih lanjut dari rekorder dan elektrometer dengan melanjutkan sinyal dari rekorder dan elektrometer ke sebuah unit pengolah pusat
(CPU,Cent ral
JENIS SAMPEL
Gas-liquid chromatography (GLC), atau sering disebut Gas Chromatography (GC) saja, merupakan tipe umum kromatografi yang digunakan dalam kimia organik untuk memisahkan dan menganalisa komponen yang bisa diuapkan (vaporised) tanpa terdekomposisi. GC dapat digunakan untuk menentukan bahan non-halal dalam pangan serta untuk menganalisa toksik (zat racun) yang dianggap sebagai bahan bukan-Toyyib.
Agar bisa sesuai untuk analisa GC, sebuah komponen harus cukup volatil dan stabil terhadap panas. Jika semua atau sebagian molekul komponen berada pada fase gas pada 400-450oC atau di bawahnya, dan semuanya tidak terurai pada suhu tersebut, GC mungkin bisa dipakai untuk menganalisa. Derivatisasi lipid dan asam lemak menjadi FAME, atau derivatisasi protein dengan hidrolisis asam yang diikuti dengan esterifikasi (N-propyl esters) atau derivatisasi karbohidrat dengan silytasi (silytation) untuk menghasilkan sampel volatil yang cocok untuk analisa GC.
GC biasa digunakan untuk menganalisa komposisi asam lemak. Lemak babi (lard) berbeda dengan lemak sapi di dalam asam-asam lemak C20:0, C16:1, C18:3, dan C20:1, dan dengan ayam di dalam asam-asam lemak C12:0, C18:3, C20:0, dan C20:1. Lemak babi dan ayam berbeda nyata dalam hal komposisi disaturated dan triunsaturated triacylglycerols (TAGs). GC juga pernah digunakan untuk melihat kontaminasi minyak sawit dengan enzymatically-randomized lard (ERLD).
METODE PREPARASI SAMPEL
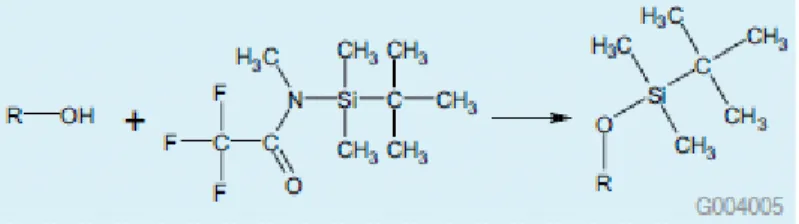
DERIVATISASI
Derivatisasi merupakan proses kimiawi untuk mengubah suatu senyawa menjadi senyawa lain yang mempunyai sifat-sifat yang sesuai untuk dilakukan analisis menggunakan kromatografi gas (menjadi lebih mudah menguap). Alasan dilakukannya derivatisasi:
Senyawa-senyawa tersebut tidak memungkinkan dilakukan analisis dengan GC terkait dengan volatilitas dan stabilitasnya.
Untuk meningkatkan batas deteksi dan bentuk kromatogram. Beberapa senyawa tidak menghasilkan bentuk kromatogram yang bagus (misal puncak kromatogram saling tumpang tindih) atau sampel yang dituju tidak terdeteksi, karenanya diperlukan derivatisasi sebelum dilakukan analisis dengan GC.
Meningkatkan volatilitas, misal senyawa gula. Tujuan utama derivatisasi adalah untuk meningkatkan volatilitas senyawa-senyawa yang tidak mudah menguap (non-volatil). Senyawa-senyawa dengan berat molekul rendah biasanya tidak mudah menguap karena adanya gaya tarik-menarik inter molekuler antara gusug polar karenanya jika gugus-gugus polar ini ditutup dengan cara derivatisasi akan mampu meningkatkan volatilitas senyawa tersebut secara dramatis.
Meningkatkan stabilitas. Beberapa senyawa volatil mengalami dekomposisi parsial karena panas sehingga diperlukan derivatisasi untuk meningkatkan stabilitasnya.
Meningkatkan batas deteksi pada penggunaan detektor tangkap elektron (ECD). Inilah contoh derivatisasi yang digunakan untuk memperbaiki bentuk puncak pseudoefedrin: Caranya:
Sirup dekongestan dibasakan dengan amonia dan diekstraksi ke dalam etil asetat sehingga akan menjamin bahwa semua komponen yang terekstraksi berada dalam bentuk basa bebasnya daripada bentuk garamnya. Bentuk basa inilah yang bertanggungjawab pada bagusnya bentuk puncak
kromatografi. Garam-garam atau basa-basa akan terurai karena adanya panas pada lubang suntik GC, sehingga dengan adanya proses ini akan dapat menyebabkan terjadinya peruraian.
Jika ekstrak pada sirup dekongestan di lakukan kromatografi gas secara langsung maka kromatogram yang dihasilkan seperti gambar dibawah. Basa bebas triprolidin dan dekstrometorfan menunjukkan bentuk puncak yang bagus, akan tetapi pesudoefedrin yang merupakan basa yang lebih kuat karena adanya gugus hidroksil dan gugus amin memberikan bentuk puncak yang kurang bagus. Hal ini dapat diatasi dengan menutup gugus polar (gugus hidroksi dan amin) pada pseudoefedrin dengan cara mereaksikannya menggunakan trifluoroasetat anhidrida (TFA). Perlakuan dengan TFA ini tidak menghasilkan senyawa derivatif terhadap senyawa-senyawa basa tersier dalam ekstrak (sirup dekongestan) ini. Reagen TFA ini sangat bermanfaat karena reagen ini sangat reaktif dan bertitik didih rendah (400C) sehingga kelebihan reagen TFA ini mudah dihilangkan dengan cara evaporasi sebelum
dilakukan kromatografi gas.
Sementara ini merupakan kromatogram sesudah dilakukan derivatisasi :
METODE ANALISIS
Bila volum atau konsentrasi dari masing-masing komponen yang terpisah sudah tertentu, hal itu disebut penentuan volumetrik (volumetric determination). GC didasarkan pada prinsip bahwa komponen target yang terdeteksi adalah murni karena sudah dipisahkan dari komponen-komponen lain dalam cuplikan. Bila pemisahan ini betul-betul sempurna, volumnya (konsentrasinya) dapat ditentukan dengan tingkat keakuratan yang sangat tinggi.
Berikut 4 pokok metoda analisis (penentuan volumetrik) yang digunakan dalam GC:
1 Metoda persentase luas permukaan (surface area percentage method)
2 Metoda pengaturan persentase luas permukaan (adjusted surface area percentagemethod)
3 Metoda kurva kalibrasi absolut (absolute calibration curve method)
4 Metoda internal standard (internal standard method)
Keuntungan dan kekurangan masing-masing metoda di atas dan pemilihan metodanya
Kelebihan
1 Waktu analisis yang singkat dan ketajaman pemisahan yang tinggi.
2 Dapat menggunakan kolom lebih panjang untuk menghasilkan efisiensi pemisahan yang tinggi.
3 Gas mempunyai vikositas yang rendah .
4 Kesetimbangan partisi antara gas dan cairan berlangsung cepat sehingga analisis relatif cepat dan sensitifitasnya tinggi.
5 Pemakaian fase cair memungkinkan kita memilih dari sejumlah fase diam yang sangat beragam yang akan memisahkan hampir segala macam campuran.
Kekurangan
1 Teknik Kromatografi gas terbatas untuk zat yang mudah menguap.
2 Kromatografi gas tidak mudah dipakai untuk memisahkan campuran dalam jumlah besar. Pemisahan pada tingkat [mg] mudah dilakukan, pemisahan pada tingkat [gram] mungkin dilakukan, tetapi pemisahan dalam tingkat [pon] atau [ton] sukar dilakukan kecuali jika ada metode lain.
3 Fase gas dibandingkan sebagian besar fase cair tidak bersifat reaktif terhadap fase diam dan zat terlarut.
METODE PENGOLAHAN DATA HASIL ANALISIS Analisis kuantitatif
Dengan asumsi bahwa luas puncak berbanding lurus dengan kadar senyawa pada kondisi elusi yang sama, maka kadar sample dapat dihitung sama dengan luas puncak sample dibagi luas puncak senyawa pembanding kali kadar senyawa pembanding. Cara demikian tentunya menanggung banyak ralat, oleh karena itu akan lebih baik bila dibuat kurva baku luas puncak versus kadar senyawa pembanding. Kemudian dibuat persamaan garis lurus dan dibuat kurva regresinya. Namun untuk memperkecil kesalahan pengukuran volume sample yang diinjeksikan maka untuk analisis kuantitatif dikenal penggunaan standar eksternal , standar internal dan metode penambahan. Selain untuk keperluan identifikasi kromatografi gas juga digunakan untuk melihat kemurnian suatu bahan. Bila sample selalu memberikan puncak tunggal pada kondisi yang berbeda (kolom, fase gerak, dll) maka bahan tersebut adalah murni. Standar eksternal Yang dimaksud dengan standar eksternal adalah menambahkan senyawa yang sifat fisikanya mirip dengan senyawa yang dianalisis (molekul yang dianalisis), senyawa ini harus netral, tidak bereaksi dengan molekul sample, mempunyai IR yang tidak jauh berbeda dengan tR sample. Standar eksternal ini ditambahkan dengan jumlah terukur pada pembuatan kurva baku dan juga pada sample (untuk kontrol volume sample yang diinjeksikan). Selanjutnya dibuat kurva luas puncak senyawa pembanding dibagi luas puncak standar eksternal versus kadar senyawa pembanding. Maka kadar sample dapat dihitung dengan memplotkan luas
puncak sample dibagi luas standar internal pada ordinat dan bila ditarik garis sejajar absis memotong garis regresi, selanjutnya ditarik garis sejajar ordinat maka akan memotong absis, pada titik potong dengan absis inilah diketahui kadar sample.
Standar internal Syarat sebagai standar internal sama dengan syarat senyawa untuk dapat dipakai sebagai standar eksternal. Cara kerja penetapan kadar menggunakan Standar internal adalah sebagai berikut: Misalnya menambahkan standar internal (A) sebanyak 0,3786 gram kepada sample (C) berat 0,5291 gram, campuran ini dilarutkan dalam pelarut yang sesuai hingga volume tertentu. Kemudian 1 |il diinjeksikan dan dicatat luas puncak A dan C. Pada prinsipnya pada penetapan ini adalah membandingkan dua senyawa berbeda. Satu diantaranya adalah diketahui beratnya. Respon detektor akan berbeda untuk senyawa berbeda, jelasnya a gram senyawa A dan a gram senyawa B tidak memberikan luas puncak yang sama. Oleh karena itu perlu adanya faktor koreksi. Perhitungan faktor koreksi dapat dilihat pada Tabel berikut.
Senyawa Berat Perbandinga
n Berat C/A Luas Puncak
Perbandinga n Luas Puncak C/A Perbandingan Luas A 0,3786 4231 1,398 1,345 0,962 C 0,5291 5671
Berat C =
Luas Puncak A x Faktor Koreksi
Luas Puncak C x Berat A
=5671
4231
x
x
0,3786
0,962
= 0,5275 Kadar C = 0,5275/0,5291 x 100% = 99,69 %Metoda Penambahan (Addition method)
Metoda penambahan adalah menambahkan senyawa murni yang dianalisis itu sendiri dengan jumlah terukur ke dalam sample. Supaya lebih jelas diambil contoh kongkrit pada penetapan metil salisilat dalam minyak gosok. Diperlukan isopropanol digunakan sebagai pelarut. Langkah-langkah adalah sebagai berikut:
1 Kedalam 3 (tiga) labu takar 10,0 ml dimasukkan masing-masing 5,0 ml minyak gosok (sample). 2 Ke dalam 2 (Dua) labu takar yang berisi sample ditambahkan metil salisilat murni (standar)
3 Ke tiga labu ( berisi: sample, sample + 0,3ml metilsalisilat murni dan sample + 0,6 ml metilsalisilat murni) diencerkan dengan isopropanol hingga tanda.
4 Dari ke tiga labu takar ini diinjeksikan masing-masing 1μ1.
5 Selanjutnya dihitung kadar metil salisilat dalam sample dengan rumus dibawah ini. Dua kali pengukuran, kadar dihitung rata-rata.
Cx =
hx
hx .Cs
+
s
−
hx
Keterangan :Cx = kadar (%vol sample)
Cs = % volume standar yang ditambahkan hx = luas puncak sample
hx+s = luas puncak (sample + standar yang ditambahkan.
GC-MS PENDAHULUAN
Gas Chromatography dan Gas Chromatography-Mass Spectrofotometric adalah dua alat yang memliki detector yang berbeda, meskipun namanya berawalan “Gas Chromatography”. Detektor yang berfungsi untuk mengubah sinyal-sinyal radiasi menjadi energy listrik yang kemudian dapat dibaca oleh alat.
Untuk GC, menggunakan detektor Thermal Conductivity Detector (TCD) , TCD bekerja dengan cara membandingkan konduktivitas panas dua aliran gas – gas pembawa murni (rujukan) dan sampel. Perubahan suhu pada kabel yang dipanaskan oleh listrik di dalam detektor dipengaruhi oleh konduktivitas panas gas yang mengalir di sekelilingnya. Perubahan dalam konduktivitas panas ini dideteksi sebagai perubahan resistansi listrik dan diukur. Yang hasil datanya berupa data kuantitatif.
Dan juga ada yang menggunakan detektor Flame Ionization Detector FID. FID biasanya menggunakan api Hidrogen/Udara yang dilewati sampel untuk mengoksidasi molekul organik dan menghasilkan partikel bermuatan listrik (ion). Ion dikumpulkan dan menghasilkan sinyal listrik yang kemudian diukur. Yang hasilnya berupa data yang kuantitatif.
Sedangkan untuk alat GC-MS, menggunakan detektor berupa MS atau berkepanjangan Mass Spectrometry. GC – MS yang bekerja dengan menggabungkan 2 metode dari 2 alat. Yaitu, GC yang secara umumnya berfungsi untuk memisahkan suatu senyawa dengan bantuan gas nitrogen, hidrogen, dll. Sedangkan GC-MS kerjanya sama dengan GC, tetapi alat tersebut dilengkapi dengan pencacah fragmen sehingga kita dapat mengetahui pemecahan ion fragmen senyawa dan dapat mengetahui Berat Molekul senyawa yang di analisis. Misalnya H2O yang memiliki Berat Molekul = 18.Maka hasil datanya adalah data kualitatif.
PRINSIP
GC-MS terdiri dari dua bagian yaitu gas chromatography (GC) dan mass spectrometry (MS) yang masing-masing mempunyai fungsi berbeda. GC berfungsi untuk memisahkan senyawa-senyawa dalam sampel. Pemisahan terjadi pada bagian kolom. Prinsip pemisahan berdasarkan perbedaan tingkat volatilitas dari senyawa dan juga berdasarkan interaksi dengan fase diam (stationary phase). Pada kolom diberlakukan gradien suhu danholding untuk mengoptimalkan proses pemisahan senyawa tersebut.
Senyawa-senyawa yang sudah terpisah pada kolom GC, akan memasuki MS. MS terdiri dari tiga bagian yaitu sumber ion, mass analyzer dan detektor. Senyawa yang masuk ke MS akan mengalami ionisasi dan fragmentasi menjadi ion-ion fragmen. Ionisasi terjadi karena adanya elektron yang berasal dari sumber ion.
Ion-ion fragmen akan memasuki mass analyzer dan akan dipisahkan berdasarkan nilai m/z-nya. Ion fragmen yang mempunyai nilai m/z kecil akan memasuki detektorlebih cepat dibandingkan ion fragmen yang mempunyai nilai m/z besar. Output dari detektor berupa diagram hubungan antara nilai m/z dengan intensitas relatif ion-ion fragmen dari suatu senyawa. Setiap senyawa mempunyai pola m/z yang berbeda-beda, sehingga kita dapat mengidentifikasi suatu senyawa dengan membandingkan dengan pola spektra yang ada pada library.
INSTRUMENTASI
1. Gas Pengangkut
Gas pengangkut/ pemasok gas (carrier gas) ditempatkan dalam silinder bertekanan tinggi. Biasanya tekanan dari silinder sebesar 150 atm. Tetapi tekanan ini sangat besar untuk digunakan secara Iansung. Gas pengangkut harus memenuhi persyaratan :
a. Harus inert, tidak bereaksi dengan cuplikan, cuplikan-pelarut, dan material dalam kolom.
b. Murni dan mudah diperoleh, serta murah. c. Sesuai/cocok untuk detektor.
d. Harus mengurangi difusi gas.
Gas-gas yang sering dipakai adalah : helium, argon, nitrogen, karbon dioksida dan hidrogen. Gas helium dan argon sangat baik, tidak mudah terbakar, tetapi sangat mahal. H2 mudah terbakar, sehingga harus berhati-hati dalam pemakaiannya. Kadang-kadang digunakan juga CO2.
Pemilihan gas pengangkut atau pembawa ditentukan oleh ditektor yang digunakan. Tabung gas pembawa dilengkapi dengan pengatur tekanan keluaran dan pengukur tekanan. Sebelum masuk ke kromatografi, ada pengukur kecepatan aliran gas serta sistem penapis molekuler untuk memisahkan air dan pengotor gas lainnya. Pada dasarnya kecepatan alir gas diatur melalui pengatur tekanan dua tingkat yaitu pengatur kasar (coarse) pada tabung gas dan pengatur halus (fine) pada kromatografi. Tekanan gas masuk ke kromatograf (yaitu tekanan dari tabung gas) diatur pada 10-50 psi (di atas tekanan ruangan) untuk memungkinkan aliran gas 25-150 mL/menit pada kolom terpaket dan 1-25 mL/menit untuk kolom kapiler.
Dalam kromatografi gas cuplikan harus dalam bentuk fase uap. Gas dan uap dapat dimasukkan secara langsung. Tetapi kebanyakan senyawa organik berbentuk cairan dan padatan. Hingga dengan demikian senyawa yang berbentuk cairan dan padatan pertama-tama harus diuapkan. Ini membutuhkan pemanasan sebelum masuk dalam kolom.
Tempat injeksi dari alat GLC/KGC selalu dipanaskan. Dalam kebanyakan alat, suhu dari tempat injeksi dapat diatur. Aturan pertama untuk pengaturan suhu ini adalah batiwa suhu tempat injeksi sekitar 50°C lebih tinggi dari titik didih campuran dari cuplikan yang mempunyai titik didih yang paling tinggi. Bila kita tidak mengetahui titik didih komponen dari cuplikan maka kita harus mencoba-coba. Sebagai tindak lanjut suhu dari tempat injeksi dinaikkan. Jika puncak-puncak yang diperoleh lebih baik, ini berarti bahwa suhu percobaan pertama terlalu rendah. Namun demikian suhu tempat injeksi tidak boleh terlalu tinggi, sebab kemungkinan akan terjadi perubahan karena panas atau penguraian dari senyawa yang akan dianalisa.
Cuplikan dimasukkan ke dalam kolom dengan cara menginjeksikan melalui tempat injeksi. Hal ini dapat dilakukan dengan pertolongan jarum injeksi yang sering disebut "a gas tight syringe".
Perlu diperhatikan bahwa kita tidak boleh menginjeksikan cuplikan terlalu banyak, karena GC sangat sensitif. Biasanya jumlah cuplikan yang diinjeksikan pada waktu kita mengadakan analisa 0,5 -50 ml untuk gas dan 0,2 - 20 ml untuk cairan seperti pada gambar di bawah.
3. Kolom
Coulom, ada dua jenis kolom yang digunakan dalam GC. Yang pertama adalahkolom kemas, yaitu berupa tabung yang terbuat dari gelas atau steinstless berisi suatu padatan inert yang dikemas secara rapi. Kolom ini memiliki ukuran panjang 1,5-10 m dan diameter 2,2-4 nm.
Yang kedua adalah kolom kapiler, yang biasanya terbuat dari silica dengan lapisan poliamida. Kolom jenis ini biasanya memiliki ukuran panjang 20-26 m dengan diameter yang sangant kecil.
4. Detektor
Detektor berfungsi sebagai pendeteksi komponen-komponen yang telah dipisahkan dari kolom secara terus-menerus, cepat, akurat, dan dapat melakukan pada suhu yang lebih tinggi. Fungsi umumnya mengubah sifat-sifat molekul dari senyawa organik menjadi arus listrik kemudian arus listrik tersebut diteruskan ke rekorder untuk menghasilkan kromatogram. Detektor yang umum digunakan:
a. Detektor hantaran panas (Thermal Conductivity Detector_ TCD) b. Detektor ionisasi nyala (Flame Ionization Detector_ FID) c. Detektor penangkap elektron (Electron Capture Detector _ECD) d. Detektor fotometrik nyala (Falame Photomertic Detector _FPD) e. Detektor nyala alkali
f. Detektor spektroskopi massa
Detector, yang paling umum digunakan dalam GC adalah detector ionisasi nyala (FID) dan detector kondutivitas termal (TCD). Kedunya peka terhadap berbagai komponen dan dapat berfungsi pada berbagai konsentrasi. Sementara TCD pada dasarnya universal dan dapat digunakan untuk mendeteksi setiap komponen selain gas pembawa (selama konduktivitas mereka berbeda dari gas pembawa, suhu detektor),dalam jumlah besar sensitif terutama untuk hidrokarbon. Sedangkan FID tidak dapat mendeteksi air. TCD adalah detector non-destruktif, sedangkan FID adalah detector destruktif. Biasanya detector ini akan dihubungkan dengan Spektrokopi Masa, sehingga akan menjadi rangkaian alat GC-MS. Adapun salah satu bentuk dari FID adalah sebagai berikut :