BAB 4
HASIL PERCOBAAN DAN BAHASAN
Bahan baku asam askorbat dan sianokobalamin diperiksa menurut Farmakope Indonesia IV. Hasil pemeriksaan bahan baku dapat dilihat pada Tabel 4.1.
Tabel 4.1 Pemeriksaan Bahan Baku
Asam Askorbat Sianokobalamin Pemeriksaan Data Pustaka
(FI IV) Pengamatan Sampel Data Pustaka (FI IV) Pengamatan Sampel Pemerian Identifikasi : Spektrum serapan UV Penetapan Kadar Serbuk berwarna putih menunjukkan serapan sesuai dengan larutan BPFI, λmaks = 266 nm 100,3 % Serbuk berwarna putih sama dengan larutan BPFI, λmaks = 266 nm 99,0 – 100,5 % serbuk hablur merah λmaks = 278, 361, 550 nm 99,0 % serbuk hablur merah λmaks = 279, 362, 551 nm 96,0 – 100,5 %
Setelah dilakukan pemeriksaan bahan baku dilanjutkan dengan verifikasi metode analisis yang digunakan. Metode analisis yang digunakan adalah metode penetapan kadar asam askorbat dan sianokobalamin dengan kromatografi cair kinerja tinggi secara simultan (Noviyantih, 2007). Metode ini memiliki kemampuan yang besar dalam memisahkan campuran zat sehingga diharapkan dapat menganalisis kedua vitamin tersebut secara simultan.
Kondisi KCKT yang optimum diperoleh dengan menggunakan fasa gerak metanol : HOAc 1% - natrium pentasulfonat 0,1% (23:77) yang diatur keasamannya hingga pH 3,5 dengan penambahan trietilamin (TEA). Kolom yang digunakan adalah Lichrospktorher C18. Kecepatan aliran fasa gerak adalah 1,0 ml/ menit di mana waktu retensi dari asam askorbat dan sianokobalamin masing-masing adalah 1,90 dan 9,20 menit. Detektor yang digunakan adalah detektor UV pada panjang gelombang λ = 275 nm.
karena dapat mengatasi banyaknya pengaruh kepolaran dalam larutan (George F. M. Ball, 2006). Ion lawan yang dipilih untuk membentuk pasangan ion adalah natrium pentasulfonat.
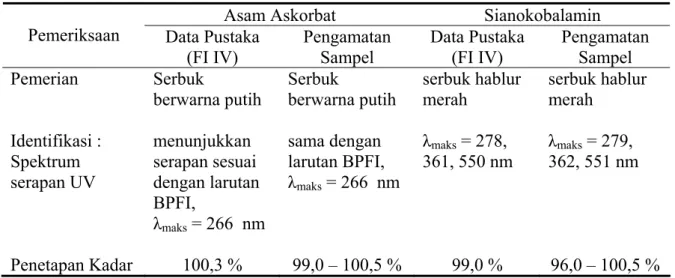
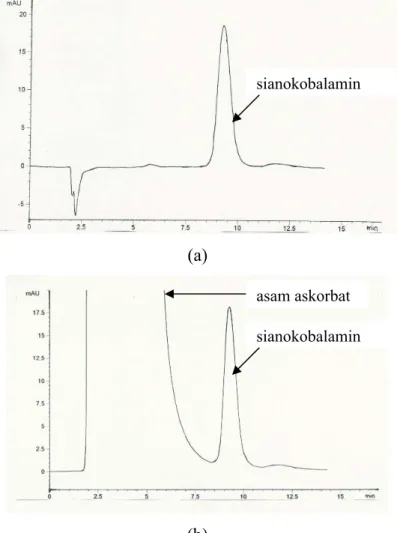
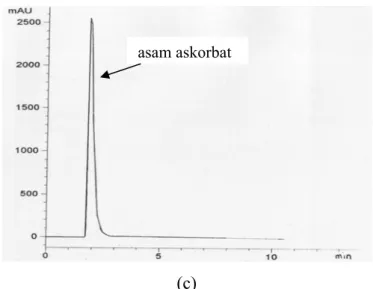
Setelah diperoleh kondisi optimum metode analisis, konsentrasi sisa asam askorbat dan sianokobalamin dalam larutan dapar asetat pH 4,80 diukur selama 12 minggu. Namun, pada minggu ke-3 pengamatan, metode analisis simultan yang digunakan tidak bisa diteruskan untuk analisis kuantitatif asam askorbat. Hal ini disebabkan karena terjadi penumpukan puncak hasil urai asam askorbat seperti terlihat pada gambar 4.2.(b) sehingga digunakan metode lain untuk mengamati perubahan konsentrasi asam askorbat.
sianokobalamin
(a)
sianokobalamin asam askorbat
(b)
Gambar 4.1 Contoh kromatogram KCKT sianokobalamin (a) dan sianokobalamin dengan asam askorbat (b) dalam dapar asetat pH 4,80 dengan perbandingan asam askorbat dan sianokobalamin 1 : 100.
(a)
asam askorbat asam askorbat
(b)
Gambar 4.2 Contoh kromatogram asam askorbat pada minggu pertama pengamatan (a) dan asam askorbat pada minggu ke-3 pengamatan (b) dalam dapar asetat pH 4,80 dengan perbandingan asam askorbat dan sianokobalamin 1 : 100.
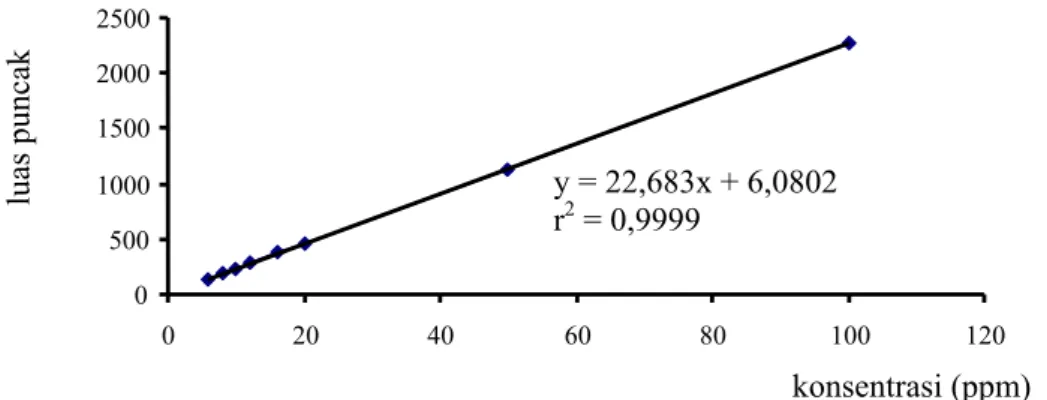
Sedangkan pengamatan terhadap perubahan konsentrasi sianokobalamin tetap dilakukan dengan metode tersebut. Setiap dilakukan pengukuran, dibuat kurva kalibrasi terlebih dahulu. Dibuat pula kurva kalibrasi sianokobalamin dengan adanya asam askorbat. Contoh kurva kalibrasi sianokobalamin dapat dilihat pada Gambar 4.3.
Konsentrasi asam askorbat yang digunakan dalam larutan uji adalah 2000 μg/ml sedangkan konsentrasi sianokobalamin adalah 20 μg/ml. Asam askorbat dan sianokobalamin dilarutkan dalam dapar asetat pH 4,80. Larutan asam askorbat memiliki pH stabilitas optimum pada pH 5,40. Sedangkan sianokobalamin paling stabil pada pH 4,5 – 5,0 (Connors dkk., 1992; Wade, 1994). Dapar asetat pH 4,80 dipilih karena konsentrasi asam askorbat terdapat dalam jumlah jauh lebih besar daripada konsentrasi sianokobalamin.
konsentrasi (ppm) 120 40 20 0 1000 1500 2000 luas punca 500 0 y = 22,683x + 6,0802 r2 = 0,9999 100 80 60
Gambar 4.3 Contoh kurva kalibrasi pengukuran kadar sianokobalamin.
Penguraian asam askorbat dapat terjadi di bawah kondisi aerob maupun anaerob membentuk hasil urai yang berbeda. Di bawah kondisi aerob, asam askorbat teroksidasi menjadi asam dehidroaskorbat. Di bawah kondisi anaerob, asam askorbat mengalami dehidrasi dan hidrolisis membentuk furfural dan karbondioksida (Connors dkk., 1992).
Pada percobaan ini larutan uji dikemas dalam ampul yang ditutup dengan aluminium foil dan dialiri gas nitrogenselama 10 detik. Hal ini dilakukan karena sianokobalamin bersifat fotosensitif dan asam askorbat mudah teroksidasi dalam larutan (Connors dkk., 1992; Remington, 2005). Adanya cahaya akan memecah ikatan organometalik pada sianokobalamin menghasilkan kob(II)alamin. Pembentukan kob(II)alamin diindikasikan dengan adanya perubahan warna larutan sianokobalamin dari merah menjadi coklat (Connors dkk., 1992; Hogenkamp, 1980).
Untuk melihat adanya interaksi antara asam askorbat dan sianokobalamin maka dibuat masing-masing larutan asam askorbat dan sianokobalamin. Larutan ini digunakan sebagai larutan pembanding terhadap penurunan konsentrasi asam askorbat dan sianokobalamin yang dikombinasikan.
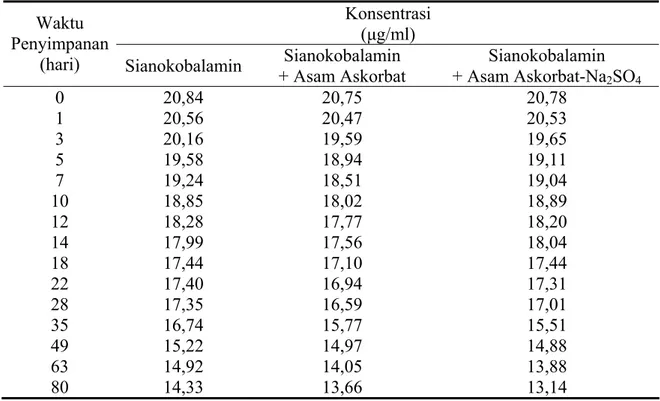
Konsentrasi sianokobalamin yang tersisa dalam larutan selama 12 minggu pengamatan dapat dilihat pada Tabel 4.2.
Pada Gambar 4.4. terlihat bahwa konsentrasi sianokobalamin dalam larutan dengan penambahan asam askorbat cenderung lebih rendah daripada larutan tunggalnya. Dapat pula dilihat profil penurunan konsentrasi sianokobalamin dalam larutan kombinasi asam askorbat dan natrium sulfat.
Tabel 4.2 Konsentrasi Sianokobalamin yang Tersisa dalam Dapar Asetat pH 4,80 Konsentrasi
(μg/ml) Waktu
Penyimpanan
(hari) Sianokobalamin + Asam Askorbat Sianokobalamin + Asam Askorbat-NaSianokobalamin 2SO4 0 20,84 20,75 20,78 1 20,56 20,47 20,53 3 20,16 19,59 19,65 5 19,58 18,94 19,11 7 19,24 18,51 19,04 10 18,85 18,02 18,89 12 18,28 17,77 18,20 14 17,99 17,56 18,04 18 17,44 17,10 17,44 22 17,40 16,94 17,31 28 17,35 16,59 17,01 35 16,74 15,77 15,51 49 15,22 14,97 14,88 63 14,92 14,05 13,88 80 14,33 13,66 13,14
Ket : Jumlah sampel larutan uji untuk setiap pengukuran, n = 2.
12 14 16 18 20 22 0 10 20 30 40 50 60 70 80 9 waktu (hari) kons ent ra s 0 i
sianokobalamin sianokobalamin-asam askorbat sianokobalamin-asam askorbat-natrium sulfat
Gambar 4.4 Grafik konsentrasi sianokobalamin terhadap waktu.
Selain dilakukan analisis terhadap perubahan konsentrasi sianokobalamin, dilakukan juga analisis terhadap perubahan konsentrasi asam askorbat. Namun, metode yang diharapkan dapat menganalisis kedua vitamin secara simultan tidak dapat diteruskan untuk analisis kuantitatif asam askorbat. Pada minggu ke-3 pengamatan, terlihat penumpukan puncak
kualitatif asam askorbat.
Konsentrasi asam askorbat yang tersisa dalam larutan diverifikasi dengan menggunakan metode analisis baru. Metode ini digunakan oleh Ichikawa (2005) untuk menganalisis penguraian asam askorbat dengan adanya sianokobalamin. Fasa gerak yang digunakan adalah metanol : larutan fosfat 20mM (25:75) yang diatur keasamannya hingga pH 3,0 dengan penambahan asam fosfat (H3PO4). Kolom yang digunakan adalah Lichrospher C18. Kecepatan aliran fasa gerak adalah 1,0 ml/ menit dan waktu retensi asam askorbat adalah 1,80 menit. Detektor yang digunakan adalah detektor UV pada panjang gelombang λ = 290 nm. Larutan asam askorbat yang telah teroksidasi dan larutan segar asam askorbat disuntikkan ke dalam sistem kromatografi cair kinerja tinggi. Terlihat puncak baru pada larutan asam askorbat yang telah teroksidasi di 3,60 menit. Contoh kromatogram dapat dilihat sebagai berikut.
asam askorbat (a) asam askorbat Hasil urai asam askorbat (b)
asam askorbat
(c)
Gambar 4.5 Kromatogram KCKT larutan asam askorbat segar dalam dapar asetat pH 4,80 (a) larutan asam askorbat yang telah teroksidasi (b) contoh kromatogram KCKT sampel uji pada minggu ke-3 pengamatan (c) dengan perbandingan asam askorbat dan sianokobalamin 1 : 100.
Dengan menggunakan metode analisis di atas konsentrasi sisa asam askorbat dalam larutan dapar asetat pH 4,80 diukur. Setiap dilakukan pengukuran, dibuat kurva kalibrasi terlebih dahulu. Dibuat pula kurva kalibrasi asam askorbat dengan adanya natrium sulfat. Berikut contoh kurva kalibrasi asam askorbat.
luas punca k 3000 2500 2000 1500 1000 500 0 50000 40000 30000 20000 10000 0 y = 15,357x + 8137,1 r2 = 0,9997 konsentrasi (ppm)
Gambar 4.6 Contoh kurva kalibrasi pengukuran kadar asam askorbat.
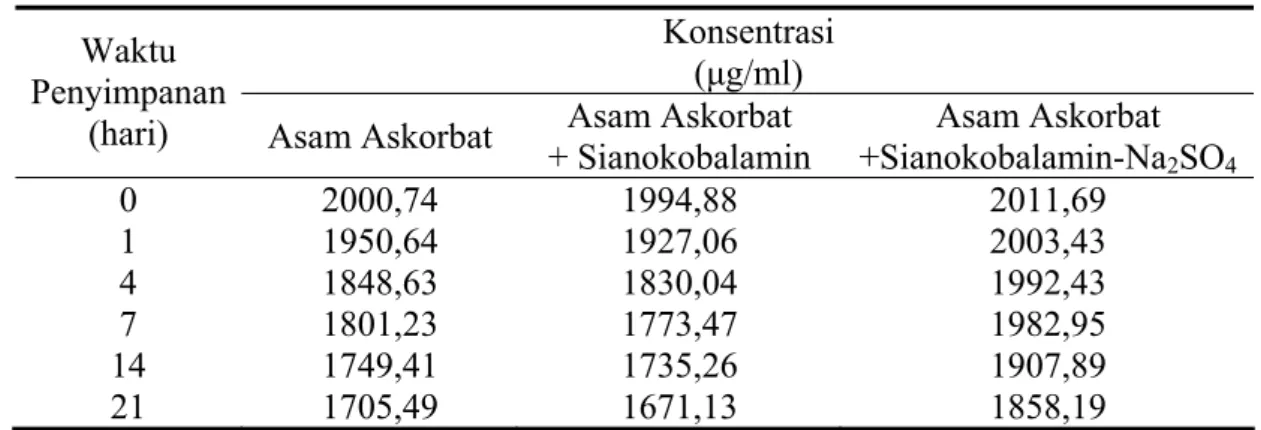
Konsentrasi asam askorbat yang tersisa dalam larutan dapar asetat pH 4,80 selama 3 minggu pengamatan dapat dilihat pada Tabel 4.3.
Pada Gambar 4.7. terlihat bahwa konsentrasi asam askorbat dalam larutan dengan penambahan sianokobalamin cenderung lebih rendah daripada larutan tunggalnya. Dapat pula dilihat profil penurunan konsentrasi asam askorbat dalam larutan kombinasi sianokobalamin dan natrium sulfat.
(μg/ml) Penyimpanan
(hari) Asam Askorbat + Sianokobalamin Asam Askorbat +Sianokobalamin-NaAsam Askorbat 2SO4 0 2000,74 1994,88 2011,69 1 1950,64 1927,06 2003,43 4 1848,63 1830,04 1992,43 7 1801,23 1773,47 1982,95 14 1749,41 1735,26 1907,89 21 1705,49 1671,13 1858,19
Ket : Jumlah sampel larutan uji untuk setiap pengukuran, n = 2.
1650 1750 1850 1950 2050 0 3 6 9 12 15 18 21 24 waktu (hari) kons ent ra si
asam askorbat asam askorbat-sianokobalamin asam askorbat-sianokobalamin-natrium sulfat
Gambar 4.7 Grafik konsentrasi asam askorbat terhadap waktu.
Dari konsentrasi sisa asam askorbat dan sianokobalamin dalam larutan terhadap waktu dihitung konstanta kecepatan reaksi masing-masingnya. Menurut literatur, reaksi penguraian sianokobalamin dan asam askorbat mengikuti persamaan reaksi orde satu semu (Connors dkk., 1992).
Reaksi penguraian asam askorbat dan sianokobalamin mengikuti reaksi orde satu. Saat asam askorbat dan sianokobalamin dikombinasikan reaksi keseluruhan tetap orde satu. Hal ini disebabkan karena konsentrasi asam askorbat dalam larutan jauh lebih besar daripada sianokobalamin sehingga reaksi hanya bergantung pada konsentrasi asam askorbat.
Tabel 4.4 Hasil Perhitungan Konstanta Kecepatan Penguraian (k) Orde Satu Asam Sianokobalamin
Larutan Uji k r2
Sianokobalamin 0,0047 0,9292
Sianokobalamin-asam askorbat 0,0051 0,9248
Sianokobalamin-asam askorbat-natrium sulfat 0,0057 0,9647
Dari hasil yang diberikan oleh persamaan reaksi orde satu dapat dilihat bahwa k3 > k2 > k1. Berarti bahwa kecepatan penguraian sianokobalamin terjadi lebih cepat dengan adanya asam askorbat dan natrium sulfat.
Tabel 4.5 Hasil Perhitungan Konstanta Kecepatan Penguraian (k) Orde Satu Asam Askorbat
Larutan Uji k r2
Asam askorbat 0,0071 0,8704
Asam askorbat-sianokobalamin 0,0075 0,8689
Asam askorbat-sianokobalamin-natrium sulfat 0,0039 0,9758
Dari hasil yang diberikan oleh persamaan reaksi orde satu dilihat bahwa k2 > k1 > k3. Dapat diartikan bahwa adanya sianokobalamin mempercepat kecepatan penguraian asam askorbat sedangkan natrium sulfat memperlambat kecepatan penguraian asam askorbat.
Konstanta kecepatan penguraian, k, dari reaksi orde satu antara larutan tunggal sianokobalamin dan asam askorbat, larutan kombinasi sianokobalamin dan asam askorbat, dan larutan kombinasi dengan penambahan natrium sulfat dianalisis secara statistik apakah terdapat perbedaan berarti. Dilakukan uji statistik menggunakan metode one way analisis variansi.
Pada uji statistik terhadap sianokobalamin dan asam askorbat didapatkan masing-masing nilai F(2,3) 12,962 dan 52,327. Nilai F hitung berarti dan melampaui aras 0,05 (9,55). Selanjutnya dilakukan uji Student-Newman-Keuls untuk membandingkan semua pasangan k yang mungkin, yang dalam hal ini terdapat tiga pasangan. Diperoleh hasil bahwa tidak terdapat perbedaan berarti antara larutan tunggal sianokobalamin dan asam askorbat dengan larutan kombinasi keduanya. Namun, penambahan natrium sulfat terhadap larutan uji asam askorbat dan sianokobalamin menunjukkan perbedaan berarti.
vitamin ini tidak berbeda berarti. Penambahan natrium sulfat dapat meningkatkan stabilitas asam askorbat namun menurunkan stabilitas sianokobalamin.
Kombinasi sianokobalamin dalam larutan dengan L-asam askorbat menyebabkan hidroksilasi pada atom C5 dan pembentukan lakton pada C6 dan C7 pada kondisi aerob (Hogenkamp, 1980). Percobaan ini dilakukan dengan mengalirkan gas nitrogen ke dalam larutan uji sehingga oksigen yang ada digantikan oleh nitrogen. Hal ini dilakukan untuk mencegah oksidasi asam askorbat. Sehingga interaksi yang terjadi antara asam askorbat dan sianokobalamin tidak dipengaruhi oleh adanya oksigen yang memicu oksidasi asam askorbat. Namun, masih ada kemungkinan terdapat oksigen dalam larutan sehingga interaksi antara asam askorbat dan sianokobalamin dapat terjadi. Oleh karena itu, menurut hasil percobaan saat asam askorbat ditambahkan ke dalam larutan uji sianokobalamin terlihat penurunan kadar dari keduanya. Disebabkan karena kemungkinan oksigen yang ada sangat sedikit, maka penurunan kadar ini tidak berarti secara statistik.