EFEK TOKSISITAS KOMPONEN BIOAKTIF DAUN LOBAK (Raphanus sativus Landra. var. hortensis Back.) DENGAN METODE BRINE SHRIMP LETHALITY TEST SEBAGAI KANDIDAT ANTIKANKER DAN PROFIL
KROMATOGRAFI LAPIS TIPISNYA
TOXICITY EFFECT BIOACTIVE COMPOUND OF LOBAK (Raphanus sativus Landra. var. hortensis Back.) LEAVES WITH BRINE SHRIMP LETHALITY TEST METHOD AS ANTICANCER CANDIDATE AND
THAT THIN LAYER CRHOMATOGRAPHY PROFILE Yustin Nur Khoiriyah, Rita Rakhmawati, Endang Anggarwulan Department of Biology, Faculty of Mathematics and Natural Sciences,
Sebelas Maret University, Surakarta. ABSTRACT
Cancer have a great rank position to cause of people death in developing country (Indrayani et al., 2006).Thesynthetic drug of cancer to healing trade have been give side effects and almost expensive relatively.This reason is push ahead to discover a new source drug of cancer. Indonesia have a great potency in this case. One of the plant which have potency to be a new source drug of anticancer candidate is Lobak (Raphanus sativus L.). This vegetables as drug usefull have various bioactive compound on this leaves and tuber, and it has been used empirical for anticancer drugs. The new source drug as a candidate of anticancer require to be proved scientifically.
In this research was conducted toxicity effect from bioactive compound of Lobak (Raphanus sativus L.) leaves with BST method as pre screening to discover an anticancer compound. The brine shrimp lethality test as toxicity test has been done by including ten larva A. salina Leach into flacon contain test sampel. Death percentage of A. salina Leach larva was counted 24 hours after giving of test sampel rate series, then made equation of linear line to determine values of LC50-24 hours.
The result of toxicity test showed that methanol extract more toxic than chloroform extract. The partition result of methanol extract showed that insoluble fraction of ethyl acetate more toxic than soluble fraction of ethyl acetate. Insoluble fraction of acetate ethyl as toxic fraction, then be partitionated with acetonitril. The test result of partition with acetonitril by BST showed that insoluble fraction acetonitril is more toxic than soluble fraction of acetonitril with values of LC50-24 hours = 90,54 g/mL. TLC chromatogram with various specific reagent showed that insoluble fraction of acetonitril found a phenolic compound.
PENDAHULUAN
Kanker menempati peringkat tertinggi sebagai penyebab kematian di negara berkembang (Indrayani et al., 2006). Usaha penyembuhan dengan obat kanker sintetis umumnya masih relatif mahal dan memiliki efek samping yang besar. Hal tersebut mendorong dilakukannya pencarian sumber obat baru yang berasal dari alam sebagai salah satu kandidat yang berkhasiat antikanker.
Salah satu tanaman yang berpotensi sebagai sumber obat baru untuk kandidat antikanker adalah tanaman Lobak (Raphanus sativus L.). Tanaman sayur berkhasiat obat ini, umbi dan daunnya mengandung berbagai kandungan kimia seperti saponin, flavonoid dan polifenol, minyak atsiri, vitamin A dan C serta bijinya mengandung 30-40% minyak lemak dan minyak atsiri. Zat-zat tersebut mengandung antibiotik terhadap beberapa jenis bakteri dan antioksidan (Mursito, 2007; Kumalaningsih, 2008). Beberapa penelitian Lobak telah dilaporkan tentang ekstrak metanol 95% akar Lobak segar, telah diisolasi satu senyawa penangkap radikal DPPH dengan EC50 0,701 mg/mL yang diduga sebagai turunan isotiosianat (Ervina et al., 2001). Senyawa isotiosianat sendiri diketahui sanggup berperan memblok aktivasi pembentukan metabolit karsinogen dan meningkatkan detosifikasi karsinogen (Yulianto, 2005), sehingga berkhasiat sebagai hepatoprotektor dan mencegah kanker.
Lee et al., (2006) melaporkan hasil penelitiannya bahwa ekstrak metanol kecambah Lobak mampu menginduksi Quinon Reductase (QR) yang berperan penting untuk melindungi dari karsinogen dan xenobiotik lain. Zat aktif Indole-3-carbinolnya, berkhasiat anti tumor, khemopreventif terhadap tumor payudara, menghambat karsinogenesis terhadap cell line estrogen responsive, imunomodulator dan mampu meningkatkan produksi TNF (Tumor Necrosis Factor) sehingga sangat berguna dalam pencegahan terhadap tumor (Weng et al., 2008). Serat di dalamnya dapat mencegah risiko kanker usus besar (kolon) (Raharjo, 2004).
Berdasarkan hal tersebut, Lobak berpotensi sebagai sumber obat baru kandidat antikanker, namun agar dapat dipertanggungjawabkan, diperlukan penelitian ilmiah lebih lanjut tentang komponen bioaktif dari daun Lobak.
Uji toksisitas sebagai skrining awal senyawa bahan alam yang diduga berkhasiat antikanker yaitu dengan menggunakan hewan uji Artemia salina Leach. yang dikenal dengan Brine Srhimp Lethality Test (BST) (McLaughlin et al., 1998). Senyawa toksik pada BST mempunyai korelasi terhadap uji sitotoksik, mengingat sifat toksik terhadap sel (sitotoksik) harus dimiliki suatu senyawa kandidat antikanker. Penelitian ini dilakukan untuk mengetahui adanya efek toksisitas dari komponen bioaktif daun Lobak dengan metode BST sebagai skrining awal pencarian senyawa antikanker.
BAHAN DAN METODE Alat dan Bahan
Alat-alat yang diperlukan dalam penelitian ini adalah rotary evaporator (Heidolp vv 2000, Germany), Oven (Memert, Germany), lampu UV, syringe, pipa kapiler, bejana pengembang, alat-alat gelas, mikropipet 10-1000 µL, mikropipet 20-250 µL, flakon, gelas ukur 50 mL, vortek, lampu 5 watt, neraca analitik, spatula, pipet tetes, wadah penetasan dengan 2 tipe ruang (terang dan gelap), aerator dan refraktometer.
Bahan-bahan yang digunakan untuk penelitian ini adalah daun Lobak (R. sativus L.) yang diambil dari Tawangmangu, pelarut penyari metanol dan kloroform berderajat pro analisis dari E. Merck, plat silica gel 60 GF254, etil asetat, kloroform, asetonitril, aseton, telur A. salina Leach, air laut dengan kadar garam 5%, suspensi ragi (Fermipan®), aquades, Serium (IV) sulfat, reagent dragendorf, FeCl3, vanilin asam sulfat, lieberman-burchad, anisaldehid, uap amonia dan uap iodium.
Cara Kerja
1. Persiapan sampel
Daun segar yang telah dibersihkan dari kontaminan bahan lain dikeringkan menggunakan sinar matahari tidak langsung dengan cara ditutup kain hitam, selanjutnya daun yang sudah kering diserbuk dengan menggunakan blender.
2. Pemisahan komponen bioaktif
Pemisahan komponen bioaktif daun Lobak meliputi beberapa tahapan yaitu ekstraksi dan partisi. Ekstraksi menggunakan metode maserasi dengan penyari metanol dan kloroform. Ekstrak teraktif dipartisi dengan etil asetat untuk memperoleh dua fraksi, yaitu fraksi larut dan fraksi tidak larut etil asetat. Fraksi teraktif dari hasil partisi dengan etil asetat selanjutnya dipartisi kembali dengan asetonitril. Pada tiap tahap pemisahan dimonitoring dengan KLT untuk mengetahui hasil pemisahan kandungan kimia dan BST sebagai bioassay guided extraction and partition.
3. Uji toksisitas dengan Metode BST
Telur udang Artemia salina L. ditetaskan dalam wadah yang terdiri dua ruang (gelap dan terang) dan berisi air laut. Telur A. salina dimasukkan dalam air laut yang telah diaerasi dan diberi penerangan dengan cahaya lampu 5 watt. Setelah 24 jam telur akan menetas dan siap dipindahkan dalam wadah baru sampai umur 24 jam. Setelah 24 jam, didapatkan nauplius A. salina berumur 24 jam yang siap digunakan untuk uji toksisitas.
Larutan uji yang dibuat dengan berbagai konsentrasi (50, 75, 100, 500, 1000 µg/mL), dalam kloroform:metanol (1:1 v/v) kemudian dimasukkan dalam flakon. Pembuatan kontrol uji dilakukan dengan memasukkan pelarut kloroform:metanol (1:1 v/v) dalam flakon sebagai kontrol uji. Flakon tersebut dan flakon kontrol uji diuapkan sampai tidak berbau pelarut, selanjutnya diisi dengan 1 mL air laut dan dihomogenisasi dengan menggunakan vortek.
Sepuluh ekor A. salina yang bergerak aktif secara acak dimasukkan ke dalam flakon-flakon yang telah diisi sampel dengan konsentrasi tertentu, air
laut ditambahkan hingga volume mencapai 5 mL. Makanan yang digunakan adalah ragi Saccharomyces cerevisae dengan konsentrasi 3 mg/5 mL air laut, sebanyak 1 tetes di masukkan ke dalam masing-masing flakon. Flakon-flakon tersebut diletakkan di bawah lampu penerangan selama 24 jam dan kemudian dihitung jumlah larva A. salina yang mati. Jumlah larva yang mati dihitung setelah 24 jam waktu kontak. Larva dikategorikan mati bila sudah tidak bergerak lagi. Setiap kadar uji dilakukan pengujian dengan lima kali pengulangan untuk mendapatkan data yang valid. Meyer et al. (1982), menyatakan bahwa suatu senyawa dikatakan toksik jika mempunyai nilai LC50 di bawah 1000 µg/ mL.
4. Penentuan Golongan Senyawa Fraksi Teraktif
Fraksi teraktif dianalisa kandungan senyawa kimianya dengan ditotolkan pada lempeng KLT silica gel 60 GF254. Jarak pengembangan 7,5 cm dengan fase gerak yang sesuai. Hasilnya dideteksi dengan sinar UV254 nm dan UV366 nm serta disemprot Serium (IV) sulfat untuk mendeteksi keberadaan senyawa organik secara umum, dan deteksi spesifik Lieberman-burchad, reagent Dragendorf, FeCl3, Vanilin asam sulfat, Serium (IV) sulfat, Anisaldehid, uap amonia dan uap iodium.
Analisis data
Uji toksisitas dianalisis dengan menghitung jumlah A. salina yang mati setelah 24 jam perlakuan dengan rumus:
% Kematian = jumlah larva A. salina mati x 100% jumlah larva uji
Dari hasil tersebut dapat dihitung nilai LC50 dengan membuat persamaan garis linier. Bila ada kematian pada kontrol dapat dikoreksi dengan rumus Abbot’s yaitu:
% Kematian = jumlah larva A. salina (Mati-kontrol) x 100% jumlah larva uji
Suatu senyawa atau ekstrak dikatakan toksik apabila menunjukkan LC50 < 1000µg/ml pada uji dengan BST (McLaughlin dan Ferrigni, 1983;Carballo et al., 2002).
Penentuan golongan fraksi komponen kandidat antikanker dideteksi dengan kromatografi lapis tipis dengan fase gerak dan fase diam yang sesuai serta pereaksi semprot yang spesifik. Profil kromatografi lapis tipis hasil deteksi semprot spesifik dianalisis secara kualitatif dengan analisis deskriptif.
HASIL DAN PEMBAHASAN Persiapan Sampel
Daun Lobak segar yang diperoleh disortir untuk mengurangi jumlah pengotor yang ikut terbawa dalam bahan utama. Debu dan mikroba yang melekat pada bahan dihilangkan dengan pencucian. Pengeringan dilakukan dibawah sinar matahari tidak langsung di tempat ternaung dengan tujuan untuk mencegah kerusakan senyawa akibat proses oksidasi, atau reaksi enzimatis lain seperti dekomposisi, perubahan pH yang akan menyebabkan hidrolisis senyawa iridoid dan flavonoid glikosida (Cannell, 1998). Daun yang sudah kering diserbuk dengan cara diblender. Pembuatan serbuk bertujuan untuk memperluas permukaan partikel yang berinteraksi dengan pelarut (Cannell, 1998).
Pemisahan Komponen Bioaktif dan Uji Brine Shrimp Lethality Test (BST) Serbuk diekstraksi menggunakan metode maserasi yang merupakan proses penyarian yang sederhana baik cara pengerjaan maupun peralatan yang digunakan. Maserasi dilakukan dengan merendam serbuk daun Lobak dalam pelarut kloroform untuk menarik senyawa-senyawa yang bersifat non polar dan sebagian senyawa semi polar yang terkandung dalam daun Lobak. Proses maserasi dengan kloroform dilakukan selama 3 kali 24 jam disertai pengadukan agar terjadi interaksi yang merata antara cairan penyari dengan seluruh permukaan masing-masing serbuk. Selain itu menurut Cannell (1998), pengadukan pada
proses maserasi ditujukan untuk meningkatkan efisiensi metode maserasi supaya kejenuhan pelarut terjadi lebih cepat dan maserat yang diperoleh lebih homogen.
Ampas sisa maserasi dengan kloroform yang tidak berbau pelarut, kemudian dimaserasi dengan metanol dengan langkah sama seperti di atas dan didapatkan ekstrak metanol kental dengan berat sebesar 49 gram.
Profil kandungan senyawa-senyawa yang terdapat dalam masing-masing ekstrak dapat dilihat pada Gambar 1.
Gambar 1. Kromatogram hasil KLT ekstrak kloroform dan ekstrak metanol
daun Lobak (A) Visibel (Sinar tampak) (B) dengan deteksi UV254,
(C) UV366, (D) Serium (IV) sulfat.
Fase diam : silika gel GF254
Fase gerak : CHCl3 : EtOAc 3:1 (v/v)
Keterangan : 1. Ekstrak CHCl3
2. Ekstrak MeOH
Hasil KLT menunjukkan bahwa ekstraksi yang dilakukan menunjukkan profil yang berbeda pada sistem fase gerak CHCl3 : EtOAc (3:1 (v/v)). Terlihat dengan tidak adanya tumpang tindih (overlapping) senyawa-senyawa pada kedua ekstrak. Hal ini berarti bahwa proses ekstraksi dengan kloroform berhasil menarik
2 2 2 2 1 1 1 1 B A C 1,00 0,25 0 0,5 0,75 D Rf
senyawa-senyawa yang bersifat semi polar dan non polar, sedangkan ekstraksi dengan metanol berhasil menarik senyawa-senyawa yang bersifat lebih polar.
Bioassay guided extraction dilakukan untuk menentukan ekstrak mana yang lebih aktif. BST merupakan metode uji hayati yang sederhana, cepat, mudah dan reproducible yang secara tidak langsung dapat mencerminkan toksisitas suatu senyawa atau bahan (Astuti et al., 2002).
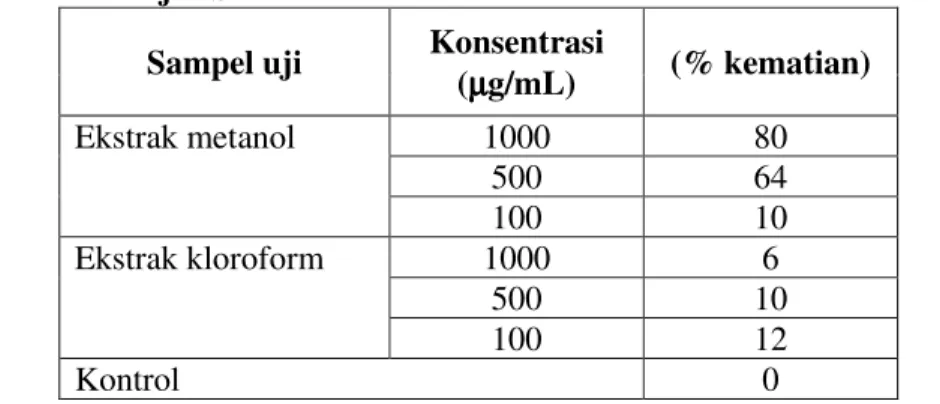
Hasil uji BST menunjukkan bahwa ekstrak metanol memberikan persentase kematian yang lebih besar terhadap larva A. salina, dengan persentase kematian sebesar 80% dibandingkan ekstrak kloroform dengan persentase kematian 6% pada konsentrasi larutan uji 1000 g/mL. Sehingga tahap partisi selanjutnya dilakukan terhadap ekstrak metanol.
Hasil uji BST ekstrak kloroform dan ekstrak metanol daun Lobak dapat dilihat pada tabel 1.
Tabel 1. Hasil uji BST ekstrak kloroform dan ekstrak metanol daun Lobak Sampel uji Konsentrasi
(µµµµg/mL) (% kematian) Ekstrak metanol 1000 80 500 64 100 10 Ekstrak kloroform 1000 6 500 10 100 12 Kontrol 0
Penelitian Lee et al., (2006) melaporkan bahwa ekstrak metanol kecambah Lobak ternyata mampu menginduksi Quinon reductase yang berperan penting dalam perlindungan terhadap penyebab kanker kimia yaitu pada sel mutan Hepa1c1c7 dan xenobiotik lain.
Ekstrak metanol dipartisi dengan menggunakan pelarut etil asetat sehingga dihasilkan dua fraksi, yaitu fraksi terlarut dan fraksi tidak larut etil asetat. Partisi ini dimaksudkan untuk menyari senyawa-senyawa yang lebih polar agar masuk dalam fraksi larut etil asetat (indeks kepolaran 4,4). Etil asetat sebagai pelarut
partisi diperoleh dari partisi pendahuluan dengan berbagai pelarut yang sebelumnya dipilih berdasar indeks kepolaran.
Profil KLT hasil partisi dengan etil asetat dapat dilihat pada Gambar 2.
Gambar 2. Kromatogram hasil KLT (1) fraksi larut etil asetat dan (2) fraksi tidak larut etil asetat dengan deteksi Serium (IV) sulfat.
Fase diam : silika gel GF254
Fase gerak : CHCl3 : EtOAc 3:1 (v/v)
Berdasarkan bioassay guided partition menggunakan Brine Shrimp Lethality Test (BST), fraksi tidak larut etil asetat memberikan persentase kematian yang lebih besar dari fraksi larut etil asetat (Tabel 2). Hal ini berarti senyawa teraktif berdasarkan metode BST berada pada fraksi tidak larut etil asetat yang selanjutnya akan dipartisi lebih lanjut dengan asetonitril.
Tabel 2. Hasil uji BST fraksi larut etil asetat dan fraksi tidak larut etil asetat daun Lobak.
Konsentrasi Larutan Uji (µµµg/mL) µ
Persentase kematian (%) Fraksi larut
etil asetat
Fraksi tidak larut etil asetat 100 10 84 Kontrol (Metanol 10µL/mL) 0 0 0,25 0,50 0,75 1,00 2 1 Rf
Berdasarkan indeks kepolaran dari asetonitril (5,8) (Cannell, 1998) maka senyawa yang terlarut dalam fraksi larut asetonitril merupakan senyawa semi polar, dan fraksi tidak larut asetonitril berupa senyawa yang lebih non polar. Profil kandungan senyawa fraksi larut asetonitril dan tidak larut asetonitril terlihat pada Gambar 3.
Gambar 3. Kromatogram hasil KLT (1) fraksi larut asetonitril, (2) tidak larut
asetonitril (A) Visibel (Sinar tampak) (B) dengan deteksi UV254, (C)
UV366, (D) Serium (IV) sulfat.
Fase diam : silika gel GF254
Fase gerak : EtOAc:Etanol:H2O (9:1:12 (v/v))
Profil kandungan senyawa kimia pada fraksi larut dan tidak larut asetonitril berdasarkan deteksi UV254, UV366 dan Serium (IV) sulfat tidak menunjukkan adanya kesamaan bercak (overlapping) pada kedua hasil partisi, sehingga uji toksisitas dengan BST dapat dilakukan pada kedua fraksi.
Hasil uji BST menunjukkan bahwa fraksi tidak larut asetonitril memberikan persentase kematian yang lebih besar dari fraksi terlarut asetonitril (Tabel 3). Melihat ketoksikan fraksi tidak larut asetonitril dibandingkan fraksi larut asetonitril, konsentrasi 100µg/mL menyebabkan kematian A. salina sebesar
2 1 0 0,25 0,50 0,75 1,00 Rf 2 1 1 2 1 2 A B C D
56%, sedangkan pada fraksi larut asetonitril tidak menyebabkan kematian dari konsentrasi 10-100µg/mL. Maka disimpulkan bahwa fraksi tidak larut asetonitril merupakan kandidat antikanker yang perlu diteliti lebih lanjut.
Tabel 3. Hasil uji BST fraksi larut asetonitril dan fraksi tidak larut asetonitril daun Lobak.
Konsentrasi Larutan Uji (µµµµg/mL)
Persentase kematian (%) Fraksi larut
asetonitril
Fraksi tidak larut asetonitril 100 0 56 75 0 40 50 0 28 20 0 8 10 0 2 Kontrol (Metanol 10µL/mL) 0
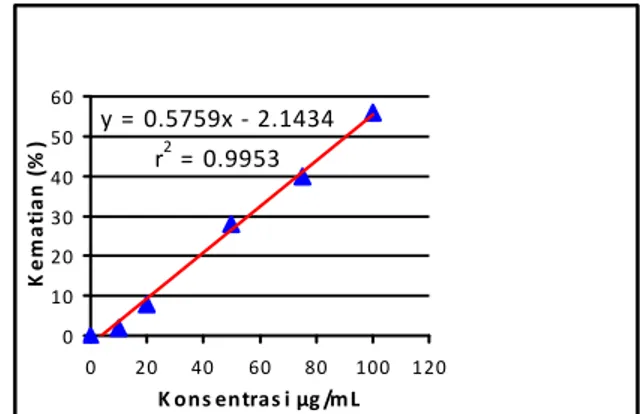
Berdasarkan persentase kematian fraksi tidak larut asetonitril dapat dihitung nilai LC50 dengan membuat persamaan garis linier y = bx + a.
Persamaan garis linier diperoleh dari kurva hubungan antara konsentrasi dan persen kematian larva A. salina dapat dilihat pada Gambar 4.
Gambar 4. Grafik hubungan persentase kematian dan konsentrasi larutan uji fraksi tidak larut asetonitril
Nilai LC50 ditentukan dengan persamaan garis lurus di atas (y=0,5759x-2,1434) dengan memasukkan nilai y=50 ke dalam persamaan persamaan garis lurus, dan diperoleh konsentrasi yang menyebabkan 50% kematian yaitu sebesar
90,54 µg/mL. LC50 menunjukkan konsentrasi yang menyebabkan kematian pada 50% hewan uji. Nilai LC50 yang diperoleh mencerminkan toksisitas senyawa terhadap hewan uji. Semakin kecil nilai LC50 suatu senyawa maka semakin tinggi toksisitasnya, dan sebaliknya semakin besar nilai LC50 suatu senyawa maka semakin rendah tingkat toksisitasnya. Meyer et al., (1982) menyatakan bahwa suatu senyawa dikatakan toksik jika mempunyai nilai LC50 di bawah 1000 µg/mL. Meskipun uji toksisitas dengan BST tidak dapat secara langsung menggambarkan kemampuan toksiknya terhadap sel kanker tertentu, namun metode ini sudah banyak dilaporkan bermanfaat untuk uji skrining senyawa aktif antikanker (Astuti et al., 2002). Mc Laughlin et al., (1998) menemukan adanya korelasi positif antara BST dgn uji sitotoksik 9KB (karsinoma nasofaring manusia), ditunjukkan dengan hasil uji sitotoksik yang memberi nilai ED50 9KB sama dengan 1/10 dari nilai LC50 hasil uji BST.
Penentuan Golongan Senyawa Fraksi Teraktif
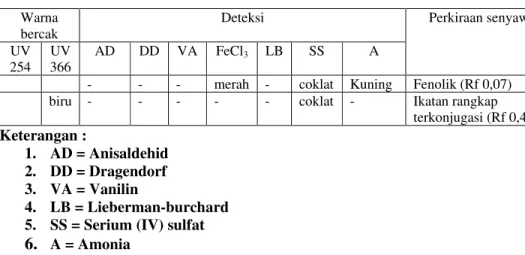
Penentuan golongan senyawa fraksi tidak larut asetonitril digunakan berbagai pereaksi semprot antara lain Lieberman-burchad, reagen Dragendorf, FeCl3, Vanilin asam sulfat, Serium (IV) sulfat, Anisaldehid, dan uap amonia (Tabel 4).
Tabel 4. Hasil deteksi dengan berbagai deteksi semprot fraksi teraktif tidak larut asetonitril
Warna bercak
Deteksi Perkiraan senyawa
UV 254
UV 366
AD DD VA FeCl3 LB SS A
- - - merah - coklat Kuning Fenolik (Rf 0,07)
biru - - - coklat - Ikatan rangkap
terkonjugasi (Rf 0,4) Keterangan : 1. AD = Anisaldehid 2. DD = Dragendorf 3. VA = Vanilin 4. LB = Lieberman-burchard
5. SS = Serium (IV) sulfat
Kandungan kimia fraksi tidak larut asetonitril dengan berbagai deteksi senyawa spesifik terlihat pada kromatogram (Gambar 5).
Gambar 5. Kromatogram fraksi tidak larut asetonitril
Fase diam : silika gel GF254
Fase gerak : CHCl3:aseton 1:1 (v/v)
Deteksi : A. Visibel (Sinar tampak)
B. Amonia
C. UV254
D. UV366
E. Anisaldehid F. Dragendorf
G. Serium (IV) sulfat
H. Lieberman burchad I. FeCl3
J. Vanillin asam sulfat
Hasil positif pada deteksi senyawa amonia ditandai dengan berubahnya warna bercak menjadi warna kuning (Gambar 5.B), yang menunjukkan bahwa kandungan senyawa dalam fraksi tersebut terdapat golongan senyawa fenolik. Hasil positif terjadi pula pada pereaksi semprot FeCl3 yang merupakan deteksi senyawa fenol. Hal ini ditunjukkan dengan perubahan warna totolan sampel fraksi
(A) (B) (C) (D) (E) (F) (G) (H) (I)
0 0,25 0,50 0,75 1,00 Rf (J)
tidak larut asetonitril menjadi merah. Pereaksi semprot FeCl3 merupakan cara klasik deteksi senyawa fenol sederhana yang menimbulkan warna hijau, merah, ungu, biru atau hitam yang kuat, tetapi kebanyakan fenol (terutama flavonoid) dapat dideteksi pada kromatogram berdasarkan warnanya atau flouresensinya di bawah lampu UV, warnanya diperkuat atau berubah bila diuapi amonia. Senyawa fenol berupa senyawa aromatik sehingga semua menunjukkan serapan kuat di daerah spektrum UV (Harborne, 1987). Hal ini dapat dilihat pada Gambar 5, dimana pada spektrum UV366 tampak bercak biru. Sehingga dapat disimpulkan bahwa di dalam fraksi tidak larut asetonitril terdapat senyawa golongan fenolik. Senyawa fenolik yang berhasil dideteksi pada penelitian ini dapat dikatakan sebagai salah satu golongan senyawa yang ikut bertanggung jawab terhadap kematian A. salina. Namun tidak menutup kemungkinan ada golongan senyawa lain yang ikut bertanggung jawab terhadap efek toksik A. salina yang belum terdeteksi.
Senyawa fenolik dilaporkan mempunyai sejumlah aktifitas biologis termasuk antioksidan. Menurut Duthie et al., (2007) terdapat hubungan antara proses terjadinya kanker (karsinogenesis) dengan senyawa antioksidan yang erat kaitannya dengan kerusakan oksidatif DNA. Dengan menekan reaksi oksidatif radikal bebas, kerusakan mitokondria sebagai organel penyedia energi dalam sel dapat dicegah. Antioksidan dapat melindungi disfungsi mitokondria dan gangguan lain yang dapat menyebabkan penyakit lain (Poon et al., 2004).
KESIMPULAN
1. Fraksi tidak larut asetonitril dari ekstrak metanol dari fraksi tidak larut etil asetat mempunyai efek toksisitas tertinggi terhadap A. salina dengan nilai LC50-24 jam sebesar 90,54 µg/mL.
2. Senyawa toksik yang terdapat dalam fraksi tidak larut asetonitril daun Lobak yang diduga ikut bertanggungjawab menyebabkan kematian larva Artemia salina Leach. adalah golongan senyawa fenolik.
UCAPAN TERIMA KASIH
Terimakasih kepada PHK A-2 Jurusan Biologi FMIPA UNS Surakarta tahun 2008 atas dukungan dana penelitiannya dan segenap tim pengurusnya.
DAFTAR PUSTAKA
Astuti, P., Alam, G., Hartati, M.S., Sari, D. dan Wahyuono, S. 2005. Uji Sitotoksik Senyawa Alkaloid dari Spons Petrosia sp.: Potensial Pengembangan Sebagai Antikanker. Majalah Farmasi Indonesia, 16 (1): 58-62
Cannel R.J.P. 1998. Natural Products Isolation. New Jersey: Humana Press Carballo, J.L., Inda, Z.L.H., Perez, P, Gravalos, M.D.G. 2002. A comparison
between two brine shrimp assays to detect in vitro cytotoxicity in marine natural products. BMC Biotechnology 2 (17) : 1-5
Duthie, G.G, S.J. Duthie, and J.A.M. Kyle. 2000. Plant polyphenol in cancer and heart disease; implications as nutritional antioxidant. Nutrition Research Rreview 13: 79-106
Ervina, M., Soediro, I.S., Kusmardiyani, S. 2001. Telaah Fitokimia Akar Lobak (Raphanus sativus L. var, Hortensis Back.) sebagai Penangkap Radikal Bebas. Laporan Penelitian. Sekolah Farmasi Institut Teknologi Bandung. Harborne, J.B. 1987. Metode Fitokimia. Terbitan Kedua. Penerjemah:
Padmawinata, K. dan I. Sudiro. Bandung: Penerbit ITB
Indrayani, L.; Soetjipto, H., dan Sihasale, L. 2006. Skrining Fitokimia dan Uji Toksisitas Ekstrak Daun Pecut Kuda (Stachytarpheta jamaicensis L. Vahl) Terhadap Larva Udang Artemia salina Leach. Berk. Penel. Hayati 12 : 57– 61.
Kumalaningsih, S. 2008. Super Oksida Dismutase (SOD). http://antioxidantcentre.com/index.php?option=com_rss&feed=RSS2.0&no _html=1. [13 Agustus 2008]
Lee, S.O. and Lee, I.S. 2006. Induction of Quinone Reductase, The Phase 2 Anticarcinogenic Marker Enzyme, in Hepa1c1c7 Cells by Radish Sprouts, Raphanus sativus L. Journal of Food Science 71 (2) : S144-S148.
Mc Laughlin, J.L., and Ferrigni, N.R. 1983. Potato dises and brine shrimp: Two Simple bioassays for antitumor prescreening and fractionating monitoring. Proceeding of symposium on discovery and development of naturally occurring antitumor agents, National Cancer Institute, Frederick, Maryland : 9-12
Mc Laughlin, J.L, Rogers, L.L, Anderson, J.E. 1998. The Use of Biological Assays to Evaluate Botanicals. Drug Information Journal 32 : 513-524 Meyer, B.N., Ferrigni, N.R., Putnam, J.E., Jacobsen, L.B., Nichols D.E,
McLaughlin, J.L. 1982. Brine Shrimp: A Convenient General Bioassay for Active Plant Constituents. Plant Medica 45 : 31-34.
Mursito, D dan Kajawi. 2007. Pengaruh Kerapatan Tanaman dan Kedalaman Olah Tanah Terhadap Hasil Umbi LobakI. Laporan Penelitian. Fakultas Pertanian UNS, Surakarta.
Poon, H.F., Calabrese, V., Butterfield, D.A. 2004. Free radicals and brain aging. Clinical Geriatri Medical 20;329-359
Raharjo, S. 2004. Era Baru Ilmu Pangan dan Gizi. http://[email protected]. [29 Juli 2008]
Weng, J., Tsai, C., Kulp S.K., Chen, C. 2008. Indole-3-carbinol as a chemopreventive and anti-cancer agent. Cancer Letters 262:2, 153-163 Yulianto, W. A. 2005. Kubis sebagai Kemopreventif Kanker.
http://www.sinarharapan.co.id/iptek/kesehatan/2005/0304/kes1.html. [29 Juli 2008]