ABSTRACT:A comparative dissolution study on nine solid dosage forms containing gemfibrozil had been done using a method from the Indonesian Pharmacopoeia 4th edition. Products tested were 3 generics and 6 branded names marketed in Indonesia. The aim of this study was to obtain the in-vitro biopharmaceutics quality data from the generic and branded gemfibrozil products available in the market. The dissolution test was performed by using the paddle method in medium 0.2 M phosphate buffer pH 7.5 ± 0.05 and the analysis was done using spectrophotometer UV at the maximum wavelength of 278 nm. GF7, a generic product, was chosen as an innovator. The dissolution profiles of the innovator and copied products were compared by using a similarity factor (f2). Results showed that f2 < 50%, there was a significant difference between the innovator and other products (P<0.05). These were confirmed by the x-ray diffraction analysis which showed a difference of crystallinity degree of each products.
Keyword: gemfibrozil; dissolution profile; comparative dissolution; crystallinity index.
ABSTRAK:Telah dilakukan uji dissolusi terbanding 9 sediaan padat yang mengandung gemfibrozil sesuai persyaratan Farmakope Indonesia edisi 4. Produk yang diuji terdiri dari 3 sediaan generic dan 6 sediaan merek dagang yang beredar di Indonesia. Penelitian ini bertujuan untuk memperoleh data biofarmasetik in-vitro yang menggambarkan mutu gemfibrozil generic dan merek dagang di pasaran. Uji dissolusi dilakukan menggunakan metoda dayung dalam medium 900 mL dapar pospat 0,2 M pH 7,5 ± 0,05 dan analisis kuantitatif menggunakan spektrofotometer UV pada panjang gelombang serapan maksimum 278 nm. Produk GF 7, salah satu obat generic, dipilih sebagai innovator. Profil dissolusi antara innovator dengan produk terbanding dianalisa menggunakan factor similaritas (f2). Hasil menunjukkan bahwa nilai f2 semua produk terbanding < 50%; dimana profil dissolusi semua produk terbanding berbeda nyata dengan innovator (P<0,05). Perbedaan ini didukung oleh data difraksi sinar X yang menunjukkan semua produk memiliki indeks kristalinitas yang berbeda.
Kata kunci: gemfibrozil; profil dissolusi; dissolusi terbanding; indeks kristalinitas.
Access this article
website: jstf.ffarmasi.unand.ac.id QR Code:
Henny
Lucida
1*,
Dachriyanus
1,
Elyunaida
2.
1 Fakutas Farmasi Universitas Andalas, Padang 2 Balai Besar Pengawasan Obat dan Makanan, PadangCorresponding Author:
Henny Lucida Fakutas Farmasi Universitas Andalas, Padang hennylucida@gmail.com hennylucida@ffarmasi.unand. ac.id
Uji Dissolusi Terbanding Sediaan Padat
Gemfibrozil Generik dan Merk Dagang yang
Beredar di Indonesia
PENDAHULUAN
Gemfibrozil merupakan senyawa pengatur kadar lemak darah karena menurunkan kadar trigliserida serum, kolesterol total, kolesterol VLDL (Very Low
Density Lipoprotein), kolesterol LDL (Low Density Lipoprotein) dan meningkatkan
pembersihan apolipoprotein B sebagai pembawa VLDL sehingga kadar VLDL berkurang dan meningkatkan kolesterol HDL (High Density Lipoprotein) melalui peningkatan subfraksi HDL serta Apolipoprotein AI dan AII (DepKes RI, 1995, DepKes RI, 1979). Sediaan gemfibrozil yang beredar di pasaran berupa tablet atau kapsul, produk generik dengan produk merek dagang mempunyai harga jual yang berbeda, biasanya produk merek dagang lebih mahal daripada obat generik.
Gemfibrozil termasuk BCS (Biopharmaceutics Classification System) kelas II, praktis tidak larut dalam air namun permeabilitas tinggi. Untuk senyawa seperti
ini, laju dissolusi menjadi tahap penentu (rate
limiting step) proses absorpsi obat sehingga
pengembangan formula sediaan difokuskan pada peningkatan laju dissolusi. Uji dissolusi komparatif dapat menjadi pembeda kualitas sediaan gemfibrozil dan memprediksi tingkat ketersediaan hayatinya karena korelasi parameter in vitro-in vivo gemfibrozil cukup baik (Rouini MR et. al., 2008).
Perbedaan harga sediaan gemfibrozil yang bervariasi menimbulkan pertanyaan apakah mutu nya juga bervariasi sehingga intensitas efek yang ditimbulkan juga berbeda. Lebih lanjut dibutuhkan data untuk mendukung program pemerintah bahwa produk obat generic tidak kalah mutunya dengan produk merk dagang. Tujuan penelitian ini adalah melakukan uji mutu fisik semua sediaan gemfibrozil yang beredar di Indonesia dan membandingkan uji dissolusi nya sesuai monografi Farmakope Indonesia.
METODE PENELITIAN Sediaan Uji dan Bahan Kimia
Sampel GF1 (tablet Gemfibrozil 900 mg merk dagang), sampel GF2 (tablet Gemfibrozil 600 mg merk dagang), sampel GF3 (kapsul Gemfibrozil 300 mg merk dagang), sampel GF4 (tablet Gemfibrozil 600 mg merk dagang), sampel GF5 (tablet Gemfibrozil 300 mg merk dagang), sampel GF6 (kapsul Gemfibrozil 300 mg merk dagang), sampel GF7 (kapsul Gemfibrozil 300 generik), sampel GF8 (kapsul gemfibrozil 300 mg generik), sampel GF9 (tablet Gemfibrozil 600 mg generik), aquadest, Kalium dihidrogen fospat mono base P, natrium hidroksida P,Baku pembanding Gemfibrozil (BPFI).
Uji Mutu Sediaan Padat Gemfibrozil Menurut Farmakope Indonesia
1. Organoleptis, meliputi: bentuk, warna, bau dan rasa 2. Uji keragaman Bobot (Depkes RI, 1995)
3. Uji keseragaman Ukuran (Depkes RI, 1979)
4. Uji waktu hancur (Pharma Test Disintegration tester 3) (Depkes RI, 1995)
5. Penetapan Kadar secara Kromatografi Cair Kinerja Tinggi (KCKT) (Shimadzu®) (Depkes RI, 1995) 6. Uji profil disolusi (Dissolution Tester Hanson Research
SR 6®) menggunakan alat tipe I (dayung) (USP 29), medium 900 ml dapar pospat 0,2 M pH 7,5 + 0,05 (Metrohm Seven Easy pH meter), kecepatan 50 rpm, suhu 370 C± 0.50C dan waktu pengambilan cuplikan berturut-turut pada 1, 5, 10, 20, 40 dan 60 menit. Cuplikan dianalisis secara spektrofotometri (Spectrophotometer UV- 1800 Shimadzu®). Metoda analisis divalidasi dengan mengukur serapan larutan gemfibrozil BPFI dengan kadar 23, 38, 46, 76, 92 μg/ml di dalam dapar pospat 0,2 M pada panjang gelombang serapan maksimum 276 nm. Diperoleh persamaan regresi y = 0.1543 x – 0.0008 dan koifisien korelasi (r) = 0.9999.
7. Pengukuran indeks kristalinitas gemfibrozil di dalam sediaan menggunakan Difraksi sinar X (X’pert PRO, PAN analytical) yang dilengkapi dengan radiasi copper Kα (40 kV, 20 mA). Scan dilakukan dari 5o sampai 50o 2.
Analisis Data
Data profil dissolusi (grafik antara % zat terdisolusi terhadap waktu) dianalisis menggunakan 2 metoda: 1. Model Dependent Method: data profil dissolusi diolah
menggunakan persamaan Higuchi (Lucida H, et. al., 2008):
Dimana: Ct = jumlah zat aktif berpenetrasi pada waktu t, KH = konstanta laju penetrasi menurut persamaan Higuchi dan t = waktu. Luas daerah di bawah kurva pada profil disolusi diolah secara statistik menggunakan uji T
Student.
2. Model Independent Method: menghitung factor kemiripan (f2) sesuai peraturan Kepala Badan POM RI nomor HK. 00.05.3.1818, 29 Maret tahun 2005, tentang Pedoman Uji Bioekivalensi. Nilai f2 dihitung menggunakan persamaan:
Dimana: n = jumlah data point; Rt = % gemfibrozil terdissolusi dari produk innovator pada waktu t; Tt = % gemfibrozil terdissolusi dari produk uji pada waktu t. Profil dissolusi dinyatakan similar jika f2 ≥ 50 (WHO, 2006).
HASIL DAN DISKUSI
Hasil pemeriksaan mutu fisik sediaan uji (Tabel 1) menunjukkan bahwa terdapat 5 kaplet dan 4 kasul gemfibrozil, semua produk memenuhi persyaratan Farmakope Indonesia keragaman bobot, waktu hancur (1,18 – 13,34 menit) dan kadar gemfibrozil (94.75 % - 100.04 %) dalam sediaan. Untuk parameter keseragaman ukuran, diameter GF2, GF 4, GF 5 dan GF 9 berada diluar rentang yang dipersyaratkan yaitu antara 11/3 – 3 kali tebal, hal ini disebabkan diameter kaplet yang diukur adalah panjang kaplet sehingga melebihi persyaratan untuk tablet yang bentuknya bulat.
Terdapat perbedaan waktu hancur produk yang bila diurut dari yang tercepat sampai yang paling lama adalah GF4 (kaplet); GF1 (kaplet), GF5 (kaplet), GF8 (kapsul), GF3 (kapsul), GF6 (kapsul), GF9 (kaplet), GF7 (kapsul) dan GF2 (kaplet). Perbedaan dalam waktu hancur dapat disebabkan oleh perbedaan bentuk sediaan (kaplet dan kapsul) dan perbedaan komposisi bahan pengikat dan penghancur dalam matriks kaplet. Dalam penelitian ini ternyata kaplet GF4 memiliki waktu hancur yang paling pendek (1,18 menit), padahal dalam proses pencetakan mengalami kompressi menghasilkan massa yang lebih keras dibandingkan kapsul. Kapsul GF8, GF3 dan GF6 memiliki waktu hancur yang berdekatan yaitu sekitar 7 menit sedangkan kapsul GF7 10,14 menit. Waktu hancur sediaan kapsul dihitung sampai cangkang kapsul mengembang dan pecah semua, kemungkinan bahan cangkang kapsul GF7 berbeda sifatnya dengan bahan 3 kapsul lainnya.
Salah satu parameter penting mutu sediaan adalah kadar zat aktif di dalam sediaan. Sediaan gemfibrozil kapsul dan kaplet mengandung gemfibrozil, C15H22O3, pada rentang 94.75 % - 102.49 % sehingga memenuhi persyaratan USP 29 yaitu tidak kurang dari 90,0 % dan tidak lebih dari 110,0 % dari jumlah tertera pada etiket. Hasil ini menunjukkan bahwa produk generik dan merk dagang gemfibrozil yang beredar di Indonesia sudah
memenuhi persyaratan mutu penting sediaan obat. Kadar zat aktif yang ditemukan pada masing-masing sediaan dijadikan dasar untuk menghitung persen dissolusi per satuan waktu.
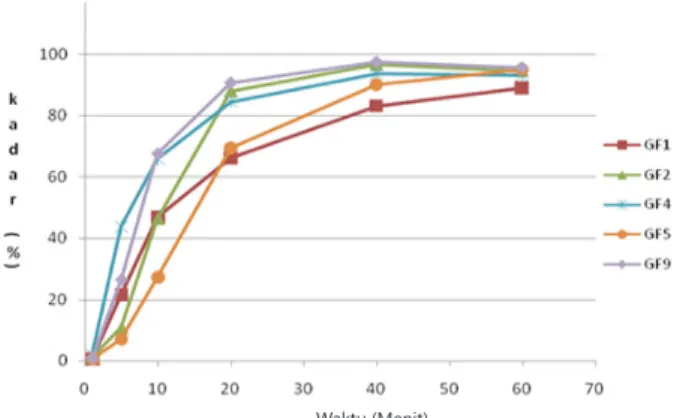
Hasil uji dissolusi pada Tabel 2 menunjukkan bahwa roduk GF7 pada menit ke 10 sudah terdissolusi 92,25%, sedangkan produk lainnya baru terdissolusi <70% bahkan produk GF5 masih 27,3%. Berdasarkan hal ini produk GF7 ditetapkan sebagai inovator. Pada profil dissolusi (Gambar 1) terlihat GF7 pada menit ke 5 persen terdisolusi telah mencapai lebih kurang 50 % yang terus meningkat sampai pada menit ke 40, dimana sudah mencapai lebih kurang 100 %. Pada produk – produk sediaan kapsul lain pada menit 40 hampir semua telah mencapai lebih kurang 80 %, kecuali produk GF3, yang pada menit ke 60 masih mencapai lebih kurang 70 %. Hasil dissolusi ternyata berbanding terbalik dengan waktu hancur, dimana kalau dibandingkan dengan sediaan dalam bentuk kapsul, aktu hancur produk GF7 lebih lama, yaitu 10.14 menit, dibandingkan dengan produk sediaan kapsul lain, yaitu GF3; GF6; dan GF8, yaitu 7.07 menit; 7.33 menit; 7.03 menit. Hasil uji profil disolusi produk sediaan kaplet lebih bervariatif (Gambar 2), disini terlihat produk GF2 mempunyai waktu hancur yang paling lama tapi terdisolusi paling baik, sedangkan produk GF1 waktu hancur lebih cepat tapi persen terdisolusi zat aktifnya tidak lebih bagus dari produk GF2.
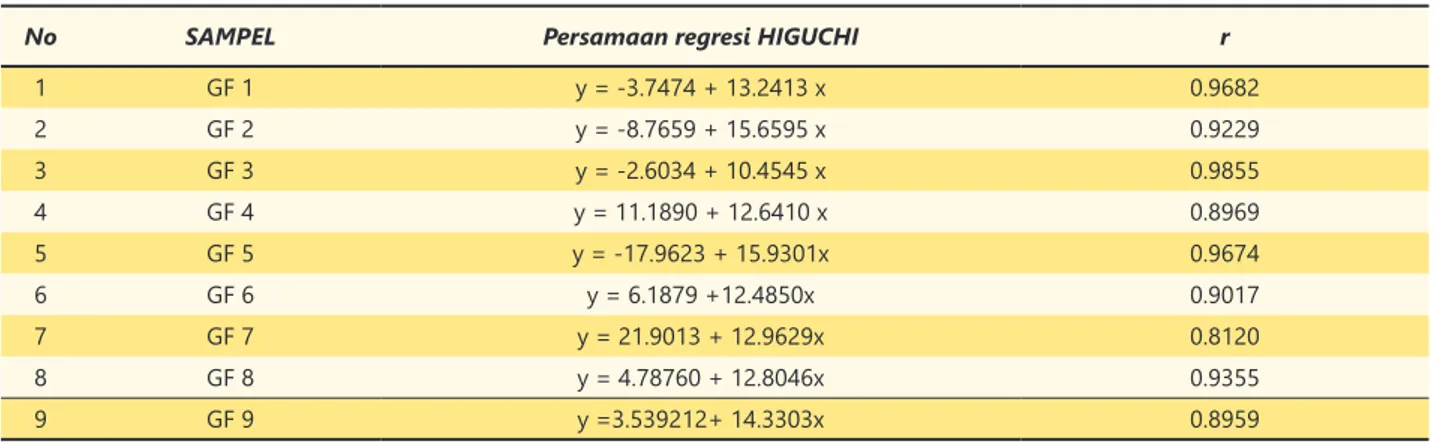
Pengolahan data dissolusi menggunakan model Higuchi (Tabel 3) menunjukkan bahwa mekanisme lepasnya gemfibrozil dari sediaan tidak semuanya mengikuti persamaan Higuchi, proses dissolusi produk GF1, GF3 dan GF5 mengikuti persamaan Higuchi karena nilai koefisien regresinya >0,95. Mekanisme lepasnya senyawa obat dari matriks sediaan sangat dipengaruhi
oleh komponen penyusun matriks sehingga formulasi yang berbeda akan menghasilkan mekanisme dissolusi yang berbeda pula.
Parameter dissolusi (T85) dari semua produk tidak dapat dihitung menggunakan persamaan Higuchi sehingga dihitung luas daerah dibawah kurva dissolusi untuk dapat menggambarkan efisiensi proses dissolusi. Data efisiensi disolusi dari masing-masing produk pada Tabel 4 bahwa GF7 (innovator) mempunyai efisiensi disolusi yang paling baik yaitu 92,08 %, sedangkan nilai efisiensi disolusi yang paling buruk adalah GF3 yaitu 51,45 %. Nilai factor similaritas (f2) pada Tabel 4 untuk semua produk <50% sehingga dapat disimpulkan bahwa profil dissolusi produk gemfibrozil GF1, GF2, GF3, GF4, GF5, GF6, GF8 dan GF9 tidak similar dengan produk innovator GF7. GF7 adalah obat generic dalam bentuk kapsul, memperlihatkan laju dissolusi dan efisiensi dissolusi yang paling baik yang tidak similar dengan produk lainnya. Hasil ini menunjukkan bahwa tidak selalu obat generic dengan harga lebih murah dari merk dagang memiliki mutu yang lebih jelek dari obat merk dagang.
Berdasarkan hasil uji disintegrasi dan uji disolusi dalam penelitian ini, dapat diketahui bahwa waktu hancur (desintegrasi) yang singkat tidak menjamin laju pelarutan (disolusi) zat aktif yang lebih efektif, karena uji desintegrasi hanya memberikan pengukuran yang tepat pada pembuatan fragmen, granul, atau agregat dari bentuk sediaan padat, sedangkan proses pelarutan berhubungan dengan luas permukaan efektif, dimana semakin kecil ukuran partikel obat maka makin cepat laju pelarutannya.
Perbedaan ini dimungkinkan dapat disebabkan karena adanya pengaruh teknologi seperti adanya variasi dalam bentuk, ukuran, dan kekerasan dalam punch dan
Tabel 3. Hasil analisa data profil dissolusi menurut persamaan Higuchi
No SAMPEL Persamaan regresi HIGUCHI r
1 GF 1 y = -3.7474 + 13.2413 x 0.9682 2 GF 2 y = -8.7659 + 15.6595 x 0.9229 3 GF 3 y = -2.6034 + 10.4545 x 0.9855 4 GF 4 y = 11.1890 + 12.6410 x 0.8969 5 GF 5 y = -17.9623 + 15.9301x 0.9674 6 GF 6 y = 6.1879 +12.4850x 0.9017 7 GF 7 y = 21.9013 + 12.9629x 0.8120 8 GF 8 y = 4.78760 + 12.8046x 0.9355 9 GF 9 y =3.539212+ 14.3303x 0.8959
Tabel 2. Hasil uji dissolusi terbanding gemfibrozil generic dan merk dagang
Produk Jumlah terdisolusi ( %) n=6
Menit 1 Menit 5 Menit 10 Menit 20 Menit 40 Menit 60
GF 1 ± SD ± 1.240.583 ± 5.1821.58 ±4.6246.73 ±3.1366.04 ± 2.0783.13 ±3.3488.93 GF 2 ± SD ± 0.731.20 ± 5.5310.88 ± 14.9846.49 ± 2.1388.03 ± 1.9996.71 ± 2.0594.65 GF 3 ± SD ± 0.231.45 ± 3.6421.66 ± 5.8235.73 ± 5.9348.54 ± 4.5363.33 ± 6.1874.41 GF 4 ± SD ± 1.591.85 ± 3.0243.66 ± 2.4665.72 84.46 ± 1.85 ± 1.7293.63 ± 4.4993.08 GF 5 ± SD ± 0.290.65 ± 6.107.20 ± 8.3227.30 ± 15.9669.36 90.03 ± 0.90 ± 6.7794.99 GF 6 ± SD ±0.150.20 ±5.3231.77 ±4.9063.46 ±3.8578.41 ±3.0286.74 ±3.6987.93 GF 7 ± SD ±0.521.25 ±6.7356.14 ±3.3492.25 ±2.6799.05 104.20±2.16 101.82±1.85 GF 8 ± SD ±0.190.60 ±3.9735.82 ±4.8158.05 ±6.0075.29 ±6.6685.42 ±8.9292.90 GF 9 ± SD ±0.180.70 ±2.9926.41 ±4.0567.59 ±1.6290.75 ±1.5697.52 ±1.8395.67
Tabel 4. Nilai efisiensi dissolusi dan factor similaritas produk gemfibrozil
Sampel Efisiensi Dissolusi (%) Faktor similaritas (f2) Similaritas
GF1 66.45 27.12 Tidak GF2 76.71 28.45 Tidak GF3 51.45 20.17 Tidak GF4 79.32 42.17 Tidak GF5 66.95 42.17 Tidak GF6 73.44 43.14 Tidak GF7 92.08 Innovator Innovator GF8 73.08 34.16 Tidak GF9 81.83 39.23 Tidak
die yang dipilih untuk digunakan dan tekanan kompresi dalam pembuatan sediaan tablet, perbedaan juga bisa dipengaruhi oleh medium disolusi, seperti kecepatan pengadukan, suhu medium, suhu pada penentuan disolusi, serta pH medium yang digunakan. Penelitian ini baru menggunakan satu jenis medium dissolusi sehingga belum dapat menyimpulkan bahwa produk-produk uji tidak bioekuivalen dengan produk-produk innovator. WHO menyarankan uji bioekivalensi melalui dissolusi terbanding dilakukan minimal pada dua jenis medium dissolusi yang berbeda.
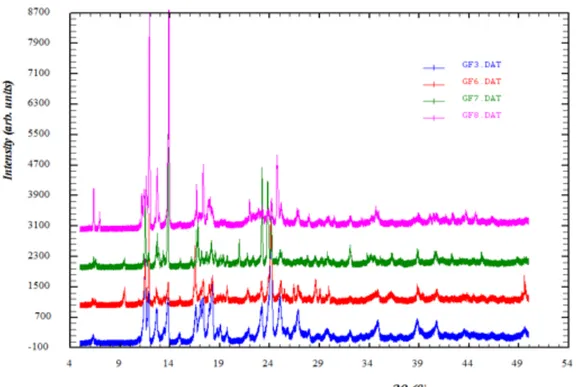
Untuk dapat memperoleh penjelasan tidak similarnya semua produk uji terhadap innovator, maka dilakukan pengamatan indeks kristalinitas sediaan gemfibrozil uji menggunakan XRD (Gambar 3 dan 4). Analisa difraksi sinar-X digunakan untuk mengetahui perbedaan derajat kristalinitas ke 9 bahan obat dan melihat penurunan intensitas puncak interferensi (Gniadoa K et. al., 2016).
Hasil analisa menunjukkan bahwa produk GF3 dengan puncak–puncak interferensi yang khas dan tajam pada 2 theta yaitu 11.8 ; 13,8 ; 14 ; 16.5 ; 18; 23 ; 24 ; 25 ; 27 sedangkan polimer hidrofilik menunjukkan padatan amorf dengan difraktogram halo amorf. Terdapat perbedaan intensitas puncak interferensi pada masing–masing produk, dibandingkan dengan produk yang lainnya, yang menunjukan perubahan derajat kristalinitasnya, dimana untuk GF7 intensitas kristalnya lebih rendah dari GF3, GF6, dan GF8, juga terjadi penurunan intensitas puncak interferensi, yang mengindikasikan terbentuk amorf. Hal ini dapat berdampak pada kelarutan produk GF 7 lebih baik dari produk gemfibrozil sediaan kapsul lainnya. Sediaan Gemfibrozil tablet terlihat derajat Kristal GF9 lebih rendah atau kurang tajam dari produk tablet lainnya, yaitu GF1, GF2, GF4, dan GF5. Hasil ini selaras dengan profil dissolusi GF9 yang berada pada urutan tertinggi dibandingkan sediaan kaplet lainnya.
Waktu (Menit) Waktu (Menit)
Gambar 1. Profil dissolusi produk Gemfibrozil kapsul Gambar 2. Profil dissolusi produk Gemfibrozil kaplet
Gambar 3. Profil difraktogram sediaan kaplet gemfibrozil (GF1, GF2, GF4, GF5 dan GF9) dibandingkan
KESIMPULAN
Semua sediaan gemfibrozil yang diuji memenuhi persyaratan mutu fisik Farmakope Indonesia IV dan USP 29. Profil dissolusi semua produk terbanding berbeda nyata dengan innovator (P<0,05). Perbedaan ini didukung oleh data difraksi sinar X yang menunjukkan semua produk memiliki indeks kristalinitas yang berbeda.
3. Lucida H., Salman, Hervian M.S., ”Uji Daya Peningkat Penetrasi Virgin Coconut Oil (VCO) dalam Basis Krim”, Jurnal Sains dan Teknologi Farmasi, Vol. 13, No. 1, 2008, 23 – 30.
4. Gniadoa K., Löbmannb K., Radesb T., Erxlebena A., The influence of co-formers on the dissolution rates of co-amorphous sulfamerazine/excipient systems, International Journal of Pharmaceutics 504 (2016) 20–26.
5. Reddy D.Y., Sankar V.R., Dachinamoorthy D., Rao A.N., Sekhar K.B.C., Conseption and evaluation of Gemfibrozil as immediate drug delivery system, J. Chem. Pharm. Res., 2010, 2(2): 590-597
6. Rouini, M..R, Ardakani Y.H., Mirfazaelian A., Hakemi L., Baluchestani M.. Biopharmaceutics and Drug disposition. , 2008, Vol No: 29, Issue (6), :349-355.
Gambar 4. Profil difraktogram sediaan kapsul gemfibrozil (GF3, GF6 dan GF8) dibandingkan
terha-dap produk innovator (GF7)
DAFTAR PUSTAKA
1. Departemen Kesehatan Republik Indonesia, “Farmakope Indonesia “, Edisi IV, Jakarta, 1995. 2. Departemen Kesehatan Republik Indonesia,