1
A. Judul Percobaan
“Pengaruh pH dan Konsentrasi Enzim Terhadap Aktivitas Enzim”
B. Waktu Percobaan
Selasa, 22 Oktober 2013 pukul 13.00 – 15.30 WIB
C. Tujuan Percobaan
Membuktikan bahwa pH dan konsentrasi enzim mempengaruhi aktivitas enzim
D. Dasar Teori
Enzim atau fermen adalah suatu protein yang berfungsi sebagai biokatalisator reaksi-reaksi biokimia pada mahkluk biologi. Zat-zat yang diuraikan oleh reaksi disebut substrat, dan yang baru terbentuk dari reaksi disebut produk. Spesifisitas enzim sangat tinggi terhadap substratnya, dan enzim mempercepat reaksi kimia spesifik tanpa pembentukan produk samping. Hampir semua enzim dalam tubuh merupakan protein. Enzim sangat penting dan berpengaruh dalam tubuh makhluk hidup. Karena hampir semua proses biologis sel memerlukan enzim agar dapat berlangsung dengan cepat. Enzim memegang peranan yang sangat penting dalam reaksi metabolisme dalam tubuh. Reaksi reaksi kimia kompleks dalam tubuh akan berlangsung sangat sangat lambat jika tanpa enzim. Enzim ini bekerja dalam cairan larutan encer, suhu, dan pH yang sesuai dengan kondisi fisiologis biologis. Melalui aktivitasnya, sistem enzim terkoordinasi dengan baik sehingga menghasilkan hubungan yang harmonis di antara sejumlah aktivitas metabolik yang berbeda, semuanya mengacu untuk menunjang kehidupan. Enzim merupakan suatu protein, maka sintesisnya dalam tubuh diatur dan dikendalikan oleh sistem genetik, seperti halnya dengan sintesis protein pada umumnya.
Pada setiap enzim memiliki pH dan suhu yang berbeda-beda untuk dapat bekerja secara optimal. Karena apabila suhu dan keasaman tidak sesuai dengan sifat suatu enzim maka enzim tersebut tidak dapat bekerja secara optimal, tidak aktif, bahkan mengalami kerusakan yang dalam istilah biologi disebut denaturasi.
2 yang sesuai enzim ini dapat bekerja secara optimal dalam reaksi katabolisme maupun anabolisme. Enzim dalam aktivitasnya bekerja secara spesifik terhadap substrat yang akan dikatalisisnya, dengan begitu kita akan mengetahui berapa besar aktivitas yang dilakukan. Seperti contoh adalah enzim yang bekerja untuk mendegradasi amilum adalah amilase. Enzim ini banyak terdapat pada saliva, sehingga makanan yang dikunyah lama akan terasa manis, karena senyawa polisakarida akan terurai menjadi monosakarida.
Suasana yang terlalu asam atau alkalis menyebabkan denaturasi protein dan hilangnya secara total aktivitas enzim. Pada sel hidup, perubahan pH sangat kecil. Enzim hanya aktif pada kisaran pH yang sempit. Oleh karena itu media harus benar-benar dipelihara dengan menggunakan buffer (larutan penyangga). Jika enzim memiliki lebih dari satu substrat, maka pH optimumnya akan berbeda pada suatu substrat. Tiap enzim memiliki karakteristik pH optimal dan aktif dalam range pH yang relatif kecil, dalam banyak kasus, bentuk kurva menandakan dari keaktifan enzim berbanding pH yang terkandung di dalamnya.
Ada beberapa faktor untuk menentukan aktivitas enzim berdasarkan efek katalisnya yaitu persamaan reaksi yang dikatalis, kebutuhan kofaktor, pengaruh konsentrasi substrat dan kofaktor, pH optimal, daerah temperatur, dan penentuan berkurangnya substrat atau bertambahnya hasil reaksi. Penentuan ini biasa dilakukan di pH optimal dengan konsentrasi substrat dan kofaktor berlebih, menjadikan laju reaksi yang terjadi merupakan tingkat ke 0 (zero order reaction) terhadap substrat. Pengamatan reaksinya dengan berbagai cara kimia atau spektrofotometri. Ada dua teori tentang mekanisme pengikatan substrat oleh enzim, yaitu teori kunci dan anak kunci (lock and key) dan teori induced fit.
3 Amilase adalah enzim pemecah karbohidrat dari bentuk mejemuk menjadi bentuk yang lebih sederhana. Misalnya, pati dan glikogen dipecah menjadi maltosa, maltotriosa atau oligosakarida. Enzim ini terdapat dalam air liur (ptialin) dan getah pankreas yang membantu pencernaan karbohidrat dalam makanan. Darah normal juga mengandung sedikit amilase dari hasil pemecahan sel yang berlangsung secara normal. Pada penyakit radang pankreas, gondongan, kencing manis, kadarnya dalam darah meningkat. Sebaliknya pada penyakit hati, kadarnya menurun.
Salah satu enzim yang diperlukan untuk pertumbuhan adalah amilase, khususnya pada tanaman yang mengandung banyak karbohidrat seperti pisang dan beberapa serealia serta bahan makanan pokok. Dimana amilase ini akan mengkatalis hidrolisis karbohidrat yang berupa pati menjadi dekstrin dan kemudian menjadi maltosa, yang terjadi saat perkecambahan serealia. Pati yang merupakan polisakarida dan tidak larut dalam air dingin serta membentuk koloid pada air panas memiliki reaksi spesifik dengan iodium.
Kecepatan reaksi enzim dipengaruhi oleh berbagai kondisi fisik dan kimia. Beberapa faktor penting yang mempengaruhi kerja enzim adalah konsentrasi berbagai komponen (seperti substrat, produk, enzim, kofaktor, dll), pH, temperatur, dan gaya irisan. Kecepatan reaksi enzim sangat dipengaruhi oleh pH larutan baik secara in vivo maupun secara in vitro. Jenis hubungan antara kecepatan reaksi dan pH ditunjukkan dengan kurva berbentuk lonceng. Setiap enzim mempunyai pH optimum yang berbeda–beda.
4 Peningkatan konsentrasi enzim akan meningkatkan kecepatan reaksi enzimatik. Dapat dikatakan bahwa kecepatan reaksi enzimatik (v) berbanding lurus dengan konsentrasi enzim [E]. Makin besar konsentrasi enzim, reaksi makin cepat.
Salah satu enzim yang diperlukan untuk pertumbuhan adalah amilase. Amilase dapat diartikan sebagai segolongan enzim yang merombak pati, glikogen, dan polisakarida yang lain. Tumbuhan mengandung α dan ß amylase; hewan memiliki hanya α amylase, dijumpai dalam cairan pankreas dan juga (pada manusia dan beberapa spesies lain) dalam ludah. Amilase memotong rantai polisakarida yang panjang, menghasilkan campuran glukosa dan maltosa. Amilosa merupakan polisakarida yang terdiri dari 100-1000 molekul glukosa yang saling berikatan membentuk rantai lurus. Dalam air, amilosa bereaksi dengan iodine memberikan warna biru yang khas.
E. Alat dan Bahan
1. Alat
Tabung reaksi, dan rak tabung Labu ukur 50 ml, gelas ukur 10 mlL Gelas kimia, dan pipet tetes
Pembakar spiritus, kasa, dan kaki tiga
Statif, klem, dan termometer Spectrometer UV
2. Bahan
Air liur
Larutan pati pH 1, 3, 5, 7, 9 Larutan pati 1%
Larutan Iodin 0.01N Akuades
V (Laju Reaksi)
5
F. Alur Kerja
1. Pengaruh pH Terhadap Aktivitas Enzim
Preparasi Larutan Enzim
Preparasi Alat
Preparasi Larutan Blanko
Tabung B
Dimasukkan 1 mL larutan pati 1% Dibiarkan ± 6 menit
Ditambah 1 mL larutan I2 0.01N Ditambah 8 mL akuades
Larutan Blanko
Diinjekkan ke spectrometer UV pada λ = 680 nm Dibaca absorbansi yang dihasilkan
Nilai A
6 Tabung Reaksi
Dibersihkan Dikeringkan
Diberi label untuk satu tabung dengan label B (larutan blanko), dan lima tabung yang lain dengan label U (larutan uji)
Tabung B Tabung U
0.5 mL Air Liur
Dimasukkan ke dalam labu ukur 50 mL Ditambahkan akuades sampai tanda batas Dikocok sampai homogen
6 Preparasi Larutan Uji
5 Tabung Uji
Dimasukkan 1 mL larutan pati pada masing-masing tabung uji dengan pH yang berbeda
pH 3 pH 5 pH 7 pH 9
pH 1
Dibiarkan ± 5 menit
Ditambah 4 tetes larutan enzim Dicampur dengan baik
Dibiarkan selama 1 menit Ditambah 1 mL larutan I2 0.01N Ditambah 8 mL akuades
Lar. Uji 4
Lar. Uji 3 Lar. Uji 5
Lar. Uji 1 Lar. Uji 2
Diinjekkan ke spectrometer UV pada λ = 680 nm Dibaca absorbansi yang dihasilkan
Nilai A4
Nilai A3 Nilai A5
7
2. Pengaruh Konsentrasi Terhadap Aktivitas Enzim
Preparasi Larutan Enzim
0.5 mL Air Liur
Dimasukkan ke dalam labu ukur 50 mL Ditambahkan akuades sampai tanda batas Dikocok sampai homogen
Larutan Enzim Encer
100 kali
Diambil 0.5 mL
Dimasukkan ke dalam labu ukur 50 mL Ditambahkan akuades sampai tanda batas Dikocok sampai homogen
Larutan Enzim Encer
200 kali
Diambil 0.5 mL
Dimasukkan ke dalam labu ukur 50 mL Ditambahkan akuades sampai tanda batas Dikocok sampai homogen
Larutan Enzim Encer
300 kali
Diambil 0.5 mL
Dimasukkan ke dalam labu ukur 50 mL Ditambahkan akuades sampai tanda batas Dikocok sampai homogen
Larutan Enzim Encer
400 kali
Diambil 0.5 mL
Dimasukkan ke dalam labu ukur 50 mL Ditambahkan akuades sampai tanda batas Dikocok sampai homogen
Larutan Enzim Encer
8 Preparasi Alat
Preparasi Larutan Blanko
Tabung B
Dimasukkan 1 mL larutan pati 1% Dibiarkan ± 6 menit
Ditambah 1 mL larutan I2 0.01N (untuk suhu 600C dan 1000C dilakukan diluar penangas air) Ditambah 8 mL akuades
Larutan Blanko
Diinjekkan ke spectrometer UV pada λ = 680 nm Dibaca absorbansi yang dihasilkan
Nilai A
6 Tabung Reaksi
Dibersihkan Dikeringkan
Diberi label untuk satu tabung dengan label B (larutan blanko), dan lima tabung yang lain dengan label U (larutan uji)
9 Preparasi Larutan Uji
5 Tabung Uji
Dimasukkan 1 mL larutan pati 1% pada masing-masing tabung uji secara terpisah
Dibiarkan pada suhu ± 5 menit
Ditambah 0.2 mL larutan enzim dengan konsentrasi (pengenceran) yang berbeda
200 kali 300 kali 400 kali 500 kali 100 kali
Dicampur dengan baik Dibiarkan selama 1 menit
Ditambah 1 mL larutan I2 0.01N (untuk suhu 600C dan 1000C dilakukan di luar penangas air) Ditambah 8 mL akuades
Dicampur dengan baik
Lar. Uji 4
Lar. Uji 3 Lar. Uji 5
Lar. Uji 1 Lar. Uji 2
Diinjekkan ke spectrometer UV pada λ = 680 nm Dibaca absorbansi yang dihasilkan
Nilai A4
Nilai A3 Nilai A5
10
G. Hasil Pengamatan
1. Pengaruh pH Terhadap Aktivitas Enzim
Air liur : larutan menyerupai lender yang tidak berwarna Pati 1% : larutan tidak berwarna
I2 0.01N : larutan kuning kecoklatan Aquades : Larutan tidak berwarna
Larutan Blanko:
Perlakuan Pengamatan
1 mL larutan pati 1% dimasukkan ke dalam tabung reaksi Larutan tidak berwarna
Dibiarkan selama 6 menit Larutan tidak berwarna
Ditambah 1 mL larutan iodin Larutan ungu (++++)
Ditambah 8 mL akuades Larutan ungu (+++)
11 Larutan Uji:
Perlakuan 1 mL Larutan Pati
pH 1 pH 3 pH 5 pH 7 pH 9
Sebelum Perlakuan Larutan tidak berwarna
Didiamkan 5 menit Larutan tidak berwarna
Ditambah 4 tetes larutan enzim Larutan tidak berwarna
Dibiarkan selama 1 menit Larutan tidak berwarna
Ditambah 1 mL larutan I2 0.01N Larutan kuning
kecoklatan (+++)
12
2. Pengaruh Konsentrasi Terhadap Aktivitas Enzim
Air liur : larutan menyerupai lender yang tidak berwarna Pati 1% : larutan tidak berwarna
I2 0.01N : larutan kuning kecoklatan Aquades : Larutan tidak berwarna
Larutan Blanko:
Perlakuan Pengamatan
1 mL larutan pati 1% dimasukkan ke dalam tabung reaksi Larutan tidak berwarna
Dibiarkan selama 6 menit Larutan tidak berwarna
Ditambah 1 mL larutan iodine (untuk T=600C dan 1000C, di luar penangas) Larutan ungu (++++)
Ditambah 8 mL akuades Larutan ungu (+++)
13 Larutan Uji:
Dimasukkan 1 mL larutan pati 1%
Hasil Pengamatan
Dibiarkan selama 5 menit Larutan tidak berwarna
0.2 mL Larutan Enzim dalam Pengenceran
100 kali 200 kali 300 kali 400 kali 500 kali
Dibiarkan selama 1 menit Larutan tidak berwarna
Setelah dipanaskan Larutan ungu Larutan ungu (+) Larutan ungu (++) Larutan ungu (+++) Larutan ungu (++++)
Ditambah 8 mL akuades Larutan biru (-) Larutan biru Larutan biru (+) Larutan biru (++) Larutan biru (+++)
14
H. Analisis Data dan Pembahasan
1. Pengaruh pH Terhadap Aktivitas Enzim
Pada percobaan pertama mengenai pengaruh pH terhadap aktivitas enzim, bertujuan untuk membuktikan pengaruh pH terhadap aktivitas kerja enzim, khususnya pada enzim amylase pada saliva (air liur). Salah satu tujuan enzim amylase adalah untuk mendegadrasi karbohidrat polisakarida menjadi karbohidrat monoksida, yaitu dari amilum menjadi glukosa. Secara teori, enzim bekerja pada kisaran pH tertentu dan menunjukkan kerja maksimum pada pH optimum. Di luar pH optimum aktivitas enzim akan terganggu. Pada percobaan ini menggunakan lima variasi pH pada subtract, di antaranya yaitu pH 1, pH 3, pH 5, pH 7, dan pH 9. Subtract yang dipakai dalam percobaan ini adalah larutan pati.
Hal pertama yang dilakukan di dalam percobaan ini adalah melakukan preparasi larutan enzim, yaitu dengan mengambil air liur sebanyak 0.5 mL, yang berupa larutan seperti lender yang tidak berwarna, dimasukkan ke dalam labu ukur 50 mL, dan selanjutnya ditambahkan akuades, yang berupa larutan tidak berwarna, sampai tanda batas. Setelah itu dilakukan preparasi alat yang digunakan, yaitu dengan menyiapkan enam tabung reaksi, satu tabung reaksi untuk larutan blanko dan lima tabung reaksi untuk larutan uji, yang selanjutnya dibersihkan dan dikeringkan.
Larutan Blanko
15 spektofometer UV, karena larutan masih berwarna sangat pekat, sehingga tidak bisa membaca nilai absorbansi yang diinginkan. Sehingga ditambahkan lagi 8 mL larutan akuades, yang merupakan larutan tidak berwarna, menghasilkan larutan ungu. Penambahan akuades adalah tanda sebagai pengenceran. Nilai absorbansi yang didapatkan dari analisis spektofotometer UV adalah 0.231.
Larutan Uji
Pada penyiapan larutan uji, disiapkan terlebih dahulu lima tabung reaksi yang bersih dan kering, selanjutnya masing-masing tabung diberi label sesuai pH subtract yang digunakan. Subtract yang digunakan adalah larutan pati, yang merupakan larutan tidak berwarna. 1 mL larutan pati dimasukkan ke dalam tabung reaksi yang telah disiapkan, proses pemasukkan larutan pati dengan pH yang berbeda tersebut disesuaikan dengan label yang telah tertera nama pH, hal ini bertujuan agar tidak tertukar. Selanjutnya dibiarkan selama ± 5 menit, hal ini bertujuan agar larutan pati terdegradasi secara sempurna. Setelah itu ditambahkan 4 tetes larutan enzim, yang merupakan larutan tidak berwarna. penambahan larutan enzim tidak menghasilkan perubahan yang signifikan, yaitu tetap berupa larutan tidak berwarna. Selanjutnya dibiarkan selama ± 1 menit, hal ini bertujuan agar larutan pati terdegradasi secara sempurna. Setelah itu ditambahkan 1 mL larutan iodine 0.01N, yang merupakan larutan kuning kecoklatan, menghasilkan perubahan yang signifikan dari masing-masing tabung, yaitu:
Tabung uji pH 1 menghasilkan larutan kuning kecoklatan (+++) Tabung uji pH 3 menghasilkan larutan kuning kecoklatan (++) Tabung uji pH 5 menghasilkan larutan kuning kecoklatan (+) Tabung uji pH 7 menghasilkan larutan merah kecoklatan Tabung uji pH 9 menghasilkan larutan merah kecoklatan (+++)
16 diinginkan. Sehingga ditambahkan lagi 8 mL larutan akuades, yang merupakan larutan tidak berwarna, menghasilkan perubahan warna sebagai berikut:
Tabung uji pH 1 menghasilkan larutan kuning kehitaman (++++) Tabung uji pH 3 menghasilkan larutan kuning kehitaman (+++) Tabung uji pH 5 menghasilkan larutan kuning kehitaman (+) Tabung uji pH 7 menghasilkan larutan merah kehitaman Tabung uji pH 9 menghasilkan larutan merah kehitaman (++)
Penambahan akuades adalah tanda sebagai pengenceran. Nilai absorbansi yang didapatkan dari analisis spektofotometer UV adalah:
Tabung uji pH 1 menghasilkan nilai absorbansi 0.220 Tabung uji pH 3 menghasilkan nilai absorbansi 0.265 Tabung uji pH 5 menghasilkan nilai absorbansi 0.131 Tabung uji pH 7 menghasilkan nilai absorbansi 0.026 Tabung uji pH 9 menghasilkan nilai absorbansi 0.171
Dari nilai absorbansi yang didapatkan, selanjutnya dibuat kurva antara nilai absorbansi dengan pH subtract yang digunakan.
pH Nilai A Larutan Blanko (AB) Nilai A Larutan Uji (AU) Nilai ∆A (AB – AU)
1 0.231 0.220 0.011
3 0.231 0.265 -0.034
5 0.231 0.131 0.1
7 0.231 0.026 0.205
17 Dari kurva yang dihasilkan, pH optimum ditunjukkan pada pH 7 yang menunjukkan bahwa kadar amilum yang terkandung sangatlah sedikit. Namun, terdapat kesalahan pada pH 3 yang terbentuk, hal ini ditunjukkannya dari kurva nilai absorbansi yang dihasilkan mengalami penurunan, sehingga menunjukkan pada pH 3 terdapat kadar amilum yang tinggi, sehingga menyerupai larutan blanko yang dibuat. Kesalahan yang terjadi karena kesalahan ketika dalam proses penambahan larutan enzim yang kurang tepat, dimungkinkan penambahan jumlah larutan enzim yang kurang sempurna (masih kurang, akibat penetesan larutan enzim) sehingga kadar amilum yang terbentuk menjadi tinggi.
Secara teori, enzim amylase bekeja pada rentang pH optimum 5 – 8. Sehingga bisa dinyatakan pH optimum yang terbentuk dari percobaan ini adalah benar.
2. Pengaruh Konsentrasi Terhadap Aktivitas Enzim
Pada percobaan kedua mengenai pengaruh konsentrasi terhadap aktivitas enzim, bertujuan untuk membuktikan pengaruh konsentrasi terhadap aktivitas kerja enzim, khususnya pada enzim amylase pada saliva (air liur). Salah satu tujuan enzim amylase adalah untuk mendegadrasi karbohidrat polisakarida menjadi karbohidrat monoksida, yaitu dari amilum menjadi glukosa. Secara teori, pada konsentrasi subtract tertentu, penambahan enzim dengan konsentrasi bertingkat akan meningkatkan jumlah kompleks ES, sehingga jumlah produk yang terbentuk juga meningkat. Pada percobaan ini menggunakan lima variasi konsentrasi pada air liur, variasi konsentrasi dilakukan dengan cara pengenceran,
-0.05
Kurva Pengaruh pH Terhadap Aktivitas
Enzim
18 yaitu pengenceran 100 kali, 200 kali, 300 kali, 400 kali, dan 500 kali. Subtract yang dipakai dalam percobaan ini adalah larutan pati.
Hal pertama yang dilakukan di dalam percobaan ini adalah melakukan preparasi larutan enzim, yaitu dengan mengambil air liur sebanyak 0.5 mL, yang berupa larutan seperti lendir yang tidak berwarna, dimasukkan ke dalam labu ukur 50 mL, dan selanjutnya ditambahkan akuades, yang berupa larutan tidak berwarna, sampai tanda batas, ini merupakan proses pengenceran 100 kali, untuk pengenceran 200 kali, 300 kali, 400 kali, dan 500 kali dilakukan dengan hal yang sama. Hasil pengenceran yang dilakukan, menghasilkan perubahan larutan yang tidak signifikan, yaitu semuanya berupa larutan tidak berwarna.
Setelah itu dilakukan preparasi alat yang digunakan, yaitu dengan menyiapkan enam tabung reaksi, satu tabung reaksi untuk larutan blanko dan lima tabung reaksi untuk larutan uji, yang selanjutnya dibersihkan dan dikeringkan.
Larutan Blanko
Untuk membuat suatu larutan blanko di dalam percobaan ini adalah dengan memasukkan larutan pati 1%, yang merupakan larutan tak berwarna, ke dalam tabung reaksi. Selanjutnya dibiarkan selama ± 6 menit, hal ini bertujuan agar larutan pati terdegradasi secara sempurna. Setelah itu ditambahkan 1 mL larutan iodine 0.01N, yang merupakan larutan kuning kecoklatan, menghasilkan perubahan yang signifikan yaitu berupa larutan ungu kehitaman. Secara kasat mata, hal ini menunjukkan bahwa pada larutan blanko memiliki kadar amilum yang tinggi, dibuktikan dengan hasil perubahan warna yang terbentuk. Namun, pengamatan secara kasat mata ini akan di buktikan lagi dengan menggunakan spektofotometer UV dengan panjang gelombang 680 nm, sebagai penghitungan kadar amilum yang terkadung di dalam larutan blanko. Berbeda dengan proses pembuatan larutan blanko pada perceboaan satu, di mana pada percobaan kedua yaitu dilakukan pemanasan sampai mencapai suhu 600C. Hal ini bertujuan agar larutan pati semakin terdegadrasi sempurna.
19 pengenceran. Nilai absorbansi yang didapatkan dari analisis spektofotometer UV adalah 0.000.
Larutan Uji
Pada penyiapan larutan uji, disiapkan terlebih dahulu lima tabung reaksi yang bersih dan kering, selanjutnya masing-masing tabung diberi label sesuai proses pengenceran pada air liur yang digunakan. Subtract yang digunakan adalah larutan pati 1%, yang merupakan larutan tidak berwarna. 1 mL larutan pati 1% dimasukkan ke dalam masing-masing tabung reaksi yang telah disiapkan. Selanjutnya dibiarkan selama ± 5 menit, hal ini bertujuan agar larutan pati terdegradasi secara sempurna. Setelah itu ditambahkan 0.2 tetes larutan enzim dengan pengenceran yang telah dilakukan, yang merupakan larutan tidak berwarna. Proses penambahan larutan enzim disesuaikan dengan label yang telah ditempelkan, hal ini dilakukan agar tidak tertukar. Penambahan larutan enzim pada masing-masing tabung tidak menghasilkan perubahan yang signifikan, yaitu tetap berupa larutan tidak berwarna. Selanjutnya dibiarkan selama ± 1 menit, hal ini bertujuan agar larutan pati terdegradasi secara sempurna. Setelah itu ditambahkan 1 mL larutan iodine 0.01N, yang merupakan larutan kuning kecoklatan, menghasilkan perubahan yang signifikan dari masing-masing tabung, yaitu:
Tabung uji pengenceran 100 kali menghasilkan larutan ungu Tabung uji pengenceran 100 kali menghasilkan larutan ungu (+) Tabung uji pengenceran 100 kali menghasilkan larutan ungu (++) Tabung uji pengenceran 100 kali menghasilkan larutan ungu (+++) Tabung uji pengenceran 100 kali menghasilkan larutan ungu (++++)
20 berwarna sangat pekat, sehingga tidak bisa membaca nilai absorbansi yang diinginkan. Sehingga ditambahkan lagi 8 mL larutan akuades, yang merupakan larutan tidak berwarna, menghasilkan perubahan warna sebagai berikut:
Tabung uji pengenceran 100 kali menghasilkan larutan ungu (-) Tabung uji pengenceran 100 kali menghasilkan larutan ungu Tabung uji pengenceran 100 kali menghasilkan larutan ungu (+) Tabung uji pengenceran 100 kali menghasilkan larutan ungu (++) Tabung uji pengenceran 100 kali menghasilkan larutan ungu (+++)
Penambahan akuades adalah tanda sebagai pengenceran. Nilai absorbansi yang didapatkan dari analisis spektofotometer UV adalah:
Tabung uji pengenceran 100 kali menghasilkan nilai absorbansi -0.104 Tabung uji pengenceran 100 kali menghasilkan nilai absorbansi 0.076 Tabung uji pengenceran 100 kali menghasilkan nilai absorbansi 0.007 Tabung uji pengenceran 100 kali menghasilkan nilai absorbansi -0.011 Tabung uji pengenceran 100 kali menghasilkan nilai absorbansi -0.033
Dari nilai absorbansi yang didapatkan, selanjutnya dibuat kurva antara nilai absorbansi dengan pH subtract yang digunakan.
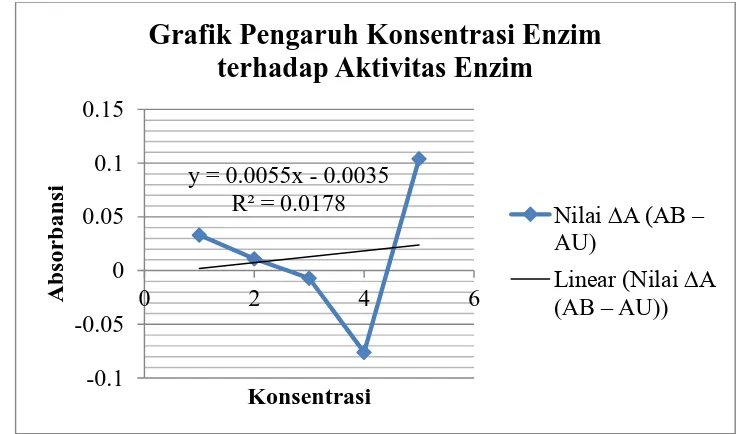
Konsentrasi Nilai A Larutan Blanko (AB) Nilai A Larutan Uji (AU) Nilai ∆A (AB – AU)
5 0.000 -0.104 0.104
4 0.000 0.076 -0.076
3 0.000 0.007 -0.007
2 0.000 -0.011 0.011
21 Dari grafik yang dihasilkan, didapatkan persamaan linear y = 0.005x + 0.003, dengan R² = 0.017. Secara teori, semakan kecil konsentrasi enzim, maka kadar amilum yang terkandung semakin meningkat. Namun, pada percobaan kami yang telah dilakukan tidak sesuai dengan teori. Dari grafik yang dihasilkan, pada konsentrasi (pengenceran) 200X, 300X, dan 400X mengalami penurunan, yang seharusnya meningkat, hal ini menunjukkan hasil yang tidak sesuai dengan teori. Hal ini dikarenakan ketelitian saat pengenceran air liur, sebagai larutan enzim. Sehingga kadar amilum kecil yang seharusnya dimiliki oleh enzim yang berkonsentrasi tinggi, tapi tidak terbentuk. Karena proses pengenceran air liur sangat berperan penting dalam penentuan konsentrasi larutan enzim yang terbentuk.
I. Kesimpulan
Dari hasil percobaan yang telah dilakukan, dapat disimpulkan bahwa:
1. pH optimum (kadar amilum yang terkandung paling kecil) yang terbentuk adalah pada pH 7.
2. Semakan kecil konsentrasi enzim, maka kadar amilum yang terkandung semakin meningkat. Nilai regresi yang diperoleh adalah R² = 0.017.
22
J. Jawaban Pertanyaan
1. Buatlah kurva yang menggambarkan hubungan antara kecepatan reaksi enzimatik � = ∆�� �� dengan pH !
Jawab:
2. Buatlah kurva antara konsentrasi (pengenceran) enzim dengan kecepatan reaksi enzimatik � = ∆�
� �� !
Jawab:
V (Laju Reaksi)
23
K. Daftar Pustaka
Anna, Poedjadi. 1994. Dasar-dasar Biokimia. Jakarta: Penerbit UI – Press.
Anonim A. 2011. Enzim. http://Wikipedia.org (diakses pada hari Kamis, 17 Oktober 2013, Pukul11:00 WIB).
Anonim B. 2011. Laporan Akhir Praktikum Biokimia “Pengaruh pH dan Inhibitor
Terhadap Aktivitas Enzim”. http://blogger.com (diakses pada hari Kamis, 17 Oktober 2013, Pukul11:10 WIB).
Ruddin, Choi.2010. LAPORAN Praktikum Biokimia II “Percobaan II Enzim”. Jayapura : Universitas Cendrawasih.
Lehninger AL. 1982. Dasar-Dasar Biokimia Jilid I. Maggy Thenawijaya, penerjemah. Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry.
24
Dokumentasi
1. Pengaruh pH Terhadap Aktivitas Enzim
Lar. Pati pada berbagai pH, yaitu pada pH 1, 3, 5, 7, 9
Dan lar. pati 1% untuk larutan blanko
Air liur yang telah diencerkan 100 kali, sebagai lar. enzim
Lar. pati dengan berbagai pH ditambah 4 tetes larutan enzim , tetapi pada lar. blanko tidak ditambahkan
Lar. I2 0.01N, berupa lar.
25
2. Pengaruh pH Terhadap Aktivitas Enzim
Lar. pati + 4 tetes lar. enzim + 1 mL I2
Lar. blanko + 1 mL I2
Semua penambahan akan diencerkan dengan penambahan 8 mL akuades
Lar. pati 1% dimasukkan ke dalam tabung reaksi yang telah diberi label
Lar. pati + 0.2 mL lar. enzim dengan pengenceran yang berbeda (100X, 200X, 300X, 400X, 500X), penambahan dilakukan
26
Lar. pati + 0.2 tetes lar. enzim + 1 mL I2
Lar. blanko + 1 mL I2
Dilakukan pemanasan sampai suhu 600C di atas penangas
Setelah dipanaskan, dilakukan pengenceran dengan menambahkan 8 mL akuades pada
masing-masinng tabung
Karena warna yang terbentuk masih pekat, maka dilakukan proses pengenceran kembali, dengan perbandingan 1:4 (1 untuk lar. dan 4