PENETAPAN KADAR RIFAMPISIN DALAM SEDIAAN TABLET DENGAN METODE KROMATOGRAFI CAIR
KINERJA TINGGI (KCKT)
TUGAS AKHIR
Oleh:
SORAYA NIM 132410081
PROGRAM STUDI DIPLOMA III ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Puji dan syukur kehadirat Allah yang Maha Kuasa yang telah melimpahkan rahmat, karunia, dan ridhoNya, sehingga penulis dapat menyelesaikan tugas akhir yang berjudul “Penetapan KadarRifampisin Dalam Sediaan Tablet Dengan Metode Kromatografi Cair Kinerja Tinggi (KCKT)”. Tugas Akhir ini diajukan sebagai salah satu syarat untuk memperoleh gelar Ahli Madya pada Program Diploma III Analis Farmasi dan Makanan pada Fakultas Farmasi Universitas Sumatera Utara.
Selama penulisan Tugas Akhir ini, penulis banyak mendapat bimbingan dan bantuan dari berbagai pihak, maka dalam kesempatan ini penulis mengucapkan terima kasih yang setulus-tulusnya kepada:
1. Ibu Dr. Masfria, M.S., Apt.,selakuDekan Fakultas Farmasi Universitas Sumatera Utara.
2. Bapak Prof. Dr. JansenSilalahi, M.App.Sc., Apt., selaku Ketua Program Studi Diploma III Analis Farmasi dan Makanan Fakultas Farmasi USU dan sebagai selaku dosen pembimbing yang telah memberikan pengarahan dan bimbingan kepada penulis dengan penuh perhatian hingga selesainya Tugas Akhir ini.
3. Bapak Prof. Dr. Karsono, Apt., selaku Dosen Penasehat Akademik yang telah memberikan nasehat dan pengarahan kepada penulis selama melaksanakan pendidikan pada Program Diploma III Analis Farmasi dan Makanan.
4. Ibu Lambok Okta SR, M.Kes., Apt., selaku Manager Mutu di Balai Besar POM Medan, yang memberikan izin tempat pelaksanaan Praktek Kerja Lapangan.
5. Bapak dan Ibu Dosen staf pengajar Fakultas Farmasi Program Diploma III Analis Farmasi dan Makanan yang berupaya mendukung kemajuan mahasiswa Analis Farmasi dan Makanan.
6. Teman-teman Analis Farmasi dan Makanan stambuk 2013 semuanya tanpa terkecuali, yang tidak bisa disebutkan namanya satu persatu, terima kasih buat kebersamaan dan semangatnya selama ini, serta masukan dalam penyusunan tugas akhir ini.
Dan secara khusus penulis sampaikan ucapan terima kasih dan rasa hormat kepada orang tua penulis Bapak Ahmad Fauzi dan Ibu Sri Gusnimawati, S.Pd., serta teman terdekat penulis Dede Kurniawan, juga untuk seluruh keluarga besar yang selalu memberikan dukungan baik moril maupun materil dan segenap doa kepada penulis sehingga penulis dapat menyelesaikan tugas akhir ini.
Penulis menyadari dalam tugas akhir ini masih banyak kekurangan dan ketidaksempurnaan. Dengan segala kerendahan hati penulis mengharapkan saran dan kritik yang bersifat membangun yang pada akhirnya dapat digunakan untuk menambah pengetahuan dan berguna bagi kita semua. Akhir kata semoga Allah SWT melimpahkan rahmat dan karuniNya untuk kita semua, Amin.
Medan, Agustus 2016 Penulis
Soraya
NIM 132410081
PENETAPAN KADAR RIFAMPISIN DALAM SEDIAAN TABLET DENGAN METODE KROMATOGRAFI CAIR KINERJA TINGGI
(KCKT) ABSTRAK
Sediaan obat sangat diperlukan suatu pengawasan untuk menjaga obat agar senantiasa memenuhi syarat mutu sehingga aman dikonsumsi. Salah satu uji yang dilakukan dalam pengawasan terhadap sediaan obat adalah penetapan kadar zat berkhasiat. Rifampisin adalah salah satu obat antibiotikumyang digunakan untuk pengobatanpenyakittuberkulosis(TBC). Tujuan penulisan tugas akhir ini adalah untuk mengetahui apakah sediaan tablet Rifampisin memenuhi persyaratan kadar yang tertera pada Indian Pharmacopoeia volume III tahun 2010 yaitu tidak kurang dari 92,5% dan tidak lebih dari 107,5% dari yang tertera pada etiket.
Dalam penulisan tugas akhir ini, penetapan kadar Rifampisin dalam sediaan tablet menggunakan metode kromatografi yakni Kromatografi Cair Kinerja Tinggi (KCKT). Fase gerak yang digunakan adalah campuran 65 mL larutan (0,1%
Asam fosfat, 0,19% Natrium perklorat, 0,59% Asam sitrat, 2,09% Potassium dihidrogen fosfat) dan 35 mL Asetnotril P, fase diam yang digunakan adalah L7 berupa Oktisilana (10 cm × 4,6 mm) dan panjang gelombang 254 nm serta volume injeksi yang digunakan 20 µL dan laju alir 1,5 mL/menit. Hasil yang diperoleh dari penetapan kadar sediaan tablet Rifampisin yaitu 93,41%, sehingga kadar Rifampisin memenuhi syarat Indian Pharmacopoeia volume III tahun 2010.
Kata kunci:Rifampisin, TBC, Penetapan Kadar, Kromatografi CairKinerja Tinggi.
DAFTAR ISI
Halaman
LEMBAR JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
SURAT PERNYATAAN TIDAK PLAGIAT ... v
ABSTRAK ... vi
DAFTAR ISI ... vii
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Percobaan ... 2
1.3 Manfaat Percobaan ... 2
BAB II TINJAUAN PUSTAKA ... 3
2.1 Pengertian Obat ... 3
2.2 Tablet ... 3
2.2.1 Jenis - jenis Tablet ... 4
2.2.2 Syarat - syarat Tablet... 5
2.3 Rifampisin ... 8
2.3.1 Sifat Fisikokimia ... 8
2.3.2Mekanisme Kerja ... 8
2.3.3Farmakokinetik ... 9
2.3.4Farmakodinamik... 10
2.3.5 Efek Samping ... 10
2.3.6Indikasi ... 11
2.3.7 Kontraindikasi ... 11
2.3.8 Sediaan, rute pemberian, dan dosis ... 11
2.4 Analisis Rifampisin dalam sediaan farmasi ... 12
2.5 Kromatografi ... 14
2.5.1 Pembagian Kromatografi ... 14
2.6 Kromatografi Cair Kinerja Tinggi... 15
2.6.1 Klasifikasi Kromatograf Cair Kinerja Tinggi ... 17
2.6.2Instrumentasi Kromatografi Cair Kinerja Tinggi ... 20
2.7 Penggunaan KCKT dalam Analisis Farmasi ... 22
BAB III METODE PENELITIAN... 23
3.1 Tempat Pengujian ... 23
3.2 Alat ... 23
3.3 Bahan ... 23
3.4 Prosedur Percobaan ... 24
3.4.1 Fase Gerak ... 24
3.4.2 Pembuatan Larutan Uji ... 24
3.4.3 Larutan Baku Pembanding... 24
3.5 Kromatografi Cair Kinerja Tinggi... 25
3.5.1 Pengaturan Kondisi Sistem ... 25
3.5.2 Mengaktifkan Sistem ... 25
3.5.3 Penentuan Garis Alas ... 25
3.6 Cara Penetapan ... 25
3.7 Perhitungan Kadar ... 26
3.8 Persyaratan ... 26
BAB IV HASIL DAN PEMBAHASAN ... 27
4.1 Hasil ... 27
4.2 Pembahasan ... 27
BAB V KESIMPULAN DAN SARAN ... 29
5.1 Kesimpulan... 29
5.2 Saran ... 29
DAFTAR PUSTAKA ... 30
DAFTAR GAMBAR
Gambar Halaman
2.1 Struktur Rifampisin ... 8
DAFTAR TABEL
Tabel Halaman
2.1 Penyimpangan bobot rata-rata ... 6 4.1 Kadar Rifampisin dalam sediaan tablet ... 27
DAFTAR LAMPIRAN
Lampiran Halaman
1 Data dan hasil penetapan kadar tablet Rifampisin ... 32
2 Kromatogram uji kesesuaian sistem larutan baku ... 33
3 Kromatogram penetapan kadar tablet Rifampisin ... 34
4 Perhitungan Penetapan kadar tablet Rifampisin ... 35
5 Gambar Alat Kromatografi Cair Kinerja Tinggi ... 37
6 Gambar Alat Ultrasonic Cleaner ... 38
7 Gambar Neraca Mikro ... 39
8 Gambar Neraca Makro ... 40
9 Sampel yang diuji tablet Rifampicin 450 mg ... 41
BAB I PENDAHULUAN
1.1 Latar Belakang
Di Negara Indonesia umumnya banyak digunakan obat dengan jenis beragam.
Jenis obat tersebut banyak beredar secara luas di pasar bebas, apotek, rumah sakit, dan pusat kesehatan masyarakat. Obat menurut Surat Keputusan Menteri Kesehatan Republik Indonesia No. 193/ Kab/B.VII/71 yakni suatu bahan atau paduan bahan-bahan yang dimaksudkan untuk digunakan dalam menetapkan diagnosa, mencegah, mengurangkan, menghilangkan, menyembuhkan penyakit atau gejala penyakit, luka atau kelainan badaniah dan rokhaniah pada manusia atau hewan dan untuk memperelok atau memperindah badan atau bagian manusia (Joenoes, 2001).
Jenis-jenis obat yang digunakan untuk menyembuhkan penyakit pada manusia digolongkan pada jenis analgetik, antipiretik, antibiotik, antihistamin, dll.
Diantara jenis obat tersebut, jenis antibiotik tuberculosis (TBC) yang beredar dimasyarakat adalah Rifampisin. Rifampisin adalah salah satu obat antibiotik tuberkulosis (TBC) yang digunakan untuk mengobati infeksi bakteri. Obat ini juga dapat digunakan untuk mencegah infeksi setelah berkontak langsung dengan seseorang yang sedang terkena infeksi TBC serius. Rifampisin akan membunuh bakteri yang menyebabkan infeksi (Tjay dan Rahardja, 2010).
Antibiotik adalah obat yang dihasilkan oleh mikroorganisme yang dapat menghambat pertumbuhan atau dapat membunuh mikroorganisme lain. Menurut daya membunuh bakteri antibiotik dibagi dalam antibiotik spektrum ciut,
antibiotik spektrum luas, dan antibiotik spektrum sebagian atau khusus (Anief, 1996).
Salah satu parameter uji yang dilakukan untuk pengujian obat dalam sediaan tablet adalah penetapan kadar zat aktif. Penetapan kadar ini dilakukan dengan metode Kromatografi Cair Kinerja Tinggi (KCKT). Metode ini memiliki banyak keuntungan yaitu: kecepatan analisis tinggi, daya pisahnya baik, mampu memisahkan molekul-molekul dari suatu campuran, mudah untuk memperoleh kembali cuplikan, kolom dapat dipakai berulang kali, dan perangkatnya dapat digunakan secara otomatis dan kauntitatif (Gandjar dan Rohman, 2007).
Berdasarkan hal ini, penulis melakukan penetapan kadar Rifampisin pada sediaan tablet dengan metode Kromatografi Cair Kinerja Tinggi (KCKT).
1.2 Tujuan
Adapun tujuan dari penetapan kadar Rifampisin dalam sediaan tablet adalah untuk mengetahui apakah kadar Rifampisin dalam sediaan tablet memenuhi persyaratan yang dipersyaratkan Indian Pharmacopoeia volume III tahun 2010.
1.3 Manfaat
Manfaat yang diperoleh dari penetapan kadar Rifampisin dalam sediaan tablet adalah agar dapat mengetahui bahwa sediaan Tablet Rifampisin memenuhi persyaratan Indian Pharmacopoeia volume III tahun 2010 yang dipersyaratkan sehingga aman untuk digunakan.
BAB II
TINJAUAN PUSTAKA
2.1 Pengertian Obat
Obat ialah suatu zat yang digunakan untuk diagnosa, pengobatan, penyembuhan atau pencegahan penyakit pada manusia atau pada hewan. Zat tersebut dapat berasal dari nabati, hewani, kimiawi alam maupun sintesis.
Sebelum dipergunakan menjadi obat, zat tersebut terlebih dahulu dibentuk menjadi sediaan farmasi, seperti kapsul, pil, tablet, sirup, suspensi, salep, dan suppositoria (Anief, 1987).
Batas antara obat dan racun sangat pendek, hal ini tergantung pada dosis dan cara pemakaian. Oleh karena itu, obat dapat bersifat sebagai obat dan dapat bersifat sebagai racun. Obat akan bersifat sebagai obat apabila tepat digunakan pada suatu penyakit dengan dosis dan waktu yang tepat. Jadi, apabila digunakan tidak tepat dalam pengobatan atau dengan dosis yang berlebihan akan menimbulkan keracunan, sedangkan apabila dosisnya lebih kecil, maka pasien tidak akan memperoleh kesembuhan (Widjajanti, 1988).
2.2 Tablet
Tablet adalah bentuk sediaan padat mengandung bahan obat dengan atau tanpa bahan pengisi. Berdasarkan metode pembuatan, tablet digolongkan sebagai tablet cetak dan tablet kempa. Tablet cetak dibuat dengan cara menekan massa serbuk lembab dengan tekanan rendah kedalam lubang cetakan. Tablet kempa dibuat dengan memberikan tekanan tinggi pada serbuk atau granul menggunakan
cetakan baja. Tablet dapat dibuat dalam berbagai ukuran, bentuk dan penandaan permukaan tergantung pada desain cetakan (Ditjen POM., 1995).
Tablet dapat berbeda-beda dalam ukuran, bentuk, berat, kekerasan, ketebalan, daya hancurnya, dan dalam aspek lainnya tergantung pada cara pemakaian tablet dan metode pembuatannya. Kebanyakan tablet digunakan pada pemberian obat- obat secara oral, dan kebanyakan dari tablet ini dibuat dengan penambahan zat warna, zat pemberi rasa, dan lapisan-lapisan dalam berbagai Janis. Tablet lain yang penggunaannya dengan cara sublingual, bukal, atau melalui vagina, tidak boleh mengandung bahan tambahan seperti pada tablet yang digunakan secara oral (Ansel, 1989).
Komposisi utama tablet adalah zat berkhasiat yang terkandung didalamnya, sedangkan bahan pengisi yang sering digunakan dalam pembuatan tablet yaitu bahan pengancur, bahan penyalut, bahan pengikat, bahan pemberi rasa dan tambahan lainnya (Ansel, 1989).
2.2.1 Jenis-jenis tablet
Jenis jenis tablet adalah sebagai berikut : 1. Tablet Kompresi
Yaitu tablet kompresi dibuat dengan sekali tekanan menjadi berbagai bentuk tablet dan ukuran, biasanya kedalam bahan obatnya diberi tambahan sejumlah bahan pembantu (Ansel, 1989).
2. Tablet Kunyah
Pada tablet kunyah sebagai bahan pengisi dapat berupa mannitol, sorbitol, laktosa atau dekstrosa ditambah bahan pemanis dan bahan pembau (Anief, 1987).
3. Tablet Salut
Tablet sering disalut agar dapat menghilangkan rasa tak enak dari obat, menaikkan stabilitas obat terhadap pengaruh uap, air, cahaya, dan terlihat lebih baik. Macam-macam tablet salut yaitu:
1. tablet salut gula 2. tablet salut selaput dan 3. tablet salut enterik
(Anief, 1987).
4. Tablet effervescent
Yaitu tablet berbuih dibuat dengan cara komprsi granul mengandung garam effervescent atau bahan-bahan lain yang mampu melepaskan gas ketika bercampur dengan air (Ansel, 1989).
2.2.2 Syarat-syarat tablet
Syarat-syarat tablet adalah sebagai berikut:
1. Keseragaman bobot
Keseragaman bobot ditetapkan sebagai berikut:
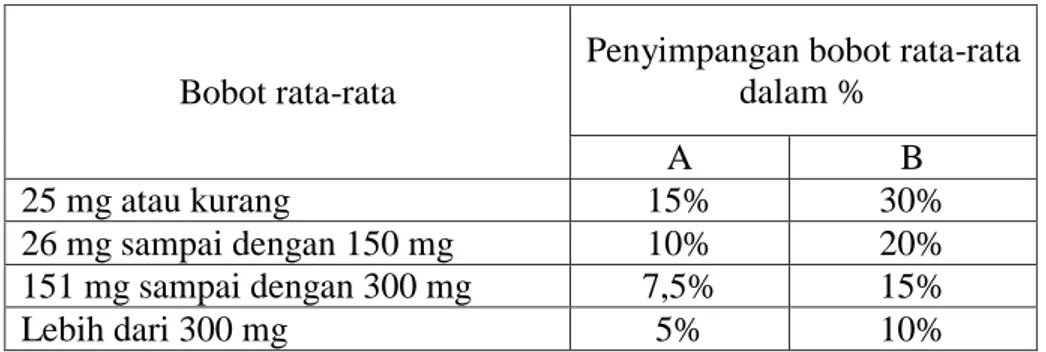
Ditimbang 20 tablet, dihitung bobot rata-rata tiap tablet. Jika ditimbang satu- persatu, tidak boleh lebih dari 2 tablet yang menyimpang dari bobot rata-rata lebih besar dari harga yang ditetapkan dalam kolom A dan tidak boleh satu tablet pun yang bobotnya menyimpang dari bobot rata-rata lebih dari harga dalam kolom B.
Jika perlu digunakan dalam 10 tablet dan tidak satu tablet yang bobotnya menyimpang lebih besar dari bobot rata-rata yang ditetapkan dalam kolom A maupun kolom B (Anief, 2008). Lihat pada Tabel 2.1.
Tabel 2.1 Penyimpangan bobot rata-rata
Bobot rata-rata
Penyimpangan bobot rata-rata dalam %
A B
25 mg atau kurang 15% 30%
26 mg sampai dengan 150 mg 10% 20%
151 mg sampai dengan 300 mg 7,5% 15%
Lebih dari 300 mg 5% 10%
Sumber : Ditjen POM., 1995 2. Kekerasan Tablet
Kekerasan tablet dan ketebalannya berhubungan dengan isi die dan gaya kompresi yang diberikan. Bila tekanan ditambahkan, maka kekerasan tablet meningkat sedangkan ketebalan tablet berkurang. Selain itu metode granulasi juga menentukan kekerasan tablet. Umumnya kekuatan tablet berkisar 4-8 kg, bobot tersebut dianggap batas minimum untuk menghasilkan tablet yang memuaskan. Alat yang digunakan untuk uji ini adalah hardness tester, alat ini diharapkan dapat mengukur berat yang diperlukan untuk memecahkan tablet (Ansel, 1989).
3. Friabilitas
Cara lain untuk menentukan kekuatan tablet ialah dengan mengukur keregasannya (friabilitas). Gesekan dan goncangan merupakan penyebab tablet menjadi hancur. Untuk menguji keregasan tablet digunakan alat Roche friabilator.
Sebelum tablet dimasukkan ke alat fribilator, tablet ditimbang terlebih dahulu.
Kemudian tablet dimasukkan kedalam alat, lalu alat dioperasikan selama empat menit atau 100 kali putaran. Tablet ditimbang kembali dan dibandingkan dengan berat mula-mula. Selisih berat dihitung sebagai keregasan tablet. Persyaratan keregasan harus lebih kecil dari 0,8% (Ansel, 1989).
4. Waktu hancur (Desintegration Test)
Uji waktu hancur tablet dilakukan untuk tablet yang tidak bersalut, tablet bersalut bukan enterik, tablet salut enterik, tablet bukal, dan tablet sublingual. Uji waktu hancur dilakukan dengan menggunakan alat uji waktu hancur. Masing masing sediaan tablet tersebut mempunyai prosedur uji waktu hancur dan persyaratan tertentu (Siregar dan Wikarsa, 2010).
Uji waktu hancur tidak dilakukan pada etiket jika dinyatakan “tablet kunyah, tablet isap, tablet yang pelepasan zat aktif bertahap dalam jangka waktu tertentu, atau tablet melepaskan zat aktif dalam dua periode berbeda atau lebih dengan jarak waktu yang jelas diantara periode pelepasan tersebut (Siregar dan Wikarsa, 2010).
5. Disolusi (Dissolution Test)
Disolusi adalah suatu proses perpindahan molekul obat dari bentuk padat ke dalam larutan suatu media. Uji ini dimaksudkan untuk mengetahiu banyaknya zak aktif yang terlarut dan memberikan efek terapi di dalam tubuh. Kecepatan absorbsi obat tergantung pada pemberian yang dikehendaki dan juga harus dipertimbangkan frekuensi pemberian obat (Syamsuni, 2007).
6. Penetapan kadar zat aktif
Penetapan kadar zat aktif bertujuan untuk mengetahui apakah kadar zat aktif yang terkandung didalam suatu sediaan sesuai dengan tertera pada etiket dan memenuhi syarat yang tertera pada masing-masing monografi. Bila zat aktif obat tidak memenuhi syarat maka obat tersebut tidak memberikan efek terapi dan juga tidak layak untuk dikonsumsi (Syamsuni, 2007).
2.3 Rifampisin
2.3.1 Sifat Fisikokimia Struktur Kimia :
Gambar 2.1. Struktur Rifampisin
Nama Kimia : 3-[(4-metil-1-piperasinil) iminometil] rifamisin sv.
Rumus molekul : C43H58N4O12
Sinonim : Rifampin, Rifadin Berat molekul : 822,95
Rifampisin merupakan turunan dari rifamisin, antibiotik yang berasal dari S.mediterranei.Senyawa ini berbentuk kristal gepeng berwarna merah jingga dengan titik leleh pada 183 – 1880C yang disertai penguraian. Rifampisin larut dalam klorofom dan DMSO, sedikit larut dalam air dengan PH 6,0 (Wattimena, dkk., 1991).
2.3.2 Mekanisme Kerja
Rifampisin terutama aktif pada sel yang sedang tumbuh. Kerjanya menghambat RNA polymerase yang teragantung pada DNA dari mikrobakteria dan mikroorganisme lain dengan menekan mula terrbentuknya (bukan pemanjangan) rantai dalam sintesis RNA. Inti RNA polymerase dari berbagai sel eukariotik tidak mengikat rifampisin dan sintesis RNAnya tidak dipengaruhi.
Rifampisin dapat menghambat sintesis RNA mitokondria mamalia tetapi diperlukan kadar yang lebih tinggi dari kadar untuk penghambatan pada kuman (Syarif, 2009).
2.3.3 Farmakokinetik a. Absorbsi
Rifampisin yang diberikan secara oral akan memberikan konsentrasi puncak dalam plasma dalam waktu 2-4 jam. Pada dosis 600 mg, konsentrasi maksimal dalam plasma adalah sebesar kurang lebih 7µg/mL. Asam aminosalisilat dapat menghambat absorpsi dan mengurangi konsentrasi rifampisin dalam plasma.
Setelah pemberian oral rifampisin dieliminasi dengan cepat melalui empedu.
Dalam proses ini terjadi deasetilasi secara progresif dimana dapat ditentukan bentuk deasetilasinya dalam empedu setelah 6 jam. Metabolit ini tetap mempunyai aktivitas antibaketri akan tetapi reabsorpsi intestinalnya berkurang.
b. Metabolisme
Waktu paruh rifampisin bervariasi antara 1,5-5 jam dan akan lebih besar pada gangguan fungsi hati. Waktu paruh ini akan berangsur angsur turun sampai kurang lebih 40% (sampai tiga jam) setelah penggunaan tahap pertama selama 14 hari, yang disebabkan karena kenaikan ekskresi biliar oleh induksi enzim.
c. Distribusi
Rifampisin dapat terdistribusi dalam seluruh tubuh. Konsentrasi efektif dapat ditemukan dalam beberapa organ dan cairan tubuh termasuk cairan serebrospinal.
Hal ini ditandai dengan adanya pewarnaan (merah jingga) dalam urin, feses, saliva, sputum, air mata dan keringat dari penderita.
d. Ekskresi
Rifampisin dapat berpenetrasi ke dalam sel fagosir dan membunuh mikroorganisme yang hidup didalam sel tersebut. Kira-kira 30% dari dosis rifampisin yang diberikan diekskresi dalam urin dan kurang lebih setengahnya dalam bentuk tak berubah (Wattimena, dkk., 1991).
2.3.4 Farmakodinamik
Rifampisin mempunyai aktivitas tinggi terhadap mycobacterium termasuk M.tuberculosis dan M. leprae. Obat tersebut juga sangat aktif terhadap Staphylococcus aureus, Listeria monocytogenes, Neisseria meningitidis, Haemophillus influenza, dan beberapa bakteri lainnya (Wattimena, dkk., 1991).
2.3.5 Efek samping
Rifampisin pada umumnya dapat diterima dengan baik oleh tubuh penderita.
Kadang-kadang muncul gangguan perut, nyeri pada otot dan persendian, serta rasa kaku pada kaki. Gejala ini terutama muncul pada minggu pertama pengobatan (Wattimena, dkk., 1991).
Pada periode pertama pemakaian obat ini dapat terjadi sakit kuning asimptomatik yang mungkin disebabkan karena kenaikan ekskresi billiard akibat induksi enzim. Terjadinya gangguan hati lebih lanjut dapat dikurangi dengan menekan dosis pemakaian obat ini, tetapi bila tetap muncul gejala hepatitis maka obat ini harus dihentikan. Selain karena kenaikan eksresi empedu oleh sel-sel hati, sakit kuning dapat disebabkan oleh pertukaran kompetitif bilirubin dimana kemudian masuk ke dalam peredaran darah dalam bentuk konyugasinya. Keadaan ini dapat muncul bila fungsi hati lemah atau bila pemaikaian rifampisin dikombinasikan dengan isoniazid. Rifampisin dan metabolitnya dapat
memberikan pewarnaan merah-jingga dalam urin, feses, saliva, keringat, air mata serta perubahan warna pada lensa kontak penderita (Wattimena, dkk., 1991).
2.3.6 Indikasi
Senyawa ini terutama digunakan untuk pengobatan tuberculosis dan lepra.
Juga untuk pengobatan karier asimptomatik pada infeksi Haemophilus influenza B (Wattimena, dkk., 1991).
Pada infeksi Streptococcus epidermitis atau S.aureus digunakan kombinasi senyawa ini dengan vankomisin atau suatu penisilin yang resisten terhadap penisilinase. Disamping itu rifampisin dapat digunakan pada pengobatan infeksi Leginella pneumophilia yang telah resisten terhadap eritromisin, pengobatan karier asimptomatik infeksi Neisseria menginitidis (Wattimena, dkk., 1991).
2.3.7 Kontraindikasi
Rifampisin tidak boleh digunakan pada keadaan sirosis, insufisiensi hati, pecandu alkohol dan pada kehamilan muda (Wattimena, dkk., 1991).
2.3.8 Sediaan, rute pemberian dan dosis
Pemberiaan secara oral dilakukan dengan dosis tunggal, satu jam sebelum makan atau dua jam setelah makan. Obat ini diberikan dalam bentuk kapsul 150 mg dan 300 mg. Selain itu terdapat pula tablet 450 mg dan 600 mg, suspensi yang mengandung 100 mg/5 mL dan injeksi volume kecil. Dosis untuk orang dewasa 600 mg dua kali sehari, untuk anak-anak dosisnya 10 mg/kg dua kali sehari dan 5 mg/kg dua kali sehari untuk bayi yang baru lahir. Dosis maksimum untuk anak- anak adalah 600 mg/hari (Wattimena, dkk., 1991).
2.4 Analisis Rifampisin dalam sediaan farmasi
Rifampisin dalam sediaan farmasi dapat berupa kapsul 150 mg dan 300 mg.
Selain itu terdapat pula tablet 450 mg dan 600 mg , suspensi yang mengandung 100 mg/5 mL, dan injeksi volume kecil (Wattimena, dkk., 1991).
Adapun Rifampisin dalam sediaan farmasi yaitu:
1. Tablet
Tablet Rifampisin mengandung C43H58N4O12 tidak kurang dari 92,5% dan tidak lebih dari 107,5% dari jumlah yang tertera pada etiket. Penetapan kadar Rifampisin dalam sediaan tablet menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) yang dilengkapi dengan detektor 254 nm dan kolom 10 cm x 4,6 mm berisi bahan pengisi L7 (Oktisilana) dengan ukuran partikel 5µm serta laju alir lebih kurang 1,5 mL per menit. Dimana penetapan kadar menggunakan fase gerak campuran 35 mL Acetonitril.dan 65 mL larutan (0,1% Asam fosfat, 0,19%
Natrium perklorat, 0,59% Asam sitrat, 2,09% Potassium dihidrogen fosfat).
Pengencer yang digunakan yaitu Asetonitril P dan pelarut campuran dari air, Asetonitril P, Natrium fosfat dibasa 17,42%, Kalium fosfat monobasa 13,61%, Asam sitrat 21,01% (640:250:77:23:10). Pada proses penimbangan kosentrasi dari larutan uji dan baku yaitu mengandung lebih kurang 0,03 mg dalam 1 mL larutan (Government of India Ministry of Health & Family Welfare, 2010).
2. Kapsul
Kapsul Rifampisin mengandung C43H58N4O12 tidak kurang dari 90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. Penetapan kadar Rifampisin dalam sediaan kapsul menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) yang dilengkapi dengan detektor 254 nm dan kolom 10
cm x 4,6 mm berisi bahan pengisi L7 (Oktisilana) dengan ukuran partikel 5µm serta laju alir lebih kurang 1,5 mL per menit. Dimana penetapan kadar menggunakan fase gerak campuran Acetonitril P : Dapar fosfat : Asam sitrat 1,0 M : Natrium perklorat 0,5 M ( 510: 350: 100: 20: 20). Pengencer yang digunakan yaitu Asetonitril P dan pelarut campuran dari air, Asetonitril P, Natrium fosfat dibasa 1,0 M, Kalium fosfat monobasa 1,0 M, Asam sitrat 1,0 M (640:250:77:23:10). Pada proses penimbangan kosentrasi dari larutan uji dan baku yaitu mengandung lebih kurang 0,03 mg dalam 1 mL larutan (Ditjen POM., 2014).
3. Suspensi Oral
Suspensi oral Rifampisin mengandung C43H58N4O12 tidak kurang dari 90,0%
dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket. Komposisi suspensi oral Rifampisin yaitu Rifampisin1,20 g dan sirup secukupnya hingga 120 ml. Penetapan kadar Rifampisin dalam sediaan suspensi menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) yang dilengkapi dengan detektor 254 nm dan kolom 10 cm x 4,6 mm berisi bahan pengisi L7 (Oktisilana) dengan ukuran partikel 5µm serta laju alir lebih kurang 1,5 mL per menit. Dimana penetapan kadar menggunakan fase gerak campuran Acetonitril P : Dapar fosfat : Asam sitrat 1,0 M : Natrium perklorat 0,5 M ( 510: 350: 100: 20: 20). Pengencer yang digunakan yaitu Asetonitril P dan air (1:1). Pada proses penimbangan kosentrasi dari larutan uji dan baku yaitu mengandung lebih kurang 0,5 mg dalam 1 mL larutan (Ditjen POM., 2014).
4. Injeksi
Rifampisin untuk injeksi mengandung C43H58N4O12 tidak kurang dari 90,0%
dan tidak lebih dari 115,0% dari jumlah yang tertera pada etiket. Penetapan kadar Rifampisin dalam sediaan injeksi menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) yang dilengkapi dengan detektor 254 nm dan kolom 10 cm x 4,6 mm berisi bahan pengisi L7 (Oktisilana) dengan ukuran partikel 5µm serta laju alir lebih kurang 1,5 mL per menit. Dimana penetapan kadar menggunakan fase gerak Dapar. Pengencer yang digunakan yaitu Asetonitril P dan pelarut campuran dari air, Asetonitril P, Natrium fosfat dibasa 1,0 M, Kalium fosfat monobasa 1,0 M, Asam sitrat 1,0 M (640:250:77:23:10). Pada proses penimbangan kosentrasi dari larutan uji dan baku yaitu mengandung lebih kurang 0,02 mg dalam 1 mL larutan (Ditjen POM., 2014).
2.5 Kromatografi
Kromatografi pertama kali dikembangkan oleh seorang ahli botani Rusia Michael Tswett pada tahun 1903 untuk memisahkan pigmen berwarna dalam tanaman dengan cara perkolasi ekstrak petroleum eter dalam kolom gelas yang berisi kalsium karbonat (Johnson dan Stevenson, 1991).
Teknik kromatografi telah berkembang dan telah digunakan untuk memisahkan berbagai macam komponen yang kompleks,baik komponen organik maupun komponen anorganik. Saat ini kromatografi merupakan teknik pemisahan yang paling umum dan paling sering digunakan dalam bidang kimia untuk melakukan analisis, baik analisis kualitatif, kuantitatif atau preparatif dalam bidang farmasi (Gandjar dan Rohman, 2007).
2.5.1 Pembagian Kromatografi
Kromatografi dapat dibedakan atas berbagai macam, tergantung pada pengelompokannya. Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi: (a) kromatografi adsorbsi; (b) kromatografi partisi; (c) kromatografi pasangan ion; (d) kromatografi penukar ion (e) kromatografi eksklusi ukuran dan (f) kromatografi afinitas (Rohman, 2009).
Berdasarkan alat yang digunakan, kromatografi dapat dibagi atas : (a) kromatografi kertas; (b) kromatografi lapis tipis, yang keduanya sering disebut kromatografi planar, (c) kromatografi cair kinerja tinggi (KCKT) dan (d) kromatografi gas (KG). Bentuk kromatografi yang paling awal adalah kromatografi kolom yang digunakan untuk pemisahan sampel dalam jumlah yang besar (Rohman, 2009).
2.6 Kromatografi Cair Kinerja Tinggi
Kromatografi cair kinerja tinggi (KCKT) atau biasa juga disebut dengan HPLC (High Perpormance Liquid Chromatography) dikembangkan pada akhir tahun 1960-an dan awal tahun 1970-an. Saat ini, KCKT merupakan teknik pemisahan yang diterima secara luas untuk analisis bahan obat (Rohman, 2009).
Kromatografi cair kinerja tinggi (KCKT) merupakan teknik yang mana solut atau zat terlarut terpisah oleh perbedaan kecepatan elusi, dikarenakan solut-solut ini melewati suatu kolom kromatografi. Pemisahan solut-solut ini diatur oleh distribusi solut dalam fase gerak dan fase diam. Penggunaan kromatografi cair secara sukses terhadap suatu masalah yang dihadapi membutuhkan penggabungan secara tepat dari berbagai macam kondisi operasional seperti jenis kolom, fase
gerak, panjang dan diameter kolom, kecepatan alir fase gerak, suhu kolom, dan ukuran sampel (Gandjar dan Rohman, 2007).
Kromatografi cair kinerja tinggi (KCKT) merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi, dan detektor yang sangat sensitif dan beragam sehingga mampu menganalisa berbagai cuplikan secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran (Ditjen POM., 1995).
Kromatografi Cair Kinerja Tinggi merupakan jenis yang khusus dari kromatografi kolom. Berbeda dengan kromatografi gas, metode ini menggunakan cairan dengan tekanan tinggi sebagai fase mobil (fase gerak) sebagai pengganti gas. Metode ini dapat dibedakan dari kromatografi kolom klasik oleh empat sifat yang khas yaitu:
a. Menggunakan kolom pendek untuk mempersingkat waktu.
b. Menggunakan kolom sempit dengan diameter antara 1 sampai 3 mm, untuk memungkinkan pemisahan dalam jumlah mikro.
c. Ukuran partikel bahan absorbsi (penyerap) terletak dibawah 50 µm, hingga akan tercapai suatu bilangan dasar teoritik yang tinggi.
d. Pelarut elusi dialirkan kedalam kolom dengan tekanan untuk mengkompensasikan tekanan arus di dalam kolom.
(Roth, 1998).
Banyak kelebihan metode kromatografi cair kinerja tinggi dibandingkan dengan metode lainnya. Beberapa kelebihan kromatografi cair kinerja tinggi antara lain:
a. Mampu memisahkan molekul-molekul dari suatu campuran.
b. Mudah melaksanakannya.
c. Kecepatan analisis dan kepekaan yang tinggi.
d. Dapat dihindari terjadinya dekomposisi/kerusakan bahan yang dianalisis.
e. Resolusi yang baik.
f. Dapat digunakan bermacam-macam detektor.
g. Kolom dapat dipergunakan kembali.
(Roth, 1998) 2.6.1 Klasifikasi Kromatografi Cair Kinerja Tinggi (KCKT)
Klasifikasi kromatografi cair kinerja tinggi (KCKT) berdasarkan pada sifat fase diam yaitu:
a. Kromatografi Absorbsi
Pemisahan kromatografi adsorbsi menggunakan fase diam silika gel atau alumina, meskipun demikian sekitar 90% kromatografi ini memakai silika gel sebagai fase diamnya. Fase geraknya berupa pelarut non polar yang ditambah dengan pelarut polar seperti air atau alkohol rantai pendek untuk meningkatkan kemampuan elusinya sehingga tidak timbul pengekoran puncak, seperti n-heksana ditambah metanol. Jenis KCKT ini sesuai untuk pemisahan-pemisahan campuran isomer struktur dan untuk pemisahan solut dengan gugus fungsional yang berbeda (Gandjar dan Rohman, 2007).
b. Kromatografi Partisi
Kromatografi jenis ini disebut juga dengan kromatografi fase terikat.
Kebanyakan fase diamnya adalah silika yang dimodifikasi secara kimiawi atau fase terikat. Sejauh ini yang digunakan untuk memodifikasi silika adalah
hidrokarbon-hidrokarbon non polar seperti oktadesilsilana, oktilsilana, atau dengan fenil. Fase diam yang paling populer digunakan adalah oktadesilsilana (ODS atau C18) dan kebanyakan pemisahannya adalah dengan fase terbalik.
Sedangkan fase geraknya adalah campuran asetonitril atau metanol dengan air atau dengan larutan buffer. (Gandjar dan Rohman, 2007).
Ditinjau dari jenis fase diam dan fase geraknya, maka kromatografi partisi dapat dibedakan atas:
a. Kromatografi Fase Normal
Kromatografi fase normal (fase diam lebih polar daripada fase gerak), kemampuan elusi meningkat dengan meningkatnya polaritas pelarut. Fase gerak ini biasanya tidak polar. Dietil eter, benzen, hidrokarbon lurus seperti pentana, heksana, heptana maupun iso-oktana sering digunakan. Halida alifatis seperti diklorometana, dikloroetana, butilklorida dan kloroform juga digunakan.
Umumnya gas terlarut tidak menimbulkan masalah pada fase normal (Gandjar dan Rohman, 2007).
b. Kromatografi Fase Terbalik
Kromatografi fase terbalik (fase diam kurang polar daripada fase gerak), kemampuan elusi menurun dengan meningkatnya polaritas pelarut. Kandungan utama fase gerak fase terbalik adalah air. Pelarut yang dapat campur dengan air seperti metanol, etanol, asetonitril, dioksan, tetrahidrofuran dan dimetilformamida ditambahkan untuk mengatur kepolaran fase gerak. Dapat ditambahkan pula asam, basa, dapar dan surfaktan. Mutu air harus tinggi baik air destilasi maupun air mineral (Gandjar dan Rohman, 2007).
c. Kromatografi Penukar Ion
KCKT penukar ion menggunakan fase diam yang dapat menukar kation atau anion dengan suatu fase gerak. Ada banyak penukar ion yang beredar di pasaran, meskipun demikian yang paling luas penggunaanya adalah polistiren resin (Gandjar dan Rohman, 2007).
Tehnik ini tergantung pada penukaran (adsorpsi) ion-ion diantara fase gerak dan tempat-tempat berion dari kemasan. Kebanyakan resin-resin berasal dari polimer stiren divinilbenzen dimana gugus-gugus fungsinya telah ditambah.
Resin-resin tipe asam sulfonat dan amin kuarterner merupakan jenis resin pilihan paling baik dan banyak digunakan. Keduanya, fase terikat dan resin telah digunakan. Tehnik ini dipakai secara luas dalam life sciences dan dikenal secara khas untuk pemisahan asam-asam amino. Tehnik ini dapat dipakai untuk keduanya, kation-kation dan anion-anion (Johnson dan Stevenson, 1991).
d. Kromatografi Eksklusi
Kromatografi ini disebut juga dengan kromatografi permiasi gel dan dapat digunakan untuk memisahkan atau menganalisis senyawa dengan berat molekul lebih besar dari 2000 Dalton. Fase diam yang digunakan dapat berupa silika atau polimer yang bersifat porus sehingga solut dapat melewati porus atau berdifusi melewati fase diam (Gandjar dan Rohman, 2007).
Tehnik ini unik karena dalam pemisahan didasarkan pada ukuran molekul dari solut. Kemasan adalah suatu gel dengan suatu permukaan berlubang-lubang sangat kecil yang inert. Molekul-molekul kecil dapat masuk ke dalam jaringan dan ditahan dalam fase gerak yang menggenang. Molekul-molekul yang lebih esar
tidak dapat masuk ke dalam jaringan dan lewat melalui kolom tanpa ditahan (Johnson dan Stevenson, 1991).
2.6.2 Instrumentasi Kromatogarfi Cair Kinerja Tinggi (KCKT)
Bagan instrumentasi Kromatografi Cair Kinerja Tinggi (KCKT) dapat dilihat pada lampiran 5 hal 37. Instrumentasi Kromatografi Cair Kinerja Tinggi (KCKT) pada dasarnya terdiri atas enam komponen pokok yaitu:
1. Wadah Fase Gerak
Wadah fase gerak yang digunakan harus bersih. Wadah pelarut kosong ataupun labu laboratorium dapat digunakan sebagai wadah fase gerak. Wadah ini biasanya dapat menampung fase gerak antara 1 sampai 2 liter pelarut (Gandjar dan Rohman, 2007).
2. Pompa
Pompa yang cocok untuk KCKT mempunyai beberapa ciri yaitu : pompa harus dibuat dari bahan yang lembam terhadap semua macam pelarut, mampu menghasilkan tekanan sampai 5000-6000 psi pada kecepatan alir sampai 3 ml/menit, sedangkan jika untuk skala preparative perlu kecepatan alir sampai 20 ml/menit, dan menghantarkan aliran pelarut yang tetap dan terulangkan ke dalam kolom. Ada tiga macam jenis pompa yang banyak dipakai pada KCKT antara lainReciprocating Pumps, Displacement Pumps (Syringe Pumps), Pneumatic Pumps (Constant Pressure Pumps) (Gritter, 1991).
3. Injektor
Sampel-sampel cair dan larutan disuntikkan secara langsung ke dalam fase gerak yang mengalir dibawah tekanan menuju kolom menggunakan alat penyuntik (injektor). Ada tiga macam sistem injektor pada KCKT yaitu injektor
dengan memakai diafragma (septum), injektor tanpa septum, injektor dengan pipa dosis (Mulja dan Suharman, 1995).
4. Kolom
Kolom merupakan komponen yang vital pada analisis kromatografi.
Keberhasilan atau kegagalan analisis bergantung pada pilihan kolom dan kondisi kerja yang tepat. Kolom pada kromatografi cair kinerja tinggi merupakan bagian yang sangat penting, karena proses separasi (pemisahan) komponen-komponen sampel akan terjadi di dalam kolom. Kolom akan menjadi kunci penentu keberhasilan pemisahan komponen-komponen sampel serta hasil akhir analisis dengan KCKT. Dianjurkan untuk memasang penyaring 2 µm di jalur antara penyuntik dan kolom untuk menahan partikel yang dibawa fase gerak dan memperjang umur dari kolom (Mulja dan Suharman, 1995).
5. Detektor
Detektor diperlukan untuk mengindera adanya komponen cuplikan di dalam eluen kolom dan mengukur jumlahnya. Detektor yang baik sangat peka, rentang tanggapan liniernya lebar, dan menanggapi semua jenis senyawa. Kita menginginkan pula detektor yang kurang peka terhadap perubahan aliran dan suhu, tetapi hal itu selalu tidak terpenuhi. Detektor pada KCKT dikelompokkan menjadi dua golongan yaitu :
a. Detektor universal yaitu detektor yang mampu mendeteksi zat secara umum, tidak bersifat spesifik, dan tidak bersifat selektif seperti detektor indeks bias dan spektrofotometri massa.
b. Detektor yang spesifik yang hanya akan mendeteksi analit secara spesifik dan selektif, seperti detektor UV-Vis, detektor fluoresensi, dan elektrokimia (Mulja dan Suharman, 1995).
6. Komputer, Integrator, atau Rekorder
Alat pengumpul data seperti komputer, integrator , atau rekorder, dihubungkan dengan detektor. Alat ini akan mengukur sinyal elektronik yang dihasilkan oleh detektor lalu memplotkannya sebagai suatu kromatogram yang selanjutnya dapat dievaluasi oleh seorang analis (Gandjar dan Rohman, 2007).
2.7 Penggunaan KCKT dalam Analisis Farmasi
Metode KCKT merupakan metode yang sangat popular untuk menetapkan kadar senyawa obat bak dalam sediaan atau dalam sampel hayati. Hal ini disebabkan KCKT merupakan metode yang memberikan sensitifitas dan spesifisitas yang tinggi (Rohman, 2007).
BAB III
METODE PENELITIAN
3.1 Tempat Pengujian
Pengujian penetapan kadar Rifampisin dalam sediaan tablet dengan metode Kromatografi Cair Kinerja Tinggi (KCKT) dilakukan di Laboratorium Obat, Balai Besar Pengawas Obat dan Makanan di Medan yang berada di Jalan Willem Iskandar Pasar V Barat I No. 2 Medan.
3.2 Alat
Alat yang digunakan adalah Seperangkat alat KCKT dengan kolom L7, 10 cm × 4,6 mm, detektor 254 nm, sonikator, penyaring membran ukuran 0,45 µm, penyaring vakum, timbangan analitik, dan alat-alat gelas.
3.3 Sampel
Sampel yang digunakan yaitu tablet Rifampicin 450 mg.
3.4 Bahan
Bahan yang digunakan adalah akuabides steril, Acetonitril P, Asam fosfat 0,1%, Natrium perklorat 0,19%, Asam sitrat 0,59%, Potassium dihidrogen fosfat 2,09%, pelarut (campuran dari 10 mL asam sitrat 21,01%, 23 mL Potassium dihidrogen fosfat 13,61%, 77 mL Dipotasium hidrogen fosfat 17,8%, 640 mL akuabides steril, dan 250 mL Asetonitril P) dan baku pembanding Rifampisin.
3.5 Prosedur Percobaan 3.5.1 Fase Gerak
Dimasukkan campuran 65 mL larutan (0,1% Asam fosfat, 0,19% Natrium perklorat, 0,59% Asam sitrat, 2,09% Potassium dihidrogen fosfat) dan 35 mL Acetonitril dalam Erlenmeyer 1000 ml kemudian disonikasi selama ± 30 menit.
3.5.2 Pembuatan Larutan uji
Sejumlah lebih kurang 20 tablet Rifampicin, digerus dan ditimbang setara 150 mg. Dimasukkan ke dalam labu ukur, di cukupkan dengan Asetonitril sebanyak 100 mL kedalam labu tentukur. Larutkan dengan menggunakan alat sonikator ± 30 detik. Sejumlah 5,0 mL larutan ini dipipet kedalam labu tentukur 25 mL dan diencerkan dengan asetonitril sampai tanda. Kemudian Sejumlah 5,0 mL larutan ini lagi dipipet kedalam labu tentukur 50 mL dan diencerkan dengan pelarut sampai tanda. Saring dengan penyaring membran dan masukkan ke dalam vial.
3.5.3 Larutan Baku Pembanding
Sejumlah cuplikan setara dengan lebih kurang 7,5 mg baku rifampisin BPFI ditimbang seksama dan dimasukkan ke dalam labu ukur, di cukupkan dengan Asetonitril sebanyak 25 mL kedalam labu tentukur. Larutkan dengan menggunakan alat sonikator ± 30 detik. Sejumlah 5,0 mL larutan ini dipipet kedalam labu tentukur 50 mL dan diencerkan dengan Asetonitril sampai tanda .Saring dengan penyaring membran dan masukkan ke dalam vial.
3.6 Kromatografi Cair Kinerja Tinggi 3.6.1 Pengaturan Kondisi Sistem
Sistem diperiksa dan dicek untuk meyakinkan apakah sistem pengalir pelarut telah disambungkan dengan baik, kolom telah dipasang, tersedia cukup pelarut di dalam botol pelarut, sistem pengawasan pelarut bekerja dengan baik untuk menghilangkan gelembung udara, penyaring pelarut sudah dipasang,dan detektor yang sesuai sudah terpasang dengan benar.
3.6.2 Mengaktifkan Sistem
Setelah masing-masing sistem diatur, hubungkan setiap sistem dengan sumber arus listrik. Tekan tombol power pada pompa, detektor UV-VIS ke posisi ON dan CBM (Communication Bus Module) ke posisi ON.
3.6.3 Penentuan Garis Alas
Bila nilai absorbansi yang ditampilkan pada detektor UV-VIS telah menunjukkan 0,000 lalu biarkan beberapa menit sampai diperoleh garis alas yang relatif cukup lurus yang menandakan sistem telah stabil.
3.7 Cara Penetapan
Kemudian larutan uji dan baku diinjeksikan secara terpisah kedalam kolom kromatografi cair kinerja tinggi (KCKT) dan dilakukan elusi dengan kondisi menggunakan kolom fase terbalik L7 (Oktisilana berukuran 10 × 4,6 mm),detektor dengan panjang gelombang 245 nm, dengan laju alir 1,5 mL per menit, dengan volume injeksi 20 µL, dengan fase gerak campuran 65 mL larutan (Asam fosfat 0,1%, Natrium perklorat 0,19%, Asam sitrat 0,59%, Potassium
dihidrogen fosfat 2,09%) dan 35 mL Asetnotril P, dan diinjeksikan kedalam KCKT.
Hasil yang diperoleh dapat dilihat dari terbentuknya puncak yang direkam oleh CBM (Communication Bus Module) yakni sejenis penghubung dengan sistem komputer yang dilengkapi dengan pencetak kromatogram.
3.8 Perhitungan Kadar
Kadar Rifampisin dalam sediaan tablet dengan metode Kromatografi Cair Kinerja Tinggi (KCKT) dapat dihitung dengan rumus:
Kadar Rifampisin :
× ×
× x 100 %Keterangan:
Lu : Luas puncak larutan uji Lb : Luas puncak larutan baku
Bb : Bobot baku yang ditimbang dalam g Bu : Bobot uji yang ditimbang dalam mg Fu : Faktor pengenceran larutan uji Fb : Faktor pengenceran larutan baku
Br : Bobot rata-rata uji yang ditimbang dalam g Ke : Kadar yang tertera pada etiket dalam mg
3.9 Persyaratan
Persyaratan Rifampisin dalam sediaan tablet menurut Indian Pharmacopoeia volume III tahun 2010 memenuhi persyaratan jika kadar tablet Rifampisin mengandung tidak kurang dari 92,5% dan tidak lebih dari 107,5% dari yang tertera pada etiket.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Pada pengujian penetapan kadar Rifampisin dalam sediaan tablet dengan kromatografi cair kinerja tinggi diperoleh kadar sebagai berikut. Lihat Tabel 4.1.
Tabel 4.1 Kadar Rifampisin dalam sediaan tablet
Sampel Bobot Uji (gram)
Waktu Retensi (menit)
Luas puncak
(mm)
Kadar*) (%)
Kadar rata-rata
(%) Rifampicin
450 mg
0,20273 6,472 806440 93,12%
93,41%
0,20247 6,471 810522 93,71%
*) Kadar adalah persentase dari yang tertera pada etiket.
Berdasarkan pengujian yang dilakukan terhadap penetapan kadar Rifampisin dalam sediaan tablet dengan metode kromatografi cair kinerja tinggi (KCKT) diperoleh kadar Rifampisin 93,41%.
Kromatogram hasil pengujian dari kromatografi cair kinerja tinggi (KCKT) dapat dilihat pada Lampiran 3 halaman 34 dan sedangkan perhitungan penetapan kadar Rifampisin dalam sediaan tablet dengan metode KCKT dapat dilihat pada Lampiran 4 halaman 35.
4.2 Pembahasan
Berdasarkan hasil penetapan kadar Rifampisin dalam sediaan tabletdengan metode Kromatografi Cair Kinerja Tinggi (KCKT), diperoleh hasil bahwasanya tablet yang mengandung Rifampisin yang diuji tersebut memenuhi persyaratan
yang ditetapkan oleh Indian Pharmacopoeia volume III tahun 2010 yaitu tidak kurang dari 92,5% dan tidak lebih dari 107,5% dari yang tetera pada etiket.
Rifampisin dalam sediaan tabletdapat ditetapkan kadarnya dengan kromatografi cair kinerja tinggi (KCKT) karena analisis dengan KCKT cepat, daya pisah baik, peka, penyiapan sampel yang mudah, dan dapat dihubungkan dengan detektor yang sesuai. Panjang gelombang analisis yang dipilih adalah 245 nm, karena pada panjang gelombang tersebut Rifampisin memberikan respon puncak yang baik.
Metode KCKT yang digunakan pada penetapan Rifampisin dalam sediaan tablet adalah kromatografi partisi metode kolom fase terbalik yakni fase diam bersifat non polar berupa Oktisilana (L7), dan fase gerak bersifat polar yaitu campuran 65 mL larutan (0,1% Asam fosfat, 0,19% Natrium perklorat, 0,59%
Asam sitrat, 2,09% Potassium dihidrogen fosfat) dan 35 mL Asetonotril P. Pada saat penggunaan metode kolom fase terbalik dimana terjadi kompetisi antara fase gerak dengan sampel yang diuji yang terjadi di dalam kolom.
Untuk pengujian Rifampisin dalam sediaan farmasi lainnya seperti kapsul, suspensi, serta injeksi juga menggunakan metode KCKT (Kromatografi Cair Kinerja Tinggi). Tetapi terdapat perbedaan dalam fase gerak dan pelarut yang digunakan dalam menyiapkan sampel untuk diinjeksi ke dalam alat KCKT.
Dari hasil pengujian yang telah dilakukan, dapat dinyatakan bahwa penetapan kadar Rifampisin dalam sediaan tabletdengan metode Kromatografi Cair Kinerja Tinggi (KCKT) dengan menggunakan prinsip kromatografi partisi metode kolom fase terbalik merupakan metode yang cukup baik dalam penetapan Rifampisin dalam sediaan tablet.
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil percobaan penetapan kadar Rifampisin dalam sediaan tablet dengan metode Kromatografi Cair Kinerja Tinggi, diketahui bahwa Rifampisin sebesar 93,41%, dimana tablet rifampisin yang diuji tersebut memenuhi persyaratan yang ditetapkan oleh Indian Pharmacopoeia volume III tahun 2010.yaitu tidak kurang dari 92,5% dan tidak lebih dari 107,5% dari yang tertera pada etiket.
5.2 Saran
Penetapan kadar suatu senyawa kimia di dalam sediaan obat saat ini, hanya dilakukan pada satu merek tablet saja. Diharapkan kepada penulis selanjutnya agar menggunakan tablet Rifampisin dengan merek dagang yang berbeda dipasaran agar wawasan kita tentang produk obat yang baik dan memenuhi persyaratan semakin luas.
DAFTAR PUSTAKA
Anief, M. (1987). Ilmu Farmasi. Yogyakarta: Gadjah Mada University Press. Hal.
31, 38, 39, 61, 62.
Anief, M. (1996). Penggolongan Obat Berdasarkan khasiat dan penggunaannya.
Yogyakarta: Gadjah Mada University Press. Hal. 16-17.
Anief, M. (2008). Ilmu Meracik Obat. Yogyakarta: Gadjah Mada University Press. Hal. 31, 38, 39, 61, 62.
Ansel HC. (1989). Pengantar Bentuk Sediaan Farmasi. Edisi IV. Jakarta : Universitas Indonesia Press. Hal. 244-245
DitJen POM RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 1083,1084.
Ditjen POM RI. (2014). Farmakope Indonesia. Edisi V. Jakarta: Departemen Kesehatan Republik Indonesia. Hal. 1094-1098.
Gandjar, I. G., dan A.Rohman. (2007). Kimia Farmasi Analisis. Yogyakarta:
Penerbit Pustaka Pelajar. Hal. 378- 394, 406
Government of India Ministry of Health & Family Welfare. (2010). Indian Pharmacopoeia. Volume III. Ghaziabad : The Indian Pharmacopoeia Commission. Hal. 1094-1095
Gritter, R.J., Bobbit, J.M., Schwarting, A.E, (1991). Pengantar Kromatografi.
Bandung: ITB Press. Hal. 22.
Joenoes, N.Z. (2001). Resep yang Rasional. Edisi II. Surabaya: Airlangga University Press. Hal. 27.
Johnson, E.L., dan Stevenson, R (1991). Basic Liquid Chromatography.Penerjemah Kosasih Padmawinata. Dasar Kromatografi Cair. Bandung: Penerbit. ITB. Hal. 291-302.
Mulja, Muhammad, dan Suharman. (1995). Analisis Instrumental. Surabaya:
Airlangga University Press. Hal. 248.
Rohman, A. (2009). Kromatografi untuk Analisis Obat. Yogyakarta: Graha Ilmu.
Hal. 2.
Rohman, A. (2007). Kimia Farmasi Analisis. Yogyakarta: Pustaka Pelajar. Hal.
406.
Roth, H.J., dan Gottfried Blaschke. (1998). Analisis Farmasi. Yogyakarta: Gadjah Mada University Press. Hal. 431-432.
Siregar, C.J.P., dan Wikarsa, S. (2010). Teknologi Farmasi Sediaan Tablet:
Dasar-Dasar Praktis. Jakarta: Penerbit Buku Kedokteran, EGC. Hal. 90, 98-110.
Syamsuni, A.H. (2007). Ilmu Resep. Jakarta: Penerbit Buku Kedokteran, EGC.
Hal. 61.
Syarif, A. (2009).Farmakologi dan Terapi. Edisi V. Jakarta: EGC. Hal. 616.
Tjay, T.H., dan Rahardja, K. (2010). Obat-Obat Penting. Edisi VI. Cetakan Pertama. Jakarta: PT Gramedia. Hal. 155-161.
Widjajanti, V.N. (1998). Obat – Obatan. Yogyakarta: Penerbit Kanisius. Hal. 23.
Wattimena, J.R., Sugiarso, N.C., Widianto, M.B., Sukandar, E.Y., Soermardji, A.A., dkk. (1991).Farmakodinami Dan Terapi Antibiotik. Yogyakarta:
Gadjah Mada UniversityPress. Hal. 137-140.
Lampiran 1. Data dan hasil penetapan kadar tablet Rifampisin.
A. Data Baku
Baku pembanding : Rifampsin BPFI 111045.
Kadar baku : 98,93%
Susut pengeringan : 0,04%
Bobot baku yang ditimbang : 7,607 mg Luas puncak larutan baku : 864684 Faktor pengenceran : 250 ml B. Data Sampel
Nama sediaan : Rifampicin 450 mg
No. Batch : -
No Reg : -
Bobot rata-rata : 0,60763 g
Kandungan Rifampisin pada etiket : 450 mg Bobot uji 1 yang ditimbang : 0,20273 g Bobot uji 2 yang ditimbang : 0,20247 g Luas puncak larutan uji 1 : 806440 Luas puncak larutan uji 2 : 810522 Faktor pengenceran : 5000 ml
Lampiran 2. Kromatogram uji kesesuaian sistem larutan baku.
Nama Baku : Rifampisin BPFI No. Kontrol : 111045 Kadar Baku : 98,93 %
LoD : 0,40 %
Penimbangan : 17,500 mg - 9,893 mg Pengenceran : 250 X
Kolom : L7
Fase Gerak : Campuran 65 mL (Asam fosfat-Natrium perklorat-Asam sitrat-Potassium dihidrogen fosfat) dan 35 mL Asetonitril
Flow : 1,5 mL/menit
Detektor : 254 nm
Vol. Injeksi : 20 µL Tgl Uji : 18 Feb 2016
Lampiran 3. Kromatogram penetapan kadar tablet Rifampisin.
Lampiran 4. Perhitungan Penetapan Kadar tablet Rifampisin.
Kadar Rifampisin :
× ×
× x 100 %Keterangan:
Lu : Luas puncak larutan uji Lb : Luas puncak larutan baku
Bb : Bobot baku yang ditimbang dalam mg Bu : Bobot uji yang ditimbang dalam mg Fu : Faktor pengenceran larutan uji Fb : Faktor pengenceran larutan baku
Br : Bobot rata-rata uji yang ditimbang dalam mg Ke : Kadar yang tertera pada etiket dalam mg
Tablet 1
% Kadar Rifampisin 1
= × ×
× x 100 %=
x x x x 100%= 93,12%
Tablet 2
% Kadar Rifampisin 1
= × ×
× x 100 %=
x x x x 100%= 93,71%
Lampiran 4 (Lanjutan).
Kadar rata-rata =
=
= 93,41%
Kadar Rata-rata (Kr) dan Deviasi
Kr 1 = =
= 93,41%
D1 =
=
x 100%= 0,31%
Jadi, kadar rata-rata = ± 93,41% (diambil dari deviasi terkecil yaitu 0,31%) Kadar zat aktif =
×
Kadar pada etiket=
×
450 mg = 420,34 mg/tablet.Lampiran 5. Gambar Alat Kromatografi Cair Kinerja Tinggi.
Lampiran 6. Alat Ultrasonic Cleaner.
Lampiran 7. Neraca Mikro.
Lampiran 8. Neraca Makro
Lampiran 9. Sampel yang diuji tablet Rifampicin 450 mg.