DETEKSI PENYAKIT BERCAK BERCINCIN YANG DISEBABKAN OLEH PAPAYA RINGSPOT VIRUS DI KABUPATEN DELI SERDANG, SUMATERA UTARA
SKRIPSI
OLEH:
MUHAMMAD FAUZI RAMADHAN 160301023
AGROTEKNOLOGI/HPT
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
2021
DETEKSI PENYAKIT BERCAK BERCINCIN YANG DISEBABKAN OLEH PAPAYA RINGSPOT VIRUS DI KABUPATEN DELI SERDANG, SUMATERA UTARA
SKRIPSI
OLEH: MUHAMMAD FAUZI RAMADHAN 160301023
AGROTEKNOLOGI/HPT
Skripsi Sebagai Salah Satu Syarat Untuk Menyelesaikan Studi Di Program Studi Agroteknologi Fakultas
Pertanian Universitas Sumatera Utara
PROGRAM STUDI
AGROTEKNOLOGI FAKULTAS PERTANIAN UNIVERSITAS SUMATERA UTARA MEDAN
2021
ABSTRAK
Muhammad Fauzi Ramadhan. 2021. Deteksi Penyakit Bercak Bercincin yang Disebabkan oleh Papaya Ringspot Virus di Kabupaten Deli Serdang, Sumatera Utara. Dibimbing oleh Lisnawita dan Hasanuddin.
Penyakit papaya ringspot atau penyakit bercak cincin yang disebabkan oleh Papaya Ringspot Virus (PRSV) merupakan salah satu penyakit utama yang menjadi ancaman serius bagi industri pepaya komersial. PRSV pertama kali ditemukan di Provinsi Nanggroe Aceh Darusalam pada tahun 2012 dengan kejadian penyakit sebesar 100% di Desa Seulawah, Kabupaten Aceh Besar, dan Desa Meuse. Pada tahun 2013 PRSV dilaporkan ditemukan di Kabupaten Deli Serdang, Sumatera Utara. Serangan penyakit ini menyebabkan kerugian dengan kehilangan hasil sebesar 40-90% tergantung waktu infeksi dan umur tanaman. Penelitian dengan metode survei yang bertujuan untuk mengetahui kejadian penyakit bercak bercincin dan mendeteksi PRSV sebagai penyebabnya telah dilakukan dengan melakukan wawancara, mengamati gejala di lapangan, dan mengambil sampel daun, batang, dan buah pepaya dari Desa Sei Beras Sekata, Kecamatan Sunggal dan Desa Sialang Muda, Kecamatan Hamparan Perak, Kabupaten Deli Serdang, Sumatera Utara. Semua sampel selanjutnya dibawa ke laboratorium untuk di deteksi dengan metode RT-PCR dan DAS-ELISA.
Hasil penelitian menunjukkan bahwa tanaman yang terinfeksi PRSV mengalami gejala shoestring, belang, dan mosaik hijau tua pada daun, gejala streak dan garis berwarna hijau tua pada tangkai dan batang pepaya, serta gejala ringspot berwarna hijau tua pada buah pepaya. Persentase kejadian penyakit di Desa Sei Beras Sekata, Kecamatan Sunggal lebih tinggi ( 98%) dari pada dan Desa Sialang Muda, Kecamatan Hamparan Perak (85%). Metode deteksi dengan menggunakan RT-PCR memberikan hasil yang lebih akurat dibanding dengan metode DAS-ELISA.
Kata Kunci: DAS-ELISA, papaya ringspot virus, pepaya, RT-PCR
i
ABSTRACT
Muhammad Fauzi Ramadhan. 2021. Detection of Ringspot Disease Caused by Papaya Ringspot Virus in Deli Serdang Regency, North Sumatra. Supervised by Lisnawita and Hasanuddin.
Papaya ringspot disease or ring spot disease caused by Papaya Ringspot Virus (PRSV) is one of the main diseases that a serious threat to the commercial papaya industry.
PRSV was first reported in Nanggroe Aceh Darussalam Province in 2012 with a 100%
incidence in Seulawah Village, Aceh Besar District, and Meuse Village. Furthermore, in 2013 monitoring was found in Deli Serdang Regency, North Sumatra. This disease causes yield loss of 40-90% depending on the time of infection and the age of the plant.
This study aims to determine the incidence of ringed spot disease and detect PRSV as the cause has been carried out by conducting interviews, observing symptoms in the field, and taking samples of papaya leaves, stems, and fruits from Sei Beras Sekata Village, Sunggal District and Sialang Muda Village, Hamparan Perak District, Deli Serdang Regency, North Sumatra. All samples were brought to the laboratory for detection using RT-PCR and DAS-ELISA methods.
The results showed that PRSV-infected plants experienced shoestring, striped, and dark green mosaic symptoms on leaves, streaks and dark green lines on papaya stalks and stems, and dark green ringspot symptoms on papaya fruit. The percentage of disease incidence in Sei Beras Sekata Village, Sunggal District was higher (98%) than Sialang Muda Village, Hamparan Perak District (85%). The detection method using RT-PCR gave more accurate results than the DAS-ELISA method.
Keywords: DAS-ELISA, papaya ringspot virus, papaya, RT-PCR.
ii
RIWAYAT HIDUP
Penulis dilahirkan di Medan, 30 Desember 1998 dari pasangan Bapak Zul Kenedi, SE dan Ibu Anita Vivien Cerly Nelwan. Penulis merupakan anak ke-3 dari 4 bersaudara.
Tahun 2016 penulis lulus dari SMA Negeri 1 Medan, kemudian pada tahun yang sama penulis masuk ke Program Studi Agroteknologi, Fakultas Pertanian, Universitas Sumatera Utara melalu jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN) penulis memilih minat/konsentrasi belajar di bidang Hama dan Penyakit Tanaman.
Selama mengikuti perkuliahan, penulis aktif dalam kegiatan organisasi kemahasiswaan, yaitu Himpunan Mahasiswa Agroteknologi (HIMAGROTEK) FP USU periode 2016-2019 sebagai anggota, dan periode 2019-2020 sebagai kepala bidang minat dan bakat. Selama menjalani perkuliahan penulis juga mengikuti beberapa kepanitian seperti Dies Natalis Himagrotek, Musyawarah Besar Himagrotek, dan Ikatan Senat Mahasiswa Pertanian Indonesia (ISMPI).
Penulis melaksanakan Praktek Kerja Lapangan di PT. Perkebunan Nusantara III Persero Unit Kebun Rantauprapat. Penulis juga melaksanakan Kuliah Kerja Nyata (KKN) pada tahun 2020 di Desa Namo Ukur Utara, Kecamatan Sei Bingai, Kabupaten Langkat, Provinsi Sumatera Utara.
iii
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan karunia dan rahmat-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan baik. Adapun judul skripsi ini adalah “Deteksi Penyakit Bercak Bercincin yang Disebabkan oleh Papaya Ringspot Virus di Kabupaten Deli Serdang, Sumatera Utara” yang merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Program Studi Agroteknologi, Fakultas Pertanian, Universitas Sumatera Utara.
Dalam penyelesaian skripsi ini tentu dari bimbingan, dukungan dan bantuan dari berbagai pihak. Pada kesempatan ini penulis mengucapkan terimakasih kepada :
1. Ibu Dr. Lisnawita, SP., M.Si., selaku ketua komisi pembimbing skripsi yang telah bersedia meluangkan waktunya untuk memberikan bimbingan dan arahan serta saran dengan penuh kesabaran sehingga penulis dapat menyelesaikan skripsi ini dengan baik.
2. Bapak Dr. Ir. Hasanuddin, M.Si., selaku anggota komisi pembimbing skripsi yang telah bersedia meluangkan waktunya untuk memberikan bimbingan dan arahan serta saran dengan penuh kesabaran sehingga penulis dapat menyelesaikan skripsi ini dengan baik.
3. Seluruh dosen Fakultas Pertanian USU khususnya Program Studi Agroteknologi yang telah memberikan ilmu-ilmu yang bermanfaat kepada penulis selama masa perkuliahan.
4. Seluruh pegawai Fakultas Pertanian USU khususnya Program Studi Agroteknologi yang telah membantu dalam menyelesaikan segala urusan
iv
administrasi penulis selama perkuliahan.
5. Kedua orang tua tersayang Zul Kenedy, SE., dan Anita Vivien Cerly Nelwan, serta saudara-saudara kandung saya Nedi Novaldi, Muhammad Fauzan Ramadhan, dan Fahmi Almahdi yang telah memberikan doa dan semangat, serta dukungan moril maupun materil kepada penulis
6. Faliha Awalina Lubis yang selalu mensupport saya selama masa perkuliahan hingga saat ini.
7. Teman-teman terkhusus M. Abdi Azhari, Doni C. Nainggolan, Ade Novita Ritongan, Ysynta Haniv, Astuti Rahayu dan Aditya Angga Winata yang telah menemani dan memberi dukungan sejak awal masa perkuliahan.
8. Teman-teman PKL, KKN, dan teman-teman seperjuangan Agroteknologi stambuk 2016 yang tidak dapat disebutkan satu persatu yang telah banyak membantu dan menemani sejak awal masa perkuliahan.
9. Laboratorium Biomolekuler Balai Karantina Pertanian Kelas II Kualanamu Deli Serdang, Laboratorium Biomolekuler Balai Besar Karantina Pertanian Belawan, dan Laboratorium Genetika Molekuler Fakultas Pertanian USU yang telah mengizinkan saya melakukan penelitian untuk skripsi ini.
Penulis menyadari skripsi ini masih jauh dari sempurna, sehingga penulis mengharapkan saran dan kritik yang bersifat membangun untuk penyempurnaan skripsi ini. Penulis juga berharap semoga skripsi ini dapat berguna bagi pembaca dan pihak pihak yang membutuhkan.
Medan, Agustus 2021 Penulis
v
DAFTAR ISI
ABSTRAK ... i
RIWAYAT HIDUP ... iii
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Penelitian ... 3
1.3 Hipotesis Penelitian ... 3
1.4 Kegunaan Penulisan ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Biologi Papaya ringspot virus ... 4
2.2 Gejala Serangan Papaya ringspot virus Pada Tanaman Pepaya ... 4
2.3 Penularan Papaya ringspot virus ... 6
2.4 Deteksi Virus Papaya ringspot virus ... 7
BAB III BAHAN DAN METODE ... 9
3.1 Waktu dan Tempat Dilaksanakannya Penelitian ... 9
3.2 Bahan dan Alat Penelitian ... 9
3.3 Metode Penelitian ... 10
3.4 Deteksi PRSV Dengan Metode Double Antibody Sandwich-Enzim Linked Immunosorbent Assay (DAS-ELISA) ... 11
3.5 Deteksi PRSV dengan Teknik Reverse-Transcription Polymerase Chain Reaction (RT-PCR) ... 13
BAB IV HASIL DAN PEMBAHASAN ... 18
4.1 Kejadian Penyakit di Lapang ... 18
4.2 Deteksi PRSV Dengan Metode Double Antibody Sandwich-Enzim Linked Immunosorbent Assay (DAS-ELISA) ... 22
vi
4.3 Deteksi PRSV Dengan Metode Reverse-Transcription Polymerase Chain
Reaction ... 23
BAB V KESIMPULAN DAN SARAN ... 30
5.1 Kesimpulan ... 30
5.2 Saran ... 30 DAFTAR PUSTAKA
LAMPIRAN
vii
DAFTAR TABEL
No. Keterangan Halaman
1. Komposisi Bahan Reaksi Satu Langkah RT-PCR 15
2. Pasangan Primer yang Digunakan Untuk Amplifikasi DNA PRSV
16
3. Tingkat Kejadian Penyakit Bercak Bercincin Pada Tanaman Pepaya di Lokasi Survei
18
4. Hasil Deteksi PRSV Dengan Metode DAS-ELISA Pada Sampel Tanaman Pepaya
22
5. Tingkat Homologi Sekuen Nukleotida Coat Protein Gen PRSV HP 1 Daun D1, HP 2 Daun D3, SGL 1 Daun D8, SGL 2 Daun D10
26
viii
DAFTAR GAMBAR
No. Keterangan Halaman
1. Gejala Papaya ringspot virus Pada Tanaman Pepaya 5 2. Gejala Papaya ringspot virus di Desa Sei Beras
Sekata, Kecamatan Sunggal, Kabupaten Deli Serdang
19
3. Gejala Papaya ringspot virus di Desa Sialang Muda, Kecamatan Hamparan Perak, Kabupaten Deli Serdang
20
4. Hasil Amplifikasi DNA Menggunakan Pasangan Primer Spesifik PRSV-326 (5´-TCG TGC CAC TCA ATC ACA AT- 3´) dan PRSV-800 (5’-GTT ACT GAC ACT GCC GTC CA-3’) dengan panjang pita 475 bp
25
5. Pohon Filogenik Berdasarkan Sekuen Nukleotida Isolat Hamparan Perak dan Sunggal (Sumut), Subang (Jabar), Nganjuk (Jatim), Kulon Progo (DIY), Bali, Chiengmai (Thai), Thailand, Thaingunyen (VIE), Guangzhou (CHN)
27
ix
DAFTAR LAMPIRAN
No. Keterangan
1. Lokasi Pengambilan Sampel 2. Sampel Penelitian
3. Tabel Penelitian DAS ELISA 4.
5.
6.
Template DAS ELISA Homologi Antar Sequensing Hasil Sequensing
x
BAB I
1
PENDAHULUAN
1.1 Latar Belakang
Pepaya (Carica papaya L.) merupakan tanaman yang banyak tersebar diberbagai negara tropis termasuk Indonesia. Buah dari tanaman ini tergolong buah yang populer dan digemari oleh masyarakat Indonesia. Rasanya manis dan menyegarkan karena mengandung banyak air. Daging buah lunak dengan warna merah atau kuning. Di dalam satu buah pepaya terdapat biji pepaya yang berjumlah banyak dan berwarna kehitam-hitaman. Biji dilapisi kulit ari berwarna transparan yang sifatnya seperti agar (Kalie, 2008).
Banyak faktor yang menjadi pembatas dalam produksi pepaya, satu di antaranya adalah gangguan penyakit tanaman. Beberapa patogen penting yang menginfeksi tanaman pepaya ialah Papaya lethal yellowing virus, Papaya meleira virus, Papaya apical necrosis virus, Papaya ringspot virus, Phytophthora palmivora (penyebab busuk akar), Collectotrichum gloesporiodes (penyebab antraknose pada buah), Pythium sp.
(penyebab busuk pangkal batang), Oidium caricae (penyebab embun tepung pepaya), dan Botryodiplodia theobromae (penyebab kanker batang pepaya) (Da Silva et al., 2007).
Penyakit Papaya ringspot atau penyakit bercak cincin yang disebabkan oleh Papaya ringspot virus (PRSV) merupakan salah satu penyakit utama yang menjadi ancaman serius bagi industri pepaya komersial. Penyakit ini merupakan penyakit yang relatif baru pada tanaman pepaya di Indonesia dan banyak mengakibatkan kerugian secara ekonomi. Serangan penyakit ini menimbulkan kerugian bagi petani. Kehilangan hasil yang diakibatkan penyakit ini berkisar 40-90%, bahkan mampu mencapai 100%
2
tergantung pada waktu infeksi dan umur tanaman (Tennant et al., 2007).
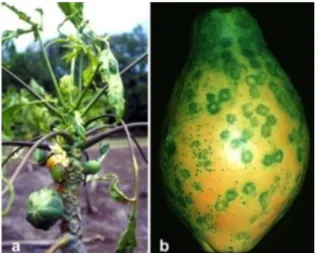
Tanaman pepaya yang terinfeksi PRSV menunjukkan gejala yang khas, yaitu mosaik menonjol pada daun, klorosis pada lamina daun, garis-garis seperti berminyak pada petiol, dan jika serangan parah daun akan berbentuk seperti tali sepatu (shoestrings). Pada kondisi infeksi yang sangat parah gejala muncul pada buah dan menyebabkan bercak hijau tua pada buah sehingga tanaman merana dan akhirnya mengalami mati pucuk dan gejala bercak bercincin gelap kecil pada permukaan buah (Tennant et al., 2007).
Hidayat et al. (2013) melaporkan ditemukannya PRSV di Provinsi Nanggroe Aceh Darussalam. Temuan ini merupakan laporan pertama PRSV di Indonesia. Awal 2012 di Provinsi Aceh, terdapat insidensi PRSV 100% di Desa Lambaro Teunom, Kecamatan Lembah Seulawah, Kabupaten Aceh Besar, dan Desa Meuse. Pemantauan PRSV dilakukan oleh Pusat Karantina Tumbuhan dan Keamanan Hayati Nabati, Badan Karantina Pertanian di Kabupaten Deli Serdang, Provinsi Sumatera Utara. Luas serangan PRSV di daerah pemantauan Kabupaten Deli Serdang mencapai 31 ha pertanaman dengan persentase serangan hampir 100% dengan hasil gejala PRSV pada pepaya dimana pada daun terjadi distorsi, mosaik, daun menjadi belang kekuningan dan terjadi pemucatan tulang daun pada daun muda (Badan Karantina Pertanian, 2013).
Harahap et al. (2020) melaporkan PRSV-P telah terdeteksi di Desa Hamparan Perak, Desa Tambak, Percut, Desa Patumbak Dua, Desa Lau Njuhar, Desa Lau Baleng, Desa: Sitinjo 1, Boang Manalu, Siempat Rube, dan Desa Kutadame dengan menggunakan metode Double Antibodi Sandwitch Enzyme Linked Immunosorbent Assay (DAS-ELISA).
Berdasarkan hasil survei pendahuluan pada pertanaman pepaya di wilayah
3
sekitar Kabupaten Deli Serdang, terdapat tanaman pepaya yang diduga terserang oleh virus penyebab penyakit. Berdasarkan hal ini maka perlu adanya identifikasi terhadap virus penyebab penyakit pada tanaman pepaya di Kabupaten Deli Serdang. Hal ini dilakukan sebagai langkah awal untuk menekan penyebaran virus yang berdampak buruk pada kondisi tanaman papaya dan merugikan petani.
1.2 Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kejadian penyakit bercak bercincin dan mendeteksi keberadaan PRSV sebagai penyebabnya di Desa Sei Beras Sekata, Kecamatan Sunggal dan Desa Sialang Muda, Kecamatan Hamparan Perak, Kabupaten Deli Serdang, Sumatera dengan Metode DAS-ELISAdan RT- PCR.
1.3 Hipotesis Penelitian
Kejadian penyakit bercak bercincin yang disebabkan PRSV di kedua lokasi tersebut berbeda.
1.4 Kegunaan Penelitian
Sebagai salah satu syarat untuk memperoleh gelar sarjana di Program Studi Agroteknologi Fakultas Pertanian Universitas Sumatera Utara, Medan dan sebagai bahan informasi bagi pihak yang membutuhkan.
BAB II
TINJAUAN PUSTAKA
2.1 Biologi Papaya Ringspot Virus
Papaya ringspot virus adalah anggota famili Potyviridae, genus Potyvirus yang diketahui memiliki daerah sebar geografi yang sangat luas. Penularan di lapangan terutama terjadi melalui kutu daun, Aphis craccivora, A. gossypii, dan Myzus persicae, secara nonpersisten (Kalleshwaraswamy et al., 2008).
Dilaporkan bahwa isolat-isolat PRSV dapat dibedakan menjadi dua tipe utama (galur), yaitu galur P dan W. Kedua galur tersebut dapat dibedakan berdasarkan pada kisaran inangnya karena PRSV-P dapat menginfeksi pepaya dan Cucurbitaceae, sedangkan PRSV-W tidak dapat menginfeksi pepaya dan hanya menginfeksi Cucurbitaceae (You et al., 2005).
Sekuen lengkap dan susunan genetik dari genom RNA isolat Hawai dan Taiwan telah dipelajari, berdasarkan dari sekuen nukleotida genom RNA, diduga bahwa strain PRSV-P mengalami proses evolusi yang berbeda berkaitan dengan perbedaan geografi (Yeh et al., 1992).
Virus PRSV ditularkan oleh kutu daun sebagai vektor secara nonpersisten dan tidak mengalami perbanyakan di dalam jaringan vektor. Siklus penularan dari tanaman sakit ke tanaman sehat melalui vektor kutu daun maksimal 15 menit setelah kutu daun memakan daun tanaman sakit kemudian memakan bagian tanaman sehat. Virus ini memiliki masa inkubasi dan virus ini tidak berkembang di dalam vektor sehingga proses penularan virus ini sangat cepat (Gonsalves et al., 2010).
2.2 Gejala Serangan Papaya Ringspot Virus Pada Tanaman Pepaya
Pada awal infeksi PRSV gejala yang muncul bercak berminyak pada batang
5
daun dan daun muda mengalami klorosis serta bercak-bercak transparan. Gejala infeksi PRSV pada tanaman pepaya muncul 2-3 minggu setelah inokulasi, gejala dapat tampak berbeda-beda disebabkan intensitas infeksi PRSV (Gonsalves et al., 2010).
Tanaman pepaya yang terinfeksi PRSV menunjukkan gejala yang khas, yaitu mosaik menonjol pada daun, klorosis pada lamina daun, dan garis-garis seperti berminyak pada tangkai daun. Tanaman yang terinfeksi parah menunjukkan adanya perubahan bentuk daun seperti tali (shoestrings) serta menyerupai kerusakan akibat serangan tungau. Tanaman yang terinfeksi ketika masih muda menjadi kerdil dan tidak akan menghasilkan buah. Buah dari tanaman terinfeksi PRSV menunjukkan benjolan mirip dengan buah pada tanaman yang kekurangan unsur hara Boron dan sering menunjukkan bercak cincin. PRSV isolat Taiwan memperlihatkan gejala nekrosis sistemik dan layu bersamaan dengan mosaik dan klorosis pada tanaman pepaya (Gonsalves et al., 2010).
Gambar 1. Gejala Papaya Ringspot Virus pada Tanaman Pepaya (Gonsalves et al., 2010).
Daun yang terinfeksi PRSV juga mengalami perubahan ketebalan menjadi lebih tipis. Respon tanaman terhadap infeksi PRSV berbeda, pada berapa varietas seperti varietas Honeydew menunjukkan gejala serangan antara 90-95% sedangkan varietas
6
Honolulu dan Gokarella sebesar 60-70% (Singh et al., 2011).
Infeksi PRSV akan mempengaruhi jumlah klorofil pada daun pepaya yang terinfeksi, jumlah klorofil menurun pada tanaman terinfeksi. Berkurangnya jumlah klorofil ini tampak dengan makin banyaknya rongga diirisan melintang daun.
Berkurangnya klorofil ini mengakibatkan terganggunya proses fotosintesis yang mengakibatkan terganggunya proses metabolisme sehingga menurunkan produktifitas pepaya (Singh et al., 2011).
Tanda yang tampak pada buah mengalami bentuk yang tidak sempurna dan munculnya ringspot. Pada akar tanaman yang terinfeksi oleh PRSV juga mengalami kerusakan dimana jumlah sel protoxylem berkurang dan sel mengalami lignifikasi (Singh et al., 2011).
2.3 Penularan Papaya Ringspot Virus
Virus ini memiliki 2 tipe yaitu tipe W (PRSV-W) yang hanya menginfeksi tanaman Cucurbits dan tipe P (PRSV-P) yang menginfeksi tanaman pepaya. Pada daerah subtropik dan tropik virus PRSV-P mengalami siklus secara lengkap pada tanaman pepaya, dimana virus PRSV-W mengalami siklus hidup lengkap pada tanaman Cucurbits (Gonsalves et al., 2010).
Virus ini dapat menular melalui biji, tetapi belum ada laporan terkonfirmasi bahwa PRSV ditularkan melalui biji pepaya. Beberapa faktor yang mempengaruhi kemampuan tular biji pada PRSV yaitu iklim, varietas tanaman pepaya dan jumlah dari biji. PRSV juga dapat menginfeksi tanaman pepaya bersamaan dengan infeksi virus lain seperti PapMV (Papaya Mozaic Virus) dan PaLCV (Papaya Leaf Curl Virus) (Usharani et al., 2013).
PRSV dapat ditularkan antar tanaman melalui kegiatan mekanis seperti
7
perompesan (pruning). Cairan perasan tanaman yang ditularkan ke bibit pepaya menunjukkan keberhasilan sebesar 80% karena dari 20 bibit terdapat 16 bibit yang bereaksi positif saat dilakukan deteksi menggunakan metode Indirect ELISA.
Penelitiannya menunjukkan bahwa gejala akan muncul 3 minggu setelah inokulasi (Kelaniyangoda et al., 2008).
2.4 Deteksi Virus Papaya Ringspot Virus
Deteksi virus penyebab penyakit pada tanaman, benih, atau bahan vegetatif sangat diperlukan dalam strategi pengendalian penyakit. Pengamatan gejala merupakan langkah awal dalam diagnosis penyebab penyakit oleh virus. Namun, pengamatan gejala saja tidak cukup akurat untuk menentukan virus penyebab suatu penyakit karena gejala yang diduga disebabkan oleh virus bisa saja disebabkan oleh patogen lain, toksisitas serangga, maupun pengaruh faktor abiotik misalnya kekurangan dan kelebihan unsur hara, stres lingkungan dan sebagainya (Agrios, 2005).
Diagnosis PRSV pada umumnya dapat dilakukan dengan pengamatan gejala dan tanda namun pengamatan gejala secara visual ini kurang valid. Gejala yang muncul pada tanaman terinfeksi oleh PRSV akan sama dengan efek yang timbul akibat kekurangan mikronutrien dalam tanah serta perubahan iklim. Langkah penting yang harus dilakukan sebelum melakukan pengendalian terhadap PRSV adalah identifikasi. Diagnosis terhadap PRSV penting karena terdapat 2 strain yang berbeda.
Enzim Linked Immunosorbent Assay (ELISA) banyak digunakan untuk deteksi cepat di berbagai belahan dunia sebagai teknik yang cepat dan dapat diandalkan untuk deteksi PRSV pada pepaya. Immuno-capture Reverse- Transcription Polymerase Chain Reaction (RT-PCR) merupakan teknik yang sangat handal untuk penentuan cepat virus dan dapat mendeteksi konsentrasi rendah PRSV pada pepaya, yang merupakan teknik
8
yang lebih sensitif dibandingkan ELISA dan RT-PCR (Sreenivasulu et al., 2010).
Reverse Transcription and Polymerase Chain Reaction (RT-PCR) menunjukkan hasil yang dapat diandalkan untuk mendeteksi PRSV dalam sampel pepaya. RT-PCR diidentifikasi sebagai metode diagnosis yang penting dan cepat bagi PRSV. Berdasarkan beberapa hal di atas, maka dapat disimpulkan bahwa keberadaan PRSV dapat dikonfirmasi dengan beberapa metode diagnosis molekuler seperti ELISA, Immuno-capture RT-PCR, dan RT-PCR. Pemilihan metode deteksi disesuaikan dengan kebutuhan (Ruiz et al., 1997).
9
BAB III
BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian
Survei dan pengambilan sampel dilakukan di 2 tempat berbeda yaitu Desa Sialang Muda, Kecamatan Hamparan Perak, Kabupaten Deli Serdang dengan ketinggian tempat 3-10 mdpl dan Desa Sei Beras Sekata, Kecamatan Sunggal, Kabupaten Deli Serdang dengan ketinggian tempat 7.5 mdpl. Deteksi penyakit dilaksanakan di Laboratorium Biomolekuluer Balai Karantina Pertanian Kelas II, Kualanamu Deli Serdang, Laboratorium Biomolekuler Balai Besar Karantina Pertanian Belawan, dan Laboratorium Genetika Molekuler Fakultas Pertanian USU dengan ketinggian tempat ±7 mdpl mulai bulan Januari 2021 sampai Oktober 2021.
3.2 Bahan dan Alat Penelitian
Bahan yang digunakan adalah daun, tangkai dan buah tanaman pepaya yang memiliki gejala PRSV (Papaya ringspot virus), akuades, alkohol, etanol, nitrogen cair, ELISA Kit dari Agdia kit, USA (yang meliputi antibodi PRSV, antigen kontrol positif dan negatif, coating buffer, PBST (phosphate buffer saline tween), GEB (general extract buffer), ECI (enzyme conjugated), konjugat, buffer PNP, PNP (P-nitro fenilfosfat) tablet), Dithiothreitol, geneJET plant RNA purification mini kit Thermo Scientific (yang meliputi Plant RNA Lysis Solution, WB1, WB2), air bebas RNAse, MyTaq™ One-Step RT-PCR kit, gel agaros, gel red nucleid acid gel stain, 1x TAE (Tris-Acetate EDTA), TrackIt™ 100 bp DNA Ladder (Invitrogen), primer spesifik PRSV326 (5’-TCGTGCCACTCAATCACAAT-3’) dan primer spesifik PRSV800 (5’- GTTACTGACACTGCCGTCCA-3’) (Mohammed et al., 2010).
Alat yang digunakan adalah plat mikrotiter, mikropipette, inkubator, Elisa
10
reader, uv transilluminator, mesin setrifugasi, vortex mixer, Thermal cycler, elektroforensis, waterbath, tabung mikro 1.5 ml, purification column, tabung koleksi 2 ml, ice box, mortar, pisau, alumunium foil, pulpen, buku data, dan kamera.
3.3 Metode Penelitian Pengambilan Sampel
Sampel tanaman dikumpulkan dari 2 lokasi perkebunan pepaya di Kabupaten Deli Serdang, yaitu Desa Sialang Muda, Kecamatan Hamparan Perak dan Desa Sei Beras Sekata, Kecamatan Sunggal, Kabupaten Deli Serdang. Sampel diambil dengan cara menggunakan teknik purposive random sampling. Sampel yang diambil adalah bagian tanaman (daun, tangkai, dan buah) yang menunjukkan gejala penyakit berupa mosaic, malformasi dan bercak cicin (ringspot).
Deskripsi gejala yang terdapat di lapangan dicatat dan didokumentasikan menggunakan kamera handphone untuk masing-masing sampel. Selanjutnya sampel diberi label sebagai penanda, dan sampel yang didapatkan dimasukkan ke dalam ice box agar kondisi sampel tetap segar.
Penanganan Sampel di Laboratorium
Sampel yang didapat dari lapangan langsung dibawa ke laboratorium, dibersihkan dan dipotong kecil-kecil lalu ditimbang sebanyak 0.1 g, lalu dibungkus dengan alumunium foil dan disimpan di freezer pada suhu -20 0C atau langsung dapat digunakan untuk bahan RT-PCR dan DAS-ELISA.
Penghitungan Kejadian Penyakit di Lapangan
Pengamatan tanaman di lapangan dilakukan secara visual yaitu dengan mengamati gejala pada bagian daun, tangkai, dan buah tanaman papaya. Pengamatan
11
kejadian penyakit di lapangan dilakukan terhadap setiap pohon yang ditemui pada masing-masing kebun pepaya.
Penghitungan kejadian penyakit dilapangan mengikuti rumus sebagai berikut :
Dimana:
KjP = a
b × 100%
KjP = Kejadian penyakit
a = Jumlah tanaman yang terserang penyakit
b = Jumlah tanaman yang diamati (Windriyanti, 2015).
3.4 Deteksi PRSV dengan Metode Double Antibody Sandwich-Enzim Linked Immunosorbent Assay (DAS-ELISA)
DAS-ELISA dilakukan sebagai uji konfirmasi terhadap keberadaan PRSV pada bagian tanaman yang dijadikan sampel, sampel merupakan daun, tangkai, dan buah dari 5 tanaman pepaya. Deteksi serologi dengan teknik langsung DAS- ELISA dilakukan menggunakan Agdia kit (NA, USA) dan prosedur dari Harahap (2021).
Pertama kali disiapkan mikroplate dengan peta sumuran/lubang mikroplate masing-masing di isi dengan 100 ul antibody PRSV yang telahdilarutkan dengn coating buffer dengan perbandingan 1 : 100. Mikroplate kemudian ditutup dengan aluminium foil dan diberi alas kertas towel basah dan disimpan didalam plastik kemudian diinkubasikan pada medicool pada suhu 4ºC selama 1 malam.
Bahan tanaman yang diuji adalah 5 tanaman pepaya per lokasi penelitian yang menunjukkan gejala penyakit yang diduga PRSV. Tiap satu tanaman pepaya, bahan sampel diambil dari daun dan biji. Sap dibuat dari sampel tanaman pepaya (daun dan biji) yang telah digerus menggunakan General ekstrak buffer (GEB) dengan perbandingan 1 : 10 (berat basah/volume) yaitu 1 gram sampel ditambahkan dengan 10
12
GEB, digerus dengan mortal dan pistil, dimasukkan ke dalam effendorf ukuran 2 ml, kemudian dicentrifuge dengan kecepatan 5000 rpm selama 5 menit. Sebelum sap sampel digunakan, sap sampel disimpan dalam medicool dengan suhu 4ºC. Siapkan pula kontrol positif dan kontrol negatif.
Selanjutnya mikroplate dikosongkan, dicuci dengan PBST sebanyak 2 kali, kemudian mikroplate dikeringkan dengan cara dibalik dan ditepuk-tepukkan pada permukaan yang telah dialasi kertas towel. 100 µl sap sampel tanaman pepaya yang telah disiapkan dimasukkan ke dalam setiap lubang mikroplate, kemudian dimasukkan kontrol positif dan kontrol negatif masing-masing sebanyak100 µl, kemudian di simpan di dalam plastik yang telah diberi alas kertas basah, dan kemudian diinkubasikan pada suhu ruang selama 2 jam. Enzim konjugat/ECI disiapkan 10 menit sebelum waktu inkubasi berakhir (enzim konjugat PRSV-P yang telah dilarutkan dengan konjugat buffer dengan perbandingan 1 : 100). Selanjutnya mikroplate dicuci sebanyak 7 kali dengan PBST. Enzim konjugat yang telah disiapkan dimasukkan kedalam lubang mikroplate sebanyak 100 ul. Tutup plate dengan kertas towel lembap dan diinkubasikan pada suhu ruang selama 2 jam. Selanjutnya mikroplate di cuci sebanyak 8 kali dengan PBST. 100 µl buffer PNP (0,5 gr PNP ditambah 5 ml buffer PNP) dimasukkan ke
dalam lubang mikroplate dan diinkubasi pada kotak
gelap pada suhu ruang selama 60 menit. Pengamatan secara visual dilakukan dengan melihat perubahan warna cairan di dalam lubang mikroplate. Perubahan warna menjadi kuning menandakan terjadinya reaksi positif. Hasil pengamatan dicatat. Analisis kuantitaf dilakukan dengan spektrofotometer ELISA Reader dengan panjang gelombang 405 nm, hasil dikatakan positif apabila nilai sampel lebih dari 2 kali rata-rata nilai kontrol negatif.
13
3.5 Deteksi PRSV dengan Teknik Reverse-Transcription Polymerase Chain Reaction (RT-PCR)
Metode deteksi dengan RT-PCR terdiri dari tahapan: ekstraksi RNA total dengan menggunakan prosedur dan kit dari geneJET plant RNA purification mini kit, Thermo Scientific, amplifikasi DNA target dengan menggunakan prosedur dan kit dari MyTaq™ One-Step RT-PCR Kit Meridian Bioscience Inc (NA, USA), dan visualisasi hasil amplifikasi.
Ekstraksi RNA total. Metode ekstraksi RNA dilakukan secara manual atau menggunakan kit ekstraksi. Ekstraksi RNA dilakukan dengan menggunakan kit dan prosedur geneJET Plant RNA Purification Mini Kit (Thermo Scientific) sesuai metode Mahmuddin (2010).
Sebanyak 0.1 g sampel tanaman bergejala PRSV (daun, batang, dan kulit buah) digerus menggunakan nitrogen cair dan masukkan sampel kedalam tabung micro 2 ml, lalu tambahkan 500 µl Plant RNA Lysis Solution yang telah ditambahkan 10 µl Dithiothreitol 2M ke dalam tabung dan divortex selama 20 detik, lalu diinkubasi pada suhu 56oC selama 3 menit, dan disentrifugasi pada kecepatan 14000 rpm selama 5 menit.
Selanjutnya supernatan dituang ke dalam tabung mikro steril 1.5 ml, ditambahkan 250 µl etanol 96-100% ke dalam larutan dan dicampur dengan menggunakan mikropipette, setelah itu dituang ke dalam purification column yang telah dimasukkan ke dalam tabung koleksi 2 ml, lalu disentrifugasi selama 1 menit pada kecepatan 11.000 rpm. Larutan dibuang dan diletakkan kembali ke dalam tabung koleksi 2 ml. Ditambahkan 700 µl buffer WB1 ke dalam purification column dan disentrifugasi selama 1 menit pada kecepatan 11.000 rpm, lalu larutan dibuang dan diletakkan ke
14
dalam tabung koleksi 2 ml yang baru. Setelah itu ditambahkan 500 µl WB2 ke dalam purification column dan disentrifugasi selama 1 menit dengan kecepatan 11.000 rpm buang larutan dan letakkan kembali ke dalam tabung koleksi 2 ml.
Selanjutnya 500 µl WB2 ditambahkan ke dalam purification column dan disentrifugasi selama 1 menit pada kecepatan maksimum 14.000 rpm, buang larutan dan letakkan kembali ke dalam tabung koleksi 2 ml lalu tempatkan purification column ke dalam tabung mikro 1.5 ml baru. Setelah itu tambahkan 50 µl air bebas RNAse ke tengah purification column, dan didiamkan selama minimal 2 menit agar air bebas RNAse benar benar terserap lalu disentrifugasi selamat 1 menit pada kecepatan 11.000 rpm untuk elusi. RNA total yang diperoleh dan terdapat dalam tabung disimpan di ruang penyimpanan pada suhu -20oC sampai digunakan. RNA total yang dihasilkan digunakan untuk template dalam pengujian RT-PCR.
15
Amplifikasi cDNA. PCR digunakan untuk melipat gandakan satu molekul DNA atau memperbanyak daerah spesifik DNA target. Bahan dan komposisi yang digunakan dapat dilihat pada Tabel 1.
Tabel 1. Komposisi Bahan Reaksi Satu Langkah RT-PCR
Komponen Volume (µl)
2x MyTaq One-Step Mix 25
Forward Primer (10 μM) 2
Reverse Primer (10 μM) 2
Reverse transcriptase 0.5
RiboSafe RNase Inhibitor 1
DEPC-H2O 14.5
Total volume 50
Master Mix yang digunakan adalah MyTaq™ One-Step RT-PCR Kit Meridian Bioscience Inc (NA, USA) dengan volume akhir reaksi 50 µl. Setelah proses pencampuran selesai tabung PCR dimasukkan ke dalam mesin Thermal cycler setelah suhu mencapai 50˚C lalu dilakukan RT-PCR.
Pasangan Primer yang digunakan adalah primer spesifik dengan target selubung PRSV yaitu PRSV 326 (5’- TCGTGCCACTCAATCACAAT-3’) sebagai primer A dan PRSV 800 (5’-GTTACTGACACTGCCGTCCA-3’) sebagai primer B, dengan target DNA berukuran ±475 pb (Tabel 2) (Harahap, 2021). Program amplifikasi cDNA ini mengacu pada metode Mohammed et al. (2012).
16 Tabel 2. Pasangan Primer yang Digunakan Untuk Amplifikasi DNA PRSV
Pasangan Primer
Target DNA Urutan Basa (5’-3’)
Ukuran Target DNA
Sumber Rujukan
PRSV 326
(5´-TCGTGCCACT CAATC ACAAT-3´) Protein
Selubung PRSV
±475 pb (Mohammed et al., 2012).
PRSV 800 (5´-GTTACTGACA
CTGCCGTCCA-3´)
Amplifikasi cDNA dimulai dengan tahapan transkripsi terbalik RNA pada suhu 45ºC selama 20 menit sebanyak 1 siklus, predenaturasi pada suhu 95ºC selama 1 menit sebanyak 1 siklus. Tahapan selanjutnya sebanyak 40 siklus yang terdiri atas denaturasi pada 95ºC selama 10 detik, penempelan pada 60ºC selama 10 detik, ekstensi pada 72ºC selama 30 detik.
Visualisasi DNA. DNA hasil amplifikasi dianalisis pada gel agarosa 1.5% yang dilarutkan dalam bufer 1x TAE (Tris-Acetate EDTA). Elektroforesis dilakukan dengan tegangan 75 volt selama 45 menit, selanjutnya direndam dalam larutan gel red nucleid acid gel stain selama 15 menit. Visualisasi DNA dilakukan di bawah UV transluminator dan didokumentasikan dengan kamera. Sampel dikatakan positif, saat muncul pita DNA.
Analisis Sekuen Nukleotida. DNA hasil amplifikasi dirunut di apical Scientific Laboratory (Malaysia). Hasil perunutan DNA dibandingkan dengan susunan nukleotida PRSV dari negara lain yang terdaftar di GenBank®, kemudian dianalisis menggunakan program Basic Local Alignment Search Tool (BLAST) pada website National Center for Biotechnology Information (www.ncbi.nlm.nih.gov). Tingkat homologi nukleotida dihitung menggunakan program Clustal W-Multiple Sequence Alignment setelah dilakukan pengeditan terhadap susunan nukleotida menggunakan perangkat lunak
17
BioEdit 7.05. Hasil tingkat homologi digunakan untuk membuat pohon filogenik dengan menggunakan perangkat lunak MEGA 6 (Tamura et al., 2013).
30
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Penyakit bercak bercincin telah dideteksi pada semua sampel tanaman. Terdapat beberapa tipe gejala penyakit bercak bercincin yang ditemukan di lapang, yaitu:
1. Pada daun : shoestring, belang, dan mosaik hijau tua, 2. Pada tangkai dan batang pepaya : streak dan garis berwarna hijau tua, 3. Pada buah pepaya: gejala ringspot berwarna hijau tua.
2. Deteksi PRSV dengan metode RT-PCR memberikan hasil yang lebih sensitif dan akurat dibandingkan dengan metode DAS-ELISA.
3. Hasil analisis filogenetik didapat 3 kelompok PRSV, masing-masing sampel yang berasal dari Hamparan Perak 1 (HP1), Hamparan Perak 2 (HP2), dan Sunggal 1 (SGL1) masuk dalam kelompok satu, dan berada dalam satu kelompok dengan isolat asal Subang (Jabar), Nganjuk (Jatim), Kulon Progo (DIY), Bali, Chiengmai (THAI), dan Thailand sedangkan sampel dari Sunggal 2 (SGL2) masuk dalam kelompok 3.
5.2 Saran
Untuk peneliti selanjutnya diharapkan dapat mendeteksi PRSV pada bagian tanaman lainnya, seperti biji dan akar tanaman dengan menggunakan RT-PCR untuk mendapatkan informasi sebaran PRSV pada tanaman pepaya.
31
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Fifth Edition. United States of America (US):Elsevier Academic Press.
Balai Karantina Pertanian. 2013. Penyakit Papaya Ringspot Virus pada Pepaya.
http://ditlin.hortikultura.pertanian.go.id/index.php/artikel/detail/Penyakit Papaya- Ringspot-Virus-PRSV-pada-Pepaya. Diakses 30 Januari 2021.
Da Silva JA T., Roshid Z., Nhut DT., Sivakumar D., Gera A., Souza MT Jr., Tennat PF.
2007. Papaya (Carica papaya L.) Biology and Biotechnology. Tree and Forestry Science and Biotechnology.
Damayanti TA., Muliarti E, Sartiami D. 2010. Efisiensi penularan virus mosaik bengkuang dengan Aphis craccivora Koch dan A. Gossypii Glover.
AGROVIGOR: 3(2): 101-109. Doi: 10.21107/agrovigor.v3i2.262.
Dijkstra J, de Jager CP. 1998. Practical Plant Virology : Protocols and Exercises.
Springer Lab. Manual. New York.
Frenkel MJ., Ward CW., Shukla DD. 1989. The use of 3’ noncoding nucleotide sequences in taxonomy of Potyvirus: Aplication to Watermelon mosaic virus 2 and Soybean mosaic virus-N. J. Gen. Virol. 70:2775– 2783.
Gonsalves D., Tripathi S., Carr JB., Suzuki JY. 2010. Papaya ringspot virus. The Plant Instructor. 149 (12): 2435-2442. DOI: 10.1094/PHI-I-2010-1004-
01.
Harahap, LH. 2021. Studi Biologi dan Penyebaran Papaya ringspot virus P (PRSV-P) di Sumatera Utara. Sekolah Pasca Sarjana. Universitas Sumatera Utara.
Harmiyati T., Hidayat SH., Adnan AM. 2015. Deteksi dan Respons Lima VarietasPepaya Terhadap Tiga Isolat Papaya ringspot virus (PRSV). J Agr Biogen. 11(3):87–94.
Hartati LH., Darma B., Lisnawita. 2020. Detection of Virus Causes Papaya Ringspot Virus - With The DAS-Elisa (Double Antibody Sandwich- Enzyme-Linked Immunosorbent Assay) Method At Different Levels In North Sumatra. IOP Conf. Ser: Earth Environt. Sci. 454 012182. DOI:10.1088/1755- 1315/454/1/012182
Hidayat SH., Sari N., Suryo W. 2013. Infeksi Papaya Ringspot Virus Pada Tanaman Pepaya di Provinsi Nanggroe Aceh Darussalam. Volume 8 Nomor 6, Desember 2012 Halaman 184-187. Jurnal Fitopatologi Indonesia ISSN: 0215-7950.
Kalie BM. 2008. Bertanam Pepaya. Jakarta: Penebar Swadaya. Kalleshwaraswamy CM., Kumar NKK. 2008. Transmission Efficiency of Papaya Ringspot Virus By Three Aphid Species. Phytopathology. 98(5):541- 546. DOI: 10.1094/PHYTO-98-5- 0541.
32
Kelaniyangoda DB., Madhubashini LWM. 2008. Indicator Plants: Tools for Detecting Papaya ring spot potyvirus and Cucumber mosaic cucumovirus. Journal of Food and Agriculture. 1(2):64-69. DOI: 10.4038/jfa.v1i2.1800.
Mohammed H., Manglli A., Zicca S., El Hussein A., Mohamed M., Tomassoli L. 2012.
First report of Papaya ringspot virus in pumpkin in Sudan. New Dis. Rep. 26:26.
DOI: 10.5197/j.2044-0588.2012.026.026.
Irsan N., Mutaqin KH., Hidayat SH. 2018. Penggunaan Pelacak DNA untuk Deteksi Papaya ringspot virus dengan Metode Hibridisasi Asam Nukleat. Jurnal Fitopatologi Indonesia. 14:89–96. DOI: 10.14692/jfi.14.3.89.
Purcifull DE, Edwardson J., Hiebert E., Gonsalves D. 1984. Papaya ringspot virus.
CMI/AAB Description of Plant Viruses, No. 292.
Naidu RA., Hughes JA. 1997. Methods for the detection of plant virus diseases, International Institude of Tropical Agriculture. Oyo Road, Ibadan, Nigeria.
Rahaman, H. 2003. Variability of Papaya ringspot virus-papaya strain (PRSV-P) infecting papaya in Bangladesh. Ph. D. Thesis Dissertation, BSMRAU. P: 33-36.
Ruiz CS., Silva RL. 1997. Use of RT-PCR for Papaya ringspot virusdetection in Papaya (Carica papaya) plants from Veracruz, Tabasco and Chiapas. Revista Mexicana de Fitopatologia. 15(2):86-90.
Salem N., Mansour A., Al-Musa A., Al-Nsour A. 2003. Seasonal variation of Prunus necrotic ringspot virus concentration in almond, peach, and plum cultivars.
Phytopathol Mediterr. 42:155-160.
Semangun, H. 2008. Penyakit-penyakit tanaman pangan di Indonesia. Edisi Kedua. Gadjah Mada University Press. Yogyakarta. 475 p.
Singh S., Singh R., Awasthi L. 2011. Induction of systemic resistance through antiviral agents of plant origin against papaya ring spot disease (Carica papaya L.).
Archive of Phytopathology and Plant Protection. 44(17):1676-1682.
Sreenivasulu M., Gopal D. 2010. Development of recombinant coat protein antibody based IC-RT-PCR and comparison of its sensitivity with other immunoassays for the detection of Papaya ringspot virus isolates from India. Plant Pathology Journal. 26(1):25-31.
Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. 2013. MEGA6: Molecular Evolutionery Genetics Analysis Version 6.0. Mol Biol Evol 30(12):2725–2729.
DOI:10.1093/molbev/mst197.
Tennant PF., Silva JA., Rashid Z., Nhut DT., Sivakumar D., Gera A., Souza Jr MT. 2007.
Papaya (Carica papaya L.) Biology and Biotechnology. Tree for. Sci. Biotech, 1(1), pp. 47-73.
33
Usharani TR., Laxmi V., Jalali S., Krishnareddy M. 2013. Duplex PCR to Detect Both PRSV And Papaya Leaf Curl Virussimultaneously From Naturally Infected Papaya (Carica papaya L.). Indian Journal of Biotechnology. Vol 12: 269-272.
Walkey DGA. 1991. Applied Plant Virology. Second Edition. London: Chapman and Hall. ISBN 94-011-3090-6.
Windriyati REH. 2015. Seleksi Cendawan Endofit untuk Pengendalian Penyakit Layu Bakteri (Ralstonia solanacearum) pada Tanaman Cabai. Tesis. Institut Pertanian Bogor, Bogor.
Yeh SD., Jan FJ., Chiang CH., Doong PJ., Chen MC., Chung PH., Bau HJ. 1992.
Complete nucleotide sequence and genetic organization of papaya ringspot virus RNA. Journal of General Virology.73:2531- 2541. DOI: 10.1099/0022-1317- 73- 10-2531.
You BJ., Chiang CH., Chen LF., Su WC., Yeh SD. 2005. Engineered Mild Strains Of Papaya Ringspot Virus For Broader Cross Protection In Cucurbits.