INDUSTRI AGAR-AGAR DAN TEPUNG IKAN
KHOIRUNNISA LISTIANI
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2020 M / 1441 H
POTENSI Pseudomonas fluorescens SEBAGAI AGEN PUPUK HAYATI BERBASIS LIMBAH PADAT
INDUSTRI AGAR-AGAR DAN TEPUNG IKAN
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
KHOIRUNNISA LISTIANI 11140950000038
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2020 M / 1441 H
iv ABSTRAK
Khoirunnisa Listiani. Potensi Pseudomonas fluorescens sebagai Agen Pupuk Hayati Berbasis Limbah Padat Industri Agar-Agar dan Tepung Ikan.
Skripsi. Program Studi Biologi. Fakultas Sains dan Teknologi. Universitas Islam Negeri Syarif Hidayatullah Jakarta. 2020. Dibimbing oleh Jamal Basmal dan Nani Radiastuti.
Pseudomonas fluorescens merupakan agen potensial pada pupuk hayati.
Pengolahan rumput laut menjadi agar-agar dalam skala industri menghasilkan limbah padat yang melimpah. Tepung ikan dihasilkan dari berbagai ikan yang kurang ekonomis. Keduanya dapat dimanfatkan sebagai substrat bagi P.
fluorescens. Tujuan penelitian ini adalah menganalisis potensi P. fluorescens sebagai agen pupuk hayati berbasis limbah industri agar (LIA) dan tepung ikan (TI). Analisis potensi P. fluorescens dilakukan dengan pengamatan zona bening dan perubahan warna. Analisis konsentrasi LIA, TI dan waktu inkubasi optimum bagi P. fluorescens dilakukan secara eksperimental. Analisis potensi P.
fluorescens menunjukkan hasil positif memiliki kemampuan mendegradasi selulosa, pelarut P dan K, serta penghasil auksin. Analisis konsentrasi LIA, TI dan waktu inkubasi optimum bagi P. fluorescens menunjukkan bahwa bakteri ini mampu tumbuh dengan baik pada pH 5. Konsentrasi LIA,TI, dan waktu inkubasi optimum bagi pertumbuhan P.fluorescens adalah 3% dan 0.3% pada hari ke-3 (media L3T3), dengan kepadatan populasi [10,820 log10] CFU /mL dan aktivitas selulase 1,45 U /mL. Konsentrasi LIA,TI, dan waktu inkubasi optimum produksi auksin oleh P.fluorescens adalah 2% dan 0.1% (media L2T1) pada hari ke-3, dengan konsentrasi auksin 4,60 ppm. Hasil analisis menunjukkan bahwa P.
fluorescens berpotensi sebagai agen pupuk hayati berbasis LIA dan TI dengan konsentrasi optimum pada L3T3 hari ke-3.
Kata kunci: LIA; Pseudomonas fluorescens; pupuk hayati; tepung ikan
v
Agent Based of Solid Waste of Agar Processing Industry and Fish Powder.
Undergraduete Thesis. Departement of Biology. Faculty of Science and Technology. State Islamic University Syarif Hidayatullah Jakarta. 2020.
Advised by Jamal Basmal and Nani Radiastuti.
Pseudomonas fluorescens is potencial agent for biofertilizer. Seaweed processing into agar on industrial scale produced abundant amount of solid waste. Fish powder is produced by fish that has less economic value. Both of them could beneficial as substrate for P. fluorescens. The aim of this research was to analyze potency of P. fluorescens as biofertilizer agent based on solid waste of agar (LIA) and fish powder (TI). Potention analysis of P. fluorescens was done by halozone and colour changes observation. Optimum concentration of LIA, TI, and incubation time was analyzed experimentally. Potention analysis of P. fluorescens showed positive result at cellulose degradation, P and K solubilization, and auxin production. Optimum concentration of LIA, TI, and incubation time analysis of P. fluorescens growth showed that this microorganism could grow well at pH 5.
Optimum concentration of LIA, TI, and incubation time analysis of P.
fluorescens growth is 3% and 0.3% at day 3 (L3T3 medium), with population density [10,820 log10] CFU /mL and cellulase activity 1,45 U /mL. Optimum concentration of LIA, TI, and incubation time analysis of auxin production by P.
fluorescens is 2% and 0.1% at day 3 (L2T1 media), with auxin concentration 4,60 ppm. Analysis result showed that P. fluorescens is potencial as biofertilizer agent based on LIA and TI as optimum concentration L3T3 day 3.
Keywords: biofertilizer; fish powder; LIA; Pseudomonas fluorescens
vi
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT berkat rahmat, hidayah dan karunia-Nya yang dicurahkan tiada hentinya dalam setiap doa dan harapan yang dipanjatkan. Sholawat serta salam penulis panjatkan kepada Rasulullah SAW sehingga penulis dapat menyelesaikan skripsi dengan judul
―Potensi Pseudomonas fluorescens sebagai Agen Pupuk Hayati Berbasis Limbah Padat Industri Agar-Agar dan Tepung Ikan‖.
Penulis menyampaikan rasa terimakasih kepada semua pihak atas segala bimbingan dan bantuan yang telah diberikan selama penyusunan skripsi ini, antara lain kepada:
1. Prof. Dr. Lily Surayya Eka Putri, M.Env.Stud selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta beserta jajarannya.
2. Dr. Priyanti, M.Si selaku ketua program studi Biologi, Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta beserta jajarannya.
3. Ir. Jamal Basmal, M.Sc, dan Dr. Nani Radiastuti, M.Si selaku pembimbing I dan pembimbing II yang telah membimbing penulis dalam bekerja di laboratorium dan penyusunan skripsi.
4. Dr. Dasumiati, M.Si dan Dr. Megga Ratnasari Pikoli, M.Si selaku penguji I dan penguji II seminar yang telah memberikan kritik dan saran dalam proses penyusunan skripsi.
5. Dr. Priyanti, M.Si dan Narti Fitriana, M.Si selaku penguji I dan penguji II sidang munaqosyah yang telah memberikan kritik dan saran dalam proses penyempurnaan skripsi.
6. Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan Perikanan (BBRP2BKP), yang telah memberikan kesempatan dan dukungan materi selama pelaksanaan penelitian.
7. Seluruh dosen Program Studi Biologi, Fakultas Sains dan Teknologi atas ilmu dan bimbingan yang diberikan dengan baik selama proses perkuliahan kepada penulis.
8. Nurrahmi Dewi Fajarningsih, S.Si, M. Biotech, Yusma Yennie, S.Pi, M.Si, dan Rinta Kusumawati, S.Si, MT, selaku kepala Laboratorium Bioteknologi,
vii penelitian.
9. Dr. Ifah Munifah, M.Si, Gintung Patantis, S. Kel, Rizki, Benget, Tomi, Maya, Wahyu, Anggi, Helena Malik, A.Md, Ukis Shofahudin, A,Md, Sujarwo dan Hana selaku pembimbing lapangan serta staff laboratorium BBRP2BKP yang telah membimbing dan membantu penulis selama pelaksanaan penelitian.
10. Seluruh pihak yang berperan secara langsung maupun tidak langsung, atas dukungan dan motivasi yang telah diberikan kepada penulis, yang tidak dapat disebutkan satu persatu.
Semoga skripsi ini dapat dapat bermanfaat bagi pembaca dan dapat memiliki kontribusi terhadap ilmu pengetahuan.
Jakarta, Januari 2020
Penulis
viii
DAFTAR ISI
Halaman
KATA PENGANTAR ... vi
DAFTAR ISI ... viii
DAFTAR TABEL ... x
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN ... ii
1.1 Latar Belakang ... ii
1.2 Rumusan Masalah ... iv
1.3 Tujuan Penelitian ... iv
1.4 Manfaat Penelitian ... iv
1.5 Kerangka Berpikir Penelitian ... v
BAB II TINJAUAN PUSTAKA ... 5
2.1 Pseudomonas fluorescens ... 5
2.2 Limbah Padat Industri Pengolahan Agar-Agar ... 8
2.3 Tepung Ikan ... 9
2.4 Pupuk Hayati (Biofertilizer) ... 10
2.5 Persyaratan Teknis Minimal Pupuk Hayati ... 14
BAB III METODE PENELITIAN ... 15
3.1 Waktu dan Tempat ... 15
3.2 Alat dan Bahan ... 15
3.3 Rancangan Penelitian ... 15
3.4 Cara Kerja ... 16
3.5 Analisis Data ... 21
BAB IV HASIL DAN PEMBAHASAN ... 26
4.1 Kemampuan Selulolitik Pseudomonas fluorescens ... 26
4.2 Kemampuan Pelarut Fosfat (P) Pseudomonas fluorescens ... 27
4.3 Kemampuan Pelarut Kalium (K) Pseudomonas fluorescens ... 28
4.4 Kemampuan Produksi Auksin Pseudomonas fluorescens ... 29
4.5 Pertumbuhan dan Aktivitas Pseudomonas fluorescens sebagai Agen Pupuk Hayati ... 30
BAB V PENUTUP ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
LAMPIRAN ... 58
ix
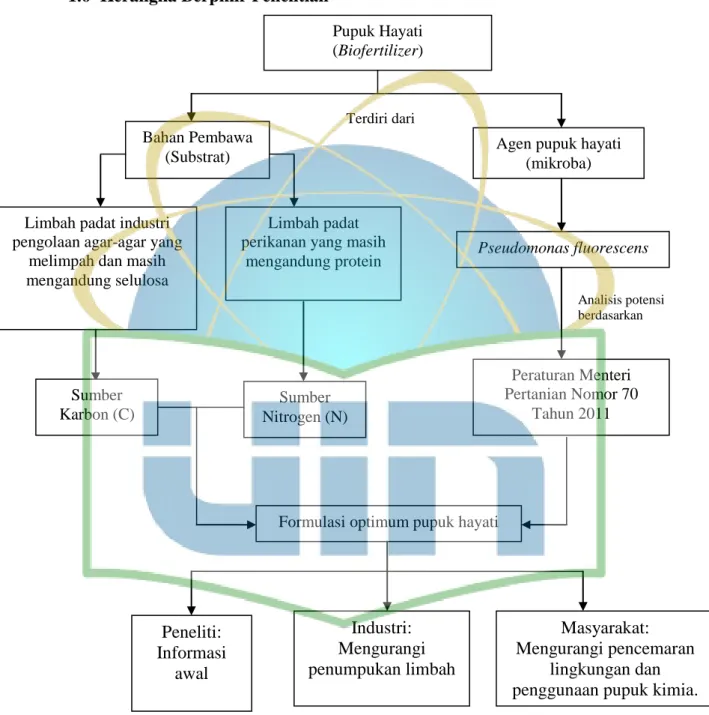
Gambar 1. Kerangka Berpikir ... v
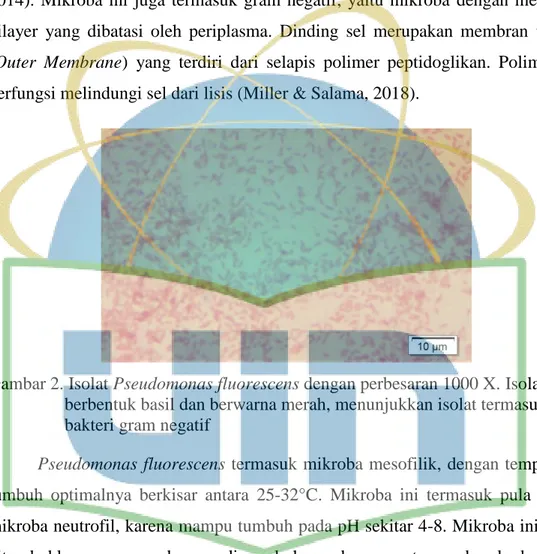
Gambar 2. Isolat Pseudomonas fluorescens dengan perbesaran 1000 X ... 5
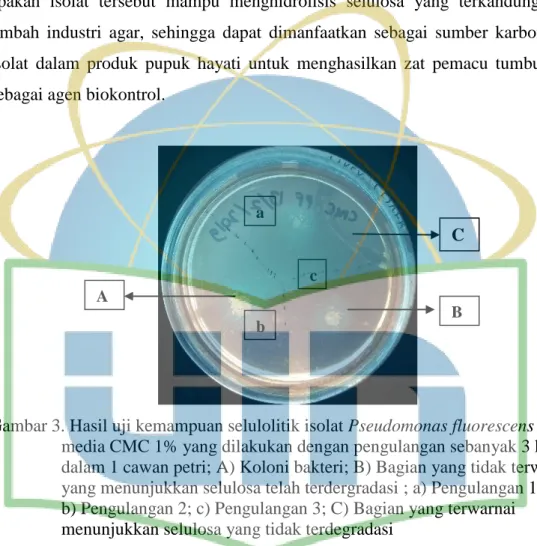
Gambar 3. Hasil uji kemampuan selulolitik isolat Pseudomonas fluorescens pada media CMC 1% ... 26
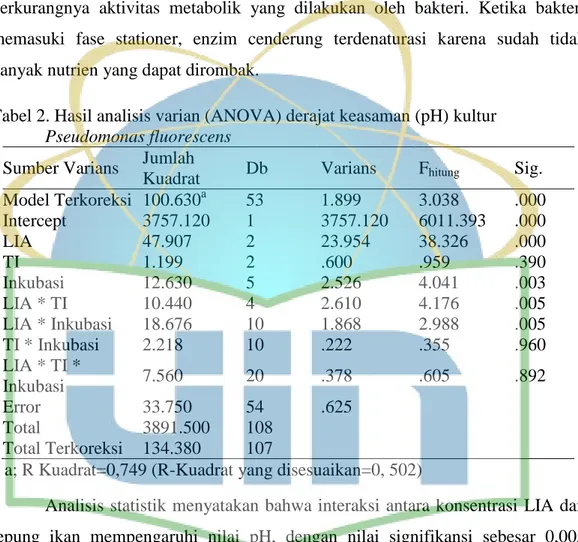
Gambar 4. Hasil uji aktivitas pelarutan P isolat Pseudomonas fluorescens pada media Pikovskaya ... 27
Gambar 5. Hasil uji aktivitas pelarutan kalium isolat Pseudomonas fluorescens pada media Aleksandrov ... 28
Gambar 6. Hasil uji kualitatif produksi auksin isolat Pseudomonas fluorescens .... 29
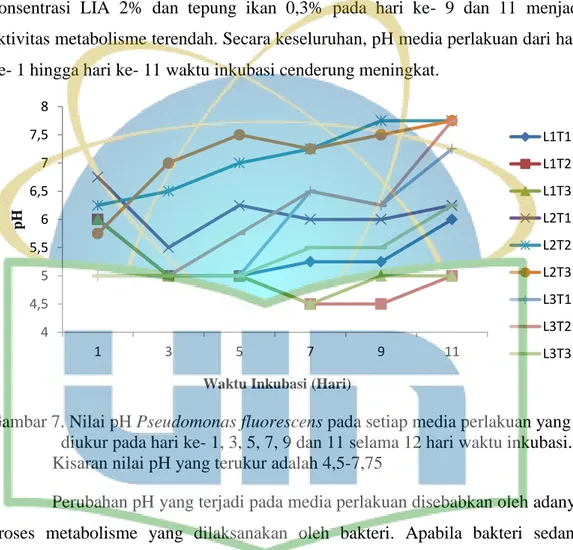
Gambar 7. Nilai pH ... 33
Gambar 8. Kepadatan populasi ... 36
Gambar 9. Aktivitas selulase ... 40
Gambar 10. Produksi auksin ... 44
x
DAFTAR TABEL
Halaman
Tabel 1. Persyaratan Teknis Minimal Pupuk Hayati Tunggal ...14
Tabel 2. Hasil analisis varian (ANOVA) derajat keasaman (pH) ...31
Tabel 3. Hasil analisis varians (ANOVA) kepadatan populasi ... 35
Tabel 4. Hasil analisis varians (ANOVA) aktivitas selulase ... 38
Tabel 5. Hasil analisis varians (ANOVA) produksi auksin ... 42
xi
Lampiran 1. Rancangan Percobaan ... 58
Lampiran 2. Diagram Alur Penelitian ... 59
Lampiran 3. Dokumentasi Penelitian ... 60
Lampiran 4. Metode Pembuatan Media Uji ... 62
Lampiran 5. Metode Pembuatan Reagen Uji ... 63
Lampiran 6. Kurva Standar Glukosa ... 64
Lampiran 7. Kurva Standar Auksin ... 64
Lampiran 8. Analisis Kemampuan Isolat Pseudomonas fluorescens ... 65
Lampiran 9. Hasil Analisis Statistik Derajat Keasaman (pH) kultur Pseudomonas fluorescens ... 66
Lampiran 10. Hasil Analisis Statistik Kepadatan Populasi Pseudomonas fluorescens ... 71
Lampiran 11. Hasil Analisis Statistik Aktivitas Selulase Pseudomonas fluorescens ... 74
Lampiran 12. Hasil Analisis Statistik Produksi Auksin Pseudomonas fluorescens ... 79
BAB I PENDAHULUAN
1.1 Latar Belakang
Pupuk hayati adalah produk biologi aktif yang terdiri atas mikroba yang dapat meningkatkan efisiensi pemupukan, kesuburan, dan kesehatan tanah.
Formula pupuk hayati adalah komposisi mikroba/mikrofauna dan bahan pembawa penyusun pupuk hayati (Permentan, 2011). Pupuk hayati sering disebut sebagai pupuk mikroba. Mikroba memiliki peran yang penting dalam meningkatkan produktivitas tanaman dan menyuburkan tanah, yaitu dengan menstimulasi pertumbuhan dan melindungi tanaman dari patogen (Jumadi et al., 2015).
Salah satu mikroba potensial untuk pembuatan pupuk hayati adalah Pseudomonas fluorescens. Mikroba ini termasuk ke dalam bakteri endofitik.
Mikroba ini menunjukkan kemampuan yang baik dalam membentuk koloni pada tanaman dan kapabilitas dalam menstimulasi pertumbuhannya (Oteino et al., 2015). Kapabilitas yang dapat mesntimulasi pertumbuhan tanaman diantaranya adalah pelarut fosfat (Vandana et al, 2017), aktivitas selulolitik, penghasil auksin (Soesanto et al., 2011) dan sebagai agen biokontrol (Panpatte, Jhala, Shelat &
Vyas, 2016).
Rumput laut merupakan salah satu komoditas unggulan Indonesia yang dimanfaatkan untuk pengolahan agar dalam skala industri. Pengolahan tersebut menghasilkan jumlah limbah padat yang melimpah dan masih mengandung selulosa sebanyak 20,17% (Sari & Assadad, 2013). Perusahaan pengolahan rumput laut membutuhkan area yang luas untuk membuang limbahnya. Limbah padat membutuhkan waktu yang lama untuk terdegradasi secara alami, sehingga dapat mencemari lingkungan dan menimbulkan bau yang tidak sedap (Afif, 2011).
Tepung ikan merupakan salah satu produk pengawetan ikan dalam bentuk ikan yang digiling menjadi tepung. Tepung ikan berasal dari berbagai ikan yang kurang ekonomis (Liliasari, 2016). Hasil ikan tersebut hampir mencapai ± 50%
dari total ikan secara keseluruhan dan masih memiliki kandungan protein yang tinggi (Abbey, Glover-Amengor, Atikpo, Atter, & Toppe, 2016). Tepung ikan
1
mengandung pula berbagai asam amino esensial yang berperan penting dalam proses metabolik mikroba (Ghaly, Ramakhrisnan, Brooks, Budge & Dave, 2013).
Penggunaan P. fluorescens sebagai agen pupuk hayati pada penelitian ini didasarkan pada studi yang dilakukan Singh, Saini & Kahlon (2016) yang menyatakan bahwa mikroba ini memiliki fleksibilitas metabolisme yang tinggi, sehingga mampu memanfaatkan selulosa sebagai sumber karbonnya. Penggunaan limbah padat industri agar-agar pada penelitian ini didasarkan pada ketersediaan limbah padat yang melimpah dan masih mengandung selulosa. Penggunaan tepung ikan pada penelitian ini didasarkan pada banyaknya ikan yang bernilai kurang ekonomis yang tertangkap ketika penangkapan selektif oleh nelayan dan masih mengandung protein.Oleh karena itu, limbah padat industri agar dan tepung ikan tersebut masih dapat dimanfaatkan. Salah satunya untuk pembuatan pupuk hayati. Limbah padat industri agar berperan sebagai penyedia karbon, sedangkan tepung ikan berperan sebagai penyedia nitrogen bagi P. fluorescens.
Studi sebelumnya terkait pemanfaatan limbah industri agar dan tepung ikan sebagai pupuk telah dilakukan oleh beberapa peneliti. López-Mosquera et al.
(2011) memanfaatkan limbah ikan dan rumput laut untuk dijadikan pupuk kompos. Sundari, Maruf & Dewi (2014) menambahkan tepung ikan dan EM4 pada pupuk organik cair rumput laut Gracilaria sp. Pemanfaatan limbah padat industri agar dan tepung ikan sebagai substrat bagi P. fluorescens untuk dijadikan pupuk hayati belum pernah dilakukan. Studi sebelumnya telah dilakukan dengan menggunakan sumber selulosa lain sebagai substrat. Serbuk gergaji digunakan Agarwal, Saxena & Chandrawat (2014) sebagai substrat bagi P. aeruginosa. Serat pepaya dan bonggol jagung sebagai substrat bagi P. aeruginosa digunakan oleh Ire & Berebon (2016). Aranganathan & Rajasree (2016), memanfaatkan limbah ikan untuk dijadikan pupuk cair dengan penambahan Bacillus subtilis.
Berdasarkan berbagai data tersebut, penelitian ini dilakukan sebagai penelitian pendahuluan terhadap analisis kemampuan P. fluorescens sebagai agen pupuk hayati berbasis limbah padat industri agar-agar dan tepung ikan. Penelitian akan berfokus pada potensi P. fluorescens dalam merombak selulosa, melarutkan fosfat dan kalium, dan menghasilkan auksin. Penelitian diharapkan dapat menyediakan informasi awal terkait potensi P. fluorescens yang mengacu pada
3
Peraturan Menteri Pertanian Nomor 70 Tahun 2011 serta formulasi konsentrasi limbah padat industri agar-agar, tepung ikan dan waktu inkubasi yang optimum untuk pembuatan pupuk hayati.
1.2 Rumusan Masalah
Penelitian ini dilaksanakan dengan rumusan masalah sebagai berikut.
1) Apakah P. fluorescens memiliki potensi sebagai agen pupuk hayati berbasis limbah padat industri agar-agar dan tepung ikan?
2) Manakah formulasi konsentrasi limbah padat industri agar-agar dan tepung ikan serta waktu inkubasi optimum bagi aktivitas P. fluorescens sebagai agen pupuk hayati?
1.3 Hipotesis
Penelitian ini dilaksanakan dengan hipotesis sebagai berikut.
1) Pseudomonas fluorescens memiliki potensi sebagai agen pupuk hayati berbasis limbah padat industri agar-agar dan tepung ikan sesuai dengan Peraturan Menteri Pertanian Nomor 70 Tahun 2011.
2) Formulasi konsentrasi limbah padat industri agar-agar dan tepung ikan serta tepung ikan optimum bagi aktivitas P. fluorescens sebagai agen pupuk hayati dapat memenuhi standar Peraturan Menteri Pertanian Nomor 70 Tahun 2011.
1.4 Tujuan Penelitian
Penelitian ini dilaksanakan dengan tujuan sebagai berikut.
1) Menganalisis potensi P. fluorescens sebagai agen pupuk hayati berbasis limbah padat industri agar-agar dan tepung ikan.
2) Menganalisis formulasi konsentrasi limbah padat industri agar agar dan tepung ikan serta waktu inkubasi optimum bagi aktivitas P. fluorescens sebagai agen pupuk hayati.
1.5 Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini diantaranya sebagai berikut.
1) Bagi peneliti: sebagai sumber informasi awal mengenai potensi P. fluorescens yang merupakan agen pupuk hayati berbasis limbah padat industri agar-agar dan tepung ikan.
2) Bagi industri: sebagai upaya alternatif dalam mengurangi penumpukan limbah padat industri pengolahan agar-agar dan perikanan.
3) Bagi masyarakat: sebagai upaya dalam mengurangi pencemaran lingkungan dan solusi dalam mengurangi penggunaan pupuk kimia.
1.6 Kerangka Berpikir Penelitian
Gambar 1. Kerangka berpikir penelitian potensi Pseudomonas fluorescens sebagai agen pupuk hayati berbasis limbah padat industri agar-agar dan tepung ikan
Pupuk Hayati (Biofertilizer)
Terdiri dari
Agen pupuk hayati (mikroba) Bahan Pembawa
(Substrat)
Limbah padat industri pengolaan agar-agar yang
melimpah dan masih mengandung selulosa
Pseudomonas fluorescens Limbah padat
perikanan yang masih mengandung protein
Peraturan Menteri Pertanian Nomor 70
Tahun 2011 Sumber
Karbon (C)
Sumber Nitrogen (N)
Formulasi optimum pupuk hayati
Analisis potensi berdasarkan
Industri:
Mengurangi penumpukan limbah
Masyarakat:
Mengurangi pencemaran lingkungan dan penggunaan pupuk kimia.
Peneliti:
Informasi awal
5
BAB II
TINJAUAN PUSTAKA
2.1 Pseudomonas fluorescens
Pseudomonas fluorescens merupakan mikroba yang termasuk ke dalam genus Pseudomonas. Karakteristik fisik mikroba ini diantaranya berbentuk basil koloni kecil, berwarna putih, dan konveks (Scales, Dickson, Lipuma & Huffnagle, 2014). Mikroba ini juga termasuk gram negatif, yaitu mikroba dengan membran bilayer yang dibatasi oleh periplasma. Dinding sel merupakan membran terluar (Outer Membrane) yang terdiri dari selapis polimer peptidoglikan. Polimer ini berfungsi melindungi sel dari lisis (Miller & Salama, 2018).
Gambar 2. Isolat Pseudomonas fluorescens dengan perbesaran 1000 X. Isolat berbentuk basil dan berwarna merah, menunjukkan isolat termasuk bakteri gram negatif
Pseudomonas fluorescens termasuk mikroba mesofilik, dengan temperatur tumbuh optimalnya berkisar antara 25-32°C. Mikroba ini termasuk pula dalam mikroba neutrofil, karena mampu tumbuh pada pH sekitar 4-8. Mikroba ini dapat ditumbuhkan menggunakan media sederhana dengan satu sumber karbon dan inkubasi aerobik selama 24-48 jam pada suhu 27-32°C. Ketika dalam kondisi yang tidak menguntungkan, mikroba mampu memasuki fase viable-but-not- culturable (VBNC). Pada fase tersebut, mikroba kehilangan kemampuannya untuk melakukan metabolisme akibat berkurangnya ketersedian nutrien pada kultur. Selanjutnya, mikroba akan mempertahankan integritas membran selnya
dan memproduksi protein hingga nutrien atau kondisi kultur sesuai dengan kebutuhan mikroba. Selanjutnya, mikroba akan memulihkan proses metabolismenya kembali, ketika kondisi kultur sesuai dengan kebutuhannya (Scales et al., 2010).
Pseudomonas fluorescens termasuk mikroba yang mudah membentuk biofilm. Kemudahan tersebut melibatkan quorum sensing, yang merupakan bentuk komunikasi sel-sel mikroba melalui persinyalan. Fenomena ini terjadi ketika setiap sel dalam populasi mikroba melepaskan feromon atau autoinduser sebagai sinyal yang dapat ditangkap oleh sel-sel sekitarnya. Autoinduser akan menjadi regulator dalam mengendalikan kepadatan populasi ketika konsentrasinya meningkat, sejalan dengan banyaknya jumlah sel dalam suatu populasi mikroba (Moat et al., 2002).
Pseudomonas fluorescens termasuk mikroba kemoorganotrof. Mikroba ini mampu memperoleh energi dengan melakukan oksidasi bahan kimia dan menggunakan bahan organik sebagai sumber karbon dan energi utamanya.
mikroba ini memiliki fleksibilitas metabolisme tinggi, yaitu mampu menggunakan beragam bahan kimia sebagai sumber energinya, seperti beragam gula dan senyawa xenobiotik kompleks (toluena, benzena). Mikroba ini mampu memproleh fleksibilitas tambahan melalui plasmid (Singh et al., 2016).
Jenis gula yang dapat digunakan P. fluorescens sebagai sumber karbon diantaranya glukosa, glukonat, gliserol, gliserat, fruktosa dan manitol. Gula tersebut digunakan dalam metabolisme karbohidrat. Proses ini dapat merubah glukosa menjadi gliseraldehid-3-fosfat dan dioksidasi lebih lanjut menjadi piruvat.
Jalur perifer intermediet mampu memasuki jalur metabolik ini untuk memperoleh energi dan sintesis blok pembangun untuk sel. Kemampuan tersebut membantu bakteri ini beradaptasi ketika dalam kondisi miskin nutrisi (Singh et al., 2016).
Pseudomonas fluorescens akan melakukan metabolisme melalui jalur perifer intermediet ketika berada dalam kondisi miskin nutrien. Pada kondisi ini, mikroba cenderung akan memanfaatkan apapun yang tersedia di lingkungan tertentu, seperi asam amino, asam lemak, bahkan senyawa xenobiotik. Proses ini berkontribusi dalam produksi metabolit seperti antibiotik, biosurfaktan dan
7
siderofor. Metabolit ini menjadi salah satu strategi pertahanan mikroba, khususnya dalam pengambilan sumber energi yang tidak tersedia secara biologis (Singh et al., 2016).
Pseudomonas fluorescens tergolong mikroba aerob obligat, namun mampu menggunakan nitrat sebagai akseptor elektron terakhir (selain O2), ketika respirasi seluler. Hal tersebut terbukti dengan tergolongnya mikroba ini dalam kelompok oksidase positif. Mikroba tersebut mampu menghasilkan enzim sitokrom C oksidase yang berperan dalam transpor elektron. Mikroba ini tergolong pula katalase positif, yaitu mikroba yang mampu menghasilkan enzim katalase sebagai bentuk pertahanan dengan detoksifikasi H2O2 (Scales et al., 2010).
Pseudomonas fluorescens termasuk ke dalam kelompok endofitik, yaitu bakteri yang dapat berkoloni di bagian interior tanaman, seperti akar, batang, atau biji. Mikroba ini dapat memasuki sel melalui celah interseluler atau sistem vaskular tanpa menimbulkan bahaya bagi tanaman. Mikroba ini memiliki prospek yang menjanjikan sebagai agen biokontrol dan Plant Growth-Promoting Rhizobacteria (PGPR) karena kelimpahan populasinya pada tanah secara alami dan sistem perakaran tanaman, serta menggunakan eksudat tanaman sebagai nutriennya (Panpatte et al., 2016).
Pseudomonas fluorescens diketahui berperan penting dalam motilitas dan fototropi akar, sintesis antibiotik, dan produksi enzim hidrolitik. Mikroba ini berperan pula dalam menghasilkan beragam metabolit sekunder, seperti 2,4- diacetylphloroglucinol (DAPG, Phl), lipopeptida, phenazines, pyrrolnitrine, pyochelin, dan hidrogen sianida. Selain itu, mikroba ini berperan dalam pelarut fosfat dan produksi fitohormon (Panpatte et al., 2016).
Pseudomonas fluorescens mampu memanfaatkan selulosa yang terkandung dalam limbah sampah dedaunan di sekitar tanah, yang dikenal dengan proses dekomposisi. Mikroba ini dapat berperan pula sebagai agen biokontrol dengan mendegradasi selulosa yang terkandung dalam dinding sel mikroba patogen. Selulase yang dihasilkan mikroba ini mampu memutus rantai glikosidik selulosa dinding sel menjadi glukosa (Wilson, 2011). Mikroba ini dapat pula mendegradasi kitin yang terkandung dalam dinding sel fungi patogen. Kitinase
yang dihasikan mikroba ini dapat memutus ikatan glikosidik kitin secara langsung dan menyebabkan sel fungi menjadi lisis (Mubarik et al., 2010).
2.2 Limbah Padat Industri Pengolahan Agar-Agar
Rumput laut Indonesia dikenal dengan kualitasnya yang baik dan banyak diminati oleh industri karena mengandung sumber karagenan, agar-agar, dan alginat yang cukup tinggi (Lestari, Sudarmin & Harjono, 2017). Rumput laut mengandung karbohidrat, protein, lemak, serat, selulosa (fraksi 2-23%), hemiselulosa, lignin, vitamin, bromin dan iodin (Nabti et al., 2016). Jenis rumput laut yang paling umum diproduksi dalam skala industri adalah rumput laut merah.
Beberapa jenis tersebut berasal dari genus Kappapychus alvarezii, Euchema spp., Laminaria japonica, Gracilaria spp, Undaria pinnatifida, Porphyra spp, Sargassum fusiforme, dan Spirulina spp. (FAO, 2016).
Agar merupakan produk utama yang dihasilkan dari rumput laut terutama dari kelas Rhodopycea, seperti Gracilaria, Sargassum dan Gellidium (Suparmi &
Sahri, 2009). Agar-agar merupakan polisakarida galaktan yang terbentuk dari subunit D-galaktosa dan 3,6-anhidro-L-galaktopiranosa. Agar dapat didegradasi menjadi asam levulinat, asam format, dan 5-hidroksimetilfurfural (Jeong et al, 2015). Agar-agar terdiri dari beberapa komponen, diantaranya agarosa dan agaropektin (Stiger-Povreau et al., 2016).
Industri agar dilaporkan menghasilkan limbah sebesar 65–75%, yang masih memiliki selulosa sebesar 19,7% (Kim et al., 2008). Selulosa merupakan polimer utama yang merupakan senyawa dominan dalam pengolahan bahan berserat (Lestari et al., 2017). Limbah pengolahan rumput laut terdiri dari dua fase, yaitu fase cair dan fase padat. Fase cair berasal dari pencucian dan presipitasi ekstraksi rumput laut, sedangkan fase padat berasal dari pemisahan ekstrak rumput laut dari padatannya. Komposisi utama fase padat adalah selulosa, sedangkan komponen lainnya adalah mineral-mineral.
Studi yang dilakukan oleh Basmal et al. (2020) menjelaskan bahwa limbah padat industri pengolahan agar-agar mengandung berbagai nutrien dan hormon yang bermanfaat bagi tumbuhan. Mikronutrien yang terkandung pada limbah diantaranya Cu (4.80 ppm), Fe (0.24 ppm), Zn (8.42 ppm), Mn (57.58 ppm), dan
9
B (32.32 ppm). Makronutrien yang terkandung pada limbah diantaranya N (0.20%), P (0.12%), K (0.17%), C-organik (10.96%), Na (0.66%), Ca (0.61%), Mg (0.09%),dan rasio C/N sebesar 54:7. Hormon pertumbuhan yang terkandung pada limbah diantaranya auksin (191 ppm), giberelin (509.5 ppm), sitokinin- kinetin (244.5 ppm) dan sitokinin-zeatin (70.5 ppm).
Selain nutrien dan hormon, pada limbah ini ditemukan pula celite, yang merupakan mineral yang berperan dalam proses penyaringan pada industri pengolahan agar-agar. Celite dapat berperan pula sebagai penyaring pada bahan pemutih, bahan isolasi panas dan bunyi, bahan pengisi, bahan gosok untuk logam, bahan bangunan ringan, dan adsorben. Celite juga memiliki kemampuan daya serap yang tinggi dan digunakan sebagai pembawa larutan sulfida untuk pupuk buatan (Genisa et al., 2015). Celite yang sudah menjadi limbah industri dikenal dengan istilah post-filtered diatomaceous earth (Anders & Alwaeli, 2015).
Celite dapat berperan pula sebagai insektisida, dengan melakukan peyerapan lipid epikutikular dan asam lemak, sehingga menyebabkan kekeringan pada arthropoda. Celite dapat menjadi alternatif yang baik untuk dijadikan kontrol alami pada hama yang menyerang biji-bijian, khususnya gandum (Shah & Khan, 2014). Menurut studi yang dilakukan Kavallieratos et al. (2010) dan Yang et al.
(2010), celite memiliki efektivitas yang tinggi untuk melawan hama jenis Rhyzopertha dominica, Sitophilus oryzae, Tribolium confusum dan T. castaneum.
2.3 Tepung Ikan
Perkembangan industri perikanan dan meningkatnya pemanfaatan ikan oleh rumah tangga yang pesat di Indonesia menghasilkan limbah yang berlimpah.
Limbah tersebut berupa bagian ikan seperti kepala, ekor sirip, tulang dan jeroan.
Limbah tersebut masih dapat dimanfaatkan karena masih mengandung protein 36- 57%; serat kasar 0,05- 2,38%; kadar air 24-63%; kadar abu 5-17%; kadar Ca 0,9- 5%, serta kadar P 1-1,9% (Zahroh et al., 2018).
Tepung ikan dapat pula diperoleh dari penggilingan bagian ikan yang tidak dimanfaatkan. Tepung ikan dapat dimanfaatkan sebagai sumber pangan dan suplemen, sumber pakan bagi hewan ternak, sebagai umpan untuk menangkap kepiting dan lobster (Tacon & Metian, 2009). Menurut Abbey et al., 2006),
limbah ikan tersebut masih mengandung total protein dan zat besi yang tinggi, masing-masing sebesar 218,06 g dan 61,86 g. Selain itu, limbah ikan juga mengandung kalsium, seng (Zn), dan mangan (Mn).
Tepung ikan juga mengandung asam amino esensial yang berperan penting dalam proses metabolik, salah satunya adalah L-triptofan. L-triptofan merupakan asam amino esensial yang menjadi prekursor utama dalam biosintesis auksin. Konsentrasi L-triptofan yang terkandung dalam tepung ikan berada pada kisaran 0,2-6,5 g (Ghaly et al., 2013; Mohanty et al., 2014). Asam amino lain yang dapat menjadi alternatif lain dalam produksi auksin adalah fenialanin, tirosin dan histidin yang merupakan golongan asam amino aromatik (Ljung, 2013;
Spaepen & Vanderleyden, 2011).
Beberapa jenis ikan yang umumnya dijadikan tepung ikan diantaranya Upeneus moluccensis (Basmal & Hermana, 2016). Selain itu, Rastrelliger brachisoma, Terapon jarbua, Liza macrolepis, dan Siganus javus (FAO, 2016;
Ramalingam et al., 2014;). Jenis ikan tersebut merupakan hasil sampingan dari penangkapan selektif yang dinilai tidak memiliki nilai ekonomis yang tinggi. Jenis ikan ini termasuk beberapa jenis Crustacea dan ikan bersirip (Carnivorous Finfish) (Tacon & Metian, 2009).
2.4 Pupuk Hayati (Biofertilizer)
Pupuk merupakan gabungan unsur hara makro dan mikro yang diberikan kepada tanaman untuk memperbaiki kualitas tanah. Berdasarkan bahan bakunya, pupuk dapat dibagi menjadi dua jenis, yakni pupuk kimia dan pupuk organik.
Pupuk kimia merupakan pupuk yang dibuat secara kimia dan menggunakan bahan kimia. Pupuk organik merupakan pupuk yang dibuat dari limbah organik yang telah melalui proses rekayasa, dapat berbentuk padat maupun cair, dan diperkaya oleh mineral maupun mikroba (Basmal, 2010).
Pupuk organik dapat dibedakan menjadi dua jenis, yaitu pupuk kompos dan pupuk hayati. Perbedaan keduanya terletak pada formulasi yang terkandung pada pupuk. Pupuk kompos dibuat dengan formulasi yang terdiri dari bahan-bahan organik dan mineral. Pupuk hayati dibuat dengan formulasi yang terdiri dari mikroba dan bahan pembawa (Permentan, 2011).
11
Pupuk hayati merupakan inokulan dengan bahan aktif mikroba hidup yang berfungsi untuk menambat hara tertentu dan memfasilitasi ketersediaan unsur hara bagi tanaman melalui simbiosis maupun non simbiosis. Simbiosis berlangsung dengan tanaman tertentu. Non simbiosis berlangsung melalui penyerapan hara dan hasil perombakan bahan organik (Rahmawati, 2016). Karakteristik pupuk hayati diketahui dari kemampuan inokulan mikroba dalam menyediakan nutrien bagi akar tanaman, diantaranya sebagai berikut.
1. Perombak Selulosa
Selulosa adalah senyawa organik dengan rumus molekul (C6H10O5)n dan homopolisakarida yang terdiri dari ˃10.000 rantai linier unit β (14) D-glukosa (Siddhanta et al., 2009). Selulosa bersifat tidak memiliki rasa, tidak berbau, hidrofobik, dan tidak larut dalam air. Selulosa memiliki potensi sebagai bahan dasar dalam pembuatan pupuk organik. Limbah industri pengolahan rumput laut merupakan salah satu biomassa selulosik telah dikembangkan sebagai sumber gula yang difermentasi menjadi etanol (Munifah, 2013).
Selulosa dapat didegradasi oleh beberapa jenis mikroba, yang dikenal dengan istilah mikroba selulolitik. Mikroba tersebut diantaranya Acidothermus cellulolyticus, Bacillus pumilis, P. fluorescens, Aspergillus, Fusarium, Penicillium, dan Trichoderma (Kuhad, 2011). Mikroba tersebut berpotensi untuk konversi biomasa tumbuhan dan alga menjadi fuel dan komponen kimia lainnya.
Proses konversi tersebut memerlukan enzim, yang dikenal dengan enzim selulase.
Enzim tersebut dapat dihasilkan oleh berbagai mikroba selulolitik (Munifah, 2013).
Selulase mendegradasi selulosa menjadi gula yang dapat larut atau enzim yang dapat menghidrolisis selulosa menjadi oligosakarida dengan memutus ikatan glikosidik β -1,4 pada selulosa, selodekstrin, selobiosa. Enzim ini berfungsi pula dalam proses penguraian serat sayuran, pemecahan pentosa dan hemiselulosa menjadi pentosa dan fraksi hemiselulosa yang mudah larut dalam air. Selain itu, untuk menghidrolisis kertas bekas dan limbah sampah. Aktivitas enzim ini diinduksi oleh beberapa sumber karbon, diantaranya selulosa, soporosa, selobiosa dan laktosa (Munifah, 2013).
2. Pelarut Fosfat (P)
Fosfat (P) merupakan salah satu unsur makro esensial yang secara alami terdapat dalam bentuk organik dan inorganik. Jumlah P di dalam tanah umumnya tinggi, yaitu sekitar 400-1200 mg/kg tanah. Hampir 95% P yang tersedia di alam merupakan P inorganik yang tidak dapat langsung digunakan tanaman. Stabilitas P di alam disebabkan karena P memiliki reaktivitas tinggi terhadap Al3+, Ca2+, dan Fe3+, sehingga keduanya dapat membentuk senyawa yang sulit terlarut (Pande, Pandey, Mehra, Singh & Kaushik, 2017).
Adanya P organik dan P inorganik di tanah berhubungan dengan siklus P yang terlibat dalam sistem tanaman-tanah. Siklus ini terjadi ketika hujan dan perubahan cuaca memicu batuan melepaskan ion P dan mineral yang dapat membentuk senyawa. Kemudian senyawa tersebut terdistribusi di tanah dan perairan. Tanaman memanfaatkan P inorganik dari tanah, kemudian dikonsumsi hewan. P akan membentuk molekul organik di dalam tanaman dan hewan, seperti DNA. Ketika tanaman atau hewan mati, P organik akan kembali ke tanah. P yang berada di tanah dapat mengalir melalui perairan maupun tergabung menjadi sedimen atau batuan (Smith et al., 2015).
Mikroba memainkan peran penting dalam siklus P dan ketersediaan P bagi tanaman. Mikroba dapat mencegah kehilangan ion P yang berikatan dengan mineral dengan cara melarutkan ion P yang penting bagi tanaman. Kehilangan tersebut terjadi karena proses pelapukan, erosi, dan limpasan permukaan tanah yang terjadi selama siklus P berlangsung. Proses kehilangan tersebut terjadi melalui aliran permukaan dan bawah tanah selama siklus P berlangsung (Fernandez et al., 2012). Beberapa jenis mikroba yang dapat melarutkan fosfat adalah Pseudomonas, Bacillus, Aspergillus, Penicillium, dan Streptomyces (Husen, Simanungkalit & Saraswati, 2007).
Tanaman dapat memanfaatkan P ketika P dalam bentuk anion ortofosfat, seperti bentuk HPO42- dan HPO41- dari larutan tanah. P dibutuhkan tanaman dalam pembentukan bunga dan buah, pertumbuhan akar, pemasakan biji dan pembentukan klorofil. P juga berasosiasi dengan regulasi biosintesis
13
makromolekul, transformasi energi, dan respirasi (Babu et al., 2017; Pande et al., 2017).
3. Pelarut Kalium (K)
Kalium (K) merupakan salah satu makronutrien esensial untuk pertumbuhan dan perkembangan tanaman. K tersedia di tanah dalam bentuk mineral, larutan, K yang dapat ditukar dan K yang tidak dapat ditukar. Sebanyak 90-98% kalium tersebut tidak dapat langsung diserap tumbuhan (Etesami et al., 2017).
Konsentrasi K terlarut umumnya sangat rendah, dengan proporsi K terbesar pada tanah terkandung pada batuan dan mineral (Mursyida et al., 2015).
Konsentrasi K terlarut dapat ditingkatkan dengan bantuan mikroorganisme pelarut K. Mikroorganisme tersebut dapat merubah K sulit terlarut menjadi K yang mudah dilarutkan tanaman. Mekanisme yang umumnya dilakukan seperti asidolisis, pengkelatan, pergantian reaksi, kompleksolisis, dan produksi asam organik. Beberapa jenis mikroorganisme yang dapat melarutkan K diantaranya Bacillus circulans, Acidithiobacillus ferrooxidans, Pseudomonas sp, Aspergillus spp. dan Aspergillus terreus (Jabin & Ismail, 2016).
4. Produksi Auksin
Auksin merupakan senyawa berupa asam dengan turunannya. Auksin alami yang umumnya ditemui adalah indole acetic acid (IAA) (Husen et al., 2007).
Auksin mampu menginduksi pemanjangan batang pada wilayah sub-apikal dan menginduksi pertumbuhan bagian tanaman. Produksi auksin diinisiasi oleh L- triptofan. L-triptofan merupakan asam amino esensial yang dibutuhkan tumbuhan dan mikroorganisme untuk biosintesis IAA (Aziz, Nawaz, Nazir, Anjum, Yaqub, Ahmad & Khan, 2015; Friedman, 2018).
Mikroorganisme tanah mampu memproduksi auksin untuk meningkatkan produktivitas tanaman. Mikroorganisme tanah yang telah dilaporkan dapat menghasilkan auksin dalam jumlah rendah diantaranya Azospirillum, Pseudomonas, dan Xantomonas (Duca et al., 2018). Ada 5 jalur bakteri dalam memproduksi IAA dengan prekursor L-triptofan. Jalur tersebut diantaranya jalur IAM (Indole-3-Acetamide), IPA (Indole-3-Pyruvate), TAM/TRM (Indole-3-
Tryptamine), TSO (Tryptophan Side-Chain Oxidation) dan IAN (Indole-3- Acetonitrile) (Spaepen & Vanderleyden, 2011).
Pada P. fluorescens, biosintesis dilakukan melalui jalur indol-3-asetaldehid, atau dikenal pula dengan istilah jalur reaksi oksidase sampingan L-triptofan.
Sebelum memasuki jalur indol-3-asetaldehid, L-triptofan ditransaminasi menjadi IPyA (inorganik pirofosfatase) oleh amino transferase. Kemudian IPyA mengalami dekarboksilasi menjadi IAAld (indol-3-asetaldehid) yang dikatalis oleh IPDC (indol-3-piruvat dekarboksilase). Selanjutnya IAAld mengalami dehidrogenasi yang dikatalis oleh IAAld dehidrogenase dan menghasilkan IAA (Spaepen & Vanderleyden, 2011).
2.5 Persyaratan Teknis Minimal Pupuk Hayati
Menurut Peraturan Peraturan Menteri Pertanian Nomor 70 tahun 2011, pupuk hayati yang menggunakan bakteri tunggal harus memenuhi persyaratan teknis sebagai berikut.
Tabel 1. Persyaratan Teknis Minimal Pupuk Hayati Tunggal untuk Bakteri Hidup Bebas dan Bakteri Endofitik (Permentan, 2011)
Parameter
Standar Mutu Menurut Jenis
Bahan Pembawa Metode
Tepung/ Granul/ Cair Pengujian
Serbuk Pelet
1. Jumlah Bakteri ≥ 107 cfu/g ≥ 107 cfu/g ≥ 107 cfu/ml TPC**) 2. Fungsional :
a. Pelarut P & K Positif Positif Positif Media Pikovskaya b. Penghasil >0,0 >0,0 >0,0 Spektrofotometri
Fitohormon atau HPLC
c. Perombak bahan Positif Positif Positif Media agar CMC/
organik (dekomposer) Avicel/Guaicol/
Indulin
3. Patogenisitas Negatif Infeksi ke daun
Tembakau 4. Kontaminan:
E. coli
Salmonella sp < 103 MPN/g atau MPN/ml
MPN-durham dan uji lanjut pada media diferensial
5. Kadar Air (%)**) ≤ 35 ADBB
6. pH 5,0 – 8,0 pH H2O, pH meter
*) TPC dilakukan pada media spesifik untuk mikroba tersebut, TPC = Total Plate Count
**) Kadar air atas dasar berat basah MPN = Most Probable Number
15
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian dilaksanakan pada bulan Mei 2018 hingga September 2019 di Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan Perikanan (BBRP2BKP), Slipi, Jakarta Pusat.
3.2 Alat dan Bahan
Alat yang diperlukan diantaranya kertas pH indikator, vorteks, timbangan analitik, laminar air flow (ESCO Fume Hood), shaking incubator, autoklaf (Hirayama HVA 85), colony counter, thermoblock, mikropipet 1-1000 µL, mikroskop cahaya (Olympus), microsentrifuge, microplate 96-well flat bottom, dan spektrofotometer UV-Vis (Spectronic® 20 Genesys TM).
Bahan yang diperlukan diantaranya biakan isolat P. fluorescens murni yang diperoleh dari koleksi kultur Universitas Gajah Mada, Yogyakarta, limbah padat industri agar-agar (LIA) dari PT Agarindo Bogatama Tangerang, tepung ikan rucah koleksi BBRP2BKP, akuades, media Nutrien Agar (NA) (Oxoid), Nutrien Broth (NB) (Oxoid), Mandels & Reese, Pikovskaya, Aleksandrov, Plate Count Agar (PCA), parafilm, pewarna Gram, kongo merah, natrium klorida 0,9%, pereaksi dinitrosalisilat (DNS), pereaksi Salkowski, L-triptofan (Lift Mode), auksin (Sigma) dan glukosa.
3.3 Rancangan Penelitian
Metode yang digunakan dalam penelitian ini adalah metode eksperimental.
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan 3 faktor perlakuan. Faktor pertama adalah konsentrasi LIA yang terdiri atas 3 taraf, yaitu 1%, 2% dan 3%. Faktor kedua adalah konsentrasi tepung ikan yang terdiri dari 3 taraf, yaitu 0,1%, 0,2% dan 0,3%. Faktor ketiga adalah waktu inkubasi yang terdiri dari 6 taraf, yaitu hari ke-1, hari ke-3, hari ke-5, hari ke-7, hari ke-9 dan hari ke-11. Setiap perlakuan dilakukan pengulangan sebanyak 2 kali dan sub ulangan sebanyak 3 kali. Rancangan penelitian dapat dilihat pada lampiran 1.
3.4 Cara Kerja
3.4.1 Peremajaan Isolat Pseudomonas fluorescens
Peremajaan isolat P. fluorescens dilakukan dengan menumbuhkan isolat pada media NB 100 mL yang diinkubasi pada shaker selama 24 jam, kemudian 1 µL isolat diinokulasikan pada media NA dan diinkubasi selama 24 jam pada inkubator suhu ruang. Setelah itu, isolat dari media NA yang telah diinkubasi diambil 1 ose dan diinokulasikan pada media NA untuk mendapatkan koloni tunggal P. fluorescens. Metode pembuatan media NB dan NA dapat dilihat pada lampiran 4.
3.4.2 Analisis Kemampuan Pseudomonas fluorescens sebagai Agen Pupuk Hayati 3.4.2.1 Kemampuan Selulolitik
Analisis aktivitas selulolitik dilakukan dengan metode pewarnaan dengan kongo merah 0,1% yang berperan sebagai indikator degradasi selulosa. Media yang digunakan adalah media Mandels & Reese. Metode pembuatan media tersebut dapat dilihat pada lampiran 4. Koloni tunggal dari isolat murni diambil sebanyak satu ujung ose, kemudian ditotol pada permukaan media padat 1% CMC pada cawan. Isolat diinkubasi pada suhu ruang selama 6 hari. Selanjutnya, kultur ditambahkan kongo merah 0,1% selama 15-30 menit kemudian dibilas dengan 1 M NaCl sebanyak 2-3 kali selama 10 menit. Adanya aktivitas selulolitik ditunjukkan dengan terbentuknya zona bening pada media. Zona bening yang terbentuk menunjukkan daerah yang selulosanya sudah terdegradasi. Daerah yang terwarnai pada media agar menunjukkan selulosa yang tidak terdegradasi oleh isolat. (Mandels & Reese, 1957; Teather & Wood, 1982).
3.4.2.2 Kemampuan Pelarut Fosfat (P)
Analisis kemampuan pelarutan P dilakukan menggunakan media padat Pikovskaya dengan sumber P CaHPO4. 2H2O, untuk mengetahui kemampuan isolat dalam melarutkan fosfat. Metode pembuatan media tersebut dapat dilihat pada lampiran 4. Koloni tunggal isolat murni sebanyak satu ujung ose ditotol pada permukaan media Pikovsykaya. Isolat diinkubasi selama 3-6 hari. Zona bening yang terbentuk menunjukkan aktivitas isolat dalam melarutan P (Gupta et al., 1994).
17
3.4.2.3 Kemampuan Pelarut Kalium (K)
Analisis kemampuan pelarutan K dilakukan menggunakan media padat Aleksandrov dengan sumber K yang digunakan adalah KCl, untuk mengetahui kemampuan isolat dalam melarutkan K. Metode pembuatan media tersebut dapat dilihat pada lampiran 4. Koloni tunggal isolat murni sebanyak satu ujung ose ditotol pada permukaan media Aleksandrov. Isolat diinkubasi selama 3-6 hari.
Zona bening yang terbentuk menunjukkan aktivitas isolat dalam melarutan K (Shanware et al., 2014).
3.4.2.4 Kemampuan Produksi Auksin
Kemampuan mikroba dalam menghasilkan IAA dianalisis secara kualitatif menggunakan media NB dengan penambahan L-triptofan 0,1%. Media diinokulasikan dengan 1 µL isolat murni yang diperoleh dari kultur cair isolat yang berumur 24 jam. Kemudian, kultur diinkubasi selama 72 jam pada suhu 30°C di tempat gelap. Inokulan diambil sebanyak 1 mL untuk disentrifugasi dengan kecepatan 10000 rpm pada suhu 4ºC selama 10 menit. Supernatan masing- masing 75 µL dihomogenkan dengan 150 µL pereaksi Salkowski, lalu diinkubasi di ruang gelap selama 25-30 menit. Perubahan warna suspensi menjadi merah mawar menunjukkan adanya produksi auksin (Gordon & Weber, 1951). Metode pembuatan pereaksi Salkowski dapat dilihat pada lampiran 5.
3.4.3 Analisis Pertumbuhan dan Aktivitas Pseudomonas fluorescens sebagai Agen Pupuk Hayati
Penelitian ini merupakan penelitian awal untuk menganalisis kemampuan tumbuh dan aktivitas P. fluorescens sebagai agen pupuk hayati. Analisis ini dilakukan dengan melakukan modifikasi media Mandels & Reese (1957) terhadap jenis sumber karbon dan sumber nitrogen. Sumber karbon yang digunakan pada penelitian ini adalah LIA, dengan variasi konsentrasi 1%, 2% dan 3%. Sumber nitrogen yang digunakan pada penelitian ini adalah tepung ikan, dengan variasi konsentrasi 0,1%, 0,2% dan 0,3%. L-triptofan ditambahkan pula pada media, berperan sebagai prekursor dalam produksi auksin.
Media Mandels dan Reese yang telah dimodifikasi dibuat dengan penambahan berbagai bahan berikut; 45 mL akuades, LIA 1%, tepung ikan 0,1%,
KH2PO4 0,03 g, MgSO4 0,015 g, NaCl 0,03 g, FeSO4 0,3 mg, MnSO4 0,3 mg,
NH4NO3 9 mg, glukosa 0,03 g, CaCl2 1,2 mg ke dalam erlenmeyer. Kemudian dilakukan sterilisasi. Selanjutnya, media yang sudah steril ditambahkan dengan 5 mL L-triptofan 0,1% dan 5 mL isolat murni P. fluorescens. Terakhir, media dikocok perlahan agar homogen. Pembuatan media untuk konsentrasi LIA 2% dan 3% serta tepung ikan 0,2% dan 0,3% dilakukan dengan tahapan yang sama.
Analisis diawali dengan menyegarkan isolat murni P. fluorescens pada media NB 50 mL selama ±24 jam menggunakan shaking incubator. Kemudian isolat dengan umur ±24 jam diinokulasi ke dalam setiap media perlakuan sebanyak 10% dari total volume media, yaitu 5 mL isolat dalam 50 mL setiap media perlakuan. Setelah itu, media dibungkus dengan plastik hitam untuk menghindari media dari kontak langsung terhadap cahaya. Selanjutnya, media diinkubasi dalam shaking incubator pada suhu 35⁰ C dengan kecepatan medium.
Analisis sampel pada setiap media perlakuan dilakukan pada hari ke 1,3,5,7,9 dan 11 terhadap beberapa parameter, diantaranya derajat keasaman (pH), kepadatan populasi P. fluorescens, aktivitas enzim selulase dan kadar glukosa, serta produksi IAA. Analisis dilakukan secara aseptis dengan pengambilan 3 mL dari setiap media perlakuan dan ±50 µL untuk pengukuran pH. Sebanyak 1 mL digunakan untuk analisis kepadatan populasi P. fluorescens dengan pengenceran ber-seri. Kemudian dihitung dengan metode Total Plate Count (TPC) pada media PCA. Sebanyak 2 mL sisanya disentrifugasi pada suhu 4⁰ C selama 10 menit dengan kecepatan 10.000 rpm. Supernatan yang diperoleh digunakan untuk analisis aktivitas selulase dan produksi auksin. Cara kerja yang dilakukan untuk analisis setiap parameter sebagai berikut.
3.4.3.1 Derajat Keasaman (pH)
Pengukuran pH dilakukan dengan menggunakan pH indikator. Sampel diambil dari setiap media ±50 µL, kemudian diteteskan pada pH indikator, lalu dilihat perubahan warna pada pH indikator.
3.4.3.2 Kepadatan Populasi
Kepadatan populasi isolat P. fluorescens diukur dengan metode Total Plate Count (TPC) untuk memperkirakan jumlah sel bakteri setiap 48 jam selama
19
12 hari masa inkubasi. Perhitungan dengan metode TPC dilakukan dengan pengambilan 1 ml inokulum mikroba untuk diencerkan dalam 9 mL NaCl fisiologis (0,9%) steril, yang disebut dengan pengenceran ke 10-1. Kemudian hasil pengenceran tersebut dimasukkan ke dalam 9 ml NaCl fisiologis (0,9%) steril, yang disebut dengan pengenceran ke 10-2. Pengenceran dilakukan hingga 10-7 dengan cara yang sama. Setelah itu, dilakukan pencawanan 3 pengenceran terakhir (10-5,10-6, 10-7) dengan tujuan untuk menghitung jumlah koloni bakteri dengan menggunakan metode sebar pada media PCA dan diinkubasi selama 24 jam pada suhu 37°C. selanjutnya, koloni yang tumbuh diamati dan dihitung menggunakan colony counter. Jumlah koloni yang memenuhi persyaratan perhitungan mikroorganisme adalah 30-300 koloni. Persamaan yang digunakan untuk menghitung kepadatan populasi isolat P.fluorescens adalah sebagai berikut (Chasanah et al., 2013).
epadatan Sel ( m umlah koloni 1 Keterangan:
CFU /mL: Colony Forming Unit per millilitre (satuan internasional penghitungan kepadatan sel bakteri
F1: Faktor seri pengenceran FP: Faktor pengenceran pertama
3.4.3.3 Aktivitas Enzim Selulase dan Kadar Glukosa
Sebelum melakukan pengukuran aktivitas enzim selulase dilakukan pembuatan kurva standar glukosa dengan interval konsentrasi 100, 200, 300, 400, 500, 600, 700, 800, 900, dan 1000 mM. Masing-masing konsentrasi diambil 1 mL dan ditambahkan dalam 1 mL pereaksi DNS (Lampiran 5), kemudian dihomogenkan, lalu dipanaskan menggunakan thermoblock dengan suhu 95ºC selama 15 menit, selanjutnya didinginkan dan diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 540 nm. Kurva standar yang terbentuk dapat dilihat pada lampiran 6.
Pengamatan aktivitas enzim selulase dilakukan dengan metode Miller (1959) yang telah dimodifikasi. Inokulan diambil sebanyak sebanyak 1 mL untuk disentrifugasi dengan kecepatan 10000 rpm pada suhu 4ºC selama 10 menit.
Kemudian, supernatan yang diperoleh diambil sebanyak 100 µL dan dilarutkan
dalam 100 µL CMC 1%, dikocok kuat dengan vorteks, dan diinkubasi selama 30 menit pada suhu 30°C dan ditambahkan dengan 200 µL DNS. Penghentian reaksi enzim dilakukan dengan pemanasan pada thermoblock pada suhu 100°C selama 15 menit, kemudian didinginkan. Selanjutnya, larutan diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 540 nm.
Perlakuan kontrol dan blanko dilakukan secara bersamaan dengan prosedur yang sama. Enzim pada kontrol yang akan direaksikan dengan sampel telah diinaktivasi dengan pemanasan pada thermoblock selama 15 menit. Enzim pada blanko, dilakukan penggantian antara larutan enzim dengan akuades untuk direaksikan dengan sampel. Aktivitas enzim diukur pada setiap pengambilan sampel yang dilakukan, sehingga dapat diketahui waktu yang tepat untuk memproduksi enzim selulase.
Aktivitas selulase dinyatakan dalam satuan U/mL. Satu unit diasumsikan sebagai jumlah enzim yang dibutuhkan untuk memecah 1 µmoL selulosa menjadi gula pereduksi per menit pada kondisi pengujian. Kadar glukosa yang dihasilkan diukur absorbansinya pada panjang gelombang 575 nm.
Absorbansi= ((As-Ab)-(Ak-Ab))
Nilai absorbansi yang diperoleh dimasukkan ke dalam persamaan yang diperoleh dari kurva standar glukosa. Selanjutnya, aktivitas selulase dihitung berdasarkan rumus berikut.
Aktivitas selulase(U ⁄mL)=
Keterangan:
As: Absorbansi sampel Ab: Absorbansi blanko Ak: Absorbansi kontrol V: volume enzim (0,1 mL) t: waktu inkubasi (30 menit)
BM: Bobot Molekul glukosa (180 Dalton).
3.4.3.4 Produksi Auksin
Sebelum melakukan pengukuran produksi auksin dilakukan pembuatan kurva standar auksin dengan interval konsentrasi 10, 20, 30, 40, 50, 60, 70, 80, 90, dan 100 ppm. Masing-masing konsentrasi diambil 1 mL dan ditambahkan dalam 1
kadar glukosa (mg/L) x1000 Vxtx BM glukosa
21
mL reagen Salkowski, kemudian dihomogenkan, lalu diinkubasi dalam ruang gelap selama 25-30 menit, selanjutnya diukur absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 535 nm. Kurva standar yang terbentuk dapat dilihat pada lampiran 7.
Pengukuran produksi auksin dilakukan dengan mengambil inokulan sebanyak 1 mL untuk disentrifugasi dengan kecepatan 10000 rpm pada suhu 4ºC selama 10 menit. Supernatan masing-masing 75 µL dihomogenkan dengan 150 µL reagen Salkowski, lalu diinkubasi di ruang gelap selama 25-30 menit.
Suspensi kemudian diukur nilai absorbansinya menggunakan spektrofotometer UV-Vis pada panjang gelombang 535 nm (Gordon &Weber, 1951).
3.5 Analisis Data
Analisis data dilakukan secara deskriptif dan statistik. Analisis deskriptif dilakukan dengan pengamatan pembentukan zona bening pada kemampuan selulolitik, pelarut P, dan pelarut K. Analisis kemampuan isolat dalam menghasilkan auksin dilakukan dengan mengamati perubahan warna yang terjadi pada supernatan setelah diberi pereaksi dan diinkubasi selama ±30 menit.
Analisis statistik dilakukan pada parameter nilai pH, kepadatan populasi, aktivitas selulase dan produksi auksin. Tujuan dilakukannya analisis adalah mengetahui konsentrasi LIA dan tepung ikan serta waktu inkubasi optimum bagi bakteri terhadap keempat parameter tersebut. Analisis statistik dilakukan menggunakan SPSS 20 (Statistical Package for the Social Science). Analisis yang digunakan adalah Two-Way ANOVA (Analisis Variat Dua Arah) dengan tingkat kepercayaan 95% (α 0,05).
Nilai signifikansi ditentukan dengan taraf 5%. Signifikansi dengan nilai
<0,05 menunjukkan bahwa H0 diterima. Signifikansi dengan nilai >0,05 menunjukkan bahwa H0 ditolak. Nilai signifikansi ditentukan untuk mengetahui pengaruh nyata dari ketiga faktor perlakuan (variabel bebas) terhadap variabel terikatnya. Apabila terdapat perbedaan yang nyata dari setiap perlakuan, akan dilanjutkan dengan uji DMRT (Duncan Multiple Range Test) pada taraf 5% untuk mengetahui perbedaan pengaruh setiap perlakuan.
Pengambilan keputusan apakah terdapat pengaruh variasi perlakuan dan waktu inkubasi terhadap nilai pH, jumlah koloni bakteri, aktivitas selulase, dan konsentrasi auksin dilakukan dengan menguji H0 dan H1 sebagai berikut.
Derajat Keasaman (pH) Konsentrasi LIA
H0: Ada pengaruh variasi konsentrasi LIA terhadap nilai pH H1: Tidak ada pengaruh variasi konsentrasi LIA terhadap nilai pH Konsentrasi Tepung Ikan
H0: Ada pengaruh variasi konsentrasi tepung ikan terhadap nilai pH H1: Tidak ada pengaruh variasi konsentrasi tepung ikan terhadap nilai pH Waktu Inkubasi
H0: Ada pengaruh waktu inkubasi terhadap nilai pH H1: Tidak ada pengaruh waktu inkubasi terhadap nilai pH Interaksi LIA dan Tepung Ikan
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA dan tepung ikan yang mempengaruhi nilai pH
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA dan tepung ikan yang mempengaruhi nilai pH
Interaksi LIA dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA dan waktu inkubasi yang mempengaruhi nilai pH
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA dan waktu inkubasi yang mempengaruhi nilai pH
Interaksi Tepung Ikan dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi tepung ikan dan waktu inkubasi yang mempengaruhi nilai pH
H1: Tidak erdapat faktor interaksi antara variasi konsentrasi tepung ikan dan waktu inkubasi yang mempengaruhi nilai pH
Interaksi antara LIA, Tepung Ikan dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA, tepung ikan dan waktu inkubasi yang mempengaruhi nilai pH
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA, tepung ikan dan waktu inkubasi yang mempengaruhi nilai pH
23
Kepadatan Populasi Pseudomonas fluorescens Konsentrasi LIA
H0: Ada pengaruh variasi konsentrasi LIA terhadap kepadatan populasi P. fluorescens
H1: Tidak ada pengaruh variasi konsentrasi LIA terhadap kepadatan populasi P. fluorescens
Konsentrasi Tepung Ikan
H0: Ada pengaruh variasi konsentrasi tepung ikan terhadap kepadatan populasi P. fluorescens
H1: Tidak ada pengaruh variasi konsentrasi tepung ikan terhadap kepadatan populasi P. fluorescens
Waktu Inkubasi
H0: Ada pengaruh waktu inkubasi terhadap kepadatan populasi P. fluorescens H1: Tidak ada pengaruh waktu inkubasi terhadap kepadatan populasi
P.fluorescens
Interaksi LIA dan Tepung Ikan
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA dan tepung ikan yang mempengaruhi kepadatan populasi P. fluorescens
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA dan tepung ikan yang mempengaruhi kepadatan populasi P. fluorescens
Interaksi LIA dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA dan waktu inkubasi yang mempengaruhi kepadatan populasi P. fluorescens
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA dan waktu inkubasi yang mempengaruhi kepadatan populasi P. fluorescens
Interaksi Tepung Ikan dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi tepung ikan dan waktu inkubasi yang mempengaruhi kepadatan populasi P. fluorescens
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi tepung ikan dan waktu inkubasi yang mempengaruhi kepadatan populasi P. fluorescens
Interaksi antara LIA, Tepung Ikan dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA, tepung ikan dan waktu inkubasi yang mempengaruhi kepadatan populasi P. fluorescens
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA, tepung ikan dan waktu inkubasi yang mempengaruhi kepadatan populasi P. fluorescens
Aktivitas Selulase Konsentrasi LIA
H0: Ada pengaruh variasi konsentrasi LIA terhadap aktivitas selulase H1: Tidak ada pengaruh variasi konsentrasi LIA terhadap aktivitas selulase Konsentrasi Tepung Ikan
H0: Ada pengaruh variasi konsentrasi tepung ikan terhadap aktivitas selulase H1: Tidak ada pengaruh variasi konsentrasi tepung ikan terhadap aktivitas selulase Waktu Inkubasi
H0: Ada pengaruh waktu inkubasi terhadap aktivitas selulase H1: Tidak ada pengaruh waktu inkubasi terhadap aktivitas selulase Interaksi LIA dan Tepung Ikan
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA dan tepung ikan yang mempengaruhi aktivitas selulase
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA dan tepung ikan yang mempengaruhi aktivitas selulase
Interaksi LIA dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA dan waktu inkubasi yang mempengaruhi aktivitas selulase
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA dan waktu inkubasi yang mempengaruhi aktivitas selulase
Interaksi Tepung Ikan dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi tepung ikan dan waktu inkubasi yang mempengaruhi aktivitas selulase
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi tepung ikan dan waktu inkubasi yang mempengaruhi aktivitas selulase
Interaksi antara LIA, Tepung Ikan dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA, tepung ikan dan waktu inkubasi yang mempengaruhi aktivitas selulase
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA, tepung ikan dan waktu inkubasi yang mempengaruhi aktivitas selulase
Produksi Auksin (IAA) Konsentrasi LIA
H0: Ada pengaruh variasi konsentrasi LIA terhadap produksi auksin H1: Tidak ada pengaruh variasi konsentrasi LIA terhadap produksi auksin
25
Konsentrasi Tepung Ikan
H0: Ada pengaruh variasi konsentrasi tepung ikan terhadap produksi auksin H1: Tidak ada pengaruh variasi konsentrasi tepung ikan terhadap produksi auksin Waktu Inkubasi
H0: Ada pengaruh waktu inkubasi terhadap produksi auksin H1: Tidak ada pengaruh waktu inkubasi terhadap produksi auksin Interaksi LIA dan Tepung Ikan
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA dan tepung ikan yang mempengaruhi produksi auksin
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA dan tepung ikan yang mempengaruhi produksi auksin
Interaksi LIA dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA dan waktu inkubasi yang mempengaruhi produksi auksin
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA dan waktu inkubasi yang mempengaruhi produksi auksin
Interaksi Tepung Ikan dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi tepung ikan dan waktu inkubasi yang mempengaruhi produksi auksin
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi tepung ikan dan waktu inkubasi yang mempengaruhi produksi auksin
Interaksi antara LIA, Tepung Ikan dan Waktu Inkubasi
H0: Terdapat faktor interaksi antara variasi konsentrasi LIA, tepung ikan dan waktu inkubasi yang mempengaruhi produksi auksin
H1: Tidak terdapat faktor interaksi antara variasi konsentrasi LIA, tepung ikan dan waktu inkubasi yang mempengaruhi produksi auksin
26
4.1 Kemampuan Selulolitik Pseudomonas fluorescens
Selulosa adalah kandungan terbanyak dari limbah industri agar-agar yang akan dimanfaatkan sebagai substrat untuk pupuk hayati, yaitu mencapai 19,7- 20,17%. Aktivitas selulolitik P. fluorescens perlu dianalisis untuk mengetahui apakah isolat tersebut mampu menghidrolisis selulosa yang terkandung pada limbah industri agar, sehingga dapat dimanfaatkan sebagai sumber karbon bagi isolat dalam produk pupuk hayati untuk menghasilkan zat pemacu tumbuh dan sebagai agen biokontrol.
Gambar 3. Hasil uji kemampuan selulolitik isolat Pseudomonas fluorescens pada media CMC 1% yang dilakukan dengan pengulangan sebanyak 3 kali dalam 1 cawan petri; A) Koloni bakteri; B) Bagian yang tidak terwarnai yang menunjukkan selulosa telah terdergradasi ; a) Pengulangan 1;
b) Pengulangan 2; c) Pengulangan 3; C) Bagian yang terwarnai menunjukkan selulosa yang tidak terdegradasi
Hasil pengujian kemampuan selulolitik dinyatakan positif. Hasil ini memenuhi persyaratan teknis minimal pupuk hayati pada Tabel 1, yaitu positif sebagai perombak bahan organik. Hasil ini ditandai dengan bagian yang tidak terwarnai kongo merah (zona bening) di sekitar koloni yang dapat diamati pada gambar 3. Bagian tersebut menunjukkan bahwa P. fluorescens memiliki kemampuan dalam mendegradasi CMC dengan cara menghasilkan enzim
A
B a
b
c
C
27
selulase. Enzim ini akan berikatan dengan molekul CMC dan memutus rantainya dan menjadi glukosa.
Hasil tersebut sesuai dengan studi yang dilakukan Wilson (2011), yang menjelaskan bahwa enzim selulase memiliki sisi aktif yang terbuka. Bagian tersebut dapat berikatan dengan molekul selulosa secara acak pada titik yang dapat diakses pada sepanjang rantai selulosa. Ikatan ini akan membentuk beberapa potongan, kemudian terpisah dengan rantai. Hal tersebut menyebabkan penurunan viskositas CMC dan terhidrolisisnya CMC menjadi glukosa.
4.2 Kemampuan Pelarut Fosfat (P) Pseudomonas fluorescens
Hasil pengujian kemampuan pelarutan P dinyatakan positif. Hasil ini memenuhi persyaratan teknis minimal pupuk hayati pada Tabel 1, yaitu positif sebagai pelarut P. Hasil ini ditandai dengan terbentuknya zona bening di sekitar koloni yang dapat diamati pada gambar 4. Bagian tersebut menunjukkan bahwa P.
fluorescens memiliki kemampuan dalam melarutkan CaHPO4 sebagai sumber P tidak terlarut pada media. Aktivitas tersebut dilakukan isolat dengan melarutkan kompleks Ca-P dan melepaskan PO43+
(fosfat) yang dapat dimanfaatkan oleh tumbuhan.
Gambar 4. Hasil uji aktivitas pelarutan P isolat Pseudomonas fluorescens pada media Pikovskaya yang dilakukan dengan pengulangan sebanyak 3 kali dalam 1 cawan petri; A) Koloni bakteri; B) Zona bening yang terbentuk; a) Pengulangan 1; b) Pengulangan 2; c) Pengulangan 3
A
B a
b
c