Makalah Kimia Dasar I
Hukum-Hukum Gas
Disusun oleh:
Dwi Hastuti (P.Kimia/K3310028) Hana Nuraeni (p.Kimia/K3310039) Hilda Nita P (P.Kimia/K3310042) Patria Sukmawati (P.Kimia/K3310065)
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN UNIVERSITAS SEBELAS MARET
HUKUM-HUKUM GAS
A. PENDAHULUAN
Pemahaman keadaan gas daripada materi merupakan bagian hakiki studi kimia dalam laboratorium. Biasanya banyaknya zat gas ditetapkan dengan mengukur volumenya. Namun, karena volume gas berubah menurut tekanan dan temperature, maka kedua kondisi ini juga harus diukur. Manfaat dari pembuatan makalah ini yaitu untuk menunjukkan bagaimana pengukuranpengukuran semacam itu digunakan untuk menghitung banyaknya gas.
Berbagai jenis gas berperilaku sangat mirip bila tekanan dan temperatur diubah. Perilaku gasgas tersebut dapat dijelaskan melalui hukumhukum gas. Hukumhukum ini bermaksud untuk menunjukkan bagaimana melakukan sejumlah perhitungan dalam memperlakukan pereaksi gas serta menghubungkan perilaku gas dengan teori molekul dengan reaksi kimia. (Keenan,1980:246)
B. HUKUMHUKUM GAS
Pada subbab ini akan membahas hubungan yang melibatkan tekanan, volume, suhu, dan jumlah gas. Secara spesifik, akan dijelaskan bagaimana satu variabel bergantung pada variable lain, asalkan kedua variable lainnya tetap. Secara kolektif, hubungan ini disebut sebagai hukum gas sederhana. (petrucci.2011:181)
1. Hukum Boyle
Gambar. Robert Boyle
Dari beberapa hubungan diantara variabel-variabel gas, yang pertama ditemukan adalah hubungan antara tekanan dan volume. Hubungan ini dikemukakan pada tahun 1662 oleh Robert Boyle. Boyle mengemukakan bahwa:
“Volume sejumlah gas pada suhu tetap berbanding terbalik terhadap tekanan gasnya.”
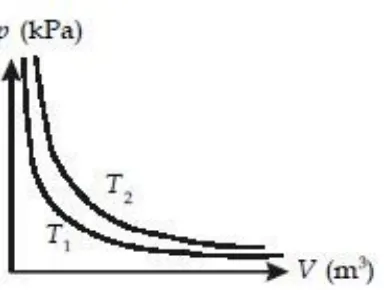
Hubungan antara tekanan (p) dan volume (V) suatu gas yang berada di ruang tertutup ini diteliti oleh Robert Boyle. Saat melakukan percobaan tentang hubungan antara tekanan dan volume gas dalam suatu ruang tertutup, Robert Boyle menjaga agar tidak terjadi perubahan temperatur pada gas (isotermal). Dari data hasil pengamatannya, Boyle mendapatkan bahwa hasil kali antara tekanan (p) dan volume (V) gas pada suhu tetap adalah konstan.
Gambar (a) Gas di dalam tabung memiliki volume V1 dan
tekanan P1. (b) Volume gas di dalam tabung diperbesar menjadi V2
sehingga tekanannya P2 menjadi lebih kecil.
Suatu gas yang berada di dalam tabung dengan tutup yang dapat diturunkan atau dinaikkan, sedang diukur tekanannya. Dari gambar tersebut dapat dilihat bahwa saat tuas tutup tabung ditekan, volume gas akan mengecil dan mengakibatkan tekanan gas yang terukur oleh alat pengukur menjadi membesar.
Secara matematis, hubungan antara tekanan dan volume dinyatakan dengan persamaan:
P ∞ V1 atau P = Va atau PV = ɑ (suatu konstanta)
PV = konstan
atau
p1V1 = p2V2
Dalam bentuk grafik, hubungan antara tekanan (p) dan volume (V)
dapat dilihat pada Gambar 8.2.
2. Hukum Charles
Hubungan antara volume gas dan suhu ditemukan oleh fisikiawan Perancis Jacques Charles pada tahun 1787 dan secara terpisah oleh Joseph Louis GayLussac yang mempublikasikannya pada tahun 1802.
Secara grafik, hukum Charles dapat digambarkan seperti pada gambar di bawah. Gambar tersebut melukiskan sejumlah gas yang terdapat dalam silinder. Tekanan dipertahankan tetap sedangkan suhu bervariasi. Volume gas bertambah ketika suhu dinaikkan atau berkurang ketika suhu direndahkan; hubungannya linear (garis lurus). Tiga kemungkinan ditunjukkan dalam gambar.
Gambaran umum yang diperoleh dari garis pada grafik adalah titik perpotongannya dengan sumbu suhu. Meskipun berbeda pada setiap suhu, volume gas untuk ketiga kasus yang ditunjukkan semuanya
mencapai nilai nol pada suhu dibawah -270°C (tepatnya pada -273,15°C). Suhu 273,15°C berhubungan dengan keadaan dimana volume hipotetis gas akan nol pada suhu mutlak nol. Titik ini yang nantinya dijadikan sebagai skala Kelvin. Hubungan antara Celcius dengan skala Kelvin adalah:
T(K)=t(℃)+273,15
Secara matematis dapat ditulis:
Hukum Charles dapat disusun kembali menjadi persamaan :
V1
T1=
V2
T2
V1 adalah volume awal
T1 adalah suhu awal
V2 adalah volume akhir
T2 adalah suhu akhir
Dari persamaan diatas dapat dilihat bahwa melipat duakan suhu Kelvin (mutlak) dari gas menyebabkan volumenya menjadi bertambah
dua kali. (Peningkatan suhu gas dari 1°C menjadi 2°C atau dari 1°F botol tersebut akan meledak. Hal ini terjadi karena naiknya tekanan gas di dalamnya akibat kenaikan suhu. Dengan demikian, dapat dikatakan bahwa:
Pernyataan tersebut dikenal dengan Hukum Gay Lussac. Secara matematis dapat dituliskan:
P∝T P
T=konstan P1
T1=
P2
T2
Dengan:
P1 = tekanan gas pada keadaan 1 (N/m2)
T1 = suhu mutlak gas pada keadaan 1 (K)
P2 = tekanan gas pada keadaan 2 (N/m2)
T2 = suhu mutlak gas pada keadaan 2 (K)
Hubungan antara tekanan dan suhu gas pada volume konstan dapat dilukiskan dengan grafik seperti yang tampak pada Gambar.
4. Hukum Avogadro
Gambar. Amedeo Avogadro
Satu penjelasan yang diajukan adalah bahwa volume gas yang sama pada suhu dan tekanan yang sama mengandung sejumlah atom yang sama. Namun, Dalton tidak sependapat dengan usulan itu. Jika usulan Gay-Lussac memang benar, maka reaksi hidrogen dan oksigen untuk membentuk air akan menjadi H(g) + O(g) HO(g) , dengan
menggunakan istilah modern, kita akan mengatakan bahwa molekul O2
terbelah menjadi atom-atomnya, yang kemudian bergabung dengan
molekul H2 membentuk molekul H2O. dengan cara ini, volume oksigen
yang diperlukan hanya setengah dari volume hidrogen.
Hipotesis Avogadro tentang volume sama – jumlah sama dapat dinyatakan dengan dua cara:
1) Volume yang sama dari gas-gas berbeda yang dibandingkan pada suhu dan tekanan sama akan mengandung jumlah molekul yang sama.
Jika jumlah mol gas (n) dilipat-duakan, volumenya akan berlipat-dua, dan seterusnya. Secara matematis dapat dinyatakan dengan:
Pada STP, jumlah molekul yang terkandung dalam 22,4 L gas adalah 6,02 x 1023, atau 1 mol.
1 mol gas = 22,4 L gas (pada STP)
5. Persamaan Gas Ideal
Gabungan dalam satu pernyataan dari hukum Boyle, Charles, Gay-Lussac, serta Avogadro ini disebut hukum gas ideal.
Hukum Boyle:V∝P1(n dan T konstan)
Hukum Charles:V∝T(n dan P konstan)
Hukum Gay−Lussac:P∝T(n dan V konstan)
Hukum Avogadro:V∝n(P dan T konstan)
Hal tersebut berarti volume gas berbanding lurus terhadap jumlah gas dan suhu serta berbanding terbalik terhadap tekanan, yaitu :
V∝nTP dan V=RnTP atau PV=nRT
Gas yang perilakunya sesuai dengan persamaan gas ideal dikatakan gas ideal atau gas sempurna (perfect gas). Sebelum didapatkan rumus diatas, diperlukan satu nilai konstanta R yang disebut konstanta gas. Cara yang paling sedehana untuk mendapatkan nilai tersebut yaitu dengan mensubstitusikan volume molar gas ideal. Namun, nilai R kemudian bergantung pada satuan apayang digunakan untuk menyatakan tekanan dan volume. Dengan volume molar 22,4140 L dan tekanan dalam atmosfir, maka kita dapatkan:
R= 8,3145 J mol-1 K-1
C. KESIMPULAN
1. Hukum Boyle adalah bahwa hasil kali antara tekanan dan volum akan bernilai konstan selama massa dan suhu gas dijaga konstan
2. Hukum Charles adalah hukum gas ideal pada tekanan tetap yang menyatakan bahwa pada tekanan tetap, volume gas ideal bermassa tertentu berbanding lurus terhadap temperaturnya (dalam Kelvin).
3. Gay-Lussac menemukan bahwa Tekanan dari sejumlah tetap gas pada
volum yang tetap berbanding lurus dengan temperaturnya dalam kelvin
4. Avogadro menyatakan bahwa Pada suhu dan tekanan tetap, volume gas berbanding lurus dengan jumlah gas
5. Hukum Gas Ideal (dalam jumlah mol) mengatakan bahwa ketika volume, tekanan dan suhu setiap gas sama, maka setiap gas tersebut memiliki jumlah molekul yang sama
DAFTAR PUSTAKA
Petrucci. 2008. Kimia Dasar Prinsip – Prinsip Dan Aplikasi Modern. Jakarta : Erlangga
http://budisma.web.id/hukum-hukum-tentang-gas.html Diakses pada tanggal 8 September 2013
http://id.wikipedia.org/wiki/Hukum_Boyle Diakses pada tanggal 8 September 2013