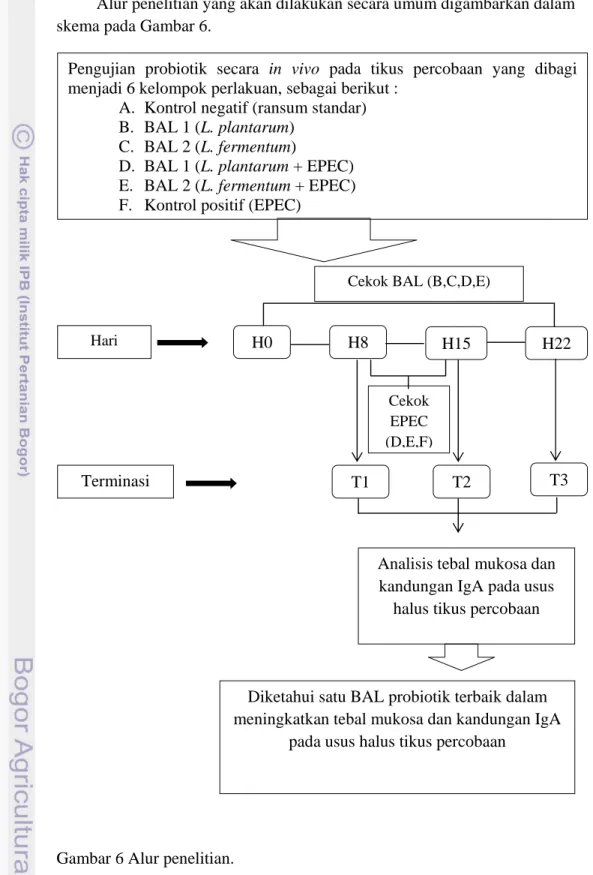
skema pada Gambar 6.
Gambar 6 Alur penelitian.
Pengujian probiotik secara in vivo pada tikus percobaan yang dibagi menjadi 6 kelompok perlakuan, sebagai berikut :
A. Kontrol negatif (ransum standar) B. BAL 1 (L. plantarum)
C. BAL 2 (L. fermentum)
D. BAL 1 (L. plantarum + EPEC) E. BAL 2 (L. fermentum + EPEC) F. Kontrol positif (EPEC)
Hari H0 H8 H15 H22 T1 T2 T3 Terminasi Cekok EPEC (D,E,F)
Cekok BAL (B,C,D,E)
Analisis tebal mukosa dan kandungan IgA pada usus
halus tikus percobaan
Diketahui satu BAL probiotik terbaik dalam meningkatkan tebal mukosa dan kandungan IgA
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Departemen Ilmu dan Teknologi Pangan, FATETA, kandang hewan SEAFAST Center dan Laboratorium Histologi, Departemen Anatomi, Fisiologi, dan Farmakologi, FKH, Institut Pertanian Bogor pada bulan Juli-Agustus 2009 dan dilanjutkan pada bulan Januari-Februari 2010.
Alat dan Bahan Penelitian
Alat yang digunakan terdiri atas seperangkat alat bedah (gunting, pinset, alas bedah), pisau silet, gelas piala, erlenmeyer, botol sampel, kapas, kertas tissue, benang, alluminium foil, tissue basket, exhause fan, pipet tetes, pipet mohr, mikropipet, gelas ukur, cup embedding, objek glass, coverglass, inkubator, waterbath, mikrotom putar (rotatory microtom), tabung ependorf, kotak preparat, pensil, dan kamera.
Bahan-bahan yang digunakan pada penelitian ini adalah tikus putih Albino Norway Rats (Ratus norvegicus) galur Sprague Dawley umur 5-6 minggu sebanyak 90 ekor tikus (15 ekor tikus setiap kelompok perlakuan) berjenis kelamin jantan dengan berat badan berkisar antara 140-240 gram, bakteri asam laktat (BAL) indigenus isolat lokal yaitu Lactobacillus plantarum dan Lactobacillus fermentum, kultur bakteri Enteropathogenic E.coli (EPEC), ransum tikus percobaan, (kasein, minyak jagung, mineral mix, carboximethylcellulose, dan maizena), eter, organ usus halus tikus, NaCl fisiologis 0.9%, larutan fiksatif Bouin (asam pikrat jenuh, formalin, dan asam asetat glasial dengan perbandingan 15:5:1), alkohol 70%, 80%, 90%, 95%, dan 100%, xylol, parafin, akuades, pewarna Hematoksilin-Eosin, entelan, neophren in toluene 0.2%, Phosphate Buffered Saline (PBS), metanol, H2O2, serum normal, antibodi primer/monoklonal imunoglobulin A (IgA), antibodi sekunder Dako Envision Peroksidase System (K1491), larutan kromogen Diamino Benzidine (DAB), air bebas ion (MilliQ), kertas film, dan label.
Prosedur pelaksanaan
1. Kandang dan perlengkapan
Kandang yang digunakan adalah kandang yang berukuran 17.5 x 23.75 x 17.5 cm, dengan jumlah sesuai dengan jumlah tikus yang digunakan. Kandang tersebut dari stainless steel. Kandang tikus berlokasi pada tempat yang bebas dari suara ribut, terjaga dari asap industri, dan polutan lainnya. Lantai kandang mudah dibersihkan dan disanitasi. Suhu optimum ruangan untuk tikus adalah 22-24oC dan kelembaban udara 50-60% dengan ventilasi yang cukup (namun tidak ada jendela yang terbuka).
2. Ransum
Komposisi ransum basal disusun berdasarkan standar AOAC (2005) (Arief et al. 2010) yaitu mengandung karbohidrat, protein, lemak, mineral, vitamin, dan air. Komposisi ransum untuk tikus percobaan adalah sebagai berikut :
Tabel 2 Komposisi campuran ransum basal tikus AOAC (2005) (Arief et al. 2010)
Bahan-bahan Jumlah (%)
Protein kasar X=1.60 x 100%N sample (10%port) Minyak jagung [(8-X) x % ekstrak eter] / 100 Campuran mineral [(5-X) x kadar abu] / 100
Campuran vitamin 1
CMC [(1-X) x % kadar serat kasar] / 100 Air [(5-X) x % kadar air] / 100
Maizena Untuk membuat 100%
3. Perlakuan hewan percobaan
Tikus dibagi enam kelompok yang masing-masing kelompok diberi perlakuan yang berbeda-beda seperti pada Tabel 3. Semua tikus diberi air minum dan ransum standar ad libitum. Kultur L. plantarum dan L. fermentum yang digunakan sebanyak 1 ml dengan populasi 108 cfu/ml (Zoumpopolou et al. 2008), sedangkan kultur Enteropathogenic Escherichia coli yang digunakan sebanyak 1 ml dengan populasi 106 cfu/ml untuk satu kali cekok (Oyetayo 2004). L. plantarum, L.
fermentum, dan EPEC diberikan pada tikus percobaan secara per oral menggunakan sonde.
Tabel 3 Kelompok tikus perlakuan
Kelompok tikus Perlakuan
A Tikus yang diberi ransum standar dan dicekok akuades mulai hari
ke-1 sampai hari ke-21 (kontrol negatif).
B Tikus yang diberi ransum standar dan dicekok L. plantarum mulai
dari hari ke-1 sampai hari ke-21.
C Tikus yang diberi ransum standar Pencekokan L. fermentum mulai
dari hari ke-1 sampai hari ke-21.
D
Tikus yang diberi ransum standar dan dicekok L. plantarum hari ke-1 sampai hari ke-21 diselingi dengan pencekokan EPEC pada hari ke-8 sampai ke-14.
E
Tikus yang diberi ransum standar dan dicekok L. fermentum mulai hari ke-1 sampai hari ke-21 diselingi dengan pencekokan EPEC pada hari ke-8 sampai ke-14.
F
Tikus yang diberi ransum standar dan dicekok akuades mulai hari ke-1 sampai hari ke-21, diselingi dengan pencekokan EPEC mulai hari ke-8 sampai hari ke-14.
4. Sampling organ usus halus
Proses terminasi (pengakhiran perlakuan) dan sampling organ usus halus dilakukan tiga kali yaitu pada hari ke-8 (T1), hari ke-15 (T2), dan hari ke-22 (T3). Saat tikus diterminasi, jaringan usus halus beserta lambungnya diambil kemudian dicuci dengan NaCl 0.9%. Jaringan lalu disimpan dan difiksasi selama 24 jam dalam larutan Bouin.
5. Pemrosesan jaringan
Potongan jaringan usus halus (duodenum, jejunum, dan ileum) yang telah difiksasi kemudian didehidrasi dengan alkohol bertingkat (70%, 80%, 90%, dan 95%) yang masing-masing selama 24 jam dan alkohol absolut (I, II, dan III) masing-masing selama 1 jam. Tahap berikutnya adalah infiltrasi parafin ke dalam jaringan dengan memasukkan sampel jaringan ke dalam parafin cair I, II, dan III masing-masing selama 1 jam dengan suhu 60oC. Setelah itu dilakukan penanaman organ dalam parafin (embedding), kemudian dibuat blok-blok jaringan sesuai ukuran organ. Blok jaringan dipotong setebal 4 µm dengan mikrotom. Hasil potongan direndam dalam akuades (suhu ruang), kemudian dimasukkan ke dalam
akuades yang dipanaskan dalam waterbath (suhu 37oC). Selanjutnya jaringan diletakkan pada gelas objek dan dimasukkan ke dalam inkubator 40oC selama minimal 24 jam.
6. Pewarnaan
Sebelum tahap pewarnaan, dilakukan deparafinisasi dan rehidrasi dengan cara mencelupkan sediaan jaringan ke dalam xylol III, II, dan I masing-masing selama 5 menit dilanjutkan dengan alkohol absolut III, II, dan I, alkohol 95%, 90%, 80%, dan 70% masing-masing selama 3 menit. Dicuci dengan air kran selama 5 menit dilanjutkan dengan akuades.
Pewarnaan Hematoksilin-Eosin (HE)
Pewarnaan jaringan diawali dengan pemberian hematoksilin selama 3 menit, lalu direndam dalam air kran selama 10 menit dan akuades selama 5 menit, dilanjutkan pewarnaan dengan Eosin selama 2 menit. Tahap pewarnaan diakhiri dengan dehidrasi pada alkohol bertingkat 70%, 80%, 90%, 95%, absolut I, II masing-masing beberapa detik, kemudian absolut III selama 1 menit. Lalu dilanjutkan dengan clearing pada xylol I, II selama beberapa detik dan xylol III selama satu menit, diakhiri dengan mounting (penutupan sediaan dengan coverglass) menggunakan entellan. Sediaan jaringan yang telah selesai diwarnai kemudian diamati dan dipotret.
Pewarnaan Imunohistokimia terhadap IgA
Pewarnaan jaringan secara imunohistokimia dilakukan dengan penghilangan enzim peroksidase endogen dengan cara mencelupkan sediaan ke dalam substrat metanol 30 mL yang telah ditambahkan hidrogen peroksida (H2O2) 0.3 mL selama 15 menit. Pencucian secara berurutan menggunakan akuades dan PBS masing-masing dua kali selama 10 menit. Sediaan jaringan kemudian diinkubasi di dalam serum normal (50-60 µl) selama 60 menit pada suhu 37oC. Dilanjutkan pencucian dengan PBS kembali selama tiga kali selama 5 menit. Sediaan jaringan kemudian diinkubasi di dalam antibodi primer IgA (50-60 µl) pada suhu 4oC selama satu malam.
Setelah inkubasi, preparat dicuci dengan PBS sebanyak tiga kali masing-masing 10 menit. Selanjutkan preparat diinkubasi di dalam antibodi sekunder Dako Envision Peroksidase System (50-60 µl) selama 60 menit pada suhu 37oC pada kondisi gelap. Hasil reaksi antigen dengan antibodi divisualisasikan dengan menggunakan DAB (Diamino Benzidin) selama 30 menit (gelap) yang selanjutnya diberi counterstain hematoksilin. Setelah itu dilakukan dehidrasi pada alkohol bertingkat 70%, 80%, 90%, 95%, absolut I, II masing-masing beberapa detik, kemudian absolut III selama 1 menit. Lalu dilanjutkan dengan clearing pada xylol I, II selama beberapa detik dan xylol III selama satu menit, diakhiri dengan mounting. Setelah itu, preparat imunohistokimia siap untuk diamati di bawah mikroskop.
7. Analisis data
Analisis Tebal Mukosa Usus Halus
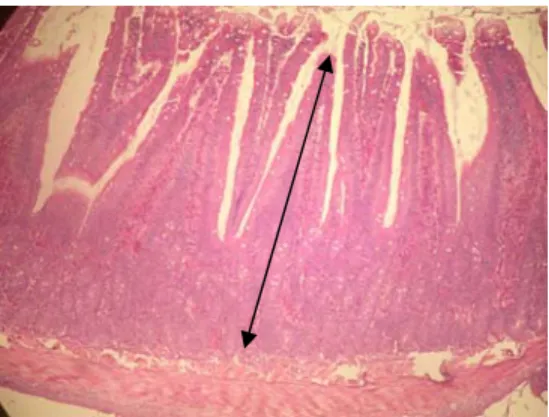
Hasil pewarnaan HE diamati dengan menggunakan mikroskop cahaya terhadap gambaran umum histologi organ usus halus. Data yang diambil berupa tebal mukosa usus halus (duodenum, jejunum, dan ileum). Pengamatan histologi usus halus tikus percobaan dengan menghitung rata-rata tebal mukosa setiap 10 vili per preparat usus. Hasil pengukuran dianalisa secara statistik dengan rancangan acak lengkap ANOVA. Apabila ada yang berbeda nyata dilakukan uji lanjut Duncan. Tebal mukosa usus halus ditunjukkan dengan tanda ( ) pada Gambar 7.
Gambar 7 Vili usus halus dengan pewarnaan HE dengan tebal mukosa dari submukosa sampai ke ujung vili usus.
Analisis imunohistokimia
Data yang diambil dari pewarnaan imunohistokimia adalah data kualitatif mengenai kandungan IgA pada jaringan usus halus yang didasarkan pada intensitas dan distribusi warna coklat yang dihasilkan dari pewarnaan IgA. Warna coklat merupakan reaksi positif (+) terhadap keberadaan IgA dan warna biru merupakan reaksi negatif (-) terhadap keberadaan IgA. Semakin banyak dan semakin tua warna coklat yang dihasilkan, berarti semakin banyak nilai (+) nya yang berarti semakin tinggi kandungan IgA nya.