UJI AKTIVITAS EKSTRAK ETANOL HERBA PUGUNTANO (Picria Fel-terrae Merr.) TERHADAP PARAMETER GINJAL
TIKUS JANTAN YANG DIINDUKSI PARASETAMOL SKRIPSI
OLEH:
DHANES KUMAR NIM 151501268
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2019
UJI AKTIVITAS EKSTRAK ETANOL HERBA PUGUNTANO (Picria Fel-terrae Merr.) TERHADAP PARAMETER GINJAL
TIKUS JANTAN YANG DIINDUKSI PARASETAMOL SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara
OLEH:
DHANES KUMAR NIM 151501268
PROGRAM STUDI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
2019
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah melimpahkan rahmat dan karunia, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Ekstrak Etanol Herba Puguntano (Picria Fel-Terrae Merr.) terhadap Parameter Ginjal Tikus jantan yang diinduksi Parasetamol”.
Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis menyampaikan rasa terima kasih kepada kepada Dr.
Aminah Dalimunthe, M.Si., Apt., sebagai dosen pembimbing skripsi yang telah membimbing dan mengajarkan dengan baik, tulus, ikhlas serta penuh kesabaran dalam proses penelitian dan penulisan skripsi, Ibu Prof. Dra. Azizah Nasution, M.Sc., Ph.D., Apt., dan Pak Dadang Irfan Husori, S.Si., M.Si., Apt., selaku dosen penguji yang telah memberikan saran membangun dalam penulisan skripsi, Dekan Fakultas Farmasi Universitas Sumatera Utara, Prof. Dr. Masfria, M.S., Apt., yang telah memberikan bantuan dan fasilitas selama masa pendidikan, Bapak Drs.
Agusmal Dalimunthe, M.Si., Apt., sebagai pembimbing akademik yang selalu memantau perkembangan akademik pada setiap semester serta seluruh staff pengajar Fakultas Farmasi USU yang telah mengajarkan pelajaran kuliah maupun pelajaran hidup,
Skripsi ini penulis hadiahkan kepada kedua orang tua, Ayahanda Kumar Sinnapan dan Ibunda Velumani P. Karuppaiah tercinta, serta kedua abang dan kakak saya, Ananth Kumar dan Abirami Kumar sebagai rasa terima kasih dan penghargaan yang tulus atas doa, dorongan dan pengorbanan, baik moril dan
UJI AKTIVITAS EKSTRAK ETANOL HERBA PUGUNTANO (Picria fel- terrae Merr) TERHADAP PARAMETER GINJAL TIKUS JANTAN YANG
DIINDUKSI PARASETAMOL ABSTRAK
Latar Belakang: Parasetamol merupakan salah satu senyawa kimia yang paling banyak digunakan sebagai obat analgesik-antipiretik di seluruh dunia, dan di sebagian besar negara ia tersedia tanpa resep. Dosis Parasetamol yang berlebihan akan merusak dan meracuni ginjal. Tumbuhan yang mempunyai sifat flavanoid dapat mengatasi kerusakan ginjal manakala herba puguntano juga mempunyai sifat flavonoid.
Tujuan: Penelitian ini dilakukan untuk mengetahui aktivitas ekstrak etanol herba puguntano terhadap parameter ginjal tikus jantan yang diinduksi parasetamol.
Metode: Lima belas ekor tikus jantan dibagi menjadi lima kelompok yang terdiri dari normal (tanpa perlakuan) dan kelompok perlakuan yang diinduksi parasetamol. Kelompok perlakuan yang diinduksi parasetamol dibagi menjadi kelompok yang hanya diberi makan dan minum, diberi katekin, carboxy methyl cellulose (CMC) 0,5%, ekstrak etanol herba puguntano 250 mg/kg bb dan 500 mg/kg bb secara per oral selama delapan hari. Setelah satu jam tikus diinduksi parasetamol dosis 1350 mg/kg bb secara oral pada hari kedelapan. Pada hari ke delapan, tikus dikorbankan dengan menggunakan kloroform untuk diambil darahnya melalui inferior vena cava. Darah yang didapat digunakan untuk pengujian kreatinin dan urea serum. Data dianalisis dengan menggunakan uji One-Way ANOVA dan dilanjutkan dengan uji Post Hoc Tukey
Hasil: Hasil uji ANOVA menunjukkan bahwa pemberian EEHPT dosis 250 mg/kg bb dan 500 mg/kg bb menurunkan kadar urea yang berbeda nyata dengan kontrol negatif pemberian CMC (p < 0.05). EEHPT dosis 250 mg/kg bb dan 500 mg/kg bb tidak memberikan hasil kadar kreatinin yang berbeda.
Kesimpulan: Berdasarkan uraian di atas dapat disimpulkan bahwa EEHPT berkhasiat pada ginjal dengan dosis 250 mg/kg bb.
Kata Kunci: ginjal, herba puguntano, parasetamol, Picria fel-terrae Merr
ACTIVITY OFETHANOL EXTRACT OF PUGUNTANO HERBAL (Picria fel-terrae Merr) ON KIDNEY PARAMETER OF PARACETAMOL
INDUCED MALE RATS ABSTRACT
Background: Paracetamol is one of the most widely used chemical compounds as an analgesic-antipyretic drug throughout the world, and in most countries it is available without prescription. Excessive doses of paracetamol will damage and poison the kidneys. Plants that have flavonoid properties can overcome kidney damage while the puguntano herbal also has flavonoid properties too.
Objective: This study aimed to evaluate activity of kidney parameter of ethanol extract of puguntano herbal which induced paracetamol in male rats.
Method: Fifteen rats were divided into 5 groups of normal group (without treatment), groups of treatment only fed and watered, given catechin, carboxy methyl cellulose (CMC) 0.5%, ethanol extract of puguntano herbal with each dose of 250 mg/kg bw and 500 mg/kg bw. Each group was given the test preparation orally for eight days. After one hour, four groups were induced with paracetamol dose of 1,350 mg/kg bw orally during eighth day. On the eighth day, the rats were sacrificed by giving chloroform, blood samples were collected for measurement of serum creatinine, and urea levels. Data were analyzed using One Way ANOVA test and continued with Post Hoc Tukey test.
Result: The ANOVA test showed that the administration of EEPH dose of 250 mg / kg bw and 500 mg / kg bw reduced urea levels significantly different from the negative control of CMC administration (p < 0.05). Ethanol extract of puguntano herbal 250 mg / kg bw gave no significant difference on the results of creatinine.
Conclusion: Based on the description above it can be concluded that ethanol extract of puguntano herbal is good for the kidneys at the dose of 250 mg / kg bw.
Keywords: kidney, paracetamol, Picria fel-terrae Merr, puguntano herbal,
DAFTAR ISI
JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
SURAT PERNYATAAN ORISINALITAS ... vi
ABSTRAK ... vii
ABSTRACT ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 4
1.3 Hipotesis Penelitian ... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan... 6
2.2 Uraian Kandungan Kimia ... 8
2.2.1 Flavanoid ... 8
2.2.2 Steroid/Triterpenoid ... 9
2.2.3 Glikosida ... 9
2.3 Parasetamol ... 10
2.3.1 Farmakokinetik ... 11
2.3.2 Efek nefrotoksik ... 11
2.4 Ginjal ... 13
2.5 Kreatinin ... 15
2.6 Urea ... 15
2.7 Obat-Obatan Yang Digunakan Untuk Pengujian Parameter Ginjal ... 16
2.8 Metode Pengujian... 19
2.8.1 Metode pengujian kreatinin... 19
2.8.2 Metode pengujian urea ... 19
BAB III METODE PENELITIAN ... 20
3.1 Lokasi Penelitian ... 20
3.2 Alat dan Bahan ... 20
3.2.1 Alat ... 20
3.2.2 Bahan ... 21
3.2.1 Hewan percobaan ... 21
3.2.2 Pengolahan simplisia ... 21
3.3 Prosedur Kerja ... 21
3.3.1 Pengolahan dan pengumpulan sampel ... 21
3.3.2 Identifikasi simplisia ... 21
3.3.3 Pembuatan simplisia... 22
3.4 Pemeriksaan Karakteristik Simplisia Herba Puguntano ... 22
3.4.1 Pemeriksaan makroskopik dan organoleptik ... 22
3.4.2 Pemeriksaan mikroskopik ... 22
3.4.3 Penetapan kadar air ... 22
3.4.4 Penetapan sari larut dalam air ... 23
3.4.5 Penetapan sari larut dalam etanol ... 23
3.4.6 Penetapan kadar abu total... 24
3.4.7 Penetapan kadar abu tidak larut dalam asam ... 24
3.5 Skrining Fitokimia Simplisia Herba Puguntano ... 24
3.5.1 Pemeriksaan alkaloid ... 25
3.5.2 Pemeriksaan flavanoid ... 25
3.5.3 Pemeriksaan glikosida ... 26
3.5.4 Pemeriksaan saponin ... 26
3.5.5 Pemeriksaan tanin ... 27
3.5.6 Pemeriksaan steroid/triterpenoid ... 27
3.6 Pembuatan Ekstrak Etanol Herba Puguntano. ... 27
3.7 Pembuatan Larutan Uji. ... 28
3.7.1 Pembuatan suspensi Na-CMC 5% ... 28
3.7.2 Pembuatan suspensi ekstrak etanol herba puguntano ... 28
3.7.3 Penyiapan hewan percobaan ... 28
3.8 Pengukuran Kadar Kreatinin Dan Urea Serum ... 30
3.8.1 Pengukuran kadar kreatinin serum ... 30
3.8.2 Pengukuran kadar urea serum ... 30
3.8 Analisis data ... 30
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Identifikasi Tumbuhan ... 32
4.2 Hasil Karakterisasi Simplisia ... 32
4.3 Hasil Skrining Fitokimia Simplisia ... 34
4.4 Hasil Pengukuran Parameter Ginjal ... 35
4.4.1 Hasil pengukuran parameter kreatinin ... 35
4.4.2 Hasil pengukuran parameter urea... 37
BAB V KESIMPULAN DAN SARAN ... 41
5.1 Kesimpulan ... 41
5.2 Saran ... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
4.1 Hasil pemeriksaan karakterisasi simplisia ... 33
4.2 Hasil skrining fitokimia serbuk herba puguntano ... 35
4.3 Hasil pengukuran kadar kreatinin ... 36
4.4 Hasil pengukuran kadar urea ... 38
DAFTAR GAMBAR
1.1 Kerangka pikir penelitian ... 5
2.1 Tumbuhan puguntano... 7
2.2 Struktur kimia kreatinin ... 15
2.3 Struktur kimia urea ... 16
4.2 Grafik hasil pengukuran kadar kreatinin ... 36
4.3 Grafik hasil pengukuran kadar urea ... 38
DAFTAR LAMPIRAN
1. Hasil identifikasi tumbuhan ... 45
2. Surat persetujuan Ethical Clearance... 46
3. Gambar tumbuhan dan daun segar puguntano ... 47
4. Hasil pemeriksaan makroskopik tumbuhan dan simplisia puguntano ... 48
5. Simplisia daun puguntano ... 49
6. Bagan alur penelitian... 50
7. Bagan alur pengujian aktivitas terhadap ginjal ... 51
8. Perhitungan karakteristik serbuk simplisia herba puguntano... 52
9. Perhitungan dosis ... 57
10. Alat ... 58
11. Hewan ... 59
12. Berat badan, kadar kreatinin dan urea tikus kelompok perlakuan ... 60
13. Hasil uji ANOVA kadar kreatinin dan urea ... 62
14. Hasil uji Post Hoc Tukey HSD kadar kreatinin dan urea ... 63
BAB I PENDAHULUAN 1.1 Latar Belakang
Parasetamol merupakan salah satu senyawa kimia yang paling banyak digunakan sebagai obat demam. Paracetamol (acetaminophen) adalah salah satu obat yang paling banyak digunakan sebagai obat analgesik-antipiretik di seluruh dunia, dan di sebagian besar negara ia tersedia tanpa resep. Parasetamol mempunyai daya kerja analgetik dan antipiretik sama dengan asetosal, meskipun secara kimia tidak berkaitan (Mazer and Peronne, 2008).
Paracetamol adalah racun yang dikenal baik untuk hati dan jaringan ekstrahepatik. Acetaminophen menginduksi nekrosis hati telah dipelajari secara luas, tetapi manifestasi ekstrahepatik tidak dijelaskan secara komprehensif dalam literatur. Secara keseluruhan, insufisiensi ginjal terjadi pada sekitar 1-2% pasien dengan overdosis Paracetamol. Data terbatas dalam serangkaian kasus retrospektif pasien anak dengan keracunan asetaminofen menunjukkan bahwa nefrotoksisitas terkait mungkin lebih umum pada anak-anak dan remaja. Ketika terjadi hepatotoksisitas yang diinduksi acetaminophen yang signifikan, biasanya terjadi cedera ginjal (Mazer and Peronne, 2008).
Asetaminofen akut (parasetamol, N-asetil-p-aminofenol; APAP) dapat menyebabkan overdosis nekrosis hati dan ginjal yang berpotensi fatal manusia dan hewan percobaan. Langkah awal toksisitasnya adalah pembentukan reaktif N- acetyl-p-benzoquinone imine (NAPQI) oleh sitokorom P450 yang pada dosis terapi dihilangkan dengan konjugasi dengan gluthation solfidryle (GSH). Dosis tinggi asetaminofen menghasilkan penipisan seluler GSH yang membuatkan NAPQI mengikat ke seluler protein dan memulai peroksidasi lipid, menyebabkan
cedera ginjal. Rusak ginjal yang diinduksi asetaminofen juga bisa disebabkan oleh hati metabolit asetaminofen, khususnya GSH konjugat.
Oleh itu, terdapat beberapa tumbuhan yang dijadikan sebagai obat tradisional dapat menengani maslah ini. Salah satunya adalah herba puguntano.
Puguntano (Picria fel- terrae Lour Merr) dari family Scrophulariaceae yang tumbuh di wilayah Asia seperti China, India, Indonesia, Philippine, Malaysia dan Myanmar (Harahap, 2015). Di Philippine, rebusan tanaman ini digunakan sebagai obat penurunan panas, terutama untuk malaria. Di Indonesia sendiri khususnya oleh masyarakat Desa Tiga Lingga, Kabupaten Dairi, Provinsi Sumatera Utara secara tradisional digunakan sebagai obat untuk mengobati berbagai macam penyakit seperti rematik, asam urat dan diabetik (Juwita, 2009).
Suatu percobaan telah dilakukan oleh (Urip, 2017) bahwa herbal ini dapat digunakan untuk hepatoprotektif. Penelitian ini dapat memberikan hasil yang positif. Berdasarkan uraian di atas, peneliti tertarik untuk menguji efek ekstrak etanol herba puguntano untuk parameter ginjal pada tikus jantan yang diinduksi Parasetamol.
Dari parameter ginjal, terdapat 2 variabel terikat yang dapat diuji adalah serum kreatinin dan serum urea. Kreatinin adalah produk endogenus akhir dari metabolisme kreatin fosfat dimana kadarnya relatif lebih konstan. Ureum merupakan hasil utama dari metabolisme protein dalam tubuh. Kadar ureum dalam serum bergantung pada katabolisme (pemecahan) protein di dalam hati yang disekresikan ke dalam ginjal kemudian diekskresikan melalui urin, Kedua parameter ini menjadi salah satu parameter untuk menilai fungsi ginjal normal (Fuadi, 2009).
Flavonoid merupakan kandungan khas tumbuhan hijau dengan mengecualikan alga dan honrwort. Flavonoid sebenarnya terdapat pada semua bagian tumbuhan termasuk daun, akar, kayu, kulit, tepung sari, nektar, bunga, buah buni, dan biji. Hanya sedikit saja catatan yang melaporkan adanya flavonoid pada hewan (Markham, 1988). Sedangkan sifat kimia dari flavonoid adalah sedikit asam sehingga dapat larut dalam basa dan sebagai antioksidan, karena mampu menangkal radikal bebas (Ekawati, 2017). Antioksidan mempunyai peranan penting dalam proses biologi untuk mencegah kerusakan disebabkan radikal bebas. Antioksidan dapat diuji menggunakan senyawa DPPH (1,1- difenil2-pikrilhidrazil) (Widyawati, 2010). Beberapa golongan senyawa flavonoid diantaranya adalah katekin, flavon, flavanon, flavonol, kalkon, dan isoflavon (Zuhra, 2008).
Saat ini banyak dilakukan penelitian potensi tanaman obat yang memiliki efek yang sama dengan obat-obat sintetik, namun efek sampingnya lebih ringan. Katekin merupakan kerabat tanin terkondensasi yang juga sering disebut polifenol karena banyaknya gugus fungsi hidroksil yang dimilikinya (Yunarto, 2015). Katekin dapat digunakan untuk menguji kontrol positif. Katekin kaya dengan flavanoids. Katekin memiliki potensi untuk memperbaiki kerusakan hati dan ginjal seperti, memodifikasi gangguan metabolisme ginjal diinduksi oleh parasetamol.
1.2 Perumusan Masalah
Berdasarkan uraian pada latar belakang, maka perumusan masalah penelitian adalah apakah ekstrak etanol herba puguntano memiliki aktivitas terhadap parameter ginjal pada tikus jantan yang diinduksi Paracetamol?
1.3 Hipotesis
Berdasarkan perumusan masalah, maka hipotesis penelitian adalah ekstrak etanol herba puguntano mempunyai efek terhadap parameter ginjal pada tikus jantan yang diinduksi dengan Paracetamol.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui aktivitas ekstrak etanol herba puguntano terhadap parameter ginjal pada tikus jantan yang diinduksi paracetamol.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi tentang uji pada ginjal dari ekstrak etanol herba puguntano terhadap tikus yang diinduksi paracetamol sehingga menambah pengetahuan dan wawasan obat berkhasiat khusus ginjal alami yang berasal dari tumbuhan.
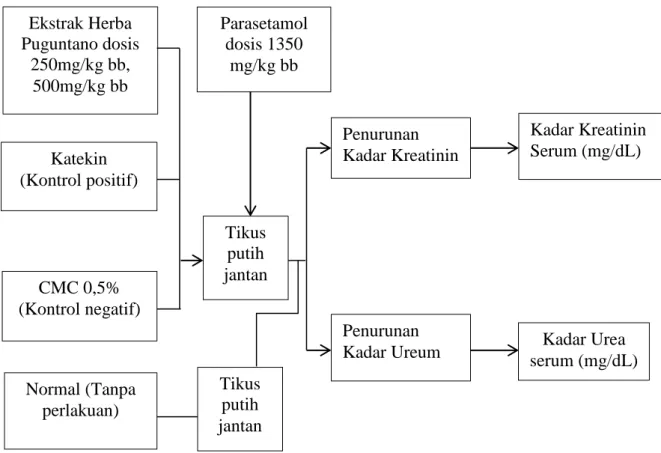
1.6 Kerangka Pikir Penelitian
Subjek yang digunakan dalam penelitian ini adalah tikus putih jantan. Untuk menginduksi kerusakan ginjal diberikan paracetamol dengan dosis 1,350 mg/kg bb selama 8 hari. Pada penelitian ini terdapat 2 variabel bebas yaitu EEHPT dosis 250 dan 500 mg/kg bb, sedangkan kelompok yang diberikan CMC 0,5% dan diberikan katekin serta kelompok yang tidak diinduksi dengan parasetamol sebagai pembanding normal. Variabel terikat dalam penelitian adalah
nefroprotektif pada tikus putih jantan. Kerangka pikir penelitian dapat dilihat pada (Gambar 1.1).
Variabel Bebas Variabel Terikat Parameter
Gambar 1.1 Kerangka pikir penelitian Ekstrak Herba
Puguntano dosis 250mg/kg bb,
500mg/kg bb
Tikus putih jantan Parasetamol
dosis 1350 mg/kg bb
CMC 0,5%
(Kontrol negatif) Katekin (Kontrol positif)
Normal (Tanpa perlakuan)
Kadar Kreatinin Serum (mg/dL)
Kadar Urea serum (mg/dL) Penurunan
Kadar Kreatinin
Penurunan Kadar Ureum Tikus
putih jantan
BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
Puguntano (Picria fel-terrae Lour) adalah salah satu tanaman familia Scrophulariaceae (Plant List). Tumbuh di wilayah Asia seperti Cina, Indonesia, India, Malaysia, Filipina, Vietnam dan Myanmar. Di Indonesia, tanaman ini tersebar di daerah Sumatera Jawa, Kalimantan dan Maluku (Harahap, 2015).
Puguntano merupakan tanaman berbatang basah dan berbaring (Agung dan Tinton, 2008). Puguntano tumbuh merambat. Tumbuhan puguntano memiliki tinggi 40 sampai 60cm. Batangnya dengan cabang-cabang yang ramping, jarang, tegak atau melata, berakar dibuku-buku dan berbulu halus (Prohati, 2017).
Tangkai daun tumbuh berhadapan, permukaan tidak berbulu, rata dan tipis.
Tumbuhan ini berbunga banyak terdapat pada aksil bertangkai pendek. Bagian tandan bunga nampak berwarna merah, panjang kelopak bunga sekitar 6 milimeter dan dua kali lipat dari panjang buah, luar sepal, meluas dan bulat telur dan berbentuk hati. Korola berwarna coklat kemerahan gelap. Buah adalah buah kapsul, bulat telur, pipih dengan panjan 3 samapi 4 milimeter, bivalved dengan beberapa biji. Biji berbentuk bulat dengan diameter sekitar 0,6 milimeter, memiliki 8 cekungan lonjong (Harahap, 2015).
Di beberapa daerah di Indonesia tanaman ini juga dikenal dengan nama puguntano (Dairi), kukurang (Maluku), tamah raheut (Sunda), dan papaita (Ternate). Di Malaysia dikenal pula dengan nama hempedu tanah, gelumak susu, rumput kerak nasi, di Laos dikenal dengan nama Kong sadden, sedangkan di Vietnam dikenal dengan nama thanh dan mau gau (Harahap, 2015).
Gambar 2.1 Tumbuhan Puguntano
Sistematika tumbuhan Puguntano menurut Herbarium Medanese (2019) adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermathophyta Kelas : Dicotyledonae Ordo : Lamiales
Famili : Scrophulariaceae Genus : Picria
Spesies : Picria fel-terrae Lour Nama Lokal : Puguntano
Bagian tanaman yang digunakan dalam pengobatan terutama adalah daun dan batang, walaupun kadang kala semua tanaman juga digunakan, ia terasa sangat pahit. Masyarakat menggunakannya secara tradisional sebagai pencabar, penurunan panas, diuretik, emanagogum dan meningkatkan pengeluaran keringat (Sudorific) (Harahap, 2015). Masyarakat menggunakan puguntano sebagai obat cacing, obat sakit perut, serta mengatasi kudis, memar, bengkak, batuk rejan dan sesak napas. Tanaman ini digunakan sebagai obat cacing untuk anak-anak, mengobati kolik dan malaria di Maluku dan Filipina, di Indonesia, tanaman ini
dapat menyembuhkan gatal-gatal dan penyakit kulit lainnya (Prohati, 2017). Daun tumbuhan dikunyah atau dibuat dalam bentuk sediaan dekoktum atau infusum digunakan obat sakit perut dan mengatur haid yang tidak teratur. Jus tumbuhan ini digunakan untuk menginduksi mual. Rebusan daun digunakan untuk mengobati sakit perut. Daun diaplikasikan dikepala jika sakit kepala, pendinginan kepala dan meredakan nyeri (Harahap, 2015). Puguntano digunakan sebagai obat malaria, diuretik, demam dan gangguan pada kulit (Perry, 1980). Puguntano digunakan untuk pengobatan demam, infeksi herpes, kanker dan inflamasi di Cina Selatan (Zhong dkk., 1970).
Beberapa penelitian menunjukkan penggunaan herba puguntano sebagai antidiabetes (Sitorus, 2012), antiasthma (Harahap, 2013), efek diuretik dan antihipertensi (Dalimunthe, 2016), analgetik (Zhou dkk, 2006), aktivitas antioksidan (Thuan, 2007), aktivitas antielmentik (Patilaya dan Husori, 2015).
Hasil penelitian yang telah dilakukan (Harahap, 2013) menunjukkan bahwa ekstrak daun puguntano mengandung flavanoid, glikosida, saponin, tanin, dan triterfenoid/steroid.
2.2 Uraian Kandungan Kimia 2.2.1 Flavonoid
Flavonoid merupakan senyawa polifenol yang berfungsi sebagai antioksidan, dimana antioksidan sendiri bermanfaat dalam mencegah kerusakan oksidatif yang disebabkan radikal bebas dan ROS sehingga mencegah terjadinya berbagai macam penyakit seperti penyakit kardiovaskular, jantung koroner, kanker, serta penuan dini. Flavonoid adalah fenil pengganti chromones (derivat
benzopyran) yang terdiri dari rangka dasar karbon-15 (C6-C3-C6), terdiri dari kroman (C6-C3) inti (cincin benzo A dan cincin heterosiklik C), juga berbagi oleh tokoferol, dengan fenil (cincin aromatik B) substitusi biasanya pada posisi-2.
Substitusi yang berbeda biasanya dapat terjadi pada cincin A dan B (Ramadhan, 2015).
2.2.2 Steroid/Triterpenoid
Steroid adalah triterpena yang kerangka dasarnya sistem cincin siklo pentana perhidrofenantren. Triterpenoid adalah senyawa yang kerangka karbonnya erasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu skualena. Uji yang biasa digunakan adalah reaksi Liebermann-Burchard yang dengan kebanyakan triterpen dan steroida memberikan warna hijau-biru. Senyawa triterpenoid dan steroid berstruktur siklik dengan berbagai gugus fungsi yang melekat padanya, seperti gugus alkohol aldaheid atau asam karboksilat. Mereka berupa senyawa tidak berwarna, berbentuk kristal, sering kali memiliki titik leleh tinggi dan bersifat aktif optik triterpenoid dapat dipilah menjadi sekurang-kurangnya empat golongan senyawa:
triterpena sebenarnya steroid, saponin dan glikosida jantung. Triterpena tertentu menjadi terkenal karena rasanya, terutama kepahitannya (Harborne, 1984).
2.2.3 Glikosida
Glikosida merupakan suatu senyawa yang bila dihidrolisis akan terurai menjadi gula (glikon) dan senyawa lain (aglikon dan genin). Glikosida dibagi atas 4 tipe berdasarkan atom penghubung glikon dan aglikon, yaitu:
a. Tipe O-heterosida dan O-glikosida, jika glikon dan aglikonnya dihubungkan oleh atom O, contohnya: salisin, glikosida flavonol.
b. Tipe S-heterosida atau S-glikosida, jika glikon dan aglikonnya dihubungkan oleh atom S, contohnya: sinigrin, glukosinat.
c. Tipe N-heterosida atau N-glikosida, jika glikon dan aglikonnya dihubungkan oleh atom N, contohnya: nikleosidin dan kronotosidin.
d. Tipe C-heterosida atau C-glikosida, jika glikon dan aglikonnya dihubungkan oleh atom C, contohnya: aloin, kardenolida dan viteskin (Farnsworth, 1966).
2.3 Parasetamol
Asetaminofen (parasetamol) merupakan metabolit fenasetin yang memiliki efek antipiretik yang sama dan telah digunakan sejak tahun 1893 (Wilmana, 2001;
Katzung, 1998). Obat ini adalah penghambat prostaglandin yang lemah pada jaringan perifer dan tidak memiliki efek antiinflamasi yang bermakna (Katzung, 1998). Efek antipiretik ditimbulkan oleh gugus aminobenzen (Wilmana, 2001).
Obat ini cukup aman untuk dosis terapi (1,2 g/hari untuk dewasa) (Katzung, 1998).
Dosis oral parasetamol sebesar 325-1000 mg (secara rektal 650 mg), dan dosis total harian tidak melebihi 4000 mg (Goodman dan Gilman, 2006). Menurut Food and Drug Administration (FDA), dosis aman penggunaan parasetamol untuk dewasa dan anak yang lebih dari 12 tahun adalah maksimal 4 gram/hari.
Konsumsi parasetamol dosis toksik sebesar 15 gram akan menyebabkan kerusakan hati dan kerusakan hati ini diiringi kerusakan organ lain, salah satu adalah ginjal berupa nekrosis tubulus akut (Rini dkk., 2013).
2.3.1 Farmakokinetik
Parasetamol dimetabolisme oleh hati melalui tiga cara, yaitu konjugasi glukuronida, konjugasi sulfat, dan oksidasi mikrosomal (Blakely dan McDonald,
1995). Dengan dosis terapi pada orang dewasa, metabolisme melalui glukuronidasi terjadi sekitar 63% dan sekitar 34% melalui sulfasi, yang tidak aktif secara farmakologis (Katzung, 2006; Mazer dan Perrone, 2008).
Reaksi tahap kedua terjadi juga melalui hepar. Sekitar 5% parasetamol dosis terapi akan dioksidasi oleh enzim P-450 menjadi reaksi intermediet yang sangat reaktif. N-asetil-p-benzoquinone imine (NAPQI) (Goodman dan Gilman, 2006; Mazer dan Perone, 2008). Hasil metabolit tersebut akan direduksi oleh glutation dan diekskresikan sebagai asam merkapturik. Hanya 1% dari obat yang diekskresi diubah dalam bentuk urin. Sekitar 90-100% obat ini mungkin ditemukan dalam urin selama hari pertama pada dosis terapeutik, terutama setelah konjugasi hepatik dengan asam glukoronat, asam sulfat atau sistein, sejumlah kecil metabolit hasil hidroksilasi dan deasetilasi juga terdeteksi (Goodman dan Gilman, 2006).
2.3.2 Efek Nefrotoksik
Efek toksik paracetamol terhadap ginjal dapat terjadi melalui mekanisme berikut:
a. Jalur sitokrom P-450
Efek ini berasal dari sintesis reaksi intermediet N-asetil-p-benzoquinone imine (NAPQI) oleh sitokrom P-450. Saat overdosis parasetamol, simpanan glukuronida dan sulfat di hati yang terbatas terpakai dengan cepat sehingga produksi NAPQI berlebihan (Gunawan, 2009; Mazer dan Perone, 2008).
Metabolit ini direduksi oleh glutation sampai simpanan glutation seluler berkurang sehingga akan mengikat sitosol protein di jaringan (Blakely dan McDonald, 1995). Hal ini mengganggu proses homeostasis dan enzim lysosomal yang melakukan apoptosis sehingga terjadi nekrosis jaringan yang berakhir
dengan disfungsi organ (Mazer dan Perone, 2008). Enzim mikrosom P-450 yang terlibat dalam proses ini ditemukan di hati dan ginjal, meskipun agak berbeda di setiap organ. Tingkat keparahan keruskaan ginjal dan kuantitas dari reaksi di jaringan dapat berkurang secara signifikan bila inhibitor dari sitokrom P-450 tersedai (Mazer dan Perone, 2008).
b. Prostaglandin
Kerusakan ginjal terjadi akibat efek inhibisi sintesis prostaglandin (PGI:2) oleh parasetamol . Prostaglandin berfungsi untuk mempertahankan aliran darah ginjal dan laju filtrasi glomerulus, khususnya pada keadaan kekurangan cairan, dengan cara vasodilatasi dan menurunkan resistensi pembuluh darah preglomerular. Penghambatan sintesis prostaglandin menyebabkan vasokonstriksi sehingga laju filtrasi glomerulus menurun. Hal ini mengakibatkan iskemia reversibel ginjal, penurunan tekanan hidrolik ginjal (faktor pendorong utama untuk filtrasi glomerulus) dan gagal ginjal akut (Rose, 2001).
Selain inhibisi sintesis prostaglandin (PGE2), mekanisme potensial lainnya berkaitan dengan prostaglandin endoperoxide synthetase (PGES), walaupun efeknya lebih substansial pada kejadian kronik daripada kejadian akut. PGES merupakan sebuah enzim pada ginjal yang mengaktifkan parasetamol menjadi metabolit toksik, yaitu NAPQI. Proses ini banyak terjadi di medulla ginjal, sedangkan sitokrom P-450 memainkan peran yang lebih penting di korteks ginjal (Mazer dan Perone, 2008). Titik akhir kedua jalur tetap sama, yaitu pembentukan metabolit toksik, kovalen mengikat protein seluler, diikuti dengan kematian sel dan nekrosis jaringan.
c. Enzim N-deacetylase
Enzim ini bekerja pada parasetamol atau NAPQI dengan melakukan deasetilasi substrat untuk p-aminophenol dan dikonversi menjadi radikal bebas yang dapat berkaitan dengan protein seluler (Mazer dan Perone, 2008). Proses ini mungkin terjadi bersama sistem enzim sitokrom P-450 dan telah diteliti pada hewan. Insufisiensi ginjal menunjukkan gejala berupa peningkatan BUN, serum kreatini dan serum potasium, penurunan jumlah urin dan berat badan (Ejaz, 2004).
Hal tersebut terjadi anatar 1 hingga 8 hari, walaupun sebagian besar kasus melaporkan anatar 2 hingga 5 hari setelah paparan. Serum kreatinin cenderung meningkat pada 7 hari setelah paparan dengan jarak 3-16 hari (Mazer dan Perone, 2008).
2.4 Ginjal
Ginjal merupakan salah satu organ tubuh yang memiliki fungsi ekskresi dan non-ekskresi. Beberapa fungsi ekskresi ginjal adalah mempertahankan osmolaritas plasma, mempertahankan kandungan air ekstraselular dan tekanan darah, serta mempertahankan derjat keasaman (pH). Fungsi non-ekskresi adalah mensintesis dan meregulasi aktivitas hormon, mensekresi renin, menghasilkan eritropoietin, dan mensekresikan prostalglandin (Callaghan, 2009).
Ginjal terletak pada dinding abdomen di rongga luar peritoneum, mulai dari vertebra torakalis kedua belas (T12) sampai vertebra lumbalis ketiga (L3).
Ginjal kanan lebih rendah dari ginjal kiri karena ada hatinya yang menduduki ruang lebih luas di bagian kanan. Setiap ginjal diselubungi oleh kapsul fibrosa dan dikelilingi oleh lemak perinefrik, selain itu diselubungi fasia perinefrik (perirenal) yang juga menyelubungi kelenjar adrenal. Sisi medial setiap ginjal merupakan daerah lekukan yang disebut hilum tempat lewatnya arteri dan vena renalis, cairan
limfatik, suplai saraf, dan ureter yang membawa urin akhir dari ginjal ke kandung kemih, untuk kemudian urin disimpan hingga dikosongkan. Jika ginjal dibagi dua dari atas ke bawah, dua daerah utama yaitu korteks di bagian luar dan medula di bagian dalam. Korteks terdiri dari glomerulus sedangkan medula terdiri dari tubulus yaitu tubulus proksimal, lengkung henle, tubulus distal, dan tubulus pengumpul (koligens). Ginjal memiliki beberapa fungsi yaitu pengaturan keseimbangan air dan elektrolit, ekskresi hasil buangan metabolik dan bahan kimia asing, pengaturan tekanan arteri, pengaturan asam dan basa, pengaturan produksi eritrosit, pengaturan produksi 1,2 dihidroksi Vitamin D, dan sintesis glukosa (Guyton dan Hall, 2006).
Mekanisme ekskresi yang dilakukan ginjal meliputi, darah memasuki glomerulus melalui arteriol aferen dan meninggalkannya melalui arteriol eferen.
Tekanan daarah di dalam glomerulus menyebabkan cairan difiltrasikan ke dalam kapsula bowman, kemudian mengalir ke dalam tubulus proksimal. Selanjutnya cairan mengalir ke lwngkung henle, setelah itu cairan mengalir melalui tubulus distal dan beraakhir di tubulus pengumpul yang mengumpulkan cairan dari beberapa nefron. Tubulus pengumpul bermuara ke pelvis ginjal, ketika flitrat glomerulus mengalir melalui tubulus tersebut, sebagian besar air dan berbagai zat yang terlarut di dalamnya direabsorbsi ke dalam kapiler peritubulus dan sejumlah kecil solut lain disekresikan ke dalam tubulus. Air dan solut yang tersisa menjadi urin (Guyton, 1990).
2.5 Kreatinin
Kreatinin adalah produk akhir kreatin fosfat otot, dan biasanya diproduksi dengan kadar yang konstan (tergantung massa otot). Sebagian besar kreatinin
dikeluarkan dari darah melalui ginjal, terutama melalui filtraasi glomerulus juga melalui sekresi tubulus proksimal. Jika filtrasi pada ginjal menurun, maka kadar kreatinin dalam darah akan meningkat. Setiap hati 1-2% kreatin diubah menjadi kreatinin. Serum kreatinin adalah indikator penting fisiologi ginjal karena kreatinin merupakan produk metabolisme otot yang diekskresi dalam bentuk tak berubah melalui ginjal (Howard, 1989). Struktur kimia kreatinin dapat dilihat pada Gambar 2.2.
Gambar 2.2 Struktur Kimia Kreatinin
2.6 Urea
Urea atau ureum adalah zat sisa katabolisme protein yang terbentuk di hati dan difiltrasi serta direabsorpsi di ginjal. Jika fungsi ginjal terganggu, maka urea akan terakumulasi dalam darah, kondisi ini disebut uremia. Keadaan ini dapat berakibat fatal. Untuk mengatasinya, maka penyebab kegagalan ginjal harus diatasi atau pasien harus menjalani dialisis untuk membuang urea dan produk sisa lainnya (Callaghan, 2009). Rumus struktur urea dapat dilihat pada gambar 2.3.
Gambar 2.3 Struktur Kimia Urea
2.7 Obat-Obatan Yang Digunakan Untuk Pengujian Parameter Ginjal
Obat-obatan dapat digunakan sebagai model pengujian parameter ginjal pada hewan percoban, berikut ini beberapa contoh obat yang sering digunakan.
a. Gliserol
Gagal ginjal akut yang diinduksi gliserol ditandai dengan mioglobinuria, nekrosis tubular dan meningkatnya vasokonstriksi pada ginjal. Mekanisme yang terlibat dalam gagal ginjal yang diinduksi gliserol meliputi cedera iskemik, nefrotoksisitas tubular disebabkan oleh mioglobin, dan pelepasan sitokin oleh ginjal setelah terjadi proses rhabdomyolisis. Sejumlah besar gangguan diketahui menyebabkan rhabdomyolisis termasuk disfungsi instrinik obat (termasuk trauma, luka bakar, penyakit otot instrinik, dan berlebihan melakukan aktivitas fisik), gangguan metabolisme, hipoksia, obat, racun, infeksi, suhu ekstrim, dan gangguan diopatik. Model untuk mempelajari bentuk gagal ginjal akut dapat dilakukan pada tikus setelah diinjeksi intramuskulargliserol 50% v/v. Dalam hal ini akan terjadi peningkatan hidrogen peroksida pada korteks ginjal tikus sehingga terjadi gagal ginjal akut. Pemberian gliserol adalah model percobaan nefrotoksisitas yang meniru gagal ginjal yang disebabkan oleh rhabdomyolisis (Singh dkk., 2012).
b. Gentamisin
Gentamisin digunakan untuk pengobatan infeksi yang disebabkan oleh bakteri gram negatif. Secara klinis, dosis tinggi gentamisin (2,5 mg/kg bb, im setiap 12 jam selam 7 hari) telah terbukti mengakibatkan nefrotoksisitas. Telah dilaporkan bahwa 30% dari pasien yang diberi gentamisin lebih dari 7 hari menunjukkan tanda-tanda nefrotoksisitas. Metode yang digunakan untuk menginduksi gagal ginjal pada tikus yaitu dengan memberikan secara i.p gentamisin sulfat dosi 100 mg/kg bb/hari selama 5-8 hari dan penilaian gagal
ginjal dinilai 24 jam setelah injeksi gentamisin terakhir diberikan. Administrasi gentamisin 100 mg/kg bb secara i.p selama 5 hari berturut-turut merangsang disfungsi ginjal sehingga penggunaan gentamisin lebih sering digunakan pada model hewan percobaan yang mengalami disfungsi ginjal yang disebabkan oleh antibiotika (Singh dkk., 2012).
c. Cisplatin
Cisplatin [cis-diaminedichloroplatinum (II)], obat anti kanker, secara luas digunakan untuk terapi kanker ovarium, karsinoma pada kepala dan leher, dan tumor sel. Nefrotoksisitas adalah keterbatasan utama dalam kemoterapi berbasis cisplatin. Pada manusia, dosis tinggi cisplatin (75 mg/m2) telah digunakan sebagai agen kemoterapi untuk kanker paru. Namun, pada dosis tersebut terjadi kerusakan ginjal yang signifikan pada pasien. Studi kklinis sebelumnya juga melaporkan bahwa cisplatin pada dosis 20 mg/m2/hari selama 5 hari menyebabkan perubahan kreatinin serum yang signifikan (Singh dkk., 2012).
Mekanisme yang berkontribusi terhadap disfungsi ginjal yang terpajam dengan cisplatin adalah berupa toksisitas tubular langsung dalam bentuk apoptosis dan nekrosis yang dimediasi melalui peradangan, ROS, kalsium yang berlebihan, aktivasi fosfolipase, penurunan kadar glutation, dan penghambatan fungsi rantai respirasi mitokondria. Telah dilaporkan bahwa pemberian 5ml/kg bb cisplatin (0.1% dalam larutan NaCl) secara i.p terjadi gagal ginjal akut pada tikus dalam waktu 72 jam setelah administrasi, sementara itu juga telah dilaporkan terjadinya gagal ginjal dengan dosis cisplatin yang sama setelah lima hari diinjeksi. Model gagal ginjal yang diinduksi cisplatin pada tikus terjadi pada dosis 12 mg/kg bb, i.p; 18mg/kg bb. i.p; 40 mg/kg bb i.p (Singh dkk., 2012).
d. Parasetamol
Parasetamol palinng banyak digunakan sebagai analgesik dan antipiretik yang aman pada dosis terapi. Namun, dapat mmenyebabkan nekrosis hari dan gagal ginjal pada manusia dan hewan percobaan dalam dosis tinggi. Pada manusia, parasetamol merupakan penyebab meningkatnya gagal ginjal pada praktek medis. Insufisiensi ginjal yang diinduksi parasetamol berkaitan dengan nekrosis tubular akut, peningkatan kadar kreatinin plasma dan penurunan glomerulus filtration rate (GFR). Stres oksidatif dilaporkan berperan dlam patogenesis kerusakan ginjal yang diinduksi parasetamol, dimediasi oleh metabolisme paracetamol melalui enzim sitokrom-P (CYP) 450 isoenzim CYP2E1 dan CYP3A4 baik di hati dan ginjal. Di jaringan ginjal, prostaglandin sintetase dan enzim N-deacetylase memainkan peran kunci dalam pembentukan radikal bebas dan metabolitnya. Pada dosis yang lebih tinggi, parasetamol didorong melalui jalur ini mengarah untuk peningkatan produksi metabolit oksigen/nitrogen reaktif, karena secara bertahap terjadi pengurangan GSH, pembentukan lipid peroksidatif menyebabkan kematian sel dan gagal ginjal.
(Singh dkk., 2012).
2.8 Metode Pengujian
Metode pengujian parameter kerusakan ginjal meliputi kadar kreatinin dan urea dalam darah menggunakan alat Cobas Integra 6000, dan pengujian metode darah lengkap menggunakan alat sysmex KX-2.
2.8.1 Metode Pengujian Kreatinin
Metode untuk mengukur kadar kreatinin menggunakan metode Jaffé.
Prinsipnya adalah reaksi antara kreatinin dan asam pikrat (kuning) dalam suasana basa (NaOH) membentuk senyawa kompleks janovski (kreatinin pikrat) berwarna
merah jingga. Intensitas warna yang terbentuk sebanding dengan konsentrasi kreatinin. Sampel terdiri dari darah dan urin. Sampel urin metupakan jumlah urin selama 24 jam. Sebelum pengukuran, sampel dideproteinasi terlebih dahulu.
Pengukuran konsentrasi kreatinin dilakukan dengan fotometer. Faktor kritis yang mempengaruhi adalah waktu reaksi, suhu reaksi (suhu pada waktu pembacaan kreatinin pikrat), derajat agitasi selama waktu reaksi, konsentrasi NaOH (basa), dan panjang gelombang (Owen dkk., 1954).
2.8.2 Metode Pengujian Urea
Metode pengujian urea dalam serum menggunakan metode bertholet. Urea dihidrolisis oleh urease untuk membentuk amonium karbonat. Kemudian, 2- ketoglutarat bereaksi dengan amonium dikatalisis oleh Glutamat dehidrogenase (GLDH) dan koenzim NADH, menghasilkan L-glutamat. Dalam reaksi ini, terjadi hidrolisis satu mol urea dan oksidasi dua mol NADH. Penurunan konsentrasi NADH berbanding lurus dengan konsentrasi urea dalam sampel. Sampel diukur pada absorbansi 340nm (utam) dan 700nm (sekunder) (Pocino dkk., 2015).
BAB III
METODE PENELITIAN
Metode yang digunakan dalam penelitian ini adalah metode eksperimental.
Tahap penelitian meliputi identifikasi tumbuhan, pengumpulan dan pengolahan simplisia, pembuatan simplisia, karakterisasi simplisia, pembuatan ekstrak secara maserasi, skrining fitokimia ekstrak dan pengujian kadar kreatinin dan urea pada serum tikus yang diinduksi dengan paracetamol. Rancangan ini dibuat sedemikian rupa untuk melengkapi penelitian sehingga jelas hal-hal yang diteliti terkait dengan pembuktian hipotesis yang dirumuskan pada peneltian ini sebagai jawaban sementara terhadap rumusan masalah. Data dianalisis statistika dengan menggunakan one way ANOVA (Analysis of variance) dan dilanjutkan dengan uji Tukey HSD dengan menggunakan program SPSS (Statistical Product and Service Solution).
3.1 Lokasi Penelitian
Penelitian dilakukan di Laboratorium Biologi Farmasi dan Laboratorium Farmakologi Fakultas Farmasi Universitas Sumatera Utara. Pengujian kadar kreatinin dan urea pada serum tikus dilakukan di Laboratorium Kesehatan Daerah Medan.
3.2 Alat dan Bahan 3.2.1 Alat
Alat-alat yang digunakan pada penelitian ini adalah: Alat gelas laboratorium, seperangkat alat rotary evaporator (Heidolph vv-2000), timbangan hewan, alat suntik, oral sonde, Cobas Integra 6000, object glass, cover glass,
kertas perkamen, krus porselin, mortir, neraca listrik, (Metller Toledo), spatula, seperangkat alat destilasi, lemari pengering, kandang metabolit
3.2.2 Bahan
Bahan tumbuhan yang digunakan pada penelitian ini adalah herba puguntano (Picria fel-terrae Merr). Bahan kimia yang digunakan antara lain parasetamol 1350mg/kg, etanol, katekin, carboxy methyl cellulose (CMC), larutan natrium hidroksida (NaOH), serta aquademineralisata. Bahan kimia yang digunakan kecuali dinyatakan lain adalah berkualitas pro analisa.
3.2.3 Hewan percobaan
Hewan yang digunakan dalam penelitian ini adalah tikus putih jantan, dengan berat 150 - 200 g sebanyak 15 ekor. Sebelum percobaan dimulai, terlebih dahulu tikus diaklimatisasi selama 1 minggu dengan perlakuan yang baik untuk menyesuaikan dengan lingkungannya.
3.3 Prosedur Kerja
Prosedur kerja dalam penelitian ini berupa pengumpulan dan pengolahan sampel, skrining fitokimia dan pembuatan ekstrak etanol herba puguntano.
3.3.1 Pengumpulan dan Pengolahan Sampel
Pengumpulan dan pengolahan sampel dimulai dengan pengumpulan bahan tumbuhan, identifikasi tumbuhan, pembuatan simplisia, pemeriksaan, dan karakterisasi simplisia dan ekstrak.
3.3.2 Identifikasi simplisia
Identifikasi tanaman herba puguntano dilakukan di Herbarium Medanense (MEDAN) Fakultas Matematika dan Ilmu Pengetahuan Alam USU.
3.3.3 Pembuatan simplisia
Herba puguntano di bersihkan, dicuci bersih dengan air mengalir, lalu ditimbang dan diperoleh berat basah. Kemudian di keringkan di dalam lemari pengering dengan suhu 30-40˚C hingga kering dan rapuh, kemudian ditimbang berat keringnya. Selanjutnya simplisia kering di blender sampai menjadi serbuk dan disimpan dalam wadah plastik sebelum dilakukan proses ekstraksi.
3.4 Pemeriksaan Karakteristik Simplisia Herba Puguntano
Pemeriksaan karakteristik simplisia meliputi pemeriksaan makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total, dan penetapan kadar abu tidak larut dalam asam.
3.4.1 Pemeriksaan makroskopik dan organoleptik
Pemeriksaan makroskopik dan organoleptik dilakukan dengan mengamati bentuk, bau, warna, dan rasa dari herba puguntano.
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik terhadap serbuk simplisia dilakukan dengan cara meneteskan kloralhidrat diatas kaca objek, kemudiaan diatasnya di letakkan serbuk simplisia, lalu ditutup dengan kaca penutup dan dilihat dibawah mikroskop.
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
i. Penjemuhan Toluen
Sebanyak 200 mL toluena dan 2 mL air suling dimasukkan ke dalam labu alas bulat, didestilasi selama 2 jam. Setelah itu toluen dibiarkan mendingin
selama 30 menit dan volume air pada tabung penerima dibaca dengan ketelitian 0,05 (WHO,1998)
ii. Penetapan kadar air
Sebanyak 5 g serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mendidih, kecepatan tetesan diatur 2 tetes per detik, sampai sebagian air terdestilasi, kemudian kecepatan destilasi dinaikkan hingga 4 tetes per detik.
Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen.
Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan dingin sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 mL. Selisih kedua volume air dibaca dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1998).
3.4.4 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk simplisia, dimaserasi selama 24 jam dalam 100 ml air kloroform (2,5 ml kloform dan air suling sampai 1 liter) dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata- rata yang telah ditara dan sisa dipanaskan pada suhu 105˚C sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995).
3.4.5 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk simplisia dimaserasi selama 24 jam dalam 100 ml etanol 96 % dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam kemudian disaring cepat untuk menghindari
penguapan etanol. Sejumlah 20 ml filtrat di uapkan sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan dan di tara. Sisa dipanaskan pada suhu105˚C sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96 persen dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995).
3.4.6 Penetapan kadar abu total
Sebanyak 2 g serbuk simplisia dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian ditarakan. Krus dipijar perlahan-lahan sampai arang habis, jika arang masih tidak dapat dihilangkan, ditambahkan air panas, saring melalui kertas saring bebas abu. Pijarkan sisa dan kertas saring dalam krus yang sama. Masukkan filtrat kedalam krus, uapkan, pijarkan hingga bobot tetap, timbang. Kadar abu dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995).
3.4.7 Penetapan kadar abu tidak larut dalam asam
Abu yang diperoleh dalam penetapan kadar abu didihkan dalam 25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam dikumpulkan disaring melalui kertas saring bebas abu, cuci dengan air panas. Di pijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan (Depkes, 1995).
3.5 Skrining Fitokimia Simplisia Herba Puguntano
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa golongan alkaloid, flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid.
3.5.1 Pemeriksaan alkaloid
Serbuk simplisia ditimbang sebanyak 0,5 g kemudian ditambahkan 1 ml asam klorida 2N dan 9 ml air suling, dipanaskan diatas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang diperoleh dipakai untuk test alkaloid.
Diambil 3 tabung reaksi, lalu kedalam nya dimasukkan 0,5 filtrat.
Pada masing-masing tabung reaksi :
a. Ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan menggumpal berwarna putih atau kuning
b. Ditambahkan 2 tetes pereaksi Bouchardat, akanterbentuk endapan berwarna coklat sampai kehitaman.
c. Ditambahkan 2 tetes pereaksi Dragendroff, akan terbentuk endapan berwarna coklat atau jingga kecoklatan.
Alkoloid positif jika terjadi endapan atau kekeruhan pada dua dari 3 percobaan diatas (Depkes, 1995).
3.5.2 Pemeriksaan flavonoid
Sebanyak 0,5 g simplisia disari dengan 10 ml etanol, lalu direfluks selama 10 menit. Kemudian disaring panas – panas melalui kertas saring kecil berlipat.
Filtrat diencerkan dengan 10 ml air. Setelah dingin ditambahkan 5 ml eter, dikocok hati-hati dan didiamkan. Lapisan metanol diambil, lalu diuapkan pada suhu 40 °C, sisanya dilarutkan dalam 5 ml etil asetat, disaring. Filtrat digunakan untuk uji flavonoida dengan cara sebagai berikut :
a. Sebanyak 1 ml larutan percobaan diuapkan hingga kering, sisa dilarutkan dalam 1 sampai 2 ml etanol 96%, lalu ditambahkan 0,5 g serbuk seng dan 2 ml asam klorida 2 N, didiamkan selama 1 menit. Ditambahkan 10 ml asam klorida pekat,
dalam waktu 2 sampai 5 menit terjadi warna merah intensif, menunjukkan adanya flavonoida.
b. Sebanyak 1 ml larutan percobaan diuapkan hingga kering, sisa dilarutkan dalam 1 ml etanol 96%, lalu ditambahkan 0,1 g serbuk magnesium dan 10 ml asam klorida pekat, terjadi warna merah jingga, menunjukkan adanya flavonoida (Depkes,1995).
3.5.3 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g, lalu disari dengan 30 ml campuran etanol 96 % garis air (7: 3) dan 10 ml asam klorida 2N, di refluks selama 2 jam, didinginkan dan disaring. Diambil 20 ml filtrat, ditambahkan 20 ml air suling dan 20 ml timbal (II) aseatat 0,4 M, dikocok, didiamkan selama 5 menit lalu disaring. Filtrat disari dengan 20 ml campuran kloforoform-isopropanol (3:2) sebanyak 3 kali pada kumpulan sari lapisan isopropanol diuapkan pada suhu tidak lebih dari 50˚C sisanya dilarutkan dengan 2 ml metanol untuk larutan percobaan.
0,1 ml larutan percobaan diuapkan diatas penangas air pada sisa ditambahkan 2 ml air dan 5 tetes Molish, kemudian ditambahkan hati-hati 2 ml hati-hati asam sulfat, terbentuk cincin berwarna ungu pada batas cairan, menunjukkan adanya ikatan gula (Depkes, 1995).
3.5.4 Pemeriksaan saponin
Serbuk simplisia ditimbang sebanyak 0,5 g dan dimasukkan kedalam tabung reaksi, lalu ditambahkan 10 ml air panas, didinginkan, kemudian dikocok kuat- kuat selama 10 menit jika terbentuk busa setinggi 1 – 10 cm yang stabil tidak kurang dari 10 menit dan buih tidak hilang dengan penambahan 1 tetes asam klorida 2N menunjukkan adanya saponin (Depkes,1995).
3.5.5 Pemeriksaan tanin
Serbuk simplisia ditimbang sebanyak 1 g, didihkan selama 3 menit dalam air suling lalu didinginkan dan disaring. Pada filtrat ditambahkan 1 – 2 tetes pereaksi besi (III) klorida 1% b/v. Jika terjadi warna biru kehitaman atau hijau kehitaman menunjukkan adanya tanin atau (Farnsworth, 1966).
3.5.6 Pemeriksaan steroid/triterpenoid
Sebanyak 1g serbuk simplisia dimaserasi dengan eter 20 ml selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 20 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat (pereaksi Lieberman Bourchard), diteteskan pada saat akan mereaksikan sampel uji. Apabila terbentuk warna biru atau biru hijau menunjukkan adanya steroida sedangkan warna merah, merah muda atau ungu menunjukkan adanya triterpenoid (Harborne, 1996).
3.6 Pembuatan Ekstrak Etanol Herba Puguntano
Pembuatan ekstrak herba puguntano dilakukan secara perkolasi. Sebanyak 500g serbuk simplisia dibasahi dengan 5 bagian (250ml) etanol teknis (yang telah didestilasi) dan dibiarkan selama 3 jam lalu dimasukkan ke dalam alat perkolator, lalu dituang cairan penyari etanol sampai semua simplisia terendam dan terdapat selapis cairan penyari di atasnya, bagan atas tabung perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam, kemudian kran dibuka dan dibiarkan tetesan ekstrak mengalir dengan kecepatan perkolat diatur 1ml/menit, perkolat ditampung. Tambahkan berulang-ulang cairan penyari diatas simplisia, sehingga didapatkan 4 liter (80 bagian) perkolat. Perkolasi dihentikan pada saat 500mg perkolat yang ditampung kemudian diuapkan dan tidak meninggalkan sisa.
Tambahkan cairan penyari secukupnya hingga diperoleh 5 liter (100 bagian)
perkolat. Dipindahkan perkolat kedalam bejana tertutup, biarkan selama 2 hari di tempat sejuk, terlindung dari cahaya, dienaptuangkan atau disaring. Perkolat yang diperoleh kemudian dipekatkan dengan alat rotary evaporator hingga diperoleh ekstrak kental herba puguntano.
3.7 Pembuatan Larutan Uji
Pembuatan larutan uji meliputi pembuatan suspensi CMC 0,5% dan pembuatan suspensi ekstrak etanol herba puguntano.
3.7.1 Pembuatan suspensi Na-CMC 0,5 %
Sebanyak 0,5 g Na-CMC ditaburkan dalam lumpang yang berisi air suling panas. Didiamkan selama 15 menit lalu digerus hingga diperoleh massa yang transparan, lalu digerus sampai homogen, diencerkan dengan air suling,dihomogenkan dan dimasukkan ke labu tentukur 100 ml, dicukupkan volumenya dengan air suling hingga 100 ml.
3.7.2 Pembuatan suspensi ekstrak etanol herba puguntano (dosis orientasi 250, 500 mg/kg bb)
Ditimbang masing-masing ekstrak sebanyak (dosis orientasi 250, 500 mg) ekstrak etanol herba puguntano kemudian dimasukkan ke dalam lumpang, ditambahkan sedikit demi sedikit suspensi Na CMC 0,5% digerus sampai homogen. Dimasukkan ke dalam labu tentukur 10 mL, dicukupkan sampai garis tanda.
3.7.3 Penyiapan hewan percobaan
Hewan percobaan yang digunakan adalah tikus jantan Galur Wistar dengan berat badan 150-200 g. Hewan diperoleh dari Laboratorium Farmakologi, Fakultas Farmasi Universitas Sumatera Utara.
Tikus berikut dibagi 5 kelompok, setiap kelompok terdiri dari 3 ekor tikus yang diberi perlakuan berbeda-beda yaitu:
Kelompok 1: kontrol normal, hewan uji diberikan makanan dan minuman secara ad libitum
Kelompok 2: kontrol positif, hewan uji diberikan katekin dosis 2 mg/kg bb sekali sehari selama 8 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1350 mg/kg bb 1 jam setelah pemberian suspensi katekin pada hari ke-8. Makanan dan minuman diberikan secara ad libitum
Kelompok 3: kontrol negatif, hewan uji diberikan suspense CMC Na 0,5%
sekalisehari selama 8 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1350 mg/kg bb 1 jam setelah pemberian suspensi CMC Na 0,5% pada hari ke-8. Makanan dan minuman diberikan secara ad libitum
Kelompok 4: Hewan uji diberikan EEHPT dosis 250 mg/kg bb sekali sehari secara oral selama 8 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1350 mg/kg bb 1 jam setelah pemberian ekstrak pada hari ke-8. Makanan dan minuman diberikan secara ad libitum
Kelompok 5: Hewan uji diberikan EEHPT dosis 500 mg/kg bb sekali sehari secara oral selama 8 hari berturut-turut diikuti pemberian parasetamol dosis tunggal 1350 mg/kg bb 1 jam setelah pemberian ekstrak pada hari ke-8. Makanan dan minuman diberikan secara ad libitum
3.8 Pengukuran Kadar Kreatinin dan Urea Serum
Pengambilan darah dilakukan dengan cara penarikan langsung dari vena cava inferior sebanyak 2ml. Dimasukkan ke dalam tube dan didiamkan ± 20 menit. Kemudian darah disentrifuge dengan kecepatan 3000 rpm selama 15 menit untuk mendapatkan serum darah tikus.
3.8.1 Pengukuran kadar kreatinin serum
Pengukuran kadar kreatinin serum menggunakan Cobas Integra 6000 dengan metode creatinine jaffe. Serum ditambahkan NaOH lalu ditambahkan reagensia asam pikrat. Pada larutan basa, kreatinin akan membentuk kompleks yang berwarna kuning orange dengan asam pikrat. Setelah 1-2 menit diukur serapan pada panjang gelombang 552nm (Absorban 1), 2 menit kemudian diukur lagi serapan pada panjang gelombang 659nm (Asorban 2).
3.8.2 Pengukuran kadar urea serum
Pengukuran kadar urea serum menggunakan Cobas Integra 6000 dengan metode Urease-GLDH (Glutamat dehidrogenase). Serum ditambahkan buffer dan enzim urease maka urea yang terdapat dalam serum akan terhidrolisis membentuk CO2 dan amonia. Lalu amonia akan bereaksi dengan ketoglutarat dan NADH dan enzim glutamat dehidrogenase (GLDH). Setelah 1-2 menit diukur serapan pada panjang gelombang 700nm (Absrban 1), 2 menit kemudian diukur lagi serapan pada panjang gelombang 340nm (Absorban 2).
3.9 Analisis Data
Data hasil penelitian dianalisis menggunakan program SPSS 17. Data hasil penelitian ditentukan homogenitas dan normalitasnya untuk menentukan analisis statistik yang digunakan. Data dianalisis menggunakan uji ANOVA untuk
menentukan perbedaan rata-rata diantara kelompok. Jika terdapat perbedaan, dilanjutkan dengan uji Post Hoc Tukey HSD untuk melihat perbedaan nyata antara kelompok perlakuan.
BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil Identifikasi Tumbuhan
Identifikasi tanaman herba puguntano dilakukan di Herbarium Medanense (MEDA) Fakultas Matematika dan Ilmu Pengetahuan Alam USU adalah Picria fel-terrae, sinonim dengan Curanga fel-terrae, suku Scrophulariaceae. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1.
4.2 Karakterisasi Simplisia
Karakterisasi simplisia merupakan uji standarisasi mutu simplisi terhadap persyaratan sebagai bahan obat dan menjadi penetapan nilai untuk berbagai parameter produk. Parameter standarisasi meliputi uji makroskopik, mikroskopik, kadar air, kadar sari larut dalam air, kadar sari larut dalam etanol, kadar abu total dan kadar abu tidak larut asam (Depkes, 2000).
Pemeriksaan makroskopik bertujuan untuk mengetahui ciri-ciri fisik simplisia suatu tumbuhan, seperti bentuk, bau dan rasa. Hasil pemeriksaan makroskopik simplisia herba puguntano daun berwarna hijau, berbentuk bulat telur, tepi daun beringgit, permukaan daun kasar dan berbulu, batang berwarna coklat muda, batang bercabang tunggal.
Pemeriksaan mikroskopik bertujuan untuk mengetahui struktur anatomi suatu simplisia tumbuhan. Hasil pemeriksaan karakteristik serbuk simplisia secara mikroskopik terlihat adanya fragmen pengenal berupa trichoma, berkas pembuluh, kristal kalsium oksalat bentuk prisrna dan stomata dengan tipe diasitik dan anomositik.
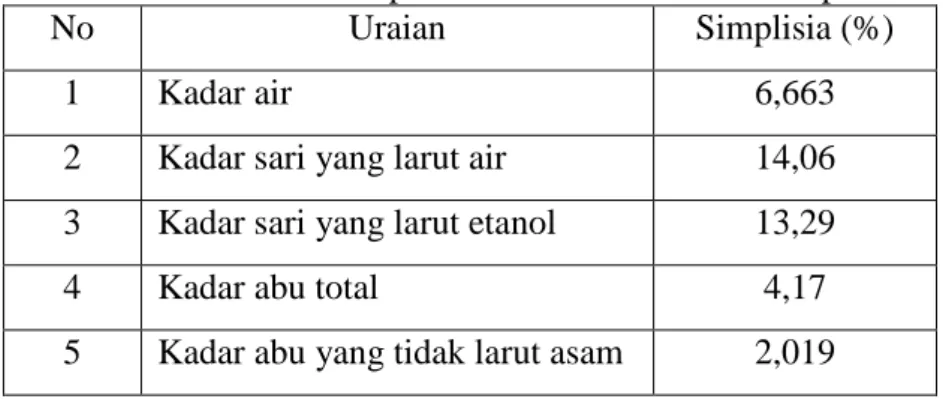
Hasil pemeriksaan kadar air, kadar sari larut air, kadar sari larut etanol, kadar abu total dan kadar abu yang tidak larut asam pada serbuk simplisia herba puguntano terlihat pada Tabel 4.1.
Tabel 4.1 Hasil pemeriksaan karakterisasi simplisia
No Uraian Simplisia (%)
1 Kadar air 6,663
2 Kadar sari yang larut air 14,06 3 Kadar sari yang larut etanol 13,29
4 Kadar abu total 4,17
5 Kadar abu yang tidak larut asam 2,019
Pengeringan simplisia dilakukan untuk mendapatkan simplisia yang tidak mudah msak sehingga dapat disimpan dalam jangka waktu yang lama. Penurunan mutu atau kerusakan simplisia dapat dicegah dengan mengurangi kadar air dan menghentikan reaksi enzimatik. Reaksi enzimatik tidak berlangsung lagi jika kadar air dalam simplisia kurang dari 10%.
Selain itu, penetapan kadar air dilakukan untuk memberikan batasan minimal kandungan air yang masih dapat ditolerir di dalam simplisia. Rata-rata hasil penetapan kadar air simplisia herba puguntano diperoleh kadar 6,663%.
Berdasarkan standarisasi kadar air simplisia secara umum memenuhi persyaratan yaitu tidak melebihi 10% untuk simplisia (Voight, 1994). Kadar air yang tinggi pada simplisia menyebabkan ketidakstabilan sediaan obat karena air merupakan media pertumbuhan bagi bakteri, jamur dan serangga. Hal ini mengakibatkan bahan aktif yang terkandung didalamnya dapat terurai (Trease dan Evans, 1983;
WHO, 1992).
Penetapan kadar sari dilakukan menggunakan pelarut air. Penetapan kadar sari larut air adalah untuk mengetahui kadar senyawa kimia bersifat polar yang
terkandung di dalam simplisia, baik senyawa polar maupun non polar.
Berdasarkan Tabel 4.1, rat-rata kadar sari yang larut air diperoleh sebesar 14,06%.
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan mineral internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri, dan eksternal (abu non-fisiologis) yang merupakan residu dari luar seperti pasir dan tanah yang terdapat di dalam sampel (Ditjen POM 2000; WHO, 1992). Kadar abu tidak larut asam untuk menunjukkan jumlah silikat, khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam asam klorida (WHO, 1992). Rata-rata hasil penetapan kadar abu total dan kadar abu tidak larut asam dari serbuk simplisia adalah 4,17%. Kadar logam berat yang tinggi dapat membahayakan kesehatan, oleh sebab itu periu dilakukan penetapan kadar abu total dan kadar abu tidak larut asam untuk memberikan jaminan bahwa ekstrak tidak mengandung logam berat tertentu melebihi nilai yang ditetapkan karena berbahaya (toksik) bagi kesehatan.
4.3 Hasil Skrining Fitokimia Simplisia
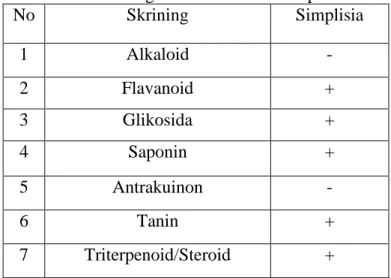
Skrining fitokimia terhadap serbuk simplisia, ekstrak etanol herba puguntano dilakukan untuk mendapatkan informasi golongan senyawa metabolit sekunder yang terdapat di dalamnya. Pemeriksaan yang dilakukan terhadap simplisia adalah pemeriksaan golongan senyawa alkaloid, flavonoid, steroid triterpenoid, tanin, saponin, dan glikosida (Tabel 4.2).
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia herba puguntano
No Skrining Simplisia
1 Alkaloid -
2 Flavanoid +
3 Glikosida +
4 Saponin +
5 Antrakuinon -
6 Tanin +
7 Triterpenoid/Steroid +
Keterangan: (+) = mengandung golongan senyawa, (-) = tidak mengandung golongan senyawa
Hasi1 skrining menunjukan bahwa serbuk simplisia herba puguntano mengandung senyawa golongan flavonoid, glikosida, saponin, tanin, dan steroid/triterpenoid. Hal ini sesuai dengan hasi1 skrining yang dilakukan oleh Sitorus, 2014.
4.4 Hasil Pengukuran Parameter Ginjal
Hasil pengukuran parameter ginjal meliputi kadar kreatinin dan urea dalam serum tikus percobaan.
4.4.1 Hasil pengukuran parameter kreatinin
Kreatinin merupakan hasil metabolism kreatin dan fosfotkreatin disintesis terutama dalam otot rangka, hati, pancreas dan ginjal. Umumnya kecepatan sintesis kreatinin relatif konstan dan kadar dalam serum menggambarkan kecepatan eliminasi ginjal (Guyton, 2006). Serum kreatinin adalah indikator penting dari kesehatan ginjal karena kreatinin merupakan produk metabolisme otot yang diekskresi dalam bentuk tak berubah melalui ginjal (Howard, 1989).
Hasil pengukuran kadar kreatinin serum tikus setelah diinduksi parasetamol ditunjukkan pada Tabel 4.3 dan Gambar 4.1.
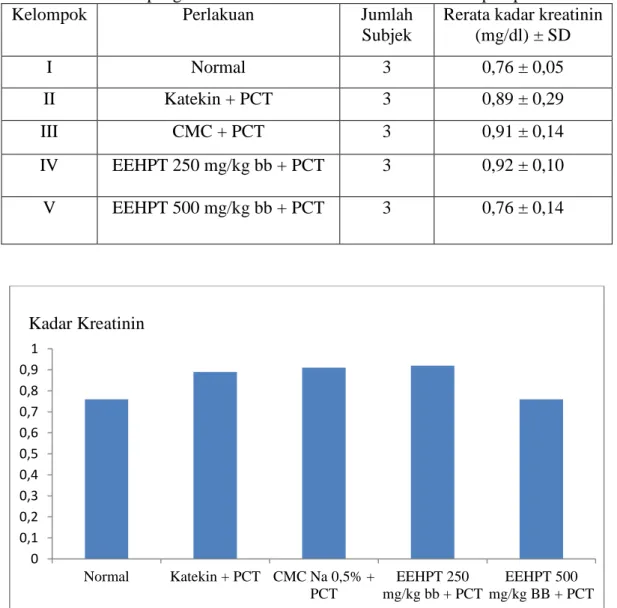
Tabel 4.3 Hasil pengukuran kadar kreatinin serum tikus kelompok perlakuan
Kelompok Perlakuan Jumlah
Subjek
Rerata kadar kreatinin (mg/dl) ± SD
I Normal 3 0,76 ± 0,05
II Katekin + PCT 3 0,89 ± 0,29
III CMC + PCT 3 0,91 ± 0,14
IV EEHPT 250 mg/kg bb + PCT 3 0,92 ± 0,10
V EEHPT 500 mg/kg bb + PCT 3 0,76 ± 0,14
Gambar 4.1 Grafik hasil pengukuran kadar kreatinin serum tikus kelompok perlakuan
Berdasarkan hasil pengujian didapatkan nilai kadar kreatinin serum tikus yang telah dibagi menjadi beberapa kelompok perlakuan data yang dapat diuji menggunakan program SPSS untuk mengetahui signifikansinya jika dibandingkan dengan kelompok normal, kelompok kontrol positif pemberian Katekin dan kelompok kontrol negatif pemberian CMC. Berdasarkan data di atas tidak
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 1
Normal Katekin + PCT CMC Na 0,5% + PCT
EEHPT 250 mg/kg bb + PCT
EEHPT 500 mg/kg BB + PCT
Kadar Kreatinin (mg/dL)
terdapat perbedaan yang signifikan antara kelompok normal dan kelompok kontrol negatif.
Pada kelompok perlakuan dosis EEHPT 250 mg/kg bb dan EEHPT 500 mg/kg menunjukkan nilai kreatinin yang tidak berbeda secara signifikan terhadap kelompok normal. Ini disebabkan, tikus dialami dehidrasi pada hari ke 8.
Dehidrasi umumnya menyebabkan kadar urea naik lebih dari kadar kreatinin. Ini menyebabkan rasio urea terhadap kreatinin yang tinggi. Penyakit ginjal atau penyumbatan aliran urin dari ginjal menyebabkan tingkat urea dan kreatinin meningkat. Kadar kreatinin serum tinggi berarti ginjalnya tidak bekerja dengan baik. Kadar kreatinin dapat meningkat sementara jika mengalami dehidrasi, memiliki volume darah rendah, makan banyak daging atau minum obat-obatan tertentu. Suplemen makanan kreatinin dapat memiliki efek yang sama (Mayoclinic, 2018). Oleh itu, terdapatnya hasil yang abnormal manakala nilai kadar urea tikus mempunyai perbedaan yang signifikan. Dari hasil data yang diatas, kelompok pemberian EEHPT 250 mg/kg bb dan EEHPT 500 mg/kg tidak memiliki aktivitas terhadap gambaran parameter serum ginjal jika ditinjau dari kadar kreatinin serum tikus.
4.4.2 Hasil pengukuran kadar urea
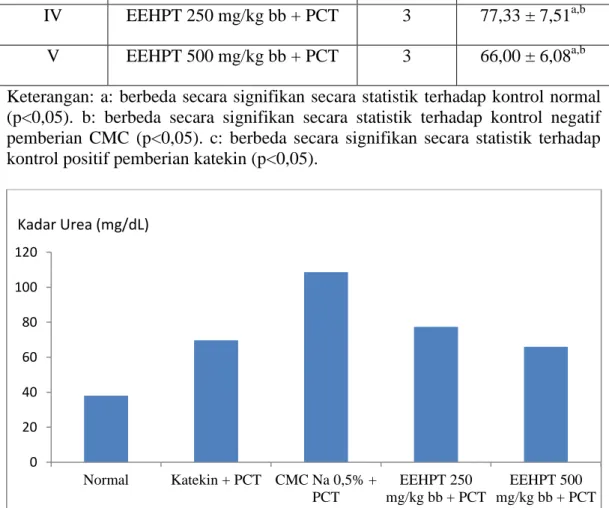
Urea merupakan hasil metabolism protein di hati yang dipengaruhi oleh asupan protein dan fungsi hati. Gangguan fungsi ginjal dapat terlihat dengan menurunnya laju filtrasi glomerulus yang mengakibatkan peningkatan kadar urea dalam darah (Lorraine dan Sylvia, 2002). Hasil pengukuran urea dilakukan perhitungan persen penurunannya terhadap kelompok kontrol negatif dan kelompok kontrol positif yang ditunjukkan pada Tabel 4.4 dan Gambar 4.2.
Tabel 4.4 Hasil pengukuran kadar urea serum tikus kelompok perlakuan
Kelompok Perlakuan Jumlah
Subjek
Rerata kadar urea (mg/dl) ± SD
I Normal 3 38,00 ± 3,61b
II Katekin + PCT 3 69,67 ± 4,51b
III CMC Na 0,5% + PCT 3 108,67 ± 4,73a,c
IV EEHPT 250 mg/kg bb + PCT 3 77,33 ± 7,51a,b
V EEHPT 500 mg/kg bb + PCT 3 66,00 ± 6,08a,b
Keterangan: a: berbeda secara signifikan secara statistik terhadap kontrol normal (p<0,05). b: berbeda secara signifikan secara statistik terhadap kontrol negatif pemberian CMC (p<0,05). c: berbeda secara signifikan secara statistik terhadap kontrol positif pemberian katekin (p<0,05).
Gambar 4.2 Grafik hasil pengukuran kadar urea serum tikus kelompok perlakuan Keterangan: a: berbeda secara signifikan secara statistik terhadap kontrol normal (p<0,05). b: berbeda secara signifikan secara statistik terhadap kontrol negatif pemberian CMC (p<0,05). c: berbeda secara signifikan secara statistik terhadap kontrol positif pemberian katekin (p<0,05).
Berdasarkan hasil pengujian didapatkan nilai aktivitas urea serum tikus yang telah dibagi menjadi beberapa kelompok perlakuan, data yang dapat diuji menggunakan program SPSS untuk mengetahui signifikansinya jika dibandingkan dengan kelompok normal, kelompok kontrol negatif pemberian CMC dan
0 20 40 60 80 100 120
Normal Katekin + PCT CMC Na 0,5% + PCT
EEHPT 250 mg/kg bb + PCT
EEHPT 500 mg/kg bb + PCT Kadar Urea (mg/dL)