PEMBUATAN DAN ANALISIS KARAKTERISTIK GELATIN DARI TULANG IKAN TUNA (Thunnus albacares)
Oleh:
MUSFIQ AMIRULDIN F 34103109
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
BOGOR
“Bacalah!! dengan menyebut nama Tuhanmu, Yang menciptakan. Dia telah menciptakan manusia dari segumpal darah. Bacalah!!! Dan Tuhanmu-lah yang Maha Pemurah.
Yang telah mengajar (manusia) dengan perantaraan kalam. Dia telah mengajarkan kepada manusia apa yang tidak diketahuinya” (QS. Al ‘Alaq: 1 – 5)
“Sebuah karya untuk kedua orangtuaku dan
orang-orang yang menyayangiku!!!”
Musfiq Amiruldin. F 34103109. Pembuatan dan Analisis Karakteristik Gelatin Dari Tulang Ikan Tuna (Thunnus albacares). Di bawah bimbingan Prof. Dr. Ir. E.
Gumbira Said, MA Dev dan Drs. Tazwir. 2007
RINGKASAN
Gelatin merupakan suatu jenis protein yang diekstraksi dari jaringan kolagen hewan. Limbah tulang ikan tuna (Thunnus albacares) selama ini belum dimanfaatkan secara optimal, padahal di dalam tulang ikan mengandung kolagen yang dapat diekstraksi menjadi gelatin. Penelitian ini bertujuan untuk mendapatkan teknik ekstraksi gelatin dari tulang ikan tuna dan mempelajari pengaruh perendaman tulang dengan konsentrasi basa (NaOH) yang berbeda sebelum perendaman asam (HCl) terhadap rendemen, pH, viskositas, dan kekuatan gel gelatin tulang ikan tuna serta mengkaji karakteristik gelatin dari tulang ikan tuna yang meliputi sifat fisik, sifat kimia, dan kandungan mikrobiologi.
Proses penghilangan lemak dan protein non kolagen pada tulang ikan dapat menaikkan mutu gelatin. Pembuatan gelatin dari tulang ikan yang paling baik menggunakan asam klorida (HCl). Rancangan percobaan yang digunakan adalah rancangan acak lengkap dengan tiga perlakuan perendaman tulang sebelum perendaman asam klorida (HCl) yaitu tanpa perendaman NaOH, perendaman NaOH 0.4% dan 0.8%. Pengamatan yang dilakukan meliputi rendemen, pH, viskositas, dan kekuatan gel gelatin.
Gelatin tulang ikan tuna yang dihasilkan pada penelitian ini memiliki rendemen berkisar antara 5.76 – 8.37%, pH berkisar antara 4.15 – 5.54, viskositas berkisar antara 3.23 – 5.57 cP, dan kekuatan gel berkisar antara 104.6 – 151.8 gr bloom. Hasil analisa sidik ragam menunjukkan bahwa perbedaan konsentrasi NaOH berpengaruh nyata terhadap rendemen, pH, viskositas, dan kekuatan gel gelatin tulang ikan tuna yang dihasilkan. Dari Hasil Uji Duncan menunjukkan bahwa perlakuan sebelum perendaman HCl yang menghasilkan gelatin terbaik adalah perendaman tulang dengan NaOH 0.4% sebelum perendaman HCl.
Karakteristik fisikokimia gelatin dari perlakuan terbaik (perendaman tulang dengan NaOH 0.4% sebelum perendaman HCl) dihasilkan kadar air 6.08%, kadar abu 1.02%, kadar protein 88.53%, kadar lemak 1.02%, kekuatan gel 151.8 gr bloom, viskositas 5.57 cP, pH 5.01, titik gel 9.000C, titik leleh 25.300C, titik isoelektrik 7.67, derajat putih 33.7%, kandungan Pb 0.55 ppm, kandungan Hg tidak terdeteksi, komposisi asam amino glisin 18.703%, prolin 10.65% dan hidroksiprolin 8.22%, total mikroba 4,5 x 104 unit koloni/gram, kandungan E.coli dan Salmonella negatif.
Musfiq Amiruldin. F 34103109. Processing and Characteristic Analysis of Gelatin from Yellow Fin Tuna (Thunnus albacares) Bones. Supervised By Prof.
Dr. Ir. E. Gumbira Said, MA Dev and Drs. Tazwir. 2007
SUMMARY
Gelatin is one of protein extraction from animal kolagen tissues. The waste of Yellow Fin Tuna (Thunnus albacares) bones has not been used optimally, in fact in fish bones contain collagen which can be extracted for gelatin. This research was aimed to get extraction method of gelatin from Yellow Fin Tuna bones, and to know the influences of different concentration alkali (NaOH) before soaking in clorid acid (HCl) to yield, pH, viscocity, and gel strength gelatin from Yellow Fin Tuna, also to know the characteristic of the physical, chemical property and microbiology of gelatin.
Degreasing and lost non collagen protein process from fish bone can be to increase gelatin quality. The best gelatin process from fish bone using clorid acid (HCl). Experimental design used complete random design with three treatments are without soaking in NaOH, soaking in 0.4% and 0.8% NaOH before soaking in clorid acid (HCl). Observation in this research contain yield, pH, viscosity, and gel strength of gelatin.
Gelatin as the result of this researce has yield ranging from 5.76% to 8.37%, pH 4.15 – 5.54, viscocity is 3.23 cP until 5.57 cP, and gel strength ranging from 104.6 gr bloom to 151.8 gr bloom. From ANOVA analysis showed different concentration NaOH significantly influences to yield, pH, viscocity, and gel strength of gelatin. Based on Duncan test result showed that the best gelatin resulted from soaking in 0.4% NaOH before soaking in clorid acid (HCl).
The fisicochemistry characteristic of gelatin for the best treatment (0.4%
NaOH) resulted 6.08% of moisture content; 1.02% of ash content; 88.53% of protein content; 1.02% of lipid content; 151.8 gr bloom of gel strength; 5.57 cP of viscocity; pH 5.01; 9.000C of gelling point; 25.300C of melting point; 7.67 of isoelectric point; 33.7% of white degree; 0.55 ppm of Pb content; undetected of Hg content; 18.703% of glisine amino acid, 10.65% of proline and 8.22% of hidroksiproline; 4,5 x 104 unite coloni/gram of total microbe, negative for E.coli and Salmonella content.
PEMBUATAN DAN ANALISIS KARAKTERISTIK GELATIN DARI TULANG IKAN TUNA (Thunnus albacares)
Oleh:
MUSFIQ AMIRULDIN F 34103109
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
2007
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
BOGOR
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PEMBUATAN DAN ANALISIS KARAKTERISTIK GELATIN DARI TULANG IKAN TUNA (Thunnus albacares)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh:
MUSFIQ AMIRULDIN F 34103109
Lahir di Jakarta, 11 Februari 1985 Tanggal lulus: 8 Agustus 2007
Menyetujui, Bogor, 8 Agustus 2007
Prof. Dr. Ir. E. Gumbira Said, MA Dev Drs. Tazwir Dosen Pembimbing I Pembimbing II
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi yang berjudul
“Pembuatan dan Analisis Karakteristik Gelatin Dari Tulang Ikan Tuna (Thunnus albacares)” merupakan hasil karya asli saya sendiri dengan arahan dosen pembimbing akademik kecuali yang jelas ditunjukkan rujukannya.
Bogor, 8 Agustus 2007 Yang Membuat Pernyataan
MUSFIQ AMIRULDIN F34103109
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 11 Februari 1985 sebagai anak pertama dari tiga bersaudara dari pasangan Abdullah dan Mursinah. Penulis menempuh pendidikan di SDN 05 Meruya Utara (1991-1997), SLTPN 134 Jakarta (1997-2000), SMUN 65 Jakarta (2000-2003). Pada akhir pendidikan SMU, penulis berkesempatan untuk mengikuti Seleksi Penerimaan Mahasiswa Baru (SPMB) dan pada tahun 2003 penulis menjadi mahasiswa di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Penulis melakukan Praktek Lapangan di PT Indofood Sukses Makmur Bogasari Flour Mills, Jakarta dengan judul “ Mempelajari Proses Produksi Tepung Terigu”. Penulis menulis skripsi berjudul “Pembuatan dan Analisis Karakteristik Gelatin Dari Tulang Ikan Tuna (Thunnus albacares)”
bekerjasama dengan Balai Besar Riset Pengolahan Produk Dan Bioteknologi Kelautan Dan Perikanan, Slipi, Jakarta.
Judul skripsi : Pembuatan dan Analisis Karakteristik Gelatin dari Tulang Ikan Tuna (Thunnus albacares)
Nama : Musfiq Amiruldin
NRP : F34103109
Departemen : Teknologi Industri Pertanian
Menyetujui,
Prof. Dr. Ir. E. Gumbira Sa’id, MA Dev Dosen Pembimbing I
Drs. Tazwir Dr. Ir. Mulyorini R, M.Si
Pembimbing II Dosen Penguji
Mengetahui,
Dr. Ir. M. Romli, MSc Ketua Jurusan
Tanggal Lulus: 8 Agustus 2007
KATA PENGANTAR
Alhamdulillahirobbil’alamin, puji dan syukur penulis panjatkan ke hadirat Allah SWT atas segala rahmat, hidayah dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan skripsi dalam rangka memenuhi tugas akhir di Departemen Teknologi Industri Pertanian. Shalawat serta salam selalu tercurah kepada Rasulullah Muhammad SAW, kepada keluarga dan sahabat-sahabatnya
Skripsi yang berjudul “Pembuatan dan Analisis Karakteristik Gelatin Dari Tulang Ikan Tuna (Thunnus albacares)” disusun berdasarkan penelitian yang telah penulis laksanakan pada bulan Maret sampai Juni 2007. Suatu karunia bagi penulis dapat melaksanakan sebuah penelitian yang dibiayai oleh Balai Besar Riset Pengolahan Produk Dan Bioteknologi Kelautan Dan Perikanan, Slipi, Jakarta Tahun Anggaran 2007.
Pada kesempatan kali ini penulis sampaikan ucapan terima kasih kepada para personalia di bawah ini:
Prof. Dr. Ir. E. Gumbira Said, MA.Dev sebagai dosen pembimbing pertama yang telah memberi bimbingan dan pengarahan yang baik serta sumber inspirasi untuk terus melakukan yang terbaik.
Drs. Tazwir sebagai pembimbing kedua yang memberi bimbingan, arahan dan perhatian yang besar selama ini.
Dr. Ir. Mulyorini R, M.Si sebagai dosen penguji yang telah banyak memberi saran dan kritikan yang membangun dalam ujian dan penyusunan skripsi ini.
Dr. Rosmawaty Peranginangin yang telah memberikan banyak masukan dalam penelitian dan penyusunan skripsi ini.
Ayahanda H. Abdullah dan Ibunda tercinta Hj. Mursinah yang telah mencurahkan kasih sayang, do’a dan dukungan tanpa akhir.
Adik-adikku Aynal Fuadi dan Rizki Nur Faizi yang telah memberikan keceriaan dan hari-hari yang indah.
Tiska Lestari, Eko Wahyudi Apriantoro dan Rizki Ika selaku Tim Gelatin yang telah berbagi suka, duka dan juga ilmu selama menjalani penelitian.
Seluruh Staf Balai Besar Riset Pengolahan Produk Dan Bioteknologi Kelautan Dan Perikanan, Jakarta.
Teman-teman TIN’40, terima kasih atas dukungan dan pengalaman terindah yeng telah kita jalani bersama.
Ayu Sinta Saputri yang telah memberikan semangat dan perhatian yang tulus.
Semua pihak lain yang telah membantu dalam penelitian dan pembuatan skripsi ini.
Akhirnya, dengan berbagai kekurangan yang ada, maka segala kritik dan saran sangat diharapkan. Semoga skripsi ini bermanfaat bagi semua pihak yang memerlukan.
Bogor, 8 Agustus 2007
Penulis
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 3
C. Manfaat Penelitian ... 3
D. Hipotesis Penelitian ... 4
II. TINJAUAN PUSTAKA ... 5
A. Ikan Tuna ... 5
B. Tulang Ikan ... 6
C. Kolagen ... 8
D. Gelatin ... 10
E. Proses Pembuatan Gelatin ... 16
F. Analisis Karakteristik Gelatin ... 20
III. METODA PENELITIAN ... 25
A. Bahan dan Alat ... 25
B. Metode Penelitian ... 25
1. Penelitian Tahap I ... 25
2. Penelitian Tahap II ... 28
C. Rancangan Percobaan ... 28
D. Waktu dan Tempat Penelitian ... 29
IV. HASIL DAN PEMBAHASAN ... 30
A. Penelitian Tahap I... 30
1. Rendemen Gelatin ... 34
2. Derajat Keasaman (pH) Gelatin ... 37
3. Viskositas Gelatin ... 40
Halaman
4. Kekuatan Gel Gelatin ... 43
B. Penelitian Tahap II ... 47
1. Analisis Komposisi Kimia Gelatin ... 48
2. Analisis Sifat Fisikokimia Gelatin ... 52
3. Analisis Logam Berat Gelatin ... 57
4. Komposisi Asam Amino Gelatin ... 59
5. Analisis Mikrobiologi Gelatin ... 61
V. KESIMPULAN DAN SARAN ... 64
A. Kesimpulan ... 64
B. Saran ... 65
DAFTAR PUSTAKA ... 66
LAMPIRAN ... 70
DAFTAR TABEL
Halaman
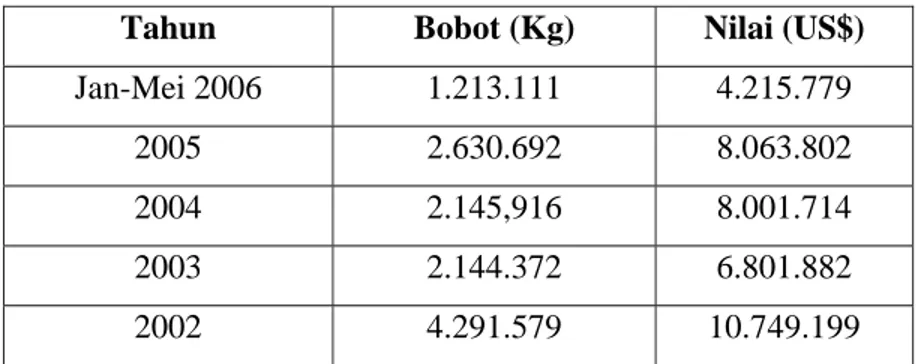
Tabel 1. Data Impor Gelatin Indonesia Tahun 2001-2005 ... 2
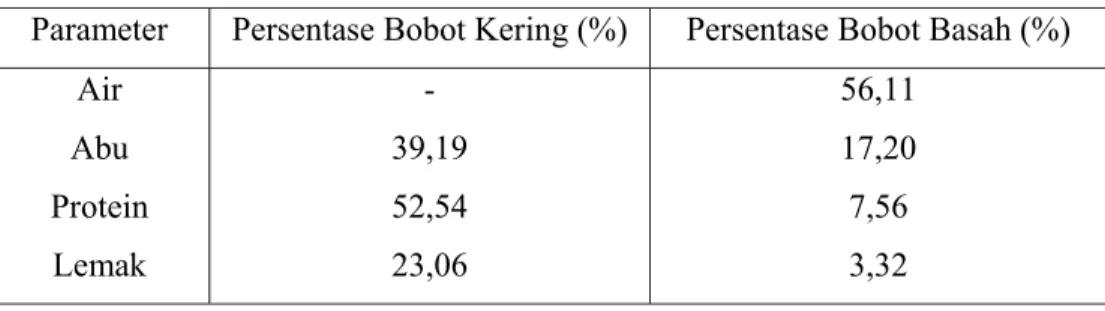
Tabel 2. Komposisi Kimia Tulang Ikan Tuna ... 6
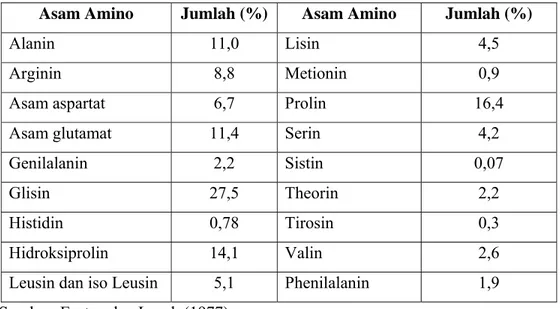
Tabel 3. Komposisi Asam Amino Gelatin ... 11
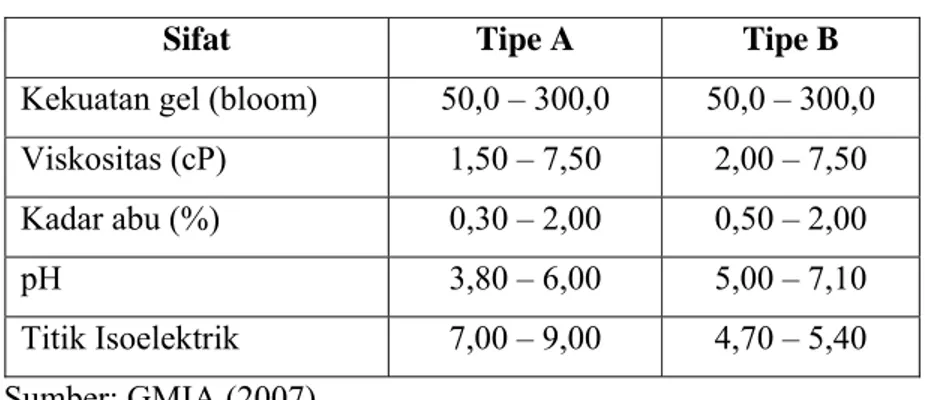
Tabel 4. Sifat Gelatin Berdasarkan Jenisnya... 13
Tabel 5. Standar Mutu Gelatin Menurut SNI No. 06-3735 Tahun1995 dan British Standard: 757 Tahun 1975... 14
Tabel 6. Standar Gelatin Pangan ... 15
Tabel 7. Spesifikasi Gelatin Farmasi ... 16
Tabel 8. Hasil Analisis Komposisi Kimia Tulang Ikan Tuna ... 31
Tabel 9. Pengaruh Perlakuan Terhadap Nilai Rendemen Gelatin Tulang Ikan Tuna ... 37
Tabel 10. Pengaruh Perendaman Terhadap Nilai pH Gelatin Tulang Ikan Tuna ... 40
Tabel 11. Pengaruh Perendaman Terhadap Nilai Viskositas Gelatin Tulang Ikan Tuna ... 43
Tabel 12. Pengaruh Perendaman Terhadap Nilai Kekuatan Gel Gelatin Tulang Ikan Tuna ... 46
Tabel 13. Hasil Pengukuran Mutu Gelatin Tulang Ikan Tuna, Gelatin Komersial dan Gelatin Standar Laboratorium ... 48
Tabel 14. Hasil Analisis Komposisi Kimia Gelatin ... 49
Tabel 15. Hasil Analisis Sifat Fisikokimia Gelatin ... 53
Tabel 16. Hasil Analisis Logam Berat Gelatin Tulang Ikan Tuna, Gelatin Komersial dan Gelatin Standar Laboratorium... 58
Tabel 17. Komposisi Asam Amino Gelatin Tulang Ikan Tuna, Gelatin Komersial dan Gelatin Standar Laboratorium ... 60
Tabel 18. Hasil Analisis Mikrobiologi Gelatin Tulang Ikan Tuna, Gelatin Komersial dan Gelatin Standar Laboratorium ... 62
DAFTAR GAMBAR
Halaman
Gambar 1. Gambar Penampakan Ikan Tuna (Thunnus albacares) ... 5
Gambar 2. Susunan Molekul Kolagen ... 8
Gambar 3. Struktur Kimia Gelatin ... 12
Gambar 4. Diagram alir Proses Pembuatan Gelatin Dengan Cara Asam (Tipe A) dan Cara Basa (Tipe B) ... 19
Gambar 5. Diagram Alir Proses Pembuatan Gelatin dari Tulang Ikan Tuna.... 27
Gambar 6. Tulang Ikan Tuna (Thunnus albacares) ... 30
Gambar 7. Gelatin Tulang Tuna dan Gelatin Komersial ... 35
Gambar 8. Grafik Rendemen Gelatin Tulang Ikan Tuna ... 35
Gambar 9. Grafik nilai pH Gelatin Tulang Ikan Tuna ... 38
Gambar 10. Grafik Viskositas Gelatin Tulang Ikan Tuna ... 41
Gambar 11. Grafik Kekuatan Gel Gelatin Tulang Ikan Tuna ... 44
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Prosedur Analisa Data ... 71
Lampiran 2. Hasil Analisa Komposisi Kimia Tulang Ikan Tuna ... 78
Lampiran 3. Hasil Pengukuran Rendemen, Viskositas, Kekuatan Gel, dan pH Gelatin dari Tulang Ikan Tuna ... 78
Lampiran 4. Hasil Analisis Ragam Rendemen Gelatin ... 79
Lampiran 5. Hasil Analisis Ragam pH Gelatin ... 80
Lampiran 6. Hasil Analisis Ragam Viskositas Gelatin ... 81
Lampiran 7. Hasil Analisis Ragam Kekuatan Gel Gelatin ... 82
I. PENDAHULUAN
A. Latar Belakang
Gelatin merupakan suatu jenis protein yang diekstraksi dari jaringan kolagen hewan. Pada hewan, kolagen terdapat pada tulang, tulang rawan, kulit, dan jaringan ikat. Gelatin diperoleh dengan cara denaturasi panas dari kolagen (Geltech, 2007).
Saat ini penggunaan gelatin sudah semakin meluas, baik untuk produk pangan maupun non pangan. Untuk produk pangan gelatin dapat dimanfaatkan sebagai bahan penstabil (stabilizer), pembentuk gel (gelling agent), pengikat (binder), pengental (thickener), pengemulsi (emulsifier), perekat (adhesive), whipping agent, dan pembungkus makanan yang bersifat dapat dimakan (edible coating). Industri pangan yang membutuhkan gelatin antara lain industri konfeksioneri, produk jelly, industri daging, industri susu, produk law fat, dan industri food supplement (Raharja, 2004). Gelatin juga digunakan dalam industri non pangan seperti industri pembuatan film, industri farmasi (seperti produksi kapsul lunak, cangkang kapsul dan tablet), industri teknik (sebagai bahan pembuat lem, kertas, cat, dan bahan perekat), dan juga digunakan dalam industri kosmetika (seperti pemerah bibir, shampo dan sabun) (Poppe, 1992).
Gelatin disebut miracle food, karena gelatin memiliki fungsi yang masih sulit digantikan dalam industri makanan maupun farmasi (LPPOM MUI, 2001). Penggunaan gelatin untuk kebutuhan sahari-hari tidak dapat dihindari, karena lebih dari 60% total produksi gelatin digunakan oleh industri pangan, sekitar 20% industri fotografi dan 10% oleh industri farmasi dan kosmetik (Peranginangin, 2006).
Kebutuhan industri akan gelatin selama ini dipenuhi dengan jalan mengimpornya dari Prancis, Jerman, Jepang, dan India. Impor gelatin yang tercatat dalam data BPS (2006) dapat dilihat pada Tabel 1. Penggunaan gelatin impor terutama dari negara-negara non muslim menimbulkan pertanyaan bagi
masyarakat Indonesia. Hal ini dikarenakan salah satu bahan baku gelatin berasal dari kulit dan tulang babi.
Tabel 1. Data Impor Gelatin Indonesia Tahun 2002-2006
Tahun Bobot (Kg) Nilai (US$)
Jan-Mei 2006 1.213.111 4.215.779
2005 2.630.692 8.063.802
2004 2.145,916 8.001.714
2003 2.144.372 6.801.882
2002 4.291.579 10.749.199
Sumber : BPS (2006)
Sumber utama lain yang sangat potensial sebagai bahan baku gelatin adalah kolagen yang berasal dari ikan. Tulang dan kulit ikan sangat potensial sebagai sumber gelatin karena mencakup 10-20% dari total bobot tubuh ikan.
Kandungan kolagen pada tulang ikan keras (teleostei) berkisar 15 – 17%, sedangkan pada tulang ikan rawan (elasmobranch) berkisar 22 – 24%
(Purwadi, 1999).
Produk gelatin yang berbahan baku ikan umumnya memiliki masalah Fishy odor atau bau amis dan tidak sedap, yaitu berasal dari urea yang mudah terurai menjadi amonia. Fishy odor tersebut sangat tidak disukai konsumen dan merupakan penyebab belum dimasukkannya gelatin ikan ke dalam GRAS (Generally Recognized as Safe). Untuk itu diperlukan metode dan teknologi pembuatan gelatin ikan yang dapat mengurangi atau meminimalisasi fishy odor, menghasilkan rendemen yang tinggi serta memiliki sifat fisik, kimia dan fungsional yang menunjang sebagai bahan baku industri, baik industri pangan maupun non pangan (Surono, 1995).
Ikan tuna (Thunnus albacares) merupakan salah satu ikan ekonomis penting yang dihasilkan perairan Indonesia. Total ekspor dari perusahaan pengolahan ikan yang berada di Bali saja dari bulan Februari hingga Juli 2004 adalah 3.353 ton. Ikan tuna biasanya diekspor dalam bentuk loin, steak dan fillet, sementara ekor, kulit, insang, kepala, tulang, dan isi perut dibuang atau kalaupun dimanfaatkan hanya untuk bahan tambahan pada pakan ternak dan ikan. Limbah ikan mencapai 50% dari total bobot ikan (Purwadi, 1999).
Untuk penggunaan dalam bahan pangan dan non pangan, kekuatan gel, viskositas dan titik leleh merupakan sifat khas gelatin yang sangat penting.
Sifat-sifat di atas dipengaruhi oleh beberapa faktor, seperti konsentrasi larutan gelatin, waktu pemanasan gel, pH dan kandungan asam. Selain itu, teknik ekstraksi seperti tingkat keasaman, jenis larutan perendaman, lama perendaman dan suhu ekstraksi diduga mempengaruhi sifat-sifat gelatin tersebut (Norland, 1990).
Beberapa penelitian mengenai gelatin yang diekstrak dari ikan yang telah dilakukan adalah dari ikan kakap putih, kakap merah, cucut, pari, paus dan patin (Dahlia, 2004; Chasanah, 2000; Yustika, 2000; Indrialaksmi, 2000;
Gomes-Gulien dan Montero, 2001; Astawan et al., 2002; Aviana, 2002;
Sopian, 2002; Rusli, 2004). Penelitian gelatin dari ikan tuna baru memanfaatkan kulitnya saja (Fahrul, 2005; Roswita, 2006). Oleh karena itu perlu dilakukan pengkajian pembuatan gelatin dari tulang ikan tuna serta karakteristisasi gelatin yang diperoleh.
B. Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk mendapatkan teknik ekstraksi gelatin dari tulang ikan tuna (Thunnus albacares). Secara khusus penelitian ini bertujuan sebagai berikut:
1. Mempelajari pengaruh perendaman tulang dengan konsentrasi basa (NaOH) yang berbeda sebelum perendaman asam (HCl) terhadap rendemen, pH, viskositas, dan kekuatan gel gelatin tulang ikan tuna (Thunnus albacares).
2. Mengkaji karakteristik gelatin dari tulang ikan tuna (Thunnus albacares) yang meliputi sifat fisik, sifat kimia dan kandungan mikrobiologi.
C. Manfaat Penelitian
Penelitian ini diharapkan dapat memanfaatkan limbah tulang ikan tuna menjadi gelatin sehingga dapat memacu tumbuhnya industri pengolahan gelatin di Indonesia yang akhirnya dapat mengurangi ketergantungan akan gelatin impor.
D. Hipotesis Penelitian
Proses pembuatan gelatin dari tulang ikan tuna tanpa perendaman dalam larutan NaOH dan dengan perendaman dalam larutan NaOH sebelum perendaman asam berpengaruh terhadap mutu fisikokimia gelatin yang dihasilkan.
II. TINJAUAN PUSTAKA
A. Ikan Tuna
Ikan tuna (Thunnus albacares) termasuk dalam keluarga Scombridae, dengan tubuh seperti cerutu, mempunyai kulit yang licin dengan sirip dada melengkung dengan ujung yang lurus dan pangkal yang lebar (Bykov, 1983).
Gambar penampakan Ikan tuna (Thunnus albacares) dapat dilihat pada Gambar 1.
Gambar 1. Diagram Ikan Tuna (Thunnus albacares) (Wikipedia, 2007) Klasifikasi ikan tuna (Thunnus albacares) menurut Subardja (1989) adalah sebagai berikut:
Filum : Chordata Sub Filum : Vertebrata Kelas : Teleostei Sub Kelas : Actioopterygii Ordo : Perciformes Sub Ordo : Scombridae Genus : Thunnus Spesies : Thunnus albacares
Genus Thunnus terdiri atas beberapa spesies antara lain Thunnus albacares yang paling banyak didapati di perairan Indonesia. Jenis di atas dikenal dengan sebutan madidihang atau yellow fin tuna. Thunnus albacares memiliki ciri-ciri: badan memanjang, bulat seperti cerutu, panjang tubuhnya
mencapai 195 cm, namun umumnya 50-150 cm, memiliki dua sirip punggung, sirip depan biasanya pendek dan terpisah dari sirip belakang, pada bagian punggung berwarna biru kehitaman dan berwarna keputih-putihan pada bagian perut. Spesies ini termasuk jenis ikan buas, bersifat predator, hidup bergerombol kecil pada waktu mencari makan. Ikan tuna adalah jenis ikan dengan kandungan protein yang tinggi dan kandungan lemak yang rendah.
Ikan tuna mengandung protein antara 22,6-26,2%. Disamping itu ikan tuna mengandung mineral ( kalsium, fosfor, besi, sodium ), vitamin A dan vitamin B (Bykov, 1983).
B. Tulang Ikan
Tulang adalah organ keras yang merupakan bentuk bagian pada endoskleton vertebrata. Menurut Lagler (1977) tulang berfungsi sebagai berikut :
1. Melindungi tubuh, dimana tulang dapat melindungi organ-organ internal dari pengaruh luar tubuh.
2. Membentuk tubuh.
3. Memproduksi sel darah.
4. Tempat penyimpanan mineral.
5. Untuk pergerakan tubuh.
6. Pada beberapa ikan, tulang bermodifikasi menjadi sirip mempercepat penempatan sperma pada saluran reproduksi pada ikan betina.
Skleton pada ikan terdiri dari : notochord, jaringan penghubung, tulang, kartilago, sisik, dan gigi (termasuk enamel dan dentin), neuralgia, dan sirip. Ikan memiliki rangka dalam yang terdiri dari tulang sejati (tulang keras), dan tulang rawan (kartilago). Dari kenampakan fisik, secara mudah terlihat bahwa tulang rawan lebih transparan (bening, tembus cahaya) dan lentur dibandingkan dengan tulang sejati (Lagler, 1977). Komposisi kimia tulang ikan tuna dapat dilihat pada Tabel 2.
Tabel 2. Komposisi Kimia Tulang Ikan Tuna
Parameter Persentase Bobot Kering (%) Persentase Bobot Basah (%) Air
Abu Protein Lemak
- 39,19 52,54 23,06
56,11 17,20 7,56 3,32 Sumber: Direktorat Jendral Perikanan Tangkap (1983)
Perkembangan dari embrio pada tulang adalah sebagai berikut:
kartilago dihasilkan oleh sel-sel masenkim, sesudah kartilago terbentuk rongga yang ada didalamnya akan terisi oleh osteoblast, yaitu sel-sel pembentuk tulang. Osteoblast juga menempati jaringan pengikat disekelilingnya dan membentuk sel-sel tulang. Jaringan utama pada tulang jaringan osseous relatif keras dan terdapat mineral, dimana yang terbesar adalah kalsium fosfat sehingga menyebabkan tulang bersifat keras. Tulang umumnya memiliki matriks berupa hialin yang homogen dan jernih. Matriks yang berserabut lebih banyak mengandung kolagen yaitu semacam zat perekat tulang, dimana didalam tulang, kolagen memberikan elastisitas dan juga berkontribusi dalam resistensi fraktur (Wikipedia, 2007).
Pemanfaatan kulit, tulang dan gelembung renang ikan secara komersial dapat sebagai bahan baku industri gelatin, dimana selama ini hanya merupakan limbah. Pemanfaatan tersebut dapat menambah penghasilan secara ekonomi dan memberi keuntungan bagi pengelolaan limbah industri perikanan karena bahan tersebut dihasilkan dalam jumlah yang banyak (Choi dan Regenstein, 2000). Menurut Surono (1994) bahwa tulang dan kulit ikan sangat potensial untuk digunakan sebagai bahan baku pembuatan gelatin, karena tulang dan kulit mencakup 10 – 20% dari total bobot tubuh ikan.
C. Kolagen
Kolagen adalah protein berbentuk serabut (fibril) yang mempunyai fungsi fisiologis yang unik. Kolagen merupakan komponen struktural utama dari jaringan pengikat putih (white connective tissue) yang meliputi hampir 30% dari total protein pada jaringan organ tubuh vertebrata dan invertebrata (Poppe, 1992). Kolagen merupakan salah satu protein terpanjang dengan jumlah paling banyak pada tubuh vertebrata. Kolagen merupakan bahan baku utama yang banyak terdapat pada kulit, urat, pembuluh darah tulang dan tulang rawan. Serat kolagen terdiri dari tiga rantai polipeptida yang saling berhubungan, masing-masing tersusun dalam jenis khusus heliks berputar.
Kolagen merupakan protein yang mengandung 35% glisin dan sekitar 11%
alanin serta kandungan prolin yang cukup tinggi (Lehninger, 1990).
Fibril kolagen terdiri dari sub-unit polipeptida berulang yang disebut tropokolagen yang disusun dalam untaian paralel dari kepala sampai ekor.
Tropokolagen terdiri atas tiga rantai polipeptida yang berpilin erat menjadi tiga untai tambang. Tiap rantai polipeptida dalam tropokolagen juga merupakan suatu heliks (Lehninger, 1990). Susunan molekul kolagen dapat dilihat pada Gambar 2.
Gambar 2. Susunan Molekul Kolagen (Lehninger, 1990)
Kolagen merupakan bahan baku gelatin yang banyak terdapat pada kulit, urat, tulang rawan, dan tulang pada hewan. Kolagen adalah serabut protein yang mempunyai fungsi biologis yang unik. Kolagen tersusun oleh unit struktural tropokolagen yang berbentuk batang dengan panjang 3000Å dengan diameter 15Å, yang mengandung tiga unit polipeptida yang saling berpilin membentuk struktur triple helix (Wong, 1989).
Protein (kolagen) dapat mengalami kerusakan oleh pengaruh panas, reaksi kimia dengan asam atau basa, goncangan dan sebab-sebab lainnya.
Selain itu protein juga dapat mengalami degradasi, yaitu pemecahan molekul kompleks menjadi molekul sederhana oleh pengaruh asam, basa atau enzim (Winarno, 2002). Perlakuan basa atau alkali dapat menyebabkan kolagen mengembang dan menyebar. Salah satu alkali yang dapat digunakan sebagai pelarut kolagen adalah NaOH (Christianto, 2001). Selain pelarut alkali, kolagen juga larut dalam pelarut asam seperti HCl (Artadana, 2001).
Konversi kolagen yang bersifat tidak larut air menjadi gelatin yang larut air merupakan transformasi esensial dalam pembuatan gelatin. Kolagen harus diberi perlakuan awal untuk mengubahnya menjadi bentuk yang sesuai sehingga dapat diekstraksi. Ekstraksi ini dapat menyebabkan pemutusan ikatan hidrogen diantara ketiga rantai bebas, dua rantai saling berikatan dan satu rantai bebas, dan tiga rantai yang masih berikatan (Poppe, 1992). Serat kolagen akan mengembang dengan baik tetapi tidak larut bila direndam dalam larutan alkali atau larutan garam netral dan nonelektrolit. Kolagen akan terputus jika terkena asam kuat atau basa kuat dan akan mengalami transformasi dari bentuk untaian larut dan tidak tercerna menjadi gelatin yang larut air (Lehninger, 1990).
Kolagen yang terdapat pada kulit dan tulang ikan mempunyai kemampuan untuk membentuk gel setelah dipanaskan. Kemampuan pembentukan gel tergantung pada karakteristik spesies ikan dan kolagen dari kulit ikan mempunyai kemampuan yang lebih tinggi dibandingkan kolagen dari tulang ikan. Kandungan NaCl yang rendah berpengaruh nyata terhadap kekuatan gel kolagen dari kulit ikan tetapi tidak berpengaruh nyata terhadap kemampuan gel kolagen dari tulang (Montero dan Borderias, 1991).
Pada ikan terdapat tiga tipe protein, yaitu myofibril (65-75%), sarkoplasma (20-30%), dan stromata (1-3%). Protein stromata merupakan jaringan ikat yang terdiri dari komponen kolagen dan elastin (Suzuki, 1981).
Kolagen murni sangat sensitif terhadap reaksi enzim dan kimia. Di samping pelarutnya, kolagen ikan mempunyai kandungan asam amino yang lebih rendah dibandingkan dengan kolagen mamalia sehingga suhu denaturasi proteinnya menjadi rendah (Ward dan Courts, 1977).
Menurut De Man (1997) proses pengubahan kolagen menjadi gelatin melibatkan tiga perubahan, sebagai berikut:
1. Pemutusan sejumlah terbatas ikatan peptida untuk memperpendek rantai.
2. Pemutusan atau pengacauan sejumlah ikatan samping antar rantai.
3. Perubahan konfigurasi rantai.
Perubahan konfigurasi rantai merupakan satu-satunya perubahan penting untuk pengubahan kolagen menjadi gelatin. Kondisi yang digunakan selama proses produksi gelatin menentukan sifat-sifatnya. Pada produksi normal, kulit atau tulang mula-mula diekstraksi dahulu pada kondisi nisbi lunak, dilanjutkan dengan ekstraksi berturut-turut pada kondisi lebih berat. Ekstraksi pertama menghasilkan gelatin dengan mutu baik, sedangkan ekstraksi selanjutnya menghasilkan gelatin dengan mutu tidak sebaik ekstraksi pertama.
D. Gelatin
Gelatin merupakan salah satu produk turunan protein yang diperoleh dari hasil hidrolisis kolagen hewan yang terkandung dalam tulang dan kulit, dan merupakan senyawa yang tidak pernah terjadi secara alamiah. Gelatin mempunyai titik leleh 35oC, di bawah suhu tubuh manusia. Titik leleh inilah yang membuat produk gelatin mempunyai karakteristik yang unik bila dibandingkan dengan bahan pembentuk gel lainnya seperti pati, alginat, pektin, agar-agar dan karaginan yang merupakan senyawa karbohidrat (Gomez dan Montero, 2001). Secara fisik dan kimia, gelatin berwarna kuning cerah atau transparan, berbentuk serpihan atau tepung, berbau dan berasa, larut dalam air panas, gliserol dan asam asetat serta pelarut organik lainnya. Gelatin dapat mengembang dan menyerap air 5-10 kali bobot asalnya (Raharja, 2004).
Gelatin dapat diperoleh dengan cara denaturasi panas dari kolagen (Geltech, 2007). Pemanasan kolagen secara bertahap akan menyebabkan struktur rusak dan rantai-rantai akan terpisah. Berat molekul, bentuk dan konformasi larutan kolagen sensitif terhadap perubahan suhu yang dapat menghancurkan makro molekulnya (Wong, 1989).
Gelatin merupakan molekul besar dan kompleks yang mempunyai nilai rata-rata bobot molekul berkisar 15.000 – 25.000. Komposisi kimia gelatin terdiri dari 50.5% karbon, 6.8% hidrogen, 17% nitrogen dan 25.5% oksigen.
Untuk sampel yang lebih murni kandungan nitrogennya berkisar antara 18.2%
sampai 18.4%. Gelatin yang diperoleh dari proses alkali lebih kaya hidroksiprolin dan rendah tirosin dibandingkan dengan gelatin yang diperoleh melalui proses asam (Smith, 1992).
Senyawa gelatin merupakan suatu polimer linier asam-asam amino.
Pada umumnya rantai polimer tersebut merupakan perulangan dari asam amino glisin-prolin-prolin atau glisin-prolin-hidroksiprolin. Dalam gelatin tidak terdapat asam amino triptofan, sehingga gelatin tidak dapat digolongkan sebagai protein yang lengkap (Gelatin Food Science, 2007). Gelatin tersusun atas 18 asam amino yang saling terikat dan dihubungkan dengan ikatan peptida membentuk rantai polimer yang panjang (Eastoe dan Leach, 1977).
Secara lengkap komposisi asam amino gelatin disajikan pada Tabel 3.
Tabel 3. Komposisi Asam Amino Gelatin
Asam Amino Jumlah (%) Asam Amino Jumlah (%)
Alanin 11,0 Lisin 4,5
Arginin 8,8 Metionin 0,9
Asam aspartat 6,7 Prolin 16,4
Asam glutamat 11,4 Serin 4,2
Genilalanin 2,2 Sistin 0,07
Glisin 27,5 Theorin 2,2
Histidin 0,78 Tirosin 0,3
Hidroksiprolin 14,1 Valin 2,6
Leusin dan iso Leusin 5,1 Phenilalanin 1,9 Sumber:Eastoe dan Leach (1977)
Penurunan komposisi asam amino tergantung pada metode pembuatannya. Pembuatan dengan proses alkali umumnya lebih banyak mengandung hidroksiprolin dan lebih sedikit tirosin dibandingkan dengan proses asam (Ward dan Courts, 1977). Struktur kimia gelatin dapat dilihat pada Gambar 3.
CH2 CHOH CH2 CH2 CH2 CH2
CH2 N CH NH CH2 NH N CH CO-NH CO CO CH-CO-NH CO CH-CO CO
R R
Glisin Prolin Glisin Hidroksiprolin Gambar 3. Struktur Kimia Gelatin (Poppe, 1992)
Berdasarkan proses pembuatannya terdapat dua jenis gelatin yaitu Tipe A dan Tipe B. Gelatin Tipe A diproduksi melalui proses asam sedangkan Tipe B diproduksi melalui proses basa. Pada proses pembuatan gelatin Tipe A melalui proses asam, bahan baku diberi perlakuan perendaman dalam larutan asam organik seperti asam klorida, asam sulfat, asam sulfit atau asam fosfat, sedangkan proses produksi gelatin Tipe B melalui proses basa, perlakuan yang diberikan adalah perendaman dalam air kapur, proses ini sering dikenal sebagai proses alkali (Utama, 1997).
Gelatin Tipe A biasanya berasal dari kulit babi, sedangkan gelatin Tipe B terutama berasal dari kulit dan tulang ruminansia (Imeson, 1992). Menurut Wiyono (2001), gelatin ikan dikategorikan sebagai gelatin tipe A. Sifat gelatin berdasarkan tipenya disajikan pada Tabel 4.
Tabel 4. Sifat Gelatin Berdasarkan Jenisnya
Sifat Tipe A Tipe B
Kekuatan gel (bloom) 50,0 – 300,0 50,0 – 300,0 Viskositas (cP) 1,50 – 7,50 2,00 – 7,50 Kadar abu (%) 0,30 – 2,00 0,50 – 2,00
pH 3,80 – 6,00 5,00 – 7,10
Titik Isoelektrik 7,00 – 9,00 4,70 – 5,40 Sumber: GMIA (2007)
Gelatin tipe A dihasilkan dari proses asam, yang umumnya dihasilkan dari kulit babi, dimana molekul kolagennya muda, sedangkan gelatin tipe B dihasilkan dari proses asam dan basa, yang umumnya diperoleh dari tulang dan kulit sapi, dimana molekul kolagen helix ulir tiga (triple helix) lebih tua, ikatan silangnya lebih padat dan kompleks. Pada umumnya proses asam digunakan untuk bahan baku yang relatif lunak, sedangkan proses alkali diterapkan pada bahan baku yang relatif keras (GMAP, 2007).
Asam mampu mengubah serat kolagen triple helix menjadi rantai tunggal, sedangkan larutan perendaman basa hanya mampu menghasilkan rantai ganda. Hal ini menyebabkan pada waktu yang sama jumlah kolagen yang dihidrolisis oleh larutan asam lebih banyak daripada larutan basa. Karena itu perendaman dalam larutan basa membutuhkan waktu yang lebih lama untuk menghidrolisis kolagen (Ward and Court, 1977).
Gelatin larut dalam air, asam asetat dan pelarut alkohol seperti gliserol, propilen glykol, sorbitol dan manitol, tetapi tidak larut dalam alkohol, aseton, karbon tetra klorida, benzene, petroleum eter dan pelarut organik lainnya.
Pada kondisi tertentu juga larut dalam campuran aseton-air dan alkohol-air (Viro, 1992).
Gelatin memiliki sifat dapat berubah secara reversible dari bentuk sol ke gel, atau sebaliknya, juga dapat membengkak atau mengembang dalam air dingin. Sifat-sifat yang dimiliki gelatin lebih disukai dibandingkan bahan- bahan semisal dengannya seperti gum xantan, karagenan, dan pektin (Utama, 1997).
Salah satu sifat fisik gelatin yang menentukan mutu gelatin adalah kemampuannya untuk membentuk gel yang disebut kekuatan gel. Kekuatan gel dipengaruhi oleh pH, adanya komponen elektrolit dan non elektrolit serta bahan tambahan lainnya. Sifat fisik lainnya adalah titik pembuatan gel, warna, kapasitas emulsi dan stabilitas emulsi (Glicksman, 1969). Ditambahkan oleh Poppe (1992) sifat fisik penting lainnya adalah viskositas. Viskositas terutama dipengaruhi oleh interaksi hidrodinamik antar molekul gelatin, selain dipengaruhi suhu, pH dan konsentrasi. Standar mutu gelatin untuk industri dapat dilihat pada Tabel 5.
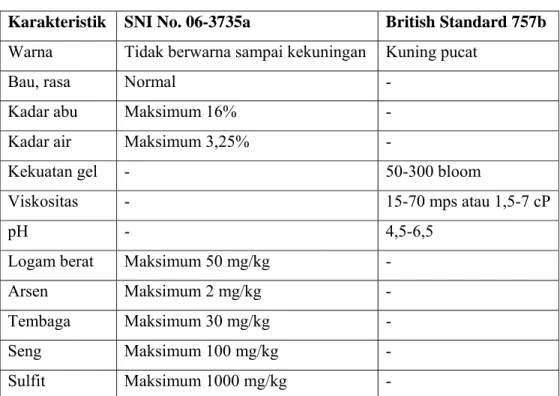
Tabel 5. Standar Mutu Gelatin Menurut SNI No. 06-3735 Tahun1995 dan British Standard: 757 Tahun 1975
Karakteristik SNI No. 06-3735a British Standard 757b Warna Tidak berwarna sampai kekuningan Kuning pucat
Bau, rasa Normal -
Kadar abu Maksimum 16% -
Kadar air Maksimum 3,25% -
Kekuatan gel - 50-300 bloom
Viskositas - 15-70 mps atau 1,5-7 cP
pH - 4,5-6,5
Logam berat Maksimum 50 mg/kg -
Arsen Maksimum 2 mg/kg -
Tembaga Maksimum 30 mg/kg -
Seng Maksimum 100 mg/kg -
Sulfit Maksimum 1000 mg/kg -
Sumber: a) Dewan Standarisasi Nasional (SNI 06.3735-1995)(1995) b) British Standard: 757 (1975)
Kegunaan gelatin terutama adalah untuk mengubah cairan menjadi padatan yang elastis, atau mengubah bentuk sol menjadi gel. Reaksi pembentukan gel oleh gelatin bersifat reversible karena bila dipanaskan akan terbentuk sol dan sewaktu didinginkan akan terbentuk gel lagi. Keadaan ini
pula yang membedakannya dengan gel dari pektin, alginat dan pati yang bentuk gelnya “irreversible” (Parker, 1982). Gelatin mempunyai banyak fungsi dan sangat aplikatif di berbagai industri. Penggunaan gelatin dalam pengolahan pangan lebih disebabkan oleh sifat fisik dan kimia yang khas daripada nilai gizinya sebagai sumber protein (Gelatin Food Science, 2007).
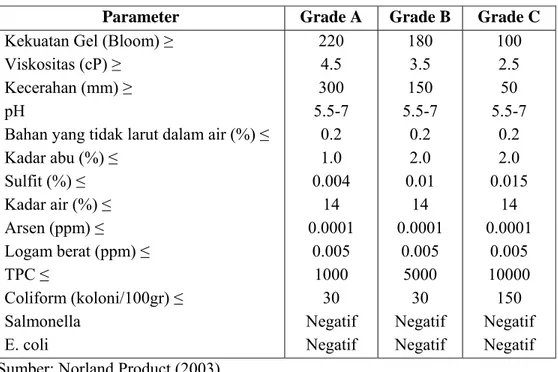
Standar mutu gelatin pangan dapat dilihat pada Tabel 6.
Tabel 6. Standar Gelatin Pangan
Parameter Grade A Grade B Grade C Kekuatan Gel (Bloom) ≥
Viskositas (cP) ≥ Kecerahan (mm) ≥ pH
Bahan yang tidak larut dalam air (%) ≤ Kadar abu (%) ≤
Sulfit (%) ≤ Kadar air (%) ≤ Arsen (ppm) ≤ Logam berat (ppm) ≤ TPC ≤
Coliform (koloni/100gr) ≤ Salmonella
E. coli
220 4.5 300 5.5-7
0.2 1.0 0.004
14 0.0001
0.005 1000 30 Negatif Negatif
180 3.5 150 5.5-7
0.2 2.0 0.01
14 0.0001
0.005 5000 30 Negatif Negatif
100 2.5 50 5.5-7
0.2 2.0 0.015
14 0.0001
0.005 10000
150 Negatif Negatif Sumber: Norland Product (2003)
Dalam industri pangan gelatin dapat berfungsi sebagai pembentuk gel, pemantap emulsi, pengental, pengikat air, pelapis, dan pengemulsi. Gelatin sebagai pelindung koloid dapat berguna dalam industri fotografi dan pelapisan logam dalam industri electroplating (Wiyono, 2001).
Dalam penggunaan gelatin pada berbagai jenis industri, terdapat beberapa faktor yang berpengaruh terhadap fungsi gelatin, yang harus diperhatikan yaitu konsentrasi, bobot molekul, suhu, pH dan penambahan senyawa lain (Meyer, 1982). Dalam air gelatin dapat membentuk larutan kental, karena sifat ini gelatin dapat digunakan sebagai bahan perekat dalam pembuatan tablet. Selain itu gelatin juga berfungsi mempertahankan kandungan zat pada tablet menjadi lebih awet, membantu penguraian obat
setelah ditelan dan dapat mempercepat pelepasan zat-zat obat yang aktif sehingga dapat segera diserap tubuh (Utama, 1997). Standar mutu gelatin untuk industri farmasi disajikan pada Tabel 7.
Tabel 7. Spesifikasi Gelatin Farmasi
Parameter Kelas Khusus Kelas 1 Kelas 2 Kelas 3
Kadar air (%) 14.0 14.0 14.0 14.0
Kekuatan gel (Bloom.g) 240 200 160 140
Viskositas (cP) 20 20 20 20
Kadar abu (%) 1.0 1.0 2.0 2.0
pH 5.5-7.0 5.5-7.0 5.5-7.0 5.5-7.0
Arsen (Ppm) 0.8 0.8 0.8 0.8
Logam Berat (Ppm) 50 50 50 50
Mikrobiologi (Per gr) 1000 1000 1000 1000
E. coli (Per 100g) Neg Neg Neg Neg
Salmonella Neg Neg Neg Neg
Sumber: Norland Product (2003)
E. Proses Pembuatan Gelatin
Pada prinsipnya proses pembuatan gelatin dapat dibagi menjadi dua macam, yaitu proses asam dan proses basa. Perbedaan kedua proses ini terletak pada proses perendamannya. Berdasarkan kekuatan ikatan kovalen silang dan jenis bahan yang diekstrak, maka penerapan jenis asam maupun basa organik dan metode ekstraksi lainnya seperti lama hidrolisa, pH dan suhu akan berbeda-beda (Pelu, 1998).
Penggunaan asam lebih menguntungkan untuk produksi gelatin bila dilihat dari segi waktu perendaman yang lebih singkat dan biaya lebih murah.
Hal ini diakibatkan karena pada perendaman asam yang singkat sudah dapat melakukan pemutusan ikatan dan struktur koil kolagen dengan lebih baik sehingga jumlah kolagen yang terekstrak hampir mendekati jumlah kolagen untuk proses basa pada perendaman tulang selama delapan minggu (Astawan, 2002).
Proses produksi utama gelatin dapat dibagi menjadi tiga tahapan, yaitu persiapan bahan baku, konversi kolagen menjadi gelatin dan yang terakhir perolehan gelatin dalam bentuk kering. Persiapan dilakukan dengan pencucian pada tulang ikan. Tulang dibersihkan dari sisa-sisa daging dan kotoran lain yang mengandung deposit-deposit lemak yang tinggi. Untuk memudahkan pembersihan maka sebelumnya dilakukan pemanasan pada air mendidih selama 1-2 menit. Proses penghilangan lemak dari jaringan tulang disebut degreasing, dilakukan pada suhu antara titik cair lemak dan suhu koagulasi albumin tulang yaitu antara 320C – 800C sehingga dihasilkan kelarutan lemak yang optimum. Konversi kolagen menjadi gelatin biasanya didasarkan pada pengaturan suhu ekstraksi, yaitu untuk mencegah kerusakan protein pada suhu tinggi. Kisaran suhu yang digunakan antara 500C dan 1000C atau lebih rendah, pada selang pH dapat bervariasi untuk tiap metode (Hinterwaldner, 1977).
Pada proses pembuatan gelatin berbahan baku tulang dan kulit, terdapat proses yeng penting dilakukan pada bahan sebelum diproses menjadi gelatin, yaitu proses liming dan degreasing. Proses degreasing bertujuan untuk menghilangkan lemak-lemak yang masih terdapat dalam jaringan kulit dan tulang dengan proses pemasakan. Penghilangan lemak pada kulit dan tulang yang paling efektif dilakukan pada suhu antara titik cair lemak dan suhu koagulasi protein, yaitu sekitar 28 – 320C. Liming bertujuan untuk melarutkan komponen non-kolagen dan untuk melunakkan kulit dan tulang dengan perendaman larutan basa, selain itu bertujuan pula untuk merusak atau memutuskan akatan kimia tertentu yang masih ada dalam kolagen dan untuk menghilangkan atau mengurangi material lain yang tidak diinginkan, seperti protein lain dan karbohidrat. Selama proses liming, lemak dikonversi menjadi sabun-sabun basa terlarut (LP POM-MUI, 2001).
Menurut Hinterwaldner (1977), kalsium dalam tulang terutama dalam kalsium fosfat dalam larutan HCl terurai menjadi Ca2+ dan asam fosfat, reaksinya adalah sebagai berikut:
Ca2(PO4) + 6 HCl 3 CaCl2 + 2 H3PO4
Tahap pengembangan kulit (swelling) adalah tahap yang bertujuan untuk menghilangkan kotoran-kotoran dan mengkonversi kolagen menjadi
gelatin (Surono, 1994). Pada tahap ini perendaman dapat dilakukan dengan larutan asam organik seperti asam asetat, sitrat, fumarat, askorbat, malat, suksinat, tartarat, dan asam lainnya yang aman dan tidak menusuk hidung.
Sedangkan asam anorganik yang biasa digunakan adalah asam hidroklorat, fosfat, klorida, dan sulfat (Grossman dan Bergman, 1991).
Metode pengkonversian kolagen menjadi gelatin adalah dengan denaturasi kolagen. Proses denaturasi terjadi dengan pemanasan kolagen pada suhu 400C atau lebih dengan penambahan senyawa pemecah ikatan hidrogen pada suhu kamar atau lebih rendah, berupa pemecahan struktur koil kolagen menjadi satu, dua atau tiga rantai polipeptida secara acak (Gomez dan Montero, 2001).
Konversi kolagen menjadi gelatin terjadi dalam tiga tahap, yaitu hidrolisis lateral, hidrolisis ikatan polipeptida terutama glisin, dan penghancuran struktur kolagen (Ward dan Courts, 1977). Menurut Hadiwiyoto (1983) produksi gelatin meliputi tahap-tahap pengecilan ukuran bahan baku, perendaman, pencucian, pemanasan, pemekatan, pendinginan, dan pengeringan. Pengecilan ukuran disini menurutnya diperlukan untuk lebih memperluas permukaan bahan sehingga proses dapat berlangsung lebih cepat dan sempurna.
Ekstraksi adalah proses denaturasi untuk mengubah kolagen menjadi gelatin dengan penambahan senyawa pemecah ikatan hidrogen pada suhu kamar atau suhu yang lebih rendah. Ekstraksi juga dapat dilakukan dengan menggunakan air panas, dimana pada proses ini terjadi denaturasi, peningkatan hidrolisis dan kelarutan gelatin. Waktu yang diperlukan untuk ekstraksi adalah 4-8 jam dengan suhu antara 55-1000C. Setelah diperoleh ekstrak bersih, dilakukan pengeringan untuk mengurangi kadar air sebanyak 85-90%. Hal ini dapat dilakukan dengan menggunakan evaporator vakum dengan suhu 43-450C dan dilanjutkan dengan menggunakan freeze dryer atau oven pada suhu antara 30-600C (Viro, 1992).
Larutan gelatin yang diperoleh selanjutnya mengalami proses pendinginan untuk memadatkan larutan gelatin. Selanjutnya adalah pengeringan gelatin pekat yang telah padat dengan sinar matahari atau
menggunakan mesin pengering yang bersuhu 32– 600C, sampai diperoleh gelatin kering. Diagram alir proses pembuatan gelatin dari tulang dan kulit dengan cara asam dan cara basa dapat dilihat pada Gambar 4.
Gambar 4. Diagram alir Proses Pembuatan Gelatin Dengan Cara Asam (Tipe A) dan Cara Basa (Tipe B) (Fahrul, 2005)
Tulang / Kulit Ikan
Perendaman dalam Larutan Asam
Pencucian
Gelatin Kering Tipe A
Pencucian dan Pembersihan
Perendaman dalam Larutan Basa
Pencucian
Ekstraksi
Penyaringan
Larutan Gelatin
Pengeringan
Ekstraksi
Penyaringan
Larutan Gelatin
Pengeringan
Gelatin Kering Tipe B
F. Analisis Karakteristik Gelatin 1. Kadar Air
Kadar air merupakan persentase air yang terikat oleh suatu bahan terhadap bobot kering ovennya. Penentuan kadar air dilakukan untuk mengetahui banyaknya air yang terikat oleh komponen padatan bahan tersebut. Kandungan air dalam suatu bahan dapat menentukan penampakan, tekstur dan kemampuan bertahan bahan tersebut terhadap serangan mikroorganisme yang dinyatakan dalam aw, yaitu jumlah air bebas yang dapat dimanfaatkan oleh mikroorganisme untuk pertumbuhannya (Sudarmadji, 1995).
2. Kadar Abu
Kadar abu menunjukkan jumlah bahan anorganik yang terdapat dalam bahan organik. Abu menunjukkan jumlah bahan anorganik yang tersisa selama proses pembakaran tinggi (suhu sekitar 6000C) selama dua jam. Jumlah abu dipengaruhi oleh jumlah ion-ion anorganik yang terdapat dalam bahan selama proses berlangsung (Rahayuningsih, 2004).
3. Kadar Lemak
Analisis kadar lemak bertujuan untuk mengetahui kemungkinan daya simpan produk, karena lemak berpengaruh pada perubahan mutu selama penyimpanan. Lemak berhubungan dengan mutu dimana kerusakan lemak dapat menurunkan nilai gizi serta menyebabkan penyimpangan rasa dan bau (Winarno, 2002).
4. Kadar Protein
Menurut Sudarmadji (1995) kadar protein yang dianalisa dengan cara Kjeldahl disebut sebagai kadar protein kasar dengan menentukan jumlah nitrogen yang dikandung oleh suatu bahan. Dasar perhitungan penentuan protein menurut Kjeldahl menyatakan bahwa umumnya protein alamiah mengandung unsur N rata-rata 16% (dalam protein murni). Faktor perkalian yang telah diketahui adalah 5,5 untuk gelatin (kolagen terlarut). Kadar protein dilakukan melalui tiga tahapan, yaitu destruksi, destilasi dan titrasi.
Destruksi merupakan proses pemanasan gelatin dengan asam sulfat pekat ditambah katalis yang berguna untuk mempercepat reaksi. Senyawa karbon dan hidrogen yang terdapat dalam rantai polipeptida teroksidasi menjadi CO, CO2 dan H2O, sedangkan senyawa nitrogennya akan berubah menjadi (NH4)2SO4. Destilasi merupakan proses dimana (NH4)2SO4 dipecah menjadi ammonia (NH3) dengan penambahan NaOH 33% dan dipanaskan.
Ammonia yang dibebaskan selanjutnya ditangkap oleh H3BO3 0.02 N dan dengan penambahan indikator mengsel, larutan yang diperoleh berwarna keunguan. Larutan tersebut dititrasi dengan H2SO4 0.02 N dimana NaOH bereaksi dengan H3BO3 bebas (tidak berikatan dengan ammonium). Titrasi dihentikan ketika indikator berwarna kehijauan.
5. Derajat Keasaman
Pengukuran pH dilakukan untuk menentukan kondisi dan jenis muatan yang terdapat pada gelatin. Gelatin merupakan rantai polipeptida yang terdiri atas berbagai macam asam amino. Asam amino mempunyai sifat zwitterion atau dipolar karena dalam struktur kimianya mempunyai gugus fungsi negatif (COO-) dan gugus fungsi positif (NH3+). Asam amino juga bersifat amfoter, yaitu dapat bersifat asam, netral atau basa sesuai dengan kondisi lingkungannya (Winarno, 2002).
6. Kekuatan Gel
Kekuatan gel gelatin didefinisikan sebagai besarnya kekuatan yang diperlukan oleh probe untuk menekan gel setinggi empat mm sampai gel pecah. Satuan untuk menunjukkan kekuatan gel yang dihasilkan dari suatu konsentrasi tertentu disebut derajat bloom (Hermanianto, 2000). Salah satu sifat fisik yang penting pada gelatin adalah kekuatan untuk membentuk gel yang disebut sebagai kekuatan gel. Kekuatan gel dipengaruhi oleh pH, adanya komponen elektrolit dan non-elektrolit serta bahan tambahan lainnya (Glicksman, 1969).
Pembentukan gel (gelasi) merupakan suatu fenomena penggabungan atau pengikatan silang rantai-rantai polimer membentuk jalinan tiga dimensi yang kontinyu, sehingga dapat menangkap air di dalamnya menjadi suatu
struktur yang kompak dan kaku yang tahan terhadap aliran di bawah tekanan. Pada waktu sol dari gelatin mendingin, konsistensinya menjadi lebih kental, dan selanjutnya akan berbentuk gel. Mekanisme yang tepat tentang pembentukan gel dari sol gelatin masih belum diketahui. Molekul- molekul secara individu bergabung dalam lebih dari satu bentuk kristalin membentuk jalinan tiga dimensi yang menjerat cairan dan berikatan silang secara kuat sehingga menyebabkan terbentuknya gel (Fardiaz, 1989).
Menurut Wijaya (1998) kekuatan gel dari gelatin komersial bervariasi antara 50 – 300 gr bloom. Berdasarkan kekuatan gelnya gelatin dibagi menjadi tiga kategori di bawah ini:
i. Gelatin dengan Bloom tinggi (250 – 300 gr bloom) ii. Gelatin dengan Bloom sedang (150 – 250 gr bloom) iii. Gelatin dengan Bloom rendah (50 – 150 gr bloom).
7. Viskositas
Viskositas adalah daya aliran molekul dalam suatu larutan baik dalam air, cairan organik sederhana dan suspensi serta emulsi encer (De Man, 1997). Viskositas merupakan sifat fisik gelatin yang sangat penting setelah kekuatan gel, karena viskositas mempengaruhi sifat fisik gelatin yang lainnya seperti titik leleh, titik jendal dan stabilitas emulsi. Viskositas gelatin berpengaruh terhadap sifat gel terutama titik pembentukan gel dan titik leleh, dimana viskositas gelatin yang tinggi menghasilkan laju pelelehan dan pembentukan gel yang lebih tinggi dibandingkan gelatin yang viskositasnya rendah. Untuk stabilitas emulsi gelatin diperlukan viskositas yang tinggi (Leiner, 2006). Viskositas dipengaruhi antara lain oleh interaksi hidrodinamik antar molekul gelatin, suhu, pH, dan konsentrasi (Poppe, 1992).
8. Titik Jendal dan Titik Leleh
Titik jendal adalah suhu dimana larutan gelatin dalam konsentrasi tertentu mulai membentuk gel. Titik leleh merupakan kebalikan dari titik jendal yaitu suhu dimana larutan gelatin mulai mencair (Baker, 1994).
9. Titik Isoelektrik
Titik isoelektrik protein (pI) adalah pH dimana protein memiliki jumlah muatan ion positif dan ion negatif yang sama. Pada titik isoelektriknya, kelarutan protein rendah sehingga terjadi penggumpalan atau pengendapan protein. Dengan demikian titik isoelektrik gelatin penting diketahui karena akan berpengaruh pada penggunaannya dalam berbagai produk, terutama kaitannya dengan tingkat kelarutan gelatin (Baker, 1994).
10. Derajat Putih
Derajat putih merupakan gambaran secara umum dari warna gelatin.
Umumnya derajat putih gelatin diharapkan mendekati 100%, karena gelatin yang bermutu tinggi biasanya tidak berwarna (bening) sehingga aplikasinya lebih luas (Budavari, 1996). Derajat putih gelatin dipengaruhi oleh bahan baku, metode pembuatan dan ekstraksi (Poppe, 1992).
11. Komposisi Asam Amino
Gelatin mengandung 19 jenis asam amino yang dihubungkan dengan ikatan peptida membentuk rantai polimer yang panjang. Komposisi asam amino dalam gelatin sangat bervariasi tergantung pada sumber kolagen tersebut, spesies hewan penghasil dan jenis kolagen (Ward dan Courts, 1977).
12. Logam Berat
Logam berat merupakan jenis logam seperti merkuri, krom, cadmium, arsen, dan timbal dengan berat molekul yang tinggi. Logam berat terakumulasi di dalam tubuh makhluk hidup yang mengakibatkan kadarnya lebih besar daripada kadarnya dalam lingkungan dan akan meningkat seiring dengan meningkatnya posisi organisme pada rantai makanan.
Analisis logam berat sangat penting bagi produk seperti gelatin, antara lain untuk menentukan apakah gelatin tersebut aman digunakan atau dikonsumsi terutama dalam produk farmasi (obat-obatan) dan produk pangan (De Man, 1997).
13. Kandungan Mikrobiologi
Uji kuantitatif mikrobiologi penting dilakukan untuk mengetahui mutu bahan pangan. Apabila suatu bahan tercemar oleh mikroba yang berasal dari kotoran manusia atau hewan maka bahan tersebut positif mengandung bakteri E.coli. Adanya E.coli dalam suatu bahan merupakan indikator kontaminasi kotoran, sedangkan Salmonella sp merupakan bakteri pathogen yang berbahaya. Salmonella sp dapat menyebabkan gangguan perut, demam tifus dan paratifus (Fardiaz, 1989).
III. METODA PENELITIAN
A. Bahan dan Alat
Bahan baku yang digunakan dalam penelitian ini adalah tulang ikan tuna yang merupakan sisa proses pengolahan fillet ikan tuna di Muara Baru, Jakarta. Bahan kimia yang digunakan adalah asam klorida, natrium oksida, resin ion exchange, dan akuades.
Alat-alat yang digunakan untuk penelitian dan analisa adalah pisau, ember, kompor gas, panci perebus, talenan, timbangan, neraca analitik Chyo JP-160, sikat, water bath, gelas beaker, sendok, oven, refrigrator (kulkas), blender, TA-XT plus Textur analyzer, thermometer digital Hanna, pH-meter Accument 900-Fisher Scientific, High performance liquid chromatography (HPLC) Water Associates, peralatan mikro Kjheldahl, peralatan soxhlet, kasha mesh size 250, sentryfuse, standart bloom jars, brookfield syncro-lectric viscometer, Absorbsi Atom Spektrofotometer (AAS), Kett digital whiteness powder C-100, Quebec Colony Counter,dan lain-lain.
B. Metode Penelitian 1. Penelitian Tahap I
Terhadap tulang ikan tuna yang merupakan bahan baku pembuatan gelatin terlebih dahulu dilakukan analisa komposisi kimia. Analisa yang dilakukan meliputi kadar air (AOAC, 1995), kadar abu (AOAC, 1995), kadar protein (AOAC, 1995), dan kadar lemak (Apriyantono, 1989).
Proses pembuatan gelatin tulang ikan tuna dengan metode asam yang digunakan meliputi persiapan bahan baku, pencucian, degreasing, pencucian dan pembersihan, pemotongan, perendaman dengan larutan basa, pencucian, perendaman dengan larutan asam, pencucian, ekstraksi, filtrasi, pengeringan, dan penggilingan. Bahan baku berupa tulang ikan tuna yang telah dipersiapkan terlebih dahulu dicuci sampai bersih dari sisa-sisa kotoran dan darah yang masih menempel pada tulang.
Degreasing dilakukan untuk menghilangkan lemak yang terdapat pada tulang. Proses degreasing tersebut dilakukan dengan merebus tulang ikan tuna selama 25-30 menit pada suhu 700C. Proses selanjutnya adalah pemotongan tulang ikan tuna yang telah mengalami degreasing sebesar 2-4 cm. Selanjutnya perlakuan pertama dilanjutkan dengan perendaman asam dan perlakuan kedua dan ketiga dilakukan perendaman basa terlebih dahulu yaitu dengan NaOH 0,4% dan 0,8% selama tiga hari untuk menghilangkan lemak yang masih penempel dan protein non-kolagen yang terdapat pada tulang ikan tuna. Tulang kemudian dicuci dengan air mengalir sampai pH netral (6-7).
Proses demineralisasi adalah proses perendaman dalam larutan asam untuk melanjutkan pembengkakkan tulang. Tujuannya adalah untuk menceraikan serabut-serabut kolagen menjadi serat-serat atau fibril-fibril, sehingga tulang menjadi lebih mudah untuk diekstraksi. Proses perendaman dalam larutan asam klorida dengan konsentrasi 5% dilakukan selama dua hari (sampai menjadi ossein), setiap hari larutan asam klorida diganti dengan yang baru. Perbandingan tulang dengan larutan asam klorida adalah 1:6. Tulang ikan tuna yang telah menjadi ossein dicuci dengan air mengalir hingga pH netral.
Langkah selanjutnya adalah ekstraksi gelatin selama ± enam jam dengan suhu 60-650C. Filtrat yang diperoleh dari proses ekstraksi disaring dengan menggunakan saringan 200 – 250 mesh. Larutan gelatin yang diperoleh kemudian dilakukan ion exchange untuk menghilangkan ion Na+ dan Cl- yang banyak digunakan pada proses sebelumnya. Larutan gelatin yang dihasilkan kemudian dikeringkan dengan oven pada suhu 40 -500C selama ± dua hari. Gelatin yang telah kering kemudian digiling sehingga diperoleh gelatin kering dalam bentuk butiran-butiran halus (bubuk).
Diagram alir proses pembuatan gelatin disajikan pada Gambar 5.
Gambar 5. Diagram Alir Proses Pembuatan Gelatin dari Tulang Ikan Tuna (modifikasi dari Poppe, 1992)
Dicuci sampai pH netral (6-7)
Ekstraksi
Pemasakan ossein pada suhu 60-650C, ± enam jam
Filtrasi Saringan 200-250 mesh
Pengeringan Oven 40-500C, ±dua hari
Penghalusan
Gelatin Kering Bubuk Ion Exchange
Ossein Perendaman Asam HCl 5% sampai menjadi ossein
Dicuci sampai pH netral (6-7) Pencucian
Degreasing
Perebusan Tulang pada suhu 700C, 25-30 menit
Pengecilan Ukuran Dipotong-potong sebesar 2-4 cm
Tulang Ikan Tuna
Perlakuan II: Perendaman
NaOH 0,4% selama tiga hari Perlakuan III. Perendaman NaOH 0,8% selama tiga hari Perlakuan I. Tidak dilakukan
perendaman NaOH
2. Penelitian Tahap II
Penelitian tahap kedua ini bertujuan mengkaji karakteristik gelatin tulang ikan Tuna yang dihasilkan dengan perlakuan terbaik meliputi sifat fisik, sifat kimia dan kandungan mikrobiologi. Pada tahap ini dilakukan pembuatan gelatin dengan teknik ekstraksi terbaik yang diperoleh dari penelitian tahap pertama dengan tiga kali ulangan. Gelatin yang dihasilkan kemudian dibandingkan dengan gelatin standar laboratorium (terbuat dari ikan cod) dan gelatin komersial (terbuat dari tulang sapi).
Pengamatan dilakukan terhadap parameter yang menjadi indikator mutu gelatin yang meliputi rendemen, kadar air, kadar abu, kadar protein, kadar lemak, pH, kekuatan gel, viskositas, titik leleh, titik jendal, titik isoelektrik, komposisi asam amino, derajat putih, logam berat, dan uji mikrobiologi yang meliputi Total Plate Count (TPC), Escherichia coli dan Salmonella. Untuk penelitian tahap kedua, data hasil pengamatan dibandingkan secara deskriptif.
C. Rancangan Percobaan
Pada penelitian tahap pertama yaitu pembuatan gelatin dari tulang ikan Tuna menggunakan Rancangan Acak Lengkap (RAL) dengan tiga perlakuan yaitu perlakuan pertama tanpa perendaman NaOH, perlakuan kedua dan ketiga dilakukan perendaman dengan larutan NaOH 0,4% dan 0,8%. Metode rancangan yang digunakan untuk penelitian tahap pertama adalah sebagai berikut :
Yi = μ + Ai + Σi
(Steel dan Torrie, 1993)
Keterangan :
Yi = Nilai hasil pengamatan μ = Rataan umum
Ai = Pengaruh perlakuan ke-i (i = 1, 2, 3) Σi = faktor galat
Data yang diperoleh, jika berupa data parametrik maka dianalisis menggunakan analisis keragaman dan jika berbeda nyata maka dilanjutkan dengan uji lanjut Duncan (Gaspersz, 1994). Semua data pada penelitian ini diolah menggunakan program SPSS 12.0
D. Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Maret sampai dengan bulan Juni 2007. Tempat penelitian adalah di Balai Besar Riset Pengolahan Produk Dan Bioteknologi Kelautan Dan Perikanan, Jalan K.S. Tubun Petamburan VI, Slipi, Jakarta dan Balai Pasca Panen Hasil Pertanian, Jalan Tentara Pelajar 12A, Cimanggu, Bogor.
IV. HASIL DAN PEMBAHASAN
A. Penelitian Tahap I
Pada penelitian tahap pertama dilakukan persiapan bahan baku yang digunakan untuk pembuatan gelatin, analisis komposisi kimia tulang ikan tuna, serta pencarian metode ekstraksi yang tepat untuk menghasilkan gelatin tulang ikan tuna yang dilihat dari rendemen, kekuatan gel, viskositas, dan derajat keasaman (pH). Bahan baku yang digunakan adalah limbah tulang ikan tuna yang berasal dari produksi fillet ikan tuna di daerah Muara Baru, Jakarta.
Bahan baku gelatin tulang ikan tuna (Thunnus albacares) dapat dilihat pada Gambar 6.
Gambar 6. Tulang Ikan Tuna (Thunnus albacares)
Persiapan bahan baku meliputi pemisahan tulang dari daging yang menempel dengan cara direbus pada suhu 700C selama 25 – 30 menit, dilanjutkan dengan pembersihan tulang dari sisa-sisa daging dan lemak yang menempel, setelah itu tulang ikan dipotong-potong 2 – 4 cm. Untuk analisis komposisi kimia, tulang ikan tuna yang telah dipotong-potong kemudian dihancurkan sampai homogen. Hasil analisis komposisi kimia tulang ikan tuna yang sudah dibersihkan disajikan pada Tabel 8.
Tabel 8. Hasil Analisis Komposisi Kimia Tulang Ikan Tuna
Parameter Kandungan (%)
Kadar Air 28,57
Kadar Abu 28,97
Kadar Protein 23,64
Kadar Lemak 15,49
Tulang ikan yang digunakan untuk pembuatan gelatin harus dalam keadaan masih segar. Kesegaran bahan baku mempengaruhi kualitas ossein dan gelatin yang dihasilkan. Menurut Hinterwaldner (1977) semakin segar bahan baku maka kualitas gelatin akan semakin tinggi. Kadar air yang dikandung oleh tulang tuna adalah 28,57%, menandakan bahwa tulang tuna yang akan digunakan untuk pembuatan gelatin umumnya masih dalam keadaan masih segar.
Kadar abu menunjukkan jumlah bahan anorganik yang terdapat dalam bahan organik. Abu menunjukkan jumlah bahan anorganik yang tersisa selama proses pembakaran tinggi (± 6000C) selama dua jam. Jumlah abu dipengaruhi oleh jumlah ion-ion anorganik yang terdapat dalam bahan selama proses berlangsung (Rahayuningsih, 2004). Kadar abu dalam tulang ikan tuna adalah 28,90%.
Kandungan protein yang terdapat dalam tulang ikan tuna adalah 23,64%, sehingga tulang ikan tuna dapat digunakan dalam pembuatan gelatin.
De Man (1997), menyatakan bahwa kolagen menyusun hampir sepertiga total massa protein pada vertebrata, yang terdapat pada jaringan ikat dalam otot, kulit, tulang, tulang rawan, gigi dan tendon.
Kadar lemak yang terkandung pada tulang ikan tuna yaitu sebesar 15,49% akan berpengaruh pada proses ekstraksi gelatin. Kadar lemak yang terdapat pada tulang ikan tuna dapat membuat gelatin yang dihasilkan akan berwarna coklat kehitaman. Untuk itu proses degreasing sangat penting diperhatikan.
Pembuatan gelatin dari tulang ikan tuna dilakukan dengan proses asam dan akan menghasilkan gelatin tipe A. Menurut Wiyono (2001) pertimbangan dilakukannya proses asam karena senyawa asam dapat memutuskan ikatan hidrogen struktur koil kolagen lebih baik dalam waktu yang relatif singkat.
Menurut Utama (1997) penggunaan asam dalam proses pembuatan gelatin mempunyai kelebihan yaitu mampu mengubah serat kolagen triple heliks menjadi rantai tunggal dalam waktu singkat, sedangkan larutan basa hanya mampu menghasilkan rantai ganda. Hal ini menyebabkan pada waktu yang sama jumlah kolagen yang dihidrolisis oleh larutan asam lebih banyak daripada larutan basa.
Proses awal dari pembuatan gelatin adalah degreasing. Degreasing adalah proses penghilangan daging, kotoran dan lemak yang masih menempel pada tulang. Pada penelitian ini degreasing dilakukan dengan cara merebus tulang ikan tuna pada suhu 700C selama 25 – 30 menit. Suhu tersebut sesuai dengan titik kelarutan lemak dan titik koagulasi albumin tulang yang berkisar antara 32 – 800C, jika suhu yang digunakan lebih dari itu maka akan merusak dan mengurangi banyaknya kolagen yang akan dihasilkan. Menurut Hinterwaldner (1977) degreasing yang dilakukan selama 30 menit merupakan waktu yang optimum untuk mengurangi jumlah lemak dalam ossein dan menghasilkan kolagen yang berkualitas baik.
Tulang ikan tuna yang telah mengalami proses degreasing dilanjutkan dengan proses pembersihan, pencucian dengan air mengalir dan pemotongan tulang menjadi 2 – 4 cm. Pencucian tulang yang baik akan menghasilkan kadar lemak yang kecil, sehingga akan mempermudah proses selanjutnya.
Menurut Nurilmala (2004) pemotongan tulang bertujuan untuk memperluas permukaan tulang sehingga pada proses selanjutnya yaitu demineralisasi dan ekstraksi, reaksi berlangsung lebih cepat dan sempurna.
Tulang yang telah dipotong-potong kemudian dilakukan proses demineralisasi untuk perlakuan pertama atau perendaman dalam larutan NaOH selama ± tiga hari terlebih dahulu untuk perlakuan kedua dan ketiga.
Menurut Nagai dan Suzuki (1999) perendaman kulit dan tulang ikan dalam NaOH 0,1 N bertujuan untuk menghilangkan protein non-kolagen dan
menghilangkan lemak yang masih terkandung dalam tulang. Konsentrasi larutan larutan NaOH yang digunakan adalah 0,4% dan 0,8%. Demineralisasi yaitu proses menghilangkan kalsium dan garam di dalam tulang, sehingga dihasilkan tulang lunak yang disebut ossein dimana terdapat kolagen didalamnya. Ossein adalah tulang lunak yang mengandung kolagen, mukopolisakarida dan sejenis kecil protein lainnya (Hinterwaldner, 1977).
Proses demineralisasi dilakukan dengan merendam tulang dalam larutan asam klorida 5% selama dua hari (sampai menjadi ossein) dan larutan asam klorida diganti setiap harinya. Penggantian asam klorida ini dimaksudkan untuk mempercepat proses demineralisasi dan mengurangi kadar lemak yang terlarut dalam larutan gelatin. Menurut Utama (1997) jenis asam yang digunakan berpengaruh terhadap jumlah gelatin yang dihasilkan dan sifat-sifatnya. Asam klorida merupakan jenis asam yang paling tepat digunakan dalam proses ekstraksi, walaupun rendemen yang diperoleh lebih rendah dibanding dengan asam sulfat, tetapi harga asam klorida lebih murah, residu abunya lebih rendah (karena bobot molekulnya lebih rendah) dan asam klorida bersifat kurang korosif jika dibandingkan asam sulfat.
Pada tahap demineralisasi, tulang diselimuti larutan asam klorida sehingga terjadi reaksi antara kalsium fosfat pada tulang dengan asam klorida menghasilkan garam kalsium yang larut sehingga tulang menjadi lunak.
Menurut Hinterwaldner (1977), kalsium dalam tulang terutama dalam kalsium fosfat dalam larutan HCl terurai menjadi Ca2+ dan asam fosfat, reaksinya adalah sebagai berikut:
Ca3(PO4)2 + 6HCl 3CaCl2 + 2H3PO4
Tulang yang telah menjadi ossein selanjutnya dicuci dengan air mengalir yang bertujuan untuk menetralkan pH (6,5-7) dan mencegah terjadinya hidrolisis lanjutan. Proses pencucian tersebut sangat mempengaruhi mutu gelatin dari nilai derajat keasaman dan seberapa besar sisa-sisa lemak yang masih menempel sesudah proses demineralisasi.
Tahap selanjutnya adalah konversi kolagen menjadi gelatin, dalam tahap ini ossein diekstraksi menggunakan akuades, perbandingan antara ossein dan akuades adalah 1:2, dengan menggunakan suhu 60-650C selama enam