KARAKTERISTIK BIODIESEL
HASIL TRANSESTERIFIKASI MINYAK GORENG BEKAS DENGAN KATALIS H-ZEOLIT DAN KOH
ARIF RAHMAN HAKIM
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2012 M/ 1433 H
KARAKTERISTIK BIODIESEL
HASIL TRANSESTERIFIKASI MINYAK GORENG BEKAS DENGAN KATALIS H-ZEOLIT DAN KOH
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
ARIF RAHMAN HAKIM 105096003157
PROGRAM STUDI KIMIA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
2012 M / 1433 H
PERNYATAAN
DENGAN INI SAYA MENYATAKAN BAHWA SKRIPSI INI ADALAH HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN
Jakarta, Mei 2011
ARIF RAHMAN HAKIM 105096003157
iv
KATA PENGANTAR
Bilmillahirrahmanirrahim, Assalamualaikum Wr. Wb
Segala puji syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan proposal penelitian yang berjudul ”Karakteristik Biodiesel Hasil Transesterifikasi Minyak Goreng Bekas dengan Katalis H-Zeolit dan KOH”. Shalawat serta salam semoga tetap tercurah limpah kepada junjungan kita Nabi Muhammad SAW, kepada para keluarga, sahabat-sahabatnya dan mudah-mudahan termasuk pula kita selaku umatnya. Amin.
Skripsi ini disusun untuk memenuhi salah satu persyaratan meraih gelar Strata 1 (S1) di Fakultas Sains dan Teknologi, Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
Selama penulisan skripsi ini, berbagai pihak telah memberikan bantuan dan dorongan semangat. Oleh karena itu, pada kesempatan ini penulis ingin mengucapkan rasa hormat dan terima kasih kepada berbagai pihak yaitu :
1. Isalmi Aziz, MT, selaku Dosen Pembimbing I yang telah membimbing dan memberikan arahan dalam menyelesaikan penulisan skripsi ini.
2. Siti Nurbayti, M.Si, selaku Dosen Pembimbing II yang telah membimbing dan memberikan saran dalam menyelesaikan penulisan skripsi ini.
3. Drs. Dede Sukandar, M.Si, selaku Ketua Program Studi Kimia Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
v
4. Dr. Syopiansyah Jaya Putra, M.Sis, selaku Dekan Fakultas Sains dan Teknologi UIN Syarif Hidayatullah Jakarta.
5. DR. Thamzil Las selaku Penguji I dan Drs. Dede Sukandar, M.Si selaku penguji II yang telah memberi saran dan kritik dalam penulisan skripsi ini.
6. Dosen-dosen Kimia yang selalu memberi semangat untuk maju.
7. Laboratorium Kimia PLT UIN Jakarta, yang telah memberikan fasilitas untuk penelitian ini.
8. Pak Aris, Mba Ernita, Mba Pipit, serta laboran lainnya yang selalu membantu selama terlaksananya penelitian.
9. Kedua orang tua yakni Bapa Mamad Ma’turidi, Umi Cicih Sunarsih, kakak, dan adik tercinta yang telah memberikan bantuan kepada penulis baik materi maupun immateri.
10. Teman-teman Program studi kimia angkatan 2005 UIN Syarif Hidayatullah
11. Semua pihak yang tidak dapat penulis sebutkan satu persatu.
Penulis juga menyadari bahwa dalam penyusunan skripsi ini masih terdapat kekurangan, untuk itu saran dan kritik yang membangun sangat penulis harapkan dari pembaca. Semoga skripsi ini bermanfaat bagi penulis dan mahasiswa Kimia UIN pada khususnya dan masyarakat pada umumnya.
Wassalamu’alaikum Wr. Wb
Jakarta, Nopember 2012
Penulis
vi
DAFTAR ISI
Hal
KATA PENGANTAR ... iv
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
ABSTRAK ... xi
ABSTRACT ... xii
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 4
1.3. Tujuan Penelitian ... 4
1.4. Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1. Biodiesel ... 5
2.2. Bahan Bakar Pembuatan Biodiesel ... 8
2.2.1. Lemak dan Minyak ... 8
2.2.2. Alkohol ... 12
2.2.3. Katalis ... 14
2.3. Proses Pembuatan Biodiesel ... 17
2.3.1. Esterifikasi ... 17
2.3.2. Transesterifikasi ... 18
2.4. Karakteristik Biodiesel ... 20
2.5. Zeolit ... 23
BAB III METODE PENELITIAN ... 28
3.1. Waktu dan Tempat Penelitian... 28
3.2. Alat dan Bahan ... 28
3.3. Cara Kerja ... 28
3.3.1. Analisa Bahan Baku ... 28
3.3.2. Pembuatan Biodiesel dengan Katalis KOH ... 31
vii
3.3.3. Pembuatan Biodiesel dengan Katalis Zeolit Alam (H-zeolit) ... 32
3.3.4. Analisa Senyawa Biodiesel dengan GC-MS ... 33
BAB IV HASIL DAN PEMBAHASAN ... 35
4.1. Analisa Sifat Fisika dan Kima Minyak Goreng Bekas ... 35
4.2. Optimasi Kondisi Operasi Pembuatan Biodiesel dengan Katalis KOH ... 37
4.2.1. Pengaruh Waktu Reaksi terhadap Yield Biodiesel ... 37
4.2.2. Pengaruh Konsentrasi Katalis terhadap Yield Biodiesel ... 38
4.2.3. Pengaruh Perbandingan Reaktan terhadap Yield Biodiesel ... 40
4.3. Optimasi Kondisi Operasi Pembuatan Biodiesel dengan Katalis H-zeolit 42 4.3.1. Pengaruh Waktu Reaksi terhadap Yield Biodiesel ... 42
4.3.2. Pengaruh Konsentrasi Katalis terhadap Yield Biodiesel ... 43
4.3.3. Pengaruh Perbandingan Reaktan terhadap Yield Biodiesel ... 45
4.4. Karakteristik Biodiesel ... 46
4.5. Komposisi Senyawa Biodiesel Hasil Uji GC-MS ... 48
BAB V KESIMPULAN DAN SARAN ... 52
5.1. Kesimpulan ... 52
5.2. Saran ... 52
DAFTAR PUSTAKA ... 53
LAMPIRAN ... 58
viii
DAFTAR TABEL
Hal
Tabel 1. Jenis Tanaman sebagai Bahan Baku Biodiesel ... 11
Tabel 2. Komposisi Asam Lemak Minyak Jelantah ... 12
Tabel 3. Standar dan Mutu Biodiesel ... 21
Tabel 4. Sifat fisika dan kimia minyak goreng bekas ... ` 35
Tabel 5. Sifat fisik biodiesel dengan katalis KOH dan H-zeolit ... 46
Tabel 6. Jenis senyawa yang terkandung pada biodiesel dengan katalis KOH ... 49
Tabel 7. Jenis senyawa yang terkandung pada biodiesel dengan katalis H-zeolit ... 50
ix
DAFTAR GAMBAR
Hal
Gambar 1. Biodiesel ... 5
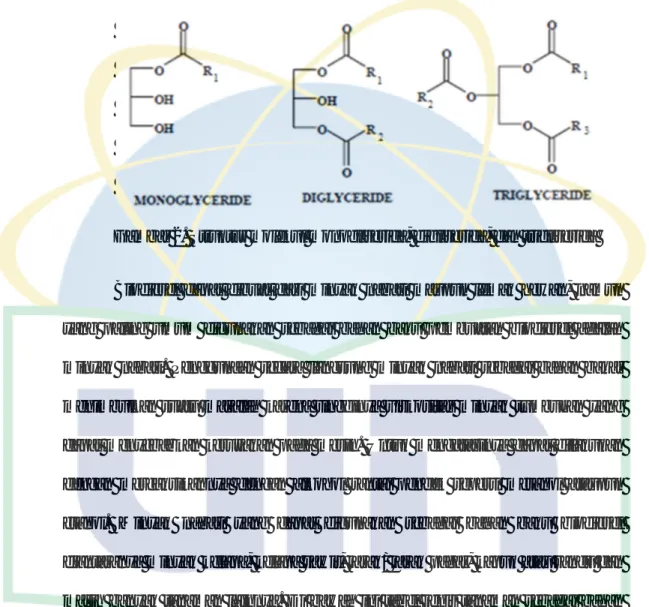
Gambar 2. Struktur molekul monogliserida, digliserida, dan trigliserida ... 10
Gambar 3. Mekanisme esterifikasi asam lemak ... 17
Gambar 4. Reaksi transesterifikasi trigliserida dengan alkohol ... 18
Gambar 5.Tetrahedra alumina dan silika (TO4) pada struktur zeolit ... 24
Gambar 6. Falling ball viscometer ... 30
Gambar 7. Rangkaian alat untuk pembuatan biodiesel ... 33
Gambar 8. GCMS Shimadzu-QP2010 ... 33
Gambar 9. Skema Kerja Penelitian ... 34
Gambar 10. Reaksi pembentukan asam lemak bebas pada minyak ... 37
Gambar 11. Reaksi safonifikasi asam lemak bebas ... 37
Gambar 12. Pengaruh waktu reaksi terhadap yield biodiesel ... 38
Gambar 13. Pengaruh konsentrasi KOH terhadap yield biodiesel ... 39
Gambar 14. Pengaruh % reaktan terhadap % yield biodiesel ... 41
Gambar 15. Pengaruh waktu reaksi terhadap yield biodiesel ... 43
Gambar 16. Pengaruh konsentrasi H-zeolit terhadap yield biodiesel ... 44
Gambar 17. Pengaruh % reaktan terhadap % yield biodiesel ... 45
Gambar 18 . Biodiesel dengan katalis H-zeolit (a) dan KOH (b) ... 45
Gambar 19. Kromatogram biodiesel dengan katalis H-zeolit ... 48
Gambar 20. Kromatogram biodiesel dengan katalis KOH hasil analisa GCMS ... 48
Gambar 21. Kromatogram biodiesel dengan katalis H-zeolit ... 40
x
DAFTAR LAMPIRAN
Hal
Lampiran 1. Standarisasi Larutan ... 58
Lampiran 2. Perhitungan Sifat Fisik dan Kimia Minyak Goreng Bekas ... 59
Lampiran 3. Persen Hasil Biodiesel pada Proses Transesterifikasi ... 62
Lampiran 4. Hasil Perhitungan Sifat Fisik Biodiesel ... 64
xi
ABSTRAK
Biodiesel merupakan energi alternatif yang sangat potensial sebagai bahan baku pengganti solar. Penelitian ini bertujuan untuk mengetahui perbandingan kualitas biodiesel yang dihasilkan dengan menggunakan katalis KOH dan H-zeolit.
Biodiesel dibuat dengan mereaksikan minyak goreng bekas dan metanol dengan perbandingan 4:1 (volum) dan suhu 60oC. Biodiesel yang dihasilkan dengan menggunakan katalis KOH mempunyai densitas 0,85 g/mL dan viskositas 3,09 cSt. Senyawa kimia yang dominan dalam biodiesel adalah asam heksadekanoat, metil ester (29,90%), dan asam 9-oktadekanoat (Z)-, metil ester (55,80%).
Sedangkan biodiesel yang menggunakan H-zeolit mempunyai densitas 0,78 g/mL dan viskositas 0,35 cSt. Senyawa kimianya adalah asam heksadekanoat, metil ester (10,85%), dan asam 9-oktadekanoat (Z),- metil ester (11,97%). Biodiesel menggunakan katalis KOH memenuhi syarat kualitas biodiesel menurut SNI.
Kata kunci : Biodiesel, Minyak goreng bekas, KOH, Zeolit alam
xii
ABSTRACT
Biodiesel is a potentially of alternative energy as a fuel substitute for diesel. This research aims to determine the comparative quality of biodiesel produced by using H-zeolite catalyst and KOH. Biodiesel is made by reacting the use cooking oil and methanol in a ratio of 4:1 (volume) and a temperature of 600C. biodiesel is produced using KOH catalyst has a density of 0,85 g/ mL and viscosity of 3,09 cSt. The dominant chemical compounds in the biodiesel is hexadecanoic acid, methyl ester (29,90%), and 9-octadecanoic acid (Z)-, methyl ester (55,80%).
While the biodiesel which use H-zeolyte catalyst has a density of 0,78 g/ mL and viscosity of 0,35 cSt. Chemical compounds are hexadecanoic acid, methyl ester (10,85%), and 9-octadecanoic acid (Z),- methyl ester (11,97%). Biodiesel using KOH catalyst qualified biodiesel quality by SNI.
Keyword : Biodiesel, Used Cooking Oil, KOH, H-zeolite.
1
BAB I PENDAHULUAN
1.1. Latar Belakang Masalah
Meningkatnya populasi manusia di bumi menyebabkan kebutuhan akan energi semakin meningkat. Setiap hari, jutaan barel minyak mentah bernilai jutaan dolar dieksploitasi tanpa memikirkan bahwa minyak bumi tersebut merupakan hasil dari evolusi alam yang berlangsung selama ribuan, bahkan jutaan tahun yang mungkin tidak dapat terulang lagi pada masa mendatang. Di lain pihak, permintaan pasar semakin meningkat baik untuk transportasi, tenaga pembangkit maupun pertambangan. Untuk mengatasi hal tersebut maka perlu dilakukan pencarian sumber bahan bakar alternatif. Bahan bakar yang alternatif ini haruslah mempunyai sifat dapat diperbaharui, tidak terbatas jumlahnya dan ramah lingkungan.
Biodiesel merupakan salah satu energi alternatif yang cukup menjanjikan.
Bahan bakunya yang berasal dari bahan terbarukan menjadikan ketersediaannya dapat dijamin. Biodiesel juga merupakan bahan bakar yang ramah lingkungan, tidak mengandung belerang sehingga dapat mengurangi kerusakan lingkungan yang diakibatkan oleh hujan asam (rain acid) (Suwarsono dkk., 2008).
Biodiesel atau alkil ester merupakan bahan bakar minyak yang disintesis dari minyak nabati atau lemak hewan (trigliserida). Biodiesel mempunyai sifat fisik yang serupa dengan minyak diesel (solar) yang berasal dari minyak bumi.
Biodiesel juga merupakan bahan bakar yang biodegradable, energi alternatif yang mampu memenuhi kebutuhan mesin dengan aman tanpa mengurangi kemampuan
2 kinerja mesin tersebut. Dengan demikian biodiesel memberikan solusi untuk menanggulangi krisis menipisnya bahan bakar fosil serta kerusakan lingkungan (Knothe dkk., 2005). Produksi biodiesel ini mendukung kelestarian alam yang sekaligus akan menciptakan lapangan kerja baru dan kemungkinan ditemukannya pasar baru untuk produk hasil pertanian.
Minyak nabati, seperti minyak kelapa sawit, merupakan bahan baku primer yang digunakan dalam produksi biodiesel. Dari segi ekonomis, harga biodiesel relatif lebih tinggi jika dibandingkan dengan harga solar. Oleh karena itu berbagai solusi dilakukan untuk mengatasi hal tersebut mulai dari pemilihan bahan baku, penggunaan reaktan, penggunaan katalis sampai dengan proses produksi. Salah satu pilihan alternatif lain yang dilakukan untuk menekan harga adalah dengan penggunaan limbah minyak goreng bekas yang biasanya berasal dari minyak sawit. Minyak goreng bekas sawit merupakan limbah rumah tangga atau industri pangan yang sebenarnya memiliki potensi tinggi untuk diproses menjadi biodiesel, namun dalam kehidupan sehari-hari kita jumpai minyak tersebut dibuang begitu saja atau dimanfaatkan terus tanpa adanya usaha untuk memproses minyak tersebut menjadi bahan yang berguna. Pembuatan biodiesel dari minyak goring bekas sebenarnya telah dilakukan oleh para peneliti dengan berbagai metode (Wijaya dan Hasanudin, 2010). Minyak-minyak sisa ini dikumpulkan dan diubah menjadi biodiesel, untuk selanjutnya dapat menjadi bahan bakar minyak bagi kompor gorengan yang telah disesuaikan, dapat pula menjadi bahan bakar untuk berbagai mesin diesel yang banyak digunakan misalnya mesin pemarut kelapa, penggilingan padi dan mesin diesel lain yang sering dijumpai pada masyarakat kita.
3 Pada umumnya pembuatan biodiesel dari minyak nabati dan alkohol melibatkan reaksi esterifikasi ataupun transeserifikasi yang diubah menjadi metil ester atau etil ester. Pada reaksi esterifikasi ataupun transesterifikasi diperlukan adanya suatu katalis yang mempercepat terjadinya suatu reaksi. Katalis yang digunakan dapat berupa katalis homogen (asam dan basa) maupun heterogen (zeolit). Katalis asam sedikit digunakan dalam industri biodiesel karena lambatnya laju reaksi, dengan katalis basa reaksi lebih cepat dan dapat berlangsung pada suhu kamar (Kwartiningsih dan Setyawardhani., 2007) dan konsentrasi yang digunakan sangat kecil antara 0,5 sampai 1% (Tambun, 2009). Penggunaan katalis homogen dalam skala industri dinilai kurang ekonomis karena katalis yang digunakan akhirnya tercampur dengan alkohol , sehingga sering terjadi reaksi samping yaitu reaksi saponifikasi (penyabunan) yang dapat mengganggu reaksi pembentukan biodiesel. Untuk itu diperlukan katalis yang dapat menggantikan katalis homogen tersebut. Katalis heterogen mempunyai kelebihan dalam pemisahan dari sisa reaktan dan produk serta tahan terhadap temperatur tinggi.
Salah satu yang prospektif dan menjanjikan adalah katalis heterogen seperti zeolit.
Zeolit adalah katalis yang sering digunakan karena memiliki memiliki penyusun yang penting yang tidak dapat ditemukan dalam katalis amorf konvensional. Zeolit mempunyai struktur berongga dan biasanya rongga ini diisi oleh air dan kation yang bisa dipertukarkan dan memiliki ukuran pori yang tertentu. Oleh karena itu zeolit sering digunakan sebagai katalis (Susilowati, 2006). Reaksi katalis terjadi di dalam pori-pori kristal zeolit. Sifat zeolit yang sangat penting sebagai katalis adalah ukuran pori-pori dan volume kosong yang besar. Selain itu perbandingan atom Si dan Al mempengaruhi sifat zeolit sebagai
4 katalis. Pada penggunaannya, zeolit memiliki aktivitas dan stabilitas termal yang tinggi (Witanto dkk., 2010), cukup ekonomis serta keberadaannya di alam cukup melimpah.
1.2. Perumusan Masalah
Permasalahan yang muncul dalam penelitian ini adalah :
1. Bagaimana pengaruh waktu reaksi, konsentrasi katalis, dan perbandingan reaktan terhadap yield biodiesel yang dihasilkan.
2. Bagaimana kualitas dan kuantitas biodiesel yang dihasilkan menggunakan katalis KOH dan H-zeolit.
1.3. Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Mendapatkan kondisi terbaik pembuatan biodiesel (waktu reaksi, konsentrasi katalis, dan perbandingan reaktan).
2. Mengetahui kualitas dan kuantitas biodiesel yang dihasilkan dengan menggunakan katalis KOH dan H-zeolit.
1.4. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi tentang kualitas dan kuantitas biodiesel yang dihasilkan jika menggunakan katalis homogen (KOH) dan katalis heterogen (H-zeolit).
5
BAB II
TINJAUAN PUSTAKA
2.1. Biodiesel
Biodiesel adalah senyawa ester asam lemak yang dihasilkan dari reaksi alkoholisis (transesterifikasi dan esterifikasi) asam lemak yang berasal dari minyak nabati atau hewani dengan alkohol rantai pendek dan digunakan sebagai bahan bakar diesel. Biodiesel merupakan bahan bakar diesel alternatif yang dapat diperbaharui dan berkelanjutan. Manfaat bahan bakar ini dibandingkan dengan bahan bakar fosil diantaranya yaitu toksisitas lebih rendah dan hampir nol emisi belerang (Marcheti dkk., 2008). Selain itu penggunaan biodiesel juga dapat mengurangi emisi karbon monoksida, hidrokarbon total, partikel, dan sulfur dioksida serta asap pada keluaran proses dan pada pembakaran biodiesel tidak menambah tingkat level CO2 pada atmosfer (Shu dkk., 2006). Pada gambar di bawah ini dapat dilihat bentuk fisik dari biodiesel.
Gambar 1.Biodiesel
6 Biodiesel mempunyai rantai karbon antara 12 sampai 20 serta mengandung oksigen. Adanya oksigen pada biodiesel membedakannya dengan minyak diesel (solar) yang komponen utamanya hanya terdiri dari hidrokarbon.
Jadi komposisi biodiesel dan petroleum diesel sangat berbeda. Biodiesel terdiri dari metil ester asam lemak nabati, sedangkan minyak diesel adalah hidrokarbon.
Namun, biodiesel mempunyai sifat kimia dan fisika yang serupa dengan minyak diesel (solar) sehingga dapat digunakan langsung untuk mesin diesel atau dicampur dengan minyak diesel. Pencampuran 20% biodiesel ke dalam minyak diesel menghasilkan produk bahan bakar tanpa mengubah sifat fisik secara nyata.
Produk ini di Amerika dikenal sebagai Diesel B-20 yang banyak digunakan untuk bahan bakar bus. Energi yang dihasilkan oleh biodiesel relatif tidak berbeda dengan minyak diesel. Walaupun kandungan kalori biodiesel sama dengan minyak diesel, tetapi karena biodiesel mengandung oksigen, maka flash point nya lebih tinggi sehingga tidak mudah terbakar. Biodiesel mengandung 10-11%
oksigen, yang mendorong pembakaran pada mesin lebih baik dibanding hidrokarbon dari bahan bakar diesel (Widyastuti, 2007). Biodiesel juga tidak menghasilkan uap yang membahayakan pada suhu kamar, maka biodiesel lebih aman daripada minyak diesel dalam penyimpanan dan penggunaannya.
Ada beberapa alasan kenapa biodiesel sangatlah penting dikembangkan sebagai energi alternatif diantaranya sebagai berikut:
1. Menyediakan pasar bagi kelebihan produksi minyak tumbuhan dan lemak hewan.
2. Untuk mengurangi ketergantungan pada bahan bakar fosil.
7 3. Biodiesel dapat diperbarui dan siklus karbonnya yang tertutup tidak menyebabkan pemanasan global (Dunn, 2005). Analisa siklus kehidupan memperlihatkan bahwa emisi CO2 secara keseluruhan berkurang sebesar 78%
dibandingkan dengan mesin diesel yang menggunakan bahan bakar petroleum 4. Emisi gas dari biodiesel lebih rendah dibandingkan bahan bakar minyak untuk
diesel
5. Bila ditambahkan ke bahan bakar diesel biasa dengan jumlah sekitar 1-2%, biodiesel ini dapat mengubah bahan bakar dengan kemampuan pelumas yang rendah, seperti modern ultra low sulfur diesel fuel , menjadi bahan bakar yang dapat diterima umum (Gerpen, 2005).
Biodiesel memiliki efek pelumasan yang sangat tinggi, sehingga membuat mesin diesel lebih awet. Biodiesel juga memiliki angka setana relatif tinggi, mengurangi ketukan pada mesin sehingga mesin bekerja lebih mulus. Biodiesel juga memiliki flash point yang lebih tinggi dibandingkan dengan solar, tidak menimbulkan bau yang berbahaya sehingga lebih mudah dan aman untuk ditangani. Keunggulan biodiesel lainnya seperti dapat diperbaharui, biodegradable (dapat terurai oleh mikroorganisme), tidak mengandung sulfur dan benzene yang mempunyai sifat karsinogen (Knothe dkk., 2005). Biodiesel sangat ramah lingkungan karena gas buang hasil pembakarannya yang dilepaskan ke atmosfer akan diserap kembali oleh tumbuhan untuk keperluan proses fotosintesis (Havendri, 2008).
Hasil pengujian emisi gas buang mesin diesel berbahan bakar biodiesel menunjukkan adanya partikel, hidrokarbon dan karbon monoksida yang lebih rendah pada saluran buang (Kristanto dan Winaya, 2002). Dari hasil penelitian
8 didapatkan emisi gas buang dari campuran 70% volume solar dan 30% volume metil ester sawit (MES-30) dan dari campuran 70% volume solar dan 30%
volume metil ester jarak (MEJ-30), menghasilkan emisi smoke, hidrokarbon, dan CO lebih rendah dibandingkandengan solar (Sugiarto, 2005).
2.2. Bahan Baku Pembuatan Biodiesel
Secara umum bahan baku pembuatan biodiesel terdiri dari lemak/minyak (nabati dan hewani) yang mengandung asam lemak berantai panjang, alkohol (biasanya metanol atau etanol), dan katalis untuk mempercepat terjadinya reaksi (Tjukup dkk., 2011).
2.2.1. Lemak dan Minyak
Lemak dan minyak adalah trigliserida atau triasilgliserol yang berarti triester (dari) gliserol. Perbedaan antara lemak dan minyak secara umum dapat dilihat dari sifat fisiknya. Pada temperatur kamar lemak berbentuk padat dan minyak bersifat cair. Sebagian besar gliserida pada hewan berupa lemak, sedangkan gliserida pada pada tumbuhan cenderung berupa minyak, karena itu biasa terdengar ungkapan lemak hewani (lemak sapi, babi dan lain-lain) dan minyak nabati (minyak jagung, kelapa, sawit dan lain-lain) (Fessenden dan Fessenden, 1986). Lemak dan minyak adalah salah satu kelompok yang termasuk pada golongan lipid, yaitu senyawa organik yang terdapat di alam serta tidak larut dalam air, tetapi larut dalam pelarut organik non-polar, misalnya dietil eter (C2H5OC2H5), kloroform (CHCl3), benzena dan hidrokarbon lainnya. Lemak dan minyak dapat larut dalam pelarut yang disebutkan di atas karena lemak dan minyak mempunyai polaritas yang sama dengan pelarut tersebut. Hasil hidrolisis
9 lemak dan minyak adalah asam karboksilat dan gliserol. Asam karboksilat ini juga disebut asam lemak yang mempunyai rantai hidrokarbon yang panjang dan tidak bercabang.
Komposisi senyawa yang terdapat dalam minyak nabati terdiri dari trigliserida-trigliserida asam lemak (mempunyai kandungan terbanyak dalam minyak nabati, mencapai sekitar 95%), asam lemak bebas (Free Fatty Acid atau biasa disingkat dengan FFA), mono dan digliserida, serta beberapa komponen- komponen lain seperti phosphoglycerides, vitamin, mineral, atau sulfur. Senyawa- senyawa yang umum digunakan dalam pembuatan biodiesel adalah (Mittelbach dkk., 2004):
a. Trigliserida, yaitu komponen utama berbagai macam lemak dan minyak- lemak.
b. Asam lemak, yaitu produk samping industri pemulusan (refining) lemak dan minyak-lemak.
Trigliserida adalah triester dari gliserol dengan asam lemak, yaitu asam karboksilat beratom karbon 6 s/d 30. Trigliserida banyak terkandung dalam minyak dan lemak, sedangkan asam lemak bebas adalah asam lemak yang terpisahkan dari trigliserida, digliserida, monogliserida, dan gliserin bebas. Hal ini disebabkan oleh pemanasan dan terdapatnya air sehingga terjadi proses hidrolisis.
Oksidasi juga dapat meningkatkan kadar asam lemak bebas dalam minyak nabati.
Dalam bahan pangan, kandungan asam lemak bebas lebih dari 0,2% akan mengakibatkan flavor yang tidak diinginkan dan dapat meracuni tubuh (Chevtia, 2008). Di bawah ini dapat dilihat stuktur umum dari monogliserida, digliserida
10 dan trigliserida. R pada senyawa di bawah ini menunjukkan kandungan atom karbon berantai panjang.
Gambar 2. Struktur molekul monogliserida, digliserida, dan trigliserida
Biodiesel dapat dibuat dari minyak nabati maupun lemak hewan, namun yang paling umum digunakan sebagai bahan baku pembuatan biodiesel adalah minyak nabati. Penggunaan secara langsung minyak nabati sebagai bahan bakar menimbulkan suatu masalah karena tingginya viskositas minyak tumbuhan yang dapat menyebabkan kerusakan pada mesin. Untuk mengatasinya dapat dilakukan dengan mereaksikannya dengan alkohol rantai pendek seperti metanol ataupun etanol. Minyak nabati yang dapat digunakan sebagai bahan baku biodiesel diantaranya minyak kelapa, kelapa sawit, jarak/ jarak pagar, kapuk atau randu dan masih banyak tanaman lainnya. Di bawah ini tabel jenis tanaman sebagai bahan baku biodiesel.
11 Tabel 1. Jenis Tanaman sebagai Bahan Baku Biodiesel
No Nama Lokal Nama Latin Sumber Minyak Isi % Berat Kering 1 Jarak Pagar Jatropha curcas Inti biji 40-60 2 Jarak Kaliki Riccinus communis Biji 45-50
3 Kacang Suuk Arachis hypogea Biji 35-55
4 Kapok/ Randu Ceiba pantandra Biji 24-40
5 Karet Hevea brasiliensis Biji 40-50
6 Kecipir Psophocarpus tetrag Biji 15-20 .
7 Kelapa Cocos nucifera Inti biji 60-70
8 Kelor Moringa oleifera Biji 30-49
9 Kacang tanah Aleurites moluccana Inti biji 57-69
10 Kusambi Sleichera trijuga Sabut 55-70
11 Nimba Azadiruchta indica Inti biji 40-50
12 Saga Utan Adenanthera pavonina Inti biji 14-28 13 Sawit Elais suincencis Sabut dan biji 45-70 + 46-54 14 Nyamplung Callophyllum
Lanceatum
Inti biji 40-73
15 Randu Alas Bombax malabaricum Biji 18-26
16 Sirsak Annona muricata Inti biji 20-30
17 Srikaya Annona squosa Biji 15-20
18 Sawit Elais guineensis Pulp+Kernel 45-70+46-54 (Sumber: Eka Tjipta Foundation, 2008)
Selain itu biodiesel bisa juga diproduksi dari minyak goreng bekas atau yang biasa disebut dengan minyak jelantah. Walaupun warnanya sudah sangat pekat karena sering digunakan, namun minyak goreng bekas tersebut masih bisa dimanfaatkan.
Penggunaan minyak goreng berulang kali sangat membahayakan kesehatan. Hal ini dikarenakan semakin banyaknya kotoran yang terkandung dalam minyak goreng akibat penggorengan bahan makanan sebelumnya dan semakin banyaknya senyawa–senyawa asam karboksilat bebas di dalam minyak serta warna minyak goreng yang semakin tidak jernih jika dipakai berulang kali.
12 Selama proses penggorengan, terjadi pemanasan dan minyak berubah menjadi berwarna gelap karena terjadinya reaksi kimia yang dapat menghasilkan senyawa kimia yang umumnya bersifat karsinogenik. Salah satu senyawa yang dihasilkan adalah asam lemak bebas (Ketaren, 2005). Apabila dikonsumsi kembali dapat menimbulkan penyakit bagi manusia, diantaranya kanker dan penyempitan pembuluh darah. Ini disebabkan asam lemak tak jenuh bersifat reaktif dan mudah mengikat oksigen dalam darah (Winarno, 1999). Menurut Ulum (2011) senyawa kimia yang terdapat dalam minyak goreng bekas adalah sebagai berikut:
Tabel 2. Komposisi Asam Lemak Minyak Jelantah
No Nama Senyawa Rumus Molekul Konsentrasi (%)
1 Asam oktanoat C8H16O2 0,02
2 Asam kaprat C10H19O2 0,01
3 Asam laurat C11H23O2 0,24
4 Asam undekanoat C11H19O2 0,03
5 Asam miristat C14H27O2 1,06
6 Asam pentadekanoat C15H29O2 0,07
7 Asam linolenat C18H29O2 0,03
8 Asam palmitoleat C16H29O2 2,05
9 Asam palmitat C16H31O2 34,52
10 Asam 1,9-metilenheksadekanoat C14H34O2 0,06
11 Asam margarat C17H31O2 0,13
12 Asam oleat C18H33O2 55,49
13 Asam stearat C18H35O2 5,31
14 Asam arakidonat C20H31O2 0,17
15 Asam 11-eicosenoat C20H39O2 0,43
16 Asam arakat C20H39O2 0,38
2.2.2. Alkohol
Alkohol merupakan senyawa karbon yang tersusun atas unsur karbon, hidrogen dan oksigen. Contoh dari senyawa alkohol adalah metanol (metil alkohol, CH3OH), etanol (etil alkohol, C2H5OH), propanol (propil alkohol, C3H7OH) dan lain-lain (Fessenden dan Fessenden, 1986). Alkohol yang biasa digunakan sebagai reaktan dalam pembuatan biodiesel adalah metanol dan etanol.
13 Metanol dan etanol memiliki sifat yang sama yaitu berwarna bening seperti air, mudah menguap, mudah terbakar, dan mudah tercampur dengan air.
Metanol merupakan jenis alkohol yang paling disukai dalam pembuatan biodiesel. Hal itu disebabkan karena metanol merupakan senyawa alkohol berantai karbon terpendek dan terpolar. Sehingga dapat bereaksi lebih cepat dengan asam lemak, dapat melarutkan semua jenis katalis, baik basa maupun asam (Yuliani dkk., 2008). Selain itu secara ekonomis metanol lebih murah dibandingkan dengan senyawa alkohol lain. Sedangkan kerugiannya adalah metanol merupakan zat beracun, dapat diserap melalui kulit, dan 100% bercampur dengan air, sehingga tumpahannya akan menimbulkan masalah (Tambun, 2009).
Keunggulan dari metanol ini berbeda sekali dengan etanol yang sifatnya kurang reaktif dibandingkan dengan metanol, tetapi etanol juga memiliki keunggulan dari segi keamanannya, lebih aman, tidak beracun dan dapat dibuat dari hasil petanian. Produksi etil ester yang menggunakan etanol sebagai alkohol jarang diteliti bila dibandingkan dengan metil ester yang menggunakan metanol sebagai alkohol. Tetapi etil ester memiliki kelebihan karena memungkinkan untuk memproduksi bahan bakar berbasis pertanian dan tambahan karbon dalam molekul etanol akan meningkatkan kandungan kalor dan angka setana. Pemisahan gliserol dengan menggunakan etanol lebih sulit dibandingkan dengan menggunakan metanol dan jika tidak berhati-hati akan berakhir dengan emulsi (Buasri dkk., 2009; Tambun, 2009).
14 2.2.3. Katalis
Katalis pertama kali ditemukan oleh J.J. Berzelius pada tahun 1836 sebagai komponen yang dapat meningkatkan laju reaksi kimia. Katalis berfungsi menurunkan energi aktivasi sehingga reaksi berjalan lebih cepat, tanpa terlibat di dalam reaksi secara permanen (Fogler, 1999). Katalis berfungsi mempercepat reaksi dengan cara menurunkan energi aktivasi, namun tidak mempengaruhi letak kesetimbangan. Katalis yang biasa digunakan adalah asam, basa dan penukar ion (Groggins, 1958).
Secara umum reaksi kimia yang terjadi dengan menggunakan katalis adalah:
dimana senyawa A bereaksi dengan katalis (C) dan membentuk senyawa intermediet (AC*) kemudian bereaksi kembali dengan senyawa B sehingga membentuk senyawa AB.
Sifat-sifat dari reaksi katalitis (Agra, 1992) yaitu sebagai berikut:
a) Pada reaksi katalitis, katalis akan menurunkan energi aktivasi.
b) Katalis yang sedikit akan mempercepat reaksi dari zat reaktan dalam jumlah banyak.
c) Katalis tidak mengubah letak kesetimbangan untuk reaksi reversibel.
A + C AC*
AC* + B AB + C
A + B + C AB + C
15 Berdasarkan tingkat kepentinganya, komponen inti katalis dapat dibedakan menjadi tiga bagian diantaranya (Hoon, 2005):
1) Selektifitas adalah kemampuan katalis untuk memberikan produk reaksi yang diinginkan (dalam jumlah tinggi) dari sejumlah produk yang mungkin dihasilkan.
2) Aktifitas adalah kemampuan katalis untuk mengubah bahan baku menjadi produk yang diinginkan.
3) Stabilitas adalah kemampuan sebuah katalis untuk menjaga aktifitas, produktifitas dan selektifitas dalam jangka waktu tertentu.
Secara umum katalis dapat dibedakan menjadi 2 jenis yaitu katalis homogen dan katalis heterogen.
A. Katalis homogen
Katalis homogen merupakan katalis yang mempunyai fasa sama dengan reaktan dan produk. Katalis homogen biasanya banyak digunakan dalam produksi biodiesel, seperti basa (NaOH, KOH), asam (HCl, H2SO4) (Ju, 2003). Penggunaan katalis homogen ini mempunyai kelemahan yaitu: bersifat korosif, berbahaya karena dapat merusak kulit, mata, paru-paru bila tertelan, mencemari lingkungan, dan tidak dapat digunakan kembali. Kelemahan lain yang dapat dilihat dari katalis homogen terjadi pada pemisahan produk karena pada umumnya terjadi reaksi samping yaitu reaksi safonifikasi dan juga munculnya emulsi yang mengakibatkan produk menjadi sulit dipisahkan sehingga membutuhkan peralatan tambahan dan waktu.
16 B. Katalis heterogen
Katalis heterogen merupakan katalis yang fasanya tidak sama dengan reaktan dan produk. Katalis heterogen secara umum berbentuk padat dan banyak digunakan pada reaktan berwujud cair atau gas (Fogler, 1999). Contoh-contoh dari katalis heterogen adalah zeolit, CaO, MgO, dan resin penukar ion (Widyastuti, 2007). Mekanisme katalis heterogen melalui lima langkah, yaitu:
1) Transport reaktan ke katalis
2) Interaksi reaktan-raktan dengan katalis (adsorpsi)
3) Reaksi dari spesi-spesi yang teradsorpsi menghasilkan produk.
4) Deadsorpsi produk dari katalis 5) Transport produk menjauhi katalis
Keuntungan dari katalis heterogen adalah ramah lingkungan, tidak bersifat korosif, mudah dipisahkan dari produk dengan cara filtrasi, serta dapat digunakan berulangkali dalam jangka waktu yang lama. Selain itu, katalis heterogen meningkatkan kemurnian hasil karena reaksi samping dapat dieliminasi.
Pemilihan katalis atau pengembangan katalis perlu dipertimbangkan untuk mendapatkan efektivitas dalam pemakaian. Dalam pengembangannya, katalis cair dapat digantikan dengan katalis padat seperti seperti zeolit, clay, dan lain-lain.
Keuntungannya adalah dapat di-recovery, recycle, dan digantikan kembali (Widyawati, 2007).
17 2.3. Proses Pembuatan Biodiesel
Pembuatan biodiesel dapat dilakukan dengan 2 cara yaitu proses esterifikasi asam lemak bebas dan transesterifikasi dari minyak nabati (Tambun, 2006).
2.3.1. Esterifikasi
Esterifikasi adalah tahap konversi dari asam lemak bebas menjadi ester.
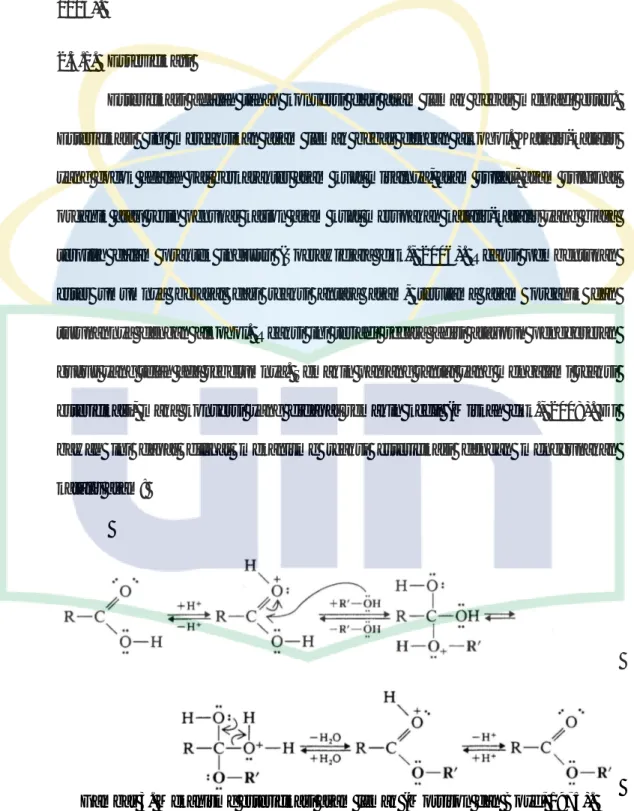
Esterifikasi ini mereaksikan asam lemak bebas dengan alkohol. Katalis-katalis yang cocok adalah zat berkarakter asam kuat misalnya, asam sulfat, asam sulfonat organik atau resin penukar kation asam kuat merupakan katalis-katalis yang biasa terpilih dalam praktek industri (Soerawidjaja dkk., 2006). Reaksi pembentukan ester umumnya berasal dari reaksi antara asam, terutama asam organik dan turunannya dengan alkohol. Reaksi ini terjadi secara adisi ataupun penggeseran gugus yang telah ada sebelumnya. Semakin panjang rantai yang mengalami reaksi esterifikasi, maka konversi yang didapat semakin kecil (Miskah dkk., 2008). Di bawah ini dapat dilihat mekanisme reaksi esterifikasi dengan menggunakan katalis asam:
Gambar 3. Mekanisme esterifikasi asam lemak (Morrison dan Boyd, 1975).
18 2.3.2. Transesterifikasi
Transesterifikasi adalah tahap konversi dari trigliserida (minyak nabati) menjadi alkil ester, melalui reaksi dengan alkohol berantai pendek, dan menghasilkan produk samping yaitu gliserol. Transesterifikasi merupakan perubahan bentuk dari satu jenis ester menjadi bentuk ester yang lain. Suatu ester merupakan suatu rantai hidrokarbon yang terikat dengan molekul yang lain (Miskah dkk., 2008). Reaksi transesterifikasi mengubah trigliserida (96-98%
minyak), dengan sisa gliserol sebagai produk sampingnya. Hasilnya, molekul- molekul trigliserida yang panjang dan bercabang diubah menjadi ester-ester yang lebih kecil yang memiliki ukuran dan sifat yang serupa dengan minyak solar.
Proses transesterifikasi direaksikan alkohol dengan minyak untuk melepas 3 rantai ester dari trigliserida. Reaksi transesterifikasi trigliserida menjadi metil ester adalah :
Gambar 4. Reaksi transesterifikasi trigliserida dengan alkohol
Transesterifikasi juga menggunakan katalis asam ataupun basa dalam reaksinya. Tanpa adanya katalis, trigliserida dapat dikonversi menjadi alkil ester namun reaksi pembentukan alkil ester tersebut berjalan dengan lambat (Mittlebatch, 2004). Katalis yang biasa digunakan pada reaksi transesterifikasi
19 adalah katalis basa karena konversi biodiesel yang dihasilkan lebih besar dan suhu lebih rendah (Freedman dkk., 1986).
Adapun faktor-faktor yang mempengaruhi reaksi pembentukan biodiesel adalah sebagai berikut:
a. Pengadukan
Agar reaksi berlangsung baik diperlukan pencampuran sebaik-baiknya dengan cara pengadukan. Pencampuran yang baik dapat menurunkan tahanan perpindahan massa. Dengan berkurangnya tahanan perpindahan massa, molekul- molekul reaktan yang dapat mencapai fase reaksi menjadi banyak, sehingga meningkatkan kemungkinan terjadinya reaksi.
b. Suhu
Semakin tinggi suhu reaksi, semakin besar energi kinetik yang dimiliki oleh zat-zat pereaksi sehingga semakin banyak molekul yang memiliki energi melebihi energi aktivasi. Hal ini mengakibatkan semakin banyak tumbukan antar molekul yang menghasilkan reaksi, sehingga kecepatan reaksi akan meningkat pula.
Arrhenius menyatakan bahwa hubungan antara konstanta kecepatan reaksi dengan suhu mengikuti persamaan eksponensial :
k = A exp (-Ea/RT)
dengan: k = konstanta kecepatan reaksi, (gmol/L)1-n / jam A = faktor tumbukan, L/gmol/jam
Ea = energi aktivasi, kal/gmol R = konstanta gas, 1,987 kal/gmol/ K T = suhu, K
n = orde reaksi
20 c. Katalis
Reaksi esterifikasi dan transesterifikasi tergolong berjalan lambat, sehingga penambahan katalis bertujuan untuk mempercepat reaksi dengan jalan menurunkan energi aktivasinya. Zat pereaksi menjadi lebih reaktif bila dibandingkan dengan reaksi tanpa katalis. Pada reaksi esterifikasi atau transesterifikasi, pemilihan katalis berhubungan dengan suhu reaksinya. Katalis basa tidak memerlukan suhu yang tinggi, sementara katalis asam umumnya digunakan untuk suhu sekitar 100OC (Kirk dan Othmer, 1980). Katalis padat dipilih bila dikehendaki pemisahan yang relatif murah.
d. Perbandingan pereaksi
Penggunaan salah satu reaktan berlebihan pada reaksi bolak-balik akan menggeser kesetimbangan reaksi ke kanan dan dapat meningkatkan tumbukan antara reaktan, sehingga produk yang dihasilkan lebih banyak. Proses alkoholisis umumnya dilakukan dengan alkohol berlebih, biasanya 1,2 sampai 1,75 kali kebutuhan stokiometri (Swern, 1982).
e. Waktu reaksi
Makin lama waktu reaksi, maka kesempatan zat-zat untuk bereaksi semakin banyak sehingga konversi reaksi semakin besar. Jika keseimbangan reaksi telah tercapai, bertambahnya waktu reaksi tidak akan memperbesar hasil.
2.4. Karakterisasi Biodiesel
Indonesia melalui Departemen Energi dan Sumber Daya Mineral sudah mengeluarkan standar dan mutu biodiesel seperti yang tercantum dalam Tabel berikut ini:
21 Tabel 3. Standar dan Mutu Biodiesel
No. Parameter Satuan Nilai Metode uji
1 Massa jenis pada 40°C kg/m3 850 – 890 ASTM D 1298 2 Viskositas kinematik pd 40°C mm2/s (cSt) 2,3 – 6,0 ASTM D 445
3 Angka setana min. 51 ASTM D 613
4 Titik nyala (mangkok tertutup) °C min. 100 ASTM D 93
5 Titik kabut °C maks. 18 ASTM D 2500
6 Korosi lempeng tembaga (3
jam pada 50 °C) maks. no 3 ASTM D 130
7
Residu karbon : dalam contoh asli dan dalam 10 % ampas distilasi
%-massa maks 0,05
(maks. 0,3) ASTM D 4530
8 Air dan sedimen %-vol. maks. 0,05 ASTM D 2709 atau ASTM D-1796 9 Temperatur distilasi 90 % °C maks. 360 ASTM D 1160 10 Abu tersulfatkan %-massa maks.0,02 ASTM D 874 11 Belerang ppm-m (mg/kg) maks. 100 ASTM D 5453 atau
ASTM D-1266
12 Fosfor ppm-m (mg/kg) maks. 10 AOCS Ca 12-55
13 Angka asam mg-KOH/g maks.0,8 AOCS Cd 3d-63 atau ASTM D-664 14 Gliserol bebas %-massa maks. 0,02 AOCS Ca 14-56 atau
ASTM D-6584 15 Gliserol total %-massa maks. 0,24 AOCS Ca 14-56 atau
ASTM D-6584 16 Kadar ester alkil %-massa min. 96,5 Dihitung
17 Angka iodium %-massa
(g-I2/100 g) maks. 115 AOCS Cd 1-25 (Sumber: SNI-04-7182-2006)
Secara umum, karakteristik bahan bakar minyak khususnya minyak solar yang perlu diketahui adalah sebagai berikut (Miskah dkk., 2008)
1) Titik nyala
Titik nyala adalah suatu angka yang menyatakan suhu terendah dari bahan bakar minyak dimana akan timbul penyalaan api sesaat, apabila pada permukaan minyak tersebut didekatkan pada nyala api. Titik nyala diperlukan sehubungan dengan pertimbangan-pertimbangan mengenai keamanan dari penimbunan minyak dan pengangkutan terhadap bahaya kebakaran.
22 2) Viskositas
Viskositas adalah suatu angka yang menyatakan besarnya hambatan dari suatu bahan bakar cair untuk mengalir atau ukuran besarnya tahanan geser dari bahan cair. Makin tinggi viskositas minyak, akan makin kental dan sulit mengalir, begitu juga sebaliknya. Viskositas bahan bakar minyak sangat penting artinya, terutama bagi mesin diesel maupun ketel uap, karena viskositas minyak sangat berkaitan dengan konsumsi bahan bakar ke dalam ruang bakar dan juga sangat berpengaruh terhadap kesempurnaan proses pengkabutan bahan bakar melalui injektor.
3) Titik tuang dan titik kabut
Bahan bakar diesel harus dapat mengalir dengan bebas pada suhu atmosfer terendah dimana bahan bakar ini digunakan. Suhu terendah dimana bahan bakar diesel masih dapat mengalir disebut titik tuang (pour point). Pada suhu sekitar 100F di atas titik tuang, bahan bakar diesel dapat berkabut. Suhu ini dikenal dengan titik kabut.
4) Berat jenis (specific gravity)
Berat jenis adalah suatu angka yang menyatakan perbandingan berat bahan bakar minyak pada temperatur tertentu terhadap air pada volume yang sama.
Bahan bakar minyak umumnya mempunyai specific gravity 0,74-0,96, dengan kata lain bahan bakar minyak lebih ringan dari pada air.
5) Angka setana
Angka setana adalah angka pengujian mesin dari suatu bahan bakar mesin diesel, yang menggambarkan sifat kelambatan pembakaran. Angka setana
23 yang tinggi menandakan kelambatan pembakaran, dan berarti makin sedikit jumlah bahan bakar diesel yang terdapat di dalam ruang bakar saat pembakaran. Angka setana dapat diperoleh dengan jalan membandingkan kesamaan sifat pembakaran suatu bahan bakar motor diesel pada motor uji dengan sifat pembakaran campuran setana (n-heksadekana) yang mempunyai angka setana = 100, dengan α-metilnaftalen, yang mempunyai angka setana = 0 (Suwarsono et al., 2008). Alat yang digunakan untuk menguji angka setana adalah CFR (cooperative fuel research engine) (Hardjono, 2007).
2.5. Zeolit
Zeolit merupakan mineral yang terdiri dari kristal aluminosilikat terhidrasi yang mengandung kation alkali atau alkali tanah dalam kerangka tiga dimensinya.
Ion-ion logam tersebut dapat diganti oleh kation lain tanpa merusak struktur zeolit dan dapat menyerap air secara reversible (Bekkum dkk., 1991). Molekul-molekul air yang terdapat dalam zeolit merupakan molekul yang mudah terlepas (Arifin dan Komarudin, 1995).
Kerangka dasar struktur zeolit (Gambar. 6) terdiri dari unit-unit tetrahedral AlO4 dan SiO4 yang saling berhubungan melalui atom O dan di dalam struktur tersebut Si4+ dapat diganti dengan Al3+ sehingga rumus empiris zeolit menjadi :
M2/nO.Al2O3.xSiO2.yH2O Dimana : M = kation alkali atau alkali tanah
n = valensi logam alkali
X = bilangan tertentu (2 s/d 10) Y = bilangan tertentu (2 s/d 7)
24 Gambar 5.Tetrahedral alumina dan silika (TO4) pada struktur zeolit
Jadi zeolit terdiri dari 3 komponen yaitu: kation yang dipertukarkan, kerangka aluminosilikat dan fase air. Ikatan ion Al –Si–O membentuk struktur kristal sedangkan logam alkali merupakan sumber kation yang mudah dipertukarkan (Bekkum, dkk., 1991; Sutarti dan Rahmawati, 1994). Struktur zeolit bermuatan ion Al3+ lebih kecil dari pada Si4+, sehingga ion Al3+ cenderung bersifat negatif dan mengikat kation alkali atau alkali tanah untuk dinetralkan muatannya. Kation alkali atau alkali tanah dalam zeolit inilah yang selanjutnya dimanfaatkan dalam proses ion exchange (Sutarti dan Rahmawati, 1994).
Zeolit alam yang telah diaktivasi dengan asam mineral (H2SO4), akan lebih tinggi daya pemucatnya karena asam mineral tersebut bereaksi dengan komponen berupa garam Ca dan Mg yang menutupi pori-pori adsorben. Di samping itu asam mineral melarutkan Al2O3 sehingga dapat menaikkan perbandingan jumlah SiO2 dan Al2O3 dari (2–3) : 1 menjadi (5–6) : 1. Zeolit dengan perbandingan jumlah SiO2 dan Al2O3 tinggi bersifat hidrofilik dan akan menyerap molekul yang tidak polar (Sutarti dan Rahmawati, 1994).
25 Berdasarkan asalnya zeolit dibagi menjadi 2, yaitu (Anshori, 2009):
A. Zeolit Alam
Zeolit alam terbentuk karena adanya proses perubahan alam (zeolitisasi) dari batuan vulkanik tuf. Pembentukan mineral zeolit diduga merupakan hasil reaksi debu vulkanik dengan air garam, ada juga beberapa zeolit seperti kabasit, erionit, dan filipsit diduga sebagai hasil dari proses hidrotermal.
Karena sifat-sifat zeolit alam sangat terbatas maka dilakukan sintesis zeolit untuk mensubstitusi zeolit yang berasal dari alam.
B. Zeolit Sintetik
Zeolit sintetik merupakan rekayasa dari zeolit alam yang direkayasa oleh manusia melalui proses kimia. Perkembangan zeolit sintetik dimulai sejak akhir tahun 1940 oleh Union Carbide Corporations, melalui suatu program pembuatan zeolit dengan meniru proses hidrotermal alamiah. Dengan cara ini telah berhasil dibuat lebih dari seratus jenis zeolit, sebagai upaya pencarian jenis-jenis zeolit yang mempunyai daya guna tinggi. Zeolit sintetik dapat diproduksi dengan cara hidrotermal dan kebanyakan diproduksi di bawah kondisi tidak setimbang, akibatnya zeolit yang dihasilkan merupakan bahan metastabil atau mudah berubah. Tahap pertama dalam pembuatan zeolit sintetis adalah mereaksikan bahan dasar seperti gel atau zat padat amorf hidroksida alkali dengan pH tinggi dan basa kuat dengan kondisi operasi pada suhu hidrotermal rendah.
Berdasarkan sifatnya, zeolit dapat digunakan untuk proses pengeringan atau dehidrasi, penyerapan (adsorbsi), penukar ion, dan sebagai katalis (Widayat dan Haryani, 2006). Zeolit telah banyak digunakan dalam berbagai keperluan
26 seperti bidang peternakan, pertanian, perikanan, industri, untuk keperluan rumah tangga dan juga pelestarian alam (Barrer,1987).
Pemakaian zeolit sebagai katalis telah banyak digunakan, diantaranya sebagai katalis dalam perengkahan minyak goreng, sebagai katalis dalam proses konversi senyawa aseton-butanol-etanol (ABE) menjadi hidrokarbon. Pengolahan zeolit alam menjadi katalis juga telah banyak dilakukan diantaranya sebagai katalis untuk pembuatan biodiesel (Susilowati, 2006). Padmaningsih et al (2006) menggunakan katalis Nb2O5-ZAA untuk membuat biodiesel. Astuti et al (2006) menggunakan zeolit alam Lampung untuk mengurangi kandungan asam lemak bebas dalam minyak goreng bekas pada pembuatan biodiesel.
Pada umumnya zeolit yang ditambang langsung dari alam masih mengandung pengotor-pengotor organik berwujud kristal maupun amorf. Untuk meningkatkan kualitas zeolit alam, terutama sebagai katalis dalam pembuatan biodiesel, harus dilakukan aktivasi terhadap zeolit alam. Daya kerja zeolit sebagai katalis dapat diperbesar dengan mengaktifkan zeolit terlebih dahulu dan untuk menghilangkan pengotor-pengotor yang terkandung dalam zeolit (Astuti, 2006).
Aktivasi katalis biasanya diikuti dengan karakterisasi zeolit yang bertujuan untuk mengetahui luas permukaan total, volume pori total, dan jari-jari pori rata- rata. Luas permukaan merupakan luas total permukaan per gram katalis. Luas permukaan dipengaruhi oleh besar atau kecilnya pori pada permukaan katalis.
Semakin kecil pori, luas permukaan akan semakin besar sehingga aktivitas zeolit dapat meningkat. Dalam reaksi katalitik, luas permukaan sangat mempengaruhi laju reaksi, karena semakin besar luas permukaan menyebabkan semakin banyak reaktan yang dapat teradsorpsi pada sisi aktif katalis.
27 Proses pembuatan katalis zeolit dilakukan melalui tahap dealuminasi, pencucian, pengeringan, dan kalsinasi (Maygasari dkk., 2010). Proses dealuminasi merupakan suatu metode untuk menjaga stabilitas struktur pori dan menghilangkan alumina dari framework zeolit agar katalis ini tidak mudah mengalami deaktivasi. Proses dealuminasi biasanya dilakukan dengan menambah sejumlah asam (misalnya amonium klorida, asam klorida, asam florida, dan sebagainya) pada zeolit. Sedangkan proses kalsinasi adalah proses hidrothermal yang dilakukan untuk menjaga agar katalis yang diperoleh relatif stabil pada suhu tinggi.
28
BAB III
METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini berlangsung selama 4 bulan dari bulan Juni 2011 sampai September 2011. Penelitian dilakukan di Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah Jakarta.
3.2. Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah piknometer, Falling Ball Viscometer, labu leher tiga, pengaduk, termometer, kondensor, dan GCMS Shimadzu-QP2010.
Bahan yang digunakan adalah minyak goreng bekas yang diambil dari pedagang kaki lima (pecel lele dan gorengan) di sekitar kampus UIN Syarif Hidayatullah Jakarta, metanol, zeolit alam dari Lampung jenis Clinoptilolit dari CV. Manatama Lampung dan KOH.
3.3. Cara Kerja
3.3.1. Analisa Bahan Baku
Sebelum dilakukan pembuatan biodiesel, minyak goreng bekas terlebih dahulu dianalisa densitas, viskositas, kadar air, kadar asam lemak total, dan kadar asam lemak bebas serta dilakukan aktivasi zeolit alam.
29 a. Analisa Kadar Air
Cawan porselen dikeringkan dalam oven selama 15 menit, lalu dimasukkan ke dalam desikator. Sebanyak 5 gram sampel minyak (W1) dimasukan ke dalam cawan tersebut dan ditimbang (W2). Cawan tersebut dipanaskan selama 4 jam pada suhu 110oC. Cawan didinginkan dalam desikator dan ditimbang (W3). Kadar air dicari dengan rumus:
Kadar Air (%) =W2 − W3
W1 × 100%
Keterangan:
W1 = berat sampel (g)
W2 = berat cawan + sampel minyak sebelum dipanaskan (g) W3 = berat cawan + sampel minyak setelah dipanaskan (g)
b. Analisa densitas
Piknometer dibersihkan dengan HCl lalu dibilas sebanyak 3 kali dengan akuades, sekali dengan alkohol dan kemudian dikeringkan di dalam oven selama 5 menit. Setelah itu dimasukkan ke dalam desikator selama 10 menit, lalu ditimbang piknometer tersebut hingga diperoleh massa tetap (W1). Piknometer diisi dengan larutan sampel, bagian luarnya dilap hingga kering dan ditimbang hingga diperoleh massa yang tetap (W2). Perhitungan densitas (ρ) sampel dengan persamaan:
Dimana :
ρ = densitas, (g/mL)
W2 = massa piknometer + sampel, (g) W1 = massa piknometer, (g)
V = volume piknometer, (mL)
30 c. Analisa Viskositas
Alat falling ball viscometer dibersihkan dengan alkohol dan aseton lalu dibiarkan hingga mengering. Sampel minyak dimasukkan ke dalam alat tersebut secara hati-hati hingga melebihi batas titik awal + 1 cm. kemudian dimasukkan bola kaca dengan cara memiringkan alat tersebut dan ditutup dengan rapat hingga tidak ada larutan yang menetes keluar. Alat diputar 180oC dan stopwatch dijalankan tepat saat bola bergerak dari titik awal. Waktu yang dibutuhkan oleh bola tersebut untuk bergerak hingga garis batas akhir diukur (t0). Viskositas sampel dihitung dengan persamaan:
Keterangan: µ = Viskositas (cSt)
ρ* = Massa jenis bola (g/mL) ρ = Massa jenis gliserol (g/mL)
k = Koefisien bola (0,007 mPa.s.cm3/g.s) t = Waktu aliran larutan (detik)
Gambar 6. Falling ball viscometer
d. Analisa Asam Lemak Total
Minyak goreng bekas sebanyak 5 gram dimasukkan kedalam erlemeyer, kemudian ditambahkan 50 ml KOH etanolisis 0,5 N. Larutan didihkan selama 1
31 jam dengan pendingin balik. Setelah dingin ditambah indikator fenolptalein dan di titrasi dengan HCl sampai warna merah hilang. Langkah yang sama dilakukan untuk analisa blangko tanpa sampel.
Ekivalen asam lemak total =Volum HCl (sampel − blanko)
Berat minyak × N. HCl
e. Analisa kadar asam lemak bebas
Minyak goreng bekas sebanyak 5 gram dimasukkan kedalam erlemeyer kemudian ditambahkan 50 ml alkohol. Campuran dipanaskan selama 10 menit sampai asam lemak larut. Setelah itu didinginkan dan dititrasi dengan KOH 0,1 N dengan indikator pp.
Ekivalen asam lemak bebas =Volum KOH x N. KOH Berat minyak
f. Pembuatan Katalis H-zeolit
Sebanyak 25 gram zeolit alam dimasukan ke dalam beaker glass yang berisi 125 mL HCl 6N, diamkan selama 30 menit pada temperatur 50oC sambil diaduk dengan pengaduk magnet, kemudian disaring dengan ukuran 70 mesh dan dicuci berulang kali sampai tidak ada ion Cl- yang terdeteksi oleh larutan AgNO3, dikeringkan pada suhu 130oC selama 3 jam dalam oven (Trisunaryanti dkk., 2005).
3.3.2. Pembuatan Biodiesel dengan Katalis KOH
Bahan baku berupa minyak goreng bekas sebelum digunakan terlebih dahulu disaring untuk memisahkan kotoran yang terdapat dalam minyak. Katalis KOH (0,5; 1; 2; 3; dan 4% berat minyak) dilarutkan dalam metanol (10, 20, 30,
32 dan 40% v/v) dan dipanaskan pada suhu 60oC. Minyak goreng bekas dipanaskan pada suhu 600C dengan selang waktu (15, 30, 60, dan 90 menit) dalam labu leher tiga yang sudah dilengkapi dengan termometer dan pengaduk. Setelah suhu kedua reaktan tercapai (60oC), larutan metoksida (KOH dan metanol) dimasukkan ke dalam labu leher tiga, pengaduk dijalankan dengan kecepatan putaran 1000 rpm.
Produk yang dihasilkan dipisahkan dalam corong pisah selama 1 malam sampai terbentuk 2 lapisan. Lapisan atas biodiesel dan lapisan bawah gliserol. Biodiesel yang dihasilkan ditimbang beratnya dan dihitung % hasilnya.
3.3.3. Pembuatan Biodiesel dengan Katalis H-Zeolit
Minyak goreng bekas dipanaskan pada suhu 60oC dengan selang waktu (1, 3, 5 dan 7 jam) dalam labu leher tiga yang sudah dilengkapi dengan termometer dan pengaduk. Metanol (10, 20, 30, dan 40% v/v) juga dipanaskan ditempat terpisah. Setelah suhu kedua reaktan tercapai (60oC), metanol dan katalis H-zeolit dengan konsentrasi ( 0,5%; 1%; 2%; 3%; dan 4% dari berat minyak) dimasukkan ke dalam labu leher tiga, pengaduk dijalankan dengan kecepatan putaran 1000 rpm. Produk yang dihasilkan dipisahkan dalam corong pisah selama 1 malam sampai terbentuk 2 lapisan. Lapisan atas biodiesel dan lapisan bawah gliserol.
Biodiesel yang dihasilkan ditimbang beratnya dan dihitung % hasil.
biodiesel =Berat biodiesel (hasil percobaan)
Berat minyak × 100%
33 Gambar 7. Rangkaian alat untuk pembuatan biodiesel
3.3.4. Analisa Senyawa Biodiesel dengan GCMS
Biodiesel yang sudah dihasilkan pada kondisi terbaik (waktu, konsentrasi katalis dan jumlah reaktan) ditambahkan n-heksan. Kemudian divortex dan dimasukkan ke dalam sentrifus. Larutan tersebut diambil, dan dimasukan ke dalam vial untuk dianalisa lebih lanjut dengan alat GCMS.
Gambar 8. GCMS Shimadzu-QP2010
34 Gambar 9. Skema Kerja Penelitian
*Katalis KOH dan H-zeolit
Sampel minyak Metanol
Reaktor
(Variasi Waktu, Konsentrasi Katalis dan Perbandingan Reaktan)
Gliserol Produk
(diamkan + 12 jam)
Biodiesel Analisa :
Densitas
Viskositas
Kadar Air
Asam Lemak Bebas
Asam lemak total
dicampur
* Katalis
Analisa :
Densitas
Viskositas
Komposisi Kimia
35 BAB IV
HASIL DAN PEMBAHASAN
4.1. Analisa Sifat Fisika dan Kima Minyak Goreng Bekas.
Minyak goreng bekas sebelum direaksikan terlebih dahulu dianalisa sifat fisika dan kimianya. Datanya dapat dilihat pada Tabel berikut.
Tabel 4. Sifat fisika dan kimia minyak goreng bekas
Nilai densitas dan viskositas pada penelitian ini diukur dua kali yaitu pada suhu ruang (29oC) dan pada suhu 40oC. Dari data di atas diketahui densitas minyak goreng bekas yang digunakan adalah 0,89 g/mL pada suhu ruang atau 29oC dan 0,88 g/mL pada suhu 400C. Nilai viskositas yang didapat sebesar 4,55 cSt pada suhu 29oC dan 3,27 cSt pada suhu 40oC, Perbedaan nilai tiap suhu disebabkan karena pada suhu yang tinggi kerapatan senyawa berkurang atau lebih encer. Pengukuran ini bertujuan untuk membandingkan densitas dan viskositas sebelum dan setelah proses transesterifikasi.
Minyak goreng bekas yang digunakan dalam penelitian ini mengandung kadar air 0,19%. Hasil ini menunjukan bahwa kadar air kurang dari 1% sehingga tidak perlu ada pelakuan untuk menghilangkan kadar air. Kadar air yang tinggi (lebih dari 1%) dapat mengakibatkan reaksi samping yaitu reaksi hidrolisis antara trigliserida dengan air yang menghasilkan asam lemak bebas yang dapat
No Sifat Fisik Kimia Satuan Nilai
1 Densitas 29oC g/mL 0,89
2 Densitas 40oC g/mL 0,88
3 Viskositas 29 oC cSt 4,55
4 Viskositas 40oC cSt 3,27
5 Kadar Air % 0,19
6 Asam lemak bebas mg KOH/g 2,71
7 Asam lemak total m.grek/g 3,08
36 mengganggu reaksi pembentukan biodiesel. Kadar air yang terkandung dalam minyak goreng selain berasal dari air yang terkandung dalam minyak goreng itu sendiri, juga berasal dari bahan pangan lain yang digoreng. Selama proses penggorengan berlangsung, sebagian air akan bebas menguap dan sebagian lagi masih berada dalam minyak (Sugiati, 2007).
Pada dasarnya kadar air berpengaruh terhadap perlakuan produksi biodiesel.
Menurut Rahayu (2009) syarat maksimal kadar air pada minyak adalah 1%. Jika kadar air lebih dari 1% maka perlu adanya perlakuan lebih lanjut untuk menghilangkan kadar air yang terkandung dalam minyak. Yoeswono dkk. (2008) mengurangi kadar air yang terkandung pada minyak dengan menambahkan natrium anhidrat.
Kadar asam lemak bebas (FFA) yang dihasilkan adalah 2,71 mg KOH/g minyak atau 0,07%. Nilai ini lebih kecil dari batas yang ditetapkan yaitu maksimal 1%. Jika kadar FFA < 1% maka tidak diperlukan pretreatment (esterifikasi) untuk menghilangkan FFA (Rahayu, 2009). Jadi pembuatan biodiesel bisa langsung menggunakan proses transesterifikasi tanpa melalui esterifikasi.
Jika kadar FFA > 1%, asam lemak bebas lebih reaktif bereaksi dengan katalis basa menghasilkan sabun dibandingkan trigliserida dan reaksi berlangsung secara nonreversible (Yurcel dan Turkay, 2003). Hal ini akan berdampak terhadap pemurnian biodiesel, dimana gliserol akan sulit dipisahkan dari biodiesel.
Tinggi atau rendahnya kandungan asam lemak bebas disebabkan oleh adanya kandungan air dalam minyak. Hal ini mungkin disebabkan karena dalam
37 proses pengolahan lemak tersebut terjadi proses oksidasi yang sangat tinggi.
Reaksi pembentukan asam lemak bebas dalam minyak adalah :
Gambar 10. Reaksi pembentukan asam lemak bebas pada minyak.
Dan reaksi safonifikasi yang mungkin terjadi akibat asam lemak bebas (FFA) berlebih adalah :
R-COOH + KOH R-COOK + H
2O
Gambar 11. Reaksi safonifikasi asam lemak bebas
4.2. Optimasi Kondisi Operasi Pembuatan Biodiesel dengan Katalis KOH 4.2.1. Pengaruh Waktu Reaksi terhadap Yield Biodisel
Untuk mempelajari pengaruh waktu reaksi terhadap yield biodiesel dilakukan dengan cara mengubah-ubah waktu reaksi di setiap percobaan. Untuk katalis KOH ini, variabel waktu yang digunakan adalah 15, 30, 60 dan 90 menit.
Sedangkan untuk variabel lainnya dibuat konstan yaitu suhu 60oC yang didasarkan pada titik uap metanol yaitu sekitar 67oC, jumlah katalis 1%, dan perbandingan reaktan 4:1(volume) (Aziz, 2006).
38 Gambar 12. Pengaruh waktu reaksi terhadap yield biodiesel (katalis KOH)
Gambar diatas menunjukan bahwa pada penambahan waktu 15 menit yield biodiesel yang dihasilkan adalah 83,37%, kemudian dengan penambahan wakktu 30 menit tejadi peningkatan yield biodiesel yaitu sebesar 84,55%, kenaikan tertinggi dapat ditunjukan dengan penambahan waktu 60 menit dengan yield 84,68%. Kenaikan persen hasil biodiesel tidak terlalu tinggi karena reaksi sudah hampir mencapai kesetimbangan, sehingga tambahan waktu reaksi tidak akan mempengaruhi reaksi (Widyastuti, 2007). Tetapi pada penambahan waktu 90 menit biodiesel yang dihasilkan tidak mengalami kenaikan yaitu sebesar 84,12%
hal ini menunjukan bahwa waktu yang optimum dapat ditunjukan pada penambahan waktu 60 menit. Aziz (2007) melakukan penelitian tentang reaksi transesterifikasi dengan katalis KOH, didapatkan waktu optimum 60 menit.
4.2.2. Pengaruh Konsentrasi KOH terhadap Yield Biodiesel
Pada pengaruh konsentrasi katalis terhadap yield biodiesel yang dipelajari ini, konsentrasi katalis yang digunakan untuk katalis KOH yaitu pada variasi
0 10 20 30 40 50 60 70 80 90 100
0 0.5 1 1.5 2
Yieldbiodiesel(%)
Waktu (jam)
39 konsentrasi 0,5%, 1%, 2%, 3% dan 4%, sedangkan untuk variabel tetap yang digunakan adalah pada waktu 1 jam berdasarkan data yang diperoleh dari pengaruh waktu terhadap yield biodiesel dengan suhu 60oC, konsentrasi reaktan 20% dan kecepatan pengadukan 1000 rpm
Berdasarkan data yang dihasilkan, dapat dilihat dalam bentuk grafik sebagai berikut:
Gambar 13. Pengaruh konsentrasi katalis KOH terhadap yield biodiesel Konsentrasi katalis KOH 0,5% menghasilkan yield biodiesel sebesar 90,36%. Ketika konsentrasi KOH dinaikkan menjadi 1%, yield biodiesel juga naik menjadi 92,10%. Hal ini disebabkan karena semakin banyak katalis akan meningkatkan energi aktivasi, sehingga akan meningkatkan jumlah molekul yang teraktifkan yang menyebabkan kecepatan reaksi menjadi naik (Widyastuti, 2007).
Kenaikan konsentrasi katalis diatas 1%, ternyata tidak menaikkan yield biodiesel.
Hal ini disebabkan karena kemungkinan reaksi samping yang terjadi antara katalis dengan minyak misalnya reaksi safonifikasi dengan katalis KOH yang menghalangi terjadinya reaksi antara minyak dengan metanol yang mengakibatkan kecepatan reaksi biodiesel yang dihasilkan semakin menurun,
0 10 20 30 40 50 60 70 80 90 100
0% 1% 2% 3% 4% 5%
yield biodiesel(%)
Konsentrasi katalis (%)