BAB I
PENDAHULUAN
I. Latar Belakang
Asam amino adalah komponen utama protein, yang ditemukan dalam semua organisme hidup dan memainkan peranan dalam sel hidup. Zat ini dibutuhkan untuk perturnbuhan normal anak-anak dan bagi orang-orang dewasa asam amino dibutuhkan untuk menjaga kesehatan. Tubuh dapat mensintesis beberapa asam amino, tetapi tidak semua. Ada 8 sampai 10 asam amino esensial yang harus ada dalam makanan. Asam-asam amino ini tidak dapat disintesis oleh tubuh sehingga harus tersedia dalam makanan.
Protein sangatlah dibutuhkan oleh tubuh kita karena protein berfungsi sebagai biokatalisator (enzim), sintesis hormon, protein cadangan, alat transport, protein structural, dan antibodi. Didalam tubuh manusia protein bertindak sebagai bahan membrane sel yang dapat membentuk jaringan pengikat, misalnya kolagen dan elastin, serta membentuk protein inert, seperti rambut dan kuku. Protein dapat bertindak sebagai enzim, misalnya glikoprotein, serta bertindak sebagai bagian sel yang dapat bergerak seperti protein otot. Secara keseluruhan protein merupakan polipeptida yang tersusun oleh serangkaian asam-asam amino. Protein juga dibutuhkan bagi tubuh dalam jumlah yang besar sehingga bila kita kekurangan protein akan mengakibatkan timbulnya berbagai penyakit yang berbahaya bagi tubuh kita.
Maka dari itu kami menyusun makalah ini agar mahasiswa dapat mengetahui dan lebih menguasai reaksi pengenalan dan identifikasi khususnya protein dan asam amino. II. Rumusan Masalah
1. Apakah yang dimaksud dengan protein dan asam amino?
2. Bagaimanakah cara dan proses prmengidentifikasi protein dan asam amino dalam suatu sampel?
III. Tujuan
1. Mengetahui pengertian protein dan asam amino
2. Mengetahui cara mengidentifikasi protein dan asam amino dalam sampel 3. Mengetahui proses reaksi pengenalan dan identifikasi asam amino
BAB II
PEMBAHASAN
A. PENGERTIAN PROTEIN DAN ASAM AMINO 1. Protein
Protein (asal kata protos dari bahasa Yunani yang berarti "yang paling utama") adalah senyawa organik kompleks berbobot molekul tinggi yang merupakan polimer dari monomer-monomer asam amino yang dihubungkan satu sama lain dengan ikatan peptida.
Molekul protein mengandung karbon, hidrogen, oksigen, nitrogen dan kadang kala sulfur serta fosfor. Protein berperan penting dalam struktur dan fungsi semua sel makhluk hidup dan virus. Kebanyakan protein merupakan enzim atau subunit enzim. Jenis protein lain berperan dalam fungsi struktural atau mekanis, seperti misalnya protein yang membentuk batang dan sendi sitoskeleton. Protein terlibat dalam sistem kekebalan (imun) sebagai antibodi, sistem kendali dalam bentuk hormon, sebagai komponen penyimpanan (dalam biji) dan juga dalam transportasi hara. Sebagai salah satu sumber gizi, protein berperan sebagai sumber asam amino bagi organisme yang tidak mampu membentuk asam amino tersebut (heterotrof).
Protein merupakan salah satu dari biomolekul raksasa, selain polisakarida, lipid, dan polinukleotida, yang merupakan penyusun utama makhluk hidup. Selain itu, protein merupakan salah satu molekul yang paling banyak diteliti dalam biokimia. Protein ditemukan oleh Jöns Jakob Berzelius pada tahun 1838.
Biosintesis protein alami sama dengan ekspresi genetik. Kode genetik yang dibawa DNA ditranskripsi menjadi RNA, yang berperan sebagai cetakan bagi translasi yang dilakukan ribosom. Sampai tahap ini, protein masih "mentah", hanya tersusun dari asam amino proteinogenik. Melalui mekanisme pascatranslasi, terbentuklah protein yang memiliki fungsi penuh secara biologi
2. Asam Amino
Asam amino adalah sembarang senyawa organik yang memiliki gugus fungsional karboksil (-COOH) dan amina (biasanya -NH2). Dalam biokimia seringkali pengertiannya dipersempit: keduanya terikat pada satu atom karbon (C) yang sama (disebut atom C "alfa" atau α).
Gugus karboksil memberikan sifat asam dan gugus amina memberikan sifatbasa. Dalam bentuk larutan, asam amino bersifat amfoterik: cenderung menjadi asam pada larutan basa dan menjadi basa pada larutan asam. Perilaku ini terjadi karena asam amino mampu menjadi zwitter-ion. Asam amino termasuk golongan senyawa yang paling banyak dipelajari karena salah satu fungsinya sangat penting dalam organisme, yaitu sebagai penyusun protein B. PROSES DAN CARA IDENTIFIKASI PROTEIN DAN ASAM AMINO
1. Uji Biuret
Uji Biuret adalah uji umum untuk protein(ikatan peptida), tetapi tidak dapat menunjukkan asam amino bebas. Zat yang akan diselidiki mula-mula ditetesi larutan NaOH, kemudian ditetesi larutan tembaga(II)sulfat yang encer. Jika terbentuk warna ungu berarti zat itu mengandung protein.
Struktur protein ada 4 tingkatan yaitu :
Struktur primer menunjukkan jumlah, jenis dan urutan asam amino dalam molekul protein (rentetan asam amino dalam suatu molekul protein)
Struktur sekunder menunjukkan banyak sifat suatu protein, ditentukan oleh orientasi molekul sebagai suatu keseluruhan, bentuk suatu molekul protein (misalnya spiral) dan penataan ruang kerangkanya (ikatan hidrogen antara gugus N-H, salah satu residu asam amino dengan gugus karbonil C=O residu asam yang lain)
Struktur tersier menunjukkan keadaan kecenderungan polipeptida membentuk lipatan tali gabungan (interaksi lebih lanjut seperti terlipatnya kerangka untuk membentuk suatu bulatan)
Struktur kuartener menunjukkan derajat persekutuan unit-unit protein. Ditinjau dari strukturnya, protein dapat dibagi dalam 2 golongan yaitu:
a. Protein sederhana yang merupakan protein yang hanya terdiri atas molekul-molekul asam amino
b. Protein gabungan yang merupakan protein yang terdiri atas protein dan gugus bukan protein. Gugus ini disebut gugus prostetik dan terdiri atas karbohidrat, lipid atau asam nukleat.
Contoh Reaksi Uji Protein
Tambahkan 1 ml NaOH 2,5 N kedalam 3 ml larutan protein dan aduk. Tambahkan setetes CuSO4 0,01 M. Aduk, jika tidak timbul warna lagi setetes atau 2 tetes CuSO4.
Reaksi yang terjadi pada protein pada uji biuret tersebut merupakan positif. Reaksi positif pada uji biuret ditandainya dengan terbentuknya warna ungu pada larutan. Hal ini dikarenakan terbentuknya senyawa kompleks Cu2+ dengan gugus -CO dan -NH pada asam amino dalam protein. Uji Biuret bertujuan untuk mengetahui ada tidaknya gugus amida pada filtrat yang dihasilkan, dimana dalam suasana basa Cu bereaksi dengan beberapa jenis larutan protein dan menghasilkan warna ungu. Hasil pembentukan senyawa kompleks, reaksi biuret dapat terjadi pada molekul yang mengandung 2 gugus ( - C - NH -) yang terikat pada
satu atom karbon atau atom nitrogen atau O terikat langsung. Senyawa yang mengandung gugus – C- NH – diganti O dengan gugus – C –NH2 O - C – NH2 atau gugus –CH2NH2 juga positif dalam uji Biuret
Contoh data hasil Pengamatan
Sampel + larutan 40% NaOH + larutan 0,1% CuSO4 Putih telur
(putih bening)
Tidak mengalami perubahan warna (putih bening)
Kurang lebih 15 tetes mengalami perubahn warna, putih bening menjadi ungu (dibagian atas)
Pembahasan
Protein terdapat pada semua sel dan merupakan komponen terpenting dalam semua reaksi kimia, rata - rata 2/3 dari berat kering suatu sel terdiri dari protein. Setiap protein merupakan polimer asam amino. Asam - asam amino dalam protein disambung dengan ikatan peptida yang merupakan ikatan kovalen amida yang terbentuk oleh gugus α-karboksil dan α-amino. Pada praktikum uji kualitatif protein ini akan diamati adanya protein pada larutan putih telur melalui uji biuret
Pada uji biuret, awalnya larutan putih telur berwarna putih bening, kemudian ketika ditambahkan dengan 40% NaOH, larutan tidak berubah warna putih bening, setelah itu ketika ditambahkan dengan 5 tetes CuSO4, larutan berubah menjadi berwarna ungu pada bagian atasnya. Dalam hal ini terbentuknya warna ungu menunjukkan bahwa pada larutan putih telur tersebut mengandung protein.
Dalam uji biuret, bila suatu peptida dan protein dimasukkan kedalam larutan encer kuprisulfat dalam basa kuat, maka warna biru pucat pada larutan akan berubah menjadi violet. Warna yang terbentuk sama dengan warna yang dibentuk oleh biuret, bila diperlakukan sama seperti pada praktikum kali ini, sehingga uji ini dinamakan uji biuret.
Reaksi ini positif terhadap ikatan - ikatan peptida, dan terhadap protein yang telah terhidrolisis sempurna memberikan hasil yang negatif.
2. Pengendapan Dengan Logam
Protein dapat diendapkan oleh ion-ion logam berat. Pengendapan ini terjadi karena ion-ion logam berat membentuk garam proteinat yang tidak larut dalam air. Pengendapan ini terjadi karena adanya reaksi penetralan muatan antara ion logam berat dengan anion dari protein.
Larutan albumin ditambahkan dengan larutan HgCl2 dan larutan Pb-asetat. Setelah larutan albumin ditambahkan dengan larutan HgCl2 dan larutan Pb-asetat, terbentuk endapan berwarna putih dari garam proteinat.
Larutan protein pada titik isoelektriknya memiliki kutub negatif dan positif dengan perbandingan sama. Endapan putih yang dihasilkan merupakan hasil dari reaksi penetralan muatan antara ion logam berat sebagai kation dengan molekul protein sebagai anion. Pada penambahan larutan protein dengan HgCl¬2 dan asetat, anion-anion dari HgCl¬2 dan Pb-asetat akan menyebabkan suasana larutan menjadi sedikit asam, sehingga protein akan mengkondisikan diri sebagai basa dan sebagian terdapat sebagai anion. Anion dari protein inilah yang bereaksi dengan ion logam berat membentuk garam proteinat yang tidak larut dalam air 3.
Contoh Reaksi Pengendapan Logam
Misal disediakan bahan larutan protein (glisin, asam aspartat, alanin, dan albumin), HgCl2 0,2 M, (CH3COO)2Pb 0,2 M, HCl 0,1 M, NaOH 0,1 M, etanol 95%, dan buffer pH 4,7. Dan alat-alat yaitu tabung reaksi, rak tabung, pipet tetes, dan pipet skala.
Maka setelah diuji akan mendapatkan hasil sebagai berikut :
No Larutan contoh HgCl2 0,2 M (CH3COO)2Pb 1. 2. 3. 4. Glisin Alanin Albumin Asam Aspartat
Tidak bereaksi, Bening Tidak bereaksi, Bening Terjadi reaksi terdapat endapan putih
Tidak berekasi, Bening
Tidak bereaksi, Bening Tidak bereaksi, Bening Terjadi reaksi terdapat endapan putih.
Tidak bereaksi, Bening Reaki-reaksi yang terjadi ialah :
· HgCl2 + Albumin · HgCl2 + Asam Aspartat COOH – CH – CH2 - COOH + HgCl2 l NH2 · HgCl2 + Glisin · HgCl2 + Alanin · (CH3COO)2Pb + Albumin · (CH3COO)2Pb + Glisin · (CH3COO)2Pb + Alanin
· (CH3COO)2Pb + Asam Aspartat 5
COOH – CH – CH2 - COOH + HgCl2 l
NH2
Pembahasan
Pada pengendapan protein dengan pengendapan logam, melalui penambahan HgCl2 dan (CH3COO)2Pb ke dalam larutan albumin menyebabkan terjadinya reaksi sehingga larutan yang sebelumnya jernih berubah menjadi keruh dan terdapat endapan. Penambahan HgCl2 dan (CH3COO)2Pb ini karena diketahui bahwa protein mampu menawarkan racun sebab asam amino yang merupakan penyusun suatu protein dapat mengikat logam seperti Hg (merkuri klorida) dan Pb (timbal asetat), racun atau logam yang terikat dalam reaksi ini ditandai dengan adanya endapan putih. Pada saat ditambahkan ke dalam protein, HgCl2 dan (CH3COO)2Pb akan terionisasi dalam bentuk Hg2+ dan PbSO4 sehingga dapat menghasilkan endapan. Ikatan yang amat kuat dari reaksi protein yang ditambahkan dengan HgCl2 dan (CH3COO)2Pb akan memutuskan ikatan jembatan garam, sehingga akan terjadi denaturasi, secara bersama gugus –COOH dan gugus –NH2 yang terdapat pada protein dapat bereaksi dengan ion logam berat dan dapat membentuk senyawa kelat.
Adanya endapan disebabkan karena adanya kemampuan protein atau asam amino untuk berikatan dengan ion logam di atas titik isoelektriknya. Kemampuan ini disebabkan karena pada saat pH berada di atas titik isoelektrik protein atau asam amino, maka ia akan bermuatan negatif sehingga mampu mengikat ion logam yang bermuatan positif. Berdasarkan teori, titik isoelktrik albumin adalah : 4,55-4,90, alanin 6,00 , glisin 5,97 dan serin 5,68 (titik isoelektrik adalah keadaan pH dimana protein /asam amino memiliki jumlah muatan positif dan negatif yang sama). Adanya pertambahan ion logam menyebabkan putusnya jembatan disulfida dan ikatan kovalen S-S pada protein yang mengandung gugus sulfuhidril.
Sedangkan untuk asam amino seperti asam aspartat, glisin, dan alanin tidak membentuk endapan karena suasana larutan masih berada di bawah titik isoelektrik kedua asam amino tersebut, sehingga asam amino yang bermuatan positif tidak mampu berikatan dengan ion logam yang bermuatan positif pula. Selain itu, ketiga jenis asam amino tersebut tidak mengandung gugus sulfuhidril.
3. Uji Xanthoprotein
Uji Xanthoprotein digunakan untuk menunjukkan adanya asam amino tirosin, fenilalanin, dan triptofan dalam protein. Inti benzen yang terdapat di dalam molekul tirosin,
6
fenilalanin, dan triptofan akan ter-nitrasi dengan penambahan HNO3. Senyawa nitro yang terbentuk berwarna kuning dan dalam lingkungan alkalis akan terionisasi dengan bebas dan warnanya menjadi lebih tua atau berubah menjadi jingga.
Reaksi yang terjadi ialah nitrasi atau reaksi substitusi atom H pada benzena yang terdapat pada molekul protein oleh gugus nitro. Pada uji ini, digunakan larutan HNO3 yang berfungsi untuk memecah protein menjadi gugus benzena
Protein merupakan salah satu dari biomolekul raksasa selain polisakarida, lipid dan polinukleotida yang merupakan penyusun utama makhluk hidup. Protein adalah senyawa organik kompleks berbobot molekul tinggi yang merupakan polimer dari monomer-monomer asam amino yang dihubungkan satu sama lain dengan ikatan peptida. Molekul protein itu sendiri mengandung karbon, hidrogen, oksigen, nitroge dan kadang kala sulfur serta fosfor. Protein dirumuskan oleh Jons Jakob Berzelius pada tahun 1938.
Uji Xantoproteat adalah uji terhadap protein yang mengandung gugus fenil(cincin benzena). Apabila protein yang mengandung cincin benzena dipanaskan dengan asam nitrat pekat, maka akan terbentuk kuning yang kemudian menjadi warna jingga bila dibuat alkalis(basa) dengan larutan NaOH.
Alat dan Bahan :
Tabung reaksi
Gelas ukur
Pipet tetes
Lampu spiritus
Penjepit tabung reaksi
Larutan putih telur (Albumin)
Larutan HNO3 2 M
Larutan NaOH 2 M Langkah Kerja :
1. Isi tabung reaksi dengan 2 ml putih telur
2. Tambahkan 2 ml larutan HNO3 , kocok dan amati perubahannya 3. Panaskan dengan nyala api kecil kemudian dinginkan
Data Pengamatan :
Reaksi Hasil Pengamatan Albumin + HNO3 (sebelum
dipanaskan)
Menggumpal, berwarna putih Albumin + HNO3 (setelah Menggumpal, berwarna kuning
dipanaskan)
Albumin + HNO3 + NaOH Menggumpal, berwarna orange (Albumin + HNO3 terpisah dari NaOH)
Pertanyaan :
1. Apa yang terjadi setelah albumin ditambah dengan asam nitrat sebelum dan setelah dipanaskan ?
2. Adakah pengaruh pemanasan dalam percobaan ini ? Jelaskan ! 3. Apa fungsi NaOH dalam percobaan ?
4. Apa yang dapat Anda simpulkan dari percobaan ini ? Jawaban :
1. Setelah ditambahkan, putih telur akan menggumpal dan berwarna putih (endapan putih). Hal ini terjadi karena proses nitrasi terhadap cincin-cincin benzena. Jika dipanaskan warna putih tersebau beribah menjadi kuning.
2. Ya. Pemanasan yang dilakukan akan membuat protein yang dikandung albumin mengalami denaturasi yang ditandain dengan adanya penggumpalan.
3. Sebagai katalisator
4. Pengujian ini memberikan hasil positif terhadap asam amino yang menggandung cincin benzena, seperti fenilalanin, tirosin dan triptofan. Asam nitrat pada putih telur akan menggumpal dan berwarna putih (endapan putih). Hal ini terjadi karena proses nitrasi terhadap cincin-cincin benzena. Jika dipanaskan warna putih tersebau beribah menjadi kuning.
4. Denaturasi Protein 1. Uji Hopkinscole
Digunakan untuk menguji adanya asam amino triptofan. Khususnya yang mengandung gugus indol.
Prosedur pengujian : protein + formaldehid+ merkurisulfatàaliri dengan asam sulfat.
Prinsip reaksi : kondensasi 2 inti indol dan aldehid menyebabkan adanya cincin ungu pada bidang batas
2. Cystine (Menggunakan pereaksi Nitroprusida dan Sulfur)
Digunakan untuk protein yang asam aminonya mempunyai gugus –SH misalnya sistein, yang berupa serbuk hablur putih, dengan sifat sangat mudah larut dalam air, praktis, tidak larut dalam etanol (95%) dan dalam pelarut organik lain, larut dalam asam mineral encer dan dalam larutan alkalihidroksida.
Cara pengujiannya : Sedikit cystine dilarutkan dalam 5 ml NaOH 1 M. Kemudian menambahkan beberapa kristal Pb-asetat dan dipanaskan hingga mendidih.
Selain itu, juga dapat dilakukan dengan: mengambil larutan protein sebanyak 3 ml dan dimasukkan ke dalam tabung reaksi, lalu menambahkan 1 ml Cystein hidroklorida; 0,5 ml natrium nitroprossida; dan 0,5 ml NH3. Kemudian mengamati dan mencatat perubahan yang terjadi serta membandingkan hasil dengan glisin
Hasilnya:
Tabung I : Cystine + larutan NaOH berwarna putih + larutan Pb asetat dan dipanaskan koagulasi.
Tabung II : Susu + larutan NaOH berwarna putih dan mengendap+ larutan Pb asetat berwarna putih dan setelah dipanaskan endapan putih
Tabung III : Albumin + larutan NaOH tidak ada perubahan + larutan Pb asetatkoagulasi, setelah dipanaskan denaturasi.
Kesimpulan: Pada tes cystine terjadi koagulasi pada tabung I dan II, serta terjadi denaturasi pada tabung III.
Sulfur juga digunakan untuk mengidentifikasi asam amino yang mengandung gugus S (sistein, methionin).
Prosedurnya : protein + NaOH dipanaskan + Pb(CH3COO)2.
Fungsi reagen : NaOH mengubah S organik menjadi S anorganik, sedangkan Pb-asetat sebagai donor Pb2+
Prinsip reaksi : SH - CH2 - CH(NH3)+ - COO- + NaOH Na2S Na2S + Pb(CH3COO)2 PbS (hitam)
Koagulasi Protein
Koagulasi merupakan proses lanjutan yang terjadi ketika molekul protein yang didenaturasi membentuk suatu massa yang solid. Cairan telur (sol) diubah menjadi padat atau setengah padat (gel) dengan proses air yang keluar dari struktur membentuk spiral-spiral yang membuka dan melekat satu sama lain. Koagulasi ini terjadi selama rentang waktu temperatur yang lama dan dipengaruhi oleh faktor-faktor yang telah disebutkan sebelumnya seperti panas, pengocokan, pH, dan juga menggunakan gula dan garam. Hasil dari proses koagulasi protein biasanya mampu membentuk karakteristik yang diinginkan. Yaitu mengental yang mungkin terjadi pada proses selanjutnya setelah denaturasi dan koagulasi. Kekentalan hasil campuran telur mempengaruhi keinginan untuk menyusut atau menjadi lebih kuat.
3. Pengendapan dengan alkohol Tabung I II III Larutan Albumin 2 ml 2 ml 2ml Hcl 1 ml - -NaOH - 1 ml -Buffer 4,6 - - 1 ml Etanol 3 ml 3 ml 3 ml
Pengujiannya: menyiapkan alat dan bahan yang digunakan, diantaranya 4 buah tabung reaksi, yang masing – masing tabung diisi dengan 3 ml protein. Kemudian diisi dengan 2 ml HCl 0,1 M pada tabung reaksi I; diisi dengan 1 ml NaOH 0,025 M pada tabung reaksi II; diisi dengan 1 ml buffer pada tabung reaksi III; diisi dengan 3 ml etanol 95% pada tabung reaksi IV. Lalu mengamati dan dicatat perubahan yang terjadi.
Larutan Tabung I II III Susu Albumin Larut (penambahan HCl 0,1 M) Berwarna putih, koagulasi (penambahan HCl 0,1 M) Larut (penambahan NaOH 0,1 M) ≠ mengendap (penambahan NaOH 0,1 M)
Larut (penambahan buffer asetat pH 4,7)
Koagulasi (penambahan buffer asetat pH 4,7)
Pada pengendapan dengan alkohol diperoleh hasil untuk tabung I setelah ditambahkan HCI menghasilkan warna bening dan terjadi penggumpalan sebagian dibawah tabung reaksi dan setelah ditambahkan etanol 95% maka penggumpalan terjadi secara keseluruhan dan untuk tabung II setelah ditambahkan NaOH menghasilkan larutan bening dan setelah ditambahkan etanol 95%, penggumpalan yang terjadi hanya sebagian. Hal ini menandakan bahwa larutan protein telah berkurang, dikarenakan adanya penambahan etanol. 4. Termokoagulasi
Langkah pengujiannya dengan membasakan 5 ml larutan albumin dengan satu tetes NaOH 0,1 M. Kemudian dipanaskan sampai mendidih. Selanjutnya mengasamkan larutan panas ini dengan asam asetat 0,1 M. Dan mengamati apa yang terjadi.
Hasilnya : Susu + NaOH 0,1 M = warna tetap Setelah pemanasan = denaturasi
+ asam asetat 0,1 M = denaturasi Albumin + NaOH 0,1 M = warna tetap Setelah pemanasan = koagulasi + asam asetat 0,1 M = koagulasi
Pada reaksi termokoagulasi, jika albumin ayam kampung ditambahkan NaOH maka terjadi denaturasi sedangkan jika ditambah dengan NaOH dan CH3COOH maka terjadi suatu koagulasi. Kesimpulannya: albumin telur ayam dan bebek yang direaksikan dengan reaksi pengendapan yaitu pada termokoagulasi maka akan terjadi denaturasi.
Selain alkohol, protein juga dapat diendapkan oleh garam seperti ammonium sulfat, karena protein mempunyai gugus –NH2, -NH, -OH , dan -CO yang mengikat air. Alkohol dan ammonium sulfat yang bersifat higroskopis akan menarik air tersebut sehingga protein kehilangan air, mempunyai kelarutan terkecil dan mudah mengendap.
5. Pengendapan Dengan Asam Kuat
Pada reaksi pengendapan dengan asam kuat akan terbentuk koagulasi. Hal ini disebabkan karena pada saat penambahan asam kuat yang direaksikan dengan larutan protein menyebabkan suatu denaturasi.
Dasar reaksi : denaturasi protein adalah rusaknya sifat fisik dan fisiologik protein. Dapat disebabkan karena pemanasan dan penambahan asam kuat. Denaturasi hanya merusak ikatan sekunder, tertier, dan kuartener.
a. Pengendapan dengan asam Nitrat; dilakukan dengan menyiapkan alat dan bahan yang digunakan, kemudian menambahkan 1 ml asam nitrat pekat pada dasar tabung dengan menggunakan pipet kedalam tabung reaksi yang telah diisi dengan 2 ml albumin. Selanjutnya mengamati dan mencatat cincin flokulasinya.
Hasilnya: Susu = denaturasi ( ≠ terbentuk cincin flokulasi ) Albumin = terbentuk cincin flokulasi
Pada reaksi asam nitrat untuk albumin ayam kampung ditambah dengan HNO3 maka akan menghasilkan atau terbentuk cincin dengan 2 lapisan dimana lapisan atas berwarna kuning dan lapisan bawah berwarna putih
Kesimpulan: pengendapan dengan asam nitrat terbentuk cincin flokulasi warna kuning. 11
b. Pengendapan dengan Asam Organik; dilakukan dengan memasukkan 3 mL larutan protein ke dalam tabung reaksi, kemudian menambahkan larutan asam trikloroasetat 10%. Lalu mengamati apa yang terjadi.
Hasilnya : Susu = denaturasi Albumin = denaturasi
Kesimpulan : asam organik menghasilkan koagulasi warna putih.
6. Milon Nase
Digunakan untuk menguji adanya gugus fenol pada protein misalnya tirosin. Tujuan : mengetahui adanya gugus hidroksifenil ( tyrosin)
Prosedur : protein + reagen merkurisulfat (HgSO4 + H2SO4), kemudian dipanaskan akan menghasilkan warna kuning. Selanjutnya didinginkan + NaNO2 dan dipanaskan akan menghasilkan warna merah.
Fungsi reagen : HgSO4 sbg donor Hg2+
H2SO4 memberi suasana asam agar Hg tidak mengendap, menghidrolisis protein agar terdapat tyrosin
NaNO2 mereduksi Hg
Prinsip reaksi: pengikatan Hg pada hidroksifenil menghasilkan kompleks berwarna merah.
7. Pengendapan oleh Garam Metalik Dasar reaksi : penetralan muatan
Pada pH alkalis dari titik isoelektris, protein bermuatan (-). Dengan adanya ion (+) dari logam, maka akan terjadi penetralan muatan dan protein mendekati titik isoelektris sehinggan mengendap. Endapan akan larut dengan penambahan alkali encer.
8. Pengendapan oleh alkaloid Dasar reaksi : penetralan muatan
Pada pH lebih asam dari titik isoelektris, protein bermuatan (+). Dengan adanya ion (+) dari asam sulfosalisilat, asam tugstat, asam pikrat, maka akan terjadi penetralan muatan dan protein mendekati titik isoelektris sehingga mengendap. Endapan akan larut dengan penambahan asam encer.
9. Pengendapan albumin dan globulin Dasar reaksi :
Denaturasi protein adalah rusaknya sifat fisik dan fisiologik protein. Dapat disebabkan karena pemanasan dan penambahan asam kuat. Denaturasi hanya merusak ikatan sekunder, tertier, dan kuartener.
Metode yang digunakan untuk mendenaturasi protein antara lain dengan pengaruh oleh panas pH ekstrim, beberapa pelarut organik seperti alcohol dan asetat oleh zat terlarut. Cuka, detergen, atau hanya dengan menggunakan larutan protein yang bersinggungan dengan udara sehingga terbentuk batu. Usaha yang dilakukan untuk mencegah denaturasi protein yaitu menggunakan garam sesuai prosedur atau aturan dan menghindari penggunaan garam-garam logam.
10. Efek formaldehid
Dasar reaksi : asam amino yang berikatan dengan formaldehid akan bereaksi asam (kehilangan sifat basa) karena formaldehid terikat pada gugus amin membentuk derivate asam amino dimetilol.
Denaturasi Protein
Denaturasi protein merupakan suatu proses dimana terjadi perubahan atau modifikasi terhadap konformasi protein, lebih tepatnya terjadi pada struktur tersier maupun kuartener dari protein. Pada struktur tersier protein misalnya, terdapat empat jenis interaksi pada rantai samping seperti ikatan hidrogen, jembatan garam, ikatan disulfida, interaksi non polar pada bagian non hidrofobik. Adapun penyebab dari denaturasi protein bisa berbagai macam, antara lain panas, alkohol, asam-basa, maupun logam berat.
Denaturasi juga dapat dikatakan suatu proses terpecahnya ikatan hidrogen, ikatan garam, atau bila susunan ruang atau rantai polipeptida suatu molekul protein berubah. Dengan perkataan lain denaturasi, Denaturasi adalah terjadi karena kerusakan struktur sekunder. tersier, dan kuartener, tetapi struktur premier (ikatan peptida) masih utuh. Adapun faktor-faktor penyebab terjadinya denaturasi pada protein adalah karena suhu pada lingkungan, pH, tekanan, aliran listrik dan adanya campuran bahan kimia pada senyawa yang terdapat pada protein tersebut. Proses denaturasi berlangsung secara tetap, dan tidak berubah. Suatu protein yang mengalami proses denaturasi akan mengalami perubahan viskositas atau berkurangnya kelarutan cairan sehingga mudah mengendap.
Ciri-ciri suatu protein yang mengalami denaturasi bisa dilihat dari berbagai hal. Salah satunya adalah dari perubahan struktur fisiknya, protein yang terdenaturasi biasanya mengalami pembukaan lipatan pada bagian-bagian tertentu. Selain itu, protein yang terdenaturasi akan berkurang kelarutannya. Lapisan molekul yang bagian hidrofobik akan
mengalami perubahan posisi dari dalam ke luar, begitupun sebaliknya. Hal ini akan membuat perubahan kelarutan.
Selain itu, masing-masing penyebab denaturasi protein juga mengakibatkan ciri denaturasi yang spesifik. Panas, misalnya. Panas dapat mengacaukan ikatan hidrogen dari protein namun tidak akan mengganggu ikatan kovalennya. Hal ini dikarenakan dengan meningkatnya suhu akan membuat energi kinetik molekul bertambah. Bertambahnya energi kinetik molekul akan mengacaukan ikatan-ikatan hidrogen. Dengan naiknya suhu, akan membuat perubahan entalpi sistem naik. Selain itu bentuk protein yang terdenaturasi dan tidak teratur juga sebagai tanda bahwa entropi bertambah. Entropi sendiri merupakan derajat ketidakteraturan, semakin tidak teratur maka entropi akan bertambah. Pemanasan juga dapat mengakibatkan kemampuan protein untuk mengikat air menurun dan menyebabkan terjadinya koagulasi. Misalnya denaturasi dengan suhu panas yang dilakukan pada buah-buahan akan mengakibatkan berkurangnya kadar air dan bertambahnya viskositas atau kekentalan kadar protein yang tertanam pada buah yang mengalami denaturasi akibat suhu panas.
Penambahan asam dan basa dapat mengacaukan jembatan garam yang terdapat pada protein. Ion positif dan negatif pada garam dapat berganti pasangan dengan ion positif dan negatif dari asam ataupun basa sehingga jembatan garam pada protein yang merupakan salah satu jenis interaksi pada protein, menjadi kacau dan protein dapat dikatakan terdenaturasi.
Bentuk protein terdenaturasi yang mengendap ini juga dapat diakibatkan oleh pengaruh logam-logam berat. Dengan adanya logam-logam berat itu akan terbentuk kompleks garam protein-logam. Kompleks inilah yang membuat protein akan sulit untuk larut. Dan sama dengan ketika protein terdenaturasi akibat asam dan basa, entalpi pelarutannya akan naik. Protein bermuatan negatif atau protein dengan pH larutan di atas titik isoelektrik akan diendapkan oleh ion positif atau logam lebih mudah. Sebaliknya, protein bermuatan positif dengan pH larutan di bawah titik isoelektrik membutuhkan ion-ion negatif. Contoh ion-ion positif yang dapat mengendapkan protein misalnya Ag+, Ca2+, Zn2+, Hg2+, Fe2+, Cu2+, dan Pb2+. Dan contoh ion-ion negatif yang dapat mengendapkan protein misalnya ion salisilat, trikloroasetat, piktrat, tanat, dan sulfosalisilat. Namun selain membentuk kompleks garam protein-logam yang sukar larut, logam berat dapat menarik sulfur pada protein sehingga mengganggu ikatan disulfida dalam protein dan menyebabkan protein terdenaturasi pula.
Gangguan pada ikatan disulfida selain disebabkan oleh logam berat juga dapat disebabkan oleh agen-agen pereduksi. Agen pereduksi ini bisa menyebabkan ikatan disulfida
putus dan dapat membentuk gugus tiol (-SH) dengan penambahan atom hidrogen. Selain ikatan disulfida, ikatan lain yang apabila terganggu dapat menyebabkan denaturasi protein adalah ikatan hidrogen. Dengan adanya alkohol dapat merusak ikatan hidrogen antar rantai samping dalam struktur tersier suatu protein. Selain itu, pengocokan, pengaruh pH, gula dan garam, serta alkohol juga dapat mendenaturasi protein. Alkohol seperti kita ketahui umumnya terdapat kadar 70% dan 95%. Alkohol 70% bisa masuk ke dinding sel dan dapat mendenaturasi protein di dalam sel. Sedangkan alkohol 95% mengkoagulasikan protein di luar dinding sel dan mencegah alkohol lain masuk ke dalam sel melalui dinding sel. Sehingga yang digunakan sebagai disinfektan adalah alkohol 70%. Alkohol mendenaturasi protein dengan memutuskan ikatan hidrogen intramolekul pada rantai samping protein. Ikatan hidrogen yang baru dapat terbentuk antara alkohol dan rantai samping protein tersebut.
Kehadiran logam-logam berat, asam-basa tertentu, alkohol dan bahan-bahan lain yang dapat memicu terjadinya denaturasi (atau dapat disebut sebagai bahan denaturan) dapat mengganggu kestabilan protein yang pada umumnya berada pada keadaan folded. Keberadaan denaturan yang mengikat pada protein folded tersebut dapat menaikkan entropi dari rantai protein sehingga terjadi reaksi dari bentuk folded menjadi unfolded. Namun sebenarnya perubahan dari keadaan folded menjadi unfolded tidak sepenuhnya diakibatkan keberadaan denaturan. Pada kondisi-kondisi ekstrim tertentu yang tidak bisa ditoleransi oleh protein, maka protein juga akan mengubah dirinya dari keadaan folded ke keadaan unfolded. Keadaan seperti ini berjalan reversibel dengan sangat lambat.
Pada keadaan protein terlipat atau folded, bagian yang hidrofilik akan berada di luar sedangkan bagian yang hidrofobik akan berada di bagian dalam. Hal ini memungkinkan protein dapat larut dalam pelarut polar seperti air. Namun saat protein terdenaturasi, terjadi pembalikan posisi menjadi bagian hidrofobik yang berada di luar. Pada saat inilah protein tidak bisa larut dalam air dan berada pada kondisi energi yang tinggi karena air akan berusaha melarutkan bagian yang hidrofobik tersebut padahal karena perbedaan kepolaran air dan bagian hidrofobik itu tidak akan larut. Oleh karena itu protein terdenaturasi akan berusaha segera kembali ke keadaan stabil atau energi rendah kembali. Apabila struktur protein tersebut terlalu kompleks, salah satu jalan untuk membuat kondisi energinya menjadi rendah kembali adalah dengan menggumpalkan dirinya. Dengan konformasi tergumpal, maka seluruh bagian hidrofobik dari protein tidak akan berinteraksi lagi dengan air yang terus berusaha melarutkannya, sehingga dapat dikatakan konformasi seperti ini lebih stabil.
Dalam pandangan klasik mengenai dua kondisi pelipatan protein, sebuah protein dikatakan berada dalam kondisi kesetimbangan dinamis antara suatu kondisi terlipat (folded state) yang kompak dengan energi dan entropi rendah serta suatu kondisi entropi tinggi yang secara struktural ditandai dengan konformasi tidak teratur berenergi tinggi yang dikenal juga sebagai kondisi tidak terlipat (unfolded state)
Proses perubahan dari folded ke unfolded berjalan reversibel namun sangat lambat berarti memungkinkan terjadi proses renaturasi. Proses renaturasi atau pengembalian struktur dari struktur protein terdenaturasi menjadi struktur protein awal bisa saja terjadi. Namun, perlu diingat apabila struktur protein awal terlalu kompleks, maka proses renaturasi atau refolding tersebut akan berlangsung sangat lambat dan sulit. Contohnya seperti pada protein yang terdapat pada telur. Apabila protein tersebut telah terdenaturasi, maka akan sulit untuk mengembalikan ke kondisi naturalnya.
Proses browning non-Enzymatic disebabkan oleh 3 hal, yaitu: a. Suhu dan lama pemanasan (pemanggangan) yang terjadi, b. Reaksi yang terjadi didahului oleh keton atau aldehid, c. Pencokelatan akibat kadar asam yang tercampur.
Mekanisme pencokelatan meliputi : pertama-tama gula dan amino bereaksi membentuk aldosilamin yang kemudian mengalami pengaturan kembali Amadori menjadi Ketosa Amin. Senyawa ini lalu mengalami suatu reaksi kompleks yang akhirnya menghasilkan polimer berwarna cokelat yang disebut Melanoidin. Laju pencokelatan meningkat cepat seiring dengan meningkatnya suhu dan pH diatas 6,8. Reaksi ini dapat menciptakan warna dan cita rasa yang diinginkan dalam bahan makanan, misal pada hasil masakan pemanggangan seperti roti.
Pada proses pencokelatan atau browning non-Enzimatik ini yang dilakukan pada Roti, memiliki dampak negatif yang bisa dan kemungkinan terjadi, yaitu menurunkan nilai biologis protein terutama untuk asam amino lisin, yang berpotensi menciptakan cita rasa yang tidak diinginkan saat membuat produk yang melalui proses non-Enzymatic Browning atau Pencokelatan non-Enzimatik ini. Tirosin yang berperan sebagai substrat sedangkan proses non enzimatis disebabkan karena reaksi Meillard, karamelisasi atau oksidasi asam askorbat. Proses pencoklatan yang terjadi akan mengurangi kualitas produk dan menurunkan minat konsumen.
11. Uji Nin Hidrin
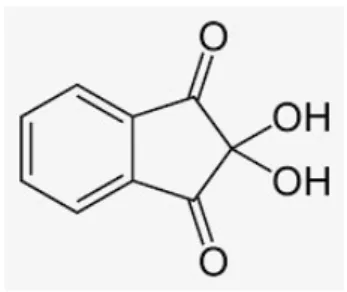
Gambar 1. Molekul ninhidrin
Ninhidrin adalah suatu senyawa oksidator kuat yang apabila bereaksi dengan asam α amino akan menghasilkan warna ungu.
Uji Ninhidrin digunakan untuk menunjukkan adanya asam amino dalam zat yang di uji. Uji ninhidrin berlaku untuk semua asam amino. Ninhidrin (2,2-Dihydroxyindane-1,3-dione) merupakan senyawa kimia yang digunakan untuk mendeteksi gugus amina dalam molekul asam amino.
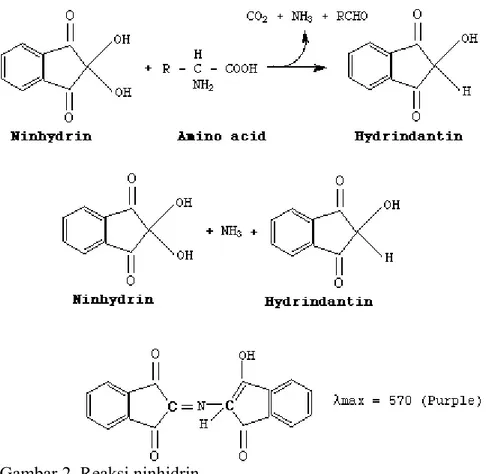
Asam amino bereaksi dengan ninhidrin membentuk aldehida
dengan satu atom C lebih rendah dan melepaskan molekul NH3 dan CO2.
Ninhidrin yang telah bereaksi akan membentuk hidrindantin. Hasil positif ditandai dengan terbentuknya kompleks berwarna biru/keunguan yang disebabkan oleh molekul ninhidrin + hidrindantin yang yang bereaksi
dengan NH3 setelah asam amino tersebut dioksidasi.
Untuk lebih jelas dapat dilihat pada Gambar 2.
Gambar 3. Hasil positif uji ninhidrin
Ninhidrin beraksi dengan asam amino bebas dan protein menghasilkan warna biru. Reaksi ini termasuk yang paling umum dilakukan untuk analisis kualitatif protein dan produk hasil hidrolisisnya.
Reaksi ninhidrin dapat pula dilakukan terhadap urin untuk mengetahui adanya asam amino atau untuk mengetahui adanya pelepasan protein oleh cairan tubuh (Santoso, 2008). Bahan dan pereaksi:
1. Larutan ninhidrin 0.1% 2. Zat yang akan diuji Langkah kerja:
1. Masukkan 2 ml yang yang akan diuji dalam tabung reaksi. 2. Tambahkan 5 tetes ninhidrin 0.1%.
3. Panaskan dalam penangas air selama 10 menit. 4. Amati munculnya warna biru/keunguan
Gambar 2. Reaksi ninhidrin Catatan:
Uji ninhidrin digunakan oleh kepolisian untuk menunjukkan sidik jari yang tertinggal di tempat kejadian perkara. Keringat yang dikeluarkan mengandung asam amino, sehingga dapat dideteksi dengan ninhidrin. Keringat akan menempel pada suatu permukaan dengan pola yang khusus sesuai dengan sisik jari pemiliknya. Polisi akan menyemprotkan larutan ninhidrin pada benda yang disentuh pelaku sehingga akan muncul bercak berwarna keunguan yang merupakan sidik jari pelaku. Hasil sidik jari dengan uji ninhidrin dapat dilihat pada Gambar 4.
Gambar 4. Sidik jari hasil uji ninhidrin
BAB III
PENUTUP
I. Kesimpulan
Uji ninhidrin adalah menguji ada atau tidaknya protein dalam suatu senyawa dengan penambahan reagen ninhidrin untuk mengetahui jumlah kadar asam amino bebas yang terkandung didalamnya, dimana asam amino bebas akan bereaksi dengan ninhidrin dan membentuk senyawa kompleks berwarna ungu, dimana asam amino mereduksi ninhidrin.
Prinsip dari uji biuret adalah menguji ada atau tidak adanya protein dalam suatu senyawa dengan penambahan reagen NaOH dan CuSO4 berdasarkan ada atau tidaknya ikatan peptida (ikatan peptida harus lebih dari 2). Dimana ion Cu2+ (dari pereaksi biuret) dalam suasana basa akan bereaksi dengan polipeptida yang menyusun protein dan membentuk senyawa kompleks berwarna biru hingga ungu.
Pada reaksi uji protein dengan penambahan logam berat seperti logam Hg dan Pb bereaksi positif dengan adanya pengendapan pada albumin, namun beraksi negatif pada alanin, asam aspartat dan glisin.
Uji Xantoproteat adalah uji terhadap protein yang mengandung gugus fenil (cincin benzena). Apabila protein yang mengandung cincin benzena dipanaskan dengan asam nitrat pekat, maka akan terbentuk kuning yang kemudian menjadi warna jingga bila dibuat alkalis(basa) dengan larutan NaOH
Prinsip reaksi uji hopkinscole: kondensasi 2 inti indol dan aldehid menyebabkan adanya cincin ungu pada bidang batas
Koagulasi protein merupakan proses berkelanjutan, dimana koagulasi adalah proses awal dengan pengadukan cepat untuk menyatukan koloid-koloid menjadi flok-flok kecil.
Denaturasi protein dengan asam asetat merupakan denaturasi kimiawi yang mampu membuat rantai panjang l heliks dalam protein tersebut memanjang. Larutan proetein telur dan susu mengalami denaturasi akibat penambahan asam asetat ditunjukkan oleh adanya endapan yang terbentuk.Denaturasi garam logam berat merupakan reaksi denaturasi akibat dari reaksi dari protein yang mengandung muatan negative akan berikatan dengan logam yang bermuatan positif. Larutan protein telur dan susu mengalami denaturasi akibat penambahan garam logam berat, ditunjukkan terbentuknya endapan yang berwarna sesuai dengan warna logam dari garam logam yang ditambahkan. Denaturasi akibat pemanasan
merupakan denaturasi fisika. Suhu yang tinggi membuat molekul – molekul penyusun amino yang bergerak sangat cepat sehingga dapat mengacaukan ikatan peptide. Baik protein telur maupun protein susu mengalami denaturasi akibat pemanasan karena saat dipanaskan molekul – molekulnya bergerak cepat sehingga mengacaukan ikatan peptide. II. Saran
Untuk menghasilkan hasil yang tepat sangat dibutuhkan ketelitian dan setelah mengetahui fungsi dan hasil dari berbagai pengujian terhadap protein diatas diharapkan kita mampu mengimplementasikan di kehidupan sehari-hari.
DAFTAR PUSTAKA
Djarir, Makfoeld (Tim Penulis Laboratorium Kimia – Biokimia Pangan Teknologi Hasil Pertanian, Fakultas Teknologi Pertanian, Universitas Gadjah Mada, Yogyakarta) dkk. 2006. Kamus Istilah Pangan Dan Nutrisi. Kanisius : Yogyakarta
Fessenden dan Fessenden. 1989. Kimia Organik Jilid 2. Ed. 3. Jakarta: Erlangga. Hal. 395 Frederick A B, William H, Brown, dkk. 2010. Introduction to general, organic, and
biochemistry. Kanada : Nelson Education Ltd. 21
Marks Dawn B, Marks Allan D, Smith Collen. 1996. Biokimia Kedokteran Dasar (Terj.). Jakarta: Penerbit Buku Kedokteran EGC.
Simanjutak, M.T dan J. Silalahi.2003. Penuntun Praktikum Biokimia hal.3 . Fakultas Matematika dan Ilmu Pengetahuan Alam Jurusan Farmasi Universitas Sumatera Utara
Wahyuningsih. 2009. Pengaruh Tirosin, Asan Askorbat, Enzim Polifenol, Xidase (PPO) Terhadap Perubahan Warna Kentang. Program Diploma III Teknik Kimia Fakultas Teknik Universitas Diponegoro http://alirohman11.blogspot.com http://adevioktavianingeblog.blogspot.com http://bisakimia.com http://id.wikipedia.org http://www.elmhurst.edu http://www.scribd.com http://www.squidoo.com http://pendidikan-bio.blogspot.com 22