BAB II
TINJAUAN PUSTAKA 2.1 Ekosistem Danau
Secara umum, ekosistem perairan darat dapat dibagi menjadi dua seri yaitu perairan lentik dan perairan lotik. Perairan lentik disebut juga perairan tenang karena mempunyai kecepatan arus yang lambat sehingga terjadi akumulasi massa air dalam periode waktu yang cukup lama. Yang termasuk perairan lentik adalah danau, kolam rawa, waduk, situ dan telaga. Sementara itu perairan lotik merupakan perairan berarus deras atau memiliki kecepatan arus tinggi yang disertai dengan perpindahan massa air dengan cepat. Yang termasuk kedalam perairan lotik misalnya sungai dan kanal.
Sebagai salah satu bentuk ekosistem, perairan danau terdiri dari faktor abiotik (fisika dan kimia) dan faktor biotik (produsen, konsumen dan dekomposer), dimana faktor-faktor tersebut membentuk suatu hubungan timbal balik dan saling mempengaruhi satu dengan yang lainnya. Secara fisik, danau merupakan suatu tempat yang luas yang mempunyai air tetap, jernih atau beragam dengan aliran tertentu dan keberadaan tumbuhan air terbatas hanya pada daerah pinggir saja (Jorgensen and Vollenweiden, 1989; Barus, 2004). Menurut Ruttner (1977), danau adalah suatu badan air alami yang selalu tergenang sepanjang tahun dan mempunyai mutu air tertentu yang beragam dari satu danau ke danau yang lain, serta mempunyai produktivitas biologi yang tinggi.
Sebagai ekosistem perairan lentik, perairan danau ditandai dengan keadaan arus air yang sangat lambat (0,001 – 0,01 m/detik) atau bahkan tidak ada arus sama sekali, sehingga waktu tinggal air (residence time) dapat berlangsung dalam waktu sangat lama. Karena kondisi arus air pada danau sangat lambat, maka pengaruhnya tidak begitu besar terhadap kehidupan organisme yang ada di dalamnya. Faktor yang sangat penting pada ekosistem danau adalah pembagian
daerah air secara vertikal (stratifikasi), dimana setiap lapisan air memiliki sifat yang berbeda satu sama lain. Adanya perbedaan sifat air antar lapisan terutama berkaitan dengan perbedaan intensitas cahaya matahati yang diserap, yang selanjutnya menyebabkan terjadinya perbedaan suhu air pada setiap kedalaman.
Berdasarkan adanya perbedaan suhu yang terdapat pada setiap kedalaman air, Effendi (2003) membedakan suatu perairan danau secara vertikal menjadi 3 (tiga) stratifikasi, yaitu :
1. Epilimnion, merupakan lapisan bagian atas dari perairan danau. Lapisan ini merupakan bagian yang hangat dari kolom air dengan keadaan suhu yang
relatif konstan (perubahan suhu secara vertikal sangat kecil). Seluruh massa air pada lapisan ini dapat bercampur dengan baik akibat dari pengaruh angin dan gelombang.
2. Metalimnion atau yang sering disebut termoklin. Lapisan ini berada disebelah bawah lapisan epilimnion. Pada lapisan ini perubahan suhu secara vertikal relatif besar, dimana setiap penambahan kedalaman 1 meter, terjadi penurunan suhu air sekitar 1 0C.
3. Hipolimnion, adalah lapisan paling dalam dari perairan danau, yang terletak di sebelah bawah lapisan termoklin. Lapisan ini mempunyai suhu yang lebih dingin dan perbedaan suhu vertikal relatif kecil, massa airnya stagnan, tidak mengalami percampuran dan memiliki kekentalan air (densitas) lebih besar.
Selain membedakan lapisan air berdasarkan suhu, suatu perairan danau dapat juga dibedakan berdasarkan kedalaman penetrasi cahaya matahari kedalam badan air menjadi beberapa zona. Dalam hal ini, Odum (1996) membedakan suatu perairan danau menjadi 3 (tiga) zona, yaitu :
1. Zona litoral, adalah daerah perairan dangkal pada danau, dimana penetrasi cahaya dapat mencapai hingga ke dasar perairan. Organisme utama yang hidup pada zona ini terdiri dari produser yang meliputi tanaman berakar (anggota spermatophyta) dan tanaman yang tidak berakar (fitoplankton, ganggang), sedangkan konsumernya meliputi beberapa larva serangga air, rotifera, moluska, ikan, penyu, zooplankton dan lain sebagainya.
2. Zona limnetik, adalah daerah perairan terbuka sampai pada kedalaman penetrasi cahaya yang efektif, sehingga daerah ini efektif untuk proses fotosintesis. Organisme utama yang hidup pada zona ini terdiri dari produser yang meliputi fitoplankton dan tumbuhan air yang terapung-apung bebas, sedangkan organisme konsumernya meliputi zooplankton dari copepoda, rotifera dan beberapa jenis ikan.
3. Zona profundal, adalah daerah dasar dari perairan danau yang dalam, dimana pada daerah ini tidak dapat lagi dicapai oleh penetrasi cahaya efektif. Sebagai organisme utama yang hidup pada zona ini adalah konsumer yang meliputi jenis cacing darah dan kerang-kerang kecil.
2.2 Status Trofik Perairan
Status trofik suatu perairan merupakan gambaran kwalitatif yang menyatakan konsentrasi unsur hara yang terdapat pada suatu badan air (Henderson dan Markland, 1987). Dalam Peraturan Menteri Negara Lingkungan hidup No.28 Tahun 2009 didefenisikan bahwa status trofik perairan adalah status kwalitas air danau/waduk berdasarkan kadar unsur hara dan kandungan biomassa fitoplankton atau produktivitasnya.
Berdasarkan tingkat kesuburan air, Mason (1993) mengklasifikasikan perairan tergenang (danau) menjadi 5 kelompok, yaitu :
1. Oligotrofik, adalah perairan yang miskin unsur hara dan produktivitas rendah (produktivitas primer dan biomassa rendah). Perairan ini memiliki kadar nitrogen dan fosfor yang rendah, namun cenderung jenuh oksigen.
2. Mesotrofik, adalah perairan yang memiliki unsur hara dan produktivitas sedang (produktivitas primer dan biomassa sedang). Perairan ini merupakan peralihan antara oligotrofik dan eutrofik.
3. Eutrofik, adalah perairan kaya unsur hara dan produktivitas tinggi. Perairan ini memiliki tingkat kecerahan rendah dan oksigen pada lapisan hipolimnion dapat lebih kecil dari 1 mg/liter.
4. Hiper-eutrofik, adalah perairan dengan kandungan unsur hara dan produktivitas primer sangat tinggi. Pada lapisan hipolimnionnya tidak terdapat oksigen (kondisi anoksik).
5. Distrofik adalah perairan yang banyak mengandung bahan organik, seperti humus dan fulvic. Jenis perairan seperti ini banyak menerima bahan organik dari tumbuhan yang berasal dari daratan sekitarnya, sehingga biasanya memiliki produktivitas primer rendah.
Keadaan tropik suatu perairan danau dapat diindikasi berdasarkan beberapa parameter fisika, kimia dan biologi perairan, yaitu: 1) produktifitas primer netto; 2) kandungan klorofil-a; 3) kandungan nitrogen anorganik; 4) kandungan total pospat; 5) bahan organik total; 6) biomasa fitoplankton; 7) penetrasi cahaya matahari; 8) senyawa anorganik yang terlarut (Whittaker, 1975). Selanjutnya, Jorgensen (1990) menambahkan bahwa tingkat trofik (kesuburan) suatu danau juga dapat dinyatakan berdasarkan kandungan total nitrogen (TN), total fosfat (TP), klorofil-a dan biomassa fitoplankton.
2.3 Faktor Fisika, Kimia dan Biologi Perairan 2.3.1 Suhu Air
Suhu air merupakan salah satu faktor yang sangat berpengaruh terhadap ekosistem perairan danau. Perubahan suhu air mempengaruhi perubahan beberapa sifat fisika maupun kimia air seperti perubahan kelarutan berbagai gas dalam air (O2, CO2, N2, dan CH4), sehingga berdampak terhadap aktifitas fisiologis organisme yang hidup di dalamnya. Suuhu merupakan faktor pembatas utama kehidupan di air, dimana setiap jenis organisme memiliki kisaran toleransi yang berbeda-beda terhadap suhu media tempat hidupnya. Ada organisme akuatik yang memiliki kisaran toleransi luas terhadap perubahan suhu lingkungan (euritermal) dan ada organisme akuatik mempunyai kisaran toleransi suhu yang sempit
(stenotermal). Selain itu, menurut Stumm and Morgan (1981), suhu air juga dapat
mempengaruhi proses dan keseimbangan reaksi-reaksi kimia yang terjadi dalam ekosistem perairan.
Suhu suatu badan air dipengaruhi oleh musim, lintang, ketinggian dari permukaan laut, sirkulasi udara, tutupan awan, dan aliran air serta kedalaman badan air. Pada danau-danau di daerah tropik, air danau mempunyai kisaran suhu yang cukup tinggi yaitu antara 20-30 0C, dan secara vertikal menunjukkan adanya penurunan suhu air seiring dengan bertambahnya kedalaman, oleh karena itu dapat terbentuk stratifikasi air yang mantap sepanjang tahun. Sebagai akibatnya, pada danau yang amat dalam masa air cenderung hanya sebagian yang dapat bercampur (Effendi, 2003).
2.3.2 Kecerahan Air dan Intensitas Cahaya
Kecerahan merupakan ukuran transparansi perairan yang ditentukan secara visual dengan menggunakan alat secchi disk (Effendi, 2003). Nilai kecerahan air berguna untuk mengetahui sampai kedalaman berapa cahaya matahari dapat menembus lapisan perairan dalam hubunganya dengan proses fotosintesis. Batas akhir cahaya matahari mampu menembus perairan disebut sebagai titik kompensasi cahaya, yaitu titik pada lapisan air dimana cahaya matahari mencapai nilai minimum yang menyebabkan proses asimilasi dan respirasi berada dalam keadaan keseimbangan.
Nilai kecerahan sangat dipengaruhi oleh keberadaan padatan tersuspensi, kekeruhan, partikel koloid, warna air,jasad renik, keadaan cuaca dan kepadatan plankton (APHA,1989). Karena cahaya matahari merupakan sumber energi utama bagi kehidupan organisme di perairan yang diserap melalui proses fotosintesis, maka kecerahan air dan intensitas cahaya merupakan salah faktor abiotik utama yang sangat menentukan terhadap laju produktivitas primer perairan.
2.3.3 Derajat Keasaman (pH)
Derajat keasaman merupakan gambaran dari jumlah atau aktivitas ion hidrogen didalam air. Secara umum nilai pH air menggambarkan keadaan seberapa besar tingkat keasaman atau kebasaan suatu perairan. Perairan dengan nilai pH = 7 berati kondisi air bersifat netral, pH < 7 berarti kondisi air bersifat asam, sedangkan pH > 7 berarti kondisi air bersifat basa (Effendi, 2003). Keberadaan senyawa karbonat, bikarbonat dan hidroksida dalam air akan
menaikkan kebasaan air, sementara keberadaan asam mineral bebas dan asam karbonat menaikkan keasaman suatu perairan. Selanjutnya, Pescod (1973) menjelaskan bahwa nilai pH air dapat dipengaruhi oleh beberapa faktor yaitu fotosintesis, respirasi organisme akuatik, suhu dan keberadaan ion-ion di perairan tersebut.
Nilai pH dapat mempengaruhi spesiasi senyawa kimia dan toksisitas dari unsur-unsur renik yang terdapat di perairan, sebagai contoh H2S yang bersifat toksik banyak ditemui di perairan yang tercemar dan perairan dengan nilai pH rendah. Perairan dengan kondisi asam kuat akan menyebabkan unsur logam berat seperti aluminium memiliki mobilitas yang meningkat dan karena logam ini bersifat toksik maka dapat mengancam kehidupan biota. Demikian juga bila pH air terlalu basa maka keseimbangan amonium dan amoniak akan terganggu, dalam hal ini kenaikan pH di atas netral akan meningkatkan konsentrasi amoniak yang juga bersifat toksik terhadap biota akuatik. Selain itu, pH air juga mempengaruhi parameter BOD5 dan kandungan nutrien dalam air seperti fosfat, nitrogen dan nutrien lainnya (Dojildo and Best, 1992).
2.3.4 DO (Dissolved Oxygen = Oksigen Terlarut )
Oksigen terlarut (DO) adalah konsentrasi gas oksigen yang terlarut dalam air yang berasal dari hasil fotosintesis fitoplankton dan tumbuhan air serta hasil difusi dari udara (APHA, 1989). Sebagian besar dari oksigen terlarut pada perairan danau dan waduk adalah merupakan hasil sampingan dari aktivitas fotosintesis. Proses difusi oksigen dari atmosfer ke perairan pada hakekatnya berlangsung relatif lambat, dimana proses ini hanya dapat terjadi secara langsung pada kondisi air yang diam (stagnant) atau terjadi karena pergolakan massa air (agitasi) yang diakibatkan adanya gelombang atau angin.
Jeffries and Mills (1996) menyatakan bahwa kelarutan oksigen perairan sangat dipengaruhi oleh beberapa faktor yaitu: suhu air, salinitas, turbulensi air, dan tekanan atmosfer. Selanjutnya masih menurut Jeffries and Mills (1996), bahwa kandungan oksigen terlarut dalam air akan berkurang seiring dengan meningkatnya suhu air, ketinggian tempat, dan berkurangnya tekanan atmosfer.
Keberadaan oksigen terlarut dalam air sangat penting bagi kehidupan semua organisme aerob perairan termasuk mikroorganisme dekomposer. Oksigen terlarut diperlukan untuk proses respirasi, dalam hal ini pembakaran terhadap bahan organik untuk menghasilkan energi. Sehubungan dengan hal tersebut, maka oksigen terlarut mempunyai peranan yang sangat penting dalam penguraian bahan-bahan organik oleh berbagai jenis mikroorganisme aerobik (APHA, 1989), sehingga keberadaan oksigen terlarut sangat erat kaitanya dengan keberadaan senyawa organik dalam air dan dapat digunakan sebagai indikator adanya pencemaran limbah organik pada suatu perairan (Lee at al, 1978).
2.3.5 BOD5 (Biochemical Oxygen Demand)
Secara spesifik BOD5 diartikan sebagai banyaknya oksigen terlarut yang dibutuhkan oleh mikroorganisme aerobik untuk dapat mendegradasikan senyawa-senyawa organik yang terdapat pada perairan. Karena oksidasi aerobik yang dilakukan mikroorganisme terjadi dengan memanfaatkan oksigen yang terlarut dalam air, maka oksidasi bahan organik berakibat terhadap penurunan konsentrasi oksigen terlarut (DO). Penurunan konsentrasi DO dapat terjadi sampai pada tingkat konsentrasi terendah, tergantung kepada banyaknya senyawa organik yang didegradasikan. Berdasarkan hal tersebut, maka nilai BOD5 merupakan salah satu indikator yang dapat digunakan untuk mengetahui tingkat pencemaran bahan organik pada suatu perairan (Lee at al, 1978).
Perairan dengan nilai BOD5 yang tinggi mengindikasikan bahwa kondisi perairan telah mengalami pencemaran oleh bahan-bahan organik, dan sebaliknya perairan dengan nilai BOD5 yang rendah mengindikasikan bahwa kondisi perairan miskin akan bahan organik sehingga diindikasikan tidak tercemar oleh limbah-limbah organik.
Menurut Barus (2004) bahwa ada beberapa faktor yang dapat mempengaruhi nilai BOD5, yaitu jumlah senyawa organik yang diuraikan, tersedianya organisme aerob yang mampu menguraikan senyawa organik tersebut dan tersedianya sejumlah oksigen yang dibutuhkan dalam proses penguraian tersebut.
2.3.6 COD (Chemical Oxygen Demand)
Dalam suatu perairan tidak semua senyawa organik dalam air dapat diuraikan secara biologi, sehingga untuk mengukur oksigen yang dibutuhkan dalam penguraian keseluruhan senyawa organik dalam air dilakukan dengan analisis COD dengan menggunakan oksidator kuat kalium dikromat dan asam sulfat. COD adalah gambaran dari jumlah total oksigen yang dibutuhkan untuk mengoksidasi bahan organik secara kimiawi, baik senyawa organik yang dapat didegradasi secara biologi maupun yang sukar atau tidak dapat didegradasi secara biologi (Effendi, 2003). Berdasarkan hal tersebut maka nilai COD dianggap paling baik digunakan untuk menggambarkan tingkat pencemaran keseluruhan bahan-bahan organik pada suatu perairan.
2.3.7 Kandungan Nutrien (N dan P)
Unsur hara (nutrien) adalah semua unsur dan senyawa yang dibutuhkan oleh organisme produsen (fitoplankton) dan berada dalam bentuk material anorganik. Elemen-elemen nutrien (unsur hara) yang utama dibutuhkan dalam jumlah besar adalah karbon, nitrogen, fosfor, oksigen, silikon, magnesium, potassium, dan kalsium. Sedangkan elemen nutrien yang dibutuhkan dalam jumlah yang sangat sedikit adalah: besi, copper, dan vanadium. Diantara unsur hara tersebut, keberadaan nitrogen dan fospor merupakan nutrien yang sangat penting dalam mendukung kehidupan organisme suatu perairan seperti fitoplankton, sehingga keberadaanya sering menjadi faktor pembatas dan akan menjadi penentu terjadinya blooming apabila konsentrasinya dalam air berlebihan (Sellers dan Markland, 1987). Selanjutnya, Nybakken (1992) menyatakan bahwa fitoplankton akan dapat menghasilkan energi dan molekul-molekul yang kompleks jika di dalam air tersedia nutrien dengan jumlah yang cukup, terutama nutrien dari senyawa nitrat dan fosfat.
Pada suatu ekosistem danau, pemasokan nutrien dapat terjadi melalui dua jalur, yaitu :1) melalui jalur hasil dekomposisi terhadap senyawa organik oleh organisme dekomposer sehingga menghasilkan senyawa anorganik sebagai nutrien. 2) melalui jalur masukan dari aliran sungai yang bermuara ke danau.
Pada umumnya perairan danau di daerah tropis mempunyai konsentrasi nutrien terlarut yang relatif tinggi. Hal ini disebabkan karena suhu air danau di daerah tropis cukup tinggi, sehingga dapat memacu laju proses dekomposisi senyawa-senyawa organik menjadi senyawa anorganik oleh mikroorganisme akuatik (Folkowski dan Raven, 1997).
a. Fosfor (P)
Fosfor merupakan salah satu bahan kimia yang keberadaanya sangat penting bagi semua mahluk hidup, terutama dalam pembentukan protein dan transfer energi didalam sel seperti ATP dan ADP. Pada ekosistem perairan, fosfor terdapat dalam bentuk senyawa fosfor, yaitu : 1) fosfor anorganik; 2) fosfor organik dalam protoplasma tumbuhan dan hewan dan 3) fosfor organik terlarut dalam air, yang terbentuk dari proses penguraian sisa-sisa organisme (Barus, 2004).
Secara alami, senyawa fosfat yang terdapat pada perairan bersumber dari hasil pelapukan batuan mineral seperti Fluorapatite (Ca5-(PO4)3F), Hydroxylapatite (Ca5(PO4)3 OH) dan Whytlockite (Ca3(PO4)2) dan dari hasil dekomposisi sisa-sisa organisme di dalam air. Selain sumber alami, senyawa fosfot juga dapat bersumber dari faktor antropogenik yang antara lain berasal dari limbah rumah tangga seperti deterjen, limbah pertanian (pupuk), limbah perikanan dan limbah industri. Sawyer dan Mc.Carty (1978) menyatakan bahwa senyawa fosfor anorganik yang terdapat pada perairan berada dalam 2 (dua) bentuk, yaitu : 1) dalam bentuk ortofosfat, yang terdiri dari trinatrium fosfat (Na3PO4), dinatrium fosfat (Na2HPO4), mononatrium fosfat (NaH2HPO4) dan diamonium fosfat ((NH3)2HPO4); 2) dalam bentuk polyfosfat, yang yang terdiri dari natrium hexametafosfat (Na3(PO3)6) dan natrium tripolifosfat (Na5P3O10).
Ortofosfat merupakan bentuk senyawa fosfat yang dapat dimanfaatkan oleh tumbuhan akuatik secara langsung sebagai sumber fosfor, sedangkan polyfosfat merupakan senyawa yang tidak dapat dimanfaatkan tumbuhan secara langsung, oleh sebab itu agar senyawa polyfosfat dapat dimanfaatkan oleh tumbuhan akuatik sebagai sumber fosfor, maka senyawa polyfosfat harus terlebih dahulu mengalami hidrolisis menjadi senyawa ortofosfat.
Oleh karena senyawa orthofosfat merupakan senyawa yang sangat dibutuhkan untuk pertumbuhan tanaman termasuk fitoplankton dan alga pada perairan, maka kesuburan suatu perairan dapat ditentukan berdasarkan kandungan orthofosfatnya. Vollenweider dalam Wetzel (1975) mengklasifikasikan tingkat kesuburan suatu perairan berdasarkan tinggi rendahnya kandungan orthofosfat pada perairan tersebut (tabel 2.1).
Tabel 2.1 Klasifikasi Perairan Berdasarkan Konsentrasi PO4 No Klasifikasi Orthofosfat (PO4)
(mg/liter)
1 Oligotrofik 0,003 – 0,01
2 Mesotrofik 0,011 – 0,03
3 Eutrofik 0,031 – 0,1
(Sumber: Vollenweider dalam Wetzel, 1975).
Selain berdasarkan kandungan fosfat, tingkat kesuburan suatu perairan dapat juga diklasifikasikan berdasarkan kandungan fosfor totalnya. Yoshimura dalam Liaw (1969) mengklasifikasikan tingkat kesuburan perairan berdasarkan kandungan fosfor totalnya menjadi 3 golongan,yaitu : 1) Perairan dengan tingkat kesuburan yang rendah yaitu perairan yang kandungan fosfor totalnya berkisar 0 – 0,02 mg/l; 2) Perairan dengan tingkat kesuburan yang sedang yaitu perairan yang kandungan fosfor totalnya berkisar 0,021 – 0,05 mg/l; 3) Perairan dengan tingkat kesuburan yang tinggi yaitu perairan yang kandungan fosfor totalnya berkisar 0,051 – 0,1 mg/l.
Menurut Bruno et al (1979) dalam Sumardianto, (1995) bahwa kandungan ortofosfat yang optimal bagi pertumbuhan fitoplankton adalah 0,27 - 5,51 mg/L, dimana apabila konsentrasinya kurang dari 0,02 mg/L, maka fosfat akan menjadi faktor pembatas. Selanjutnya, Moyle (1946) dalam Ardiwijaya (2002) menyatakan bahwa perairan dengan konsentrasi fosfat yang rendah (0,00-0,02 mg/l) akan didominasi oleh fitoplankton dari kelas Bacillariophyceae (Diatom), pada konsentrasi fosfat yang sedang (0,02-0,05 mg/l) akan didominasi oleh kelas Chlorophyceae, sedangkan pada konsentrasi fosfat yang tinggi (>0,10 mg/l) akan didominasi oleh kelas Chlorophyceae.
b. Nitrogen (N)
Nitrogen merupakan salah satu unsur yang esensial dalam tubuh semua mahluk hidup, yang berperan sebagai komponen dasar penyusun molekul asam amino dan protein. Selnjutnya, protein mempunyai bermacam-macam fungsi, yang antara lain adalah sebagai penyusun enzym dan hormon.
Secara alami senyawa nitrogen di perairan berasal dari hasil metabolisme organisme air dan dari hasil proses dekomposisi bahan-bahan organik oleh bakteri. Kandungan nitrogen yang tinggi di suatu perairan dapat disebabkan oleh adanya masukan limbah seperti limbah domestik, perikanan, pertanian, peternakan dan limbah industri ke perairan tersebut. Pada perairan, senyawa nitrogen biasanya ditemukan dalam bentuk gas nitrogen (N2), nitrit (NO2-), nitrat (NO3-), amonia (NH3), dan amonium (NH4+) serta beberapa senyawa nitrogen organik kompleks (Haryadi, 2003). Biasanya pada perairan yang alami, senyawa nitrit (NO2) ditemukan dalam konsentrasi yang sangat rendah, dimana kadarnya lebih rendah dari pada senyawa nitrat (NO3-). Hal ini disebabkan karena nitrit bersifat tidak stabil, sehingga jika terdapat oksigen yang cukup akan teroksidasi menjadi senyawa nitrat. Senyawa nitrit merupakan bentuk peralihan antara ammonia dan nitrat serta antara nitrat dan gas nitrogen (N2) yang biasa dikenal dengan proses nitrifikasi dan denitrifikasi (Effendi, 2003).
Proses nitrifiksasi terjadi melalui dua tahap reaksi yaitu reaksi oksidasi amonia (NH3) menjadi nitrit (N2) dan selanjutnya reaksi oksidasi nitrit (N2) menjadi nitrat. Reaksi tersebut melibatkan bakteri-bakteri aerob seperti
Nitrosomonas dan Nitrobacter. Proses nitrifikasi dapat berlangsung optimal
apabila berada pada lingkungan dengan pH 8 dan akan berkurang secara nyata apabila pada pH < 7. Selain dipengaruhi oleh pH, proses nitrifikasi juga dipengaruhi oleh suhu perairan, dimana proses nitrifikasi dapat berlangsung dengan baik apabila pada kondisi suhu 30 – 36 °C (Jenie dan Rahayu, 1993). Hal ini disebabkan karena mikroba yang terlibat dalam proses nitrifikasi tergolong pada mikroba mesofilik. Namun, menurut Henriksen dan Kemp (1988) bahwa kisaran suhu optimal untuk berlangsungnya nitrifikasi bisa pada kisaran suhu yang lebih luas, yaitu pada kisaran 25 – 35 °C.
Proses nitrifikasi:
Nitrosomonas NH4+ + 3/2 O2 2 H+ + NO2- + H2O (Amonium) (Nitrit) Nitrobacter NO2- + ½ O2 NO3- ( Nitrit) (Nitrat)
Senyawa nitrat (NO3-) sebagai hasil oksidasi mikroba adalah senyawa yang bersifat sangat reaktif dan sangat mudah larut dalam air, sehingga dapat langsung digunakan dalam proses biologis (Hendersen-Seller, 1987). Nitrat merupakan bentuk nitrogen yang utama pada perairan alami sebagai salah satu nutrien yang penting untuk pertumbuhan algae dan tumbuhan air lainya, sehingga konsentrasi nitrat yang melimpah dapat menstimulasi pertumbuhan dan perkembangan bagi organisme perairan khususnya algae (fitoplankton) bila didukung oleh ketersediaan nutrien lainya (Alaerst dan Sartika, 1987). Selanjutnya, Mackentum (1969) menyatakan bahwa untuk pertumbuhan yang optimal fitoplankton, memerlukan kandungan nitrat perairan pada kisaran 0,9 - 3,5 mg/l.
Menurut Seller dan Markland (1987) bahwa pada konsentrasi kritis, nitrogen dan fosfor potensial menyebabkan blooming fitoplankton (algae) apabila kandungan posfor pada perairan melebihi 0,01 ppm dan kandungan nitrogen melebihi 0,3 ppm. Pertumbuhan algae yang berlimpah dapat membentuk lapisan pada permukaan air, yang menghambat penetrasi cahaya matahari untuk proses fotosintesis sehingga dipandang merugikan bagi ekosistem perairan.
Pada umumya perairan alami di daerah tropis mempunyai konsentrasi nitrogen dan posfor sangat rendah, bahkan kadang tidak terdeteksi, sehingga keberadaan senyawa fosfor dan nitrogen merupakan unsur pembatas terhadap pertumbuhan fitoplankton (eutrofikasi). Bila rasio N dan P > 12, maka yang berperan sebagai faktor pembatas adalah P. Bila rasio N dan P < 7 maka sebagai faktor pembatas adalah N, dan bila rasio N dan P berada diantara 7 sampai 12 menandakan bahwa N dan P bukanlah sebagai faktor pembatas (non-limiting factor) bagi proses eutrofikasi (Goldman dan Horne, 1983).
2.3.8 Klorofil-a Fitoplankton
Klorofil adalah zat pembawa warna hijau pada organisme autotrof, yang berperan dalam menyerap dan menggunakan energi sinar matahari untuk mensintesis karbohidrat dan oksigen dari CO2 dan H2O. Oleh karena itu, kandungan klorofil pada tumbuhan foto autotrof menjalankan peranan yang sangat penting dalam menentukan laju fotosintesis. Klorofil dapat dibedakan menjadi klorofil-a dan klorofil-b. Klorofil-a terutama efektif menyerap cahaya biru violet dan merah, sedangkan klorofil-b efektif menyerap cahaya biru dan orange, dan memantulkan cahaya kuning-hijau. Klorofil-a terdapat pada semua organisme autotrof dan berperan langsung dalam reaksi terang fotosintesis, yaitu memainkan peranan penting pada fotosistem I dan II, sedangkan klorofil-b tidak secara langsung berperan dalam reaksi terang (http : // www. Lablink. Or. Id/ Env/ Bio/ Fotosintesis. Htm. 2008).
Fitoplankton merupakan mikroalgaeyang hidup di kolom air yang masih dapat ditembus oleh cahaya. Oleh karena kemampuannya dalam melakukan proses fotosintesis yang menghasilkan bahan organik dan oksigen, maka pada suatu perairan fitoplankton berperan sebagai produsen primer yang utama. Kemampuan melakukan fotosintesis yang dimiliki disebabkan karena adanya klorofil-a sebagai pigmen fotosintetik yang selalu ada terdapat pada tubuh fitoplankton tersebut. Prezelein (1981) menyatakan bahwa klorofil-a merupakan salah satu pigmen aktif di dalam tubuh tumbuhan yang berperan penting untuk berlangsungnya proses fotosintesis di perairan, dan oleh karena itu maka kandungan klorofil-a merupakan salah satu parameter yang sangat menentukan tinggi rendahnya produktivitas primer suatu perairan. Kandungan klorofil-a pada suatu perairan dapat digunakan sebagai ukuran kwantitas total (standing stock) fitoplankton, yaitu ukuran banyaknya fitoplankton pada saat dan volume air tertentu. Bila kandungan klorofil-a fitoplankton yang terdapat pada suatu perairan dilengkapi dengan data cahaya, maka kandungan klorofil-a dapat digunakan untuk menghitung besarnya produktivitas primer dan sebagai indikasi tingkat kesuburan suatu perairan (Arsjad, at all., 2004). Selain itu, konsentrasi klorofil-a perairan juga dapat digonakan untuk menggambarkan keadaan tinggi rendahnya biomassa
algae yang terdapat pada suatu perairan. Menteri Negara Lingkungan Hidup (2009) menyatakankan bahwa rata-rata berat klorofil-a fitoplankton adalah setara dengan 1 % dari biomassa algae, sehingga konsentrasi klorofil-a merupakan salah satu parameter air yang dapat digunakan dalam penentuan tingkat kesuburan suatu perairan.
Hatta (2002) menyatakan bahwa konsentrasi klorofil-a di permukaan perairan dapat dikelompokan menjadi tiga kategori, yaitu : Konsentrasi klorofil-a rendah (< 0,07 mg/m3); sedang (0,07 - 0,14 mg/m3); dan tinggi (> 0,14 mg/m3).
Tabel 2.2. Status Trofik Perairan Berdasarkan Konsentrasi Klorofil-a Status Trofik Klorofil-a (μg/l)
Oligotrofik < 2
Mesotrofik < 5
Eutrofik < 15
Hipermetrofik = 200
(Sumber:Peraturan Menteri Negara Lingkungan Hidup No 28 Thn 2009).
2.4 Eutrofikasi
Eutrofikasi adalah pengayaan (enrichment) perairan oleh nutrien terutama nitrogen (N) dan fosfor (P) yang berupa bahan anorganik dan sangat dibutuhkan oleh tumbuhan air dan dapat mengakibatkan terjadinya peningkatan produktifitas primer perairan (Mason, 1993). Biasanya, eutrofikasi dipandang sebagai kondisi yang tidak diinginkan dan membahayakan karena pengaruhnya yang dapat mengganggu pemanfaatan badan air tersebut untuk kepentingan manusia. Selain itu, dampak ekologis dari eutrofikasi adalah terjadinya perubahan fisika dan kimia air yang diikuti dengan perubahan keseimbangan kehidupan antara organisme produser dan konsumer dalam air.
Mason (1996) menyatakan bahwa eutrofikasi perairan dapat secara langsung berdampak dan mempengaruhi aktifitas manusia dalam beberapa hal, yang antara lain adalah: 1) berpengaruh terhadap penyediaan air bersih; 2) berpengaruh terhadap estetik/keindahan dan rekreasi; 3) berpengaruh terhadap pengelolaan danau dan aliran air.
Sesungguhnya eutrofikasi adalah sebuah proses alamiah yang terjadi dengan perlahan-lahan dan memakan waktu yang berabad-abad bahkan ribuan tahun lamanya, dimana badan air yang relatif tergenang seperti danau dan pantai tertutup mengalami perubahan produktifitas secara bertahap. Namun demikian, sejalan dengan terus meningkatnya populasi manusia yang diikuti dengan peningkatan aktifitas maka jumlah limbah organik yang dihasilkan masuk ke badan air juga semakin meningkat, sehingga memberikan kontribusi terhadap laju penambahan unsur hara badan air. Sebagai akibatnya, eutrofikasi dapat terjadi jauh lebih cepat lagi dari waktu yang seharusnya (Goldman dan Horne,1983).
Eutrofikasi dapat diklasifikasikan menjadi 2 kelompok, yaitu : Artificial
/cultural eutrophication dan natural eutrophication. Artificial eutrophication
terjadi karena adanya pengaruh aktivitas manusia, sedangkan natural eutrophication disebabkan karena peristiwa alam (bukan aktifitas manusia) (Effendi, 2003). Bertambahnya jumlah dan aktifitas penduduk disekitar perairan danau, dapat mengganggu keseimbangan lingkungan perairan, karena akan memberikan kontribusi pada laju penambahan unsur hara dan limbah organik lainnya yang masuk ke badan air. Jumlah unsur hara yang masuk ke badan perairan biasanya lebih besar dari pemanfaatan unsur hara tersebut oleh biota perairan, sehingga akan terjadi penyuburan yang berlebihan (Ahl, 1980).
Gejala eutrofikasi di perairan danau biasanya dapat ditandai dengan adanya perubahan parameter kimia, fisika dan biologi air, seperti melimpahnya konsentrasi unsur hara, menurunya konsentrasi oksigen terlarut (DO), menurunya penetrasi cahaya, peningkatan kandungan klorofil-a, produktivitas primer serta kelimpahan dan dominasi fitoplankton.
Henderson-Seller and Markland, (1987) menyatakan bahwa untuk mendeteksi terjadinya eutrofikasi pada suatu perairan danau, ada enam indikator utama yang dapat dipakai yaitu : 1) menurunnya konsentrasi oksigen terlarut; 2) meningkatnya konsentrasi unsur hara; 3) menigkatnya padatan tersuspensi, terutama bahan organik; 4) bergantinya populasi fitoplankton yang dominan dari kelompok diatome menjadi chlorophyceae; 5) meningkatnya konsentrasi fosfat, dan 6) menurunnya penetrasi cahaya (meningkatnya kekeruhan).
2.5 Budidaya Ikan Sistim Keramba Jaring Apung (KJA)
Kegiatan keramba jaring apung (KJA) merupakan salah satu bentuk kegiatan perikanan akuakultur yang dilakukan pada wadah jaring yang terapung. Dirjen Perikanan (2001) mendefinisikan keramba jaring apung sebagai tempat pemeliharaan ikan yang terbuat dari bahan jaring yang memungkinkan keluar masuknya air dengan leluasa, sehingga terjadi pertukaran ke perairan sekitarnya. Komponen-komponen keramba jaring apung terdiri dari kerangka atau bingkai, pelampung, jangkar, pemberat jaring, penutup kantung jaring, bangunan fisik dan peralatan pendukung lainnya.
Budidaya ikan sistim KJA merupakan kegiatan budidaya ikan yang dapat dikembangkan secara intensif denga kepadatan (densitas) ikan budidaya yang cukup tinggi. Karena kepadatan tebar ikan yang dibudidayakan pada KJA cukup tinggi, sehingga tidak dapat lagi hanya dengan mengandalkan sumber makanan dari yang tersedia secara akami di perairan, melainkan harus didatangkan dari luar sebagai pakan tambahan. Pada umumnya pakan tambahan yang di berikan adalah pakan buatan yang disebut dengan pelet.
Secara ekonomi usaha budidaya ikan dengan sistim keramba jaring apung mempunyai beberapa keunggulan, yang antara lain adalah: 1) menambah efisiensi penggunaan sumberdaya; 2) dapat meningkatkan produksi ikan; 3) memberikan pendapatan yang lebih teratur dibandingkan dengan hanya bergantung pada usaha penangkapan. Namun demikian, bila pengelolaan budidaya ikan keramba jaring apung (KJA) yang dilakukan dalam jumlah yang berlebihan dan teknologi yang tidak memperhatikan daya dukung lingkungan perairan akan dapat memberikan dampak yang serius terhadap lingkungan perairan tersebut, baik lingkungan biotik maupun lingkungan abiotiknya.
Menurut Beveridge (1984) kegiatan keramba jaring apung berdampak terhadap 4 (empat) hal utama yaitu (1) membutuhkan banyak tempat (space) atau permukaan perairan danau, (2) menghambat aliran air dan arus untuk transportasi oksigen, sedimen, plankton serta larva ikan, (3) menurunkan kualitas estetika perairan danau dan (4) menurunkan kualitas lingkungan hidup danau. Selanjutnya Beveridge (1984) menyatakan bahwa kegiatan budidaya ikan keramba jaring
apung berpengaruh sencara nyata terhadap lingkungan perairan, yaitu mulai dari adanya perubahan hara air, perubahan konsentrasi oksigen terlarut (DO), perubahan konsentrasi metabolik toksik serta berkembangnya organisme-organisme penyebab penyakit, sehingga perairan tersebut menjadi tidak layak lagi untuk dimanfaatkan sebagai sumber air minum, sarana rekreasi dan peruntukan perikanan itu sendiri.
2.6 Limbah KJA
Secara umum limbah yang berasal dari kegiatan budidaya ikan KJA adalah limbah organik yang berasal dari sisa-sisa pakan yang tidak terkonsumsi oleh ikan budidaya dan buangan dari sisa metabolisme ikan berupa faeces dan urine Banyaknya pakan yang tidak tidak terkonsumsi dan feses yang dihasilkan oleh ikan budidaya KJA tergantung pada beberapa faktor yang antara lain adalah jenis pakan, kepadatan ikan disetiap keramba, kesehatan ikan yang dipelihara, frekuensi pemberian pakan, metode pemberian pakan dan rasio konversi makanan. Mc Donald et al, (1996); Boyd (1999) menyatakan bahwa dari sejumlah pakan yang diberikan kepada ikan budidaya akan tertinggal sebagai sisa pakan yang tidak terkonsumsi lebih kurang 30 %. Selanjutnya, dari sejumlah pakan yang dikonsumsi oleh ikan akan diekskresikan kembali ke badan air sebagai faeses sekitar 25– 30 %. Hal ini berarti bahwa limbah organik dari pakan ikan KJA yang terbuang ke badan air secara kontiniu jumlahnya cukup besar.
Limbah organik dari kegiatan KJA yang masuk ke dalam perairan dapat berbentuk padatan, koloid, tersuspensi atau terlarut. Pada umumnya, limbah organik dalam bentuk padatan akan mengendap ke dasar perairan, sedangkan bentuk lainnya (koloid, tersuspensi) akan tetap berada di badan air. Jika laju pengendapan partikel limbah jauh lebih besar dari kecepatan arus air, maka partikel-partikel bahan organik akan mengendap ke dasar perairan di sekitar lokasi KJA tersebut berada (Barg, 1992). Philips et al, (1985) dalam Beveridge (1996) menyatakan bahwa limbah organik dalam bentuk padat akan jatuh ke dasar danau dan akhirnya membentuk sedimen. Selama proses sedimentasi, sebahagian limbah organik akan dikonsumsi oleh biota lain seperti ikan-ikan liar, dan
sebahagian lagi akan pecah menjadi partikel-partikel yang lebih halus. Jika limbah organik tidak dimakan oleh fauna perairan lain, seperti ikan, kepiting, bentos dan lainnya, maka limbah organik akan mengalami dekomposisi oleh mikroba, baik mikroba aerobik (mikroba yang hidupnya memerlukan oksigen), mikroba anaerobik (mikroba yang hudupnya tidak memerlukan oksigen) dan mikroba fakultatif (mikroba yang dapat hidup aerobik dan anaerobik) (Garno.2004).
2.7 Dekomposisi Limbah Organik 2.7.1 Dekomposisi di Badan air Aerob.
Limbah-limbah organik yang berada pada badan air aerob akan dimanfaatkan dan diuraikan (dekomposisi) oleh mikroba-mikroba aerobicdengan proses sebagai berikut:
Bakteri aerobic
Bahan Organik + O2 CO2 + NH3 + produk lain + E ( COHNS ) (Amoniak)
Bakteri aerobic
(COHNS) + O2 + E C5H7O2N (sel baru) (Garno, 2002)
Dari kedua reaksi tersebut, dapat dijelaskan bahwa semakin banyak limbah organik yang masuk dan tinggal di lapisan aerobik suatu perairan, akan semakin besar pula oksigen yang dibutuhkan oleh mikroba aerob untuk dapat mendekomposisikanya, sehingga berakibat terhadap penurunan konsentrasi oksigen terlarut (DO) badan air. Bahkan jika kebutuhan oksigen bagi mikroba aerob melebihi konsentrasi oksigen terlarut di dalam air, maka konsentrasi oksigen terlarut bisa menjadi nol (anoksid)
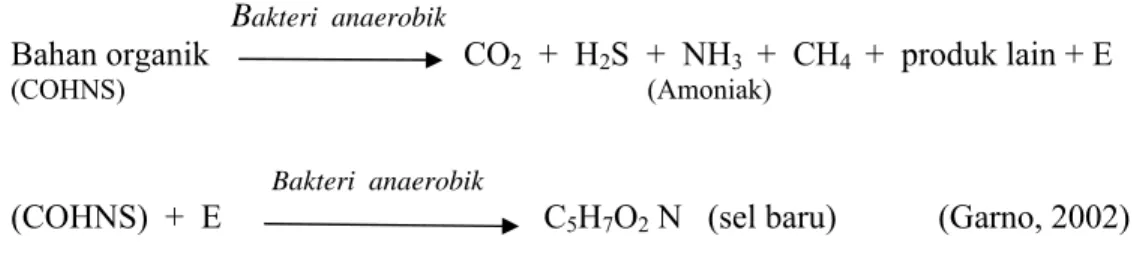
2.7.2 Dekomposisi di Badan Air Anaerob
Limbah organik yang masuk ke badan air yang anaerob akan dimanfaatkan dan diuraikan (dekomposisi) oleh mikroba anaerobik atau fakultatif, dengan proses sebagai berikut:
Bakteri anaerobik
Bahan organik CO2 + H2S + NH3 + CH4 + produk lain + E (COHNS) (Amoniak)
Bakteri anaerobik
(COHNS) + E C5H7O2 N (sel baru) (Garno, 2002)
Dari kedua reaksi tersebut diatas dapat dijelaskan bahwa dekomposisi bahan organik pada badan air yang anaerob akan menghasilkan sejumlah sel-sel mikroba baru, selain menghasilkan senyawa-senyawa CO2, NH3, H2S, dan CH4. Asam sulfide (H2S) adalah senyawa yang mengeluarkan bau busuk dan menyengat, sedangkan amin (CH4) merupakan senyawa yang berbau anyir.
Dekomposisi senyawa organik di badan air yang aerob maupun anaerob akan menghasilkan NH3 dan CO2, dimana selanjutnya NH3 akan mengalami proses nitrifikasi sehingga menghasilkan senyawa nitrat (NO3). Senyawa nitrat merupakan suatu senyawa yang sangat dibutuhkan dan dimanfaatkan oleh organisme perairan berklorofil (fitoplankton) sebagai makananya.
Tabel 2.3 Perbandingan Hasil Oksidasi Senyawa Organik pada Kondisi Aerob dan Anaerob
Kondisi Aerobik Kondisi Anaerobik C CO2 C CH4
N NH3 , HNO3 N NH3 , Amin P H3PO4 P PO3
S H2SO4 S H2S Sumber : Fardiaz (1992)
2.8 Dampak Dekomposisi Limbah KJA
Proses dekomposisi limbah organik dalam jumlah yang berlebihan di badan air, baik di badan air aerob maupun di badan air anaerob cenderung selalu bersifat merugikan karena sebagian besar produknya (NH3 , H2S dan CH4) dapat mengganggu kehidupan fauna perairan, sedangkan produk yang sebagai nutrien meskipun sampai pada konsentrasi tertentu menguntungkan namun jika nutrien terus bertambah, akan berakibat terhadap pertumbuhan fitoplankton yang sangat pesat (blooming) dan menurunkan kualitas perairan (Garno, 2002).
2.8.1 Dampak Langsung.
Sebagai dampak langsung dari proses dekomposisi limbah organik di badan air aerobik akan berakibat terhadap penurunan oksigen terlarut (DO). Karena oksigen terlarut sangat dibutuhkan untuk proses pernafasan organisme akuatik, maka penurunan nilai DO akan membahayakan bagi fauna-fauna air yang hidup didamnya. Bila jumlah limbah organik yang masuk ke badan air terjadi secara kontiniu dan dalam jumlah yang terus bertambah, mikroba air akan memanfaatkan oksigen dalam jumlah yang lebih besar lagi untuk dapat mendekomposisi bahan organik tersebut. Oksigen tersebut diserap dari oksigen yang terlarut pada badan air, sehingga sebagai akibatnya badan air akan mengalami deplesi oksigen, bahkan badan air yang tadinya bersifat aerob akan berubah menjadi badan air yang bersifat anaerob (Polprasert, 1989).
2.8.2 Dampak Tidak Langsung
Selain berdampak secara langsung terhadap perairan, proses dekomposisi pada perairan juga akan berdampak secara tidak langsung terhadap perairan itu sendiri. Dampak tersebut antara lain disebabkan karena proses dekomposisi akan menghasilkan senyawa-senyawa nutrien terutama senyawa nitrat dan fosfat ke badan air. Nutrien merupakan senyawa kimia yang sangat dibutuhkan oleh alga (fitoplankton) dan tumbuhan air lainya untuk dapat hidup dan bertumbuh dengan baik (Margalef, 1958), sehingga meningkatnya konsentrasi nutrien pada badan air akan di ikuti oleh meningkatnya biomassa fitoplankton pada badan air. Sesungguhnya peningkatan konsentrasi nutrien pada badan air apabila masih pada batas tingkat konsentrasi tertentu, adalah penting dalam meningkatkan produktivitas perairan danau (Garno, 1995). Akan tetapi apabila peningkatan konsentrasi nutrien terjadi dengan terus menerus, apalagi dalam jumlah yang cukup besar akan dapat menyebabkan badan air menjadi sangat subur atau eutrofik (Henderson, at all. 1987) dan akan memacu pertumbuhan bagi berbagai tumbuhan air dengan pesat (blooming), seperti fitoplankton dan eceng gondok (Eichornia crassipes).