EKSPRESI pCambia 1303
DWI NOVIANTHY
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
KONSTRUKSI GEN
KITINASE
UNTUK KETAHANAN
TERHADAP
GANODERMA
PADA VEKTOR
EKSPRESI pCambia 1303
DWI NOVIANTHY
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
DWI NOVIANTHY. Konstruksi Gen
Kitinase
untuk Ketahanan terhadap
Ganoderma
pada Vektor Ekspresi pCambia 1303. Dibimbing oleh MARIA
BINTANG dan TETTY CHAIDAMSARI.
Usaha peningkatan produksi perkebunan kelapa sawit tidak terlepas dari
masalah hama dan penyakit, yang antara lain disebabkan oleh cendawan patogen
Ganoderma
spp. Pendekatan baru untuk memperoleh kelapa sawit transgenik
adalah dengan menyisipkan gen penghasil zat yang berfungsi sebagai anti jamur.
Salah satunya adalah gen
kitinase
yang berasal dari
Trichoderma
. Tujuan dari
penelitian adalah konstruksi gen
kitinase
pada vektor ekspresi pCambia 1303
diantara promotor 35S
Cauliflower Mosaic Virus
(CaMV) dan promotor spesifik
akar. Gen
kitinase
diklon terlebih dahulu ke dalam vektor ekspresi pCambia 1303,
kemudian ditransformasi ke
Escherichia coli
XL-1
Blue
selanjutnya ditransfer ke
dalam
Agrobacterium tumefaciens
. Hasil penelitian menunjukkan bahwa gen
kitinase
berhasil disisipkan ke dalam pCambia 1303. Restriksi DNA rekombinan
dengan enzim restriksi
NcoI
dan
SpeI
menghasilkan 2 pita, yaitu 12000 bp adalah
pCambia 1303 dan 1500 bp adalah gen
kitinase
. Transformasi DNA rekombinan
ke dalam
Agrobacterium tumefaciens
telah berhasil dilakukan dengan
menggunakan sel kompeten strain AGLO. Keberhasilan transformasi diuji
melalui restriksi plasmid yang diisolasi dari sel transforman menggunakan enzim
restriksi
NcoI
dan
SpeI
.
ii
ABSTRACT
DWI NOVIANTHY. Construction of
Chitinase
Gene for Resistant to Ganoderma
on Expression Vector pCambia 1303. Under the direction of MARIA BINTANG
and TETTY CHAIDAMSARI.
Efforts to increase palm oil production face problems associated with pest
and diseases caused by pathogenic fungus such as
Ganoderma
spp. A new
approach to obtain palm oil transgenic is by inserting a gene encoding antifungi
compound. One of genes is
chitinase
gene derived from
Trichoderma
. The
research targets are to insert
chitinase
gene into expression vector pCambia 1303
between the 35S
Cauliflower Mosaic Virus
(CaMV) promoter and the root
specific promoter. The
Chitinase
gene was cloned into pCAMBIA 1303
expression vector followed by transformation of recombinant plasmid into
Escherichia coli
XL-1
Blue
and transferred into
Agrobacterium tumefaciens
.
Results showed that the
chitinase
gene was successfully inserted into pCambia
1303. Restriction of the recombinant DNA using restriction enzymes
Nco
1 and
Spe
1 resulted in two bands of 1200 bp which is pCambia 1303 and of 1500 bp
which is the
chi
gene. The recombinant DNA was successfully transformed into
Agrobacterium tumefaciens
using competent cell of AGLO strain. The success of
transformation was analyzed by restricting recombinant DNA isolated from
transformant colonies using
NcoI
and
SpeI
restriction enzymes.
KONSTRUKSI GEN
KITINASE
UNTUK KETAHANAN
TERHADAP
GANODERMA
PADA VEKTOR
EKSPRESI pCambia 1303
DWI NOVIANTHY
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
4
Judul Skripsi : Konstruksi Gen
Kitinase
untuk Ketahanan terhadap
Ganoderma
pada Vektor Ekspresi pCambia 1303
Nama
:
Dwi
Novianthy
NIM
:
G84051121
Disetujui
Komisi Pembimbing
Prof. Dr. drh Maria Bintang, MS
Dr. Tetty Chaidamsari, M.Si
Ketua
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kepada Allah SWT atas
segala karuniaNya, shalawat dan salam semoga selalu tercurah kepada Nabi
Muhammad SAW, keluarga, sahabat, dan para pengikutnya sampai akhir zaman
sehingga penulis dapat menyelesaikan penelitian ini. Penelitian ini berjudul
Konstruksi Gen
Kitinase
untuk Ketahanan terhadap
Ganoderma
pada Vektor
Ekspresi pCambia 1303. Kegiatan penelitian ini dilakukan dari bulan Februari
hingga Juli 2009, bertempat di Laboratorium Balai Penelitian Bioteknologi
Perkebunan Indonesia, Jalan Taman Kencana, Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
membantu dalam penyelesaian penelitian ini, antara lain kepada Prof. Dr. drh
Maria Bintang, MS selaku pembimbing utama dan Dr. Tetty Chaidamsari, M.Si
selaku pembimbing lapangan yang telah memberikan saran, kritik, dan
bimbingannya serta Mba Herti dan Mba Nina di Laboratorium Biologi Molekuler
dan Rekayasa Genetika, Balai Penelitian Bioteknologi Perkebunan Indonesia atas
peran dan kerjasamanya yang telah banyak membantu dalam menyelesaikan
penelitian ini.
Ucapan terima kasih juga penulis sampaikan kepada orang tua, kakak dan
adik penulis untuk semua doa, dukungan dan bimbingan yang sangat berarti bagi
penulis. Serta kepada rekan selama penelitian Yoanita, Embi, Ratna atas saran dan
motivasi yang diberikan. Penulis berharap semoga penelitian ini dapat
memberikan manfaat bagi semua orang yang membacanya.
Bogor, Oktober 2009
6
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 5 Januari 1987 dari Ayah
Sutarno Wiryomikarto dan Ibu Atikah Azhari. Penulis merupakan anak kedua dari
tiga bersaudara.
Tahun 2005 penulis lulus dari SMUN 62 Jakarta dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
(USMI). Penulis memilih mayor Departemen Biokimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam dengan minor Departemen Ilmu Gizi dan Kesehatan
Masyarakat.
Selama mengikuti perkuliahan penulis aktif dalam kegiatan-kegiatan
organisasi kemahasiswaan selama beberapa periode (CREBs periode 2007/2008).
Penulis juga aktif mengikuti beberapa acara kepanitiaan di IPB seperti masa
pengenalan departemen Biokimia 2007/2008 dan 2008/2009. Penulis melakukan
Praktik Lapang di Laboratorium Pusat Riset Obat dan Makanan, Badan Pengawas
Obat dan Makanan (BPOM), Jalan Percetakan Negara No.23, Jakarta Pusat
dengan judul Uji Antioksidan Metode DPPH (2,2-difenil-1-pikrilhidrazil)
terhadap 15 Tanaman Obat.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xi
PENDAHULUAN ... 1
TINJAUAN PUSTAKA... 1
Kelapa Sawit ... 1
Gen
Kitinase
sebagai Gen Ketahanan terhadap Penyakit
Busuk Akar ... 2
Plasmid pCambia 1303 ... 2
Pengklonan... 3
Polymerase Chain Reaction
(PCR) ... 4
Agrobacterium tumefaciens
... 4
BAHAN DAN METODE ... 4
Bahan dan Alat ... 4
Metode Penelitian ...
5
HASIL DAN PEMBAHASAN ... 8
Pemurnian Gen
Kitinase
Produk PCR ... 8
Cloning
Gen
Kitinase
Hasil PCR pada pGEMT-
Easy
... 8
Transformasi Gen
Kitinase
ke
Escherichia coli
(XL-1
Blue
)... 8
Konfirmasi Koloni Transforman yang Membawa Fragmen Sisipan ... 9
Restriksi Gen
Kitinase
dan pCambia 1303 dengan Enzim Restriksi ... 10
Ligasi Gen
Kitinase
dengan pCambia 1303 ... 12
Isolasi DNA Plasmid Rekombinan ... 12
Transformasi Menggunakan Sel Kompeten Kimia ke
Agrobacterium
tumefaciens
Strain AGLO... 14
SIMPULAN DAN SARAN ... 15
DAFTAR PUSTAKA ... 15
8
DAFTAR GAMBAR
Halaman
1 Tanaman kelapa sawit ... 2
2 Tanaman muda kelapa sawit yang terserang
Ganoderma
... 2
3 Pemurnian PCR produk gen
kitinase
... 8
4 Vektor klon pGEMT-
Easy
dan peta restriksi yang dimiliki ... 8
5 Contoh duplikat dari koloni hasil transformasi ... 9
6 Hasil PCR koloni
kitinase
14... 9
7 Hasil analisis BLASTX fragmen gen
kitinase
...
10
8 Hasil elektroforesis restriksi pCambia 1303 dengan enzim
NcoI
dan
SpeI
. 10
9 Hasil pemurnian plasmid pCambia 1303 ... 11
10 Hasil elektroforesis restriksi gen
kitinase
dari pGEMT-
Easy
. ... 11
11 Peta restriksi pCambia 1303 dengan enzim restriksi ... 12
12 Skema ligasi gen
kitinase
dengan plasmid pCambia 1303... 12
13 Contoh transformasi koloni gen
kitinase
dengan pCambia ke dalam sel
kompeten (XL1-
Blue
) ... 12
14 Hasil elektroforesis isolasi DNA plasmid gen
kitinase
dengan pCambia
1303 ... 13
15 Hasil pemotongan plasmid pCambia 1303-gen
kitinase
dengan
NcoI
dan
SpeI
.. ... 13
16 Contoh duplikat koloni hasil transformasi pCambia 1303 yang
mengandung gen
kitinase
melalui
Agrobacterium
... 14
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 18
2 Prosedur elektroforesis gel agarosa... 19
3 Komposisi larutan sediaan ... 20
4 Prosedur kerja transformasi plasmid ke dalam sel kompeten...
22
5 Elektroforegraf urutan basa gen
kitinase
... .
23
6 Hasil analisis BLASTX fragmen gen
kitinase
... .
24
PENDAHULUAN
Usaha peningkatan produksi perkebunan kelapa sawit secara rutin tidak terlepas dari masalah hama dan penyakit yang antara lain disebabkan oleh cendawan patogen Ganoderma spp. Cendawan ini menyebabkan busuk pangkal batang yang merupakan penyakit pada tanaman kelapa sawit yang penting dan sulit untuk ditanggulangi (Santoso et al. 2001). Penyakit ini menyerang sistem perakaran dan gejala penyakit yang ditimbulkannya hanya terlihat pada akhir infeksi sehingga tanaman yang sakit tidak mungkin lagi dapat diselamatkan. Kerugian serius terjadi pada generasi tanaman lanjut seperti pada generasi tanaman ketiga, yang kematian dari tanaman tersebut akibat serangan penyakit ini dapat mencapai 60% (Singh 1991).
Pendekatan yang umum dilakukan dalam pengendalian penyakit tersebut adalah dengan cara mekanis, kimia, atau hayati. Cara mekanis dilakukan dengan membersihkan sumber infeksi sebelum tanam dan menghindari perlukaan pada batang atau akar, namun ternyata pendekatan ini dianggap kurang ekonomis karena masih banyak generasi tanaman baru yang terkena infeksi Ganoderma spp. Pendekatan kimia menggunakan fungisida diantaranya fungisida Tridemorph atau Triadimenol 50 ppm dan Bayfidan 10 ppm dapat membunuh miselium Ganoderma in vitro. Pemberian fungisida pada kelapa sawit ternyata sulit dilakukan, karena areal kelapa sawit yang luas dan menimbulkan dampak negatif terhadap lingkungan. Cara hayati menggunakan biofungisida Trichoderma dan Tenicilium yang dilaporkan dapat menghambat pertumbuhan hifa Ganoderma spp (Lubis 1992). Tetapi cara biologis ini penerapannya pada perkebunan kelapa sawit masih kurang populer karena daya bunuh biofungisida relatif lebih lama.
Adapun pengendalian penyakit ini adalah melalui program pemuliaan tanaman dengan menemukan gen-gen yang tahan terhadap Ganoderma spp baik yang berasal dari dalam atau antarspesies, namun hingga saat ini tanaman yang dimaksud belum pernah ada. Untuk memecahkan persoalan dalam rangka mendapatkan bahan tanaman kelapa sawit yang tahan Ganoderma diperlukan pendekatan baru. Salah satu upaya yang dapat dilakukan adalah dengan membuat tanaman transgenik kelapa sawit tahan Ganoderma spp.
Kendala yang dihadapi dalam upaya penanggulangan penyakit tersebut adalah siklus pemuliaan kelapa sawit memerlukan waktu yang cukup lama (10-13 tahun) dan sumber gen yang resisten terhadap Ganoderma tidak tersedia diantara plasma nutfah kelapa sawit. Oleh karena itu, salah satu strategi untuk mendapatkan tanaman kelapa sawit tahanGanoderma adalah dengan jalan menyisipkan gen-gen (transgenik) yang menghasilkan zat-zat yang berfungsi sebagai anti jamur, seperti enzim kitinase maupun glukanase yang dapat melisis dinding sel hifa jamur patogen. Dalam rekayasa genetik tanaman kelapa sawit, gen-gen yang akan disisipkan diharapkan dapat diekspresikan secara terus-menerus sepanjang hidup tanaman kelapa sawit terutama pada bagian perakaran, untuk itu pemilihan promotor yang bersifat konstitutif dan cocok untuk kelapa sawit berperan penting dalam pengendalian Ganodermaspp.
Upaya untuk mendapatkan gen penghasil zat anti jamur dititikberatkan pada sumber yaitu yang berasal dari jamur Trichoderma khususnya untuk mengisolasi genkitinase dan glukanase. JamurTrichoderma telah terbukti memiliki agen pengendali biologis terhadap jamur patogen tanaman dengan melisis dinding sel jamur patogen tanaman dengan enzim yang dihasilkannya terutama kitinase dan glukanase (Schirmbocket al. 1994; Lorito et al. 1996).
Tujuan utama dari penelitian adalah konstruksi gen kitinase pada vektor ekspresi pCambia 1303 diantara promotor 35S Cauliflower Mosaic Virus (CaMV) dan promotor spesifik akar. Hasil dari penelitian ini berupa fragmen gen kitinase dalam pCambia 1303 yang akan digunakan ke tahap selanjutnya melalui Agrobacterium tumefaciens untuk ditransformasikan pada eksplan tanaman kelapa sawit.
TINJAUAN PUSTAKA
Kelapa SawitKelapa sawit (Elaeis guineensis, Jacq) berasal dari Afrika. Tanaman ini dikenal di Indonesia sejak tahun 1848, namun baru ditanam secara komersial pada tahun 1911. Elaeis berasal dari kata Elaion (bahasa Yunani) yang berarti minyak sedangkan guineensis berasal dari Guinea yaitu nama pantai barat Afrika yaitu Jacquis (Lubis 1992). Pada umumnya perkebunan kelapa sawit sering dihadapi masalah hama maupun
penyakit (Lubis 1992). Terdapat berbagai cara untuk mengklasifikasikan hama dan penyakit pada tanaman kelapa sawit. Berdasarkan bagian tanaman yang diserang dikenal dengan hama perusak (pemakan) daun, perusak bunga dan buah, perusak akar dan batang. Apabila ditinjau dari jenis hama yang menyerang maka dapat dibedakan hama serangga, mamalia, nematoda dan lain-lain. Teknis pencegahan dan pemberantasannya dikenal dengan cara manual, kimia dan biologis. Menurut Lubis (1992), penyebab penyakit busuk pangkal batang atau akar pada kelapa sawit adalah cendawanGanoderma spp, yang sampai sekarang ini penyakit tersebut belum dapat dikendalikan dengan baik. Gejala awal dimulai dari pelepah daun berwarna pucat seperti kekurangan hara tetapi terbatas hanya pada beberapa pelepah yang terdapat di pucuk. Selanjutnya daun mengalami nekrosis dimulai dari daun tua kemudian ke daun yang lebih muda. Pelepah daun akan patah dan menggantung. Daun pupus (pelepah muda) tidak membuka dan terkumpul lebih banyak dari biasa. Umumnya 6-12 bulan setelah gejala terakhir tanaman akan mati. Infeksi yang terjadi disebabkan karena kontak akar yang sakit.
Gambar 1 Tanaman kelapa sawit.
Gambar 2 Tanaman muda kelapa sawit yang terserangGanoderma.
GenKitinase sebagai Gen Ketahanan terhadap Penyakit Busuk Akar Gen dapat didefinisikan sebagai bagian genom yang berperan dalam proses ekspresi
gen. Peranan tersebut yaitu sebagai ruas model atau ruas penyandi dalam proses transkipsi. Dari keseluruhan genom organisme tidak seluruhnya menjadi ruas penyandi, hanya bagian yang diapit oleh promotor dan terminator. Daerah promotor merupakan tempat dimulainya perpanjangan asam ribonukleat (RNA). Sedangkan sisi terminator berfungsi sebagai tempat titik akhir dari proses perpanjangan RNA (akhir transkipsi) (Jusuf 2001).
Kitinase adalah enzim yang mempunyai kemampuan mendegradasi kitin, sebagai komponen utama dinding sel jamur (Dattaet al. 2000). Selain memiliki kemampuan menempel pada dinding sel jamur secara langsung, kitinase juga melepaskan oligo-N-asetil-glukosamin yang berfungsi sebagai elisitor, yang telah terbukti berperan penting dalam mengaktifkan respon ketahanan (Ren & West 1992). Beberapa publikasi hasil penelitian melaporkan bahwa tanaman yang mengekspresikan gen kitinase terbukti mempunyai ketahanan terhadap berbagai cendawan tertentu, seperti tanaman tembakau yang tahan terhadap cendawan Rhizoctonia solani (Jach et al. 1992) dan Sclerotinia sclerotiorum(Terekawaet al. 1997), tanaman mentimun yang tahan terhadap serangan Botrytis cinerea (Tabei et al. 1998) dan tanaman padi yang tahan terhadapRhizoctonia solani(Linet al.1995; Dattaet al. 2000). Protein kitinase diduga dapat digunakan sebagai perlindungan terhadap jamur patogen. Dugaan ini didukung pada pengamatan tumbuhan tingkat tinggi yang tidak mempunyai kitinase, namun setelah diberi kitinase tumbuhan tersebut menunjukkan adanya aktivitas anti jamur secara in vitro. Aktivitas kitinase akan meningkat setelah tanaman terinfeksi bakteri dan virus patogen atau dengan induksi dengan etilen, sinar UV atau asam salisilat (Linet al. 1995).
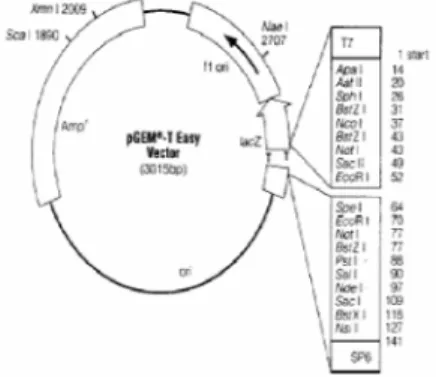
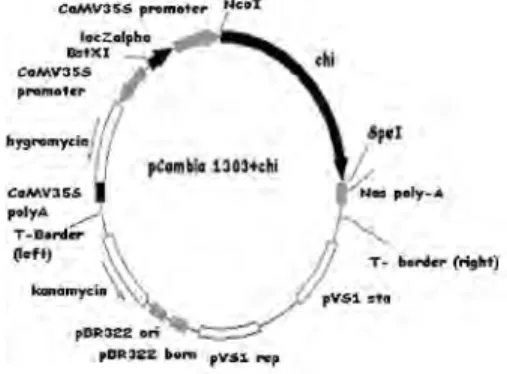
Plasmid pCambia 1303
DNA vektor adalah molekul DNA yang diperlukan untuk membawa dan memperbanyak fragmen DNA yang dibawanya. DNA yang sering digunakan adalah plasmid bakteri. Sedangkan plasmid adalah bahan genetik ekstra kromosom yang diwariskan secara tetap. Ciri-ciri plasmid antara lain berukuran kecil dan hanya mengandung beberapa gen, membawa informasi genetika, terlepas dari DNA kromosom atau kadang-kadang dapat berintegrasi dengan DNA kromosom serta dapat diisolasi dengan mudah dari sel bakteri.
3
Ciri lain plasmid adalah mempuyai situs untuk memulai replikasi yang disebut ORI (Origin of Replication) (Jusuf 2001). Selain itu menurut Sambrook & Russel (2001), plasmid yang sering digunakan sebagai vektor haruslah berukuran kecil.
Plasmid pCambia dikonstruksi sebagai vektor DNA dalam metode transformasi langsung dan menggunakan Agrobacterium. Plasmid pCambia mempunyai rentang yang luas sehingga bersifat stabil jika ditransformasikan baik ke tanaman dikotil maupun pada tanaman monokotil. Vektor ini didasarkan pada pCambia 1301 yang memiliki mgfp5 versiAequoria victoria hijau. pCambia 1302 di fusi dengan gusA (N358Q) dan pCambia 1303 memiliki gusA, mgfp5, His6 fusion sedangkan pCambia 1304 memiliki mgfp5, gusA, His6 fusion. Plasmid pCambia 1301 dapat diuji dengan seleksi biru putih karena membawa genLac Z’ penyandi enzim -galaktosidase. Gen Lac Z’ ini akan berwarna biru jika ditambah dengan isopropil– –D-thiogalaktopiranosida (IPTG) dan 5 – bromo –4–kloro– 3 – indiol – – galaktopiranosida (X-Gal). Gen yang tidak berekspresi ini mengakibatkan koloni menjadi berwarna putih (Sambrook & Russel 2001). Plasmid pCambia 1303 mengandung promotor CaMV35S (Cauliflower Mosaic Virus). Promotor ini berhubungan dengan urutan yang terpoliadenilasi pada T-DNA plasmid. Hal ini memungkinkan pembuatan klon langsung ke dalam DNA plasmid. T-DNA merupakan untaian T-DNA yang akan ditransfer ke sel tanaman. Gen gus-A ( beta-glucuronidase) dalam plasmid pCambia 1303 berfungsi sebagai gen reporter untuk memonitor proses transformasi dan introduksi gen yang direkayasa (Widyasari & Suhandono 2007).
Gen gus-A digunakan sebagai penyeleksi untuk mengetahui telah terintegrasinya T-DNA dari Agrobacterium ke dalam genom tanaman sehingga hanya tanaman transgenik yang dapat hidup di media tumbuh yang mengandung antibiotik higromisin. Gengus-A menyandikan enzim -glucuronidase yang digunakan sebagai penanda pada sistem transformasi pada tanaman. Gengus-A disisipi intron lalu disekuen sandinya sehingga ekspresi gen hanya mungkin terjadi bila sudah terintegrasi pada tanaman. Jika masih berada di dalam bakteri maka intron tidak terpotong sehingga ekspresi tidak terjadi (Nasution 1999).
Pengklonan
Cloning adalah suatu teknik isolasi dan pemurnian fragmen DNA tunggal dari DNA genom yang kemudian digabung dengan suatu vektor untuk membentuk DNA rekombinan yang dapat bereplikasi dalam inang bakteri (Kendrew & Lawrence 1994). Tahapan cloning diawali dengan isolasi fragmen DNA dan DNA vektor, masing-masing DNA dapat diisolasi dari bakteri. Setelah isolasi, fragmen DNA dan DNA vektor dipotong dengan enzim restriksi yang sama. Tahap selanjutnya adalah penggabungan fragmen DNA dengan DNA vektor. Tahap ini biasanya disebut tahap ligasi. Penggabungan DNA ini biasanya dibantu oleh enzim ligase. Hasil tahap ligasi yaitu terbentuknya DNA rekombinan (fragmen DNA dengan DNA vektor) (Nasution 1999).
Tahap ketiga adalah transformasi DNA rekombinan ke bakteri. Transformasi adalah suatu cara memasukkan DNA asing ke dalam sel inang sehingga saat ini telah dikembangkan beberapa teknik transformasi yaitu diantaranya (1) induksi senyawa kimia, yaitu DNA asing masuk akibat perbesaran pori membran sel oleh pengaruh senyawa kimia, (2) inokulasi dengan virus, yaitu masuknya DNA asing ke dalam sel dibantu oleh virus yang menjembataninya dengan membran sel inang, (3) fusi protoplas, yaitu dua protoplas atau lebih dilebur sehingga terbentuk sel baru yang mempunyai sifat tertentu, (4) biolistik, yaitu pemasukan DNA dilakukan dengan membungkus partikel emas dengan makromolekul DNA lalu ditembakkan ke sel inang, (5) elektroporasi, yaitu transfer DNA dilakukan dengan bantuan penerapan medan listrik. Teknik yang terakhir adalah tekniktri-parental mating (Sainet al.1999). Menurut Nasution (1999), tahap keempat adalah seleksi sel inang yang telah mengalami transformasi dan telah mengandung DNA rekombinan. Inang yang telah mengalami transformasi dan telah mengandung DNA rekombinan dapat diseleksi berdasarkan gen penanda (selectable marker) yang dibawa oleh plasmid. Gen penanda yang biasa digunakan adalah gen ketahanan terhadap suatu antibiotik tertentu.
Tahap kelima adalah transformasi ke sel target. Sel target yang digunakan dapat berupa sel tanaman tingkat tinggi, ragi, jamur dan sel-sel mamalia. Tahap yang terakhir adalah meneliti gen yang diklon. Kegiatan ini ditekankan pada cara mendapatkan informasi mengenai lokasi gen, struktur gen, cara gen
ditranskipsi dan produk translasi yang dikode oleh gen (Nasution 1999).
Polymerase Chain Reaction (PCR)
PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA target tersebut dengan bantuan enzim dan oligonukleotida sebagai primer dalam suatuthermocycler. Primer yang berada sebelum daerah target disebut sebagai primer forward dan primer yang berada setelah daerah target disebut primer reverse. Enzim yang digunakan sebagai pencetak rangkaian molekul DNA baru dikenal sebagai enzim polimerase (Muladno 2002).
Reaksi PCR pada dasarnya adalah tiruan dari proses replikasi DNA, yaitu adanya pembukaan rantai DNA utas ganda, penempelan primer, dan perpanjangan rantai DNA baru oleh DNA polimerase dari arah 5’ ke 3’. Tetapi pada teknik PCR tidak menggunakan enzim ligase dan primer RNA. Satu siklus pada teknik PCR terdiri atas tiga tahap, yaitu denaturasi, annealing dan ekstensi. Denaturasi dilakukan pada suhu 90-95oC sehingga terjadi pemisahan utas ganda DNA menjadi dua utas tunggal DNA yang menjadi cetakan (template) tempat penempelan primer dan tempat kerja DNA polimerase. Selanjutnya pada tahapannealing, suhu diturunkan untuk penempelan primer oligonukleotida pada sekuens yang komplementer pada molekul DNA cetakan. Suhu annealing tiap sekuens DNA bersifat spesifik dan merupakan faktor penentu keberhasilan suatu reaksi PCR. Sedangkan tahap terakhir adalah ekstensi. Tahap ekstensi dilakukan pada suhu 72oC. Suhu ini merupakan suhu optimum untuk kerja enzim Taq DNA polimerase. Pada tahap ini terjadi sintesis DNA komplemen dengan DNA cetakan. Ketiga tahap tersebut dilakukan berulang kali dalam mesin PCR, pada umumnya antara 25-40 siklus bergantung dari jumlah DNA yang diinginkan (Saiki et al. 1989).
Agrobacterium tumefaciens
Agrobacterium tumefaciens merupakan bakteri tanah Gram negatif yang termasuk famili Rhizobiaceae dan anggota dari genus Agrobacterium. Pada awal abad 20-an A. tumefaciens diketahui merupakan penyebab crown gall diseases yang membentuk benjolan dalam tanaman dikotil yang menyerang 90 famili tumbuhan dikotil
sehingga menimbulkan kerugian ekonomi yang besar. Tumor ini dihasilkan dari proses transfer, integrasi dan ekspresi daritransfered DNA (T-DNA) utas tunggal. T-DNA dihasilkan oleh plasmid Ti yang dipicu oleh molekul yang dilepaskan sel tanaman yang sedang tumbuh sehingga menginduksi virulance(vir)gene dariA.tumefaciens untuk menghasilkan T-DNA. Setelah terintegrasi, ekspresi dari T-DNA memicu biosintesis hormon pertumbuhan tanaman dan senyawa opines yang merupakan nutrisi bagi A. tumefaciens.
Kemampuan T-DNA untuk mentransfer DNA ke organisme eukariotik dan gen yang berada di T-DNA dapat digantikan dengan gen apa saja, menjadikan A. tumefaciens sebagai vektor yang ideal untuk transfer gen ke suatu organisme eukariotik, seperti tanaman untuk menghasilkan suatu tanaman transgenik, fungi dan sel manusia (Tzfira & Citovsky 2003).Agrobacterium memiliki tiga komponen genetik yang digunakan untuk menginfeksi tanaman. Komponen yang pertama adalah komponen T-DNA yaitu fragmen yang ditransfer ke sel tanaman. T-DNA terletak di plasmid Ti dari Agrobacterium. Komponen kedua adalah virulance (vir) region yang mensintesis protein vir dan komponen ketiga adalah gen chromosomal virulance (chv) yang berfungsi dalam pelekatan bakteri ke dalam sel tanaman (Sheng & Citovsky 1996).
BAHAN DAN METODE
Bahan dan AlatBahan-bahan yang digunakan untuk pemurnian gen kitinase produk PCR adalah genkitinase berupa isolat DNA plasmid yang sudah didapat dari Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI) yang dimurnikan dengan Pure Link TMQuick Gel Extraction kit (Invitrogen), dan untuk verifikasi hasil dengan gel agarosa bahan yang digunakan adalah serbuk agarosa, buffer TBE 0.5 X, etidium bromida (EtBr),loading buffer (brom fenol biru 2.5%, sukrosa 40%), dan marker 1 kb plus (Invitrogen). Teknikcloning yang dilakukan dapat dibagi menjadi tiga tahap, yaitu tahap ligasi, transformasi, dan seleksi transforman. Pada tahap ligasi bahan yang digunakan antara lain vektor pGEM-T Easy (Promega), T4 DNA ligase dan buffer ligasi. Sedangkan bahan yang digunakan pada tahap transformasi dan seleksi transforman adalah sel kompeten E.coli XL1-Blue yang
5
diperoleh dari Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI), media Luria Bertani (LB) agar Low Salt (LA) yang telah ditambahkan ampisilin 100 mg/L + isopropil – – D – Thiogalaktopiranosida (IPTG) 100mM + 5 – bromo – 4 – kloro – 3 – indiol – – galaktopiranosida (X-Gal) 40 mg/L. Isolasi DNA plasmid dilakukan denganHigh Pure Plasmid Isolation Kit (Roche). Restriksi dilakukan dengan menggunakan enzim dari Biolabs. Enzim yang digunakan adalah NcoI dan SpeI. Sedangkan transformasi dengan menggunakan sel kompeten kimia dari AGLO, bahan yang digunakan antara lain es batu, nitogen cair, media Yeast Exctract Pepton (YEP), antibiotik rifampisin 50 ppm, dan kanamisin 25 ppm.
Peralatan yang digunakan untuk pemurnian gen kitinase produk PCR adalah pisau skapel, timbangan, sentrifus Eppendorf 5417R, dan penangas air. Peralatan yang digunakan untuk elektroforesis adalah sisir, cetakan agar, bak elektroforesis, adaptor 100 volt, dan perangkat gel doc. Selain itu peralatan lain yang digunakan adalah shaker incubator, ruang laminar, autoklaf, pH meter, magnetic stirer, dan peralatan-peralatan gelas seperti cawan petri, gelas piala, labu Erlenmayer, dan gelas ukur.
Metode Penelitian
Penelitian ini dibagi menjadi 2 tahap, yaitu tahap penemuan gen dan tahap strategi konstruksi gen. Penelitian yang dilakukan sebelumnya yaitu menemukan gen kitinase yang akan digunakan untuk tahapan selanjutnya dengan cara mencari spesifikasi gen yang diinginkan pada bank data www.ncbi.nlm.nih.gov. Kemudian disain primer berdasarkan informasi yang didapatkan dari National Center for Biotechnology Information (NCBI), amplifikasi menggunakan primer spesifik, cloning pada pGEMT-Easy dan tahap selanjutnya adalah sekuensing. Setelah tahap I penelitian berhasil ditemukan maka dilanjutkan ke tahap II penelitian yaitu strategi konstruksi gen. Pemurnian GenKitinaseProduk PCR Pemurnian gen kitinase produk PCR menggunakan Pure Link TM Quick Gel Extractiondari Invitrogen. Fragmen dipotong dari gel dengan menggunakan scalpel dan ditimbang bobotnya. Gel yang sudah dipotong dilarutkan dengan menggunakan buffer GS1 (gel solubilization buffer) dengan perbandingan antara sampel dan buffer yang ditambahkan adalah 1:3. Gel diinkubasi pada
suhu 50oC selama 15 menit, dan setiap 3 menit dibolak-balikan secara perlahan agar bercampur rata dan larut. Setelah larut gel tersebut diinkubasi lagi selama 5 menit pada suhu ruang. Larutan ditransfer ke dalam tabung lalu disentrifugasi dengan kecepatan 12000 rpm (15300 rcf) selama 2 menit pada suhu 25oC. Setelah disentrifus, sebanyak 500
µL GS1 ditambahkan ke dalam tabung dan diinkubasi selama 1 menit lalu disentrifus lagi dengan kecepatan 12000 rpm (15300 rcf) selama 2 menit. Sebanyak 700 µL W9 (wash buffer) ditambahkan ke dalam tabung lalu diinkubasi selama 5 menit dan disentrifus kembali dengan kecepatan 12000 rpm selama 2 menit. Setelah itu tabung disentrifus kembali dengan kecepatan 12000 rpm (15300 rcf) selama 2 menit untuk menghilangkan sisa etanol yang ada. Lalu dielusi dengan 30 µL buffer TE (Tris-EDTA). Setelah itu diinkubasi selama 1 menit dan disentrifus kembali dengan kecepatan 12000 rpm (15300 rcf) selama 2 menit. Hasil elusi diverifikasi pada gel agarosa 1 %. Sebanyak 2 µL hasil elusi dilarutkan dengan 1µL loading buffer dan dimasukkan ke dalam sumur yang terbentuk pada gel. Gel diletakkan dalam bak elektroforesis yang telah diisi dengan buffer TBE 0.5X. Lalu dihubungkan dengan adaptor dengan potensial listrik sebesar 100 volt. Setelah selesai, gel diletakkan di bawah sinar UV (perangkat gel doc) untuk melihat ada tidaknya pita yang terbentuk. Ukuran perkiraan fragmen hasil pemurnian gen kitinase produk PCR sekitar 1500 bp (Chaidamsari 2005).
Cloning GenKitinase ke pGEMT-Easy
Setelah verifikasi pada gel agarosa menunjukkan hasil sesuai dengan yang diharapkan, selanjutnya cloning gen diawali dengan ligasi gen kitinase dengan pGEMT-Easy menggunakan kit dari Promega. Sebanyak 3.5 µL insert (hasil elusi) ditambahkan dengan 5 µL buffer ligase, 0.5 µL vektor pGEMT-Easydan 1µL T4 ligase. Sehingga total campuran sebanyak 10 µL. Tabung mikro ditutup rapat dengan parafilm kemudian diputar sebentar. Setelah itu campuran diinkubasi selama 1 jam pada suhu ruang atau semalaman pada suhu 4oC. Selanjutnya hasil ligasi akan ditransformasi ke E.coli(XL1-Blue) (Chaidamsari 2005). Transformasi Gen Kitinase ke Escherichia coli (XL1-Blue)
Transformasi gen kitinase ke E.coli (sel kompeten) menggunakan metode Doyle
(1996). Setelah disimpan semalaman pada suhu 4oC, hasil ligasi ditempatkan di dalam freezer yang selanjutnya akan dimasukkan ke dalam sel kompeten. Sebanyak 10 µLkitinase hasil ligasi dimasukkan ke dalam 200 µL XL1-Blue (sel kompeten). Kemudian dikocok perlahan hingga tercampur rata. Lalu diinkubasi di dalam es selama 30 menit, setelah itu diinkubasi dalam penangas air pada suhu 42oC selama 50 detik. Selanjutnya tabung tersebut segera dimasukkan ke dalam es selama 10 menit. Setelah dimasukkan ke dalam es larutan tersebut ditambahkan dengan 800 µL LB (Luria Bertani) + glukosa dan dikocok selama 1.5 jam pada suhu 37oC dengan kecepatan 150 rpm. Setelah dikocok, larutan diambil sebanyak 100 µL dan disebar menggunakan segitiga penyebar ke dalam media LA yang mengandung ampisilin 100ppm + IPTG (isopropil – – D – thiogalaktopiranosida) 100mM + X-Gal (5-bromo-4-kloro-3-indiol- -galaktopiranosida) 40 mg/L. Selanjutnya diinkubasi semalam pada suhu 37oC.
Seleksi transforman dilakukan dengan pengamatan terhadap koloni yang terbentuk. Koloni yang terbentuk adalah sel E.coli yang berhasil ditransformasi, sedangkan yang tidak berhasil ditransformasi akan mati akibat penambahan ampisilin. Dua jenis koloni akan terbentuk pada cawan petri. Koloni yang berwarna putih menunjukkan sel yang mengandung plasmid yang berhasil disisipi. Sedangkan koloni yang berwarna biru mengandung plasmid yang tidak berhasil disisipi. Setiap koloni putih yang terbentuk diberi nomor dan ditandai. Koloni yang berwarna putih kemudian dengan tusuk gigi steril diambil sedikit untuk PCR DNA koloni dan sedikit dipindahkan ke medium LB agar dalam cawan petri (duplikat koloni).
Konfirmasi Koloni Transforman yang Membawa Fragmen Sisipan
Konfirmasi koloni transforman menggunakan metode Chaidamsari (2005) dan dilakukan dengan teknik PCR DNA koloni. Proses PCR DNA koloni menggunakan mesin PCR (Biometra T-personal). Proses ini diawali oleh pemecahan sel (lisis) dengan pemanasan pada suhu 96oC selama 5 menit kemudian suhu turun menjadi 50oC dan berlangsung selama 90 detik, suhu naik kembali menjadi 96oC selama 90 detik, lalu 90 detik selanjutnya pada suhu 45oC, 1 menit pada suhu 96oC dan 40oC selama 1
menit. Setelah pemanasan pada proses lisis, campuran PCR (buffer lengkap, molecular
water, dNTPs, primer M13F, M13R danTaq polimerase) ditambahkan pada setiap sampel. Proses PCR dilanjutkan kembali dengan suhu 94oC selama 30 detik, 55oC selama 1 menit dan 2 menit pada 72oC selama 30 siklus dan selanjutnya 72oC selama 5 menit. PCR DNA koloni dilakukan menggunakan primer universal M13 F dan R serta koloni bakteri sebagai cetakan. Hasil PCR DNA koloni diverifikasi pada gel agarosa. Koloni terpilih kemudian dikultur dalam medium LB cair yang telah ditambahkan ampisilin dan diinkubasi pada shaker-incubator suhu 37oC, 150 rpm. Dari kultur bakteri yang tumbuh, selanjutnya dilakukan isolasi DNA plasmid menggunakan High Pure Plasmid Isolation Kit (Roche). Hasil isolasi diverifikasi kembali pada gel agarosa. Tahap selanjutnya akan dilakukan sekuensing fragmen gen terklon. Pengurutan basa (sekuensing) fragmen gen terklon dilakukan di Lembaga Molekuler Eijkmen Jakarta menggunakan primer universal M13F dan M13R. Hasil sekuen selanjutnya dianalisis menggunakan program bioedit dan BLASTX untuk membandingkan sekuen nukleotida yang ditranslasi pada seluruh open reading frame (ORF) dengan sekuens protein pada basis data. Analisis menggunakan BLASTX bertujuan untuk mengetahui kesesuaian urutan basa yang didapatkan dengan urutan basa yang ada dalam bank data.
Isolasi DNA Plasmid Rekombinan
Isolasi DNA plasmid dilakukan berdasarkan hasil PCR DNA koloni yang diketahui mengandung plasmid terinsersi fragmen yang diinginkan. Koloni tersebut dikulturkan dalam media LB yang mengandung ampisilin kemudian diinkubasi selama 16 jam pada suhu 37oC, 150 rpm. Plasmid diisolasi dengan menggunakan High Pure Plasmid Isolation Kit (Roche). Sebanyak 3–4 mL dipindahkan ke dalam tabung mikro lalu disentrifugasi dengan kecepatan 8000 rpm (6753 rcf) pada suhu 25oC selama 2 menit. Selanjutnya pelet yang dihasilkan diresuspensikan kembali dengan 250 µL suspension buffer + RNAse. Setelah itu ditambahkan kedalamnya 250 µLlysis buffer dan tabung dibolak-balikan secara perlahan sebanyak 6-8 kali, kemudian diinkubasi selama 5 menit pada suhu ruang. Lalu sebanyak 350 µLbinding buffer ditambahkan kedalamnya dan dibolak-balikan secara perlahan sebanyak 3-6 kali, kemudian diinkubasi selama 5 menit di dalam es. Setelah disimpan di dalam es, suspensi
7
tersebut disentrifugasi dengan kecepatan 12000 rpm (15300 rcf) selama 10 menit. Supernatan yang dihasilkan, dipindahkan ke dalam tube filter (kolom) dan disentrifugasi kembali dengan kecepatan 12000 rpm (15300 rcf) selama 2 menit. Selanjutnya sebanyak 500 µL wash buffer I ditambahkan kedalamnya dan disentrifugasi dengan kecepatan 12000 rpm (15300 rcf) selama 2 menit. Kemudian ditambahkan lagi dengan wash buffer II sebanyak 700 µL dan disentrifugasi dengan kecepatan 12000 rpm (15300 rcf) selama 2 menit. Tabung filter (kolom) disentrifus dalam keadaan kosong untuk menghilangkan sisa etanol yang ada. Kemudian ditransfer ke dalam tabung 1.5 mL yang baru. Lalu dilarutkan dengan elution buffer sebanyak 30 µL, larutan diinkubasi selama 1 menit untuk melarutkan DNA yang berada pada membran filter, selanjutnya disentrifugasi kembali dengan kecepatan 12000 rpm (15300 rcf) selama 2 menit. DNA plasmid diverifikasi pada gel agarosa 1 %.
Restriksi Gen Kitinase dan pCambia 1303 dengan Enzim Restriksi
Restriksi dilakukan dengan menggunakan enzim dari Biolabs. Plasmid yang mengandung gen kitinase dipotong menggunakan enzimNco1 danSpe1. Restriksi DNA plasmid dan pCambia 1303 dilakukan dengan dimasukkannya 7 µL DNA plasmid dan ditambahkan dengan 8.8 µL dH2O, 0.2 µL
BSA, 2 µL buffer 2 (SpeI), 1 µL enzimSpeI dan 1 µL enzim NcoI sehingga volum total yang ada didalam tabung mikro tersebut sebanyak 20 µL. Campuran diinkubasi selama 3 jam pada suhu 37oC. Selanjutnya hasil restriksi dielektroforesis dengan menggunakan gel agarosa 0.5%. Setelah itu gel ditempatkan di bawah lampu ultraviolet (UV) untuk melihat gen kitinase yang sudah terpisah sempurna dengan vektor (pGEMT). Tahap selanjutnya fragmen gen kitinase dipotong dari gel menggunakanscalpeluntuk elusi dan hasil elusi dicek pada gel agarosa 1 % (Chaidamsari 2005).
Ligasi GenKitinase dengan pCambia 1303 Ligasi dilakukan dengan menggunakan T4 ligase dan buffer ligase dari Promega. Sebanyak 1 µL hasil elusi dicampurkan dalam tabung steril 500 µL dengan buffer (2x) sebanyak 5 µL, vektor pCambia sebanyak 3 µL dan T4 ligase sebanyak 1 µL sehingga volume total menjadi 10 µL. Campuran diinkubasi selama 1 jam pada suhu ruang atau semalaman pada suhu 4oC (Chaidamsari
2005). Selanjutnya hasil ligasi gen kitinase dengan pCambia akan ditransformasi ke sel kompeten (XL-1 Blue). Sel kemudian disebarkan diatas medium LB agar yang telah ditambahkan dengan kanamisin 25 ppm. Setelah itu diinkubasi semalam pada suhu 37
o
C. Seleksi transforman dilakukan dengan pengamatan terhadap koloni yang terbentuk. Koloni yang terbentuk adalah koloni berwarna putih. Koloni putih yang tumbuh dari gen kitinase diduplikat dan diisolasi DNA plasmidnya. Koloni putih tersebut mengandung DNA rekombinan. Koloni tersebut juga dibuat duplikatnya dan dikulturkan dalam media LB yang mengandung kanamisin 25 ppm. Lalu dikocok pada kecepatan 150 rpm selama semalam pada suhu 37oC. Dari kultur bakteri yang tumbuh, selanjutnya dilakukan isolasi DNA plasmid menggunakan High Pure Plasmid Isolation Kit (Roche). Hasil isolasi diverifikasi kembali pada gel agarosa 1%. Transformasi Menggunakan Sel Kompeten Kimia keAgrobacterium tumefaciensStrain AGLO
Setelah hasil verifikasi pada agarosa sesuai dengan yang diharapkan, tahap selanjutnya adalah restriksi kembali gen kitinase dengan enzim restriksi yang sama. Tujuan dari restriksi ini adalah untuk mengecek gen kitinase tersebut sudah masuk ke dalam vektor atau tidak. Selanjutnya jika gen kitinase tersebut sudah masuk ke dalam vektor ekspresi maka tahap selanjutnya akan ditransformasikan ke dalam Agrobacterium. Transformasi keAgrobacterium menggunakan metode Chaidamsari (2005), dengan cara sebanyak 5-10 L DNA plasmid dimasukkan ke dalam 500 L sel kompeten, diamkan di dalam es selama 15 menit. Setelah itu, diinkubasi di dalam es, diinkubasi kembali selama 5 menit di dalam nitrogen cair dengan suhu –260oC dan setelahnya 5 menit pada suhu 37oC. Kemudian sebanyak 1 mL YEP (Yeast Exctract Pepton) ditambahkan kedalamnya dan dikocok selama 3 jam pada suhu 28oC dengan kecepatan 150 rpm. Setelah dikocok, larutan tersebut disentrifugasi dengan kecepatan 6000 rpm (3800 rcf) selama 3 menit.
Supernatan yang dihasilkan sebagian dibuang dan sebanyak 200 L supernatan yang tersisa diresuspensikan dengan pelet yang terbentuk. Setelah itu sebanyak 200 L larutan tersebut dipipet dan dimasukkan ke dalam media LA yang telah berisi antibiotik kanamisin 25 ppm dan rifampisin 50 ppm.
Inkubasi selama 2 hari pada suhu 28oC dalam kondisi gelap dengan kecepatan 150 rpm. Setelah diinkubasi selama 2 hari, hasilnya adalah terbentuknya koloni berwarna putih. Koloni yang terbentuk kemudian diambil dengan tusuk gigi steril dan diberi nomor lalu dimasukkan ke dalam media agar untuk dibuat duplikatnya dan dikulturkan dalam media LB yang mengandung kanamisin 25 ppm dan rifampisin 50 ppm. Selanjutnya dikocok selama 2 malam dengan kecepatan 150 rpm dan dilakukan isolasi DNA plasmid. Setelah itu, dilakukan restriksi kembali dengan menggunakan enzim NcoI dan SpeI. Keberhasilan tahap ini dapat dilihat berdasarkan hasil restriksi dengan enzimNcoI dan SpeI. Tahap selanjutnya dari penelitian ini, akan dilanjutkan oleh peneliti yang lain dari hasil yang didapatkan akan ditransformasikan melalui Agrobacterium ke eksplan tanaman kelapa sawit.
HASIL DAN PEMBAHASAN
Pemurnian GenKitinase Produk PCR Strategi dalam konstruksi gen harus mempertimbangkan dua hal yaitu urutan nukleotida gen yang akan dikonstruksi dan vektor ekspresi yang akan digunakan. Gen kitinase(chi) telah diamplifikasi oleh peneliti sebelumnya. Hasil PCR produk yang didapat dari tahap penelitian sebelumnya, dimurnikan terlebih dahulu untuk menghilangkan komponen-komponen yang dapat menghambat proses kloning selanjutnya. Hasil pemurnian PCR produk gen chi ditunjukkan pada Gambar 3. Berdasarkan hasil yang didapat, terlihat bahwa pada sumur 2 terdapat pita yang cukup tebal dengan ukuran yang sesuai dengan pita marka 1500 bp. Hasil dari gambar ini menunjukkan bahwa produk PCR yang telah murni adalah benar gen chi yang diinginkan.M 1 2
Gambar 3 Pemurnian PCR produk genchi. (M) marker, (1&2) genchi.
Cloning GenKitinaseHasil PCR pada
pGEMT-Easy
Fragmen hasil amplifikasi (PCR) yang diverifikasi pada gel agarosa (Gambar 3), dipotong dari gel dan dimurnikan untuk digunakan pada tahapcloning.Cloning dibagi menjadi tahap ligasi, transformasi ke dalam sel kompeten, dan seleksi transforman. Vektor cloning yang digunakan pada penelitian adalah pGEMT-Easy dari Promega. Seperti terlihat pada Gambar 4, plasmid yang digunakan memiliki basa timin pada bagian ujungnya (3’ T-overhang). Basa T dari vektor dapat berikatan dengan fragmen gen hasil PCR yang memiliki kelebihan basa adenin, tanpa memerlukan tahapan restriksi terlebih dahulu. Proses ligasi terjadi dengan adanya bantuan enzim T4 DNA ligase, yaitu enzim yang membentuk ikatan fosfodiester diantara fragmen gen (insert) dan basa dari plasmid yang digunakan. Proses tersebut dapat dilakukan pada suhu ruang selama satu jam atau diinkubasi pada suhu 4oC selama semalam. Proses ligasi antara genkitinasedan vektor cloning dalam hal ini telah berhasil dilakukan.
Gambar 4 Vektor klon pGEMT-Easy dan peta restriksi yang dimiliki (Promega 1999).
Transformasi GenKitinase keEscherichia coli (XL-1Blue)
Produk ligasi yang telah berhasil, kemudian ditransformasi ke dalam sel E.coli XL1- Blue kompeten. Berdasarkan koloni yang terbentuk pada media (Gambar 5), menunjukkan bahwa hasil kloning gen kitinase ke dalam pGEMT-Easy telah berhasil dilakukan. Transformasi dilakukan dengan pemberian kejut panas (heat shock) pada suhu 42oC selama 50 detik. Prinsip utama dari proses tersebut adalah terjadi lonjakan suhu dari 0oC ke 42oC terhadap sel yang telah diberi perlakuan dengan CaCl2. Garam CaCl2
2000 bp
1500 bp 1000 bp
9
(B)
Gambar 5 Contoh duplikat dari koloni hasil transformasi. (A) koloni berwarna
putih, (B) koloni berwarna biru. akan mempengaruhi struktur dan muatan dari membran sel. Sehingga pada saat terjadi lonjakan suhu membran menjadi tidak selektif terhadap molekul asing dan produk ligasi dapat masuk ke dalam sel. Sel kemudian dikultur dalam media tumbuh (LB + glukosa) selama 1.5 jam untuk memperbanyak jumlah sel. Setelah itu sel disebar pada medium seleksi (LA + ampisilin 100 ppm + isopropil--D-thiogalaktopiranosida (IPTG) 100mM + 5-bromo-4-kloro-3-indiol- -galaktopiranosida (X-Gal) 40 mg/L), dan diinkubasi semalaman pada suhu 37oC.
Tahap terakhir dari proses cloning adalah seleksi transforman. Seleksi transforman dapat dilakukan dengan pengamatan warna koloni putih dan biru yang tumbuh pada media seleksi. Keberhasilan pada tahap cloning ini dilihat dari hasil koloni yang terbentuk pada media. Secara teoritis koloni berwarna putih merupakan koloni yang membawa fragmen gen sisipan (insert) dan sebaliknya koloni berwarna biru membawa plasmid yang tidak tersisipi oleh fragmen gen yang diinginkan. Adanya koloni biru putih berhubungan dengan terekspresinya enzim -galaktosidase. Fragmen gen sisipan yang terdapat pada plasmid akan menghambat sintesis -peptida yang berperan sebagai aktivator terhadap kerja enzim -galaktosidase (Reece 2004). Dalam keadaan aktif, yaitu ketika berada pada bentuk tetramernya, enzim –galaktosidase akan menghidrolisis X-Gal (5– bromo–4–kloro–3– indol– – D – galaktopiranosida) menjadi galaktosida dan senyawa turunan 5-bromo-4-kloro indoksil yang berwarna biru. Penyisipan fragmen DNA ke MCS (Multiple Cloning Site) akan merusak susunan basa genLac Z’ sehingga ekspresi gen yang menghasilkan enzim fungsional tidak terjadi.
Hal ini mengakibatkan koloni menjadi berwarna putih. Pada seleksi biru putih, IPTG berfungsi sebagai penginduksi ekspresi gen sedangkan X-Gal berfungsi sebagai substrat.
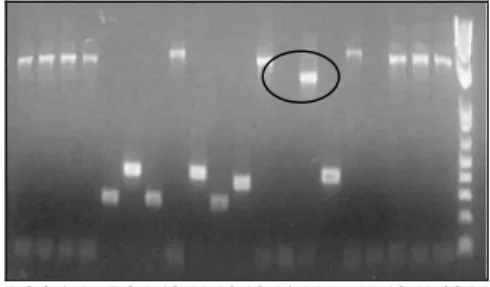
Konfirmasi Koloni Transforman yang Membawa Fragmen Sisipan Hasil dari PCR DNA koloni disajikan pada Gambar 6. Koloni positif atau koloni yang membawa fragmen gen chiditunjukkan dengan terbentuknya pita berukuran sekitar 1700 bp. Apabila dicermati lebih lanjut, terjadi penambahan ukuran sekitar 200 bp dari fragmen asli chi yaitu 1500 bp. Penambahan tersebut berasal dari primer universal yang digunakan (M13). Primer universal yang berada dalam pGEMT akan menambah ukuran insert karena sebagian basa pGEMT-Easy turut diamplifikasi pada saat proses PCR DNA koloni. Dari gambar terlihat bahwa koloni nomor 14 merupakan koloni positif. Koloni yang positif, kemudian dikultur dalam media yang telah ditambahkan antibiotik. Selanjutnya dilakukan isolasi DNA plasmid dari setiap kultur yang diperoleh menggunakan High Pure Plasmid Isolation Kit (Roche).
Hasil isolasi plasmid diverifikasi pada gel agarosa. Kemudian, plasmid dari tiap koloni chi dianalisis urutan basanya menggunakan primer universal M13 F dan M13 R. Adapun tujuan utama dari PCR DNA koloni adalah untuk mengkonfirmasi koloni transforman yang membawa fragmen gen sisipan (Nurhaimi 2006) dan menghindari kesalahan dari pengamatan warna koloni. Hasil isolasi DNA plasmid yang positif selanjutnya disekuensing. Sekuensing diperlukan untuk menganalisis fragmen gen kitinase yang berhasil diisolasi. Sekuensing dapat dilakukan dengan menggunakan produk PCR langsung atau melalui hasilcloning.
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 M
Gambar 6 Hasil PCR DNA kolonichi 14. (M) marker 1 kb plus DNA
ladder, (No 1-20) nomor koloni yang digunakan sebagai cetakan. ( B)
Urutan basa yang diperoleh kemudian dianalisis menggunakan program BLASTX. Berdasarkan analisis BLASTX dengan melihat parameter skor (bits) lebih dari 150 dan E value yang kurang dari 10-4, maka tingkat homologi yang dihasilkan cukup baik (Claveri & Notredam 2003). Semakin tinggi skor (bits) maka tingkat homologinya semakin baik, semakin rendah E value maka semakin baik pula tingkat homologinya. Selain nilai skor danE value, tingkat homologi juga dapat dilihat dari garis berwarna merah pada grafik hasil BLASTX. Analisis ini diperlukan untuk mengetahui apakah gen yang berhasil diisolasi sesuai dengan yang diharapkan.
Hasil analisis BLASTX (Gambar 7) menunjukkan bahwa fragmen gen kitinase. (chi) yang diperoleh menyandi enzim endochitinase. Chi memiliki homologi yang tinggi dengan enzimchitinase yang lain. Hal tersebut teramati melalui skor (bits) yang lebih besar dari 150. Homologi chi dengan protein lain yang bersesuaian disajikan pada Tabel 1. Selanjutnya hasil sekuen dengan M13 F danreverse complement M13 R disejajarkan menggunakanpairwaise aligment (Bioedit). Tujuan utama dari pairwaise aligment adalah untuk mengetahui urutan basa yang sama (overlap) dari hasil sekuen menggunakan primer M13 F dan M13 R. Data hasil sekuensing berupa elektroforegraf yang menggambarkan urutan basa fragmen genchi berukuran 1500 bp (Lampiran 5). Ukuran fragmen yang didapat sesuai dengan hasil amplifikasi fragmen gen chi sebelumnya, yaitu sekitar 1500 bp. Hasil yang didapat merupakan gambaran bahwa proses cloning dan sekuensing telah berhasil dilakukan.
Gambar 7 Hasil analisis BLASTX fragmen genchi.
Tabel 1 Hasil analisis BLASTX fragmen genchi * Protein yang bersesuaian Score Evalue endochitinase [Trichoderma.... 322 1e-86 endochitinase [Hypocrea... 322 1e-86 endochitinase [Hypocrea... 320 4e-86 endochitinase [Trichoderma.... endochitinase [Trichoderma... 309 307 6e-83 3e-82
*hanya ditampilkan sebagian, secara lebih lengkap dapat dilihat pada lampiran 6.
Restriksi GenKitinase dan pCambia 1303 dengan Enzim Restriksi
Hasil sekuensing yang telah didapat, digunakan untuk memulai tahap awal dalam konstruksi gen chi. Tahap awal untuk mengkonstruksi gen ini adalah restriksi gen chi dan pCambia itu sendiri. Supaya genchi dapat disambungkan pada vektor ekspresi (pCambia 1303), maka terlebih dahulu pCambia 1303 dipotong dengan enzim NcoI dan SpeI. Hasil restriksi pCambia 1303 disajikan pada Gambar 8. Setelah dipotong dengan enzim NcoI dan SpeI, hasil elektroforesis pada Gambar 8 menunjukkan pita dengan ukuran sekitar 12000 bp. Pita dengan ukuran 12000 bp tersebut merupakan ukuran pCambia 1303 yang berhasil dipotong dengan enzim NcoI dan SpeI. Setelah itu, fragmen pCambia 1303 tersebut dipotong dari gel untuk dielusi dengan Pure Link TMQuick Gel Extraction (Invitrogen). Hasil pemurnian dari plasmid pCambia 1303 disajikan pada Gambar 9. Hasil pemurnian tersebut
M 1
Gambar 8 Hasil elektroforesis restriksi pCambia 1303 dengan enzim
NcoIdanSpeI (M) marker, (1) pCambia 1303.
11
1 2 M
Gambar 9 Hasil pemurnian plasmid pCambia 1303. (1&2) pCambia 1303, (M) marker.
menunjukkan bahwa pada sumur satu dan dua terlihat adanya pita yang cukup tebal dengan ukuran 12000 bp. Hal ini menggambarkan bahwa pemurnian plasmid pCambia 1303 hasil restriksi telah murni.
Begitu pula sebaliknya, gen chi dipotong dengan enzim NcoI dan SpeI dari vektor cloning (pGEMT-Easy) untuk disambungkan pada vektor ekspresi pCambia 1303. Hasil elektroforesis gen chi dari pGEMT-Easy disajikan pada Gambar 10. Setelah dipotong dengan enzim NcoI dan SpeI, hasil elektroforesis pada Gambar 10 menunjukkan adanya 2 pita dengan ukuran 3000 bp dan 1500 bp. Dua pita DNA ini disebabkan adanya dua sisi restriksi yang dikenali oleh enzim restriksi dalam urutan nukleotida plasmid. Pita dengan ukuran 3000 bp merupakan ukuran dari vektor cloning (pGEMT-Easy) sedangkan pita dengan ukuran
Gambar 10 Hasil elektroforesis restriksi gen chi dari pGEMT-Easy. (M) marker, (1) pGEMT-Easy (3000 bp) dan genchi(1500 bp).
1500 bp merupakan ukuran dari gen chi. Dengan demikian disimpulkan bahwa genchi sudah terpisah sempurna dari vektor cloning (pGEMT-Easy). Selanjutnya fragmen dari gen chi dipotong dari gel lalu dielusi denganPure Link TM Quick Gel Extraction (Invitrogen) untuk diligasi dengan pCambia 1303.
Vektor pCambia 1303 yang digunakan pada penelitian berfungsi sebagai vektor ekspresi. Plasmid pCambia 1303 mempunyai rentang yang luas sehingga bersifat stabil jika ditransformasikan baik ke tanaman dikotil maupun pada tanaman monokotil. Vektor ini didasarkan pada pCambia 1301. pCambia 1303 mengandung gusA, mgfp5, dan His6 fusion. Selain itu, plasmid pCambia 1303 juga mengandung promotor CaMV35S (Cauliflower Mosaic Virus). Promotor ini berhubungan dengan urutan yang terpoliadenilasi pada T-DNA plasmid. Hal ini memungkinkan pembuatan klon langsung ke dalam T-DNA plasmid. Sedangkan T-DNA sendiri merupakan untaian DNA yang akan ditransfer ke sel tanaman. Gen gusA ( beta-glucuronidase) dalam plasmid pCambia 1303 yang berfungsi sebagai gen reporter untuk memonitor proses transformasi dan introduksi gen yang direkayasa.
Selain itu, enzim restriksi NcoI dan SpeI yang digunakan untuk memotong genkitinase dan pCambia 1303 tergolong dalam enzim endonuklease restriksi yang hanya memotong DNA utas ganda pada sekuen tertentu yang disebut sekuen pengenalan atau situs pengenalan (recognition site). Enzim SpeI berasal dari strain E.coli yang diisolasi dari Sphaerotilus dengan situs restriksi 5’A CTAGT3’. Sedangkan enzim NcoI berasal dari strain E.coli yang diisolasi dari Nocardia corallina dengan situs restriksi 5’C CATGG 3’.
Alasan enzim NcoI dan SpeI digunakan pada penelitian ini karena, gen chi akan dimasukkan ke dalam vektor ekspresi (pCambia 1303). Untuk dapat memotong, hal pertama yang harus dilihat adalah restriction map dari pCambia 1303 dan pGEMT-Easy. Enzim-enzim yang ada pada pCambia disesuaikan terlebih dahulu dengan enzim yang ada pada pGEMT-Easy. Pada peta restriksi pCambia 1303, terdapat NcoI dan SpeI tepat dibelakang promotor CaMV35S yang mengekspresikan gen gusA dan gene flourescent protein (gfp) (Gambar 11). Sedangkan pada peta restriksi pGEMT-Easy juga terdapat enzim NcoI dan SpeI (Gambar 4). Jika enzim yang akan digunakan tersebut
M 1
3000 bp
1500 bp 12000 bp 12000 bp
sesuai dengan terdapat pada vektor kloning maupun vektor ekspresi maka enzim tersebut dapat digunakan untuk memotong gen yang diinginkan. Dalam proses restriksi ini juga menggunakan BSA (Bouvine Serum Albumin) yang berfungsi untuk menstabilkan enzim pada restriksi pCambia 1303 dan genkitinase itu sendiri.
Gambar 11 Peta restriksi pCambia 1303 dengan enzim restriksi. Ligasi GenKitinasedengan pCambia 1303 Genkitinase dan pCambia 1303 yang telah dipotong dengan enzim NcoI dan SpeI, kemudian diligasi. Enzim DNA ligase berfungsi menempelkan rantai tunggal pada ujung molekul DNA utas ganda, yang memiliki ujung 5’ dengan gugus fosfat dan yang memiliki ujung 3’ dengan gugus hidroksil. Sifat komplementer hasil restriksi dari enzim restriksi yang sama (atau enzim berbeda yang menghasilkan ujung lancip yang sama) sangat penting untuk menempelkan DNA dari sumber yang berbeda. Enzim ligase memiliki efisiensi lebih tinggi untuk menempelkan ikatan fosfodiester yang putus pada pasangan ujung lancip daripada ujung tumpul (Turneret al. 2000). Skema ligasi gen chi dengan plasmid pCambia 1303 disajikan pada Gambar 12.
Hasil ligasi antara pCambia 1303 dan gen chi kemudian ditransformasi keE.coli strain XL1-Blue. Transformasi merupakan proses memasukkan DNA asing biasanya plasmid, ke dalam suatu organisme. Metode transformasi dilakukan antara lain dengan metode fisika, (injeksi partikel, bombardment, pulsa medan listrik),metode kimia (melarutkan DNA dalam larutan PEG dan penggunaan kejut panas), atau secara biologis (menggunakan vektorE. coli atau Agrobacterium) (Endress 1994). Transformasi ke sel bakteri biasanya dilakukan dengan perlakuan Ca2+ sehingga membuat bakteri tersebut kompeten untuk dimasuki DNA plasmid. (Turneret al. 2000).
Gambar 12 Skema ligasi genchidengan plasmid pCambia 1303.
Transformasi ke E. coli dilakukan untuk memperbanyak jumlah DNA plasmid rekombinan. Sel kemudian disebarkan diatas medium LB agar yang telah ditambahkan dengan kanamisin 25 ppm. Setelah itu diinkubasi semalam pada suhu 37oC. Dalam hal transformasi koloni, seleksi transforman antara genchidengan pCambia 1303 melalui warna koloni yang terbentuk berbeda dengan seleksi transforman antara gen chi pada pGEMT-Easy.
Warna koloni yang terbentuk pada hasil transformasi gen chi dengan pCambia ke dalam sel kompeten hanya menghasilkan satu warna koloni saja, yaitu koloni berwarna putih (Gambar 13). Setelah hasil transformasi menghasilkan warna koloni putih yang mengandung plasmid rekombinan, maka dari koloni yang terbentuk tersebut diduplikat dan dikultur untuk memperbanyak jumlah plasmid rekombinan.
Gambar 13 Contoh transformasi koloni gen chidengan pCambia ke dalam sel kompeten (XL1-Blue).
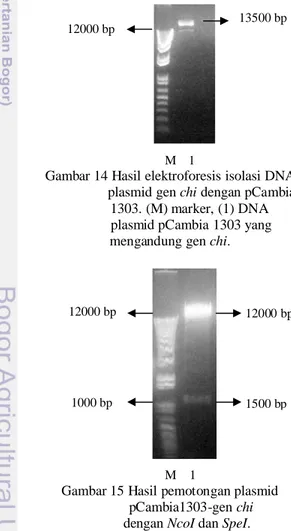
Isolasi DNA Plasmid Rekombinan Hasil isolasi DNA plasmid dielektroforesis pada gel agarosa sehingga menghasilkan
pita-13
pita DNA yang berbeda ukurannya dapat terpisah. Elektroforesis DNA plasmid yang mengandung sisipan gen chi disajikan pada Gambar 14. Berdasarkan hasil isolasi DNA plasmid genchi yang ditransformasi ke dalam sel E.coli menghasilkan satu ukuran yaitu ± 13500 bp. Ukuran ini didapat dari penggabungan ukuran pCambia yaitu 12000 bp dan gen chi itu sendiri yang mempunyai ukuran sekitar 1500 bp.
Tahap selanjutnya, DNA plasmid hasil isolasi dipotong kembali dengan enzim NcoI dan SpeI untuk memeriksa bahwa plasmid tersebut adalah benar pCambia 1303 yang mengandung genchi. Hasil pemotongan DNA kemudian dielektroforesis pada gel agarosa dan disajikan pada Gambar 15. Hasil pemotongan menunjukkan bahwa pita yang terbentuk merupakan plasmid klon pCambia 1303 yang telah disisipi gen chi. Hal ini diperlihatkan dari ukuran pita DNA berukuran 12000 bp yang merupakan ukuran rantai DNA pCambia 1303 setelah dipotong denganNcoI dan SpeI dan pita DNA 1500 bp yang merupakan ukuran dari genchi.
M 1
Gambar 14 Hasil elektroforesis isolasi DNA plasmid genchidengan pCambia
1303. (M) marker, (1) DNA plasmid pCambia 1303 yang
mengandung genchi.
M 1
Gambar 15 Hasil pemotongan plasmid pCambia1303-genchi denganNcoI dan SpeI.
Timbulnya beberapa pita DNA hasil isolasi disebabkan oleh adanya perbedaan konformasi dari plasmid-plasmid tersebut. Pergerakan fragmen DNA pada gel agarosa proporsional terhadap logaritma berat molekul fragmen tersebut. Plasmid yang memiliki putaran (koil) lebih banyak memiliki bentuk yang lebih kompak sehingga lebih mudah melalui pori-pori dalam gel agarosa daripada plasmid yang putarannya lebih sedikit. Sehingga, plasmid yang memiliki putaran lebih banyak lebih cepat jalannya di dalam gel dibanding dengan plasmid yang memiliki putaran lebih sedikit. Faktor penting lain yang berpengaruh adalah kehadiran interkalator. Interkalator yang paling terkenal adalah etidium bromida. Etidium bromida merupakan senyawa polisiklik aromatik bermuatan positif yang akan berikatan dengan DNA yang bermuatan negatif dengan menginsersikan dirinya diantara pasangan basa (interkalasi). Interkalasi menyebabkan DNA heliks melonggar sekitar 26oC. Proses isolasi, elektroforesis dan pewarnaan DNA dengan etidium bromida juga mempengaruhi putaran DNA heliks (Turneret al. 2000).
Isolasi DNA plasmid pada penelitian ini menggunakan High Pure Plasmid Isolation Kit (Roche). Isolasi DNA plasmid dengan menggunakan kit ini, pada prinsipnya sama dengan pemisahan plasmid berdasarkan ukuran. Proses pemisahan plasmid berdasarkan ukurannya dimulai dengan pembuatan ekstrak sel. Jika sel dipecah secara perlahan pada kondisi terkendali hanya sebagian kecil DNA kromosom yang putus, sehingga fragmen DNA kromosom berukuran jauh lebih besar dari ukuran plasmid dapat dipisahkan dari plasmid dengan cara mengendapkan DNA kromosom bersama serpihan sel melalui sentrifugasi. Cara ini dapat meminimalkan kerusakan DNA kromosom dan selanjutnya dari proses sentrifugasi akan menghasilkan larutan jernih yang mengandung DNA yang hampir seluruhnya berupa DNA plasmid.
Prinsip dari elektroforesis gel agarosa yaitu dapat memisahkan DNA linear berdasarkan perbedaan ukuran, melalui migrasi DNA pada sebuah matriks dalam pengaruh medan listrik karena setiap nukleotida dalam sebuah molekul asam nukleat membawa sebuah muatan negatif. Elektroforesis juga bisa digunakan untuk mendeterminasi organisasi molekul plasmid (Turner et al. 2000). Jika gel ditempatkan dalam tangki elektroforesis yang mengandung larutan buffer dan tangki tersebut dialiri arus
12000 bp
1000 bp
12000 bp 13500 bp
1500 bp 12000 bp
listrik, maka molekul DNA yang bermuatan negatif pada pH netral akan bergerak ke arah positif (anode). Kecepatan migrasi DNA dapat ditentukan oleh beberapa faktor, diantaranya ukuran molekul DNA, konsentrasi agarosa, konformasi DNA, voltase yang digunakan, adanya etidium bromida di dalam gel dan komposisi larutan buffer (Muladno 2002).
Transformasi Menggunakan Sel Kompeten Kimia keAgrobacterium tumefaciensStrain
AGLO
Berdasarkan hasil pemotongan pCambia 1303 dan gen chi yang diverifikasi pada agarosa sesuai dengan yang diharapkan, maka tahap selanjutnya adalah transformasi pCambia 1303 yang mengandung gen chike Agrobacterium tumefaciens dengan menggunakan sel kompeten kimia strain AGLO. Transformasi ini telah berhasil dilakukan berdasarkan hasil terbentuknya koloni yang ditunjukkan pada Gambar 16. Transformasi gen kitinase ke dalam Agrobacterium tumefaciens dilakukan dengan pemberian kejut panas (heat shock).
Prinsip utama dari proses tersebut adalah terjadi lonjakan suhu dari 0 oC ke 37 oC terhadap sel. Sehingga pada saat terjadi lonjakan suhu membran menjadi tidak selektif terhadap molekul asing dan produk dapat masuk ke dalam sel. Sel yang telah ditransformasi selanjutnya diinkubasikan dalam medium YEP (yeast ekstrak pepton) dan dikocok selama 3 jam dengan kecepatan 150 rpm, pada suhu 28oC. Pengocokan ini berfungsi memberikan kesempatan bagi sel untuk mengekspresikan gen marka pada plasmid. Setelah itu, sel disebarkan dalam medium selektif yang telah ditambahkan dengan kanamisin 25 ppm dan rifampisin 50 ppm.
Gambar 16 Contoh duplikat koloni hasil transformasi pCambia1303 yang mengandung genchi melaluiAgrobacterium.
Seleksi transforman umumnya berdasarkan oleh adanya marka seleksi yang diselipkan pada plasmid. Marka seleksi itu sendiri merupakan gen yang memberi karakteristik baru pada sel transforman yang tidak dimiliki oleh sel bukan transforman. Dalam transformasi melalui Agrobacterium ini, antibiotik yang digunakan adalah kanamisin dan rifampisin. Kedua antibiotik ini digunakan karena plasmid pCambia 1303 membawa marka seleksi berupa gen resistensi terhadap antibiotik kanamisin sedangkan antibiotik rifampisin digunakan dalam transformasi melalui Agrobacterium ini berfungsi untuk membunuh E. coli agar plasmid rekombinan yang terdapat di dalamE. coli dapat dimasukkan ke dalam Agrobacterium. Dengan demikian, sel yang mengalami transformasi (membawa plasmid pCambia 1303) bersifat resisten terhadap kanamisin maupun rifampisin, sedangkan sel yang tidak mengalami transformasi akan sensitif terhadap kedua antibiotik tersebut. Oleh karena itu, seleksi transforman dapat dilakukan dengan cara menumbuhkan sel yang ditransformasi dalam medium yang mengandung kanamisin dan rifampisin. Sel transforman akan mampu tumbuh dan membentuk koloni sedangkan sel yang bukan transforman akan mati.
Sel perlu waktu cukup untuk menghasilkan enzim dalam jumlah yang cukup untuk menangkal pengaruh antibiotik. Oleh karena itu, setelah proses transformasi sel tidak langsung ditumbuhkan ke dalam medium selektif (mengandung antibiotika) tetapi terlebih dahulu ditumbuhkan dalam medium cair tanpa antibiotika dalam jangka waktu pendek agar replikasi plasmid dan pembentukan enzim dapat berlangsung. Dalam transformasi melalui Agrobacterium ini, setelah disebarkan dalam medium selektif, plasmid pCambia yang mengandung genchi diinkubasi selama 2 hari dalam keadaan kondisi gelap. Hal ini bertujuan untuk menyamakan kondisi tempat tinggal Agrobacterium yang hidup di dalam tanah yaitu dalam keadaan gelap. Sehingga sel transforman dapat bertahan hidup saat ditumbuhkan dalam medium selektif.
Koloni yang positif, kemudian dikultur dalam media yang telah ditambahkan antibiotik. Selanjutnya dilakukan isolasi DNA plasmid dari setiap kultur yang diperoleh. Hasil isolasi plasmid diverifikasi pada gel agarosa (Gambar 14). Untuk mengkonfirmasi kebenaran konstruksi gen chi ke pCambia 1303 melalui Agrobacterium ini, maka perlu
15
dilakukan pemotongan dengan menggunakan enzim restriksi yang sama yaituNcoI danSpeI (Gambar 15) agar dapat diketahui bahwa plasmid pCambia 1303 yang mengandung gen chi telah masuk ke dalamAgrobacterium. Hasil transformasi plasmid pCambia 1303 yang mengandung gen chi selanjutnya akan ditransfer pada tanaman kelapa sawit (kalus sawit) melalui sistem Agrobacterium tumefaciens. Dengan demikian, konstruksi genchi pada vektor ekspresi (pCambia 1303) dapat dimanfaatkan untuk menanggulangi busuk akar pada tanaman kelapa sawit yang disebabkan oleh Ganoderma spp. Sehingga dengan orientasi konstruksi gen ini, gen-gen yang akan disisipkan diharapkan dapat diekspresikan secara terus-menerus sepanjang hidup tanaman kelapa sawit terutama pada bagian perakaran.
Gambar 17 Orientasi konstruksi genchi dengan pCambia 1303.
SIMPULAN DAN SARAN
SimpulanKonstruksi genkitinase(chi) telah berhasil disisipkan ke dalam pCambia 1303. DNA rekombinan yang terkonstruksi dapat dibuktikan dengan isolasi plasmid. Restriksi DNA rekombinan dengan enzim NcoI dan SpeI menghasilkan 2 pita, yaitu pita dengan ukuran 12000 bp yang merupakan ukuran dari pCambia 1303 dan pita dengan ukuran 1500 bp yang merupakan ukuran dari gen chi. Transformasi DNA rekombinan ke dalam Agrobacterium tumefaciens telah berhasil dilakukan dengan menggunakan sel kompeten kimia strain AGLO dengan prinsip kejut panas (heat shock) yang dapat dilihat keberhasilannya dari hasil restriksi dengan enzimNcoI danSpeI.
Saran
DNA rekombinan yang telah berhasil ditransformasikan ke dalam sel Agrobacterium tumefaciens strain AGLO sebaiknya dilanjutkan dengan mengintegrasikan ke dalam sel tanaman. Selanjutnya, untuk mengetahui efektivitas gen kitinase pada Ganoderma sebaiknya dilakukan bioassay ditingkatE.coli.
DAFTAR PUSTAKA
Chaidamsari. 2005. Biotechnology for cocoa pod borer resistance in cocoa [disertasi]. Netherlands: Plant Research International, Wageningen University.
Claveri JM, Notredame C. 2003. Bioinformatics for Dummies. Ed ke-2. New York: Wiley Publishing. Datta K, Nicola ZK, Baisakh N, Oliva N,
Datta K. 2000. Agrobacterium mediated engineering for sheath blight resistance of indica rice cultivars from different ecosystems. Theor Appl Genet 100: 832-839. Doyle K. 1996. Promega Protocol and
Application Guide. Tird Edition. USA: Promega Corporation. hlm. 41-54.
Endress R. 1994. Plant Cell Biotechnology. Berlin: Spriner-Verlag.
Jach G et al. 1995. Enhanced quantitative resistance against fungal disease by combinatorial expression on different barley anti fungal proteins in transgenic tobacco. The Plant J 8: 97-109.
Jusuf M 2001. Genetika I Struktur dan Ekspresi Gen. Jakarta: Infomedika. Kendrew SJ, Lawrence E. 1994. The
Encyclopedia of Molecular Biology. Cambridge: Blackwell Science. Lin W, Anuartha CS, Datta K, Potrykus L,
Muthukrishnan. 1995. Genetic engineering of rice for resistace to sheath blight.Biotechnology 13: 686-691.