Bab II Tinjauan Pustaka
II.1 Biodiesel
II.1.1 Sejarah Biodiesel
Biodiesel adalah bahan bakar mesin diesel yang dibuat dari bahan hayati. Ide untuk menggunakan minyak dari tumbuh-tumbuhan sebagai bahan bakar mesin diesel telah muncul semenjak ratusan tahun yang lalu. Bahkan Rudolf Diesel (pencipta mesin diesel) telah menggunakan minyak tumbuh-tumbuhan dalam melakukan tes terhadap mesin diciptakannya. Salah satu prototipe mesin yang ia peragakan pada “World
Exhibition” di Paris pada tahun 1900 menggunakan minyak yang berasal dari kacang
tanah. Ide ini kemudian menarik minat para peneliti Eropa terutama yang berasal dari negara-negara Eropa yang memiliki daerah koloni yang memiliki prospek cerah bagi pengembangan biodiesel. Hal ini ditandai dengan munculnya berbagai artikel mengenai penggunaan minyak dari tumbuhan-tumbuhan tropis untuk menggerakan mesin di negara-negara seperti Belgia, Perancis, Inggris, serta Jerman. Namun perkembangan ilmu pengetahuan dan teknologi dalam mengeksplorasi serta memanfaatkan bahan bakar fosil jauh lebih pesat. Teknologi yang dikembangkan mampu menekan biaya produksi menjadi relatif rendah bila dibandingkan dengan manfaat yang didapat. Hal ini membuat ketertarikan terhadap biodiesel menjadi meredup. Ketertarikan itu muncul lagi setelah terjadinya perang dunia kedua yang memicu terjadinya krisis minyak bumi di dunia.9
Saat ini, biodesel telah digunakan secara komersial di berbagai negara seperti Austria, Jerman, Perancis, Italia, Spanyol, dan Amerika Serikat. Biodiesel ini digunakan baik dalam bentuk murni maupun dalam bentuk campuran dengan bahan bakar fosil. Biodiesel sebagai alternatif pengganti solar tersebut dimungkinkan karena biodiesel memiliki kemiripan sifat dengan solar. Berikut ini adalah perbandingan sifat fisik dan kimia antara salah satu jenis biodiesel dengan solar.
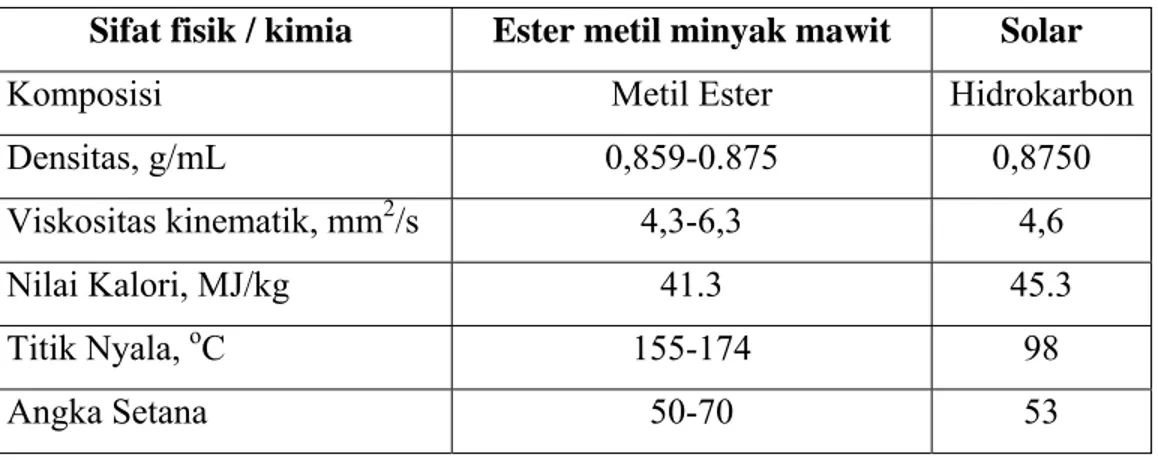
Tabel II.1 Perbandingan sifat ester metil minyak sawit dengan solar3
Sifat fisik / kimia Ester metil minyak mawit Solar
Komposisi Metil Ester Hidrokarbon
Densitas, g/mL 0,859-0.875 0,8750 Viskositas kinematik, mm2/s 4,3-6,3 4,6 Nilai Kalori, MJ/kg 41.3 45.3 Titik Nyala, oC 155-174 98 Angka Setana 50-70 53
Beberapa keuntungan pemanfaatan biodiesel sebagai energi alternatif pengganti solar, antara lain:
• Biodiesel merupakan bahan bakar yang dapat diperbaharui. • Biodiesel menghasilkan gas buang yang ramah lingkungan.
• Biodiesel dapat dicampurkan dengan solar dalam berbagai komposisi.
• Biodisel mengandung oksigen, sehingga kebutuhan udara untuk pembakaran sempurna lebih sedikit; emisi CO lebih kecil.
Disamping kelebihan tersebut, terdapat pula kelemahan biodiesel, antara lain titik nyala (flash point)nya yang sangat tinggi. Tingginya flash point tersebut dapat menyebabkan terjadinya polimerisasi termal atau oksidatif yang lama kelamaan dapat menimbulkan kerusakan mesin. Akan tetapi, tingginya harga minyak bumi akibat tingginya kebutuhan serta kesadaran untuk menjaga ekologi membuat para ahli di berbagai dunia terus-menerus berupaya untuk mengembangkan penelitian tentang biodiesel, termasuk di Indonesia yang kaya akan sumber-sumber biodiesel.
II.1.2 Sintesis Biodiesel
Biodiesel dapat disintesis dari berbagai macam material hayati, seperti minyak sawit (palm oil), minyak kelapa, minyak jarak pagar, minyak biji kapok randu dan sebagaiya.
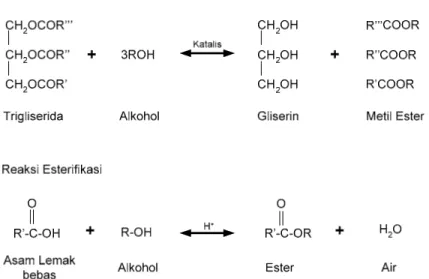
Di Indonesia saja terdapat lebih dari 30 macam tumbuhan yang potensial untuk dijadikan bahan mentah pembuat biodiesel ini. Biodiesel dihasilkan melalui dua jalur reaksi, yaitu esterifikasi dan transesterifikasi seperti yang ditunjukan oleh Gambar II.1.
Gambar II.1 Reaksi transesterifikasi dan esterifikasi pada sintesis biodisel9
Secara umum biodiesel dibuat dengan cara mereaksikan senyawa trigliserida dengan alkohol yang akan menghasilkan metil ester (biodiesel) dan senyawa samping gliserin. Oleh karena produk yang dihasilkan, metil ester dan gliserin, mempunyai densitas yang berbeda, kedua produk dapat dipisahkan. Metil ester kemudian dimurnikan agar sesuai dengan standar yang ada.
Crude Palm Oil (CPO) biasanya mengandung sekitar 5 % asam lemak bebas (Free Fatty Acid). Adanya asam lemak bebas dalam reaktan akan mengurangi kinerja
katalis.12 Hal ini menyebabkan produksi biodiesel menjadi tidak ekonomis. Oleh karena
itu asam lemak bebas tersebut harus dipisahkan terlebih dahulu sebelum transesterifikasi. Asam lemak dapat dipisahkan dengan reaksi esterifikasi dengan menggunakan katalis asam menghasilkan metil ester. Dengan adanya dua tahap ini akan meningkatkan perolehan dari metil ester.
II.1.3 Katalis Heterogen untuk Sintesis Biodiesel
Selama ini sintesis biodiesel diselenggarakan dengan menggunakan katalis homogen. Katalis asam yang biasa digunakan adalah H2SO4, sedangkan katalis basa yang biasa
digunakan adalah KOH dan NaOH. Kelemahan katalis homogen ini adalah asam atau basa kuat yang dipakai memiliki wujud yang sama dengan wujud reaktan dan produknya, sehingga untuk mendapatkan produk murni diperlukan tahap pemisahan yang memperbesar biaya produksi. Kelemahan lainnya adalah katalis homogen hanya dapat digunakan sekali pakai.
Katalis ezimatis juga telah dikembangkan. Enzim yang dapat digunakan sebagai katalis pembuatan metil ester adalah enzim lipase yang berasal dari mikroorganisme. Katalis enzim cocok digunakan pada bahan baku minyak yang banyak mengandung asam lemak bebas. Katalis ini memungkinkan pembuatan biodiesel dengan hanya satu tahap. Keunggulan lain dari enzim adalah kondisi operasinya sedang, tahap pemisahan produk lebih mudah, dan gliserin yang dihasilkan lebih murni. Namun penggunaan enzim sebagai katalis mempunyai beberapa kelemahan, yaitu waktu reaksi yang panjang, konsentrasi katalis tinggi, dan harga enzim yang mahal.
Oleh karena itu dikembangkan alternatif lain yaitu penggunaan katalis heterogen. Karena wujud katalis dan produk berbeda maka sangat mudah memisahkan produk dengan katalis setelah akhir reaksi. Keuntungan lain dari katalis heterogen adalah keaktifannya yang tinggi dan bisa dipakai berulang kali, dan usia pakai (lifetime) katalis lebih panjang. Katalis heterogen juga memudahkan dalam penanganan dan penyimpanan. Contoh katalis basa heterogen yang dapat digunakan sebagai katalis pembuatan biodiesel antara lain : CaCO3, K2O, CaO, MgO, Na2CO3, NaHCO3, dan
logam alkali lainnya. Contoh katalis asam heterogen adalah resin penukar ion logam – logam transisi, silika dan zeolit.9
II.2 Lempung Sebagai Katalis Asam Heterogen II.2.1 Klasifikasi Lempung dan Penggunaannya
Mineral lempung (clay) sangat umum digunakan dalam industri keramik. Mineral lempung merupakan penyusun batuan sedimen dan penyusun utama dari tanah. Lempung memiliki ukuran diameter partikel < 2 μm dan dapat ditemukan dekat permukaan bumi.. Pembentukan lempung terjadi akibat pelapukan batuan feldspar yang terpaparkan ke atmosfer. Hasil pelapukan tersebut bisa tetap berada di sekitar batuan asal (lempung primer) atau tersedimentasi di tempat-tempat yang jauh dari asal (lempung sekunder). Jenis lempung yang penting untuk industri adalah yang terbentuk melalui proses sedimentasi yaitu lempung sekunder. Lempung sekunder tersebut memiliki ukuran partikel yang lebih halus dan lebih homogen dengan struktur kristal yang membentuk lembaran-lembaran serta memiliki plastisitas yang baik.
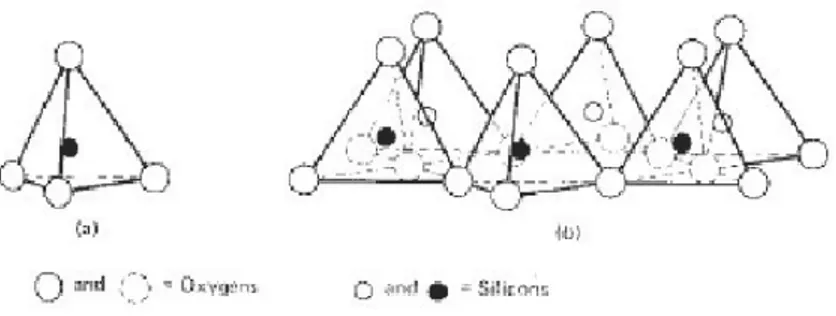
Lempung terdiri dari dua struktur lapisan dasar yaitu silika dan alumina. Lapisan silika memiliki rumus molekul (Si4O10)4-. Lapisan ini terbentuk dari satu atom silikon (Si)
yang membentuk struktur tetrahedral dengan empat atom oksigen (O2-) atau hidroksi (OH). Atom silikon berada di pusat tetrahedral. Jarak antara atom – atom oksigen adalah sama.
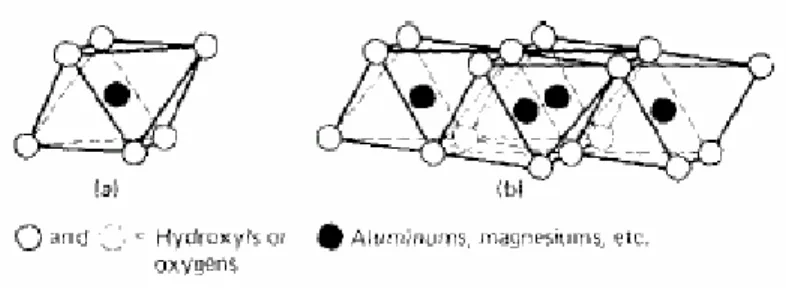
Gambar II.3 Struktur kristal alumina
Lapisan alumina memiliki rumus molekul Al2(OH)6 dan ini biasa disebut gibbsite.
Struktur ini tersusun satu atom alumunium dan enam atom oksigen yang membentuk struktur oktahedral. Atom alumunium dapat digantikan oleh atom magnesium membentuk struktur dengan nama brucite, Mg3(OH)6.
Berdasarkan struktur dan komposisi kimia, lempung dapat dibagi menjadi tiga kelas utama, yaitu kandite, smectite dan illite.
a. Kandite
Kandite adalah jenis mineral lempung yang mempunyai struktur susunan lapisan kristal
T-O (tetrahedral–oktahedral) dengan lapisan oktaheral seperti struktur gibbsite. Lapisan tersebut bermuatan netral, oleh karena itu ikatan antar lapisannya merupakan ikatan van
der Waals yang lemah. Jenis lempung yang berasal dari golongan kandite adalah
kaolinite, anauxite, dickite, dan nacrite.
Gambar II.4 Struktur molekul kandite
Kaolinite terbentuk dari perubahan hidrotermal dari mineral–mineral aluminosilikat. Batuan granit merupakan sumber terbesar penghasil kaolinite. Dalam pembentukannya, ion-ion seperti Na+, K+, Mg2+, dan Ca2+ disingkirkan terlebih dahulu melalui proses pertukaran ion dengan kondisi pH yang rendah. Sifat dari kaolinite adalah tidak dapat
mengadsorpi air, sehingga kaolinite tidak dapat mengembang pada saat kontak dengan air. Oleh karena itu kaolinite banyak digunakan dalam industri keramik.
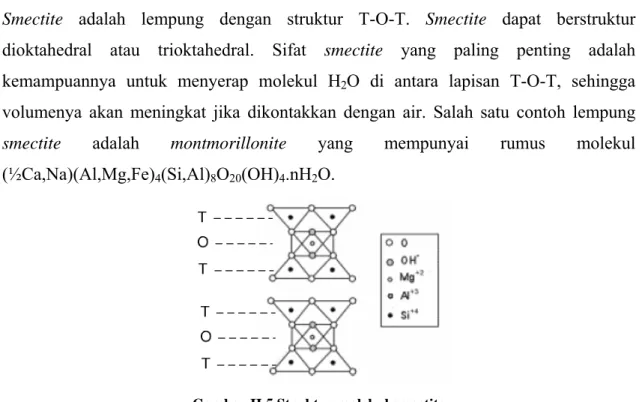
b. Smectite
Smectite adalah lempung dengan struktur T-O-T. Smectite dapat berstruktur
dioktahedral atau trioktahedral. Sifat smectite yang paling penting adalah kemampuannya untuk menyerap molekul H2O di antara lapisan T-O-T, sehingga
volumenya akan meningkat jika dikontakkan dengan air. Salah satu contoh lempung
smectite adalah montmorillonite yang mempunyai rumus molekul
(½Ca,Na)(Al,Mg,Fe)4(Si,Al)8O20(OH)4.nH2O.
Gambar II.5 Struktur molekul smectite
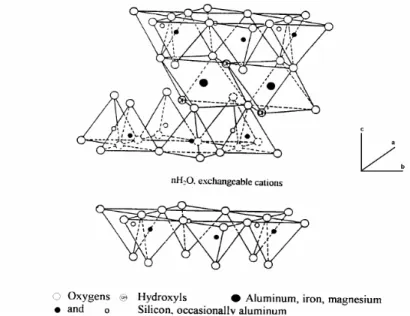
Montmorillonite merupakan unsur utama dari bentonite. Montmorillonite terbentuk
karena adanya perubahan bentuk dari abu vulkanik yang disebabkan oleh perubahan cuaca. Montmorillonite dapat mengembang sampai beberapa kali dari volume awalnya ketika kontak dengan air. Montmorillonite paling banyak dipelajari karena kapasitas pertukaran kation yang relatif lebih besar dibandingkan dengan lempung jenis lain
Lapisan interlayer montmorillonite biasanya mengandung ion Na+, Ca2+ dan Mg2+. Ketika lempung ini kering, kation – kation ini berada dalam struktur heksagonal pada unit silika. Namun bila dikontakkan dengan air, ion-ion tersebut dapat tergantikan oleh ion-ion baik logam maupun nonlogam seperti H3O+, HN4+, Al3+, Fe3+, R4N+, R4P+ dsb.
(Nagendrappa, 2002). Sifat inilah yang menyebabkan lempung dapat berfungsi sebagai katalis.
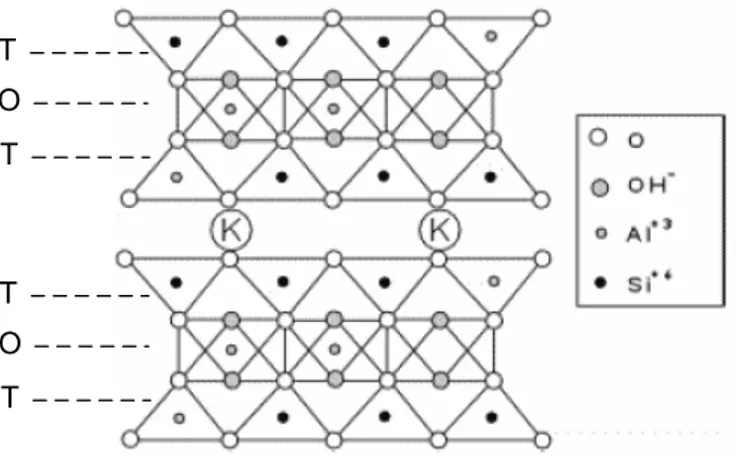
c. Illite
Illite mempunyai rumus molekul (Si8-y,Aly)O20(OH)4 dengan harga y antara 1-1,5. Illite
mempunyai struktur dasar yang mirip dengan batuan pembentuk mineral mika. Illite merupakan lapisan silikat 2:1 dengan lapisan dasarnya terdiri dari dua lapisan silikat dengan alumina yang membentuk oktahedral.
T O T T O T
Gambar II.6 Struktur molekul illite
Untuk menjaga keseimbangan struktur, ion Ca2+ dan Mg2+ dapat menggantikan ion K. Lapisan dalam kation K, Ca dan Mg dapat mencegah air masuk ke dalam struktur. Oleh karena itu, illite merupakan jenis lempung yang tidak mengembang (non-expanding
clay). Illite terbentuk dari perubahan dari batuan kaya K dan Al. Illite merupakan unsur
utama pembentuk batuan mudrock dan shale.
Lempung merupakan mineral yang mempunyai banyak kegunaan dan aplikasi, tidak hanya sebagai bahan keramik, bahan bangunan, bahan pelapisan kertas, atau bahan farmasi saja. Penggunaan lempung telah mengalami pengembangan. Saat ini lempung juga banyak digunakan sebagai adsorben, penyangga katalis, penukar ion. Aplikasi lempung tersebut berhubungan dengan karakteristik yang dimilikinya.
II.2.2 Karakteristik Lempung
Lempung bersifat lengket dan mudah dibentuk saat lembab, tetapi keras dan kohesif saat kering. Lempung memiliki kemampuan untuk menyerap ion dari suatu larutan dan melepaskan ion tersebut bila kondisinya berubah. Molekul air sangat tertarik pada permukaan mineral lempung. Oleh karena itu, ketika sedikit lempung ditambahkan ke dalam air maka akan terbentuk slurry karena lempung mendistribusikan dirinya sendiri ke dalam air. Campuran lempung dalam jumlah besar dan sedikit air akan menghasilkan lumpur yang dapat dibentuk dan dikeringkan untuk menghasilkan bahan yang keras dan padat.
Penggunaan lempung sebagai katalis disebabkan oleh keistimewaan struktur lempung, yaitu ukuran porinya yang besar serta kemampuannya untuk menyerap anion atau kation. Kation atau anion yang terserap menggantikan anion atau kation yang ada dalam lempung. Reaksi pertukaran ion ini adalah reaksi yang stoikiometrik. Ion yang diserap terkekang di sekeliling unit silika–alumina dan reaksi pertukaran ini tidak mempengaruhi struktur alumina-silika. Kapasitas pertukaran (exchange capacity) dinyatakan dalam milliequivalent per gram atau per 100 gram. Kation yang dapat dipertukarkan antara lain kalsium, magnesium, hidrogen, kalium, amonium dan natrium. Sedangkan untuk anion antara lain sulfat, klorin, fosfat dan nitrat.
II.2.3 Pengaktifan Lempung
Secara umum, aktivitas lempung dapat ditingkatkan melalui beberapa perlakuan, yaitu • Secara fisik, yaitu memperkecil ukuran partikel lempung sehingga dapat
memperbesar luas permukannnya
• Secara termal, yaitu mengubah komposisi kimia dan atau kristalinitas struktur melalui efek temperatur ( misalnya pengeringan dan kalsinasi) • Secara kimia, dalam hal ini dibatasi pada prinsip pertukaran ion, dengan
demikian tidak termasuk mengubah struktur mineral lempung secara kimia • Pillarisasi, yaitu mengubah struktur mineral lempung secara fisik dan kimia
menciptakan ruang yang dapat mengadsorbsi ion-ion tertentu secara spesifik (meningkatkan selektifitas)
Dalam prakteknya, suatu metode pengaktifan sering kali mencakup beberapa perlakuan sekaligus. Pada penelitian ini, dilakukan dua metode pengaktifan lempung yaitu metode pengasaman dan metode pilarisasi. Baik pada proses pengasaman maupun pilarisasi, lempung melewati tahap perlakuan fisik yaitu dengan memperkecil ukuran partikel hingga sebesar 230 mesh, maupun perlakuan termal yaitu pengeringan yang dilanjutkan dengan kalsinasi.
II.2.3.1. Metode Pengasaman
Walaupun lempung secara alami memiliki sifat asam, tetapi kemampuan lempung alam sebagai katalis suatu reaksi masih rendah. Pengaktifan dengan asam adalah salah satu cara alternatif untuk meningkatkan keasaman lempung yang dengan sendirinya akan meningkatkan aktifitas katalitiknya. Pada metode ini, lempung direndam dengan larutan asam seperti asam sulfat, nitrat atau asam klorida selama jangka waktu tertentu dan pada suhu tertentu pula. Pada penelitian ini digunakan asam sulfat. Kontak dengan asam ini menyebabkan pelucutan ion aluminium, magnesium dan besi dari lapisan oktahedral, ion aluminium pada lapisan tetrahedral. Selain itu, kation-kation yang mudah tergantikan (exchangeable cations) pada lapisan interlayer yang umumnya ditempati oleh ion Na+, Ca+2 atau Mg+2 akan digantikan oleh ion H+.Bagian ujung dari lapisan sandwich tersebut mengalami swelling sehingga membuka dan memisah satu sama lain (mengalami delaminasi), sedangkan bagian tengahnya tetap terekat. Pengaktifan dengan asam ini mengakibatkan peningkatan luas permukaan dan diameter pori secara signifikan.. Selain meningkatkan keasaman dari lempung, proses pengaktifan dengan asam juga dapat menghilangkan pengotor-pengotor yang ada di dalam lempung alam seperti calcite.2,7
Gambar II.7 Struktur ruang montmorillonite
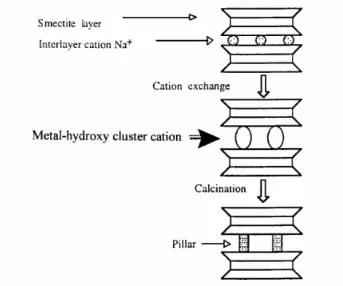
II.2.3.2. Metode Pilarisasi
Lempung juga dapat diaktifkan dengan penambahan ion-ion logam-logam asam seperti Al, Ti dan Cr dan sebagainya.15 Pengakitfan dengan logam asam dilakukan melalui
proses pilarisasi. Proses ini bertujuan untuk memperbesar ukuran pori lempung. Pada dasarnya pilarisasi adalah penggantian ion-ion yang ada di lapisan interlayer dari lempung dengan polikation yang lebih besar besar dengan muatan positif tinggi yang apabila telah melewati tahap pengeringan akan membentuk pilar-pilar “metal oxide
cluster” yang secara permanen membatasi lapisan sandwich satu dengan yang lainnya
dan menciptakan pori-pori yang lebih mantap. Salah satu contoh polikation yang digunakan sebagai pilar adalah [Al13O4(OH)24(H2O))12]7+ atau yang dikenal dengan
Secara umum proses tersebut dapat digambarkan sebagai berikut:
Gambar II.8 Tahapan proses pilarisasi 2
Struktur lempung terpilarisasi ditampilkan pada gambar berikut:
Gambar II.9 Struktur skematik lempung terpilarisasi
Ukuran pori, tipe, kekuatan pusat asam, dan kestabilan termal sebuah lempung terpilarisasi bergantung kepada jenis atom pilar yang digunakan. Ada beberapa jenis logam besar yang sudah biasa digunakan sebagai pilar, antara lain : Al, Fe, Ti, La, Ce, Cr, Zr ataupun Ga, yang menghasilkan lempung terpilarisasi dengan karakteristik sifat yang berbeda-beda. Contohnya: Ti-PILC mempunyai pori yang besar, Zr-PILC
Ket. gambar: A = lapisan lempung; B = permukaan internal; C = cross linking unit (pilar); D = ruang antar lapisan; E = jarak antar pilar; F = gugus fungsi
(montmorillonite) kaya akan pusat asam Bronsted dan meningkatkan kestabilan termal, sedangkan Al-PILC (montmorillonite) kaya akan pusat asam Lewis. Dari semua jenis pilar yang telah diteliti, logam yang paling umum digunakan adalah Al, karena Al tergolong mudah didapatkan, relatif murah dan metode pembuatannya telah mapan.15
Untuk jenis lempung terpilarisasi tertentu, ukuran pori dan distribusinya, serta kestabilan termalnya juga bergantung kepada metode pelaksanaan pilarisasi. Selain itu, metode pengeringan dan kalsinasi diduga berpengaruh terhadap porositas sampel yang telah diinterkalasi. Pada tahap pertukaran ion (pilarisasi), distribusi yang seragam akan dapat dihasilkan bila proses pertukaran ionnya berjalan lambat. Ini terjadi karena adanya persaingan antara kation bermuatan tinggi antar lapisan yang telah lebih dulu ada dengan kation pilar. Ukuran pori suatu lempung terpilarisasi ditentukan oleh jarak antar lapisan dan jarak antar pilar atau densitas pilar. Jarak antar lapisan sendiri bergantung kepada jenis pilar yang digunakan, sedangkan jarak antar pilar bergantung kepada densitas muatan dalam lapisan lempung.
II.2.4 Karakterisasi Katalis Berbasis Lempung II.2.4.1 Analisis Luas Permukaan Katalis
Luas permukaan spesifik adalah luas permukaan suatu material per massa material tersebut. Metode untuk menghitung luas permukaan adalah dengan adsorpsi gas nitrogen. Pada dasarnya, metode ini menentukan kuantitas gas yang diperlukan untuk menutupi secara sempurna permukaan dari berat bubuk sampel. Jika kuantitas gas - dalam mol per gram bubuk adalah qo - luas permukaan spesifik dapat dirumuskan
sebagai berikut
Sw=qoNAo... (1)
N = bilangan Avogadro (6,02x1023)
Ketika mol gas yang teradsorpsi per gram padatan, q, diplot dengan tekanan kesetimbangan, P, untuk temperatur konstan, isoterm adsorpsi dapat diperoleh. Untuk tujuan ini persamaan Langmuir sering digunakan dalam bentuk
) 1 ( 1 0 P a q q P + = ... (2) dimana a = konstanta
Slope dari kurva P / q vs P sama dengan 1/qo. Langmuir mengasumsikan bahwa
adsorpsi hanya terjadi pada satu lapis saja.Brunauer, Emmett, dan Teller menurunkan persamaan umum yang mempertimbangkan pembentukan film yang tebalnya lebih dari satu molekul. Persamaan ini, yang dikenal sebagai persamaan BET, dapat ditulis:
1 0 0 1 0 1 0 c 1 1 = + . ( ) c c P P q P P q q P − − ... (3) P0 = tekanan uap jenuh
c1 = konstanta yang berhubungan dengan panas adsorpsi
Ketika P / q (Po-P) diplot dengan P / Po, garis lurus akan diperoleh dengan slope (c1-1) /
qoc1. Karena c1 relatif besar dibanding 1 untuk isotherm ini, maka slope mendekati 1/qo,
hingga qo dapat dicari.
II.2.4.2 Analisis X Ray Diffraction
Sinar X memiliki panjang gelombang pada skala Angstrom (Å) yang energinya cukup untuk mempenetrasi suatu padatan sehingga dapat digunakan untuk menyelidiki struktur internal padatan tersebut. Sinar X dapat berinteraksi dengan elektron-elektron suatu atom. Ketika foton sinar X bertumbukan dengan elektron-elektron tersebut, beberapa foton dari sinar datang tersebut akan dibelokkan jauh menyimpang dari arah datangnya. Jika panjang gelombang sinar yang dihamburkan tersebut tidak berubah terhadap sinar mula-mula, proses ini disebut hamburan elastis. Sinar X yang dihamburkan ini membawa informasi tentang distribusi elektron dalam material. Prinsip inilah yang dipakai dalam analisis dengan menggunakan metode XRD. Metode
ini dipakai dalam penentuan derajat kristalinitas. Difraksi sinar X digunakan untuk mengidentifikasi fasa ruah, parameter unit sel, dan untuk memperkirakan ukuran partikel.
Pada XRD, sinar X dihasilkan dengan cara menembakkan suatu logam target (umumnya tembaga) dengan elektron berenergi tinggi didalam suatu tabung vakum. Sinar X yang diperoleh kemudian diarahkan ke permukaan kristal padatan. Kristal tersebut diputar sehingga sinar X yang mengenainya dapat diarahkan ke berbagai dengan sumbu kristalografinya. Sinar X tersebut akan didifraksikan oleh atom-atom yang berada pada kisi periodik. Sinar-sinar hamburan yng memiliki fase yang sama akan berinterferensi saling menguatkan. Detektor kemudian merekam pola sinar yang didifraksikan sehingga diperoleh pola difraksi sinar X dari sampel. Jarak antar kisi kristal (d) dapat dihitung dengan menggunakan persamaan Bragg
nλ=2d sin θ ... (4) dimana λ panjang gelombang difraksi
θ adalah sudut antara garis normal dengan arah sinar difraksi n = 1,2,…
Pola difraksi sinar X dari suatu sampel padatan diperoleh dari suatu sumber sinar X yang tetap (biasanya Cu Kα) dan sebuah detektor bergerak yang menangkap intensitas radiasi sinar yang didifraksikan oleh padatan tersebut sebagai fungsi sudut 2 teta (sudut antara sinar datang dan sinar difraksi).
II.2.4.3 Scanning Electron Microscopy (SEM)
SEM digunakan untuk melihat topologi dan morfologi suatu serbuk padatan Mikroskop elektron adalah suatu instrumen yang menggunakan pancaran elektron berenergi tinggi sehingga memperbesar gambar dari sutu partikel yang sangat kecil. Penembak elektron memancarkan sinar elektron berenergi tinggi yang berjalan melewati serangkaian lensa magnetik yang memfokuskan elektron pada suatu titik pada sampel. Interaksi kemudian terjadi di dalam sampel yang mengalami radiasi. Sinar
elektron yang datang akan berinteraksi dengan sampel secara tidak elastis yang menyebabkan terjadinya ionisasi elektron yang terdapat pada atom sampel. Elektron-elektron yang terionisasi dari atom sampel in disebut Elektron-elektron-Elektron-elektron sekunder. Detektor akan mendeteksi baik elektron-elektron sekunder maupun “back scattered
electron” sebagai fungsi posisi dari pancaran elektron primer (yang berasal dari
sumber). Elektron-elektron sekunder memiliki energi yang rendah (10-50 eV) dan berasal dari daerah permukaan sampel, sedangkan back scattered electron berasal dari bagian yang lebih dalam dan mengandung informasi mengenai komposisi sampel, karena elemen yang lebih berat akan menghamburkan elektron dengan lebih efisien sehingga menghasilkan gambar yang lebih jelas.
II.2.4.4 Kekuatan Asam Katalis
Keasaman suatu katalis berhubungan erat dengan keaktifannya sebagai katalis asam. Keasaman katalis dapat ditentukan dengan metode titrasi. Katalis lempung dicampurkan dengan larutan basa seperti NaOH dengan konsentrasi tertentu. Larutan basa akan menetralkan sifat asam dari katalis lempung. Setelah pencampuran, larutan tersebut dititrasi dengan sejumlah asam sampai titik akhir titrasi yang dapat dilihat melalui perubahan warna indikator. Keasaman katalis lempung sebanding dengan jumlah mol basa yang dapat menetralkan sifat asam dari lempung tersebut. Dengan kata lain, keasaman katalis dapat dihitung sebagai selisih antara jumlah mol basa sebelum pencampuran dikurangi jumlah mol basa setelah pencampuran.
II.2.4.5 Uji Aktifitas Katalis
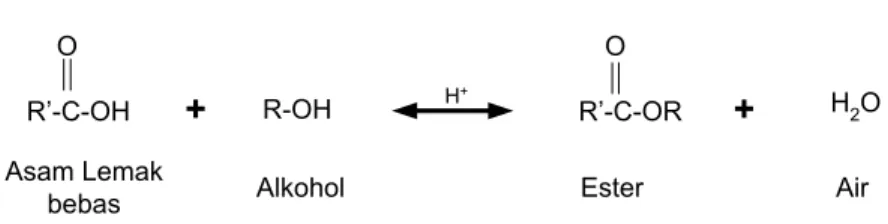
Uji aktifitas katalis dilakukan dengan melibatkan katalis pada reaksi esterifikasi asam lemak bebas dengan metanol berlebih. Proses esterifikasi merupakan salah satu proses pembuatan biodiesel dengan bahan baku asam lemak bebas. Asam lemak bebas yang digunakan dalam penelitian ini adalah PFAD atau Palm Fatty Acid Distillate. PFAD terdiri dari campuran asam stearat, asam laurat dan asam palmitat. PFAD direaksikan dengan metanol yang akan menghasilkan metil ester (biodiesel) dan produk samping air.
Reaksi Esterifikasi Air Ester Alkohol Asam Lemak bebas O R’-C-OH O R’-C-OR + H2O + R-OH H+
Gambar II.10 Reaksi esterifikasi asam lemak bebas
Aktifitas katalis tersebut dinyatakan sebagai derajat konversi asam lemak bebas. Konversi asam lemak bebas ditentukan melalui persamaan berikut :
Konversi (X) Angka asam awal - Angka asam akhir Angka asam awal
= ...(5)
Angka asam dari asam lemak ditentukan melalui proses titrsi sejumlah larutan asam lemak dalam campuran etanol 95% - dietil eter 50:50 dengan titran yaitu larutan 0,1 N KOH dalam etanol.