LAPORAN AKHIR PRAKTIKUM KIMIA ANALISIS PENETAPAN KADAR FORMALIN DENGAN METODE
SPEKTROFOTOMERI VISIBLE
OLEH : KELOMPOK 7 GOLONGAN III
NI LUH GEDE TIARA YANTI (1108505049)
PUTU EKA MASMITHA UTAMI DEWI (1208505096)
I GDE PASEK PADMANABA (1208505097)
M. AVERIL PRIMA PUTRA RASHID (1208505098)
JURUSAN FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA
1
PENETAPAN KADAR FORMALIN DENGAN METODE SPEKTROFOTOMETRI VISIBEL
I. TUJUAN
Menetapkan kadar formalin dengan metode spektrofotometri visibel
II. DASAR TEORI
2.1 Formalin
Gambar 1. Struktur Kimia Formalin(OECD SIDS, 2002)
Formalin merupakan larutan yang terdiri atas 37% formaldehid dalam air. Menurut Farmakope Indonesia Edisi 3, kadar formaldehid tidak kurang dari 34,0% dan tidak lebih dari 38,0% dan dapat dicampur dengan air dan dengan etanol (95%) P. Pemeriannya berupa cairan jernih, tidak berwarna atau hampir tidak berwarna; bau menusuk, uap merangsang selaput lendir hidung dan tenggorokan. Jika disimpan di tempat dingin dapat menjadi keruh. Formalin dapat dicampur dengan air dan dengan etanol (95%) P (Depkes RI, 1979).
Formalin adalah nama dagang larutan formaldehid dalam air dengan kadar 35-40%. Formalin biasanya mengandung golongan alkohol (metanol) sebanyak 10-15% yang berfungsi sebagai stabilisator supaya formaldehidnya tidak mengalami polimerasi. Formalin merupakan bahan pembunuh hama atau desinfektan, bahan pengawet mayat, menurut BPOM kadar formalin dalam makanan adalah sekitar 1,88-413,89 ppm (mg/kg) (Sudjarwo dkk., 2013).
Berbagai metode untuk identifikasi formaldehid/formalin telah diusulkan. Metode spektrofotometri telah digunakan secara luas untuk determinasi dari formaldehid. Sebagian besar dari metode ini berdasarkan reaksi dari formaldehid dengan reagen organik dan/atau reagen anorganik,seperti reagen Schiff,
2 pararosanilin, p-fenilendiamin, asam kromotropat, p-aminoazobenzen, brilliant
cresyl blue-bromate, dan malachite green-sulfite (Li et al, 2007)
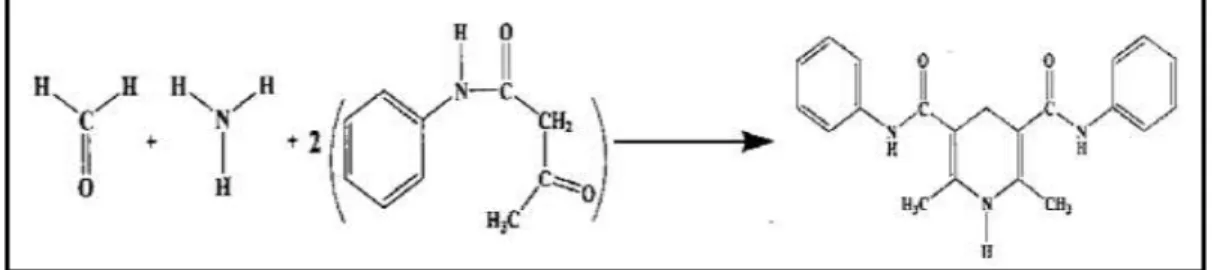
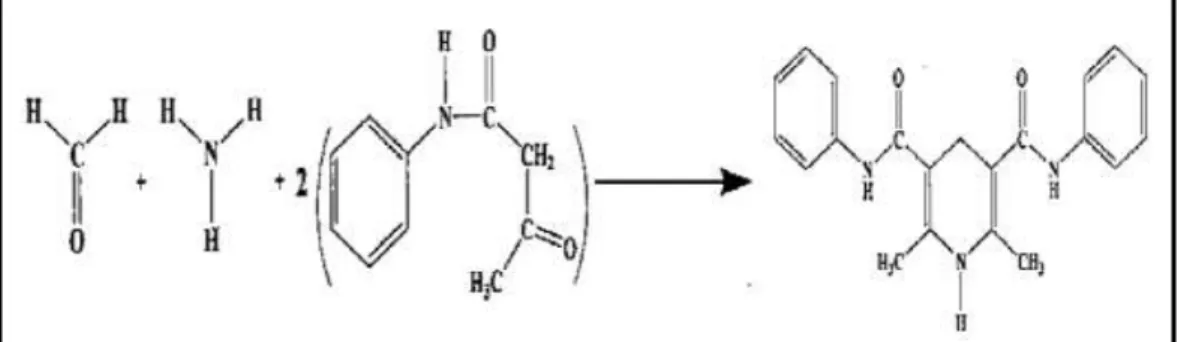
Nash (1953) memperkenalkan metode kolorimetri kedalam analisis kimia untuk HCHO (formaldehid). Metode ini berdasarkan pada reaksi Hantzsch (gambar 2) dari formaldehid dengan asetilaseton atau 2,4-pentanadion dalam ammonia (Li et al, 2007). Ketika formaldehid ditambahkan ke dalam larutan netral dari asetilaseton dan garam ammonium, warna kuning perlahan-lahan terbentuk yang memperlihatkan terjadinya sintesis dari diasetilhidrolutidin (DDL) (Nash, 1953). DDL memiliki serapan maksimum pada panjang gelombang 412 nm (Salem et al, 2010).
Gambar 2. Reaksi Formalin dengan Reagen Nash (Li et al, 2007).
2.2 Spektrofotometri UV-Vis
Spektroskopi didefinisikan sebagai interaksi antara radiasi elektromagnetik (REM) dengan sampel. Jika panjang gelombang REM yang digunakan bersesuaian dengan panjang gelombang ultraviolet-visibel maka disebut dengan spektroskopi ultraviolet-visibel yang biasa disingkat dengan UV-vis. Radiasi elektromagnetik atau cahaya merupakan suatu bentuk energi yang tingkah lakunya digambarkan dengan sifat-sifat gelombang dan partikel. Sifat-sifat optis radiasi elektromagnetik seperti difraksi paling sesuai dijelaskan dengan menggambarkan
cahaya sebagai suatu gelombang. Beberapa interaksi antara radiasi
elektromagnetik dengan materi seperti absorpsi dan emisi dapat disebut dengan memperlakukan cahaya sebagai suatu partikel (Gandjar dan Rohman, 2012).
3 Pada umumnya terdapat dua tipe instrumen spektrofotometer uv-vis, yaitu single-beam dan double-beam.
a. Single-beam instrument
Single-beam instrument dapat digunakan untuk kuantitatif dengan
mengukur absorbansi pada panjang gelombang tunggal. Single-beam
instrument mempunyai beberapa keuntungan yaitu sederhana, harganya
murah, dan mengurangi biaya yang ada merupakan keuntungan yang nyata. Beberapa instrumen menghasilkan single-beam instrument untuk pengukuran sinar ultra violet dan sinar tampak. Panjang gelombang paling rendah adalah 190 sampai 210 nm dan paling tinggi adalah 800 sampai 1000 nm (Skoog, 1996).
b. Double-beam instrument
Double-beam dibuat untuk digunakan pada panjang gelombang 190
sampai 750 nm. Double-beaminstrument dimana mempunyai dua sinar yang dibentuk oleh potongan cermin yang berbentuk V yang disebut pemecah sinar. Sinar pertama melewati larutan blangko dan sinar kedua secara serentak melewati sampel, mencocokkan fotodetektor yang keluar menjelaskan perbandingan yang ditetapkan secara elektronik dan ditunjukkan oleh alat pembaca (Skoog,1996).
Hukum Lambert Beer menyatakan bahwa, bila cahaya monokromatik melewati medium tembus cahaya, laju berkurangnya intensitas oleh bertambahnya ketebalan, berbanding lurus dengan intensitas cahaya. Hal ini berarti bahwa intensitas cahaya yang dipancarkan berkurang secara eksponensial dengan bertambahnya ketebalan medium yang menyerap. Dengan menyatakan bahwa lapisan manapun dari medium itu yang tebalnya sama akan menyerap cahaya masuk dengan fraksi yang sama (Bassett et al., 1994).
Hukum Lambert Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan.
4 Dimana :
A = Absorbansi dari sampel yang akan diukur T = Transmitansi
Io = Intensitas sinar masuk
It = Intensitas sinar yang diteruskan ε = Koefisien ekstingsi
b = Tebal kuvet yang digunakan C = Konsentrasi dari sampel
(Gandjar dan Rohman, 2007). Dalam Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan. Dalam Hukum Lambert – Beer tersebut ada beberapa pembatasan yaitu :
- Sinar yang digunakan dianggap monokromatis.
- Penyerapan terjadi dalam suatu volume yang mempunyai penampang luas yang sama.
- Senyawa yang diserap dalam larutan tersebut tidak tergantung terhadap yang lain dalam larutan tersebut.
- Tidak terjadi peristiwa fluoresensi atau fosforesensi. - Indeks bias tidak tergantung pada konsentrasi larutan.
(Gandjar dan Rohman, 2012)
Berikut adalah hal-hal yang harus diperhatikan dalam analisis
spektrofotometri UV-Vis yaitu :
a. Pembentukan molekul yang dapat menyerap sinar UV-Vis
Hal ini perlu dilakukan jika senyawa yang dianalisis tidak menyerap pada daerah tersebut. Cara yang digunakan adalah dengan merubah menjadi senyawa lain atau direaksikan dengan pereaksi tertentu. Pereaksi yang digunakan harus memenuhi beberapa persyaratan yaitu :
- Reaksinya selektif dan sensitif
- Reaksinya cepat, kuantitatif dan reprodusibel - Hasil reaksi stabil dalam jangka waktu yang lama
5 b. Waktu Operasional
Tujuannya adalah untuk mengetahui waktu pengukuran yang stabil. Waktu operasional ditentukan dengan mengukur hubungan antara waktu pengukuran dengan absorbansi larutan (Gandjar dan Rohman, 2007).
c. Pemilihan Panjang Gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah panjang gelombang yang mempunyai absorbansi maksimal. Untuk memilih panjang gelombang maksimal, dilakukan dengan membuat kurva hubungan antara absorbansi dengan panjang gelombang dari suatu larutan baku pada konsentrasi tertentu.
Ada beberapa alasan menggunakan panjang gelombang maksimal, yaitu: - Pada panjang gelombang maksimal, kepekaannya juga maksimal karena
pada panjang gelombang maksimal tersebut perubahan absorbansi untuk setiapsatuan konsentrasi adalah yang paling besar.
- Di sekitar panjang gelombang maksimal, bentuk kurva absorbansi datar dan pada kondisi tersebut hukum Lambert-Beer akan terpenuhi.
- Jika dilakukan pengukuran ulang, maka kesalahan yang disebabkan oleh pemasangan ulang panjang gelombang akan kecil sekali, ketika digunakan panjang gelombang maksimal
(Gandjar dan Rohman, 2007). d. Pembuatan Kurva Baku
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai konsentrasi. Masing-masing absorbansi larutan dengan berbagai konsentrasi diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi dengan konsentrasi Bila hukum Lambert-Beer terpenuhi maka kurva baku berupa garis lurus. Kemiringan atau slope adalah a (absortivitas) atau (absortivitas molar). Kurva baku sebaiknya sering diperiksa ulang. Penyimpangan dari garis lurus biasanya disebabkan oleh: kekuatan ion yang tinggi, perubahan suhu, dan reaksi ikutan yang terjadi (Gandjar dan Rohman, 2007).
6 e. Pembacaan Absorbansi Sampel atau Cuplikan
Absorban yang terbaca pada spektrofotometer hendaknya antara 0,2-0,8 atau 15%-70% jika dibaca sebagai transmittan. Anjuran ini berdasarkan anggapan bahwa kesalahan dalam pembacaan T adalah 0,005 atau 0,5%. (Gandjar dan Rohman, 2007).
III. ALAT DAN BAHAN
3.1 Alat Ball filler Botol vial Gelas beaker Kuvet Labu ukur 5mL, 10mL,25 mL Pipet tetes Pipet volume Spektrofotometer UV-visible 3.2 Bahan Amonium asetat Aquadest Asam asetat Asetil aseton Larutan Formalin 37% b/v IV. PERHITUNGAN
4.1 Perhitungan pembuatan Reagen Nash
Reagen Nash yang dibuat sejumlah 50 ml, sehingga jumlah masing – masing bahan adalah :
a. Amonium asetat = 50 ml
100 ml x 15 gr = 7,5 gr
b. Asam Asetat = 50 ml
7
c. Asetil Aseton = 50 ml
100 ml x 0,2 ml = 0,1 ml
d. Aquadest = 50 ml
100 ml x 100 ml = add 50 ml
4.2 Pembuatan 10 mL Larutan Stok Formalin 2% b/v
Diketahui : Larutan formalin yang tersedia = 37% b/v
Konsentrasi yang diperlukan = 2% b/v
Volume larutan yang diperlukan = 10 mL
Ditanya : Volume larutan formalin 37% b/v yang diambil = ….. ?
Penyelesaian : M1V1 = M2V2 37 % V1 = 2 % . 10 ml V1 = 2 gr 100 ml x 10 ml 37 gr100 ml V1 = 0,54 mL
4.3 Pembuatan 10 mL larutan Formalin 100 µg/mL dari larutan formalin 2% b/v
Diketahui : Konsentrasi formalin = 2% b/v
V Formalin 100 µg/ml = 10 mL
2 % b/v = 2 gram/100ml
= 2 x 104g/ml
Ditanya : Volume larutan formalin 2% b/v yang diambil = ….. ?
Penyelesaian : C1V1 = C2V2 2 x 104 µg/ml . V1 = 100 µg/ml x 10 ml V1 = 100 μg x 10 mlml 2 x 104μgml .V1 = 0,05 ml
8 4.4 Perhitungan konsentrasi setiap larutan standar
Diketahui : Vlarutan stok formalin standar1 = 0,1 mL
Vlarutan stok formalin standar2 = 0,2 mL Vlarutan stok formalin standar 3 = 0,3 mL
Vlarutan stok formalin standar 4 = 0,4 mL
Vlarutan stok formalin standar 5 = 0,5 mL
Vmasing-masing larutan = 5 mL
Clarutan stok formalin = 100 µg/mL
Ditanya : Konsentrasi masing-masing larutan seri = …?
Penyelesaian :
- Untuk standar 1
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin 100 µg/mL x 0,1 mL = Clarutan formalin standar 1 x 5 mL Clarutan standar formalin standar 1 =
100 µg /mL x 0,1 mL 5 µg /mL
= 2 µg/mL - Untukstandar 2
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin 100 µg/mL x 0,2 mL = Clarutan formalin standar 2 x 5 mL Clarutanstandar formalin standar 2 =
100 µg /mL x 0,2 mL 5 µg /mL
= 4 µg/mL
- Untuk standar 3
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin 100 µg/mL x 0,3 mL = Clarutan formalin standar 3 x 5 mL Clarutanstandar formalin standar 3 =
10 µg/mL x 0,3 mL 5 µg/mL
= 6 µg/mL - Untuk standar 4
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin 100µg/mL x 0,4 mL = Clarutan formalin standar 4 x 5 mL
9 Clarutanstandar formalin standar 4 =
100 µg /mL x 0,4mL 5 µg /mL
= 8 µg/mL - Untuk standar 5
Cstok formalin x Vstok formalin = Clarutan formalin x Vlarutan formalin 100 µg/mL x 0,5 mL = Clarutanformalin standar 5 x 5 mL Clarutan standar formalin standar 5 =
100 µg /mL x 0,5mL 5 µg /mL
= 10 µg/mL
4.5 Pembuatan Larutan Sampel Formalin
Diketahui : Clarutan stok formalin = 100µg/mL
V larutan stok formalin yang digunakan = 0,25 mL V larutan formalin yang ingin dibuat = 5 mL
Ditanya : Clarutan stok formalin yang digunakan = …?
Penyelesaian :
CstokFormalin x Vstok Formalin = ClarutanFormalin x V larutanFormalin 100 µg/mL x 0,25 mL = ClarutanFormalin x 5 mL CstokFormalin = 25 g 5ml = 5 µg/mL V. PELAKSANAAN PERCOBAAN 5.1 Prosedur Kerja
5.1.1 Pembuatan Larutan Formalin 2% b/v dari larutan Formalin 37% b/v
Diambil 0,54 mL larutan formalin 2% b/v dengan pipet volume
Dimasukkan kedalam labu ukur 10 mL dan ditambahkan aquadest hingga
tanda batas dan digojog hingga homogen
5.1.2 Pembuatan Larutan Stok Baku Formalin 100 µg/mL
Larutan formalin 2% b/v diambil sebanyak 0,05 mL menggunakan pipet
10
Ditambahkan aquadest hingga tanda batas kemudian digojog hingga homogen
5.1.3 Pembuatan Reagen Nash
Ditimbang 7,5 gram Ammonium Asetat (NH4CH3COO) dan dimasukkan
dalam beaker glass
Ditambahkan 0,15 mL Asam Asetat (CH3COOH) dan 0,1 mL Asetil Aseton. Dilarutkan dengan Aquadest hingga larut dan dimasukkan ke dalam labu ukur 50 mL
Ditambahkan aquadest hingga volume 50 mL dan digojog hingga
homogen
Dimasukkan kedalam botol kaca gelap serta dibungkus dengan
aluminium foil
5.1.4 Pembuatan Larutan Standar
Dipipet masing-masing 0,1 mL, 0,2 mL, 0,3 mL, 0,4 mL dan 0,5 mL larutan formalin 100 µg/mL lalu dimasukkan ke dalam labu ukur 5 mL, ditambahkan aquadest sampai batas 5 mL
Kemudian masing-masing larutan dimasukkan ke dalam 5 buah vial yang
berbeda
Dari masing-masing vial tersebut dipipet 1 mL, dimasukkan ke dalam vial baru, dan ditambahkan dengan 2 mL reagen Nash dan 2 mL
aquadest
Didiamkan kurang lebih selama 30 menit
5.1.5 Pembuatan Larutan Sampel Formalin
Sebanyak 0,35 mL larutan stok baku formalin 100 µg/mL dipipet, kemudian ditempatkan pada labu ukur 5 mL
Ditambahkan aquadest hingga tanda batas dan digojog. Larutan sampel kemudian ditampung pada botol vial
11
Diambil 1 ml larutan sampel dan ditambahkan 2 ml reagen Nash dan 2 ml aquadest. Didiamkan kurang lebih selama 30 menit.
5.1.6 Penentuan Kadar Formalin
Diukur absorbansi salah satu larutan standar pada rentang panjang gelombang 350-450 nm, ditentukan panjang gelombang maksimumnya
Dilakukan pengukuran absorbansi masing-masing seri larutan standar pada panjang gelombang maksimum kemudian dibuat kurva kalibrasi dan persamaan regresi liniernya
Ditetapkan kadar sampel formalin dengan mengukur absorbansinya
secara spektrofotometri visibel
Diukur absorbansi sampel formalin pada panjang gelombang
maksimumnya
Ditetapkan kadar formalin dengan memanfaatkan persamaan regresi
linear dari 5 variasi larutan standar dan dihitung persentase perolehan kembali.
5.2 Skema Kerja
5.2.1 Pembuatan Latutan Formalin 2% b/v dari larutan 37% b/v
5.2.2 Pembuatan Larutan Stok Baku Formalin 100 µg/mL
\
Diambil 0,54 mL larutan formalin 2% b/v dengan pipet ukur
Ditambahkan aquadest hingga 10 mL ke dalam labu ukur, digojog sampai homogen
Larutan formalin 2% b/v diambil sebanyak 0,05 mL menggunakan pipet volume
12 5.2.3 Pembuatan Reagen Nash
5.2.4 Pembuatan Larutan Standar
5.2.5 Pembuatan Larutan Sampel Formalin
Dibuat 5 variasi kadar larutan standar
Diambil larutan stok baku sebanyak 0,1 mL; 0,2 mL; 0,3 mL; 0,4 mL; 0,5 mL
Dimasukkan ke dalam labu ukur 5 mL, ditambahkan dengan aquadest hingga tanda batas
Ditimbang 7,5 gram ammonium Asetat (NH4CH3COO), dimasukkan ke
dalam beaker glass
Ditambahkan 0,15 mL Asam Asetat (CH3COOH) DAN 0,1 mL Asetil
Aseton
Diencerkan dengan aquadest hingga 50 mL dan digojog sampai homogen
Dimasukkan ke dalam labu ukur 10 mL. Ditambahkan aquadest hingga tanda batas kemudian digojog hingga homogen.
13 2.2.6 Penentuan Kadar Formalin
Ditentukan panjang gelombang maksimumnya dandilakukan pengukuran absorbansi masing-masing seri larutan standar pada panjang gelombang
maksimum
Diukur absorbansi salah satu larutan standar pada rentang panjang gelombang 352 nm -451 nm dengan spektrofotometer UV-Vis
Dilakukan pengukuran absorbansi larutan sampel pada panjang gelombang maksimum dengan spektrofotometer UV-Vis
Dibuat kurva kalibrasi larutan standar dan persamaan regresi liniernya
Dihitung nilai persentase perolehan kembali
Dihitung kadar sampel berdasarkan nilai absorbansi sampel dan persamaan regresi linier larutan standar
Dipipet 1 ml larutan sampel dan ditambahkan 2 ml reagen Nash dan 2 ml
aquadest
Didiamkan kurang lebih selama 30 menit.
Ditempatkan pada labu ukur 5 mL, ditambahkan aquadest hingga tanda batas dan digojog. Larutan ditampung pada vial
14
VI. HASIL PERCOBAAN
6.1 Data Pengamatan 6.1.1 Tabel Penimbangan
Sebelum dilakukannya kegiatan praktikum, terlebih dahulu dilakukan pembuatan larutan baku dan larutan sampel dari formalin dengan melakukan pengukuran sebagai berikut;
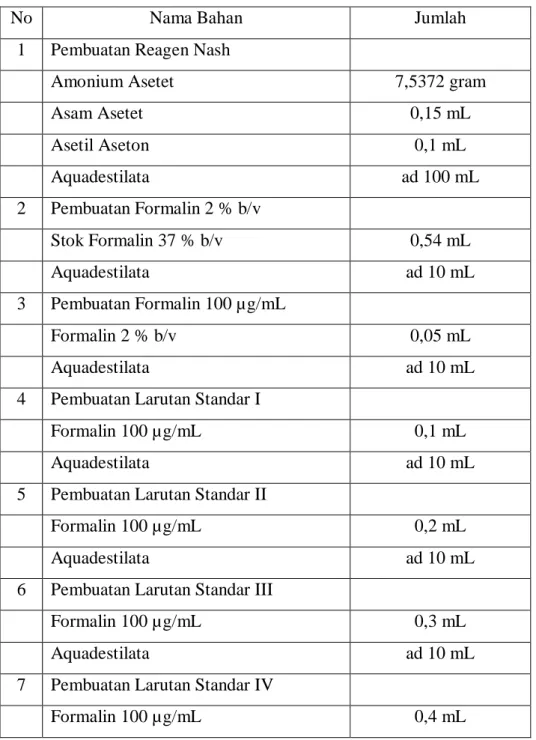
Tabel 1. Tabel Penimbangan Bahan
No Nama Bahan Jumlah
1 Pembuatan Reagen Nash
Amonium Asetet 7,5372 gram
Asam Asetet 0,15 mL Asetil Aseton 0,1 mL Aquadestilata ad 100 mL 2 Pembuatan Formalin 2 % b/v Stok Formalin 37 % b/v 0,54 mL Aquadestilata ad 10 mL 3 Pembuatan Formalin 100 µg/mL Formalin 2 % b/v 0,05 mL Aquadestilata ad 10 mL
4 Pembuatan Larutan Standar I
Formalin 100 µg/mL 0,1 mL
Aquadestilata ad 10 mL
5 Pembuatan Larutan Standar II
Formalin 100 µg/mL 0,2 mL
Aquadestilata ad 10 mL
6 Pembuatan Larutan Standar III
Formalin 100 µg/mL 0,3 mL
Aquadestilata ad 10 mL
7 Pembuatan Larutan Standar IV
15
Aquadestilata ad 10 mL
8 Pembuatan Larutan Standar V
Formalin 100 µg/mL 0,5 mL
Aquadestilata ad 10 mL
9 Pembuatan Larutan Sampel
Formalin 100 µg/mL 0,25 mL
Aquadestilata ad 10 mL
10 Pembuatan Larutan Siap Ukur
Larutan Standar/Seri masing-masing 1 mL
Aquadest untuk tiap Standar/Seri 2 mL
Reagen Nash untuk tiap Standar/Seri 2 mL
6.1.2 Hasil
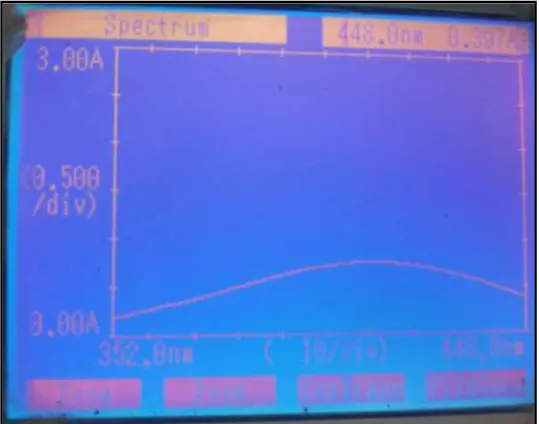
Setelah larutan standar formalin dan sampel siap ukur selesai, dilakukan proses analisa dengan menggunakan metode spektrofotometri. Dimana formalin dianalisa pada rentang panjang gelombang 352-450 nm, dimana diperoleh hasil absorbansi sebagai berikut;
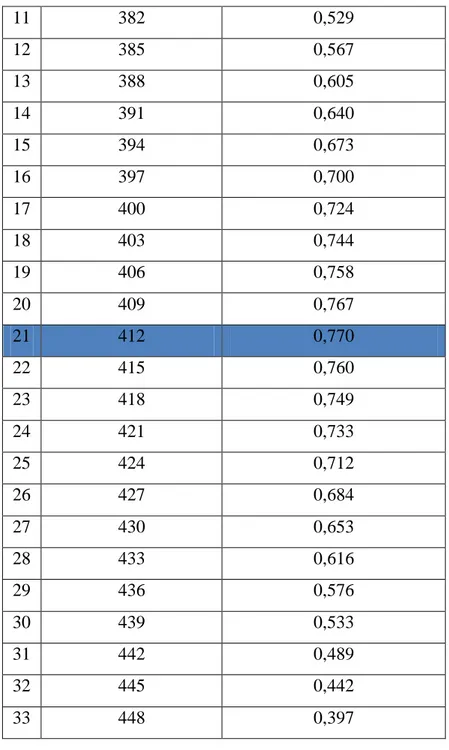
Tabel 2. Hasil Pengamatan Larutan Formalin (Standar III)
No Panjang Gelombang
(nm)
Absorbansi larutan Standar 6 μg/ mL 1 352 0,193 2 355 0,222 3 358 0,254 4 361 0,286 5 364 0,325 6 367 0,341 7 370 0,375 8 373 0,414 9 376 0,451 10 379 0,489
16 Dihitung pula absorbansi kelima standar dari variasi larutan formalin pada panjang gelombang yang diperoleh dari analisa sebelumnya, serta diukur absorbansi larutan sampel. Diperoleh hasil sebagai berikut;
Tabel 3. Hasil Analisa Absorbansi Larutan Seri dan Sampel pada λmaks
No Larutan Absorbansi pada 412 nm
1 Standar I, 2 µg/mL 0,381 11 382 0,529 12 385 0,567 13 388 0,605 14 391 0,640 15 394 0,673 16 397 0,700 17 400 0,724 18 403 0,744 19 406 0,758 20 409 0,767 21 412 0,770 22 415 0,760 23 418 0,749 24 421 0,733 25 424 0,712 26 427 0,684 27 430 0,653 28 433 0,616 29 436 0,576 30 439 0,533 31 442 0,489 32 445 0,442 33 448 0,397
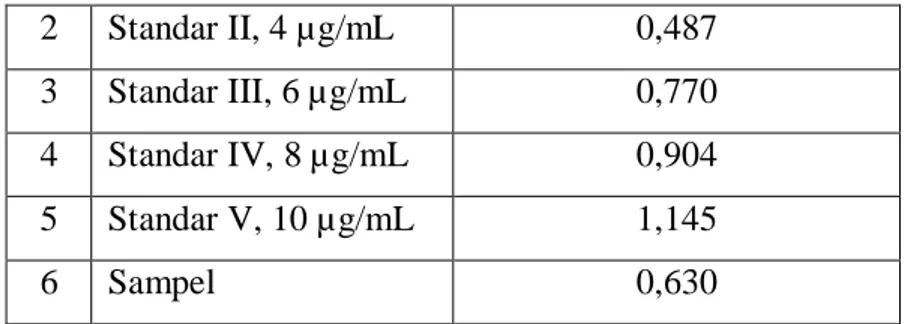
17 2 Standar II, 4 µg/mL 0,487 3 Standar III, 6 µg/mL 0,770 4 Standar IV, 8 µg/mL 0,904 5 Standar V, 10 µg/mL 1,145 6 Sampel 0,630
6.1.3 Spektrum Formalin dengan Reagen Nash pada Rentang Panjang Gelombang Diperoleh spektrum formalin yang direaksikan dengan reagen Nash dan diamati pada rentang panjang gelombang 352 nm sampai 450 nm sebagai berikut:
Gambar 3. Spektrum Formalin dalam Reagen Nash.
6.2 Perhitungan Hasil Percobaan
6.2.1 Pembuatan Kurva Kalibrasi Larutan Seri Formalin
Diketahui : Absorbansi Standar I = 0,381
Konsentrasi Standar I = 2 µg/mL
Absorbansi Standar II = 0,487
Konsentrasi Standar II = 4 µg/mL
Absorbansi Standar III = 0,770
Konsentrasi Standar III = 6 µg/mL
Absorbansi Standar IV = 0,904 Konsentrasi Standar IV = 8 µg/mL 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 350 360 370 380 390 400 410 420 430 440 450 A b so rb an si Panjang gelombang
Spektrum Formalin dalam
Pereaksi Nash
18
Absorbansi Standar V = 1,145
Konsentrasi Standar V = 10 µg/mL
Ditanya : Persamaan Regresi Linear Formalin = . . . . ?
Penyelesaian :
Dilakukan perhitungan menggunakan kalkulator yang di atur pada mode
Regresi – Linear, dan dimasukkan konsentrasi dan nilai absorbansi yang
diperoleh ke dalam kalkulator. Sehingga diperoleh persamaan sebagai berikut:
y = bx + a
y = 0,09725 x + 0,1539
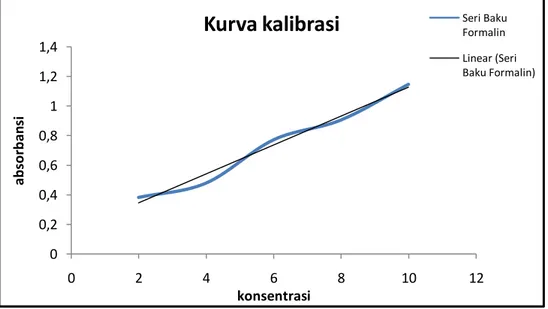
Dimana y merupakan absorbansi dan x merupakan konsentrasi. Dari persamaan diatas diperoleh kurva dengan nilai r sebesar 0,980. Dimana, dengan nilai r diatas 0,95 dan mendekati 1,00 merupakan nilai regresi yang baik dan dapat digunakan untuk menghitung konsentrasi sampel. Adapun kurva kalibrasinya sebagai berikut:
Gambar 4. Kurva Kalibrasi Larutan Seri Formalin
6.2.2 Perhitungan Kadar Sampel Formalin
Diketahui : Absorbansi Sampel : 0,630
Persamaan Regresi Linear : y = 0,09725x + 0,1539
Ditanya : Kadar Formalin dalam Sampel = . . . . ?
0 0,2 0,4 0,6 0,8 1 1,2 1,4 0 2 4 6 8 10 12 ab so rb an si konsentrasi
Kurva kalibrasi
Seri BakuFormalin Linear (Seri Baku Formalin)
19 Penyelesaian : mL µg 4,9 x 0,09725 0,4761 x 0,4761 x 0,09725 0,1539 -0,630 x 0,09725 0,1539 x 0,09725 0,630 0,1539 x 0,09725 y
Jadi, sampel yang memberikan absorbansi 0,630 memiliki konsentrasi atau kadar sebesar 4,9 µg/mL
6.2.3 Perhitungan Peresen Perolehan Kembali (Recovery Point) Sampel Formalin
Diketahui : Kadar Formalin dalam Sampel = 4,9 µg/mL
Kadar Formalin Sampel Sebenarnya = 5 µg/mL
Ditanya : Peresen Perolehan Kembali (Recovery Point) = . . . ?
Penyelesaian : % Recovery = 𝑘𝑎𝑑𝑎𝑟 𝑦𝑎𝑛𝑔 𝑑𝑖𝑝𝑒𝑟𝑜𝑙𝑒 ℎ 𝑘𝑎𝑑𝑎𝑟 𝑠𝑒𝑏𝑒𝑛𝑎𝑟𝑛𝑦𝑎 x 100 % = 4,9μg/mL 5 μg/mL x 100 % = 98 % VII. PEMBAHASAN
Kegiatan praktikum kali ini bertujuan untuk menentukan kadar formalin dalamm sampel dengan menggunakan metode spektrofotometri visibel. Dimana analisia spektrofotometri merupakan analisis kuantitaif yang pengukurannya berdasarkan daya serapan radiasi elektromagnetik oleh sampel, dimana radiasi elektromagnetik dalam hal ini berupa sinar monokromatis yang diserap oleh gugus fungsional kromofor. Formalin merupakan senyawa non-absorbing atau senyawa yang tidak dapat menyerap sinar monokromatis yang dikarenakan formalin tidak memiliki gugus kromofor. Oleh karena itu, terlebih dahulu
20 formalin direaksikan dengan pereaksi tertentu untuk menghasilkan larutan berwarna yang dapat menghasilkan gugus kromofor dan menjadikan formalin menjadi senyawa turunan berupa absorbing derivative yang dapat diukur dengan spektrofotometrer. Umumnya formalin direaksikan dengan reagen Nash dan hasil reaksinya dapat diukur di daerah visibel pada panjang gelombang maksimum 412 nm (Gandjar dan Rohman, 2012; Wiryawan dkk., 2008).
Sebelum melakukan penetapan kadar formalin dalam sampel, dibuat larutan formalin dengan kadar 100 μg/mL. Pada laboratorium tersedia larutan formalin dengan konsentrasi 37% b/v sehingga perlu dilakukan pengenceran. Pengenceran pertama dari larutan formalin 37% b/v menjadi 2% b/v dengan cara dipipet 0,54 mL larutan stok formalin 37% b/v dan dilarutkan dengan aquadest 10 mL. Kemudian larutan formalin 2% b/v diencerkan menjadi 100 μg/mL dengan memipet 0,05 mL larutan formalin 2% b/v dan dilarutkan dengan aquadest 10 mL. Digunakan pelarut aquadest dalam pengenceran dikarenakan formalin dapat bercampur dengan air dan alkohol, tetapi tidak bercampur dengan kloroform dan eter (Windholz, 1976).
Kemudian dibuat formalin dengan lima variasi konsentrasi, yaitu 20 µg/mL, 40 µg/mL, 60 µg/mL, 80 µg/mL dan 100 µg/mL. Dibuat variasi konsentrai ini bertujuan untuk memperoleh komponen dasar perhitungan dalam persamaan regresi linear dan untuk memperoleh kurva kalibrasi yang baik. Dimana dengan menggunakan lima variasi konsentrasi diharapkan dapat mengurangi kesalahan pengukuran yang diakibatkan oleh penggunaan variasi dalam persamaan regresi yang sedikit. Dari masing-masing larutan dengan berbagai konsentrasi tersebut, dipipet 1 mL dan ditambahkan dengan 2 mL reagen Nash dan 2 mL aquadest yang direaksikan dalam botol vial. Larutan didiamkan selama kurang lebih 30 menit. Pada umunya, beberapa metode pengembangan untuk deteksi dan penetapan kadar formalin yang direaksikan dengan reagen Nash diperlukan waktu reaksi minimal 10 menit dan maksimal 30 menit ±2 menit. Pada praktikum kali ini, dipilih waktu 30 menit yang diharapkan mampu menghasilkan kompleks warna yang lebih stabil sehingga larutan yang dibuat dapat diukur di daerah visibel, selain itu proses pendiaman juga bertujuan untuk mengoptimalkan
21 reaksi formalin dengan reagen Nash dikarenakan laju reaksi pembentukan
absorbing derivative dari formalin yang lambat (Li et al., 2007). Dimana pereaksi
yang digunakan harus memenuhi beberapa persyaratan yaitu; reaksinya selektif dan sensitif, reaksinya cepat, kuantitatif dan reprodusibel serta hasil reaksinya stabil dalam jangka waktu yang lama (Gandjar dan Rohman, 2007). Berikut adalah reaksi pembentukan absorbing derivative dari formalin yaitu diasetilhidrolutidin (DDL);
Gambar 5. Reaksi Formalin denga Reagen Nash memebntuk Diasetilhidrolutidin yang emrupakan absorbing derivate (Li et al., 2007).
Larutan dengan berbagai konsentrasi yang telah direaksikan dengan perekasi Nash selama 30 menit, selanjutnya diukur absorbansinya pada rentang panjang gelombang 352-450 nm. Pengukuran ini dilakukan dengan instrumen spektrofotometer yang telah dikalibrasi dengan larutan blanko terlebih dahulu. Kalibrasi alat spektrofotometer dengan blanko penting dilakukan sebelum melakukan analisis untuk mengurangi kesalahan serapan yang disebabkan oleh serapan oleh pelarut ataupun komponen lain selain analit dalam larutan uji yang dalam hal ini berupa preaksi. Blanko yang digunakan berupa reagen Nash, dikarenakan dalam larutan uji dimungkinkan masih terdapat komponen dari reagen Nash yang belum bereaksi sepenuhnya dengan formalin dan dalam reagen Nash sudah terdapat aquadest yang juga digunakan sebagai pelarut larutan uji dan peraksi (Gandjar dan Rohman, 2007).
Dilakukan analisis pada rentang panjang gelombang 352 nm sampai 450 nm. Panjang gelombang ini merupakan panjang gelombang visibel larutan formalin yang dimana dalam rentang panjang gelombang tersebut diharapkan terdapat absorbansi maksimum. Dari pustaka, absorbansi maksimum dari formalin terdapat
22 pada gelombang dengan panjang 412 nm. Pengukuran ini dilakukan dengan menggunakan larutan yang konsentrasinya berada pada posisi medial atau diantara konsentrasi rendah dan tinggi yaitu 60 μg/mL. Dengan konsentrasi tersebut, diharapkan absorbansi yang dihasilkan pada rentang panjang gelombang memiliki kesesuaian dengan absorbansi yang dihasilkan oleh larutan pada konsentrasi rendah dan tinggi pada setiap panjang gelombang pengukuran (Salem et al, 2010). Hasil dari analisis formalin pada rentang panjang gelombang menunjukkan bahwa panjang gelombang maksimum dari formalin dalam praktikum sudah sesuai dengan literatur yang menyatakan bahwa panjang gelombang maksimum untuk penetapan kadar formalin adalah 412 nm. Pada panjang gelombang 412 nm, diperoleh absorbansi paling maksimal dengan nilai 0,770. Panjang gelombang maksimum ini selanjutnya digunakan untuk mengukur absorbansi larutan seri atau variasi lima konsentrasi dan larutan sampel. Hasil yang diperoleh adalah sebagai berikut: Pada konsentrasi 20 µg/mL menghasilkan absorbansi sebesar 0,381; pada konsentrasi 40 µg/mL menghasilkan absorbansi sebesar 0,487; konsentrasi 60 µg/mL menghasilkan absorbansi sebesar 0,770; pada konsentrasi 80 µg/mL menghasilkan absorbansi sebesar 0,904 dan pada konsentrasi 100 µg/mL menghasilkan absorbansi sebesar 1,145.
Dari nilai absorbansi diatas, diperoleh persamaan regresi linear sebesar y = 0,09725x + 0,1539. Dengan harga r = 0,980, dimana harga r dari suatu persamaan regresi liear yang dapat digunakan untuk menetapkan kadar suatu sampel adalah dari 0,95 hingga 1,00. Sehingga persamaan regresi linear diatas dapat digunakan untuk menetapkan kadar formalin dalam sampel.
Dilakukan pengukuran absorbansi larutan sampel pada panjang gelombang 412 nm, dan diperoleh absorbansi sebesar 0,630. Absorbansi tersebut kemudian dimasukkan kedalam persamaan regresi linier dan dihitung untuk memperoleh nilai x yang merupakan kadar atau kosentrasi. Diperoleh konsetrasi atau kadar formalin dalam larutan sampel sebesar 4,9 µg/mL. Dimana, konsentrasi formalin dalam sampel sebenarnya adalah 5 µg/mL, sehingga diperoleh persen perolehan kembali (recovery point) dari formalin dalam larutan sampel sebesar 98 %.
23
VIII. KESIMPULAN
Spektrofotometri visibel merupakan metode analisis instrumental, dengan sepktrofotometer yang panjang gelombangnya berada pada sinar tampak atau visibel (400-800 nm), sehingga senyawa yang akan dianalisis harus berwarna atau dibuat berwarna. Penentuan konsentrasi suatu sampel dapat menggunakan kurva kalibrasi, dan sampel yang ditetapkan kadarnya dalam praktikum kalini memiliki konsentrasi sebesar 4,9 μg/mL.
24
DAFTAR PUSTAKA
Bassett, K., R. C. Denney, G. H. Jeffery, dan J. Mendham. 1994. Buku Ajar
Vogel; Kimia Analisis Kuantitatif Anorganik, Edisi 4. Jakarta: EGC
Departemen Kesehatan Republik Indonesia. 1979. Farmakope Indonesia, Edisi III. Jakarta: Departemen Kesehatan Republik Indonesia.
Gandjar, I.G. dan A.Rohman. 2007. Kimia Analsis Farmasi. Yogyakarta: Pustaka Pelajar.
Gandjar, I.G. dan A.Rohman. 2012. Analisis Obat secara Spektrofotometri dan
Kromatografi. Yogyakarta: Pustaka Pelajar.
Li, Qiong, Piyanete, Sritharathikhun and Motomizu, Shoji. 2007. Development of Novel Reagent for Hantzsch Reaction for the Determination of Formaldehyde by Spectrophotometry and Fluorometry. Analytical
Sciences. Vol. 23, hal.413-417
Nash, T. 1953. The Colorimetric Estimation of Formaldehyde by Means of the Hantzsch Reaction. Biochemistry Journal. Vol. 55, hal.412-421
OECD SIDS. 2002.SIDS Initial Assessment Report for SIAM 14: Formaldehyde. Paris: UNEP Publication.
Salem, M.Z.M., Böhm, Martin, Srba, Jaromír, and Barcík, Štefan. 2010. Evaluation of Test Methods for Determination of Formaldehyde Emission from Composite Wood Products. Proceedings of the International
Convention of Society of Wood Science and Technology and United Nations Economic Commission for Europe. 11-14
Skoog. W.H. 1996. Fundamental of Analytical Chemistry. 6th edition. USA:
Saunders Publishing.
Sudjarwo, Poedjarti S, Pramitasari A.R. 2013. Validasi Spektrofotometri Visible Unutk Penentuan Kadar Formalin Dalam Daging Ayam. Berkala Ilmiah
Kimia Farmasi. Vol.2 No 1.
Windholz, M. 1976. The Merck Index : Encyclopedia of Chemicals, Drugs, and
25
LAMPIRAN
Gambar 1. Spektrum Formalin 6 µg/mL pada Rentang Panjang Gelombang 352 nm samapi 450 nm.