Referat
MENGENAL KELASI BESI PADA TALASEMIA
Oleh :
Lucky Bintang Kharismawati, S.Ked NIM. I1A010029
Pembimbing :
BAGIAN/SMF ILMU KESEHATAN ANAK FK UNLAM – RSUD ULIN
BANJARMASIN Agustus, 2014
DAFTAR ISI
Halaman
HALAMAN JUDUL... i
DAFTAR ISI... ii
DAFTAR GAMBAR... iii
DAFTAR TABEL... iv
DAFTAR SINGKATAN... v
BAB I PENDAHULUAN... 1
BAB II TINJAUAN PUSTAKA A. Talasemia... 3
B. Dampak Kelebihan Beban Besi Akibat Tranfusi Darah... 8
C. Terapi Kelasi Besi... 13
BAB III PENUTUP A. Kesimpulan... 25
BAB I
PENDAHULUAN
Talasemia merupakan salah satu penyakit genetik terbanyak di dunia. Pembawa sifat talasemia-β dan talasemia-α mencapai 1,67% populasi dunia sedangkan pembawa sifat hemoglobin E sekitar 0,95%.1 Pembawa sifat talasemia-β di Indonesia ditemukan lebih tingi yaitu 3%-10%, pembawa sifat talasemia-α 2,6-11% dan pembawa sifat hemoglobin E 1,5-33%. Di Pusat Talasemia Jakarta pada akhir bulan Maret 2007 tercatat 1264 pasien dengan 80-100 pasien baru setiap tahun. Kasus talasemia-b merupakan kasus yang terbanyak didapatkan yaitu 50,6%, talasemia β-HbE 46,7% dan talasemia- α 2,2%.2
Pasien talasemia akan senantiasa mengalami anemia akibat gangguan produksi hemoglobin sehingga memerlukan tranfusi darah. Transfusi darah merupakan tata laksana suportif utama yang bertujuan mempertahankan kadar hemoglobin 9-10 g/dL untuk meningkatkan tumbuh kembang anak serta mengurangi deformitas tulang dan hepatosplenomegali akibat hematopoeisis ekstramedular.3,4
Tranfusi darah terus menerus pada pasien talasemia memiliki komplikasi terjadinya penimbunan zat besi dalam tubuh. Kelebihan besi ini bila tidak ditangani dapat menyebabkan terjadinya disfungsi pada hati, jantung, dan kelenjar
endokrin yang progresif berakibat timbulnya fibrosis hati, sirosis hati, gagal jantung, diabetes mellitus, hipogonadisme, hipotiroidisme, hipoparatiroidime hingga kematian. Untuk mencegah terjadinya komplikasi akibat kelebihan besi ini diperlukan terapi kelasi besi. Tujuan utama terapi kelasi besi adalah mencapai kadar besi tubuh yang aman. Terapi kelasi besi yang dikenal saat ini dapat diberikan secara parenteral (Deferoksamin) dan peroral (Deferipron dan Deferasirox).5,6
Melihat terjadinya peningkatan kasus talasemia pada anak dan pentingnya terapi kelasi besi, maka para klinisi perlu mengetahui jenis-jenis terapi kelasi besi untuk mengetahui keuntungan sekaligus efek sampingnya sehingga dapat memilih dan memberikan penanganan yang terbaik.
BAB II
TINJAUAN PUSTAKA
A. Talasemia
1. Definisi
Talasemia merupakan kelainan monogenik yang paling sering ditemukan dan merupakan suatu kelompok kelainan bawaan sintesis hemoglobin dengan karakteristik penurunan produksi satu atau lebih rantai globin pada hemoglobin dewasa. Talasemia dapat dikelompokkan sesuai dengan rantai globin yang tidak terbentuk secara efektif, sebagai talasemia alfa (α), beta (β), delta beta (δβ) dan gamma delta beta (γδβ). Namun secara keseluruhan, talasemia alfa dan beta adalah yang paling penting. Sebagian besar tipe talasemia yang penting diwariskan dengan cara Mendelian resesif, orangtua pembawa sifat tanpa gejala mempunyai satu diantara empat kesempatan mempunyai anak dengan kelainan berat.6,7
2. Epidemiologi
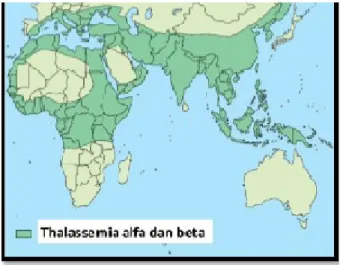
Talasemia didistribusikan secara luas pada daerah Mediterania, Timur Tengah, subkontinen India dan Asia Tenggara mulai dari Cina selatan melewati semenanjung Malaya sampai ke Indonesia (Gambar 2.1). Pada banyak negara ini
frekuensi gen untuk talasemia yang berbeda dan variasi-variasi struktur hemoglobin sangat tinggi. Seiring dengan perbaikan kondisi sosial pada negara-negara berkembang dan penurunan mortalitas oleh karena infeksi dan malnutrisi, anak-anak dengan talasemia yang sebelumnya akan meninggal muda sekarang bertahan cukup lama dan memerlukan perawatan. Pada daerah-daerah ini juga ditemukan penyebab dari tingginya frekuensi talasemia yaitu muncul sebagai sekuele dari infeksi malaria falsiparum.1
Gambar 2.1 Peta penyebaran talasemia di dunia, perhatikan bahwa penyebaran ini nampaknya sesuai dengan penyebaran malaria falsiparum. 1
Darah manusia dewasa merupakan campuran dari beberapa tipe hemoglobin. Hemoglobin yang terbanyak (HbA) terdiri dari dua rantai alfa dan beta, rantai-rantai ini dikodekan oleh 4 lokus gen alfa dan 2 beta. Hemoglobinopati merupakan kelainan autosomal resesif dari gen-gen ini. Lebih dari 600 variasi yang berbeda telah digambarkan dan mereka dapat mempengaruhi baik struktur Hb (kelainan varian seperti sel sabit) atau mengurangi kuantitas rantai beta atau alfa hemoglobin (talasemia).1,5
Talasemia dinamakan sesuai dengan rantai yang mengalami defisiensi, yakni alfa atau beta. Kelainan rantai alfa disebabkan oleh karena delesi gen, sedangkan rantai beta disebabkan oleh alel non-delesional dan sudah ditemukan lebih dari 100 kelainan. Secara klinis, keadaan yang berat timbul bila terjadi kelainan pada kedua gen atau pada 3 sampai 4 rantai alfa. Darah manusia dewasa umumnya mengandung 2,6% HbA2 (α2δ2) yang merupakan hemoglobin residual dan juga sejumlah Hb fetal (HbF, α2γ2) pada tiga bulan pertama kehidupan. Kedua hemoglobin ini tidak mengandung rantai beta, sehingga keberadaan mereka pada usia yang lebih tua dapat membantu diagnosis adanya hemoglobinopati.5
Perbedaan harus dibuat antara pembawa sifat (hanya memiliki sebuah lokus globin yang terkena dan terus sehat selama hidup, namun mempunyai risiko menurunkan penyakit ke anak-anaknya) dan orang-orang dengan kelainan homozigot atau heterozigot ganda sehingga mengalami kelainan. Kelainan-kelainan ini diturunkan secara resesif menurut genetika Mendelian, orang tua
mempunyai satu diantara empat kesempatan untuk melahirkan anak penderita hemofilia apabila mereka berdua merupakan pembawa sifat (Gambar 2.2).7,8,9
Gambar 2.2.
Pewarisan sifat talasemia mengikuti pola pewarisan sifat Mendelian, sehingga orang tua pembawa sifat akanmempunyai kesempatan mewariskan satu dari empat keturunannya.
4. Manifestasi Klinis dan Diagnosis Talasemia
a. Talasemia Beta
Talasemia beta heterozigot merupakan kelainan asimptomatik dengan gambaran anemia hipokrom mikrositik (MCH dan MCV rendah) serta memiliki
kadar HbA2 dua kali normal. Talasemia beta homozigot atau mereka yang mewarisi gen talasemia beta yang berbeda dari kedua orang tua, biasanya mengalami anemia berat pada tahun pertama kehidupan.
Keadaan ini dihasilkan dari kekurangan rantai globin beta, kelebihan rantai alfa yang dipresipitasi ke dalam prekursor sel darah merah sehingga menyebabkan kerusakan sel tersebut, baik dalam sumsum tulang ataupun pembuluh darah perifer. Hipertrofi dari sumsum tulang yang tidak efektif menyebabkan perubahan skeletal dan juga hepatosplenomegali yang bervariasi. Kadar HbF selalu meningkat. Pada saat anak-anak ini diberikan transfusi, sumsum tulang dapat menghentikan produksinya sehingga terjadi pertumbuhan dan perkembangan yang normal. Meskipun demikian, dapat terjadi akumulasi besi dan menyebabkan kematian akibat kerusakan pada miokardium, pankreas atau hati. Mereka juga rentan terhadap infeksi dan menderita defisiensi asam folat. Bentuk-bentuk talasemia beta yang lebih ringan (talasemia intermedia), walaupun tidak selalu tergantung pada transfusi, terkadang juga dikaitkan dengan perubahan tulang, anemia, ulkus tungkai bawah dan gangguan pertumbuhan.10,11
Variasi klinis dari talasemia beta yang dinamakan talasemia intermedia berada diantara spektrum talasemia mayor dan pembawa sifat asimptomatik. Sindrom ini meliputi kelainan-kelainan dengan spektrum disabilitas yang luas, pada sisi yang berat, pasien dapat datang dengan anemia lebih lambat dibandingkan dengan talasemia beta tergantung transfusi dan hanya mampu mempertahankan hemoglobin kurang lebih 6 g/dL tanpa transfusi.8,9
Secara umum, gambaran klinis talasemia beta intermedia mirip dengan talasemia beta mayor. Pada spektrum yang berat, khususnya pada kasus-kasus gangguan pertumbuhan, pasien harus diterapi dengan transfusi rutin. Meskipun demikian, beberapa komplikasi penting seperti hipersplenisme progresif timbul pada pasien dengan bentuk-bentuk yang lebih ringan. Gejala klinis kelebihan beban besi akibat peningkatan absorpsi bahkan dapat dilihat pada pasien dengan transfusi yang tidak rutin.9,12
b. Talasemia Alfa
Homozigot talasemia αo : Sindrom hidrops Hb Bart’s ini biasanya terjadi dalam rahim. Bila hidup hanya dalam waktu pendek. Gambaran klinisnya adalah hidrops fetalis dengan edem permagna dan hepatosplenomegali. Kadar Hb 6-8 g/dl dengan eritrosit hipokromik dan beberapa berinti. Kadar Hb Bart’s 80%, sisanya Hb Portland. Kelainan sering disertai toksemia gravidarum, perdarahan postpartum dan masalah karena hipertrofi plasenta. Pemeriksaan otopsi memperlihatkan peningkatan kelainan bawaan. Beberapa bayi, berhasil diselamatkan dengan tranfusi tukar dan tranfusi berulang. Pertumbuhan dan perkembangan bisa mencapai normal.
HbH disease (talasemia αα/α+) : Ditandai dengan anemia dan splenomegali sedang. Memiliki variasi klinis, beberapa tergantung tranfusi, sedangkan sebagian besar bisa tumbuh normal tanpa tranfusi. Gambaran darah tepi khas talasemia dengan perubahan eritrosit,dengan HbH bervariasi, sedikit Hb Bart’s dan HbA2 rendah sampai sedang. HbH dapat diketahui dengan bantuan
brilliant cresil blue yang akan menyebabkan pengendapan dan pembentukan
badan inklusi. Setelah splenektomi bentukan ini makin banyak pada eritosit.
B. Dampak Kelebihan Beban Besi Akibat Transfusi Darah
Besi merupakan logam yang penting untuk sintesis hemoglobin, reaksi oksidasi reduksi dan proliferasi sel, sedangkan kelebihan besi akan menyebabkan disfungsi organ lewat produksi spesies oksigen reaktif. Jumlah kadar besi di dalam tubuh berkisar antara 3-4 g, dua pertiga berada di dalam sel darah merah dan didaur ulang dengan penghancuran eritrosit; sisanya disimpan dalam bentuk ferritin/hemosiderin, sementara hanya 1-2 mg besi yang diserap lewat traktus gastrointestinal dan beredar di dalam darah. Metabolisme besi tubuh merupakan suatu sistem setengah tertutup, dan secara kritikal diregulasi oleh beberapa faktor termasuk hepcidin yang baru saja ditemukan.Dalam peredaran darah, besi biasanya terikat pada transferrin dan kebanyakan besi terikat transferrin digunakan oleh sumsum tulang untuk eritropoiesis. Oleh karena tidak adanya mekanisme aktif di dalam tubuh untuk mengekskresikan besi, suatu akumulasi progresif besi tubuh akan mudah terjadi sebagai akibat dari transfusi berkepanjangan pada pasien dengan talasemia.10,13
Setiap unit eritrosit yang ditransfusi mengandung 200-250 mg besi sebagai bagian dari pigmen heme. Pada saat eritrosit dipecah oleh sistem makrofag, besi dilepaskan dari heme dan disimpan di dalam tubuh. Oleh karena pengeluaran besi harian oleh tubuh dalam keringat dan pelepasan sel epitel hanya berkisar 1 mg,
maka pemberian satu unit PRC berhubungan dengan sekitar 200 hari siklus besi harian tubuh. Oleh karena kelebihan besi tidak dapat dieliminasi dari tubuh, maka transfusi kronik akan menyebabkan keseimbangan besi tubuh sangat jauh dari ekulibrium. Toksisitas besi dalam dosis tinggi disebabkan oleh karena kemampuannya bereaksi dengan molekul oksigen, memindahkan elektron ke dalamnya dan menghasilkan spesies oksigen antara, yang kemudian dengan adanya besi akan menyebabkan terbentuknya radikal-radikal yang lebih reaktif lagi. Radikal reaktif ini akan menyerang lipid, protein dan DNA, menyebabkan terjadinya kerusakan sel yang pada akhirnya akan timbul sebagai disfungsi organ.10,14
Hati merupakan organ terpenting untuk penyimpanan besi dengan kapasitas terbesar untuk mensekuestrasi kelebihan besi.Perubahan periodik disfungsi organ telah dipelajari pada pasien dengan talasemia beta homozigot. Biasanya dalam waktu 2 tahun transfusi, abnormalitas fungsi hati seperti peningkatan enzim transaminase tidak terlalu nyata dan biasanya berada dalam batas normal atau hanya sedikit meningkat. Selama periode ini, pemeriksaan biopsi hati akan menunjukkan fibrosis ringan dengan inflamasi ringan dan deposisi besi. Secara klinis, hati menjadi besar dan dapat dipalpasi dan pemeriksaan fungsi hati lainnya dalam rentang normal atau sedikit meningkat. Oleh karena itu penting untuk pasien-pasien tergantung transfusi dinilai secara menyeluruh untuk memastikan adanya kelainan hati fibrotik atau sirosis dengan pemeriksaan CT-Scan, MRI dan analisis biokimia termasuk pemeriksaan transaminase serum.10
Penyebab paling penting dari transfusi jangka panjang adalah kematian mendadak oleh karena gagal jantung. Dilaporkan kurang lebih 70% kematian pada pasien talasemia beta disebabkan oleh sebab kardiogenik. Tanda-tanda disfungsi kardiak termasuk hipertrofi jantung, aritmia dan endokarditis yang pada akhirnya akan menyebabkan gagal jantung. Gangguan ventrikel kiri sangat menonjol dan digambarkan oleh penurunan fraksi ejeksi ventrikel lewat pemeriksaan echokardiogram. Oleh karena penurunan fraksi ejeksi ventrikel ini timbul sebelum tanda-tanda klinis gagal jantung dan juga sebelum pembesaran bayangan jantung pada rontgen dada, echokardiogram merupakan pemeriksaan paling berguna untuk pemantauan kerusakan miokardial oleh kelebihan beban besi.10,11
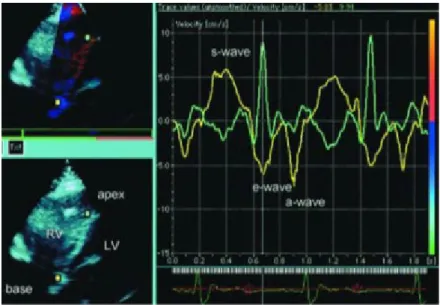
Echokardiogram yang disarankan untuk deteksi kegagalan jantung yang disebabkan oleh deposisi besi di miokardial adalah dengan Doppler jaringan. Pemindaian dilakukan lewat jendela akustik empat-bilik apikal.Laju miokardial kemudian diperiksa secara terus menerus dari basal ke apeks di dalam dinding bebas ventrikel kiri dan kanan juga di septum interventrikular (Gambar 2.3).
Penelitian oleh Vogel menemukan bahwa sensitivitas echokardiogram Doppler untuk menemukan deposisi besi abnormal sebesar 88% dengan spesifisitas 65% (menggunakan T2* MRI sebagai baku emas).11,12
Gambar 2.3 Suatu pemeriksaan echocardiogram Doppler jaringan menunjukkan perubahan warna dari biru ke merah pada septum miokardial sebagai tanda adanya deposisi besi.Terbaliknya gelombang s dan e pada apeks menandakan adanya abnormalitas gerakan dinding pada sistolik dan diastolik.Keadaan ini dapat timbul bahkan pada pasien talasemia dengan fraksi ejeksi dalam batas normal.
MRI juga merupakan pemeriksaan yang berguna untuk menilai fungsi ventrikular dan deposisi besi pada otot jantung dapat dideteksi dengan peningkatan intensitas sinyal. Lebih jauh lagi, perhitungan T2 dan R2 dengan MRI memungkinkan penilaian konsentrasi semi-kuantitatif pada otot jantung, bahkan pada kadar yang relatif rendah. Penelitian oleh Vogel juga menemukan nilai T2* yang normal berkisar antara 20 dan 83 ms, nilai T2* di bawah 20 ms menandakan adanya deposisi besi miokard abnormal (gambar 8). Anderson dan kawan-kawan juga menunjukkan bahwa MRI T2* dapat mendeteksi adanya deposisi besi miokardial bahkan sebelum tanda dan gejala gagal jantung timbul serta sebelum terapi kelasi secara umum dipertimbangkan.14,15
Berdasarkan suatu studi kohort pasien dengan talasemia beta, disfungsi organ oleh karena kelebihan beban besi timbul pertama kali di hati pada saat kadar ferritin melebihi 1.000 ng/dL dan keterlibatan organ lainnya termasuk jantung mengikuti seiring dengan peningkatan kadar besi lebih lanjut. Deposisi jantung signifikan biasanya dapat diamati pada saat kadar ferritin serum lebih dari 1.800-2.500 ng/dL. Secara klinis, untuk mendeteksi adanya disfungsi organ, pemeriksaan kadar ferritin harus dilakukan setiap 1-3 bulan sekali. Pada saat kadar ferritin serum lebih dari 1.500 ng/dL, maka pasien harus diperiksa untuk tanda dan gejala gagal jantung, aritmia serta pemeriksaan echokardiogram periodik dapat dipertimbangkan.
Selain deposisi besi di jantung dan hati, sel beta pankreas merupakan salah satu target penting untuk toksisitas besi, yang dapat menyebabkan intoleransi glukosa dan diabetes mellitus. Faktor tambahan yang menyebabkan intoleransi glukosa adalah gangguan utilisasi insulin oleh hati, yang mengakselerasi kerusakan sel beta oleh karena hiperinsulinemia. Ditinjau dari perspektif pemeriksaan serial gula darah, urin dan glikoalbumin berguna untuk memantau terjadinya diabetes mellitus, sedangkan pemeriksaan glikohemoglobin tidak berguna oleh karena dampak transfusi berulang.14,15
Endokrinopati oleh karena transfusi jangka panjang dapat diamati termasuk gangguan pertumbuhan, pubertas inkomplit dan disfungsi tiroid.Pada pasien dengan talasemia dan anemia sel sabit, perhatian khusus harus diberikan kepada tanda dan gejala awal seperti gangguan pertumbuhan dan imaturitas seksual.10,11
C. Terapi Kelasi Besi
Tujuan utama terapi kelasi besi adalah mencapai kadar besi tubuh yang aman. Pemberian terapi kelasi besi yang adekuat dan kepatuhan pasien sangat menentukan keberhasilan terapi ini. Terapi kelasi besi dimulai apabila kadar feritin serum mencapai 1000 ng/dL, yaitu kira-kira setelah 10-20 kali transfusi untuk mencegah kerusakan jaringan. Terapi kelasi besi yang ideal mempunyai syarat-syarat sebagai berikut yaitu :
Stabilitas kompleks besi-kelator Efisiensi kelasi tinggi
Laju metabolisme rendah
Berat molekul tidak terlalu besar Penetrasi jaringan dan sel
Solubilitas dalam air dan lipid Tidak ada redistribusi besi Relatif non-toksik
Pencapaian keseimbangan besi negatif Murah
Dapat diberikan secara oral
Penelitian untuk meningkatkan kualitas terapi kelasi besi telah dilakukan dalam 30 tahun terakhir. Deferoksamin merupakan kelasi besi yang paling lama dipakai di dunia. Pemberian deferoksamin secara subkutan ternyata memberikan perubahan yang besar dalam meningkatkan usia harapan hidup dan mengurangi komplikasi akibat kelebihan besi, sehingga terapi ini dijadikan terapi standar
untuk pasien thalasemia di seluruh dunia. Tetapi pemberian dengan cara subkutan menyebabkan ketidakpatuhan yang cukup tinggi, sehingga para ahli dunia mencoba mencari alternatif lain dengan menemukan formulasi kelasi besi secara oral.13,14
1. Jenis-Jenis Kelasi Besi
Jenis-jenis terapi kelasi besi yang dikenal saat ini ada tiga jenis yaitu yang diberikan secara parenteral (Deferoksamin) dan yang diberikan secara oral (Deferipron dan Deferasirox).
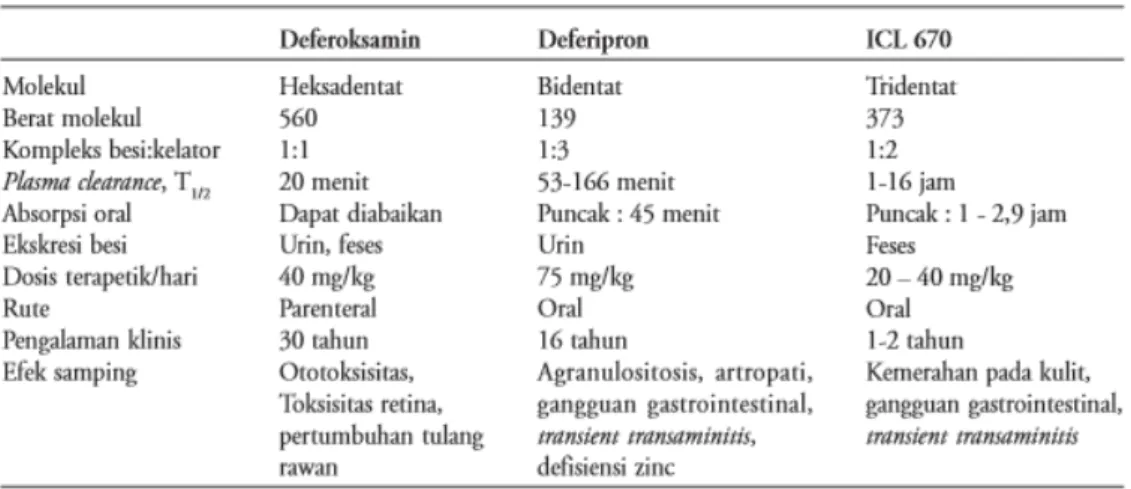
a. Deferoksamin
Deferoksamin (DFO) merupakan kelator besi dengan bentuk molekul heksadentat yang paling lama dan banyak dipakai yaitu sejak tahun 1976. Deferoksamin adalah molekul berbentuk heksadentat dengan berat molekul 560 kDa, dengan demikian deferoksamin sulit diabsorpsi di saluran cerna. Deferoksamin merupakan suatu asam trihidroksamat yang diproduksi oleh
Streptomyces pilosus. Zat ini mempunya spesifisitas untuk besi ferric (besi oksidat
dalam kompleks protein ferritin). Deferoksamin sulit diabsorpsi peroral dan cepat dimetabolisme, sehingga kekurangan utamanya adalah kebutuhan untuk diberikan secara infus parenteral kontinyu.
Satu molekul DFO dapat mengikat 1 atom besi dan memiliki stabilitas yang tinggi terhadap Fe3+. Deferoksamin merupakan suatu molekul hidrofilik sehingga ambilan ke dalam sel dan kompartemen subselular menjadi lambat, tetapi ambilan ke dalam hepatosit cukup cepat. Kadar terapi dicapai dalam waktu singkat yaitu sekitar 5-10 menit dan akan hilang segera setelah penghentian terapi yaitu sekitar 20 menit. Ekskresi obat terjadi melalui urin dan feses.19
2) Penggunaan
Pemberian deferoksamine dapat dilakukan setelah pemeriksaan kadar ferritin atau setelah satu tahun dan dilakukan pemeriksaan kadar besi hati dengan biopsi, dosis awal tidak melebihi 25-35 mg/kgBB/24 jam. Deferoksamine diberikan setiap hari selama 5 minggu (14). Dosis yang biasa diberikan adalah 40 mg/kg secara infus subkutan diberikan 8-12 jam, dalam 5-7 hari perminggu. Pemberian vitamin C sebesar 2-3 mg/kg peroral akan meningkatkan ekskresi besi di urin. Pemakaian DFO cukup efektif dalam menurunkan kadar besi dalam darah dan jaringan secara bermakna.19 Hal tersebut mengakibatkan kesintasan pasien talasemia mayor meningkat. Gabutti mendapatkan jumlah pasien yang hidup pada usia 30 tahun lebih besar pada kelompok yang patuh menggunakan DFO dibandingkan kelompok yang tidak patuh (95% : 12%). Modell dkk juga mendapatkan kematian yang masih terjadi akibat gagal jantung, terutama disebabkan oleh ketidakpatuhan dalam menggunakan kelasi besi. Masalah yang timbul pada penggunaan DFO adalah harga obat mahal, kepatuhan rendah dan komplikasi yang timbul.14
3) Efek Samping
Beberapa komplikasi akibat penggunaan DFO adalah gangguan pendengaran sensorineural frekuensi tinggi (18%), gangguan penglihatan/retina (6%), reaksi alergi (2%), gangguan pertumbuhan (2%), infeksi akibat Yersinia (1%), dan nyeri pada tempat pemasangan (9%). Cunningham mendapatkan bahwa nyeri pada tempat pemasangan DFO merupakan penyebab tersering pasien talasemia menghentikan penggunaan DFO. Olivieri dkk merekomendasikan deteksi dini toksisitas DFO untuk mengembalikan abnormalitas dengan cara modifikasi terapi (Tabel 2.1).
Tabel 2.1 Penuntasan Toksisitas Pada Penggunaan DFO
Kadar vitamin C yang rendah juga telah ditemukan pada pasien-pasien talasemia dengan kelebihan beban besi, suplementasi dapat meningkatkan ekskresi besi oleh deferoksamin dengan meluaskan cadangan besi yang dapat dikelasi. Namun terapi ini harus dilakukan secara hati-hati karena peluasan cadangan besi ini dapat meningkatkan pembentukan radikal bebas dan memperberat toksisitas besi. Karena efek samping ini, maka pemberian asam
askorbat hanya dianjurkan bila terdapat penurunan efisiensi pemberian deferoksamin dan diberikan dosis 100-200 mg hanya pada saat diberikan terapi deferoksamin (30-60 menit sesudah terapi dimulai).12,15
Walaupun kepatuhan berobat dengan deferoksamin merupakan permasalahan utama, studi-studi telah menunjukkan bahwa pemberian deferoksamin menunjukkan keuntungan kardioprotektif pada pasien-pasien yang melanjutkan terapi secara teratur. Penelitian-penelitian terbaru juga menunjukkan, pemberian deferoksamin selama lebih dari 10 tahun pada pasien talasemia dikaitkan dengan masa bebas komplikasi kelebihan beban besi yang panjang.12,14 b. Deferipron
Deferiprin (DFP) merupakan molekul bidentat dengan berat molekul 139 kDa. Penelitian jangka panjang dari deferipron pada talasemia telah menunjukkan penurukan kadar ferritin serum secara signifikan, terutama pada pasien dengan kadar ferritin sebelum studi lebih dari 5000 ng/dL. Efek kardioprotektif juga telah diamati dengan pemberian deferipron, pada sebuah penelitian penting yang dipublikasikan Mei 2006, tidak ada kejadian kardiak pada semua dari 157 pasien yang menerima deferipron sampai 9 tahun (paparan setara dengan 750 tahun pasien, Tabel 2.2).15,18
Obat ini juga menunjukkan efektivitas yang lebih baik dibandingkan deferoksamin dalam memindahkan besi miokardial pada pasien-pasien
asimptomatik. Sehingga dibandingkan dengan deferoksamin pemberian deferipron dikaitkan dengan proteksi kardiak yang lebih besar.
1) Mekanisme Kerja
Pada dasarnya cara kerja dari Deferipron (DFP) hampir sama dengan Deferoksamin (DFO), hanya saja pemberian kelator yang satu ini melalui oral. Tiga molekul DFP dapat mengikat 1 molekul besi (3:1) dengan onset puncak sekitar 45 menit setelah pemberian dan dengan waktu paruh sekitar 53-166 menit. Kelator ini mengekskresikan besi melalui urin.19
2) Penggunaan
Pemberian deferipron dapat dimulai dengan dosis 25 mg/kgBB diberikan 3 kali sehari dengan target terapi kadar ferritin di bawah 500 ng/dL. Walaupun studi-studi pada Tabel 2.2 telah menunjukkan efektivitas deferipron yang baik, namun oleh karena pengalaman menggunakan deferoksamin jauh lebih besar dan adanya kontroversi di sekitar penggunaan deferipron maka deferipron sampai saat ini masih digunakan sebagai terapi pengganti deferoksamin.16
Tabel 2.2 Efektivitas Deferoksamin vs Deferipron Dalam Mencegah Kejadian Kardiak15
Berbagai penelitian telah menunjukkan bahwa DFP berhasil menurunkan kadar feritin secara bermakna. Keuntungan lain menggunakan DFP adalah efek proteksi terhadap jantung yang merupakan penyebab kematian terbesar pada pasien talasemia. Efek kardioproteksi dilaporkan lebih superior dibandingkan DFO. Anderson dkk menunjukkan bahwa pasien talasemia yang menggunakan deferipron mempunyai kandungan besi di jantung yang lebih rendah dibandingkan dengan menggunakan deferoksamin. Pennell dkk menemukan bahwa DFP monoterapi selama 1 tahun lebih efektif secara bermakna dibandingkan DFO dalam memperbaiki siderosis miokardial asimptomatik pada talasemia-β mayor. 3) Efek Samping
Efek samping yang mungkin terjadi akibat penggunaan DFP adalah agranulositosis (0,5%), neutropenia (8,0%), artropati (15,0%), keluhan gastrointestinal (33,2%) dan peningkatan enzim transaminase hati. Agranulositosis dan neutropenia lebih sering timbul pada pasien yang mengalami
hipersplenisme dan merupakan efek samping serius. Meskipun demikian, Pennel dkk menemukan dalam penelitian selama 1 tahun bahwa agranulositosis ini bersifat sementara dan bahkan dapat membaik tanpa penghentian pengobatan. Artropati awalnya diduga terkait dengan kadar feritin serum pasien, namun penelitian tidak dapat membuktikan adanya keterkaitan tersebut. Keluhan gastrointestinal dan artropati akan makin menurun seiring dengan makin lama penggunaan DFP. Efek samping yang dapat tejadi termasuk kehilangan pendengaran frekuensi tinggi, abnormalitas retinal dan kelainan metafisis serta spinal yang dapat menyebabkan penurunan tinggi badan.14
Pemberian DFP pada talasemia pernah dikaitkan dengan peningkatan enzim alanin transferase (ALT) dan kejadian fibrosis hati. Sejauh ini belum ada penelitian yang dapat menunjukkan adanya kaitan bermakna antara penggunaan DFP dan fibrosis hati. Wanless dkk membuktikan dengan melakukan biopsi sebelum dan sesudah pemberian DFP pada pasien talasemia dan tidak ada satupun pasien yang mengalami fibrosis hati. Fibrosis hati pada pemberian DFP lebih sering terjadi pasien talasemia yang menderita hepatitis C sehingga diduga kuat bahwa kejadian fibrosis tersebut lebih disebabkan oleh infeksi hepatitis C.17 c. Deferasirox
Deferasirox atau dikenal sebagai ICL 670 adalah molekul tridentat dengan berat molekul 373 kDa.
Deferasirox akan membentuk ikatan 2 kelator dengan 1 atom besi (2:1). Afinitas deferasirox terhadap besi sangat tinggi, mudah diabsorpsi,dan dapat bersirkulasi selama beberapa jam. Hal ini terjadi karena konsentrasi puncak plasma dicapai dalam waktu 2 jam, dan masih dapat terdeteksi selama 24 jam; rerata waktu paruh eliminasi antara 11-16 jam. Dengan demikian deferasirox dapat diberikan hanya dosis tunggal untuk mencapai kadar terapi. Ekskresi utama deferasirox adalah melalui feses.19
2) Penggunaan
Deferasirox telah disetujui oleh United States Food and Drug
Administration untuk digunakan pada pasien kelebihan besi akibat transfusi bagi
pasien berusia lebih dari 2 tahun. Dosis deferasirox yang dapat diberikan adalah 20-40 mg/kg/hari. Dengan dosis ini eksresi besi dalam feses paling sedikit 0,3 mg/kgBB/hari yang cukup baik untuk menjaga keseimbangan besi pada pasien talasemia. Dosis 20 mg/kgBB/hari dalm 18 bulan pengobatan dilaporkan dapat mengurangi konsentrasi besi dalam hati sebanyak 1,2 mg/g berat kering hati dan ini sebanding dengan pengurangan besi hati oleh DFO yaitu 1,3 mg/g berat kering hati.
Terapi kelasi besi paling mutakhir yang telah disetujui oleh FDA (badan obat dan makanan AS) adalah deferasirox. Deferasirox diberikan sebagai dosis sekali sehari dilarutkan dalam segelas air, secara umum dapat ditoleransi baik; efek samping yang dilaporkan termasuk nausea, vomitus, diare, kram perut, kemerahan kulit dan peningkatan kadar kreatinin serum ringan. Kemampuan
kelasi deferasirox dua kali lebih kuat dari deferoksamin, di mana 1 mg deferasirox akan memindahkan besi dua kali lebih banyak dari 1 mg deferoksamin. Efisiensi kelasi deferasirox bergantung kepada asupan besi, pada asupan kurang dari 0,3 mg/kg maka efisiensi sebesar 22% dan akan meningkat menjadi 34% pada asupan lebih besar dari 0,5mg/kg. Sedangkan efisiensi kelasi deferoksamin secara rerata adalah 13%.11
Deferasirox diberikan awalnya 20 mg/kgBB per hari, pasien dengan transfusi lebih sering diberikan 30 mg/kgBB dan yang lebih jarang 10 mg/kgBB. Dosis dapat disesuaikan dengan 5-10 mg/kgBB dan disesuaikan dengan target terapi.17
Tabel 2.3 Perbandingan antara Deferoksamin, Deferipron dan Deferasirox
Efek samping utama adalah ruam kemerahan yang timbul bila diberikan dosis melebihi 40 mg/kg/hari. Ruam ini dapat hilang meskipun tanpa menghentikan pengobatan. Efek samping lain adalah peningkatan enzim transaminase, nausea, diare, nyeri kepala, dan nyeri abdomen. Efek nefrotoksik pernah dilaporkan terjadi pada penelitian terhadap tikus yang sebelumnya tidak mengalami kelebihan besi, sehingga diduga efek ini terkait dengan deprivasi besi yang berat. Proteinuria ringan sementara pernah terlihat pada pasien talasemia yang mendapat deferasirox namun hal ini lebih disebabkan oleh adanya kelainan ginjal sebelumnya.
d. Terapi Kombinasi
Terapi kombinasi adalah terapi kelasi besi yang menggunakan 2 jenis kelator yaitu deferoksamin dan deferipron. Kebutuhan akan terapi kombinasi didasari oleh perlunya kepatuhan dalam terapi kelasi besi dan kebutuhan DFO lebih sedikit sehingga meningkatkan kepatuhan dan mengatasi keterbatasan DFP dalam menginduksi keseimbangan besi negatif.
1) Mekanisme Kerja
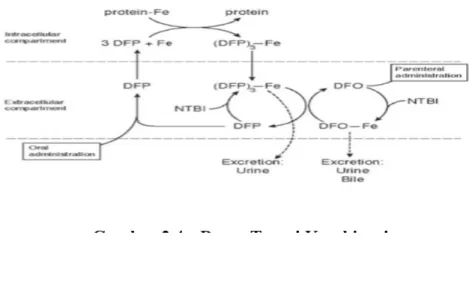
Dasar terapi kombinasi adalah adanya shuttle effect. Deferipron memasuki sel dan mengikat besi yang kemudian membawa ke dalam plasma. Besi selanjutnya ditransfer menjadi deferoksamin untuk diekskresikan ke urin dan feses.
2) Penggunaan
Terapi kombinasi tersebut menunjukkan hasil yang cukup baik, terlihat dari penurunan kadar feritin yang cukup bermakna untuk memperbaiki gangguan intolerasni glukosa. Terapi kombinasi menggunakan DFP 50 mg/kg/hari dan DFO 2,5-3 g/hari 3 hari/minggu dan menemukan peningkatan eksresi besi melalui urin dan penurunan kadar feritin serum yang baik. Pemberian DFP rutin dan DFO intermitten efektif dalam menurunkan kelebihan besi dan meningkatkan fungsi jantung pasien talasemia. Pemakaian terapi kombinasi tersebut juga dilaporkan meningkatkan kesintasan talasemia yang bermakna di Cyprus. Terapi kombinasi dapat diberikan secara simultan maupun sekuensial dalam waktu yang berbeda. Cara dan dosis pemakaian tertera pada Tabel 2.419
3) Efek Samping
Efek samping yang dapat terjadi pada pemberian terapi kombinasi ini adalah efek samping yang disebabkan oleh kedua obat terapi kelasi besi yang diberikan di atas.
Beberapa komplikasi akibat penggunaan DFO adalah gangguan pendengaran sensorineural frekuensi tinggi (18%), gangguan penglihatan/retina (6%), reaksi alergi (2%), gangguan pertumbuhan (2%), infeksi akibat Yersinia (1%), dan nyeri pada tempat pemasangan (9%). Cunningham mendapatkan bahwa nyeri pada tempat pemasangan DFO merupakan penyebab tersering pasien talasemia menghentikan penggunaan DFO.19
Efek samping yang mungkin terjadi akibat penggunaan DFP adalah agranulositosis (0,5%), neutropenia (8,0%), artropati (15,0%), keluhan gastrointestinal (33,2%) dan peningkatan enzim transaminase hati.14
BAB III
PENUTUP
A. Kesimpulan
Talasemia saat ini merupakan permasalahan kesehatan yang semakin besar di negara-negara berkembang. Seiring dengan perbaikan taraf kehidupan dan layanan kesehatan maka akan semakin banyak penderita talasemia yang mencapai usia dewasa. Pemberian terapi transfusi secara menahun akan mengakibatkan penderita talasemia menderita kelebihan beban besi dengan segala akibat dan komplikasinya.
Terapi dengan kelasi besi baik secara oral maupun intravena telah menunjukkan manfaat yang baik dalam menurunkan mortalitas dan morbiditas
pasien dengan hemosiderosis sekunder. Tidak ada perbedaan bermakna antara efektivitas terapi kelasi besi yang berbeda, sehingga pemilihan didasarkan pada preferensi dan ketersediaan obat di masing-masing tempat.
Upaya pencegahan kelebihan besi pada pasien talasemia mayor yang banyak dipakai saat ini adalah deferoksamin subkutan. Cara ini efektif dalam menurunkan kadar besi bila dilakukan teratur dengan kepatuhan yang tinggi. Untuk meningkatkan kepatuhan, dapat digunakan obat kelasi besi peroral yaitu deferipron (L1) atau deferasirox (ICL 670) yang dapat diberikan secara monoterapi ataupun kombinasi. Terapi kelasi besi peroral diharapkan meningkatkan kepatuhan pasien sehingga kerusakan organ akibat hemokromatosis dapat direduksi. Permasalahan yang masih muncul adalah harga kelator tersebut belum dapat dijangkau oleh sebagian besar masyarakat di negara berkembang termasuk Indonesia.16,17
DAFTAR PUSTAKA
1. McLeod C, et. al. Deferasirox for the treatment of iron overload associated with regular blood transfusions (transfusional hemosiderosis) in patients suffering with chronic anemia: a systematic review and economical evaluation. Health Technology Assesment 2009; 13: 123-126.
2. Abetz L, Baladi JF, Jones P, et.al. The impact of iron overload and its therapy on quality of life: result from a literature review. Health and Quality of Life Outcomes 2006; 4: 1-6.
3. Norbert G. Treatment of Secondary Hemochromatosis. Deutsches Ärzteblatt International 2009; 106: 499-504.
4. Davies SC, et. al. Screening for sickle cell disease and talasemia: a systematic review with supplementary research. Health Technology Assesment 2000; 4.
5. Greenberg PL, et al. Major hematologic disease in the developing world: New aspect of diagnosis and management of talasemia, malarial anemia and acute leukaemia. Hematology 2001: 479 - 498.
6. Ceci A, Mangiarini L, Fellsi M, et al. The Management of Iron Chelation Therapy:Preliminary Data from a National Registry of Talasemia Patients. Hindawi Publishing Corporation 2011; 1: 1-7.
7. Weatherall DJ. The hereditary anemias. [ed.] Drew Provan. ABC of Clinical Hematology 2nd ed. s.l. : BMJ Books, 2003.
8. Lichtman MA. Disorders of globin synthesis: the talasemias. William's Hematology 7th.ed. 2007.
9. Kohgo Y.et al. Body iron metabolism and pathophysiology of iron overload. International Journal of Hematology 2008; 88: 7-15.
10. Jabbar DA, Davison G, Muslin AJ. Getting the iron out: Preventing and treating heart faliure in transfussion dependent talasemia. Cleveland Clinic Journal of Medicine 2007; 7: 807-816.
11. Aessopos A, Berdoukas V, Tsironi M. The heart in transfusion dependent homozygousthalassaemia today – prediction, prevention and management. European Journal of Haematology 2007; 80: 93–106.
12. CMP Medica. Desferal vial drug information. www.mims.co.id. [Online] CMP Medica, 2014.[Cited: July 26, 2014]
13. Borgna-Pignatti C, et al. Cardiac morbidity and mortality in deferoxamine- or deferiprone-treated patients with talasemia major. Blood 2006; 107: 3733-3737.
14. Cohen AR. New Advances in Iron Chelation Therapy. Hematology 2006: 42-47.
15. Sharma RN, Pancholi SS. Oral Iron Chelators: A New Avenua for the Management of Talasemia Majo. Journal of Current Pharmaceutical Research 2010; 1: 1-7.
16. Tanner MA, Galanello R, Dessi C, et al. Combination chelation therapy in talasemia major for the treatment of severe myocardial siderosis with left ventricular dysfunction. Journal of Cardiovascular Magnetic Resonance 2008; 10(12): 1-9.
17. Bjh. Succesful chelation therapy with the combination of deferasirox and deferiprone in a patient with talasemia major and persisting severe iron overload after single-agent chelation therapies. Brities Journal of Haematology 2011; 154: 654-665.
18. Ceci A, Mangiarini L, Felisi M, et. al. The Management of Iron Chelation Therapy: Preliminary Data from a National Registry of Thalassaemic Patients. Hindawi Publishing Corporation 2011; 1: 1-7.
19. Gatot D. Pendekatan mutakhir kelasi besi pada thalassemia. Sari Pediatri 2007; 8(4): 78-84.