ISOLASI dan BIODEGRADASI LIMBAH DADUK oleh
KAPANG SELULOLITIK dari PERKEBUNAN TEBU
SKRIPSI
ALDILA WANDA NUGRAHA
PROGRAM STUDI S-1 BIOLOGI
DEPARTEMEN BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS AIRLANGGA
ISOLASI dan BIODEGRADASI LIMBAH DADUK oleh
KAPANG SELULOLITIK dari PERKEBUNAN TEBU
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Bidang Biologi
Pada Fakultas Sains dan Teknologi Universitas Airlangga
Disetujui oleh:
Pembimbing I, Pembimbing II,
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Isolasi dan Biodegradasi Limbah Daduk oleh Kapang Selulolitik dari Perkebunan Tebu Penyusun : Aldila Wanda Nugraha
Nomor Induk : 080810121 Tanggal Ujian : 26 Juni 2012
Disetujui oleh:
Pembimbing I, Pembimbing II,
Drs. Agus Supriyanto M. Kes. Dr. Ni’matuzahroh NIP.19620824 198903 1 002 NIP. 19680105 199203 2 003
Mengetahui,
Ketua Departemen Biologi Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
KATA PENGANTAR
Dengan memanjatkan puji syukur ke hadirat Allah Subhanallahu Wa Taala atas segala limpahan rahmat, karunia, dan hidayah-Nya, penyusun dapat menyelesaikan penulisan skripsi yang berjudul “ Isolasi dan Biodegradasi Limbah Daduk oleh Kapang Selulolitik dari Perkebunan Tebu”.
Dalam kesempatan ini penyusun mengucapkan terima kasih yang sebesar-besarnya kepada semua pihak atas segala bantuan yang diberikan, sehingga penulisan skripsi ini dapat terselesaikan dengan baik. Penyusun menyadari bahwa dalam penulisan naskah skripsi ini masih jauh dari sempurna, oleh karena itu segala kritik, tanggapan, maupun saran yang bersifat membangun diharapkan dapat menjadi perbaikan di masa mendatang.
Penyusun berharap semoga naskah skripsi ini dapat bermanfaat sebagai tambahan informasi dan wawasan bagi semua pihak.
Surabaya, Juni 2012 Penyusun,
UCAPAN TERIMA KASIH
Alhamdulillah, segala puji dan syukur selalu penyusun panjatkan ke hadirat Allah Subhanahu Wa Ta’ala yang telah menganugerahkan rahmat, taufik, serta hidayah-Nya sehingga penyusun dapat menyelesaikan penulisan naskah skripsi ini dengan baik.
Dalam kesempatan ini penyusun ingin menyampaikan ucapan terima kasih yang tak terhingga kepada:
1. Ibu Dr. Alfiah Hayati selaku Ketua Departemen Biologi Fakultas Sains dan Teknologi Universitas Airlangga yang senantiasa memberikan dorongan semangat kepada penyusun agar dapat menyusun skripsi ini dengan baik, 2. Bapak Drs. Agus Supriyanto, M. Kes. selaku dosen pembimbing I yang
senantiasa mencurahkan segenap ilmu, waktu, dan tenaga untuk memberikan bimbingan, arahan, dan masukan yang sangat berharga selama penyusunan konsep proposal, penelitian, hingga penulisan naskah skripsi ini,
3. Ibu Dr. Ni’matuzahroh selaku dosen pembimbing II yang telah memberikan bimbingan, masukan, saran, dan solusi selama penyusunan proposal, penelitian, hingga penyusunan naskah skripsi ini,
4. Bapak Drs. Salamun M. Kes. selaku dosen penguji III yang telah memberikan arahan, semangat, dan saran kepada penyusun semenjak sidang proposal hingga penyusunan naskah skripsi ini,
5. Bapak Drs. Saikhu Ahmad Husen M. Kes. selaku dosen penguji IV yang telah memberikan arahan, motivasi, dan saran kepada penyusun semenjak sidang skripsi hingga penyelesaian penyusunan naskah skripsi ini,
6. Ibu Tri Nurhariyati, S.Si., M. Kes. selaku dosen wali, terima kasih atas bimbingan dan ilmu yang diberikan selama menjadi dosen wali,
7. Segenap bapak – ibu dosen pengajar di Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya,
9. Bapak Ir. Budiarto, MMA selaku Kepala Pusat Penelitian Gula PT. Perkebunan Nusantara X (PERSERO) Penataran Jengkol Kediri,
10. Bapak Sandi Gunawan, S.Si selaku Kepala Seksi Bidang Mikrobiologi Pusat Penelitian Gula PT. Perkebunan Nusantara X (PERSERO) Penataran Jengkol Kediri,
11. Bapak Slamet Riyadi, Bapak Purwo Nurhadianto, A.Md, Bapak Misdi, dan Bapak Totok selaku karyawan Pusat Penelitian Gula PT. Perkebunan Nusantara X (PERSERO) Penataran Jengkol Kediri,
12. Keluarga tercinta: Ayahanda Ir. Sutoto, Ibunda Suhaedah, Adik Mohammad Hamzah Al-Fadhily, dan Adik Nizma Putri Choirunnisa yang selalu memberi doa, semangat dan dukungan,
13. Yaniar Wahyu Prabawanti, terima kasih atas segala bantuan, semangat, motivasi, dan doa yang diberikan baik semasa perkuliahan, penyusunan proposal, pelaksanaan penelitian, sampai dengan penulisan naskah skripsi ini, 14. Seluruh rekan-rekan Biologi angkatan 2008, terima kasih atas segala bantuan
dan semangat yang diberikan,
15. Karyawan dan Laboran Biologi FSaintek Unair: Bapak Setyanto, Bapak Suwarni, Bapak Sukadji, Bapak Eko Suyanto, Bapak Sunarto, Bapak M. Sudjoko, Bapak Catur Sasongko, Ibu Arie dan Ibu Yatminah yang senantiasa memberikan pelayanan dan bantuan kepada penyusun,
16. Semua pihak yang telah membantu serta memberi kenangan dan motivasi yang tidak dapat penyusun sebutkan satu persatu.
Surabaya, Juni 2012 Penyusun,
Aldila Wanda Nugraha. 2012. Isolasi dan Biodegradasi Limbah Daduk oleh Kapang Selulolitik dari Perkebunan Tebu. Skripsi ini di bawah bimbingan Drs. Agus Supriyanto, M. Kes. dan Dr. Ni’matuzahroh. Departemen Biologi, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Penelitian ini dilakukan untuk memperoleh kapang selulolitik dari limbah daduk dan menentukan genusnya, mengetahui pengaruh variasi jenis kapang dan waktu inkubasi terhadap biodegradasi limbah daduk, dan kombinasi kedua perlakuan tersebut yang menghasilkan rasio C/N terendah. Penelitian ini bersifat eksploratif dan eksperimental. Penelitian eksploratif terdiri dari isolasi kapang, pengamatan karakteristik makroskopis dan mikroskopis, serta uji potensi selulolitik tiap kapang pada media CMC. Penelitian eksperimental menggunakan rancangan faktorial 4x4 dengan tiga kali ulangan. Variabel yang digunakan adalah jenis kapang K0, K1, K2, dan K3 serta waktu inkubasi yang terdiri dari 2,4,6, dan 8 minggu. Penurunan rasio C/N dianalisa menggunakan uji ANAVA dua arah dan dilanjutkan dengan uji DUNCAN. Penelitian berhasil mendapatkan 12 isolat kapang, yang terdiri dari 5 isolat dari genus Aspergillus dan 7 isolat dari genus
Trichoderma. Uji CMC menunjukkan bahwa 11 isolat berpotensi sebagai kapang selulolitik. Variasi jenis kapang dan waktu inkubasi berpengaruh terhadap rasio C/N. Rasio C/N tertinggi didapatkan pada perlakuan kontrol (58,33). Rasio C/N terendah dicapai dari kombinasi jenis kapang K3 (Aspergillus sp.5) dan waktu inkubasi 8 minggu (20,68), dengan persentase penurunan hingga 64,55%.
Aldila Wanda Nugraha. 2012. Isolation and Biodegradation of Daduk’s Waste by Cellulolitic Mold from Sugarcane Farming. This study was supervised by Drs. Agus Supriyanto, M. Kes, and Dr. Ni’matuzahroh. Department of Biologi, Faculty of Science and Technology, Airlangga University, Surabaya.
ABSTRACT
The research was aimed to get cellulolitic mold of daduk's waste and determines its genus, to study the effect of mold types and incubation periods variation to daduk's waste biodegradation, and both treatment combinations that result the lowest C/N ratio. This are explorative and experimental research. Explorative research consisted of mold isolation, microscopic and macroscopic characteristic observation of mold, and cellulolitic potency test from each mold on CMC's media. The experimental research was conducted in a factorial design 4x4 with three replications. Variables that used were mold types K0, K1, K2, and K3 and also incubation periods which were consisted of 2,4,6, and 8 weeks. Decreasing of C/N ratio was analyzed using ANAVA two ways test and continued with DUNCAN's test. The research succesfully got 12 isolates of mold, consisted of 5 isolates from genus Aspergillus and 7 isolates from genus Trichoderma. CMC’s tests showed that 11 isolates were potentially as cellulolitic mold. Variation of mold types and incubation periods affected to C/N ratio. The highest C/N ratio was found on control treatment (58,33). The lowest C/N ratio was reach from combination of K3's mold type ( Aspergillus sp.5 ) and 8 weeks incubation periods (20,68), with decreasing percentage up to 64,55%.
DAFTAR ISI
Halaman
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN ... . ii
LEMBAR PENGESAHAN ... iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ... .. iv
KATA PENGANTAR ... v
2.2 Tinjauan Umum tentang Biodegradasi ... 8
2.3 Faktor-Faktor yang Mempengaruhi Pengomposan ... 10
2.4 Tinjauan Umum Kapang Selulolitik ... 14
2.4.1 Kapang Aspergillus niger ... 15
2.4.2 Kapang Trichoderma viride ... 17
2.4.3 Kapang Penicillium chrysogenum ... 18
2.5 Biodegradasi oleh Kapang Selulolitik ... 20
2.6 Tinjauan tentang Lignoselulosa ... 22
3.3 Prosedur Penelitian... 30
3.3.1 Pembuatan media ... 30
3.3.2 Tahap sterilisasi ... 30
3.3.3 Preparasi sampel daduk tebu ... 30
3.3.4 Penanganan sampel tahap identifikasi kapang ... 31
3.3.5 Tahap isolasi dan identifikasi kapang ... 32
3.3.6 Hasil pengamatan identifikasi kapang ... 34
3.3.7 Tahap perbanyakan isolat murni ... 34
3.3.8 Tahap pembuatan suspensi kapang ... 35
3.3.9 Tahap inokulasi suspensi kapang pada daduk tebu 35 3.3.10 Penentuan kadar C-organik ... 36
3.3.11 Penentuan kadar N-total ... 37
3.3.11.1 Melakukan destruksi sampel ... 37
3.3.11.2 Melakukan destilasi ... 37
3.4 Rancangan Penelitian ... 38
3.5 Variabel Penelitian ... 39
3.6 Pengumpulan Data ... 39
3.7 Analisis Data ... 40
BAB IV HASIL DAN PEMBAHASAN ... 41
4.1 Hasil Isolasi Kapang Indigenous Dari Limbah Daduk ... 41
4.1.1 Hasil identifikasi kapang genus Aspergillus ... 41
4.1.2 Hasil identifikasi kapang genus Trichoderma ... 48
4.2 Uji Potensi Kapang Selulolitik ... 57
DAFTAR TABEL
Nomor Judul Tabel Halaman 3.1 Rancangan faktorial 4x4 ... 39 4.1 Tabel karakteristik makroskopis kapang genus Aspergillus .. 41 4.2 Tabel karakteristik mikroskopis kapang genus Aspergillus ... 42 4.3 Tabel karakteristik makroskopis kapang genus
Trichoderma ... 48 4.4 Tabel karakteristik mikroskopis kapang genus
Trichoderma... 49 4.5 Visualisasi kapang (top verse) dan hasil screening potensi
isolat kapang selulolitik pada media CMC (Carboxyl
Methyl Celullose)... 60 4.6 Pengaruh kombinasi jenis kapang dan waktu inkubasi
DAFTAR GAMBAR
No. Judul Halaman
1 a). Daduk atau daun tebu kering ... 8
b). Tanaman tebu ... 8
2. Karakteristik mikroskopis Aspergillus niger ... 16
3. Karakteristik mikroskopis Trichoderma viride ... 18
4. Karakteristik mikroskopis Penicillium chrysogenum ... 19
5. Mekanisme hidrolisis selulosa secara enzimatis ... 22
6. Struktur kimia rantai selulosa... 23
7. Satuan penyusun lignin ... 26
8. Struktur kimia lignin ... 26
9. Struktur kimia hemiselulosa... 28
10. Isolat kapang Aspergillus niger ... 44
11. Isolat kapang Aspergillus sp.2 ... 45
12. Isolat kapang Aspergillus sp.3 ... 46
13. Isolat kapang Aspergillus sp.4 ... 46
14. Isolat kapang Aspergillus sp.5 ... 47
15. Isolat kapang Trichoderma sp.1 ... 51
16. Isolat kapang Trichoderma sp.2 ... 52
17. Isolat kapang Trichoderma sp.3 ... 53
18. Isolat kapang Trichoderma sp.4 ... 54
19. Isolat kapang Trichoderma sp.5 ... 54
21. Isolat kapang Trichoderma sp.7 ... 56 22. Koloni Aspergillus sp.5 yang dapat membentuk zona halo ... 57 23. Grafik pengaruh variasi jenis kapang dan lama waktu
DAFTAR LAMPIRAN Nomor Judul
1. Nilai rerata rasio C/N yang dihasilkan pada perlakuan berbagai variasi jenis isolat murni kapang selulolitik dan waktu inkubasi berbeda ... 74 2. Analisis statistik kenormalan data dan normalitas yang
disebabkan oleh galat percobaan menggunakan uji
Kolmogorov-smirnov... 76 3. Uji Levene Test untuk menguji homogenitas keragaman
data serta uji ANAVA untuk mengetahui pengaruh masing-
masing perlakuan terhadap rasio C/N ... 77 4. Uji Duncan untuk mengetahui derajat beda antar variasi
perlakuan (berbeda nyata atau tidak antar perlakuan) ... 79 5. Persyaratan teknis minimal pupuk organik menurut SK
Mentan No: 28/ Permentan/SR.130 /B/2009. Standar
BAB I PENDAHULUAN
1.1 Latar Belakang Masalah
Tebu (Saccharum officinarum) merupakan salah satu jenis tanaman yang hanya dapat ditanam di daerah yang memiliki iklim tropis. Di Indonesia, perkebunan tebu menempati luas areal ± 321.000 hektar dengan total produksi mencapai ± 2.000.000 ton pada tahun 2002. Selama ini, produk utama yang dihasilkan dari tebu adalah gula, sementara limbah yang lain tidak begitu diperhatikan seperti ampas tebu, tetes tebu, blotong, dan abu. Di luar limbah pabrik itu, tanaman tebu juga menghasilkan limbah sejak masa tanam hingga penebangan atau pemanenan berupa daun tebu kering yang disebut daduk. Limbah ini dapat dimanfaatkan untuk peningkatan kesuburan tanah dan memiliki nilai ekonomis. Perubahan paradigma industri gula menjadi industri yang menerapkan zero waste industry dengan mengoptimalkan pemanfaatan setiap limbah atau hasil samping dari tebu maupun proses pengolahannya, yang diharapkan dapat menekan Harga Pokok Produksi (HPP) gula (Misran, 2005).
disebabkan pula oleh rendahnya eksplorasi keanekaragaman kapang selulolitik potensial yang terdapat pada limbah daduk. Hasil eksplorasi dengan substrat berupa materi organik, berhasil diperoleh kapang yang memiliki potensi selulolitik yang terdiri dari genus Aspergillus, Trichoderma, Rhizopus,
Botryotrichum, dan Fusarium (Irawan dkk., 2008).
Kecepatan suatu bahan organik menjadi kompos dipengaruhi oleh rasio C/N, jika rasio C/N rendah, maka proses dekomposisi bahan tersebut berlangsung cepat, sebaliknya bila rasio C/N tinggi, maka proses dekomposisi bahan organik berjalan lambat (Vukobratović et al., 2008). Oleh karena itu diperlukan upaya dalam penanganan limbah tersebut, salah satunya adalah secara biologi dengan mempergunakan bantuan mikroba aerob maupun anaerob yang bertumpu pada kemampuan metabolisme mikroba dengan bantuan enzim sebagai katalisator biologis (Harlina, 2002).
dalam Prianko (2000) aktivitas Trichoderma viride mampu menurunkan rasio C/N ampas tebu dari 290:1 menjadi 31:1 dalam waktu 6 minggu dengan penambahan inokulum 15%.
dari semua hal tersebut di atas, disertai penambahan perlakuan variasi waktu inkubasi yang berbeda, diharapkan mendukung proses biodegradasi limbah daduk secara optimal dengan diindikasikan oleh penurunan rasio C/N. Dengan demikian daduk yang belum termanfaatkan secara optimal pada areal perkebunan tebu akan berkurang dan memiliki nilai ekonomis. Selain itu, informasi ini sangat diperlukan untuk meningkatkan kesuburan tanah secara alami setelah pemanenan tebu yang akan meningkatkan efisiensi pemupukan, memberikan nilai tambah terhadap daduk dan dapat dikembangkan lebih lanjut.
1.2 Rumusan Masalah
Berdasarkan latar belakang di atas diperoleh rumusan masalah sebagai berikut :
1. Apakah diperoleh kapang selulolitik dari limbah daduk hasil perkebunan tebu dan dari genus apa?
2. Apakah variasi jenis kapang dan waktu inkubasi berpengaruh terhadap biodegradasi limbah daduk yang diindikasikan dari rasio C/N?
3. Manakah kombinasi jenis kapang dan waktu inkubasi yang dapat menghasilkan rasio C/N terendah?
1.3 Asumsi Penelitian
selulolitik yang terdiri dari genus Aspergillus, Trichoderma, Rhizopus,
Botryotrichum, dan Fusarium (Irawan dkk., 2008). Dengan adanya
keanekaragaman kapang pada limbah daduk, maka dapat diperoleh kapang selulolitik indigenous sebagai penghasil enzim selulase yang mampu mendegradasi komponen materi organik pada daduk secara spesifik. Penambahan kapang dengan jenis berbeda, dapat memberikan hasil yang berbeda terhadap biodegradasi daduk tebu. Setiap jenis kapang menghasilkan tipe dan konsentrasi enzim berbeda yang nantinya berpengaruh terhadap biodegradasi daduk yang diindikasikan oleh penurunan rasio C/N. Demikian halnya dengan perlakuan variasi waktu inkubasi, semakin lama waktu inkubasi, maka semakin banyak aktivitas enzimatis sehingga daduk terdegradasi dengan optimal. Sehingga dapat diasumsikan bahwa kombinasi antara penambahan jenis kapang selulolitik yang berbeda serta lama waktu inkubasi 2, 4, 6, dan 8 minggu akan mempercepat proses biodegradasi limbah daduk yang diindikasikan dari perbedaan penurunan rasio C/N.
1.4 Hipotesis Penelitian 1.4.1 Hipotesis kerja
1.4.2 Hipotesis statistik
1. Ho : tidak ada pengaruh variasi jenis kapang selulolitik dan waktu inkubasi terhadap rasio C/N.
Ha : ada pengaruh variasi jenis kapang selulolitik dan waktu inkubasi terhadap rasio C/N.
1.5 Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Memperoleh kapang selulolitik dari limbah daduk hasil perkebunan tebu dan menentukan genusnya.
2. Mengetahui apakah variasi jenis kapang dan waktu inkubasi berpengaruh terhadap biodegradasi limbah daduk yang diindikasikan dari rasio C/N.
3. Mengetahui kombinasi jenis kapang dan waktu inkubasi yang dapat menghasilkan rasio C/N terendah.
1.6 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA 2.1 Tinjauan Umum Daduk Tebu
Daduk tebu yang merupakan daun tebu kering, merupakan limbah lignoselulosa yang menumpuk pada areal perkebunan setelah tanaman tebu dipanen, dan proses degradasinya umumnya dengan cara dibakar karena sulit didekomposisi secara alami. Daduk tebu dan tanaman tebu dapat dilihat pada gambar 2.1. a dan b. Struktur daduk tebu terdiri dari 38,3% selulosa, 30,06% hemiselulosa, 8,88% lignin, kadar abu 3,98%, serta mengandung sejumlah besar silika (Kurniawan dkk., 2008). Limbah ini sangat sulit dicerna sebagai pakan hewan dan berukuran relatif besar untuk dipindah tempatkan. Sifat-sifat fisik daun tebu (cincang) meliputi: ukuran partikel 1-10 cm, kepadatan massa 25-40 kg (kering) m-3, dan kadar air 10,37%. Sedangkan sifat-sifat kimianya yaitu: karbon 39,8; hidrogen 5,5; oksigen 46,8; dan nitrogen 0,19 (Jorapur et.al., 1997). Klasifikasi tebu berdasarkan taksonominya adalah sebagai berikut (Singh, 1999): Kingdom : Plantae
Division : Magnoliophyta Class : Liliopsida Subclass : Commelinidae Order : Poales
Family : Poaceae Genus : Saccharum
a. b.
Gambar 2.1. a). Daduk atau daun tebu kering dan b). Tanaman tebu (Sumber: Cheesman, 2004)
2.2 Tinjauan Umum tentang Biodegradasi
Biodegradasi adalah proses di mana bahan organik maupun anorganik mengalami penguraian secara biologis, khususnya oleh mikroba-mikroba yang memanfaatkan bahan organik sebagai sumber energi. Biodegradasi limbah lignoselulosa secara umum disebut pengomposan, dengan merubah materi organik menjadi kompos atau humus. Bermanfaat untuk meningkatkan kesuburan tanah dan merangsang perakaran yang sehat, memperbaiki struktur tanah dengan meningkatkan kandungan bahan organik tanah dan meningkatkan kemampuan tanah untuk mempertahankan kandungan air tanah (Isroi, 1997).
substansi sel kecil. Guna pembentukan biomassa, setiap 10 bagian C memerlukan 1 bagian N untuk membentuk protoplasma sel (Anas, 1992).
Umumnya degradasi dapat berlangsung secara aerob dan anaerob. Degradasi secara aerob dapat terjadi bila mendapat udara yang cukup dan berlangsung pada kelembaban 50-70%, dimana mikroorganisme perombak menggunakan karbon sebagai sumber energi dan bahan pembentuk protoplasma. Sedang pada kelembaban 75-85% degradasi akan berlangsung secara anaerob (Schlegel dan Schimdt, 1994). Proses pengomposan tanpa penambahan inokulum berlangsung selama 2-4 bulan (Apriadji, 1998). Perubahan-perubahan yang terjadi dalam pembuatan kompos adalah proses penguraian, pengikatan, dan pembebasan berbagai zat atau unsur hara (Sutedjo, 1990). Mereduksi ukuran potongan bahan mentah sebelum pengomposan akan mempercepat proses biodegradasi, ini disebabkan semakin luas permukaan yang tersedia bagi mikroorganisme pengurai untuk mendegradasi material-material organik tersebut (Murbandono, 1997). Diperkirakan jumlah mikroba dalam 1 gram tanah subur adalah: bakteri: 108 - 109; aktinomisetes: 107 - 108; protozoa: 103 - 105; alga: 103 - 106; dan kapang: 105 - 106 (Metting, 1993).
Perubahan rasio C/N dalam proses biodegradasi merupakan parameter utama yang menunjukkan adanya proses dekomposisi struktur kimia bahan organik. Rasio C/N dari bahan kompos akan mempengaruhi proses mikrobiologis dalam transformasi residu organik menjadi pupuk (Mindawati dkk., 1998). Menurut Murbandono (1997), proses biodegradasi dimaksudkan untuk menurunkan perbandingan C/N dari bahan organik yang akan
dipergunakan sebagai pupuk. Telah diketahui bahwa rasio C/N tanah pertanian antara 10-12, sedangkan bahan organik yang akan dipergunakan sebagai kompos pada umumnya memiliki kandungan C/N yang masih tinggi, sehingga belum bisa langsung digunakan sebagai kompos (Djojosuwito, 2000).
2.3 Faktor-Faktor yang Mempengaruhi Pengomposan
Isroi (1997) menyatakan faktor-faktor yang mempengaruhi proses pengomposan antara lain :
1. Rasio C/N
Rasio C/N yang efektif untuk proses pengomposan berkisar antara 20:1 hingga 30:1. Diperlukan mikroba untuk memecah senyawa C sebagai sumber energi dan menggunakan N untuk sintesis protein. Apabila rasio C/N terlalu tinggi, maka mikroba akan kekurangan N untuk sintesis protein sehingga dekomposisi berjalan lambat.
2. Ukuran partikel
Permukaan area yang lebih luas akan meningkatkan kontak antara mikroba dengan bahan dan proses dekomposisi akan berjalan lebih cepat. Ukuran partikel juga menentukan besarnya ruang antar bahan (porositas). Untuk memperluas permukaan dapat dilakukan dengan memperkecil ukuran partikel bahan tersebut.
3. Aerasi
air. Aerasi yang diberikan juga membantu menghilangkan sebagian panas yang dihasilkan sehingga temperatur dapat dipertahankan pada kondisi optimal untuk produksi enzim. Aerasi secara alami akan terjadi pada saat terjadi peningkatan suhu yang menyebabkan udara hangat keluar dan udara yang lebih dingin masuk kedalam tumpukan kompos. Aerasi ditentukan oleh porositas, ketebalan lapisan substrat, dan kelembaban. Apabila aerasi terhambat, maka akan terjadi proses anaerob yang akan menghasilkan bau yang tidak sedap. Aerasi dapat ditingkatkan dengan melakukan pembalikan atau mengalirkan udara ke dalam tumpukan kompos.
4. Porositas
Porositas adalah ruang di antara partikel di dalam tumpukan kompos. Rongga-rongga ini akan diisi oleh air dan udara. Udara akan mensuplai oksigen untuk proses pengomposan. Apabila rongga dijenuhi oleh air, maka pasokan oksigen akan berkurang dan proses pengomposan juga akan terganggu.
5. Kelembaban
aktivitas mikroba akan menurun dan terjadi pengomposan anaerob yang menimbulkan bau yang tidak sedap.
6. Temperatur/suhu
Panas dihasilkan oleh aktivitas mikroba. Ada hubungan langsung antara peningkatan suhu dengan konsumsi oksigen. Semakin tinggi temperatur akan semakin banyak konsumsi oksigen dan akan semakin cepat pula proses dekomposisi. Peningkatan suhu dapat terjadi dengan cepat pada tumpukan kompos. Temperatur yang berkisar antara 30-60°C menunjukkan aktivitas pengomposan yang cepat. Suhu yang lebih tinggi dari 60°C akan membunuh sebagian mikroba.
7. pH substrat
pH substrat yang optimum untuk proses pengomposan berkisar antara 6,5 sampai 7,5, karena enzim-enzim tertentu hanya akan mengurai suatu substrat sesuai dengan aktivitasnya pada pH tertentu. Proses pengomposan sendiri akan menyebabkan perubahan pada bahan organik dan pH substrat itu sendiri. Sebagai contoh, proses pelepasan asam, akan menyebabkan penurunan pH (pengasaman), sedangkan produksi ammonia dari senyawa-senyawa yang mengandung nitrogen akan meningkatkan pH pada fase-fase awal pengomposan. pH kompos yang sudah matang biasanya mendekati 7 (pH netral).
8. Kandungan hara
9. Kandungan bahan berbahaya
Beberapa bahan organik mungkin mengandung bahan-bahan yang berbahaya bagi kehidupan mikroba. Logam-logam berat seperti Mg, Cu, Zn, Ni, dan Cr adalah beberapa bahan yang termasuk kategori ini. Logam-logam berat akan mengalami imobilisasi selama proses pengomposan. 10. Lama waktu pengomposan
Lama waktu pengomposan tergantung pada karakteristik bahan yang akan dikomposkan dan metode pengomposan yang digunakan dengan atau tanpa penambahan aktivator pengomposan. Secara alami, pengomposan akan berlangsung dalam waktu beberapa bulan.
11. Aktivator pengomposan yang dipergunakan
Aktivator pengomposan merupakan organisme/mikroorganisme yang ditambahkan dalam media bahan organik untuk mengoptimalkan biodegradasi kompos. Kelompok organisme ini diantaranya adalah kapang, aktinomisetes, maupun bakteri. Jenis mikroorganisme dan konsentrasi yang berbeda akan berpengaruh terhadap waktu biodegradasi bahan organik.
C/N ratio 30:1 dalam perbandingan berat. Daduk memiliki rasio C/N yang cukup tinggi, sehingga jauh dari persyaratan optimal yaitu antara 25-30 (Cahaya dkk., 2008). Tingginya rasio C/N pada daduk, menyebabkan bahan tersebut mengalami proses pelapukan yang lambat secara alami (Hairiah, 2003).
Ada beberapa cara untuk mengetahui laju degradasi bahan organik antara lain: (1) menghitung CO2 yang dibebaskan atau O2 yang digunakan, (2) menghitung penurunan bahan organik atau rasio C/N yang berkurang, (3) mengamati penurunan kandungan senyawa tertentu antara lain lignin, selulosa atau hemiselulosa (Isroi, 2000).
2.4 Tinjauan Umum Kapang Selulolitik
Kapang adalah mikroorganisme multiseluler tidak berklorofil, berbentuk hifa atau miselium, eukariotik, berdinding sel dari kitin atau selulosa, menyerap nutrisi dengan cara absorbsi, bereproduksi seksual dan aseksual (membentuk spora). Sebagian besar tubuh kapang terdiri atas benang-benang yang disebut hifa, yang saling berhubungan menjadi semacam jala, yaitu miselium. Kapang dapat ditemukan pada substrat, baik di lingkungan darat, perairan, maupun udara, dan hidup dengan cara mencerna sisa-sisa materi organik dan sampah, yang juga berperan penting dalam mendaur ulang mineral dan karbon. Kapang dapat mensintesis protein dengan mengambil sumber karbon dari karbohidrat (misalnya glukosa, sukrosa atau maltosa), sumber nitrogen dari bahan organik atau anorganik, dan mineral dari substratnya (Gandjar et al., 1999).
berlangsung karena aksi katalisator biokimia yaitu enzim yang dihasilkan oleh mikroba hidup tertentu, menyebabkan perubahan bahan organik yang kompleks menjadi bahan yang lebih sederhana oleh kegiatan enzim dari mikroorganisme.
Penelitian yang dilakukan oleh Pujiati (2009) menunjukkan bahwa pada inokulum Aspergillus niger dengan kepadatan spora sebesar 650/mm3,dengan konsentrasi sebesar 20% terjadi penurunan rasio C/N ampas tebu yang semula 269,738 menjadi 117,932 dengan penurunan 56,28%, konsentrasi inokulum 30% sebesar 116,958 dengan penurunan 56,64% dan pada konsentrasi inokulum 40% besarnya rasio C/N adalah 132,585 dengan penurunan 50,85%. Sedangkan uji potensi pada Trichoderma viride dengan substrat ampas tebu yang memiliki rasio C/N awal sebesar 269,74. Pada konsentrasi 20% didapat rerata rasio C/N sebesar 136,56; dengan konsentrasi 30% sebesar 137,95; dan pada konsentrasi 40% didapat rerata rasio C/N sebesar 130,28. Hal ini menunjukkan tidak terjadi perbedaan rerata rasio C/N yang signifikan antara konsentrasi 20%, 30%, dan 40%, sehingga apabila diaplikasikan untuk pengomposan, akan lebih efisien jika mempergunakan konsentrasi inokulum sebesar 20% v/w (Choiroh, 2009).
2.4.1 Kapang Aspergillus niger
Aspergillus niger merupakan salah satu jenis kapang selulolitik, yaitu kapang yang memiliki kemampuan merombak atau mendegradasi selulosa terutama pada kondisi aerob, ditunjukkan pada gambar 2.2. Klasifikasi kapang
Aspergillus niger berdasarkan Madigan et al. dalam Brock Biology of Microorganisms Eleventh Edition (2006) adalah sebagai berikut :
Phylum : Ascomycota Class : Eurotiomycetes Order : Eurotiales Family : Trichocomaceae Genus : Aspergillus
Species : Aspergillus niger
Gambar 2.2. Karakteristik mikroskopis Aspergillus niger (Sumber: Madigan et al., 2006 ).
Koloni Aspergillus niger dapat mencapai ukuran 4-5 cm dalam 7 hari dan terdiri dari lapisan basal yang kompak berwarna putih hingga kuning dan suatu lapisan konidiofor yang lebat yang berwarna coklat tua hingga hitam. Kepala konidia berwarna hitam, berbentuk bulat dan cenderung merekah menjadi kolom-kolom pada koloni berunur tua. Vesikula berbentuk bulat hingga semi bulat, berukuran 3,5-5,0 µm, berwarna coklat, memiliki ornamentasi berupa tonjolan dan duri-duri yang tidak beraturan (Gandjar et al., 1999).
dengan zat makanan yang tedapat dalam media. Molekul sederhana yang terdapat disekeliling hifa dapat langsung diserap, molekul lain yang lebih kompleks seperti protein, lemak, dan selulosa harus dipecah sebelum diserap ke dalam sel, untuk itu Aspergillus niger menghasilkan beberapa enzim ekstraseluler diantaranya selulase (Pujiati, 2009).
2.4.2 Kapang Trichoderma viride
Karakteristik makroskopis Trichoderma viride berupa koloni berwarna putih kehijauan dan selanjutnya hijau redup terutama pada bagian yang banyak terdapat konidia, sedangkan bagian reverse tidak berwarna. Konidiofor dapat bercabang menyerupai piramida, yaitu pada bagian bawah cabang lateral yang berulang-ulang. Konidia berbentuk semibulat hingga oval pendek dan berdinding relatif kasar. Klamidospora umumnya ditemukan dalam miselia dari koloni yang sudah tua, terletak interkalar dan kadang terminal, berbentuk bulat dan berdinding halus (Gandjar et al., 1999). Ditunjukkan pada gambar 2.3. Klasifikasi kapang Trichoderma viride berdasarkan Madigan et.al dalam Brock Biology of Microorganism Ninth Edition (2000) adalah sebagai berikut :
Kingdom : Fungi Phylum : Ascomycota Class : Sordariomycetes Order : Hypocreales Family : Hypocreaceae Genus : Trichoderma
Gambar 2.3. Karakteristik mikroskopis Trichoderma viride (Sumber : Madigan et al., 2000).
Studi enzim selulase kompleks yang diisolasi dari genus Trichoderma
menunjukkan keberadaan enzim berikut ini: (1) endoglukanase atau endo 1,4-β -D-glukanase, (2) eksoglukanase atau ekso-β-1,4-D-glukanase atau selobio- hidrolase yang memotong dari ujung-ujung rantai disakarida selobiosa, (3) β -glukosidase yang menghidrolisis selobiosa dengan membentuk glukosa (Fengel and Wegner, 1995). Menurut Prihatmani (1995) dalam Prianko (2000) aktivitas
Trichoderma viride mampu menurunkan rasio C/N ampas tebu dari 290:1 menjadi 31:1 dalam waktu 6 minggu dengan penambahan starter 15%.
2.4.3 Kapang Penicillium chrysogenum
serta terbentuk dalam kolom-kolom yang tidak padat (Gandjar, et al., 1999). Ditunjukkan pada gambar 2.4. Klasifikasi kapang Penicillium chrysogenum
berdasarkan Brock Biology of Microorganism Ninth Edition (2000) adalah sebagai berikut :
Kingdom : Fungi Phylum : Ascomycota Class : Eurotiomycetes Order : Eurotiales Family : Trichocomaceae Genus : Penicillium
Species : Penicillium chrysogenum
Gambar 2.4. Karakteristik mikroskopis Penicillium chrysogenum.
(Sumber: Madigan et al., 2000).
Koloni kapang Penicillium tumbuh cepat pada media Czapek’s Dox dan PDA dengan waktu inkubasi selama 7 hari atau lebih. Kapang ini berbeda dengan Aspergillus terutama pada pendukung konidia, pada Penicillium
2.5 Biodegradasi oleh Kapang Selulolitik
Peran penting mikroorganisme dalam degradasi selulosa adalah menguraikan unsur hara yang terikat dalam material organik yang sukar larut diubah menjadi senyawa organik yang terlarut. Dari penguraian ini dihasilkan senyawa asam format, asam malat, gula reduksi dan non reduksi, asam fosfat dan bermacam-macam bentuk unsur hara yang tersedia bagi tanaman. Kapang mengurai selulosa dan mengubahnya menjadi CO2 dan materi sel, kemudian energi dan CO2 yang terbentuk digunakan untuk pertumbuhannya. Untuk keperluan tersebut dihasilkan enzim ekstraseluler karena sel mikroorganisme impermeabel terhadap molekul selulosa.
awal proses degradasi. Menurut Judoamidjojo dkk. (1989) enzim selulase tidak dapat bekerja pada lignin, hal tersebut dikarenakan lignin berukuran makro molekul (BM 38.000-75.000) sehingga enzim selulase tidak dapat berpenetrasi ke dalam lapisan lignin yang dilindungi oleh selulosa dan hemiselulosa.
Sehubungan dengan hal ini Isroi (1997) menyatakan bahwa perlakuan pendahuluan secara mekanis untuk mengurangi ukuran partikel dan mendorong pembengkakan selulosa merupakan hal penting dalam peningkatan degradasi selulosa. Selain itu praperlakuan kimiawi sebelum proses enzimatis yang dilakukan dengan melarutkan substrat lignoselulosa ke dalam larutan asam atau basa kuat untuk mengurangi lignin juga dapat meningkatkan degradasi selulosa. Fan dan Lee (1983) mengemukakan bahwa mekanisme hidrolisis selulosa secara enzimatis (gambar) sebagai berikut :
2. enzim endo-β-1,4-glukanase ( Cx) yang memecah ikatan β-1,4 glukosida secara acak, terutama pada bagian amorf untuk menghasilkan selobiosa sebagai produk utama. Tetapi enzim ini tidak aktif pada bagian kristal.
3. Enzim ekso-β-1,4-selobiohidrolase (CBH) memisahkan suatu unit selobiosa dari ujung non pereduksi rantai selulosa. Komponen ini tidak terlalu aktif menyerang baik daerah kristal maupun daerah amorf, tetapi setiap komponen ini berinteraksi dengan kedua daerah tersebut.
Gambar 2.5. Mekanisme hidrolisis selulosa secara enzimatis (Fan dan Lee, 1983). 2.6 Tinjauan tentang Lignoselulosa
Lignoselulosa adalah komponen utama tanaman yang menggambarkan jumlah sumber bahan organik yang dapat diperbarui. Lignoselulosa terdiri dari selulosa, lignin, hemiselulosa, dan beberapa bahan ekstraktif lain. Semua komponen lignoselulosa terdapat pada dinding sel tanaman (Lynd et al., 2002).
2.6.1 Selulosa
Selulosa merupakan komponen utama penyusun dinding sel tanaman. Kandungan selulosa pada dinding sel tanaman tingkat tinggi sekitar 35-50% dari berat kering tanaman (Lynd et al., 2002). Selulosa merupakan polimer glukosa dengan ikatan β-1,4 glukosida dalam rantai lurus, struktur dasar selulosa berupa suatu selobiosa yaitu dimer dari glukosa. Rantai panjang selulosa terhubung bersama melalui ikatan hidrogen dan gaya van der Waals.
Selulosa mengandung sekitar 50-90% bagian kristal dan sisanya bagian amorf. Selulosa merupakan satu polimer dari glukosa yang memiliki struktur fisik yang spesifik dan resistan terhadap bahan-bahan reaksi kimiawi. Selulosa memiliki bentuk senyawa kimiawi terpisah (tunggal). Selulosa banyak terdapat
Selulosa kristal
ekso- β-1,4-selobiohidrolase (CBH)
Cx + CBH
Selobiosa
Glukosa Cx
β-glukosidase
pada bahan-bahan berserat dan berkayu seperti pada jerami, rumput, daun-daunan, batang, dan ranting tanaman. Pada tanaman muda dan tanaman yang banyak mengandung air, bahan dinding selnya memiliki persentase jumlah yang rendah, sedangkan kandungan gula, protein dan bahan-bahan yang terlarut memiliki persentase jumlah yang tinggi. Pada tanaman dewasa, batang, daun dan ranting-rantingnya memiliki kandungan selulosa yang tinggi. Selulosa dapat didegradasi dengan mudah hanya oleh organisme-organisme tertentu yang spesifik, diantaranya kapang, bakteri, Actinomycetes dan hewan-hewan tingkat rendah (Aziz et al., 2002).
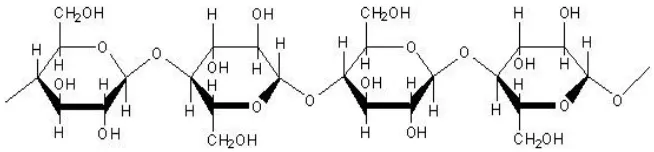
Selulosa merupakan polisakarida yang mempunyai rumus molekul (C6H10O5)n dan sebagian bahan dasar dari jaringan tanaman. Struktur kimia rantai selulosa ditunjukkan pada gambar 2.6. Secara alamiah molekul selulosa disusun dalam bentuk fibril, terdiri dari beberapa molekul glukosa paralel yang dihubungkan oleh ikatan hidrogen (Jalil, 2004).
Selulosa membentuk komponen serat dari dinding sel tumbuhan. Tingkat kekuatan selulosa disebabkan oleh struktur keseluruhannya. Molekul selulosa merupakan rantai-rantai, atau mikrofibril dari D-glukosa sampai sebanyak 14.000 satuan yang terikat satu sama lain oleh ikatan hidrogen. Suatu molekul tunggal selulosa merupakan polimer lurus dari 1,4-β-D-glukosa (Howard, 2003).
Selulosa merupakan komponen utama penyusun dinding sel tanaman dan hampir tidak pernah ditemui dalam keadaan murni di alam, melainkan berikatan dengan bahan lain, yaitu lignin dan hemiselulosa (Lynd et al., 2002) membentuk suatu lignoselulosa. Degradasi selulosa oleh bakteri merupakan hasil kerja sekelompok enzim selulase (Howard et al., 2003) yang bekerja secara sinergis.
Menurut Sudana (1993) titik pusat pendekomposian selulosa terletak pada pecahnya ikatan 1,4β-glukosida. Pecahnya ikatan 1,4β-glukosida menyebabkan selulosa terhidrolisis menjadi senyawa yang lebih sederhana, yaitu oligosakarida (terutama selobiosa). Selanjutnya oligosakarida akan terhidrolisis menjadi monosakarida (terutama glukosa). Pemecahan ikatan 1,4β-glukosida dilakukan oleh komplek enzim selulase.
Sistem selulase sekurang-kurangnya terdiri dari tiga enzim: (1) Enzim endo β-1,4-glukanase mempengaruhi secara serentak ikatan β-1,4 di dalam makromolekul dan menghasilkan potongan-potongan besar berbentuk rantai dengan ujung-ujung bebas, (2) Enzim ekso-β-1,4-glukanase memotong mulai dari ujung-ujung rantai disakarida selobiosa, (3) Enzim β-glukosidase menghidrolisis selobiosa dengan membentuk glukosa. Enzim-enzim ini hanya akan dibentuk oleh mikroorganisme (Schlegel dan Schmidt, 1994).
2.6.2 Lignin
baik secara biologi, enzimatis, maupun kimia. Struktur ini ditemukan dalam semua tanaman dengan konsentrasi yang berlainan tergantung sifat tanaman dan tingkat pertumbuhan. Biasanya konsentrasi berkisar antara 5-30%, dimana tumbuhan yang usianya lebih tua kandungan ligninnya lebih banyak dibanding tumbuhan yang usianya muda.
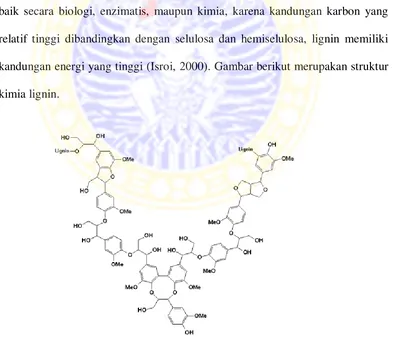
Lignin sulit didegradasi karena strukturnya yang kompleks dan heterogen, serta berikatan dengan selulosa dan hemiselulosa dalam jaringan tanaman. Lebih dari 30 % tanaman tersusun atas lignin yang memberi bentuk yang kokoh dan memberikan proteksi terhadap serangga dan patogen (Orth et al., 1993). Di samping memberikan bentuk yang kokoh terhadap tanaman, lignin juga membentuk ikatan yang kuat dengan polisakarida yang melindungi polisakarida dari degradasi mikroba dan membentuk struktur lignoselulosa. Secara alami lignin berwarna coklat, jika daduk berubah warna menjadi agak putih, berarti ada sebagian kandungan lignin yang hilang atau mulai terdegradasi, dengan struktur yang lebih lunak dibanding pada umumnya (Isroi, 2000).
arilalkil dan ikatan eter. Lignin merupakan senyawa polimer aromatik yang sulit didekomposisi dan hanya sedikit organisme yang mampu mendegradasi lignin, diantaranya kapang lignoselulolitik.
Gambar 2.7. Satuan penyusun lignin (Steffen, 2003)
Lignin adalah molekul komplek yang tersusun dari unit fenilpropan yang terikat di dalam struktur tiga dimensi. Lignin sangat resisten terhadap degradasi, baik secara biologi, enzimatis, maupun kimia, karena kandungan karbon yang relatif tinggi dibandingkan dengan selulosa dan hemiselulosa, lignin memiliki kandungan energi yang tinggi (Isroi, 2000). Gambar berikut merupakan struktur kimia lignin.
2.6.3 Hemiselulosa
Hemiselulosa merupakan suatu polisakarida lain yang terdapat dalam tanaman dan tergolong senyawa organik. Hemiselulosa bersifat non-kristalin dan tidak bersifat serat, mudah mengembang karena itu hemiselulosa sangat berpengaruh terhadap bentuknya jalinan antara serat pada saat pembentukan lembaran, lebih mudah larut dalam pelarut alkali dan lebih mudah dihidrolisis dengan asam. Perbedaan hemiselulosa dengan selulosa yaitu hemiselulosa mudah larut dalam alkali tapi sukar larut dalam asam, sedang selulosa adalah sebaliknya. Hemiselulosa juga bukan merupakan serat-serat panjang seperti selulosa. Hasil hidrolisis selulosa akan menghasilkan D-glukosa, sedangkan hasil hidrolisis hemiselulosa akan menghasilkan D-xilosa dan monosakarida lainnya. Hemiselulosa tersusun dari gabungan gula-gula sederhana dengan lima atau enam atom karbon, ditunjukkan pada gambar 2.9. (Hidayati, 2007).
berlangsung, hemiselulosa akan melunak, dan pada saat hemiselulosa melunak, serat yang sudah terpisah akan lebih mudah menjadi berserabut (Indrani, 2006). Di bawah ini adalah gambar struktur hemiselulosa.
BAB III
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini telah dilaksanakan di laboratorium Mikrobiologi Departemen Biologi Fakultas Sains dan Teknologi Universitas Airlangga, Surabaya dan Laboratorium Pengujian Tanah dan Pupuk Pusat Penelitian Gula PT. Perkebunan Nusantara X (PERSERO) Kabupaten Kediri, Jawa Timur selama bulan Januari hingga Mei 2012.
3.2 Bahan dan Alat Penelitian 3.2.1 Bahan penelitian
Bahan penelitian yang digunakan dalam penelitian ini, yakni daduk tebu hasil sampling dari 5 plot acak pada perkebunan tebu Puslit Gula PTPN X Djengkol Kab. Kediri, kapas, aluminium foil, plastik wrap, akuades, alkohol 70%, spiritus, tissue, media PDA (Potato Dextrose Agar), Sodium CMC (Carboxyl Methyl Cellulose), akuades, NaCl, KNO3, agar, Congo red, H2SO4 pa. 98%, selenium mixture (katalis destilasi), H3BO3 1%, NaOH 40%, H2SO4 0,1 N. 3.2.2 Alat penelitian
pembakar bunsen, label, kertas, set alat titrasi, pencacah daun, Vapodest
(destilator), Digestion apparatus (pemanas listrik/block digestor Kjedahltherm), labu Kjedahl, gelas ukur, dan eksikator.
3.3 Prosedur Penelitian 3.3.1 Pembuatan media
Media yang digunakan untuk isolasi dan identifikasi adalah: media PDA, chloramphenikol, media CMC (Carboxyl Methyl Cellulose), dan Congo red.
3.3.2 Tahap sterilisasi
Semua alat penelitian berupa cawan Petri, labu Erlenmeyer, botol kultur, tabung reaksi, pipet ukur, dan gelas ukur sebelum digunakan harus disterilkan terlebih dahulu dalam autoklaf pada suhu 121oC selama 15 menit pada tekanan 1 atm. Semua bentuk kegiatan dalam penelitian ini dilakukan secara aseptik. 3.3.3 Preparasi sampel daduk tebu
dalam labu Erlenmeyer volume 1L untuk 4 perlakuan yang masing-masing diulang 3 kali (Suwastika, 2007).
3.3.4 Penanganan sampel tahap isolasi kapang
(1) Sampel daduk tebu didapatkan dari lahan perkebunan tebu PTPN X Kediri. Pengambilan sampel dilakukan secara acak sebanyak 5 sampel dengan metode plot acak, lalu ke-5 sampel dijadikan satu.
(2) Semua kegiatan yang dilakukan baik pada pengambilan sampel dan terutama pada laboratorium dilakukan secara aseptik.
(3) Memasukkan 30 gram sampel daduk tebu ke dalam labu Erlenmeyer yang telah berisi 450 ml akuades steril, kemudian dihomogenkan.
(4) Selanjutnya mengambil suspensinya, kemudian diencerkan dengan pengenceran seri 10-1, 10-2, 10-3,10-4, 10-5 dalam 5 tabung reaksi yang telah berisi 9 ml akuades steril pada setiap tabung reaksi.
Bagan kerja penanganan dan penanaman sampel
3.3.5 Tahap isolasi dan identifikasi kapang 1. Tahap isolasi
Setelah melalui seri pengenceran, 1 ml suspensi pengenceran pada seri 10-3 dan 10-5 ditanamkan pada cawan Petri yang telah berisi media PDA (potato dextrose agar) dengan ditambah 1 ml antibiotik chloramphenikol pada tiap cawan Petri sebagai anti bakteri dengan menggunakan metode pour plate. Media yang digunakan berada dalam kisaran pH 6,5 – 7,5. Setelah ditanam, masing-masing cawan Petri diinkubasi pada suhu ruang selama 5-7 hari.
Setelah koloni kapang tumbuh di dalam media cawan Petri, masing-masing koloni dipindahkan ke media agar miring potato dextrose agar
(PDA) untuk mendapatkan isolat murni, dan diinkubasi pada suhu ruang selama5 hari. Kemudian tiap jenis isolat dikarakterisasi melalui pengamatan makroskopis koloni dan mikrokopis kapang.
2. Tahap identifikasi
a. Pengamatan makroskopis
antaranya: 1) warna koloni top dan reverse, 2) tekstur koloni, 3) zonasi, 4) radial furrow dan 5) adanya tetes eksudat.
b. Pengamatan mikroskopis
Karakter mikroskopis dari isolat kapang yang ditemukan diindentifikasi dengan menggunakan panduan kunci indentifikasi. Pengamatan mikroskopis kapang diamati dengan pembuatan slide culture, dimana isolasi kapang dari media biakan miring diambil memakai jarum ose dan ditumbuhkan pada gelas obyek steril yang telah berisi setetes media PDA. Slide culture yang terdapat spora kapang ini kemudian diinkubasi selama 5 hari pada suhu kamar. Kapang yang tumbuh pada slide culture diamati di bawah mikroskop dengan perbesaran 100- 400x. Pengamatan mikroskopis kapang ini meliputi: 1) keadaan hifa, 2) bentuk spora, 3) konidiofor / sporangiofor dan, 4) bentuk conidial head (Gandjar dkk, 1999).
3. Tahap uji potensi
a. Setelah di dapatkan isolat murni dari masing-masing isolat, selanjutnya dilakukan uji biodegradasi selulosa dengan menggunakan media CMC(Carboxyl Methyl Cellulose). Isolat murni yang akan diuji potensi, ditanam dengan cara ditutul di 2 titik pada cawan petri yang telah berisi media CMC(Carboxyl Methyl Cellulose) padat. Masing-masing cawan Petri berisi satu isolat dan diinkubasi selama 5 hari.
Cellulose), kemudian diwarnai menggunakan larutan Congo red 0.1% dengan cara dibilas selama 30 menit, kemudian larutan dibuang. Selanjutnya cawan dibilas dengan air fisiologis sebanyak 3 kali untuk mengurangi kepekatan warna Congo red pada media. Pewarnaan ini untuk mengetahui kemampuan kapang dalam mendegradasi selulosa dengan indikasi terbentuk zona halo (clear zone) dengan tingkat kecerahan tertentu sesuai kemampuan degradasi kapang tersebut (ditandai dengan simbol: + = rendah, ++ = sedang, +++ = tinggi, ++++ = tinggi sekali / cerah sekali).
3.3.6 Hasil pengamatan identifikasi dan uji potensi kapang
Hasil yang didapat berupa data karakteristik dari setiap jenis kapang
indigenous yang diperoleh, melalui serangkaian identifikasi morfologi makroskopis koloni dan mikroskopis kapang. Seluruh kapang yang diperoleh diuji screening kemampuan degradasi selulosa pada media CMC, maka didapat data jenis-jenis kapang selulolitik. Dari seluruh isolat kapang berpotensi selulolitik, dipilih 3 jenis isolat paling potensial (diameter zona halo terluas dan tingkat kecerahan tinggi) untuk diuji lebih lanjut kemampuan degradasinya terhadap limbah daduk tebu, dengan indikasi penurunan rasio C/N serta variasi waktu inkubasi 0, 2, 4, 6, dan 8 minggu.
3.3.7 Tahap perbanyakan isolat murni
tabung reaksi, setelah agar memadat dilakukan inokulasi kultur murni kapang dan diinkubasi pada suhu kamar selama ± 5 hari.
3.3.8 Tahap pembuatan suspensi kapang
Kultur biakan murni setiap jenis kapang selulolitik dalam tabung reaksi dihomogenkan dengan akuades steril, lalu suspensi konidia dari setiap tabung dipindahkan ke dalam botol kultur berukuran 125 ml. Suspensi konidia diambil menggunakan pipet tip 1 ml lalu dilakukan pengenceran seri untuk mendapatkan konsentrasi konidia 10-3, 10-4, 10-5,10-6, dari masing-masing suspensi tersebut dihitung jumlah konidianya dengan Haemositometer, suspensi diambil menggunakan pipet tip 10µ l. Pada penelitian ini ditentukan konsentrasi konidia pada setiap substrat uji adalah sebesar 106 konidia/gram substrat daduk. Pada aplikasinya, setiap 30 gram substrat uji akan ditambah 30 ml suspensi konidia, kemudian kembali ditambah 40 ml akuades hingga homogen.
3.3.9 Tahap inokulasi suspensi kapang pada daduk tebu
3.3.10 Penentuan kadar C-organik
1. Menimbang krus porselen di atas neraca analitik dan mencatat beratnya 2. Memasukkan kompos daduk sampai berat bertambah sebanyak 1 gram dan
mencatat beratnya
3. Memasukkan krus berisi kompos kedalam oven dengan suhu 105°C selama 4 jam
4. Memindahkan krus dalam eksikator hingga dingin
5. Menimbang berat krus berisi kompos daduk dan mencatat beratnya
6. Memasukkan krus dalam furnace dengan suhu 300°C selama 1,5 jam dan selanjutnya pada suhu 600°C selama 2,5 jam
7. Mematikan furnace dan mendinginkan krus dalam eksikator
8. Menimbang krus diatas neraca analitik ( Eviati dan Sulaiman, 2009) Perhitungan :
% Kadar air = x 100%
% Abu = x 100%
% BO = 100 – (E+F)
C-Organik =
Keterangan :
A = berat cawan
B = berat cawan + contoh
F = hasil penghitungan persentase abu G = hasil penghitungan persentase berat organik
1,724 = Faktor
3.3.11 Penentuan kadar N-total 3.3.11.1 Melakukan destruksi sampel
1. Menimbang 0,5 gram sampel dalam labu Kjedahl 2. Menambahkan 0,25-0,5 gram selenium mixture
3. Menambahkan 5 ml H2SO4 pa.
4. Mengocok sampel agar homogen, lalu mendiamkan selama 10-15 menit 5. Melakukan destruksi hingga sempurna pada suhu 350°C selama 3,5 jam 6. Mendinginkan cairan jernih (jernih menandakan destruksi sempurna) 7. Menambahkan akuades sebanyak 10 ml agar tidak mengkristal 8. Mendinginkan sampel (Eviati dan Sulaiman, 2009).
3.3.11.2 Melakukan destilasi
1. Menyiapkan penampung hasil destilasi berisilarutan H3BO3 1% sebanyak 25 ml dalam Erlenmeyer
2. Menambahkan akuades hingga mencapai volume 100 ml
3. Menambahkan 20 ml NaOH 40% pada labu Kjedahl berisi sampel 4. Melakukan destilasi selama 2 menit
5. Mengamati perubahan warna larutan penampung dari merah muda menjadi hijau
7. Mencatat nominal hasil titrasi Perhitungan :
Keterangan :
Vc = mL H2SO4 untuk contoh titaran
Vb = mL H2SO4 untuk contoh blanko titaran N = Normalitas H2SO4 penitar (0,1 N) 14,008 = Bobot setara N
Fp = faktor pengenceran (100)
Fk = faktor koreksi (Suwastika, 2007)
3.4 Rancangan Penelitian
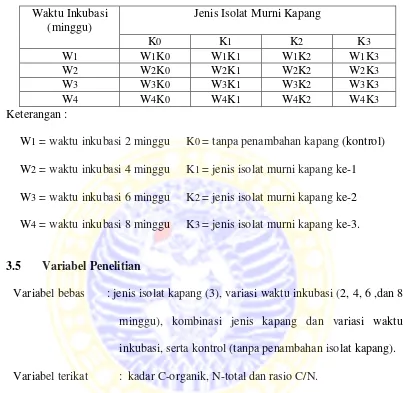
Tabel 3. 1. Rancangan faktorial 4x4 Waktu Inkubasi
(minggu)
Jenis Isolat Murni Kapang
K0 K1 K2 K3
W1 W1K0 W1K1 W1K2 W1K3
W2 W2K0 W2K1 W2K2 W2K3
W3 W3K0 W3K1 W3K2 W3K3
W4 W4K0 W4K1 W4K2 W4K3
Keterangan :
W1 = waktu inkubasi 2 minggu K0 = tanpa penambahan kapang (kontrol) W2 = waktu inkubasi 4 minggu K1 = jenis isolat murni kapang ke-1 W3 = waktu inkubasi 6 minggu K2 = jenis isolat murni kapang ke-2 W4 = waktu inkubasi 8 minggu K3 = jenis isolat murni kapang ke-3.
3.5 Variabel Penelitian
Variabel bebas : jenis isolat kapang (3), variasi waktu inkubasi (2, 4, 6 ,dan 8 minggu), kombinasi jenis kapang dan variasi waktu inkubasi, serta kontrol (tanpa penambahan isolat kapang). Variabel terikat : kadar C-organik, N-total dan rasio C/N.
Variabel terkendali : konsentrasi konidia kapang (106 konidia/gram substrat), ukuran substrat, dan berat substrat daduk uji (30 gram).
3.6 Pengumpulan Data
minggu ke- 2, minggu ke- 4, minggu ke- 6, dan minggu ke- 8 setelah pemberian perlakuan.
3.7 Analisis Data
Data karakteristik makroskopis dan mikroskopis kapang dianalisa secara deskriptif untuk menentukan genus isolat kapang. Luas diameter dan tingkat kecerahan zona halo digunakan sebagai indikator potensi selulolitik tiap kapang pada media CMC (Carboxyl Methyl Cellulose). Variasi nilai rasio C/N dari berbagai perlakuan diuji secara statistik menggunakan SPSS 16.0. Uji awal yang dilakukan, meliputi uji normalitas menggunakan uji Kolmogorov-smirnov dan uji homogenitas menggunakan uji Levene Test. Jika didapatkan data yang normal dan homogen, uji dilanjutkan menggunakan uji ANAVA dua arah dengan derajat signifikansi 5% untuk mengetahui adanya pengaruh perlakuan terhadap rasio C/N. Bila didapatkan pengaruh dari perlakuan yang diberikan, uji dilanjutkan dengan uji Duncan pada taraf 5% untuk mengetahui adanya derajat beda antar perlakuan. Cara pengambilan keputusan data dari uji ANOVA ini adalah:
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Isolasi Kapang Indigenous Dari Limbah Daduk
Berdasarkan hasil isolasi, isolat kapang indigenous yang berhasil diisolasi dari limbah daduk tebu terdiri dari 2 genus, yaitu genus Aspergillus dan genus
Trichoderma. Genus Aspergillus terdiri dari 5 spesies dan genus Trichoderma
terdiri dari 7 spesies. Data tersebut didapatkan berdasarkan hasil identifikasi karakteristik kapang secara makroskopis dan mikroskopis. Hasil identifikasi kapang dari genus Aspergillus secara makroskopis disajikan dalam tabel 4.1, secara mikroskopis dalam tabel 4.2. Hasil identifikasi kapang dari genus
Trichoderma secara makroskopis disajikan dalam tabel 4.3, dan secara mikroskopis dalam tabel 4.4.
4.1.1 Hasil identifikasi kapang genus Aspergillus
4.1 Tabel karakteristik makroskopis kapang genus Aspergillus
No. Jenis kapang
(1) Permukaan atas (top verse) koloni: 4 spesies berwarna hijau muda hingga hijau tua dan 1 spesies berwarna hitam, pertumbuhan cepat, seluruhnya bertekstur granul kasar, 3 spesies memiliki bentuk yang tidak beraturan dan 2 spesies yang berbentuk membulat. (2) warna reverse (sebalik koloni): 5 spesies berwarna putih. (3) zonasi: 4 spesies tidak memilki zonasi dan hanya Aspergillus sp.4 yang memiliki zonasi. (4) radial furrow: semua spesies tidak memiliki. (5) tetes eksudat: 4 spesies tidak terdapat tetes eksudat dan hanya Aspergillus sp.5
yang memiliki. Dari data tersebut terdapat beberapa kesamaan makroskopis koloni genus Aspergillus berdasarkan literatur (Gandjar dkk., 1999) sebagai berikut: permukaan atas koloni: (1) koloni umumnya tumbuh cepat, bertekstur granul. (2) warna top side: putih, hitam, hijau muda dan hijau kecoklatan. Bagian bawah koloni: putih, kecoklatan dan kekuningan.
4.2 Tabel karakteristik mikroskopis kapang genus Aspergillus
No.
spesies berbentuk bulat, dan berwarna hijau (kecuali Aspergillus niger berwarna hitam). (3) konidiofor: semua spesies tidak berseptat, tunggal (tidak bercabang), dan berwarna hialin. (4) conidial head berbentuk bulat pada Aspergillus niger dan 4 spesies berbentuk semi bulat, warna conidial head kehijauan, kecuali pada A. niger berwarna coklat gelap, dan Aspergillus sp.2 berwarna hialin. Dari data tersebut terdapat beberapa kesamaan mikroskopis kapang dengan genus
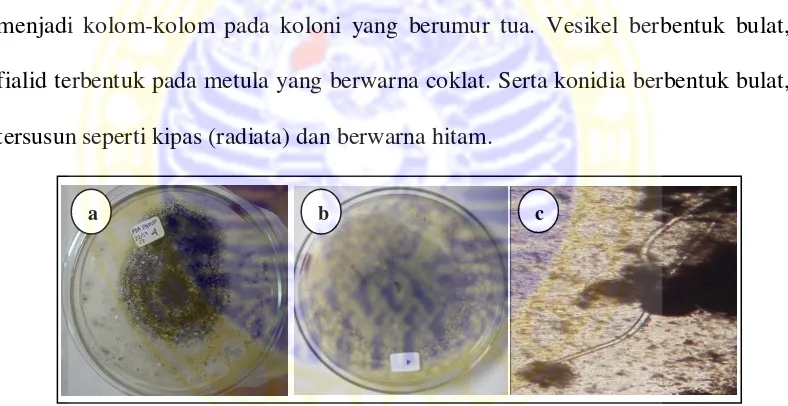
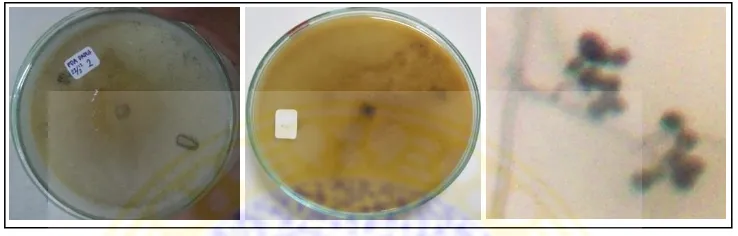
(1) Aspergillus niger Makroskopis koloni
Koloni pada media PDA tumbuh cepat, dengan bentuk koloni membulat (reguler), hitam pada top verse, putih pada reverse side, dan bertekstur berupa granul. Memiliki zonasi, tetapi tidak terdapat tetes eksudat, dan radial furrow. Mikroskopis kapang
Hifa tidak berseptat, tangkai dari konidiofor berdinding halus, berwarna kecoklatan, mononematus (keluar dari hifa secara tunggal), dan tidak berseptat.
Conidial head berbentuk bulat, berwarna coklat gelap, dan cenderung merekah menjadi kolom-kolom pada koloni yang berumur tua. Vesikel berbentuk bulat, fialid terbentuk pada metula yang berwarna coklat. Serta konidia berbentuk bulat, tersusun seperti kipas (radiata) dan berwarna hitam.
Gambar 4.1. Isolat kapang Aspergillus niger, a. karakter makroskopis
top verse, b. karakter makroskopis reverse, c. karakter mikroskopis perbesaran 100x.
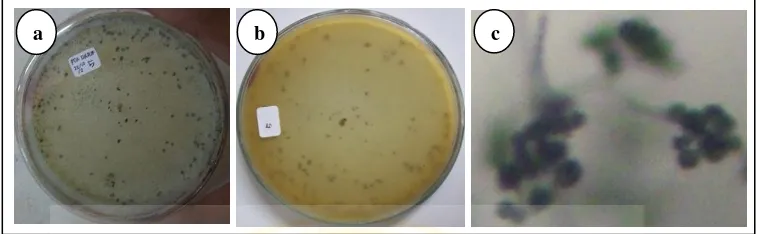
(2)Aspergillus sp. 2
Makroskopis koloni
Koloni pada media PDA tumbuh cepat, dengan bentuk koloni tidak menyebar, hijau tua pada bagian top verse dan putih pada bagian reverse side, bertekstur granul kasar. Tidak terdapat zonasi, tetes eksudat dan radial furrow.
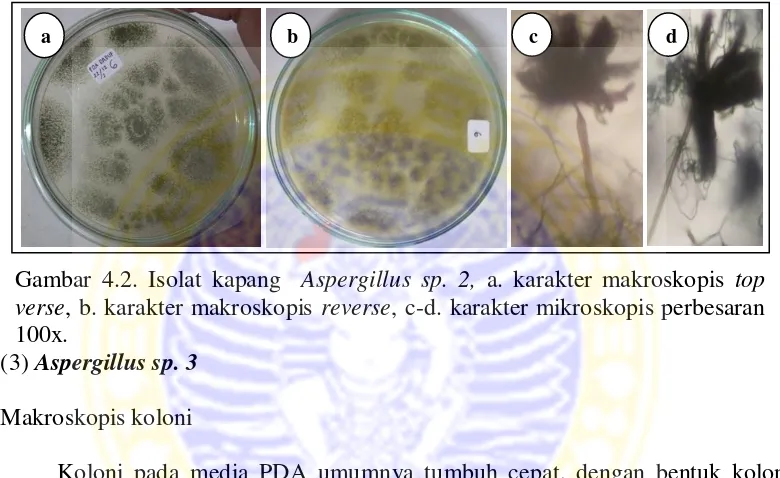
Mikroskopis kapang
Hifa tidak berseptat, hialin, dan bercabang. Konidiofor tumbuh tegak dan memanjang, tidak berseptat, hialin, dan mononemantus (keluar dari hifa secara tunggal). Conidial head berbentuk semi bulat dan berwarna hialin. Vesikel berbentuk bulat dan berwarna hialin. Konidia berbentuk bulat, hijau, dan berantai.
Gambar 4.2. Isolat kapang Aspergillus sp. 2, a. karakter makroskopis top verse, b. karakter makroskopis reverse, c-d. karakter mikroskopis perbesaran 100x.
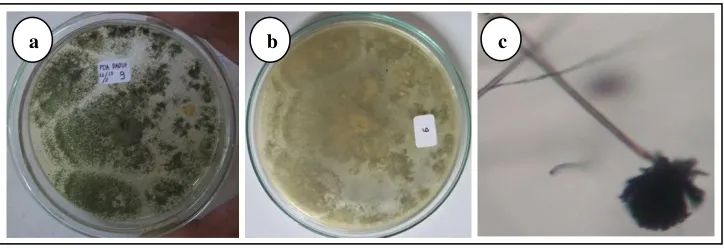
(3) Aspergillus sp. 3
Makroskopis koloni
Koloni pada media PDA umumnya tumbuh cepat, dengan bentuk koloni irregular, hijau tua pada bagian top verse, putih pada reverse, dan bertekstur granular kasar. Tidak memiliki zonasi, tetes eksudat dan radial furrow. Mikroskopis kapang
Hifa tidak berseptat, hialin, dan bercabang. Tangkai konidiofor berdinding halus, berwarna kehijauan, mononemantus (keluar dari hifa secara tunggal), dan aseptat. Conidial head berbentuk semi bulat, berwarna kehijauan, dan cenderung merekah menjadi kolom pada koloni yang berumur tua (seperti kipas / radiata). Vesikel berbentuk bulat, fialid terbentuk pada metula, dan konidia berbentuk bulat tersusun berantai (kolumnar), bertepi halus, dan berwarna kehijauan.
Gambar 4.3. Isolat kapang Aspergillus sp. 3, a. karakter makroskopis top verse, b. karakter makroskopis reverse, c. karakter mikroskopis perbesaran 100x.
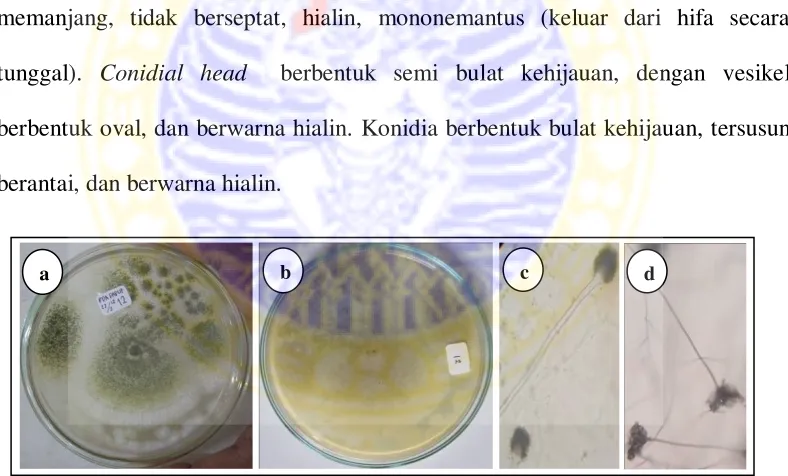
(4) Aspergillus sp. 4 Makroskopis koloni
Koloni pada media PDA tumbuh cepat, berbentuk regular, hijau pada top verse dan putih pada reverse, dan bertekstur granul kasar. Terdapat zonasi (berupa area koloni putih dan hijau), tetapi tidak memiliki tetes eksudat dan radial furrow. Mikroskopis kapang
Hifa tidak berseptat, bercabang, dan hialin. Konidiofor tumbuh tegak dan memanjang, tidak berseptat, hialin, dan mononemantus (keluar dari hifa secara tunggal). Conidial head berbentuk semi bulat dan berwarna kehijauan. Vesikel berbentuk semi bulat dan berwarna hialin. Fialid terbentuk pada metula, dengan konidia berbentuk bulat, bertepi halus, berwarna hijau, dan tersusun berantai.
Gambar 4.4. Isolat kapang Aspergillus sp. 4, a. karakter makroskopis top verse, b. karakter makroskopis reverse, c. karakter mikroskopis perbesaran 400x, d. karakter mikroskopis perbesaran 100x.
a b c
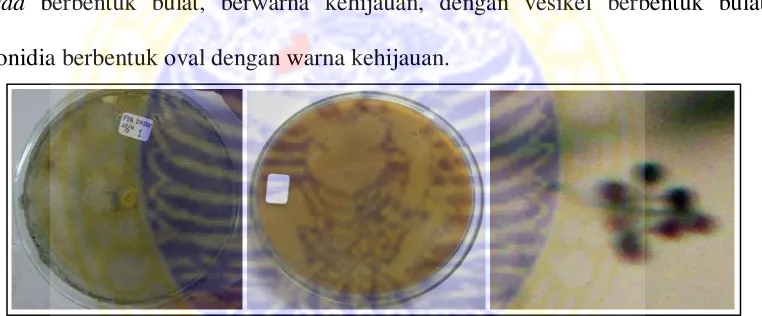
(5) Aspergillus sp. 5 Makroskopis koloni
Koloni pada media PDA tumbuh cepat, dengan bentuk koloni irregular tapi cenderung berbentuk oval dan bulat. Koloni berwarna hijau tua pada bagian
top verse dan putih pada reverse, bertekstur berupa granul kasar. Terdapat zonasi pada koloni berumur tua (dibatasi oleh koloni berwarna putih), adanya tetes eksudat, akan tetapi tidak memiliki radial furrow.
Mikroskopis kapang
Hifa tidak berseptat, bercabang, dan hialin. Konidiofor tumbuh tegak dan memanjang, tidak berseptat, hialin, mononemantus (keluar dari hifa secara tunggal). Conidial head berbentuk semi bulat kehijauan, dengan vesikel berbentuk oval, dan berwarna hialin. Konidia berbentuk bulat kehijauan, tersusun berantai, dan berwarna hialin.
Gambar 4.5. Isolat kapang Aspergillus sp. 5, a. karakter makroskopis top verse, b. karakter makroskopis reverse, c. karakter mikroskopis perbesaran 400x, d. karakter mikroskopis perbesaran 100x.
4.1.2 Hasil identifikasi kapang genus Trichoderma
4.3Tabel karakteristik makroskopis kapang genus Trichoderma
No. Jenis kapang
Berdasarkan hasil pengamatan makroskopis koloni genus Trichoderma yang ditemukan, adalah sebagai berikut:
(1) Top verse koloni: 4 spesies berwarna hijau muda hingga hijau tua, pada
Trichoderma sp.5 tepi koloni berwarna coklat, 2 spesies berwarna putih (pada
Trichoderma sp.7 muncul granul hijau) dan pada Trichoderma sp.4 berwarna putih tetapi pada area sentral terdapat miselium berwarna hijau (bertekstur granul halus), pertumbuhan relatif lambat (muncul hifa aerial setelah 2 hari inkubasi), 4 spesies bertekstur granul halus, 1 spesies bertekstur granul kasar, 2 spesies bertekstur cottony. Koloni semua spesies irregular dan menutupi seluruh area cawan. (2) warna reverse: keseluruhan berwarna putih. (3) zonasi: 6 spesies tidak memiliki, hanya Trichoderma sp.7 yang memiliki zonasi. (4) radial furrow: 7 spesies tidak memiliki, (5) tetes eksudat: hanya Trichoderma sp.5 yang memiliki. Dari data tersebut terdapat beberapa kesamaan makroskopis koloni genus
sebagai berikut: Pertumbuhan koloni lambat, tumbuh menyebar dengan koloni berbentuk irregular yang menutupi seluruh cawan Petri. Pada pertumbuhan awal, miselium berwarna putih kehijauan, dan selanjutnya hijau tua terutama pada daerah yang menunjukkan banyak konidia. Tekstur koloni bergranul (baik halus maupun kasar). Warna reverse umumnya putih, tetapi ada yang berpigmen. Biologi molekuler dengan teknologi penggunaan sekuen dari lokus gen menghasilkan peningkatan sangat besar dalam mengidentifikasi tiap spesies,
taksonomi Trichoderma terus berkembang dari 9 spesies pada 1970 menjadi 80
spesies pada saat ini (Samuels, 2006). Di bawah ini adalah tabel karakteristik
mikroskopis kapang dari genus Trichoderma. 4.4 Tabel karakteristik mikroskopis kapang genus Trichoderma
Berdasarkan hasil pengamatan mikroskopis kapang genus Trichoderma yang ditemukan adalah sebagai berikut: (1) hifa: keseluruhan spesies memiliki hifa tidak berseptat, berpigmen (hialin dan kehijauan), tampak adanya klamidospora, dan tersusun irregular. (2) konidia: 6 spesies berbentuk semi bulat, hanya
Trichoderma sp.1 berbentuk oval, serta berwarna hialin dan hijau. (3) konidiofor: semua spesies tidak berseptat, bercabang (menyerupai piramida), dan berwarna hijau/hialin. (4) conidial head berbentuk semi bulat pada 4 spesies dan bulat pada 3 spesies, warna conidial head kehijauan, kecuali pada Trichoderma sp.4 dan
Trichoderma sp.6 berwarna hialin. Dari data tersebut terdapat beberapa kesamaan mikroskopis kapang dengan genus Trichoderma pada literatur (Samuels, 2006 dan Gandjar dkk., 1999) sebagai berikut: hifa tidak berseptat dan tersusun irregular, menunjukkan adanya klamidospora, berwarna hialin hingga kehijauan. Konidiofor bercabang menyerupai piramida, pada bagian bawah cabang lateral yang berulang-ulang, sedangkan ke arah ujung percabangan menjadi bertambah pendek. Fialid tampak langsing dan panjang terutama pada cabang apikal, serta konidia berbentuk semi bulat hingga oval pendek. Klamidospora ditemukan pada miselia dari koloni berumur tua dan umumnya berbentuk bulat. Untuk berbagai karakter khusus dari masing-masing spesies dari genus Trichoderma diuraikan secara berturut-turut di bawah ini:
(1) Trichoderma sp.1 Makroskopis koloni
bentuk irregular. Berwarna hijau tua pada bagian top verse, pada bagian reverse
berwarna hijau kecoklatan, dan dengan tekstur berupa granul halus. Tidak terdapat zonasi, tetes eksudat, dan radial furrow.
Mikroskopis kapang
Hifa tidak berseptat, berpigmen kehijauan, dan tampak adanya klamidospora pada koloni berumur tua (14 hari). Miselium tersusun tidak beraturan. Konidiofor bercabang menyerupai bentuk piramid, berwarna hijau, mononemantus (keluar dari hifa secara tunggal), serta tidak berseptat. Conidial head berbentuk bulat, berwarna kehijauan, dengan vesikel berbentuk bulat. Konidia berbentuk oval dengan warna kehijauan.
Gambar 4.6. Isolat kapang Trichoderma sp.1. a. karakter makroskopis top verse, b. karakter makroskopis reverse, c. mikroskopis perbesaran 400x.
(2) Trichoderma sp.2
Makroskopis koloni
Pertumbuhan koloni cenderung lambat (inkubasi hari ke-2 mulai muncul miselium), setelah 10 hari koloni menutupi seluruh area cawan dengan bentuk irregular. Top verse berwarna hijau tua dan coklat muda pada reverse, dan koloni bertekstur granul halus. Tidak terdapat zonasi, tetes eksudat dan radial furrow. Mikroskopis kapang