SINTESIS ASAM 4-HIDROKSISINAMAT
DARI STARTING MATERIAL 4-HIDROKSIBENZALDEHIDA DAN ASAM MALONAT DENGAN KATALIS AMONIA :
TINJAUAN TERHADAP PENINGKATAN JUMLAH MOL ASAM MALONAT
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Andreas Bob Dwi Putra NIM : 048114002
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
YOGYAKARTA 2008
ii
SINTESIS ASAM 4-HIDROKSISINAMAT
DARI STARTING MATERIAL 4-HIDROKSIBENZALDEHIDA DAN ASAM MALONAT DENGAN KATALIS AMONIA :
TINJAUAN TERHADAP PENINGKATAN JUMLAH MOL ASAM MALONAT
SKRIPSI
Diajukan Untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Program Studi Ilmu Farmasi
Oleh :
Andreas Bob Dwi Putra NIM : 048114002
FAKULTAS FARMASI UNIVERSITAS SANATA DHARMA
YOGYAKARTA 2008
iii
iv
iv
HALAMAN PERSEMBAHAN
Perjalanan hidup telah diatur teratur
Jangan harap seseorang dapat mencapai fajar
sebelum ia menjalani dan melewati malam
Pengetahuan adalah kehidupan
Demikian pula dengan sayap-sayapnya
yang membentang dan berwarna-warni
(Kahlil Gibran)
Kupersembahkan Untuk :
”D`Cinnamic Team” dan teman-temanku....
Dwika..
Almamaterku..
.
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma:
Nama : Andreas Bob Dwi Putra
NIM :
048114002
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas
Sanata Dharma karya ilmiah saya yang berjudul:
SINTESIS ASAM 4-HIDROKSISINAMAT DARI
STARTING MATERIAL
4-HIDROKSIBENZALDEHIDA DAN ASAM MALONAT DENGAN KATALIS
AMONIA : TINJAUAN TERHADAP PENINGKATAN JUMLAH MOL ASAM
MALONAT
berserta perangkat yang diperlukan. Dengan demikian saya memberikan kepada Perpustakaan
Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain,
mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan
mempublikasikan di internet atau media lain untuk kepentingan akademis tanpa perlu meminta
izin dari saya maupun memberikan royalti kepada saya selama tetap mencantumkan nama saya
sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal 22 Juli 2008
Yang menyatakan
Andreas Bob Dwi Putra
v PRAKATA
Puji syukur penulis panjatkan kepada Tuhan Yesus Kristus atas semua rahmat dan karuniaNya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi yang berjudul “Sintesis Asam 4-Hidroksisinamat Dari Starting Material 4-Hidroksibenzaldehida dan Asam Malonat Dengan Katalis Amonia : Tinjauan Terhadap Peningkatan Jumlah Mol Asam Malonat.” Skripsi ini disusun dalam rangka memenuhi salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm).
Selama penelitian dan penyusunan skripsi ini, penulis tidak terlepas dari bantuan dan dukungan berbagai pihak. Oleh karena itu, penulis mengucapkan terimakasih kepada :
1. Rita Suhadi, M.Si., Apt selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Jeffry Julianus, M.Si., selaku dosen pembimbing atas kesediaannya dalam memberikan arahan, dukungan dan masukan dalam penelitian dan penulisan skripsi ini.
3. Lucia Wiwid Widjayanti, M.Si., selaku dosen penguji yang telah banyak memberikan masukan kepada penulis.
4. Christine Patramurti, M.Si, Apt., selaku dosen penguji yang telah banyak memberikan masukan kepada penulis.
5. Yohannes Dwiatmaka, M.Si., atas izin penggunaan laboratorium; Pak Parlan, dan segenap laboran Fakultas Farmasi yang telah banyak membantu dan memberi kepercayaan selama bekerja di laboratorium.
vi
6. Pak Pardjan dan Pak Pudjono atas masukannya yang sangat berharga
7. Papi, Mami, Oma, Yoyo, Ebet, segenap keluarga besar tercinta atas semua dukungan, doa, kasih sayang dan semangat yang diberikan.
8. Anggota team sinamat, team besi, dan team nitrofurazon: Coco, Elvan, Fadhjhar, Yusak, Edvan, Leo, Adit, Kak Budi, Boris dan Probo terimakasih untuk kerjasama, bantuan, serta suka dan duka dalam masa “perjuangan” di laboratorium.
9. Teman-teman KKN, Kelompok Praktikum :Oktav, Pipit, Wiwid, Ayu, Sapi; Andre, Ali, Eli, Ibu Marpaung atas bimbingannya.
10.Teman - teman kosku dan tetangga kos: Noel, Ronal, Dirham, Michael, Frans, Agung “ndut”, Agung “q-ting”, VD, Ari, Vincent, Niko terimakasih untuk persahabatan yang diberikan.
11.Semua pihak yang turut membantu dalam penyusunan skripsi ini.
Penulis menyadari masih banyak kekurangan yang terdapat dalam penelitian dan penyusunan skripsi ini. Oleh karena itu penulis mengharapkan kritik dan saran yang menyempurnakan. Semoga penulisan skripsi ini dapat memberikan manfaat bagi semua pihak serta mendukung perkembangan ilmu pengetahuan.
Yogyakarta, April 2008 Penulis,
Andreas Bob Dwi Putra
viii
PERNYATAAN KEASLIAN KARYA
Penulis menyatakan dengan sesungguhnya bahwa skripsi yang penulis tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Yogyakarta, Juni 2008 Penulis
Andreas Bob Dwi Putra
ix INTISARI
Telah dilakukan sintesis asam 4-hidroksisinamat yang memiliki aktivitas antioksidan lebih baik daripada asam sinamat. Penelitian ini bertujuan untuk mensintesis asam 4-hidroksisinamat yang lebih efektif daripada mengisolasinya dari alam. Sintesis dilakukan dengan mereaksikan starting material 4-hidroksibenzaldehida dan asam malonat dengan katalis amonia. Penelitian ini merupakan penelitian eksperimental untuk mengetahui pengaruh meningkatnya jumlah mol asam malonat terhadap persentase rendemen. Perbandingan antara 4-hidroksibenzaldehida dan asam malonat yang dilakukan pada penelitian ini sebesar 1:1, 1:11/2 dan 1:2.
Pada senyawa hasil sintesis uji pendahuluan yang dilakukan antara lain : uji organoleptis, uji kelarutan, uji kualitatif dengan pereaksi kimia, pengukuran titik lebur dan uji kemurnian menggunakan kromatografi lapis tipis. Elusidasi struktur dengan spektrofotometri inframerah dan spektroskopi 1H-NMR
Dari hasi uji yang dilakukan maka diperoleh senyawa berbentuk jarum berwarna kuning dengan rendemen untuk perbandingan mol 1:1 sebesar 7,01%; perbandingan mol 1:11/2 sebesar 21,26% dan 25,6% dari perbandingan mol 1 : 2. Hasil uji kelarutan menunjukkan bahwa senyawa hasil sintesis larut dalam air panas, eter, metanol, etanol dan tidak larut pada benzena dan air dingin. Hasil uji kemurnian dengan sistem KLT menunjukkan bercak tunggal pada tiga jenis fase gerak yang berbeda kepolarannya. Jarak lebur senyawa hasil sintesis sebesar 214-216° C sesuai dengan jarak lebur asam 4-hidroksisinamat. Elusidasi struktur dengan spektrofotometri inframerah dan spektroskopi 1H-NMR menunjukkan bahwa senyawa hasil sintesis merupakan asam 4-hidroksisinamat.
Kata kunci : Asam 4-hidroksisinamat, antioksidan, reaksi kondensasi Knoevenagel
x ABSTRACT
It has been done the synthesis of 4-hydroxycinnamic acid which had a stronger antioxidant activity than cinnamic acid. The purpose of this research was to obtain the 4-hydroxycinnamic acid from pure synthesis that more effective than isolated from the plant. Starting material used in this research was 4-hydroxybenzaldehyde and malonic acid and amonia as catalyst. This was an experimental research to examine the effect of raising mol of malonic acid to the rendement. Ratio between 4-hydroxybenzaldehyde and malonic acid in this research was 1:1; 1:1/2 and 1:2
Previous test of the synthetic product was organoleptic, solubilitiy test, identification with chemical reagen, melting point test, and purity test with thin layer chromatography. Structure elucidation was conducted by infrared spectrophotometry, and 1H-NMR spectroscopy.
The synthetic product has yelow needle-shape with rendement of each mol ratio was 7,01 for ratio 1:1, 21,26% for ratio 1:1/2 and 25,6% obtain from synthesis with 1:2 ratio of mol. Result of solubility test showed that synthetic product was soluble in hot water, aether, ethanol, methanol and insoluble in benzena and cold water. Purity of syntethic product was tested by TLC system and have a single spot in three different polarity of mobile phase. Melting point range of synthetic product was 214-216°C. Structure elucidation with infrared spectrophotometry and 1H-NMR spectroscopy showed that synthetic product was identified as 4-hydroxycinnamic acid.
Key words : 4-hidroxycinnamic acid, antioxidant, Knoevenagel condensation reaction.
xi DAFTAR ISI
HALAMAN JUDUL ... ii
PERSETUJUAN PEMBIMBING ... Error! Bookmark not defined. PENGESAHAN SKRIPSI ... Error! Bookmark not defined. HALAMAN PERSEMBAHAN ... iv
PRAKATA ... v
PERNYATAAN KEASLIAN KARYA ... viii
INTISARI ... ix
ABSTRACT ... x
DAFTAR ISI ... xi
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xviii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian penelitian ... 3
3. Manfaat Penelitian ... 4
a. Manfaat Teoritis. ... 4
b. Manfaat Praktis. ... 4
B. Tujuan ... 4
xii BAB II
PENELAAHAN PUSTAKA ... 5
A. Asam Sinamat ... 5
B. Asam 4-hidroksisinamat... 6
C. Amina ... 7
D. Kereaktifan Senyawa Aldehid... 8
E. Kondensasi Knoevenagel ... 9
F. Kristalisasi ... 12
G. Pemeriksaan Kemurnian Senyawa Hasil Sintesis ... 12
1. Pemeriksaan Titik Lebur ... 12
2. Kromatografi Lapis Tipis ( KLT ) ... 13
H. Elusidasi Struktur ... 15
1. Spektrofotometri Inframerah (Spektrofotometri IR) ... 15
2. Spektroskopi resonansi magnet inti (1H-NMR) ... 15
I. Landasan Teori ... 17
J. Hipotesis ... 17
BAB III METODE PENELITIAN ... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Variabel Penelitian ... 18
C. Bahan / Materi Penelitian ... 18
D. Alat ... 19
E. Tata Cara Penelitian ... 19
xiii
1. Sintesis Asam 4-hidroksisinamat ... 19
a. Sintesis dengan perbandingan mol 1:1.. ... 19
b. Sintesis dengan perbandingan mol 1:1/2. . ... 20
c. Sintesis dengan perbandingan mol 1:2.. ... 20
2. Rekristalisasi Senyawa Hasil Sintesis ... 21
3. Uji Pendahuluan ... 21
a. Uji organoleptis. ... 21
b. Uji Kelarutan. ... 21
c. Identifikasi senyawa hasil sintesis dengan pereaksi kimiawi ... 22
d. Uji Titik Lebur ... 22
e. Uji Kemurnian dengan Kromatografi Lapis Tipis. ... 22
4. Elusidasi struktur senyawa hasil sintesis ... 22
a. Spektrofotometri Infra Merah.. ... 22
b. Spektroskopi Resonansi Magnetik Inti (1H-NMR) ... 22
5. Tata cara analisis hasil ... 23
a. Pemeriksaan kemurnian senyawa hasil sintesis. ... 23
b. Elusidasi struktur senyawa hasil sintesis. ... 23
c. Perhitungan rendemen ... 23
BAB IV HASIL DAN PEMBAHASAN ... 24
A. Sintesis Asam 4-Hidroksisinamat ... 24
B. Rekristalisasi Senyawa Hasil Sintesis ... 27
C. Uji Pendahuluan ... 29
xiv
1. Uji Organoleptis ... 29
2. Uji Kelarutan ... 30
3. Identifikasi Senyawa Hasil Sintesis Dengan Pereaksi Kimiawi ... 31
4. Uji Titik Lebur ... 33
5. Uji Kemurnian dengan KLT ... 34
D. Elusidasi Struktur dan Identifikasi Senyawa Hasil Sintesis ... 38
1. Interpretasi Spektra Infra Merah ... 38
2. Interpretasi Spektra 1H-NMR ... 41
BAB V KESIMPULAN DAN SARAN ... 45
A. Kesimpulan ... 45
B. Saran ... 45
DAFTAR PUSTAKA ... 46
LAMPIRAN ... 48
BIOGRAFI PENULIS ... 53
xv
DAFTAR TABEL
Tabel I. Urutan kebasaan senyawa amina ... 8
Tabel II. Klasifikasi kelarutan ... 21
Tabel III. Rendemen hasil pemurnian dengan rekristalisasi ... 28
Tabel IV. Hasil Uji Organoleptis ... 29
Tabel V. Hasil Uji Kelarutan ... 30
Tabel VI. Harga Rf hasil uji KLT dengan tiga fase gerak ... 36
Tabel VII. Perbandingan interpretasi gugus senyawa hasil sintesis dengan literatur ... 39
Tabel VIII Analisa Spektra 1H-NMR senyawa hasil sintesis... 42
Tabel IX. Kepolaran fase gerak campuran ... 51
xvi
DAFTAR GAMBAR
Gambar 1. Bentuk isomer cis dan trans pada asam sinamat. ... 5
Gambar 2. Ikatan hidrogen pada asam karboksilat ... 6
Gambar 3. Asam 4-hidroksisinamat ... 7
Gambar 4. Resonansi pada benzaldehida ... 8
Gambar 5. Reaksi asam karboksilat dengan amonia ... 11
Gambar 6. Dekarboksilasi senyawa dengan gugus karbonil β-karboksilat... 11
Gambar 7. Dekarboksilasi asam malonat dengan tautomerasi keto-enol ... 11
Gambar 8. Reaksi pembentukan garam malonat dan ion enolat dari asam malonat ... 24
Gambar 9. Deaktivasi gugus aldehida oleh delokalisasi elektron hidroksi fenol Gambar 10. Reaksi antara 4-hidroksibenzaldehid dengan ion enolat ... 25
Gambar 11. Reaksi dehidrasi dan dekarboksilasi pada asam 4-hidroksisinamat .. 26
Gambar 12. Kristal kuning hasil rekristalisasi ... 30
Gambar 13 Hasil uji kualitatif asam 4-hidroksisinamat. ... 31
Gambar 14.Mekanisme reaksi pada uji kualitatif dengan pereaksi vanilin asam sulfat ... 32
Gambar 15. Pembentukan warna pada senyawa dengan sistem konjugasi semu . 33 Gambar 16. Profil bercak pada sistem KLT I ... 36
Gambar 17. Profil Bercak pada sistem KLT II dan III ... 37
Gambar 18. Spektra IR senyawa hasil sintesis ... 39
Gambar 19. Spektra 1H-NMR ... 42
Gambar 20. Jenis proton pada asam 4-hidroksisinamat ... 43
xvii
Gambar 21. Resonansi pada asam 4-hidroksisinamat ... 44 Gambar 22. Rekristalisasi dengan pelarut aquadest ... 51
xviii
DAFTAR LAMPIRAN
Lampiran 1. Data perhitungan rendemen ... 48
Lampiran 2. Rekristalisasi dan kristal hasil sintesis... 51
Lampiran 3. Perhitungan kepolaran fase gerak campuran ... 51
Lampiran 4. Data Uji Titik Lebur ... 52
1 BAB I PENGANTAR
A. Latar Belakang
Oksidasi kolesterol LDL (Low Density Lipoprotein) oleh radikal bebas merupakan penyebab terjadinya artheosclerosis sehingga memicu dilakukannya berbagai penelitian mengenai senyawa antioksidan yang dapat menangkal radikal bebas.
Salah satu senyawa yang diketahui memiliki efek antioksidan adalah asam sinamat. Asam sinamat memiliki ikatan tak jenuh α dan β diketahui mempunyai efek sebagai antioksidan. Mekanisme antioksidan pada asam sinamat yaitu dengan cara mendonorkan atom hidrogen pada ikatan tak jenuhnya (Zang et al., 2000).
Asam 4-hidroksisinamat (p-coumaric acid) merupakan senyawa turunan asam sinamat dan termasuk dalam senyawa fenolik golongan fenilpropanoida. Senyawa golongan fenilpropanoid merupakan salah satu kelompok senyawa yang berasal dari jalur sikhimat dan banyak terdapat dalam buah-buahan seperti dalam apel dan buah per, selain itu juga terdapat dalam tumbuhan dan sayuran seperti kacang, tomat, kentang dan teh.
Hasil penelitian menunjukkan bahwa dengan adanya gugus hidroksi yang berada pada sistem aromatis atau gugus fenolik dapat meningkatkan aktifitas antioksidan suatu senyawa. Gugus hidroksi fenolik dapat meningkatkan efek
2
antioksidan suatu senyawa karena adanya delokalisasi kerapatan elektron pada suatu senyawa untuk menstabilkan radikal bebas (Velkov et al., 2007).
Adanya ikatan tak jenuh α dan β dan sebuah gugus fenolik pada asam 4-hidroksisinamat diharapkan dapat meningkatkan aktifitasnya sebagai antioksidan dibandingkan asam sinamat yang hanya memiliki ikatan tak jenuh α,β saja sebagai penangkal radikal bebas. Hal ini sudah dibuktikan melalui penelitian stabilisasi radikal bebas oleh komponen fenolik secara statistik dan modeling yang menunjukkan bahwa senyawa asam 4-hidroksisinamat memiliki aktifitas antioksidan 7,2 lebih kuat dibandingkan asam sinamat (Velkov et al, 2007).
Penelitian ini bertujuan untuk memperoleh asam 4-hidroksisinamat melalui cara sintesis murni. Hal ini dilakukan karena proses isolasi asam 4-hidroksisinamat dari tumbuhan Galanthus elwesii hanya menghasilkan rendemen sebesar 15 % (Tuzen and Ozdemir, 2003). Oleh karena itu jika dapat disintesis dengan rendemen yang lebih banyak, maka akan sangat membantu dalam memperoleh senyawa tersebut.
Sintesis turunan asam sinamat dapat dilakukan dengan reaksi Perkin dan kondensasi Knoevenagel. Reaksi Knoevenagel lebih umum digunakan karena rendemen yang didapatkan lebih banyak dibandingkan dengan reaksi Perkin. Reaksi kondensasi Knoevenagel merupakan suatu reaksi kondensasi suatu aldehid dan senyawa karboksilat yang mempunyai dua gugus karbonil dengan katalis basa yang memiliki gugus amina (Fessenden dan Fessenden, 1986)
Starting material 4-hidroksibenzaldehida merupakan suatu aldehida aromatis dan salah satu kekurangan dari penggunaan aldehid aromatis sebagai
3
starting material ialah sifat elektrofilnya yang lebih lemah dibandingkan aldehid alifatis sehingga dilakukan variasi dengan meningkatkan jumlah mol asam malonat dengan tujuan agar ion enolat yang terbentuk dari garam malonat lebih banyak sehingga meningkatkan jumlah enolat yang akan bereaksi dengan 4-hidroksibenzaldehida untuk membentuk senyawa target. Selain itu sisa reaksi berupa asam malonat lebih mudah dipisahkan dari senyawa target karena sifat kelarutan yang berbeda pada air dingin dimana asam malonat sangat larut dalam air dingin sementara senyawa target agak sukar larut dalam air dingin (Anonim, 2001).
Pada penelitian ini digunakan katalis amonia karena sifat basanya yang lebih kuat daripada piridin yang secara umum digunakan sebagai katalis pada reaksi kondensasi Knoevenagel. Diharapkan dengan semakin kuat katalis yang digunakan maka pembentukan asam 4-hidroksisinamat semakin cepat dan diperoleh persentase rendemen yang lebih banyak.
1. Permasalahan
Penelitian ini untuk mengetahui apakah dengan ditingkatkannya jumlah mol asam malonat dapat meningkatkan rendemen asam 4-hidroksisinamat?
2. Keaslian penelitian
Penelitian tentang sintesis asam 4-hidroksisinamat dengan starting material 4-hidroksibenzaldehid dan asam malonat dengan katalis amonia sejauh pengamatan peneliti belum pernah dilakukan
4
3. Manfaat Penelitian
a. Manfaat Teoritis. Penelitian ini diharapkan dapat memberikan dan memperkaya pengetahuan di bidang sintesis obat khususnya pada sintesis asam 4-hidroksisinamat
b. Manfaat Praktis. Penelitian ini diharapkan dapat memberikan suatu alternatif untuk mensintesis senyawa antioksidan yang telah diteliti secara teoritis
B. Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh peningkatan jumlah mol asam malonat terhadap rendemen asam 4-hidroksisinamat.
5 BAB II
PENELAAHAN PUSTAKA
A. Asam Sinamat
Asam sinamat merupakan senyawa yang diisolasi dari kulit kayu manis (Cinnamomum burmanni) dan termasuk dalam famili Lauraceae. Kulit kayu manis digunakan sebagai pewangi atau menimbulkan citarasa dalam makanan, kosmetik, sabun dan industri farmasi. Minyak kayu manis diketahui juga memiliki efek antiseptik terhadap mikroorganisme. Kandungan utama minyak kayu manis adalah sinamaldehid yang jika teroksidasi akan menghasilkan asam sinamat. Ester asam sinamat seperti etil dan metil sinamat banyak digunakan dalam industri minuman dan parfum karena memiliki bau yang harum. Dalam industri farmasi, ester sinamat digunakan untuk obat anestetik lokal dan luka bakar (Anwar et al., 1994)
Asam sinamat memiliki perbedaan titik leleh yang berbeda diantara dua bentuk isomer-nya yaitu cis dan trans. Kedua bentuk isomer ini memiliki titik leleh yang berbeda, pada trans-asam sinamat memiliki titik leleh 1330C sedangkan isomer cis memiliki titik leleh 68 0C (Anwar et al., 1994)
O
OH
O HO
asamcis-sinamat asamtrans-sinamat
Gambar 1. Bentuk isomer trans dan cis pada asam sinamat
6
Asam sinamat termasuk dalam golongan senyawa asam karboksilat aromatis yang memiliki gugus fenil pada ujung rantai alifatik-nya. Asam sinamat dapat disintesis dari benzaldehid dan merupakan konstituen utama dari parfum (Anwar et al., 1994).
Salah satu sifat asam karboksilat yaitu memiliki titik didih yang lebih tinggi dibandingkan senyawa lain dengan bobot molekul yang hampir sama, seperti alkohol, aldehid dan keton.
O
O O
O H
H
Ikatan hidrogen pada dimer
Gambar 2. Ikatan hidrogen pada asam karboksilat
Titik didih yang tinggi pada senyawa asam karboksilat merupakan hasil dari kepolarannya dan biasanya asam karboksilat membentuk ikatan hidrogen intermolekuler yang sangat kuat. Karena kuatnya ikatan ini, asam karboksilat seringkali dijumpai dalam bentuk dimer, bahkan dalam fase uapnya.
B. Asam 4-hidroksisinamat
Asam 4-hidroksisinamat merupakan turunan asam sinamat yang memiliki gugus hidroksi pada posisi para dari cincin aromatis dan terikat pada rantai alifatik. Senyawa ini juga dikenal dengan nama asam p-kumarat; asam 3-(-4-hidroksifenil)-2 propionat; asam p-hidroksisinamat; dan asam β -(-4-hidroksifenilakrilat) memiliki bobot molekul 164,16 gram/mol. Serbuk kristal
7
asam 4-hidroksisinamat berbentuk jarum dalam keadaan kering, dengan titik lebur 210-213 0C. Mempunyai sifat susah larut dalam air dingin, larut dalam air panas, alkohol dan eter. Praktis tidak larut dalam benzen, dan ligroin (Anonim, 2001).
OH O
HO
Gambar 3. Asam 4-hidroksisinamat
Hasil isolasi asam trans-4-hidroksisinamat dari sekam padi telah diketahui memiliki daya hambat pertumbuhan mikrobia yang efektif dan dibuktikan dengan pengujian pada 17 spesies bakteri dan 2 spesies yeast. Dari pengujian ini didapatkan nilai IC50 sebesar 100-170 µg/ml untuk bakteri dan 160 µg/ml untuk yeast yang diuji pada media cair. Sebagian besar bakteri gram positif dan gram negatif sensitif senyawa asam 4-hidroksisinamat, namun asam trans -4-hidroksisinamat lebih dianjurkan untuk digunakan pada bakteri gram positif (Jeung et al.,1998).
C. Amina
Amina memiliki atom nitrogen dengan suatu pasangan elektron bebas, hal ini menjadikan amonia bersifat basa dan dapat berperan sebagai nukleofil. Jika amina bebas terstabilkan relatif terhadap kationnya, maka amina itu merupakan basa lemah dan jika kation itu terstabilkan relatif terhadap amina bebasnya, maka
8
amina itu adalah basa yang lebih kuat. Berikut urutan kebasaan senyawa amina berdasarkan pKa:
Tabel I. Urutan kebasaan senyawa amina
Nama pKa ion amonium Arylamin (anilin) 4,63 Heterosiklik amin
Selain itu, resonansi juga mempengaruhi sifat basa suatu amina. Suatu molekul dengan kemampuan beresonansi akan menurunkan kebasaannya karena elekteron-elektron menyendiri pada senyawa nitrogen bebas lebih mudah terstabilkan dengan adanya resonansi tersebut (Fessenden dan Fessenden, 1986).
D. Kereaktifan Senyawa Aldehid
Aldehida memiliki sifat lebih reaktif terhadap nukleofil daripada keton sehingga lebih sering digunakan dalam reaksi adisi nukleofilik. Dari segi halangan sterik, dengan hanya adanya satu substituen yang terikat pada C = O pada aldehid dibandingkan dengan keton yang memiliki dua substituen, maka akan lebih mudah suatu nukleofil bereaksi dengan aldehid. Demikian juga untuk keadaan
9
elektronnya, pada aldehid polarisasi dari gugus karbonilnya lebih besar bila dibandingkan dengan keton, disamping itu aldehid hanya memiliki satu alkil yang menstabilkan muatan positif pada atom C karbonil (McMurry, 2004).
O O
O O
H
H H H
Gambar 4. Resonansi pada benzaldehid
Aldehida aromatis berbeda dengan aldehida alifatis dimana aldehid aromatis kurang reaktif sebagai elektrofil, hal ini disebabkan karena adanya donor elektron dari resonansi cincin benzen pada gugus karbonil. Donor elektron pada gugus karbonil benzaldehid menyebabkan benzaldehid kurang reaktif sebagai elektrofil dibandingkan aldehid alifatik (McMurry, 2004)
E. Kondensasi Knoevenagel
Kondensasi Knoevenagel adalah reaksi antara sebuah aldehida dan suatu senyawa yang mempunyai hidrogen αterhadap dua gugus pengaktif (seperti C = O atau C = N) dengan menggunakan amonia atau suatu amina sebagai katalis. Pada kondisi ini asam malonat dapat digunakan sebagai pereaksi (Fessenden dan Fessenden, 1986)
Sintesis asam sinamat dan turunanannya dapat dilakukan dengan reaksi Perkin dan Knoevenagel. Hasil sintesis menurut reaksi Perkin menghasilkan prosentase rendemen yang lebih kecil daripada reaksi Knoevenagel. Oleh karena
10
itu kondensasi Knoevenagel lebih sering digunakan untuk sintesis asam sinamat dan turunannya (Norman and Coxon, cit Ekowati, 2003).
Knoevenagel (1898) menemukan reaksi kondensasi antara aldehid dan asam malonat yang dilakukan dalam larutan yang mengandung alkohol dengan adanya amonia kering, atau senyawa amina primer atau sekunder. Penggunaan katalis dari kelompok amina ini adalah hasil modifikasi dari reaksi Perkin yang merupakan reaksi kondensasi antara komponen karbonil yang memiliki hidrogen aktif (Fieser, 1952).
Pengaplikasian reaksi ini terutama digunakan pada kondensasi keton dan aldehida dengan senyawa yang mudah terenolisasi yang terdiri dari 2 gugus pengaktivasi. Ester malonat dan ester sianoasetat merupakan contoh dari 2 senyawa yang mudah terenolisasi. Produk yang dihasilkan merupakan senyawa “terdehidrasi” dengan intermediet jenuh yang dapat diisolasi pada kondisi khusus. Proton asam digunakan sebagai nukleofil dikarenakan dua alasan. Pertama, karena basa lemah seperti amina dapat memberikan konsentrasi enolat yang cukup untuk reaksi, tanpa menyebabkan deprotonasi dari keton atau aldehid dan alasan kedua ialah self-condensation dari komponen karbonil dapat diminimalkan. Proton asam juga membantu tahap eliminasi. Pada umumnya, dekarboksilasi dan eliminasi pada reaksi Knoevenagel terjadi secara bersamaan (Carey and Sundberg, 1977).
Reaksi asam karboksilat dengan suatu amina tidak akan membentuk amida karena amina merupakan suatu basa yang mengubah keasaman gugus karboksilat menjadi bentuk anion karboksilat yang tidak reaktif (McMurry, 2004).
11
Gambar 5. Reaksi asam karboksilat dengan amonia
Asam karboksilat juga sangat mudah mengalami dekarboksilasi. Dekarboksilasi ialah hilangnya CO2 dari gugus karboksil yang disebabkan pemanasan pada senyawa karboksilat. Pada asam karboksilat yang memiliki gugus karbonil pada posisi β dari gugus karboksilnya, hanya dengan sedikit pemanasan senyawa tersebut sudah dapat mengalami dekarboksilasi.
O
Gambar 6. Proses dekarboksilasi pada senyawa β-karbonil karboksilat
Dekarboksilasi pada asam karboksilat ini terjadi karena adanya penataulangan dari enam elektron yang berbentuk siklik sehingga menghasilkan karbondioksida dan bentuk enol dari gugus karboksil. Bentuk enol sebagai hasil dari dekarboksilasi ini kemudian akan membentuk suatu senyawa keto dengan adanya tautomerisasi keto-enol. Dekarboksilasi ini disebabkan karena bentuk keto pada tautomerisasi keto-enol dari suatu karboksilat lebih stabil. (Brown and Poon, 2005)
Gambar 7. Dekarboksilasi pada asam malonat dengan tautomerasi keto-enol
12
F. Kristalisasi
Pengkristalan kembali (rekristalisasi) merupakan metode pemurnian suatu zat padat dengan cara melarutkan zat padat tersebut pada pelarut yang sesuai dengan pemanasan dan kemudian mendinginkan larutan tersebut. Dengan memanaskan larutan, maka kelarutan zat akan meningkat. Saat larutan didinginkan maka kelarutan akan berkurang dan senyawa mulai mengendap. Beberapa metode rekristalisasi adalah :
1. Mengkristalkan kembali secara langsung dari cairan pelarut 2. Mengkristalkan kembali dengan asam basa
3. Mengkristalkan kembali secara presipitasi dengan solvent kedua
Agar rekristalisasi dapat berjalan dengan baik, pengotor harus dapat larut dalam pelarut untuk rekristalisasi atau mempunyai kelarutan lebih besar daripada senyawa yang diinginkan. Jika hal ini tidak terpenuhi, kotoran akan ikut mengkristal bersama senyawa yang diinginkan (Bresnick, 2004).
G. Pemeriksaan Kemurnian Senyawa Hasil Sintesis 1. Pemeriksaan Titik Lebur
Titik lebur adalah proses perubahan fisika pada suhu tertentu yang mengakibatkan padatan mulai berubah menjadi cair pada tekanan 1 atmosfer. Ketika suhu dinaikkan, terjadi penyerapan energi oleh molekul senyawa sehingga bila energi yang diserap cukup besar maka akan terjadi vibrasi dan rotasi dari molekul tersebut. Bila suhu tetap dinaikkan terus maka molekul akan rusak dan berubah menjadi cairan. Pada keadaan cair, molekul masih terikat satu dengan lainnya tetapi sudah tidak teratur lagi (MacKenzie, 1967).
13
Pemeriksaan titik lebur merupakan aspek penting yang seringkali dilakukan dalam penelitian sintesis suatu senyawa, Hal ini dapat dibenarkan karena pemeriksaan titik lebur dapat memberikan informasi mengenai kemurnian dari suatu produk hasil sintesis. Ketajaman jarak lebur suatu senyawa merupakan kriteria kemurnian suatu senyawa. Pada umumnya suatu senyawa mempunyai kemurnian yang baik bila jarak leburnya tidak lebih dari 20C, rentang jarak lebur yang lebih besar 20C dapat dikatakan senyawa kurang murni (MacKenzie, 1967).
2. Kromatografi Lapis Tipis ( KLT )
Kromatografi Lapis Tipis ( KLT ) ialah metode pemisahan fisika kimia yang terdiri dari komponen fase diam dan fase gerak. Fase diam dapat berupa zat padat atau cairan penyerap yang pada umumnya dipakai adalah silika gel, alumunium oksida, kieselgur, selulosa, dan turunannya, serta poliamida. Fase diam ini merupakan lapisan berpori dan akan menghasilkan pemisahan pada pelat. Fase gerak atau pelarut pengembang ialah media angkut dan terdiri atas satu atau beberapa pelarut, yang bergerak di dalam fase diam karena adanya gaya kapiler (Stahl, 1985).
Prinsip kerja KLT berupa lapisan yang dapat memisahkan senyawa yang terdiri atas fase diam ditempatkan pada penyangga berupa pelat gelas, logam, atau lapisan yang cocok. Campuran yang akan dipisahkan berupa larutan yang ditotolkan pada fase diam. Setelah pelat ditaruh di dalam bejana tertutup rapat yang berisi larutan pengembang atau fase gerak yang cocok, pemisahan terjadi selama masa perambatan kapiler atau pengembangan, selanjutnya senyawa yang
14
tidak berwarna harus dapat dideteksi dengan lampu ultraviolet atau dengan pereaksi semprot (Stahl, 1985).
Biasanya KLT digunakan untuk menguji kemurnian secara kualitatif dari campuran senyawa. Hal ini berkaitan dengan pembuktian ada atau tidaknya komponen yang dicari dan apakah komponen tersebut murni atau tidak. Biasanya pembuktian ini membutuhkan suatu sistem pelarut yang cocok dan pereaksi warna (Gasparic, 1978).
Pembuktikan kemurnian suatu campuran selama proses pemurnian dengan KLT dilakukan dengan membandingkan sampel dengan material awal. Terkadang dapat terjadi suatu komponen yang murni memberikan dua bercak pada kromatogram dan kecurigaan pada bercak kedua kemungkinan karena bercak tersebut berasal dari bercak pertama selama elusi sampel atau hasil dari oksidasi, hidrolisis, atau degradasi komponen pertama (Gasparic, 1978).
Terbentuknya bercak tunggal tidak dapat disimpulkan sebagai bercak murni sebelum digunakan dua atau lebih sistem pelarut yang berbeda kepolarannya (Gasparic, 1978).
Identifikasi dari komponen yang dianalisis memiliki prinsip bahwa setiap komponen memiliki kondisi dan karakteristik pada kromatogram yang disebut sebagai harga Rf. Karakteristik tersebut dapat berupa fluoresensi warna, dan lain-lain. Variasi dari harga Rf dan ketajaman warna adalah gambaran dari komponen yang dapat dikonfirmasi hanya dengan cara membandingkan secara langsung pada kromatogram yang sama. Reliabilitas dari identifikasi dapat ditingkatkan dengan memilih kondisi operasi, misalnya komponen yang diidentifikasi dielusi hanya
15
sampai bagian tengah kromatogram dimana pemisahan lebih jelas daripada daerah di dekat awal elusi atau yang paling dekat dengan pelarut. Untuk mengeliminasi adanya efek gangguan dari suatu komponen, standar diaplikasikan pada kromatogram tidak hanya sebagai senyawa tunggal tetapi berada di dalam campuran yang mengandung sebagian konsentrasi dari masing-masing komponen. Jika standar tidak bisa diperoleh, maka aturan tentang sifat kromatografi dan struktur suatu komponen dapat digunakan untuk identifikasi sampel yang dianalisis.
H. Elusidasi Struktur 1. Spektrofotometri Inframerah (Spektrofotometri IR)
Spektrofotometri IR biasanya digunakan untuk mengetahui gugus fungsional yang terdapat dalam sampel. Namun demikian, spektrofotometri IR tidak memberikan informasi mengenai struktur sebanyak yang diberikan spektroskopi Nuclear Magnetic Ressonance (Spektroskopi NMR).
Semua ikatan kimia memiliki frekuensi khas yang membuat ikatan mengulur (stretch) atau menekuk (bend). Bila frekuensi energi elektromagnetik inframerah yang dilewatkan pada suatu molekul sama dengan frekuensi mengulur atau menekuknya ikatan maka energi tersebut akan diserap. Serapan inilah yang dapat direkam oleh detektor pada spektrofotometri IR (Bresnick, 2004). 2. Spektroskopi resonansi magnet inti (1H-NMR)
Inti atom hidrogen mempunyai satu proton yang dianggap berputar dan dalam melakukan putarannya inti tersebut dipandang sebagai sebuah batang magnet kecil.
16
Bila sejumlah proton ditempatkan dalam medan magnet, beberapa proton akan terletak searah sedangkan yang lain terletak berlawanan arah terhadap medan magnet yang digunakan. Proton yang terletak searah dengan medan magnet dianggap lebih stabil, sehingga untuk "membalik" medan magnet proton ke arah yang berlawanan dibutuhkan energi yang lebih besar. Apabila inti yang berputar ini dikenai radiasi elektromagnetik pada frekuensi yang tepat (frekuensi radio), proton yang berenergi spin lebih rendah dapat menyerap energi dan akan "meloncat” ke keadaan spin berenergi lebih tinggi.
Keadaan resonansi adalah kesetimbangan dinamis yang terjadi antara status spin yang berenergi lebih rendah dengan status spin yang berenergi lebih tinggi. Keadaan resonansi ini dapat dikenali dan dihubungkan dengan frekuensi energi yang diserap dan diperlukan agar terjadi keadaan resonansi (Bresnick, 2004).
Pergerakan elektron mengelilingi proton akan menciptakan medan magnet tersendiri. Medan magnet ini terletak searah sedemikian rupa sehingga melawan medan magnet yang diberikan. Dengan demikian, pengaruh medan magnet yang dirasakan oleh proton akan berkurang dan proton dikatakan terperisai. Apabila sirkulasi elektron (terutama elektron π) menginduksi suatu medan yang memperkuat medan yang diberikan, proton tersebut dinyatakan tak terperisai.
Proton yang terperisai membutuhkan pemberian medan magnet yang lebih kuat sehingga kekuatan medan efektif tertentu tercapai guna berlangsungnya penyerapan. Oleh karena itu proton yang terperisai akan menggeser penyerapan
17
ke ”atas-medan” (sinyal muncul di bagian kanan spektra). Di sisi lain, proton yang tidak terperisai akan menggeser penyerapan ke “bawah-medan". Pergeseran posisi penyerapan akibat pemerisaianatau pembukaan perisai oleh elektron disebut geseran kimia. Setiap jenis ikatan mempunyai nilai pergeseran kimia masing-masing (Bresnick, 2004).
Gugus elektronegatif akan membuka perisai proton sehingga memungkinkan proton lebih "merasakan" medan magnet yang diberikan. Semakin besar elektronegativitas suatu gugus yang berdekatan, semakin jauh sinyal bergeser ke bawah medan (Bresnick, 2004).
I. Landasan Teori
Sintesis suatu senyawa organik adalah reaksi antara suatu nukleofil dan elektrofil. Aldehida aromatis adalah suatu senyawa yang sifat elektrofilnya lebih lemah dibandingkan dengan aldehid alifatis. Salah satu cara untuk mengatasi masalah ini ialah dengan cara meningkatkan jumlah nukleofil yang akan bereaksi dengan elektrofilnya sehingga meningkatkan jumlah enolat yang akan bereaksi dengan 4-hidroksibenzaldehida daripada meningkatkan jumlah elektrofil yang kurang reaktif.
J. Hipotesis
Peningkatan jumlah mol asam malonat dapat meningkatkan rendemen dari asam 4-hidroksisinamat.
18 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan suatu penelitian eksperimental karena adanya perlakuan pada subjek uji berupa peningkatan jumlah mol asam malonat.
B. Variabel Penelitian
1. Variabel bebas pada penelitian ini adalah 4-hidroksibenzaldehid dan asam malonat sebagai starting material dalam pembentukan asam 4-hidroksisinamat.
2. Variabel tergantung pada penelitian ini adalah pembentukan rendemen asam 4-hidroksisinamat.
3. Variabel perantara pada penelitian ini adalah pembentukan ion enolat dari garam malonat sebagai nukleofil yaitu reaksi antara asam malonat dengan katalis amonia.
4. Variabel pengacau terkendali pada penelitian ini adalah suhu percobaan, kondisi peralatan dan kemurnian bahan karena dapat mempengaruhi hasil reaksi dari 4-hidroksibenzaldehid dengan asam malonat untuk membentuk asam 4-hidroksisinamat
C. Bahan / Materi Penelitian
Asam malonat (p.a, E. Merck), piridin (p.a, E. Merck), 4-hidroksi benzaldehid (p.a, E. Merck), vanilin (p.a, E. Merck), aquadest (laboratorium Farmasi Universitas Sanata Dharma), asam klorida (p.a, E. Merck), etanol (p.a, E. Merck), n-heksan (mutu teknis, Brataco Chemika), etil asetat (teknis, Brataco
19
Chemika), kloroform (p.a, E. Merck), asam asetat glacial (teknis, Asia Lab), aseton (teknis, Asia Lab), amonium hidroksida (p.a, E. Merck), besi (III) klorida (teknis, Brataco Chemika), asam sulfat (p.a, E. Merck), petroleum eter (p.a, E. Merck), eter (teknis, Brataco Chemika), dimetil sulfoksida (p.a, E. Merck), Kieselgel 60 GF254, es batu.
D. Alat
Pendingin alihn (Vuline), kompor listrik (Herdolph MR 2002), beaker
glass (Duran schott mainz), klem, erlenmeyer bertutup (Duran schott mainz),
stirrer magnetik, selang air, baskom, termometer, corong buchner, pompa vakum (Robinair High Vacuum Pump model no. 15100), corong kaca, cawan petri, oven (Memmert oven model 400), flakon, kertas saring, lempeng KLT, alat pembuat KLT, gelas pengaduk, timbangan elektrik (Mextler PM 100), lampu UV254 nm, kaca arloji, gelas ukur (Iwaki pyrex), labu ukur (Iwaki pyrex), pipet ukur (Brand), bejana KLT, pipa kapiler, alat uji titik lebur (Thermophan), spektrofotometer UV/Vis (MILTON Roy Spectronic 3000 ARR), spektrometer IR (IR Prestige-21 Shimadzu), Spektrometer H1-NMR (H-NMR JOEL-MY60).
E. Tata Cara Penelitian 1. Sintesis Asam 4-hidroksisinamat
a. Sintesis dengan perbandingan mol 1:1. Asam malonat sebanyak 20 mmol dilarutkan dalam 60 mmol amonia, sambil dipanaskan di atas penangas air, kemudian ke dalam campuran tadi 4-hidroksibenzaldehida dimasukkan sebanyak 20 mmol dan dipanaskan pada suhu 800C sambil diaduk selama 2 jam. Kemudian larutan HCl 2N 50 ml ditambahkan ke dalam larutan dan diaduk selama kurang
20
lebih 2 jam hingga tidak terdapat gelembung. Larutan didinginkan hingga terdapat endapan dan disaring dengan corong Buchner dan dicuci dengan larutan HCl 2N, air dan petroleum eter. Endapan yang diperoleh selanjutnya dimurnikan dengan rekristalisasi menggunakan pelarut air panas.
b. Sintesis dengan perbandingan mol 1:1/2. Asam malonat sebanyak 30 mmol dilarutkan dalam 90 mmol amonia, sambil dipanaskan di atas penangas air, kemudian ke dalam campuran tadi 4-hidroksibenzaldehida dimasukkan sebanyak 20 mmol dan dipanaskan pada suhu 800C sambil diaduk selama 2 jam. Kemudian larutan HCl 2N 50 ml ditambahkan ke dalam larutan dan diaduk selama kurang lebih 2 jam hingga tidak terdapat gelembung. Larutan didinginkan hingga terdapat endapan dan disaring dengan corong Buchner dan dicuci dengan larutan HCl 2N, air dan petroleum eter. Endapan yang diperoleh selanjutnya dimurnikan dengan rekristalisasi menggunakan pelarut air panas.
c. Sintesis dengan perbandingan mol 1:2. Asam malonat sebanyak 40 mmol dilarutkan dalam 120 mmol amonia, sambil dipanaskan di atas penangas air, kemudian ke dalam campuran tadi 4-hidroksibenzaldehida dimasukkan sebanyak 20 mmol dan dipanaskan pada suhu 800C sambil diaduk selama 2 jam. Kemudian larutan HCl 2N 50 ml ditambahkan ke dalam larutan dan diaduk selama kurang lebih 2 jam hingga tidak terdapat gelembung. Larutan didinginkan hingga terdapat endapan dan disaring dengan corong Buchner dan dicuci dengan larutan HCl 2N, air dan petroleum eter. Endapan yang diperoleh selanjutnya dimurnikan dengan rekristalisasi menggunakan pelarut air panas.
21
2. Rekristalisasi Senyawa Hasil Sintesis
Serbuk hasil sintesis dilarutkan dalam air panas, apabila pelarut berlebih dijenuhkan hingga perbandingan serbuk : aquadest panas sebesar 1 : 36 (berdasarkan hasil uji kelarutan). Kemudian larutan disaring dan filtrat ditampung dalam labu alas bulat. Filtrat tersebut didinginkan dalam ice bath hingga terbentuk kristal. Kristal yang diperoleh disaring dan dikeringkan dalam oven pada suhu 1000C hingga kering. Setelah kering, kristal ditimbang dan dihitung rendemennya 3. Uji Pendahuluan
a. Uji organoleptis. Senyawa hasil sintesis diamati bentuk kristal, warna, bau dan rasa dan dibandingkan dengan asam 4-hidroksisinamat berdasarkan literatur.
b. Uji Kelarutan. Kristal hasil sintesis kurang lebih 10 mg dimasukkan dalam erlenmeyer kemudian ditambahkan air 0,01 ml (10 µl) bila perlu digojog, apabila belum larut kemudian ditambahkan air hingga larut. Dilakukan hal yang sama dengan pelarut etanol, air panas, eter, dan benzena.
Tabel II. Klasifikasi kelarutan
Istilah kelarutan Jumlah bagian pelarut yang diperlukan untuk melarutkan 1 bagian zat sangat mudah larut < 1
mudah larut 1 – 10
larut 10 – 30
agak sukar larut 30 – 100
sukar larut 100 – 1000
sangat sukar larut 1000 – 10000 praktis tidak larut > 10000
22
c. Identifikasi senyawa hasil sintesis dengan pereaksi kimiawi Sejumlah kristal hasil sintesis diletakkan pada drople plate kemudian ditetesi dengan larutan vanilin + asam sulfat, amati warna yang terbentuk
d. Uji Titik Lebur. Sejumlah kristal hasil sintesis diisikan kedalam
electrothermal capillary tubes, kemudian dimasukkan ke dalam alat pengukur titik lebur (Thermophan). Amati peleburan kristalnya dan catat suhu pada waktu pertama kali melebur hingga semua kristal melebur dengan kenaikan suhu 0,2° C per menitnya
e. Uji Kemurnian dengan Kromatografi Lapis Tipis. Kemurnian hasil sintesis diuji dengan mengamati jumlah bercak dan harga Rf senyawa hasil sintesis yang dibandingkan dengan harga Rf material awal. Sistem KLT yang digunakan ialah : fase diam kieselgel 60 GF254, fase gerak : n-heksana : etil asetat (4:2); n-heksana : kloroform : asam asetat (10:8:2); kloroform : aseton : asam asetat (10:5:0,5) dan penampak bercak : sinar UV 254 nm
4. Elusidasi struktur senyawa hasil sintesis
a. Spektrofotometri Infra Merah. Sampel sebanyak kurang lebih 0,5-1 mg dicampur homogen KBr kurang lebih 10 mg, kemudian dikempa dan dibuat tablet. Cahaya infra merah dari sumber dilewatkan melalui cuplikan, kemudian dipecah menjadi frekuensi-frekuensi individunya dalam monokromator dan intensitas relatif dari masing-masing frekuensi diukur oleh detektor hingga didapat spektra infra merah dari senyawa yang bersangkutan.
b. Spektroskopi Resonansi Magnetik Inti (1H-NMR). Sample sebanyak 10-50 mg dimasukkan dalam tabung dan tambahkan pelarut DMSO d6
23
serta 1-2 tetes tetrametilsilan (TMS) sebagai standar internal. Sel sampel berupa tabung gelas kecil silindris diletakkan diantara kutub-kutub magnet. Sel sampel dipusingkan maka akan didapat sinar resonansi proton dari spektrometer 1H NMR. Kekuatan 1H NMR yang digunakan adalah 60 MHz.
Data yang diperoleh dari instrumen diatas dapat digunakan untuk menentukan struktur senyawa hasil sintesis
5. Tata cara analisis hasil
a. Pemeriksaan kemurnian senyawa hasil sintesis. Dilakukan berdasarkan data kromatografi lapis tipis dan data titik lebur
b. Elusidasi struktur senyawa hasil sintesis. Dilakukan berdasarkan spektra infra merah dan spektra resonansi magnetik inti 1H-NMR
c. Perhitungan rendemen 100%
teoritis secara
senyawa berat
sintesis hasil
senyawa
berat ×
=
24 BAB IV
HASIL DAN PEMBAHASAN
A. Sintesis Asam 4-Hidroksisinamat
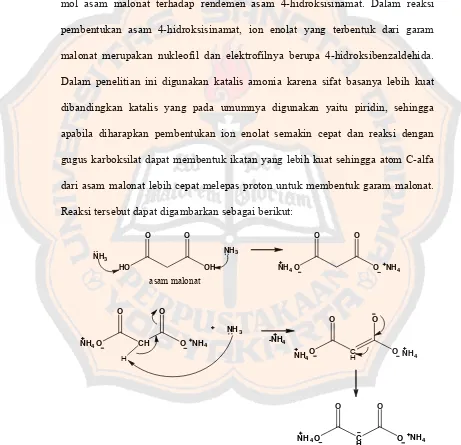
Penelitian ini dilakukan untuk mengamati pengaruh peningkatan jumlah mol asam malonat terhadap rendemen asam 4-hidroksisinamat. Dalam reaksi pembentukan asam 4-hidroksisinamat, ion enolat yang terbentuk dari garam malonat merupakan nukleofil dan elektrofilnya berupa 4-hidroksibenzaldehida. Dalam penelitian ini digunakan katalis amonia karena sifat basanya lebih kuat dibandingkan katalis yang pada umumnya digunakan yaitu piridin, sehingga apabila diharapkan pembentukan ion enolat semakin cepat dan reaksi dengan gugus karboksilat dapat membentuk ikatan yang lebih kuat sehingga atom C-alfa dari asam malonat lebih cepat melepas proton untuk membentuk garam malonat. Reaksi tersebut dapat digambarkan sebagai berikut:
O
Gambar 8. Reaksi pembentukan garam malonat dan ion enolat dari asam malonat
25
Dengan terbentuknya garam malonat, jika ada satu mol basa maka akan terbentuk enolat dari garam malonat hasil reaksi dengan amonia. Hal ini karena atom H alfa pada malonat semakin mudah dilepas bila dibantu dengan sifat nukleofil amonia yang kuat. Kuatnya sifat basa amonia dibandingkan katalis yang umum digunakan seperti piridin diharapkan dapat membentuk ion enolat lebih cepat dan semua asam malonat akhirnya menjadi ion enolat sehingga diharapkan akan meningkatkan rendemen senyawa hasil sintesis.
Dilihat dari sifat elektrofilnya, gugus hidroksi fenolik yang terdapat pada 4-hidroksibenzaldehid dapat mendelokalisasikan elektronnya ke dalam cincin aromatis dari 4-hidroksibenzaldehida dan beresonansi sehingga menyebabkan atom C karbonilnya kurang reaktif. Cara yang digunakan untuk mengatasi lemahnya sifat elektrofil dari 4-hidroksibenzaldehida pada penelitian ini ialah dengan meningkatkan jumlah mol nukleofilnya tetapi jumlah mol dari elektrofilnya tidak diubah untuk mengamati pengaruh penambahan asam malonat terhadap jumlah rendemen yang terbentuk.
OH O
O O
H H
-H
Gambar 9. Deaktifasi gugus aldehida oleh delokalisasi elektron hidroksi fenol.
Dari hasil orientasi untuk mendapatkan kondisi sintesis yang optimum maka cara sintesis dilakukan dengan mereaksikan asam malonat dan amonia dengan perbandingan mol 1:3 terlebih dahulu, karena untuk membentuk ion
26
enolat dari asam malonat diperlukan 3 mol amonia dan digunakan refluks untuk mencegah menguapnya katalis amonia.
Setelah ion enolat dari garam malonat terbentuk maka enolat tersebut direaksikan dengan 4-hidroksibenzaldehida yang memiliki gugus aldehid sebagai elektrofil dan hasil reaksi ini akan membentuk suatu senyawa yang dapat mengalami dehidrasi dan dekarboksilasi jika dipanaskan dengan penambahan asam.
Gambar 10. Reaksi antara 4-hidroksibenzaldehid dengan ion enolat
Proses dehidrasi dan dekarboksilasi ini terjadi bersamaan ketika asam klorida ditambahkan sambil dipanaskan. Dekarboksilasi dapat diamati dengan terbentuknya gelembung pada larutan. Pengadukan dihentikan bila gelembung sudah hilang yang menandakan reaksi dekarboksilasi sudah tidak terjadi lagi.
Berdasarkan hasil orientasi, proses dari pembentukan garam malonat hingga hilangnya gelembung setelah ditambahkan asam klorida berlangsung selama 4 jam. Namun bila masih terdapat gelembung pada larutan maka pemanasan dan pengadukan diteruskan gelembung hilang dan tidak terebentuk kembali.
27
Gambar 11. Reaksi dehidrasi dan dekarboksilasi pada asam 4-hidroksisinamat Pengendapan dilakukan dengan mendinginkan larutan dalam ice bath. Hal ini dilakukan karena asam 4-hidroksisinamat adalah senyawa yang sulit larut dalam air dingin dan lebih larut dalam air panas. Hal inilah yang menyebabkan terbentuknya endapan ketika larutan didinginkan.
B. Rekristalisasi Senyawa Hasil Sintesis
Untuk mendapatkan senyawa yang murni dilakukan rekristalisasi hasil sintesis dengan menggunakan pelarut air panas. Serbuk yang didapatkan dari hasil sintesis dilarutkan seluruhnya dalam air panas sebab asam 4-hidroksisinamat sulit larut dalam air dingin dan lebih mudah larut dalam air panas sehingga jika larutan didinginkan, diharapkan senyawa tersebut mengendap kembali.
28
Sisa reaksi yang tidak larut dalam air panas disaring dengan kertas saring untuk memisahkan dari senyawa yang diinginkan. Penyaringan dilakukan saat larutan masih dalam keadaan panas karena jika larutan sudah dingin, maka senyawa yang diinginkan akan mengendap kembali.
Untuk menghilangkan pereaksi yang berupa asam malonat dapat digunakan air, sebab senyawa ini sangat mudah larut dalam air (1 gram dalam 0,6 ml air). Untuk mendapatkan senyawa murni pada penelitian ini, senyawa hasil sintesis harus direkristalisasi beberapa kali hingga sisa reaksi berupa asam malonat dan 4-hidroksibenzaldehida dapat dipisahkan namun proses rekristalisasi yang dilakukan berulang-ulang dapat mengurangi rendemen hasil sintesis.
Melalui uji kemurnian dengan menggunakan kromatografi lapis tipis dan uji titik lebur, dapat dibuktikan bahwa cara rekristalisasi ini dapat memurnikan senyawa hasil sintesis. Dari hasil rekristalisasi didapatkan rendemen sebagai berikut:
Tabel III. Rendemen Senyawa Hasil Sintesis Perbandingan mol
(4-hidroksibenzaldehid : asam malonat)
Persen rendemen
1 : 1 7,01 %
1 : 11/2 21,26 %
1 : 2 25,6 %
Berdasarkan hasil rekristalisasi diketahui bahwa dengan semakin meningkatnya jumlah asam malonat maka persentase rendemen yang didapatkan juga meningkat. Hal ini terjadi karena semakin banyak ion enolat yang terbentuk dari garam malonat maka kesempatan bereaksi enolat tersebut dengan nukleofil berupa 4-hidroksibenzaldehid semakin besar sehingga akan meningkatkan
29
rendemen. Dari data dapat diketahui bahwa peningkatan persentase rendemen yang cukup tinggi terjadi setelah perbandingan antara 4-hidroksibenzaldehida dan asam malonat dinaikkan dari 1:1 ke perbandingan mol 1:11/2 (7,01% menjadi 21,26%), dan peningkatan persentase rendemen dari perbandingan mol 1:11/2 ke perbandingan mol 1:2 tidak begitu tinggi (21,26% menjadi 25,6%). Hal ini terjadi karena pengaruh sifat elektrofil yang lemah dari 4-hidroksibenzaldehida dan kurangnya waktu reaksi sehingga tidak semua 4-hidroksibenzaldehida bereaksi dengan asam malonat untuk membentuk asam 4-hidroksisinamat.
C. Uji Pendahuluan 1. Uji Organoleptis
Uji organoleptis dilakukan untuk mengamati spesifikasi senyawa hasil sintesis yang dibandingkan dengan starting material sebagai identifikasi awal bahwa senyawa yang terbentuk dari hasil sintesis berbeda dengan starting material. Hasil uji organoleptis senyawa hasil sintesis ditunjukkan pada tabel dibawah ini
Tabel IV. Hasil uji organoleptis
Pengamatan Senyawa hasil sintesis 4-hidroksibenzaldehid
Bentuk serbuk jarum serbuk
Warna kuning mengkilat putih kecoklatan
Rasa tidak berasa tidak berasa
Bau tidak berbau tidak berbau
30
Gambar 12. Kristal jarum berwarna kuning hasil rekristalisasi
Hasil pengamatan diatas menunjukkan perbedaan antara starting material dengan senyawa hasil sintesis dan menunjukkan bahwa telah terbentuk senyawa baru dari hasil sintesis. Senyawa hasil sintesis berbentuk jarum sehingga memiliki salah satu ciri dari asam 4-hidroksisinamat. Oleh karena adanya ciri yang sama dengan asam 4-hidroksisinamat maka uji pendahuluan lainnya dapat dilakukan.
2. Uji Kelarutan
Hasil uji ini nantinya dapat digunakan sebagai acuan penggunaan pelarut dalam identifikasi senyawa hasil sintesis menggunakan KLT maupun pada saat elusidasi struktur. Data uji kelarutan yang diperoleh adalah sebagai berikut :
Tabel V. Hasil Uji Kelarutan
Pelarut
Kelarutan Senyawa hasil
sintesis
Asam 4-hidroksi sinamat (Merck I., 2001) aquadest Tidak larut Sukar larut aquadest panas Agak sukar larut
(1 : 36)
Larut
etanol Larut (1:15) Larut
metanol Larut (1:12) -
eter Larut (1: 25) Larut
benzena Tidak larut Praktis tidak larut
31
Berdasarkan data uji kelarutan tersebut, senyawa hasil sintesis memiliki kelarutan yang sama dengan asam 4-hidroksi sinamat berdasarkan literatur. Hasil uji kelarutan ini menunjukkan bahwa senyawa hasil sintesis cenderung polar karena larut pada pelarut organik yang lebih polar, sehingga dapat digunakan sebagai acuan untuk pemilihan pelarut yang digunakan pada berbagai uji yang akan dilakukan selanjutnya.
3. Identifikasi Senyawa Hasil Sintesis Dengan Pereaksi Kimiawi
Identifikasi senyawa hasil sintesis dengan pereaksi kimia dilakukan dengan menggunakan larutan vanilin dalam asam sulfat yang diencerkan. Pereaksi vanilin dan asam sulfat dapat digunakan untuk mengidentifikasi senyawa turunan sinamat. Pada asam 4-hidroksisinamat pengkoplingan ini akan menyebabkan larutan berwarna ungu (Tuzen dan Ozdemir, 2003).
Gambar 13. Hasil uji kualitatif asam 4-hidroksisinamat
Keterangan : A. Larutan vanilin asam sulfat
B. Larutan vanilin asam sulfat + senyawa hasil sintesis
Dari hasil uji pada senyawa hasil sintesis, terbentuk warna ungu ketika ditambahkan pereaksi vanilin dalam asam sulfat. Hasil ini menunjukkan bahwa warna yang terbentuk dari hasil reaksi asam 4-hidroksisinamat sama dengan warna yang terbentuk pada senyawa hasil sintesis ketika direaksikan dengan
32
vanilin dalam asam sulfat. Hal ini menguatkan dugaan bahwa senyawa hasil sintesis merupakan asam 4-hidroksisinamat. Reaksi yang terjadi adalah antara vanilin asam sulfat sebagai elektrofil dan asam 4-hidroksisinamat sebagai nukleofil.
Gambar 14. Mekanisme reaksi pada uji kualitatif dengan pereaksi vanilin asam sulfat
33
Senyawa yang terbentuk dari reaksi antara vanilin asam sulfat dengan asam 4-hidroksisinamat ialah senyawa yang memiliki sistem konjugasi lebih panjang daripada asam 4 hidroksisinamat sendiri sehingga menyebabkan senyawa ini berwarna. Sistem konjugasi pada senyawa ini ialah sistem konjugasi semu dimana pasangan elektron bebas (elektron π) atom oksigen dapat didonorkan karena adanya resonansi pada ikatan C-O karbonil sehingga membentuk sistem konjugasi yang lebih panjang saat terjadi resonansi dan terbentuk warna ungu. Pembentukan sistem kromofor tersebut dapat digambarkan sebagai berikut:
HO
Gambar 15. Pembentukan warna pada senyawa dengan sistem konjugasi semu
4. Uji Titik Lebur
Uji titik lebur digunakan untuk mengetahui informasi mengenai identifikasi dan kemurnian dari suatu senyawa hasil sintesis dengan menggunakan alat uji titik lebur. Berdasarkan pemeriksaan diketahui bahwa senyawa hasil sintesis mempunyai jarak lebur sebesar 214-2160C. Hasil ini menunjukkan bahwa senyawa hasil sintesis telah murni karena jarak lebur tidak lebih dari 20C, sebab jika lebih dari 20C dapat diperkirakan adanya senyawa lain yang mempengaruhi jarak lebur. Hal ini karena adanya senyawa sisa reaksi menyebabkan panas yang
34
digunakan untuk melebur senyawa tersebut tidak sama sehingga dapat diperkirakan bahwa jarak leburnya akan lebih dari 20C.
Untuk uji kualitatif, titik lebur senyawa hasil sintesis dibandingkan dengan titik lebur asam 4-hidroksisinamat. Berdasarkan literatur diketahui bahwa asam 4-hidroksisinamat memiliki titik lebur 210-2130C (Merck Index edisi 13). Jika dibandingkan antara titik lebur senyawa hasil sintesis dengan titik lebur asam 4-hidroksisinamat, maka perbedaan sebesar 10C tidak memberi perbedaan yang berarti karena untuk senyawa yang memiliki titik lebur di atas 2000C, adanya perbedaan ±100C tidak memberi arti yang signifikan sehingga dapat disimpulkan
bahwa titik lebur senyawa hasil sintesis sama dengan titik lebur asam 4-hidroksisinamat.
5. Uji Kemurnian dengan KLT
Pemeriksaan kemurnian dengan kromatografi lapis tipis (KLT) dilakukan dengan menggunakan 3 fase gerak yang berbeda dan fase diam silika gel GF254. Selain bertujuan untuk memeriksa kemurnian, uji dengan KLT juga bertujuan untuk mengetahui apakah sudah terbentuk senyawa hasil sintesis. Terbentuknya senyawa baru dapat diketahui dari adanya nilai Rf yang berbeda pada senyawa hasil sintesis yang diuji bila dibandingkan dengan senyawa awal.
Starting material dan senyawa hasil sintesis yang diidentifikasi tidak berfluoresensi dibawah sinar UV 254 nm sedangkan silika gel GF254 memiliki indikator fluoresensi pada UV dengan panjang gelombang 254 nm sehingga semua bercak senyawa baik starting material maupun senyawa hasil sintesis dapat
35
terlihat dan dibandingkan dengan jelas pada fase diam dengan indikator lampu UV dengan panjang gelombang 254 nm.
Untuk identifikasi kemurnian, digunakan tiga fase gerak yang berbeda kepolarannya. Hal ini bertujuan untuk memastikan kemurnian senyawa hasil sintesis yang dapat dibuktikan melalui terbentuknya bercak tunggal pada ketiga fase gerak yang digunakan. Terbentuknya bercak tunggal pada salah satu fase gerak belum dapat dikategorikan bahwa senyawa hasil sintesis sudah murni karena suatu fase gerak belum tentu dapat memisahkan senyawa secara sempurna. Oleh karena itulah perlu diubah kepolarannya agar pada setiap kepolaran fase gerak dapat dibuktikan bahwa senyawa hasil sintesis sudah murni. Urutan kepolaran fase gerak dari paling kecil hingga paling polar pada penelitian ini yaitu
n-heksana : etil asetat (4:2); klorofom : eter (3:1); kloroform : aseton : asam asetat (10:5:0,5).
Dari hasil elusi dengan fase gerak n heksan : etil asetat (4:2) terlihat bahwa senyawa hasil sintesis (bercak C, D, E) memiliki nilai Rf yang berbeda dari
starting material yaitu 4-hidroksibenzaldehid dan asam malonat, namun bercak senyawa hasil sintesis dan asam malonat belum terelusi dengan baik karena kepolaran yang kecil dari fase gerak I belum mampu mengangkat bercak sehingga menyebabkan bercak lebih tertahan pada fase diam. Bercak senyawa hasil sintesis dan asam malonat masih terlihat mengekor (tailing) yang dapat disebabkan oleh ketidakjenuhan fase gerak yang digunakan, tetapi bercak yang terelusi adalah bercak tunggal dan tidak terjadi pemisahan bercak. Oleh karena itulah diperlukan fase gerak II dan II untuk memastikan kemurnian senyawa hasil sintesis
36
Tabel VI. Harga Rf hasil uji KLT dengan tiga fase gerak
Senyawa
Fase gerak
I Fase gerak II Fase gerak III Harga Rf Harga Rf Harga Rf
p-hidroksibenzaldehid 0,36 0,51 0,72
asam malonat 0,04 0,08 0,24
hasil sintesis (1 : 1) 0,08 0,25 0,54
hasil sintesis (1 : 11/2) 0,08 0,25 0,56
hasil sintesis (1 : 2) 0,09 0,26 0,55
Gambar 16. Profil bercak pada sistem KLT I Keterangan :
Fase diam : silika gel GF254 Bercak A : 4-hidroksibenzaldehid
Fase gerak I : n heksan : etil asetat (4:2) Bercak B : asam malonat Deteksi : sinar UV254 nm Bercak C : hasil sintesis (1 : 1)
Jarak rambat : 10 cm Bercak D : hasil sintesis (1 : 11/
2) Bercak E : hasil sintesis (1 : 2)
37
Nilai Rf senyawa hasil sintesis menunjukkan bahwa senyawa tersebut merupakan senyawa yang lebih polar daripada 4-hidroksibenzaldehid karena jarak rambatnya pada silika lebih rendah daripada jarak rambat 4-hidroksibenzaldehid. Hasil ini juga didukung dengan data kromatogram dari dua fase gerak lainnya yang lebih polar yaitu kloroform : eter (3:1) dan kloroform : aseton : asam asetat (10 : 5 : 0,5) yang ditunjukkan pada gambar berikut:
Gambar 17. Profil bercak pada sistem KLT II dan III Keterangan :
Fase diam : silika gel GF254 Bercak A : 4-hidroksibenzaldehid
Fase gerak II : kloroform : eter (3:1) Bercak B : asam malonat Fase gerak III : kloroform : aseton : asam asetat Bercak C : hasil sintesis (1 : 1)
(10 : 5 : 0,5) Bercak D : hasil sintesis (1 : 11/2)
Jarak rambat : 10 cm Bercak E : hasil sintesis (1 : 2)
Deteksi : sinar UV254nm
38
Fase gerak II yang lebih polar daripada fase gerak I menunjukkan bercak tunggal senyawa hasil sintesis dan bercak terelusi lebih jauh karena kepolaran fase gerak dapat membawa senyawa namun bercak senyawa hasil sintesis masih terlihat mengekor (tailing). Oleh karena itu dibutuhkan fase gerak III yang paling polar untuk mngetahui bahwa senyawa hasil sintesis sudah murni yang ditunjukkan oleh bercak tunggal senyawa dan tidak mengekor (tailing) dan senyawa juga terelusi lebih jauh karena interaksi antara senyawa hasil sintesis dengan fase gerak III lebih kuat daripada fase gerak I dan II.
Perbedaan nilai Rf yang jelas pada senyawa awal (A) dan senyawa hasil sintesis (C, D, dan E) menunjukkan bahwa senyawa hasil sintesis memiliki interaksi lebih kuat dan lebih tertahan pada fase diam diam dibandingkan dengan 4-hidroksibenzaldehida.
Uji kemurnian ini sesuai dengan persyaratan dalam literatur yang menyebutkan bahwa terbentuknya suatu bercak tunggal tidak dapat disimpulkan sebagai bercak murni sebelum digunakan sistem pelarut dengan kepolaran yang berbeda. (Gasparic, 1978).
D. Elusidasi Struktur dan Identifikasi Senyawa Hasil Sintesis 1. Interpretasi Spektra Infra Merah
Spektrofotometri infra merah dilakukan untuk mengetahui keberadaan gugus-gugus fungsional pada senyawa hasil sintesis. Dengan diketahuinya gugus fungsional tersebut akan dapat membantu dalam penentuan struktur senyawa hasil sintesis.
39
Gambar 18. Spektra IR senyawa hasil sintesis
Tabel VII. Perbandingan interpretasi gugus senyawa hasil sintesis dengan literatur Bilangan
Gelombang (cm-1)
Intensitasnya Gugus fungsional
3387 kuat-tajam OH (fenolik)
3024, 38 Lemah Ikatan C-H aromatis
1674,21 kuat-tajam karakteristik karbonil (ikatan C=O karbonil)
1597,06 dan 1625
sedang-tajam ikatan ena C=C yang terkonjugasi dengan bentuk trans pada cincin aromatik dan gugus karbonil
1219-1319,31 kuat-sedang Ikatan C-O karboksilat (COOH) 941,26 sedang-tajam pendukung adanya cincin aromatis
833,25 sedang-tajam senyawa aromatis tersubtitusi posisi para
(Silverstein,1991)
40
Pada spektra infra merah senyawa hasil sintesis terdapat tujuh profil pita yang menunjukkan keberadaan gugus-gugus fungsional yang dimiliki senyawa asam 4-hidroksisinamat. Pita vibrasi ulur dengan serapan tajam berintensitas kuat pada 3387 cm-1(pita A) menunjukkan adanya gugus OH fenolik. Pita vibrasi dengan intensitas lemah dan melebar pada bilangan gelombang 3024 cm-1 (Pita B), mendukung adanya ikatan C-H aromatis. Adanya senyawa aromatis juga ditunjukkan pada vibrasi ulur ikatan C=C aromatis dengan serapan sedang-tajam pada bilangan gelombang 941,26 cm-1 (pita F).
Pada bilangan gelombang 1674,21 cm-1 (pita C) tampak vibrasi ulur berintensitas kuat yang menunjukkan ikatan C=O karbonil yang khas untuk gugus karboksilat terkonjugasi dengan ikatan ena (olefinik). Hal ini didukung dengan adanya serapan tumpang tindih C-O pada bilangan gelombang 1219-1319 cm-1 (pita E).
Ikatan C=C ena (olefin) terkonjugasi biasanya ditunjukkan dengan adanya dua pita vibrasi ulur yang memiliki serapan pada bilangan gelombang sekitar 1625 cm-1 dan 1600 cm-1. Pada spektra di atas kedua pita ini muncul pada serapan ± 1625 cm-1 dan 1597,06 cm-1 (pita D). Pita vibrasi ulur ini menunjukkan ciri senyawa olefin yang terkonjugasi dengan suatu karbonil dan cincin aromatis karena serapan ikatan olefinik yang terkonjugasi dengan gugus karbonil berkurang kira-kira 30 cm-1(Silverstein,1991).
Berdasarkan serapan pada bilangan gelombang 1597,06 cm-1 dapat diketahui pada senyawa hasil sintesis terbentuk konjugasi ikatan olefinik dengan bentuk trans. Ikatan olefinik yang terkonjugasi dengan bentuk cis biasanya
41
memiliki serapan yang sama kuat dengan karbonil, namun bentuk struktur trans
tidak menyerap sekuat cis dan hal ini terlihat jelas pada spektra yang menunjukkan serapan pita vibrasi ulur C=C ena terpisah dan tidak sekuat dan setajam serapan karbonil. Pada bilangan gelombang 833,25 cm-1 (pita G) spektra IR tersebut juga ditemukan pita vibrasi yang menunjukkan hasil sintesis ialah senyawa tersubsitusi pada posisi para.
Dari hasil interpretasi spektra inframerah ini terlihat bahwa senyawa hasil sintesis merupakan senyawa aromatis yang tersubtitusi pada posisi para dan memiliki gugus hidroksi fenolik. Senyawa hasil sintesis juga memiliki ikatan rangkap olefinik yang terkonjugasi dengan suatu karbonil dan cincin aromatis dengan struktur berbentuk trans yang tidak dimiliki oleh senyawa awal (4-hidroksibenzaldehid). Ikatan C=O karbonil yang membentuk ikatan konjugasi dengan ikatan rangkap olefinik ini berasal dari gugus karboksil yang didukung dengan adanya ikatan C-O pada pita E (1219-1319 cm-1). Dari hasil interpretasi data spektra inframerah ini dapat disimpulkan bahwa senyawa hasil sintesis tersebut merupakan asam 4-hidroksisinamat.
2. Interpretasi Spektra 1H-NMR
Spektroskopi resonansi magnet inti digunakan untuk mengidentifikasi keberadaan atom hidrogen dalam suatu senyawa dan sifat lingkungan dari setiap tipe atom hidrogen di dalam senyawa. Hasil elusidasi struktur dengan spektroskopi NMR dari senyawa hasil sintesis ditunjukkan pada gambar di bawah ini.
42
Gambar 19. Spektra 1H-NMR
Tabel VIII. Analisa spektra 1H-NMR senyawa hasil sintesis Jenis proton Determinasi δ H (DMSO d6) cincin aromatik jika dikombinasikan dengan sinyal C
Hd
Hd
δ 6,7-6,9 ppm (2H, doblet)
proton pada ikatan C=C
He
δ 6,4 ppm (1H, singlet)
proton pada ikatan C=C
Hf
δ 6,1 ppm (1H, singlet)
43
Dari gambar spektra di atas dapat dilihat bahwa senyawa hasil sintesis memiliki 6 sifat lingkungan atom hidrogen. Sinyal yang dihasilkan antara lain sinyal A, B, C, D, E dan F. Berdasarkan keberadaan lingkungan proton pada senyawa asam 4-hidroksisinamat maka jumlah sinyal yang terlihat di spektra sesuai dengan lingkungan proton pada senyawa.
O
Gambar 20. Jenis proton pada asam 4-hidroksisinamat.
Sinyal A yang merupakan sinyal singlet yang tidak terperisai dan menunjukkan proton yang terikat pada suatu gugus karboksilat (Ha). Proton tersebut sangat tidak terlindungi karena adanya efek induksi magnetik dan efek elektronegativitas dari kedua oksigen didekatnya sehingga menyebabkan pergeseran sinyal A jauh di bawah medan pada ± δ 9,4 ppm. Pada umumnya sinyal proton karboksilat berada pada δ 10,0- δ 13,2 ppm, pergeseran pada spektra hasil analisis disebabkan karena penggunaan pelarut DMSO d6 yang memiliki kepolaran cukup besar (indeks kepolaran = 7,2) sehingga dapat memutus ikatan dimer pada gugus karboksilat. Pemutusan ikatan dimer oleh pelarut polar dapat menggeser letak sinyal (Silverstein, 1991).
Proton fenolik pada spektra ditunjukkan oleh sinyal sinyal B. Tinggi sinyal menunjukkan adanya 1 proton berdasarkan perbandingan tinggi sinyal. Proton pada gugus fenolik senyawa hasil sintesis berada pada δ 7,8 ppm karena proton tersebut dipengaruhi langsung oleh elektronegatifitas atom oksigen.