1
STRUKTUR ATOM DAN TABEL
1. TEORI ATOM
Lima belas abad S.M. Democritus (filusuf Yunani):
“ Semua materi terdiri dari zat yang sangat kecil, berupa partikel yang tidak dapat dibagi lagi
4
Teori Atom Dalton (1808)
Kimia modern diawali dengan Teori Atom Dalton
• Semua materi terdiri dari partikel kecil yang tidak dapat dibagi lagi yang disebut atom
• Atom dari unsur yang sama identik (massa, sifat kimia dan ukuran)
• Senyawa terdiri dari atom-atom dari unsur yang berbeda yang bergabung dengan
perbandingan bilangan bulat yang sederhana
• Hukum Perbandingan Tetap ( J. Proust, 1799)
• Hukum Kelipatan Perbandingan
• Hukum Kekekalan Massa (Lavoiseir, 1774)
6
Namun...
Mulai tahun 1850 – abad 21
serangkaian penelitian menemukan
partikel subatomik :
•
Elektron
•
Proton
•
Neutron
8
Tabung Sinar Katoda
a. “Gas discharge tubes” a. “Gas discharge tubes”
b. Pembelokan sinar
J.J.Thomson (1856 – 1940). Ahli fisika dari Inggris yang mendapatkan Penghargaan Nobel pada tahun 1906
untuk menemukan elektron
10
Robert Andrew Milikan (1868 – 1953). Ahli fisika dari Amerika yang mendapatkan Penghargaan Nobel di
bidang fisika pada tahun 1923 untuk menemukan muatan elektron
RADIOAKTIVITAS
Antoine Becquerel (1852 – 1908) Ahli
fisika dari Prancis yang mendapatkan Penghargaan Nobel
di bidang fisika pada tahun 1903 untuk menemukan
12
Proton
dan
Setelah menemukan elektron,
J.J. Thomson
mengajukan Model Atom, yang dikenal dengan Model Atom
Thompson - Roti Kismis. Elektron (kismis) tersebar di
dalam badan atom yang bermuatan
14
Ernest Rutherford (1871 – 1937). Ahli fisika dari New Zealand yang mendapatkan Penghargaan Nobel di bidang kimia pada tahun 1908 untuk menemukan
Rutherford mengusulkan bahwa seluruh muatan positif atom terpusat di inti atom (nukleus) yang
menjadi pusat massa atom. Partikel yang bermuatan positif dalam nukleus disebut proton.
Penelitian yang lain menemukan massa proton = 1,67262 x 10-24 g
Penemuan Rutherford meninggalkan satu masalah...
Perbandingan jumlah proton H dan He 1 : 2
namun...
Perbandingan massa H dan He 1 : 4
18
Penelitian Chadwick (1932), menemukan partikel yang bermuatan netral dengan massa hampir
sama dengan proton
NEUTRON
H mengandung 1 proton
He mengandung 2 proton dan 2 neutron maka...
Proton dan neutron
Proton dan neutron
Proton dan neutron
terpaketkan dalam
terpaketkan dalam
inti atom dengan
inti atom dengan
ukuran yang sangat
ukuran yang sangat
kecil.
kecil. Elektron Elektron bagaikan awan yang
bagaikan awan yang
mengelilingi nukleus.
20
3. Nomor Atom, Nomor Massa dan Isotop
A
X
Z
X = Lambang unsur
Z = nomor atom (= jumlah proton)
4. Teori Kuantum (Max Planck, 1900)
•Planck mengatakan : Atom dan molekul
dapat menyerap atau mengemisikan energi dengan jumlah yang terdiskritkan.
•Satuan terkecil dari energi tersebut disebut
kuantum
•Energi yang diserap atau diemisikan dalam
22
• Setiap kuantum memiliki energi sebesar
E = h.
E = energi (J)
h = konstanta Planck ( 6,63 x 10-34 J.s)
= frekuensi radiasi (s-1)Sifat Gelombang
(rambatan energi) (panjang gelombang) = Jarak antara 2 bukit
(atau lembah)
(frekuensi) = jumlah getaran perdetik
24
Radiasi Elektromagnetik
Radiasi elektromagnetik : emisi atau transmisi energi dalam bentuk gelombang elektromagnetik
26
TEORI ATOM
28
Spektrum Emisi
Spektrum emisi : spektrum garis atau kontinu dari radiasi yang diemisikan oleh suatu zat
Spektrum garis: emisi cahaya dengan panjang gelombang tertentu Spektrum emisi atom
Spektrum kontinu: emisi cahaya dengan panjang gelombang yang berkelanjutan
30
32
• Elektron berputar dalam jalur orbit
• Elektron tunggal atom hidrogen hanya dapat berada pada orbit-orbit tertentu yang memiliki energi tertentu
38
BILANGAN KUANTUM
Dalam mekanika kuantum, tiga bilangan kuantum
diperlukan untuk menggambarkan distribusi elektron dalam suatu atom, yaitu :
1. Bilangan Kuantum Utama (n)
2. Bilangan Kuantum Momentum Sudut (l)
3. Bilangan Kuantum Magnetik (m)
Tiga bilangan kuantum ini dapat menunjukan tempat orbital sebuah elektron berada.
Bilangan kuantum yang ke empat :
4. Bilangan kuantum spin (s),
Menunjukkan …
• Tingkat energi suatu orbital.
• Jarak rata-rata suatu elektron dengan inti atom
• n = 1,2,3, …
n = 1 2 3 4 ... Kulit K L M N ...
40
Orbital s
42
Bilangan Kuantum Magnetik , m
Menggambarkan …
Arah orientasi ruang orbital,
Pada sub kulit l, maka nilai m yang mungkin :
-l, (-l + 1),…,0,…,(+l –1), +l
Pada sub kulit s, l = 0 m = 0
(tidak punya arah orientasi ruang) Pada sub kulit p, l = 1 m = -1, 0, +1
(punya 3 orbital dengan arah orientasi
Bilangan Kuantum Spin , s
s = 1/2 s = - 1/2
44
46
Orbital-orbital Atom
Orbital s
Orbital d
48
50
Prinsip Larangan Pauli
Dua buah elektron tidak mungkin memilki empat bilangan kuantum yang sama keempat-empatnya
Dari tiga kemungkinan konfigurasi elektron He di bawah ini, mana yang benar ? Berapakah empat bilangan
kuantum untuk masing-masing elektron ?
He
Paramagnetik dan Diamagnetik
Zat Paramagnetik Dipengaruhi medan magnet (ada
52
Aturan Hund
Konfigurasi elektron dengan arah elektron yang paralel pada orbital-orbital dengan tingkat energi yang sama
Prinsip Aufbau (“membangun”)
Elektron mengisi orbil atom satu demi satu dimulai dari orbital dengan energi yang lebih rendah terlebih dahulu
Kestabilan penuh – Kestabilan setengah penuh
Silahkan Saudara buat konfigurasi 24Cr dan 29Cu !
24Cr [Ar] 4s1 3d5
29Cu [Ar] 4s1 3d10
54
Tabel Periodik
Lavoisier ( 1789) 26 unsur
1870 60 unsur
Sekarang 114 unsur
56
• Logam kilap, dapat ditempa, penghantar panas dan listrik, membentuk senyawa dengan oksigen yang
bersifat basa
Mulanya, unsur dibagi jadi dua kelompok besar :
• Nonlogam tidak mempunyai sifat khas, tidak menghantar panas dan listrik (kecuali grafit) dan
Triade Dobereiner ( 1817)
Menemukan tiga unsur dengan kemiripan sifat dan ada hubungannya dengan massa atom relatif, seperti :
Litium Kalsium Klor
Natrium Stronsium Brom
Kalium Barium Yod
58
Hukum Oktaf Newlands (1865)
John Newlands menemukan hubungan lain antara sifat unsur dan massa atom relatifnya….
Jika ia menyusun unsur berdasarkan kenaikkan Ar, maka
setiap unsur kedelapan mempunyai sifat mirip dengan unsur yang pertama Hukum Oktaf
(sama halnya dengan oktaf dalam nada musik)
Li Be B C N O F
Na Mg Al Si P S Cl
Mendeleyev dan Meyer (1868)
Menyempurnakan susunan unsur Newlands dengan menyelidiki lebih detil sifat fisika dan kimia dari
unsur-unsur yang sudah ditemukan.
Beberapa perbaikannya antara lain :
1. Selisih Ar dua unsur berurutan sekurang-kurangnya dua satuan
2. Unsur-unsur transisi disediakan jalur khusus
60
4. Koreksi Ar Cr bukan 43,3 tapi 52,0
5. Tanpa eksperimen mengubah valensi boron dan aluminium dari 2 menjadi 3
Keuntungan dari daftar Mendeleyef dalam memahami sifat unsur :
1. Sifat kimia dan fisika unsur dalam satu golongan berubah secara teratur.
2. Valensi tertinggi yang dapat dicapai unsur sama dengan nomor golongan.
3. Sifat Li mirip dengan Mg. Sifat Be mirip dengan Al. Sifat B mirip dengan Si. Kemiripan ini dikenal sebagai
hubungan diagonal.
4. Mendeleyey meramal sifat unsur-unsur yang belum ditemukan
62
Tabel Periodik Modern
1. Daftar ini disusun berdasarkan konfigurasi elektron
2. Unsur dalam suatu jalutr vertikal mempunyai struktur elektron terluar yang sama oleh karena itu mempunyai sifat kimia yang mirip. Jalur ini disebut “golongan”.
Tabel Periodik Modern
64
Sifat Periodik
1. Jari-jari Atom
Jarak dari inti atom ke elektron terluar ( ½ kali ikatan kovalen molekul unsur diatomik)
Jari -jari atom
berkisar :
70 A
os/d 290 A
o66
Variations in atomic and ionic radii in the periodic table.
Variations in atomic and ionic radii in the periodic table.
Value are in picometers
68
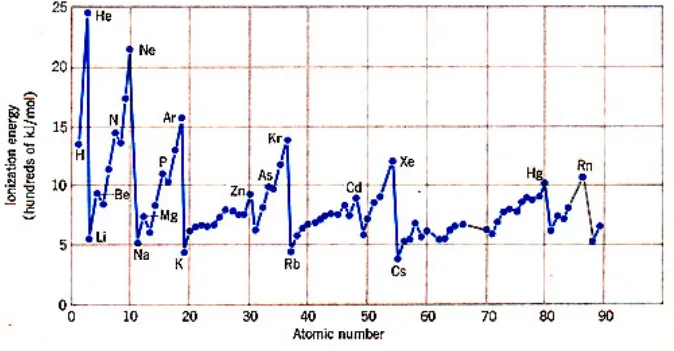
2. Energi ionisasi
Energi ionisasi (EI) adalah energi yang dibutuhkan untuk memindahkan satu elektron dari keadaan terisolasi, atom gas atau ion dalam keadaan dasar.
X(g) X+
(g) + e
Energi ionisasi umumnya meningkat dari bawah ke atas pada satu golongan dan meningkat dari kiri kekanan
3. Afinitas elektron
Afinitas elektron (EA) adalah jumlah energi yang
Dikeluarkan karena penambahan elektron pada atom gas
atau ion dalam keadaan dasar.
X(g) + e- X -(g)