VII TOLERANSI TEMBAKAU TRANSGENIK GENERASI R2
YANG MENGEKSPRESIKAN GEN P5CS TERHADAP
CEKAMAN AKIBAT PENYIRAMAN POLIETILEN GLIKOL
(PEG)
Abstrak
Percobaan yang dilakukan bertujuan untuk (i) menentukan pengaruh penyiraman polietilena glikol (PEG) selama fase pertumbuhan vegetatif (15-60 hari sesudah tanam [hst]) terhadap pertumbuhan tanaman R2 zuriat dari tembakau GS transgenik P5CS, (ii) mengevaluasi toleransi lima tembakau GS transgenik terhadap cekaman akibat perlakuan PEG, dan (iii) menentukan kandungan prolina daun lima tembakau GS transgenik dalam kondisi non-cekaman dan cekaman dengan penyiraman larutan PEG dan hubungan antara akumulasi prolina dengan respons tembakau transgenik terhadap cekaman PEG. Bibit tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R0 ditumbuhkan dalam pot plastik (500 ml) yang berisi medium campuran arang sekam:coco pit (1:1). Setelah 15 hari sesudah tanam (HST), bibit diberi perlakuan cekaman dengan penyiraman larutan PEG 6000 pada konsentrasi 0%, 2.5%, 5%, 7.5%, 10%, 12.5% dan 15% selama periode antara 15 - 60 HST dan tanaman dipanen umur 55 dan 65 HST. Contoh daun untuk analisis kandungan prolina dipanen pada umur 78 HST. Hasil penelitian menunjukkan cekaman dengan penyiraman larutan PEG, dapat menurunkan tinggi tanaman, jumlah daun, luas daun, bobot kering daun, tajuk, biomasa dan akar tembakau GS non-transgenik maupun tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R0.
Kata kunci : Cekaman kekeringan, biosintesis dan akumulasi prolina, indeks sensitivitas terhadap cekaman PEG
VII TOLERANCE OF TRANSGENIC TOBACCO
EXPRESSING GENE P5CS OF R2 GENERATION AGAINST
STRESS DUE TO POLYETHYLENE GLYCOL (PEG)
Abstract
The objectives of this experiment were (i) to determine the effects of sress due to polyethylene glycol (PEG) treatment during the period of 15 - 78 days after planting (DAP) on growth of R2 plants derived from transgenic GS tobacco carrying P5CS transgene, (ii) to evaluate tolerance of R2 plants derived from five line of transgenic GS tobacco against drought stress, and (iii) to determine their leaf proline content under optimum and under PEG induced stress conditions and their correlation to stress responses. The R2 seedlings derived from five transgenic GS tobacco P5CS were grown individually in plastic pot (500 ml) containing a mixture of rice hull: coco pit medium (1:1). After 15 DAP, seedlings were subjected to stress conditions by drenching them with solution of PEG 6000 at 0%, 2.5%,5%, 7.5%, 10%, 12.5% or 15% concentration for the period of 15 - 78 DAP. The plants were harvested at 78 DAP. Leaf samples for proline content analysis were collected at 78 DAP. Results of the experiment indicated stress due to PEG treatment reduced plant height, leaf number, total leaf width, leaf, shoot, biomass, and root dry weight of all tobacco plants. The R2 plants derived from P5CS transgenic GS tobacco showed better growth and higher plant height, leaf, biomass and root dry weight than that of non-transgenic under stress or non-stress condition. Increased leaf proline content after drought stress was observed in all tobacco transgenic, while less was observed in tobacco non-transgenic.
Keywords: Dehydration cekamans, Proline biosynthesis and accumulation, sensitivity index against PEG induced stres
PENDAHULUAN
Ketersediaan air merupakan faktor pembatas utama dalam budi daya tanaman. Pada genotipe tanaman yang toleran terhadap cekaman kekeringan, penurunan daya hasil akibat cekaman tidak sebesar yang terjadi pada genotipe peka sehingga penggunaan genotipe yang toleran mempunyai arti penting dalam budidaya tanaman di lahan kering.
Kondisi cekaman kekeringan dengan potensial air jaringan tanaman rendah mempengaruhi pertumbuhan tanaman terutama pada kenampakan morfologi dan perkembangan tanaman, perkembangan sel, fisiologi dan biokimia (Yoshiba et al. 1997). Pengurangan pemberian air menyebabkan perubahan pola perkembangan daun bunga matahari. Pada keadaan defisit air menyebabkan luas daun berkurang dibanding kondisi optimum. Pengurangan luas daun ini dipengaruhi oleh pengurangan kecepatan pembelahan dan luas areal sel sampai 40 % dibanding tanaman kontrol. Cekaman air menyebabkan pengurangan biomasa daun dan polong kering kacang tanah (Collino et al. 2000) dan penurunan bobot kering polong diduga disebabkan oleh proses terhambatnya inisiasi dan pemanjangan ginofor (Chapman et al. 1993). Pada tanaman kedelai, defisit air menurunkan luas area dan kandungan klorofil daun (Shimada et al. 1992), menurunkan ukuran polong, biji, dan bobot kering polong (Pookpadi et al. 1990), dan menurunkan kualitas biji (Franca-Neto et al. 1993). Cekaman kekeringan mempengaruhi pula sistem reproduksi tanaman. Herrero dan Johnson (1981) mempelajari pengaruh cekaman kekeringan pada sistem reproduksi tanaman jagung. Hasil penelitian menunjukkan bahwa pemanjangan rambut jagung (silk) terhenti pertumbuhan pada potensial air daun kira-kira -9 bar. Gejala morfologi yang biasa nampak pada tanaman kekurangan air adalah tanaman layu, daun menggulung, dan kerdil.
Karakter toleransi / ketahanan terhadap kekeringan pada prinsipnya berkait dengan upaya tanaman untuk menjaga keseimbangan osmotik dengan meningkatkan penyerapan air dan menurunkan kehilangan air. Penurunan luas daun merupakan salah satu cara adaptasi tanaman untuk menekan kehilangan air melalui proses transpirasi (White dan Singh, 1993) dan merupakan salah satu bentuk respons tanaman menghadapi cekaman kekeringan. Penurunan luas daun
dapat berpengaruh negatif terhadap area fotosintesis sehingga tidak menguntungkan tanaman. Lebih lanjut, cekaman kekeringan dapat menyebabkan menurunnya bobot daun segar hingga 12% (Popova et al. 1996).
Pengembangan ketahanan potensial osmotik sel daun dan akar serta penurunan densitas stomata per luasan permukaan daun merupakan adaptasi terhadap cekaman kekeringan yang paling menguntungkan (Blum 2004). Dengan membatasi kehilangan air melalui transpirasi dan menjaga tekanan turgor sel melalui pengaturan potensial osmotik jaringan, tanaman tetap mampu menyerap air dalam kondisi cekaman kekeringan dan mampu menjaga pertumbuhan dan perkembangannya (Gupta 1997).
Cekaman kekeringan menyebabkan respons biokimia atau metabolik pada tanaman. Karakter metabolik berupa akumulasi prolin pada jaringan tanaman merupakan karakter untuk toleransi tanaman terhadap cekaman kekeringan. Peningkatan kandungan prolina yang berfungsi sebagai solut dalam osmotic adjustment dilaporkan mempunyai peranan penting dalam respons tanaman terhadap cekaman kekeringan (Slee et al. 1990; Bao et al. 1991). Dengan osmotic adjustment, tanaman dapat menjaga potensial air daun dan akar yang lebih rendah dan mempertahankan turgor sel dalam kondisi cekaman kekeringan. Kedua kemampuan tersebut merupakan indikator sifat tanaman yang toleran terhadap cekaman kekeringan (Cellier et al. 1998). Berdasarkan hal tersebut, peningkatan kandungan prolina daun dalam kondisi cekaman kekeringan dapat digunakan sebagai penduga toleransi tanaman terhadap cekaman kekeringan (Gupta 1997).
Senyawa polietilena glikol (PEG) merupakan senyawa yang dapat menurunkan potensial osmotik larutan melalui aktivitas matriks sub-unit etilena oksida yang mampu mengikat molekul air dengan ikatan hidrogen. Penyiraman larutan PEG ke dalam media tanam diharapkan dapat menciptakan kondisi cekaman karena ketersediaan air bagi tanaman menjadi berkurang.
Senyawa osmotikum polietilena glikol (PEG) dapat menurunkan potensial air medium dan penyiraman PEG dalam medium tanam dapat mensimulasikan kondisi cekaman kekeringan (Saint-Clair 1976). Penggunaan PEG dilaporkan efektif untuk menapis respons plasma nutfah tanaman terhadap cekaman kekeringan (Asay dan Johnson 1983). PEG juga telah digunakan untuk menapis
respon tanaman anggur, kacang tanah, kedelai, kubis-kubisan, padi dan sorghum terhadap cekaman kekeringan (Duncan et al. 1995; Adkins et al. 1995; Dami dan Hughes 1995; Sunaryo et al. 2002; Adisyahputra 2006). Hasil penelitian menunjukkan adanya korelasi positif antara toleransi tanaman terhadap cekaman akibat perlakuan PEG dengan toleransi terhadap cekaman kekeringan (Sunaryo et al. 2002; Adisyahputra 2006).
Percobaan ini secara umum bertujuan untuk mengevaluasi pengaruh cekaman kekeringan terhadap pertumbuhan dan perkembangan tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1. Secara khusus, percobaan ini bertujuan untuk: (1) menguji pengaruh penyiraman PEG terhadap pertumbuhan dan hasil tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1, (2) menganalisis akumulasi prolina dalam daun tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 pada kondisi cekaman dengan penyiraman larutan PEG 6000, dan (3) menganalisis hubungan antara akumulasi prolina daun dengan pertumbuhan dan hasil tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1.
BAHAN DAN METODE
Bibit tembakau transgenik. Benih dari lima nomor tembakau transgenik
P5CS generasi R1 dipanen dari masing-masing nomor tembakau transgenik P5CS generasi R0 (GS-1, GS-2, GS-3, GS-4, dan GS-5) ditanam dalam medium MS (Murashige dan Skoog, 1962) dengan penambahan kanamisin 100 mg/l. Jumlah bibit yang mampu tumbuh dari benih dan yang mati dalam medium dengan penambahan kanamisin diamati dan digunakan untuk menentukan jumlah transgen yang terintegrasi dalam genom masing-masing tanaman transgenik R0. Hanya bibit tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 yang tumbuh dalam medium yang mengandung kanamisin yang digunakan dalam percobaan.
Penyiapan bibit tembakau. Bibit tanaman R2 zuriat dari tembakau GS
transgenik P5CS generasi R1 dan tembakau GS non-transgenik ditanam dalam pot plastik (250 ml) berisi medium campuran tanah:pasir:pupuk kandang (2:1:1) dan diaklimatisasi dalam ruangan yang terkontrol kelembaban (100%) dan penyinarannya (1000 lux) selama satu minggu. Setelah periode aklimatisasi, tanaman tembakau dipindah kedalam pot plastik (500 ml) yang berisi medium campuran arang sekam:coco peat (1:1) dan dipelihara di rumah kaca sampai umur 2 minggu (14 hari). Pemeliharaan yang dilakukan meliputi penyiraman hingga jenuh setiap pagi dan sore hari.
Pengaruh cekaman PEG terhadap pertumbuhan dan hasil. Setelah
bibit tanaman R2 zuriat dari tembakau GS transgenik P5CS generasi R1 yang resisten terhadap kanamisin dan bibit tembakau GS non-transgenik disiram dengan larutan PEG 2.5%,5%, 7.5%, 10%, 12,5% atau 15% hingga 60 HST. Larutan PEG disiramkan setiap dua hari sekali sebanyak 20 ml per tanaman. Sebagian tanaman transgenik R2 yang lain disiram setiap hari dengan air (PEG 0%) hingga saat panen dan dijadikan sebagai kontrol.
Unit percobaan terdiri atas 5 bibit tembakau dan untuk setiap perlakuan diulang 3 kali. Percobaan dilakukan menggunakan rancangan perlakuan faktorial dan rancangan lingkungan acak kelompok. Pengamatan dilakukan terhadap tinggi tanaman, jumlah dan luas daun, rataan panjang buku, bobot daun, bobot tajuk, bobot akar, dan bobot biomasa kering, serta panjang akar.
Analisis kandungan prolina. Bibit tanaman R2 zuriat dari tembakau GS
transgenik P5CS generasi R1 dengan atau tanpa penyiraman PEG dipanen daunnya pada umur 78 HST dan dianalisis kandungan prolinanya. Analisis kandungan prolina daun dilakukan dengan menggunakan metode yang dikembangkan oleh Bates et al, (1973). Kandungan prolina daun tanaman tembakau GS non-transgenik dengan atau tanpa penyiraman PEG digunakan sebagai kontrol.
HASIL
Bibit tembakau transgenik. Populasi tanaman R2 yang diuji dalam
percobaan ini dikecambahkan dari benih R1 yang dipanen dari tanaman transgenik R0 setelah ditumbuhkan pada medium selektif MS0 yang mengandung antibiotik kanamisin 100 mg/l. Setelah ditumbuhkan pada medium MS0 selektif selama 3 minggu, hanya bibit tembakau yang tahan terhadap antibiotik kanamisin yang digunakan dalam percobaan ini. Hasil analisis segregasi antara bibit yang resisten dan rentan terhadap kanamisin mengindikasikan bahwa tanaman transgenik R0 yang didapat mengintrograsikan paling tidak satu lokus nptII fungsional didalam genomnya (Tabel 17).
Pengaruh cekaman PEG terhadap pertumbuhan dan hasil. Semua
arang sekam. Terdapat beberapa tanaman yang mati, namun kematian tanaman ini bukan disebabkan oleh kondisi media tumbuh maupun perlakuan PEG, tetapi lebih disebabkan proses adaptasi tanaman yang kurang maksimal pada tahapan aklimatisasi dari ruang kultur ke kondisi iklim rumah kaca.
Hasil pengamatan menunjukkan bahwa penyiraman larutan PEG pada konsentrasi 2.5%,5%, 7.5%. 10%, 12.5% atau 15% sudah memberikan kondisi cekaman pada tanaman tembakau yang diuji. Penyiraman PEG 2.5%,5%, 7.5%. 10%, 12.5% atau 15% secara umum menurunkan pertumbuhan tanaman tembakau non-transgenik maupun tanaman R2 zuriat dari tembakau GS transgenik P5CS.
Tabel 17 Segregasi fenotipe bibit R2 yang ditanam dalam medium MS selektif dengan penambahan antibiotika kanamisin 100 mg/l, hasil analisis χ2, dan pendugaan jumlah lokus nptII fungsional yang terintegrasi dalam genom tembakau transgenik.
Segregasi fenotipe bibit
R2 dalam MS selektif: Probabilitas χ2, untuk model segregasi: Nomor genotipe KanR KanS 3 : 1 13 : 3 Lokus nptII Transgenik GS-1 128 30 3.376 0.001 1 Transgenik GS-2 119 27 3.653 0.034 1 Transgenik GS-3 136 49 0.146 6.769 1 Transgenik GS-4 96 40 1.186 9.46 1 Transgenik GS-5 91 43 3.223 14.788 1
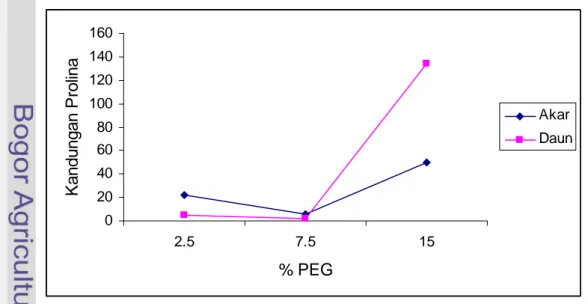
Keterangan: Penghitungan χ2, dilakukan dengan menggunakan koreksi Yates dan pada α = 0.05. 0 20 40 60 80 100 120 140 160 2.5 7.5 15 % PEG K andungan P rolina Akar Daun
Gambar 27 Menunjukkan bahwa ekspresi pembentukan senyawa prolina lebih banyak di daun daripada di akar tanamn.
Tabel 18 Pengaruh penyiraman polietilena glikol (PEG) dengan konsentrasi 0%,2.5%, 5%,7.5%, 10%,12.5% dan 15% pada umur 35 HST terhadap tinggi tanaman,bobot akar kering, bobot kering daun,dan panjang akar dari tanaman R1 zuriat tembakau GS transgenik P5CS generasi R2 dan tembakau GS non-transgenik.
Nilai peubah pada konsentrasi penyiraman PEG: Peubah dan genotipe
yang diuji 0% 2.5% 5% 7.5% 10% 12.5% 15%
Tinggi Tanaman (cm):
Nontransgenik GS-0 9.83 A 3.00 ED 2.16DEF 2.33 EF 2.20DEF 2.33DEF
Transgenik GS-1 8.33 B 2.16DEF 2.06DEF 1.90DEF 1.33DEF 1.80 EF 1.93 EF
Transgenik GS-2 8.00ABC 1.63 EF 1.86DEF 1.46DEF 1.73DEF 1.83 EF 1.85 EF
Transgenik GS-3 7.33BC 2.33DEF 1.13 EF 1.73DEF 1.50DEF 1.16DEF 1.100DEF
Transgenik GS-4 6.33 C 1.06DEF 1.16 EF 0.66 F 0.60 F - 0.85 EF
Transgenik GS-5 3.16D 1.83 EF 1.83DEF 1.73DEF 1.16DEF - 1.750DEF
Bobot akar kering (g):
Nontransgenik GS-0 0.43ABCDE 0.30ABCDE 0.10E 0.20BCDE 0.15DE 0.15DE 0.15DE
Transgenik GS-1 0.46ABCD 0.20BCDE 0.08 E 0.10 E 0.10 E 0.08 E 0.08 E
Transgenik GS-2 0.43ABCDE 0.12 E 0.10 E 0.05 E 0.05 E
Transgenik GS-3 0.43ABCDE 0.70 ABCD 0.72
ABC
0.06 E 0.41ABCD E
0.12 E 0.06 E
Transgenik GS-4 0.33 ABCDE 0.21 BCDE 0.81 A 0.09 E 0.49ABCD
E
0.06 E
Transgenik GS-5 0.20BCDE 0.05 E 0.18
CDE
0.13 E 0.23BCDE 0.02E
Bobot kering daun (g):
Nontransgenik GS-0 0.60 BC 0.43 BC 0.08 C 0.02 C 0.05 C 0.04C 0.08 C Transgenik GS-1 0.50 BC 0.27 C 0.06 C 0.01 C 0.05 C 0.07C 0.10 C Transgenik GS-2 0.50 BC 0.58 BC 0.06C 3.01A 0.08 C 0.09C 0.72 BC Transgenik GS-3 0.40 BC 0.08 C 0.03 C 0.008C 0.05 C 0.03C 0.08 C Transgenik GS-4 0.37 BC 0.09 C 0.013 C 0.001 C 0.001 C 2.00AB 0.705 BC Transgenik GS-5 0.400 BC 0.103 C 0.107 C 0.009 C 0.034 C 0.062 C Panjang akar (cm): Nontransgenik GS-0 21.667 ABCD 22.667 ABCD 27.333 AB 23.000 ABCD 22.000 ABCD 25.833 AB 18.33 ABCD Transgenik GS-1 21.333 ABCD 27.667 AB 23.667 ABCD 26.333 AB 15.333 ABCD 26.000 AB 20.00 ABCD Transgenik GS-2 26.000 AB 19.333 ABCD 24.33 ABC 21.33 ABCD 24.0 ABC 28.0AB 16.33 ABCD Transgenik GS-3 9.667 ABCD 20.670 ABCD 15.000 ABCDE 18.000 ABCD 26.330 AB 22.000 ABCD 9.250 CDE Transgenik GS-4 21.330 ABCD 16.000 ABCD 13.330 BCE 8.333 DE 20.330 ABCD 1.000 E 16.670 ABCD Transgenik GS-5 19.333 ABCD 22.670 ABCD 29.67A 19.33AB D 14.33ABCDE 16.000 ABCD
Keterangan: Data rataan pada kolom dengan huruf kapital yang sama, tidak berbeda nyata berdasarkan uji jarak berganda Duncan pada α =0.05.
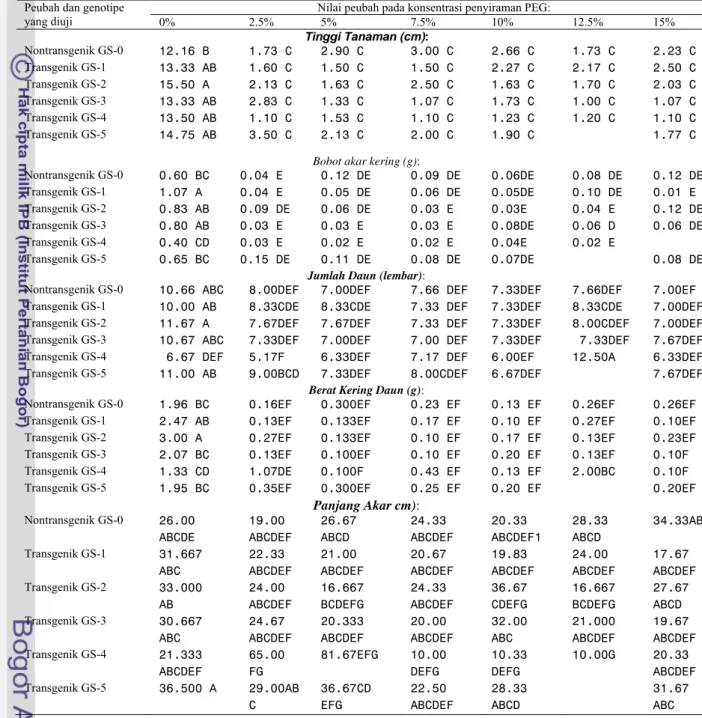
Tabel 19 Pengaruh penyiraman polietilena glikol (PEG) dengan konsentrasi 0%,2.5%, 5%,7.5%, 10%,12.5% dan 15% pada umur 55 HST terhadap tinggi tanaman, bobot akar kering, jumlah daun, berat kering daun,dan panjang akar dari tanaman R2 zuriat tembakau GS transgenik P5CS R2 dan tembakau GS non-transgenik.
Nilai peubah pada konsentrasi penyiraman PEG: Peubah dan genotipe
yang diuji 0% 2.5% 5% 7.5% 10% 12.5% 15% Tinggi Tanaman (cm): Nontransgenik GS-0 12.16 B 1.73 C 2.90 C 3.00 C 2.66 C 1.73 C 2.23 C Transgenik GS-1 13.33 AB 1.60 C 1.50 C 1.50 C 2.27 C 2.17 C 2.50 C Transgenik GS-2 15.50 A 2.13 C 1.63 C 2.50 C 1.63 C 1.70 C 2.03 C Transgenik GS-3 13.33 AB 2.83 C 1.33 C 1.07 C 1.73 C 1.00 C 1.07 C Transgenik GS-4 13.50 AB 1.10 C 1.53 C 1.10 C 1.23 C 1.20 C 1.10 C Transgenik GS-5 14.75 AB 3.50 C 2.13 C 2.00 C 1.90 C 1.77 C
Bobot akar kering (g):
Nontransgenik GS-0 0.60 BC 0.04 E 0.12 DE 0.09 DE 0.06DE 0.08 DE 0.12 DE Transgenik GS-1 1.07 A 0.04 E 0.05 DE 0.06 DE 0.05DE 0.10 DE 0.01 E Transgenik GS-2 0.83 AB 0.09 DE 0.06 DE 0.03 E 0.03E 0.04 E 0.12 DE Transgenik GS-3 0.80 AB 0.03 E 0.03 E 0.03 E 0.08DE 0.06 D 0.06 DE Transgenik GS-4 0.40 CD 0.03 E 0.02 E 0.02 E 0.04E 0.02 E Transgenik GS-5 0.65 BC 0.15 DE 0.11 DE 0.08 DE 0.07DE 0.08 DE
Jumlah Daun (lembar):
Nontransgenik GS-0 10.66 ABC 8.00DEF 7.00DEF 7.66 DEF 7.33DEF 7.66DEF 7.00EF Transgenik GS-1 10.00 AB 8.33CDE 8.33CDE 7.33 DEF 7.33DEF 8.33CDE 7.00DEF Transgenik GS-2 11.67 A 7.67DEF 7.67DEF 7.33 DEF 7.33DEF 8.00CDEF 7.00DEF Transgenik GS-3 10.67 ABC 7.33DEF 7.00DEF 7.00 DEF 7.33DEF 7.33DEF 7.67DEF Transgenik GS-4 6.67 DEF 5.17F 6.33DEF 7.17 DEF 6.00EF 12.50A 6.33DEF Transgenik GS-5 11.00 AB 9.00BCD 7.33DEF 8.00CDEF 6.67DEF 7.67DEF
Berat Kering Daun (g):
Nontransgenik GS-0 1.96 BC 0.16EF 0.300EF 0.23 EF 0.13 EF 0.26EF 0.26EF Transgenik GS-1 2.47 AB 0.13EF 0.133EF 0.17 EF 0.10 EF 0.27EF 0.10EF Transgenik GS-2 3.00 A 0.27EF 0.133EF 0.10 EF 0.17 EF 0.13EF 0.23EF Transgenik GS-3 2.07 BC 0.13EF 0.100EF 0.10 EF 0.20 EF 0.13EF 0.10F Transgenik GS-4 1.33 CD 1.07DE 0.100F 0.43 EF 0.13 EF 2.00BC 0.10F Transgenik GS-5 1.95 BC 0.35EF 0.300EF 0.25 EF 0.20 EF 0.20EF
Panjang Akar cm): Nontransgenik GS-0 26.00 ABCDE 19.00 ABCDEF 26.67 ABCD 24.33 ABCDEF 20.33 ABCDEF1 28.33 ABCD 34.33AB Transgenik GS-1 31.667 ABC 22.33 ABCDEF 21.00 ABCDEF 20.67 ABCDEF 19.83 ABCDEF 24.00 ABCDEF 17.67 ABCDEF Transgenik GS-2 33.000 AB 24.00 ABCDEF 16.667 BCDEFG 24.33 ABCDEF 36.67 CDEFG 16.667 BCDEFG 27.67 ABCD Transgenik GS-3 30.667 ABC 24.67 ABCDEF 20.333 ABCDEF 20.00 ABCDEF 32.00 ABC 21.000 ABCDEF 19.67 ABCDEF Transgenik GS-4 21.333 ABCDEF 65.00 FG 81.67EFG 10.00 DEFG 10.33 DEFG 10.00G 20.33 ABCDEF Transgenik GS-5 36.500 A 29.00AB C 36.67CD EFG 22.50 ABCDEF 28.33 ABCD 31.67 ABC
Keterangan: Data rataan pada kolom dengan huruf kapital yang sama, tidak berbeda nyata berdasarkan uji jarak berganda Duncan pada α =0.05.
PEMBAHASAN
Adanya perbedaan respon terhadap penyiraman PEG antara tanaman tembakau transgenik P5CS R2 zuriat dengan tanaman tembakau non transgenik. Tanaman tembakau transgenik P5CS cenderung menunjukkan pertumbuhan yang lebih tinggi dibandingkan dengan tanaman tembakau non transgenik akibat perlakuan penyiraman PEG.
Kemampuan untuk menjaga pertumbuhan vegetatif dalam kondisi cekaman kekeringan juga dikaitkan dengan kemampuan tanaman untuk menjaga turgor pucuk selama terjadinya cekaman melalui akumulasi senyawa osmolit tertentu seperti prolina.
Terdapat tanaman tembakau transgenik yang pertumbuhannya lebih terhambat dibandingkan dengan tanaman tembakau non transgenik akibat penyiraman dengan PEG, hal ini diduga karena adanya feedback inhibition pada gen P5CS dari sel tanaman tembakau transgenik.
Perlakuan cekaman kekeringan secara terkontrol pada tanaman dapat dilakukan dengan penyiraman PEG, karena di dalam air, PEG dapat larut dan dapat menyebabkan penurunan potensial air secara homogen sehingga dapat menimbulkan cekaman kekeringan bagi tanaman.
Salah satu respon tanaman terhadap cekaman kekeringan adalah meningkatkan kandungan osmolit dalam sel, antara lain dengan mengakumulasi senyawa prolina (Mundree et al. 2002). Ekspresi pembentukan prolina antara masing-masing organ tanaman berbeda-beda. Hasil pengamatan menunjukkan bahwa ekspresi pembentukan prolina pertama terjadi di akar, dimana konsentrasi prolina yang terbentuk di akar lebih tinggi dibandingkan di daun akibat penyiraman PEG 2.5%, dengan semakin meningkatnya konsentrasi PEG yang diberikan sampai 15% terjadi ekspresi pembentukan prolina yang lebih tinggi pada daun ( Gambar 27). Hal ini di duga sampai pemberian PEG 7.5% akar masih mampu menjaga agar potensial osmotik jaringan tetap berada pada batas-batas optimum, dengan memproduksi senyawa prolina yang lebih tinggi di bandingkan prolina yang terbentuk di daun. Kondisi ini menunjukkan bahwa untuk menjaga keseimbangan osmotik dalam jangka panjang maka tanaman harus mampu
menurunkan laju transpirasi dengan mereduksi biomassa tajuk dan memakasimalkan penyerapan air melalui peningkatan pertumbuhan akar (Blum et al. 1997).
Akumulasi prolina bersama senyawa osmolit yang lain dalam sel tanaman dilaporkan dapat menurunkan potensial osmotik sel ketika tanaman mengalami cekaman kekeringan (Blum 1996). Dengan demikian tanaman dapat tetap mempertahankan tekanan turgor sel, penyerapan air dan kelangsungan berbagai proses fisiologis dalam sel. Akumulasi senyawa osmolit dilaporkan merupakan respon adaptif terhadap cekaman kekeringan pada berbagai jenis tanaman dan diyakini berperan dalam proses adaptasi pada lingkungan yang tercekam kekeringan (Serraj dan Sinclair 2002).
Tanaman tembakau transgenik lebih mampu mempertahankan pertumbuhannya pada kondisi cekaman kekeringan sampai umur 55 HST, juga berhubungan dengan panjang akar.
SIMPULAN
Dari hasil pengamatan dan uraian di atas dapat ditarik simpulannya sebagai berikut:
1. Cekaman kekeringan yang diberikan dengan penyiraman larutan PEG dapat menghambat pertumbuhan tanaman R2 zuriat dari tembakau GS transgenik P5CS maupun tembakau non transgenik.
2. Pembentukan senyawa prolina yang tertinggi terjadi di organ daun tanaman tembakau