Bab III
Metodologi Penelitian
III.1 Alat
Peralatan gelas yang digunakan terdiri dari labu erlenmeyer, gelas kimia, gelas ukur, cawan petri, tabung reaksi, batang pengaduk, dan spreader (batang L). Peralatan non-gelas yang digunakan terdiri dari batang ose, spatula, mikropipet (Soccorex) berukuran 0-50 μl, 50-200 μl; mikropipet (Eppendorf, Germany) dengan ukuran 1-10 μl, 100-1000 μl; dan tip mikropipet berukuran 10μl, 200 μl, 1000 μl, yang digunakan untuk mengambil reagen dan sampel dalam skala kecil dan tabung mikrosentrifuga berukuran 0,5 mL dan 1,5 mL, yang digunakan untuk wadah sampel dalam skala kecil.
Autoclave (All American, Wiconsin) digunakan untuk mensterilkan media dan peralatan yang digunakan, oven (Memmert) digunakan untuk pengeringan peralatan gelas dan plastik, Freezer model 8831 (Caravell, Denmark) suhu -20°C dan model 3671 (Forma Scientific Inc., USA, Caravell, Denmark) suhu -20°C digunakan untuk menyimpan sampel, enzim, dan reagen-reagen. Laminar flow (Oliphant LTD, Australia) digunakan untuk pekerjaan yang memerlukan kondisi steril, misalnya meremajakan bakteri dan pembuatan media. Inkubator goyang (Lab line dan Thermolyne ROSI 1000) digunakan untuk menumbuhkan bakteri pada media cair.
Vortex (Vortex-2 Genie) digunakan untuk menghomogenkan campuran. Spektrofotometer (Smart SpecTM
3000 Biorad) digunakan untuk pengukuran optical density. pH meter Thermo Orion (model 710) digunakan untuk mengukur pH larutan. Termometer digunakan untuk mengukur suhu. Timbangan digital model 682B (Mettler Toledo, Switzerland) digunakan untuk pengukuran massa bahan-bahan kimia.
Sentrifuga model JA2-21 (Biofuge) dengan kecepatan 0-12.500 rpm dan sentrifuga Beckman model J2-HS digunakan untuk memanen sel, memisahkan supernatan dan sel atau debris sel, dan untuk mengendapkan DNA. Peralatan elektroforesis (Biorad) digunakan untuk memisahkan fragmen DNA. Lampu WL/UV (Cole Parmer Instrument, France) digunakan untuk visualisasi hasil elektroforesis. Mesin PCR (BioRad Gene Cycler) digunakan untuk memperoleh fragmen cDNA. Kamera digital Canon Power Shot A460 digunakan untuk dokumentasi.
III.2 Bahan
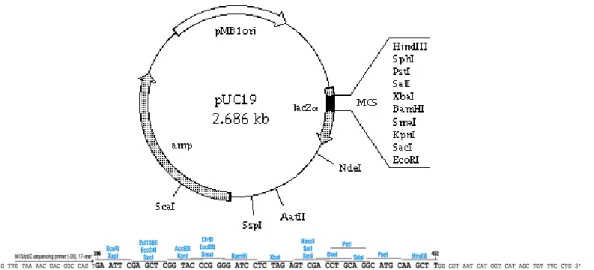
Bakteri yang digunakan dalam penelitian adalah bakteri laut galur lokal SFNB3 yang diperoleh dari Dr. Ocky Karnaradjasa, Universitas Diponegoro, Semarang. Plasmid yang digunakan adalah pUC19 dan Escherichia coli TOP10F’ (F’{proAB, lacIq, lacZ∆M15, Tn10(TetR)}mcrA, ∆(mrr-hsdRMS-mcrBC), d80lacZ∆M15, ∆lacX74, deoR, recA1, λ-araD139, ∆(ara-leu)7697, galU, galK, rpsL(Str-R), endAJ, nupG}) digunakan sebagai sel inang untuk memperbanyak DNA plasmid yang diperoleh dari Laboratorium Biokimia, Program Studi Kimia, ITB.
Zat-zat kimia yang digunakan dalam penelitian adalah pepton, ekstrak ragi, bakto agar, pati, bakto tripton, NaCl, EDTA (Asam Etilendiamintetraasetat), lisozim, etanol, RNase, isopropanol, aquabides (ddH2O), agarosa, buffer TAE (Tris-Base,
asam asetat glasial, EDTA, akuades), etidium bromida, loading buffer (sukrosa, bromfenol biru, Tris-HCl, EDTA), bufer fosfat (Na2HPO4 dan NaH2PO4),
ampisilin (100 mg/mL), alkalin fosfatase, CaCl2 0,1 M, NaOH, KI/I2,
d-cycloserine, IPTG (Isopropiltiogalaktosida), X-Gal, T4 DNA Ligase, DNA λ, GeneRulerTM 1 kb DNA Ladder, Taq polimerase, Taq bufer, dNTP, primer 16S rRNA (BactF1 dan UniB), Wizard® Genomic DNA Purification Kit (Promega), QIAprep Spin Miniprep Kit (Qiagen), GFXTM PCR DNA and Gel Band Purification Kit (Amersham Pharmacia Biotech). Enzim restriksi yang digunakan adalah HindIII dan EcoRI.
III.3 Metode
III.3.1 Peremajaan kultur dan pertumbuhan bakteri laut galur lokal SFNB3 Peremajaan kultur bakteri dilakukan dengan menumbuhkan kultur pada media padat marine yang terdiri dari 0,05% ekstrak ragi, 0,25% pepton, 2% bakto agar dan air laut, dengan menggunakan ose secara aseptik. Media padat yang telah diinokulasi bakteri laut galur lokal SFNB3 kemudian diinkubasi pada suhu 30°C selama dua hari, dan selanjutnya disimpan pada suhu 4°C. Hasil pertumbuhan bakteri ini dapat digunakan untuk memperoleh DNA kromosom.
III.3.2 Isolasi DNA kromosom bakteri laut galur lokal SFNB3 dengan metode Wizard® Genomic DNA Purification Kit
Isolasi DNA kromosom dilakukan dengan menggunakan metode Wizard® Genomic DNA Purification Kit. Koloni tunggal bakteri laut galur lokal SFNB3 diinokulasi ke dalam 5 mL media marine cair dan diinkubasi pada suhu 30°C selama 16-18 jam dengan kecepatan 150 rpm. Kemudian kultur sel dituangkan ke dalam tabung mikrosentrifuga 1,5 mL dan disentrifugasi dengan kecepatan 12500
x g selama dua menit. Supernatan dibuang dan pelet sel diresuspensi dengan 600 µL Nuclei Lysis Solution, kemudian diinkubasi pada suhu 80°C selama lima menit. Campuran didinginkan pada suhu ruang, lalu ditambah 3 µL RNase solution untuk mendegradasi RNA, dan dihomogenkan dengan membolak-balikan (inversi) tabung. Campuran diinkubasi kembali pada suhu 37°C selama 30 menit, lalu didinginkan pada suhu ruang, dan ditambahkan 200 µL Protein Precipitation Solution. Untuk menghomogenkan campuran, digunakan vortex dengan kecepatan tinggi selama 20 detik. Kemudian dilakukan inkubasi di dalam es selama lima menit dan campuran disentrifugasi dengan kecepatan 12500 x g selama tiga menit.
Pelet sel dibuang dan supernatan dipindahkan ke dalam tabung mikrosentrifuga 1,5 mL baru yang berisi 600 µL isopropanol, campuran dihomogenkan dengan membolak-balikan tabung, kemudian disentrifugasi dengan kecepatan 12500 x g selama dua menit. Supernatan dibuang dan pelet DNA ditambah dengan 600 µL etanol 70% untuk pencucian. Sentrifugasi dilakukan untuk mendapatkan DNA, dengan kecepatan 12500 x g selama dua menit. DNA yang telah diperoleh dikeringkan pada suhu ruang selama 15 menit, kemudian ditambahkan 100 µL DNA Rehydration Solution untuk mengelusi DNA dan diinkubasi pada suhu 65°C selama satu jam.
III.3.3 Identifikasi bakteri laut galur lokal SFNB3 dengan sekuensing gen 16S rRNA
Untuk mengidentifikasi spesies bakteri laut galur lokal SFNB3 yang digunakan dalam penelitian, dilakukan amplifikasi gen 16S rRNA bakteri laut galur lokal SFNB3 dengan proses PCR. Kondisi reaksi PCR untuk 16S rRNA adalah denaturasi awal dengan suhu 94°C selama dua menit, siklus amplifikasi sebanyak 30 siklus yang terdiri dari denaturasi pada suhu 94°C selama satu menit; annealing pada suhu 48°C selama satu menit; dan elongation pada suhu 72°C selama 1 menit, Post-elongation pada suhu 72°C selama 10 menit, dan penyimpanan hasil PCR dilakukan pada suhu 4°C untuk mempertahankan agar sampel PCR tetap dingin sebelum dilanjutkan ke tahap berikutnya. Campuran
reaksi PCR terdiri atas DNA kromosom bakteri laut galur lokal SFNB3 sebagai templat, dNTP, enzim Taq Polimerase, bufer enzim Taq polimerase, ddH2O,
primer UniB1 dan BactF1. Primer yang digunakan untuk 16S rRNA yaitu UniB1 (reverse primer): 5’-GGTTAC(G/C)TTGTTACGACTT-3’ dan BactF1 (forward primer): 5’-AGAGTTTGATC(A/C)TGGCTCAG-3’.
III.3.4 Pemotongan DNA kromosom Vibrio sp. SFNB3 secara parsial dengan enzim restriksi EcoRI
DNA kromosom Vibrio sp. SFNB3 yang telah diisolasi, dipotong secara parsial dengan enzim restriksi EcoRI untuk memperoleh fragmen DNA dengan ukuran tertentu. Pemotongan DNA kromosom secara parsial dilakukan dengan beberapa tahapan, yaitu pemotongan DNA kromosom dengan variasi aktivitas unit enzim restriksi, variasi waktu inkubasi, dan perbandingan waktu inkubasi. Untuk variasi aktivitas unit enzim restriksi digunakan 1,525 µg DNA kromosom yang dipotong masing-masing dengan 2,5 U, 5 U, dan 10 U enzim restriksi EcoRI dalam volume total campuran 20 µL dan diinkubasi pada 37°C, selama satu malam. Untuk variasi waktu inkubasi digunakan 1,525 µg DNA kromosom yang dipotong dengan 2,5 U enzim restriksi EcoRI dalam volume total campuran 20 µL. Campuran diinkubasi dengan waktu yang berbeda, yaitu selama 1 jam, 2 jam, 3 jam, 4 jam, 5 jam, dan 6 jam pada 37°C. Untuk perbandingan waktu inkubasi digunakan 3,05 µg dan 4,026 µg DNA kromosom yang dipotong dengan 5 U enzim restriksi EcoRI, secara berturut-turut diinkubasi selama 3 jam dan satu malam, dalam volume total campuran 25 µL dan 20 µL.
Untuk pemotongan fragmen DNA dengan ukuran tertentu digunakan 6,1 µg DNA kromosom yang dipotong dengan 10 U enzim restriksi EcoR1 dalam volume total campuran 50 µL. Campuran kemudian diinkubasi pada 37°C selama 3 jam.
Hasil pemotongan DNA kromosom secara parsial dengan enzim restriksi EcoRI dianalisis dengan gel agarosa 1% b/v, dengan tegangan 80 V selama 45 menit, kemudian divisualisasi dengan sinar UV dekat.
III.3.5 Pemurnian DNA dengan GFXTM PCR DNA and Gel Band Purification Kit
Fragmen DNA dengan ukuran sekitar 4,5-6 kb dipotong dengan pisau steril, kemudian ditimbang. Potongan fragmen DNA pada gel agarosa kemudian diekstraksi dan dimurnikan dengan GFXTM
PCR DNA and Gel Band Purification Kit.
Setiap 10 mg gel ditambah dengan 10 µL bufer 1 (capture buffer) untuk mendenaturasi protein dan melarutkan gel, kemudian diinkubasi pada 60°C sampai gel larut. Campuran kemudian ditransfer ke dalam kolom GFX lalu diinkubasi pada suhu ruang selama satu menit dan disentrifugasi selama satu menit dengan kecepatan 12500 x g.
DNA yang terdapat pada kolom GFX dicuci dengan menggunakan 500 µL bufer 2 (wash buffer) dan dikeringkan melalui sentrifugasi selama 1 menit dengan kecepatan 12500 x g. Kolom GFX yang terdapat DNA di dalamnya, dipindahkan pada tabung mikrosentrifuga 1,5 mL yang baru, kemudian ditambah 50 µL ddH2O
untuk mengelusi DNA dan diinkubasi pada suhu ruang selama satu menit. Untuk mendapatkan larutan DNA murni, dilakukan sentrifugasi selama satu menit dengan kecepatan 12500 x g. Selanjutnya DNA hasil pemurnian dianalisis melalui elektroforesis gel agarosa 1% pada tegangan 80 Volt.
III.3.6 Elektroforesis gel agarosa
DNA yang akan dianalisis dengan elektroforesis gel agarosa dicampur dengan loading buffer (6x larutan stok, 400 g/L sukrosa, 2,5 g/L bromfenol biru dalam 0,6 mL larutan 10 mM Tris-HCl pH 8 dan 1 mM EDTA). Elektroforesis dilakukan menggunakan TAE 1x (Tris asetat 40 mM, EDTA 1 mM) sebagai running buffer, dengan tegangan 80 Volt. Penanda yang digunakan adalah DNA λ yang dipotong dengan enzim restriksi HindIII. Pita DNA diamati menggunakan sinar UV dengan panjang gelombang 302 nm, selanjutnya gel didokumentasikan dengan kamera digital.
III.3.7 Isolasi DNA plasmid pUC19 dengan metode QIAprep Spin Miniprep
Kit
Kultur sel transforman dipindahkan ke dalam tabung mikrosentrifuga 1,5 mL dan disentrifugasi dengan kecepatan 12500 x g selama satu menit. Supernatan dibuang dan pelet sel diresuspensi dengan 250 µL bufer P1, kemudian ditambahkan 250 µL bufer P2 dan dihomogenkan dengan membolak-balik tabung sebanyak empat sampai enam kali. Bufer N3 sebanyak 350 µL ditambahkan ke dalam campuran dan dihomogenkan kembali dengan membolak-balik tabung, lalu dilakukan sentrifugasi dengan kecepatan 12500 x g selama 10 menit.
Pelet sel yang berwarna putih dibuang dan supernatan dipindahkan ke dalam kolom QIAprep dengan dekantasi atau dipipet lalu disentrifugasi dengan kecepatan 12500 x g selama satu menit. Supernatan dibuang dan pelet sel ditambahkan 0,5 mL bufer PB untuk pencucian kolom kemudian disentrifugasi dengan kecepatan 12500 x g selama satu menit. Supernatan dibuang dan pelet DNA dalam kolom dicuci kembali dengan 0,75 mL bufer PE lalu disentrifugasi dengan kecepatan 12500 x g selama satu menit. Untuk menghilangkan sisa bufer, dilakukan sentrifugasi kembali dengan kecepatan 12500 x g selama satu menit.
Kolom QIAprep Spin Miniprep Kit yang berisi DNA plasmid pUC19 ditempatkan pada tabung mikrosentrifuga 1,5 mL kemudian ditambahkan 50 µL air steril (ddH2O steril), didiamkan selama satu menit, dan disentrifugasi dengan kecepatan
12500 x g selama satu menit untuk memperoleh larutan DNA plasmid.
Larutan DNA plasmid pUC19 dianalisis dengan elektroforesis gel agarosa 1% pada tegangan 80 Volt.
III.3.8 Pemotongan DNA plasmid pUC19 dengan enzim restriksi EcoRI dan defosforilasi
DNA plasmid pUC19 hasil isolasi QIAprep Spin Miniprep Kit sebanyak 0,1 µg, dipotong dengan enzim restriksi EcoRI, dengan aktivitas 5 unit pada suhu 37°C
selama enam jam. Hasil pemotongan dianalisis dengan elektroforesis gel agarosa 1% pada tegangan 80 V.
Defosforilasi dilakukan terhadap DNA plasmid pUC19 yang telah dipotong oleh EcoRI dengan 1 U enzim alkalin fosfatase. Campuran DNA plasmid pUC19 dan alkalin fosfatase ditambah bufer enzim alkaline fosfatase 1/10 kali volume dan dihomogenkan lalu diinkubasi pada suhu 37°C selama 30 menit. Enzim diinaktifkan dengan cara inkubasi pada 65°C selama 10 menit.
Untuk memurnikan DNA plasmid linier yang telah didefosforilasi maka dilakukan proses pemurnian dengan GFXTM
PCR DNA and Gel Band Purification Kit seperti pada pemurnian fragmen DNA Sub Bab III.3.5.
DNA plasmid pUC19 hasil pemurnian kemudian dianalisis dengan elektroforesis gel agarosa 1% pada tegangan 80 volt.
III.3.9 Ligasi
Ligasi dilakukan dalam volume total campuran 20 µL. Campuran untuk reaksi ligasi mengandung 1 U T4 DNA ligase, 2 µL bufer 10x T4 DNA ligase, 50 ng DNA plasmid pUC19, dan 111,111 ng fragmen DNA dengan ukuran ~ 4,5-6 kb. Campuran dihomogenkan kemudian diinkubasi pada suhu 4°C selama 16-18 jam untuk memperoleh hasil yang optimum.
III.3.10 Pembuatan sel E. coli Top10F’ kompeten
Pembuatan sel E. coli Top10F’ kompeten dilakukan menurut metode Cohen (Sambrook et al., 1989). Koloni tunggal E. coli Top10F’ ditumbuhkan dalam 5 mL media Luria Bertani cair yang ditambah dengan 5 mg tetrasiklin pada suhu 37°C, dengan pengocokan 150 rpm selama 16-18 jam. Kultur sel sebanyak 200 μL diinokulasi ke dalam 20 mL media Luria Bertani cair yang telah ditambahkan dengan 45 mg/mL tetrasiklin, dan diinkubasi pada 37°C dengan pengocokan 150
rpm hingga diperoleh OD600 ≈ 0,4 (± 3 jam). Selanjutnya kultur sel diinkubasi di
dalam es selama 20 menit, setelah itu dipindahkan ke dalam tabung sentrifuga 50 mL dan disentrifugasi dengan kecepatan 4000 rpm pada suhu 4°C selama 10 menit. Supernatan dibuang dan pelet sel dicuci dengan 5 mL larutan CaCl2 0,1 M
segar, lalu diinkubasi kembali di dalam es selama 5 menit dan disentrifugasi dengan kecepatan 4000 rpm pada suhu 4°C selama 10 menit. Supernatan dibuang dan pelet diresuspensi dengan 300 μL larutan CaCl2 0,1 M segar, kemudian
dipindahkan ke dalam tabung mikrosentirfuga 1,5 mL, masing-masing 100 µL. Sel kompeten didinginkan dalam es dan kemudian disimpan pada suhu 4°C.
III.3.11 Transformasi E. coli Top10F’ dengan DNA plasmid rekombinan Transformasi E. coli Top10F’ dengan DNA plasmid rekombinan dilakukan menurut metode Cohen (Sambrook et al., 1989). DNA plasmid rekombinan sebanyak 2,5 µL ditambahkan ke dalam 100 μL sel E. coli Top10F’ kompeten dan dibiarkan di dalam es selama 30 menit. Selanjutnya dilakukan heat shock pada 42°C selama 90 detik dan diinkubasi di dalam es selama 2 menit. Campuran ditambahkan 900 μL media LB cair, kemudian ditumbuhkan dengan pengocokan 150 rpm pada suhu 37°C selama 3 jam.
Kultur sel hasil transformasi sebanyak 250 µL ditumbuhkan kembali pada media padat LB yang mengandung ampisilin (100 mg/mL), 0,5 mM IPTG dan 80 μg/mL X-Gal untuk mengisolasi DNA plasmid rekombinan, dengan cara disebarkan menggunakan batang L dan diinkubasi pada suhu 37°C selama 16-18 jam.
Koloni putih yang tumbuh diremajakan kembali pada media padat LBA dan media padat LBA ditambah 1% pati. Selanjutnya dilakukan penapisan seperti yang akan dijelaskan pada Sub Bab III.3.12. Transforman yang diduga mengandung gen α-amilase ditumbuhkan pada 5 mL LB cair yang mengandung ampisilin (100 mg/mL) dan diinkubasi kembali pada suhu 37°C dengan
pengocokan 150 rpm selama 16-18 jam, kemudian dilakukan isolasi DNA plasmid rekombinan dengan metode QIAprep Spin Miniprep Kit.
III.3.12 Penapisan (Screening)
Bakteri laut galur lokal Vibrio sp. SFNB3 ditumbuhkan pada media padat marine yang terdiri dari 0,05% ekstrak ragi, 0,25% pepton, 2% bakto agar, air laut, dan 1% pati secara aseptik lalu diinkubasi pada suhu 30°C selama dua hari. Selanjutnya penapisan (screening) dilakukan dengan penambahan larutan 0,5% KI/0,15% I2 ke atas permukaan media padat marine yang telah ditumbuhi bakteri
tersebut. Terbentuknya daerah bening (halo zone) mengindikasikan adanya aktivitas α-amilase yang dapat menghidrolisis pati sehingga kompleks antara pati dan iodin tidak terbentuk. Jika tidak ada aktivitas α-amilase akan terdapat daerah gelap karena pati membentuk komplek dengan iodin.
Untuk penapisan sel transforman, diperlukan D-sikloserin sebelum diberi penambahan 0,5% KI/0,15% I2. Transforman ditumbuhkan pada media luria
bertani yang terdiri dari 1% bakto tripton, 1% NaCl, 0,5% ekstrak ragi, 2% bakto agar, dan 1% pati serta penambahan ampisilin (100mg/mL) secara aseptik, lalu diinkubasi pada suhu 37°C selama satu malam. Sebanyak 3 mg/5 mL D-sikloserin dituangkan ke atas permukaan tumbuhnya transforman, kemudian diinkubasi pada 37°C selama 5 jam (Cha et al., 1993). D-sikloserin akan menghambat biosintesis dinding sel E. coli sehingga α-amilase dapat disekresikan dan pati dapat dihidrolisis. Selanjutnya dilakukan penambahan 0,5% KI/0,15% I2.
III.3.13 Isolasi plasmid rekombinan yang membawa gen α-amilase dengan metode QIAprep Spin Miniprep Kit
Koloni putih dari hasil transformasi yang diduga membawa gen α-amilase ditumbuhkan pada 5 mL media cair LB yang mengandung ampisilin (100 mg/mL) pada suhu 37°C dengan pengocokan 150 rpm selama 16-18 jam. Kemudian
dilakukan isolasi DNA plasmid rekombinan dengan metode QIAprep Spin Miniprep Kit seperti yang telah dijelaskan sebelumnya pada Sub Bab III.3.7.
III.3.14 Pemotongan plasmid rekombinan yang membawa gen α-amilase dengan enzim restriksi EcoRI
DNA plasmid rekombinan yang membawa gen α-amilase hasil isolasi QIAprep Spin Miniprep Kit sebanyak 250 ng dipotong dengan 5U enzim restriksi EcoRI dalam volum total campuran 20 μL. Selanjutnya campuran diinkubasi pada suhu 37°C selama 16-18 jam. Hasil pemotongan DNA plasmid rekombinan dengan enzim restriksi kemudian dianalisis dengan elektroforesis gel agarosa 0,8% (b/v) untuk mengetahui ukuran fragmen DNA sisipan.
III.3.15 Analisis urutan nukleotida
Urutan nukleotida fragmen DNA sisipan ditentukan dengan metode dideoxy Sanger menggunakan dye terminator (Macrogen, Korea). Untuk menentukan urutan nukleotida hasil amplifikasi gen 16S rRNA digunakan primer untuk 16s rRNA yaitu UniB1 (reverse primer): 5’-GGTTAC(G/C)TTGTTACGACTT-3’ dan BactF1 (forward primer): 5’-AGAGTTTGATC(A/C)TGGCTCAG-3’.
Untuk menentukan urutan nukleotida fragmen DNA sisipan digunakan primer universal pUC19, yaitu M13F-pUC (forward primer: 5’(GTAAAACGACGGCCAGT)3’), dan M13R-pUC (reverse primer: 5’(AACAGCTATGACCATG)3’). Analisis kesamaan urutan nukleotida dilakukan dengan menggunakan metode blastn yang berasal dari program BLAST pada situs NCBI. Selanjutnya dapat dilakukan penjajaran dengan menggunakan program Clustal-X dan GeneDoc.